Клинический разбор в общей медицине №1 2025
Клинический разбор в общей медицине №1 2025
Неврологические проявления рино-орбито-церебрального мукормикоза
Номера страниц в выпуске:65-73
Аннотация
Мукормикоз – тяжелая грибковая инфекция, развивающаяся у иммунокомпрометированных пациентов. Рино-орбито-церебральный мукормикоз (РОЦМ) является наиболее распространенной и опасной клинической формой инфекции, характеризуется инфицированием полостей носа, околоносовых пазух, шейных пространств, орбит и внутричерепных структур.
Цель. Описание серии клинических наблюдений, включавших 8 пациентов с РОЦМ с 2019 по 2023 г., для выявления особенностей неврологических проявлений РОЦМ.
Материалы и методы. В данной статье изложен собственный опыт ведения 8 пациентов с рино-орбито-церебральным мукормикозом (РОЦМ). Описаны неврологические синдромы поражения черепных нервов, сосудистые и воспалительные поражения нервной системы в рамках данного синдрома.
Результаты. Неврологические осложнения РОЦМ имелись у всех больных и включали поражение черепных нервов (во всех случаях), тромбозы кавернозного синусов, инсульты и поражение оболочек головного мозга. Представлен алгоритм диагностики РОЦМ, описана тактика подбора медикаментозной терапии и хирургической помощи в санации очагов мукормикоза. Прослежен катамнез в каждом описываемом случае.
Ключевые слова: мукормикоз, рино-орбито-церебральный мукормикоз, коронавирусная инфекция, сахарный диабет.
Для цитирования: Руина Е.А., Королев И.А., Григорьева В.Н., Антипенко Е.А., Мисник А.С., Головина К.А. Неврологические проявления рино-орбито-церебрального мукормикоза. Клинический разбор в общей медицине. 2025; 6 (1): 65–73. DOI: 10.47407/kr2024.6.1.00552
Мукормикоз – тяжелая грибковая инфекция, развивающаяся у иммунокомпрометированных пациентов. Рино-орбито-церебральный мукормикоз (РОЦМ) является наиболее распространенной и опасной клинической формой инфекции, характеризуется инфицированием полостей носа, околоносовых пазух, шейных пространств, орбит и внутричерепных структур.
Цель. Описание серии клинических наблюдений, включавших 8 пациентов с РОЦМ с 2019 по 2023 г., для выявления особенностей неврологических проявлений РОЦМ.
Материалы и методы. В данной статье изложен собственный опыт ведения 8 пациентов с рино-орбито-церебральным мукормикозом (РОЦМ). Описаны неврологические синдромы поражения черепных нервов, сосудистые и воспалительные поражения нервной системы в рамках данного синдрома.
Результаты. Неврологические осложнения РОЦМ имелись у всех больных и включали поражение черепных нервов (во всех случаях), тромбозы кавернозного синусов, инсульты и поражение оболочек головного мозга. Представлен алгоритм диагностики РОЦМ, описана тактика подбора медикаментозной терапии и хирургической помощи в санации очагов мукормикоза. Прослежен катамнез в каждом описываемом случае.
Ключевые слова: мукормикоз, рино-орбито-церебральный мукормикоз, коронавирусная инфекция, сахарный диабет.
Для цитирования: Руина Е.А., Королев И.А., Григорьева В.Н., Антипенко Е.А., Мисник А.С., Головина К.А. Неврологические проявления рино-орбито-церебрального мукормикоза. Клинический разбор в общей медицине. 2025; 6 (1): 65–73. DOI: 10.47407/kr2024.6.1.00552
Clinical Case
Ksenija A. Golovina1
1 Privolzhsky Research Medical University, Nizhny Novgorod, Russia;
² Semashko Regional Clinical Hospital, Nizhny Novgorod, Russia
ekaterina_ruina@mail.ru
Abstract
Mucormycosis is a severe fungal infection that develops in immunocompromised patients. Rhino-orbito-cerebral mucormycosis (ROCM) is the most common and dangerous clinical form of infection, characterized by infection of the nasal cavities, paranasal sinuses, cervical spaces, orbits and intracranial structures.
Aim. To describe a series of clinical observations, including 8 patients with ROCM from 2019 to 2023, to identify the features of neurological manifestations of ROCM.
Materials and methods. This article describes our own experience in the management of 8 patients with rhino-orbito-cerebral mucormycosis (ROCM). Neurological syndromes of cranial nerve damage, vascular and inflammatory lesions of the nervous system within the framework of this syndrome are described.
Results. Neurological complications of RCM were present in all patients and included damage to cranial nerves (in all cases), thrombosis of the cavernous sinuses, strokes and damage to the membranes of the brain. The algorithm of diagnosis of ROCM is presented, the tactics of selection of drug therapy and surgical care in the rehabilitation of foci of mucormycosis are described. The catamnesis was traced in each described case.
Keywords: mucormycosis, rhinocerebral mucormycosis, coronavirus infection, diabetes mellitus.
For citation: Ruina E.A., Korolev I.A., Grigoreva V.N., Antipenko E.A., Misnik A.S., Golovina K.A. Neurological manifestations of rhino-orbito-cerebral mucormycosis. Clinical review for general practice. 2025; 6 (1): 65–73 (In Russ.). DOI: 10.47407/kr2024.6.1.00552
Мукормикоз – опасная, молниеносно протекающая, потенциально смертельная инфекция, вызываемая грибами порядка Mucorales. Возбудителями данной инфекции являются грибы Rhizopus spp., Mucor spp. и Lichtheimia spp., значительно реже Rhizomucor spp., Cunninghamella spp., Apophysomyces spp. [1]. Источником инфекции служат споры грибов рода Mucorales, находящиеся в воздухе. Основной путь передачи инфекции воздушно-капельный, возможен фекально-оральный и контактный [2]. Возбудитель мукормикоза отличается высокой ангиоинвазивностью, приводящей к сосудистым тромбозам с последующим распространенным некрозом тканей и системной диссеминацией процесса.
Частота встречаемости мукормикоза в разных странах различна. Так, например, в Индии до 2019 г. заболеваемость мукормикозом составляла 0,005–1,7 на 1 млн населения, что в 80 раз выше, чем в мире (0,14 на 1 тыс. населения) [3]. В период пандемии новой коронавирусной инфекции число случаев мукормикоза в Индии увеличилось в 2,1 раза по сравнению с периодом до COVID [4].
При нормальном функционировании защитных механизмов организма риск заражения мукормикозом минимальный. В условиях иммунодефицита вследствие таких состояний, как сахарный диабет, инфекция COVID-19, онкологические, хронические инфекционные, гематологические заболевания, трансплантация органов и тканей, а также при лечении иммуносупрессивными препаратами происходят заражение и дальнейшее развитие различных форм инфекции [5].
Мукормикоз может проявляться полиморфными клиническими синдромами с изолированным поражением придаточных пазух носа, желудочно-кишечного тракта, легких, кожи, почек и нервной системы. Наиболее распространенным и опасным проявлением считается рино-орбито-церебральный мукормикоз (РОЦМ).
РОЦМ – это особая форма грибковой инфекции, характеризующаяся колонизацией и инвазией слизистой оболочки носа, пазух с переходом процесса на соседние области – орбиту, кости лицевого скелета и основания черепа, шейные пространства и внутричерепные структуры [6].
Неврологические осложнения РОЦМ опасны, трудно диагностируемы, их наличие ассоциировано с высокой инвалидизацией и летальным исходом. Представления о неврологических проявлениях РОЦМ в России требуют уточнения, поскольку данные в имеющихся отечественных литературных источниках единичны и противоречивы [7, 8].
Цель исследования – описание серии клинических наблюдений, включавших 8 пациентов с РОЦМ с 2019 по 2023 г., для выявления особенностей неврологических проявлений РОЦМ.
Поскольку число наблюдений было менее 10, далее приводятся лишь абсолютные значения признаков.
Развитие симптоматики РОЦМ у большинства (6 из 8) пациентов было ассоциировано с новой коронавирусной инфекцией. У всех пациентов коронавирусная инфекция протекала в форме пневмонии среднетяжелой степени без симптомов дыхательной недостаточности. У 4 пациентов первые симптомы РОЦМ манифестировали в острый период коронавирусной инфекции, у 2 – через 2 мес после перенесенной инфекции. У 2 пациентов связи с коронавирусной инфекцией не прослеживалось: 1 мужчина заболел РОЦМ в 2019 г. до пандемии, а другая пациентка – после завершения пандемии в 2023 г.
У большинства пациентов (7 из 8) в анамнезе имелись сердечно-сосудистые заболевания, такие как ишемическая болезнь сердца, гипертоническая болезнь, нарушения сердечного ритма по типу фибрилляции предсердий (см. таблицу).
Начальные симптомы РОЦМ включали повышение температуры, головную боль, общую слабость, симптомы воспаления придаточных пазух носа. Обращал на себя внимание субфебрильный характер лихорадки до 37,5 °С у 4 из 8 пациентов, у остальных повышения температуры вовсе не отмечалось. На головную боль средней интенсивности двусторонней локализации без тошноты и рвоты жаловались большинство пациентов. Симптомы воспаления придаточных пазух носа включали ощущение заложенности носа, боль в области придаточных пазух носа, гнойные выделения из носовых ходов, неприятный гнилостный запах из носа, отечность лица. Данная симптоматика отмечалась у всех пациентов.
В общем анализе крови при поступлении были выявлены умеренные воспалительные изменения в виде двукратного повышения уровня лейкоцитов крови, абсолютный нейтрофилез, абсолютная лимфопения у 6 пациентов. У 1 пациента изменения в общем анализе крови отсутствовали, еще у 1 пациента наблюдались признаки выраженной трехростковой цитопении, требующей переливания компонентов крови.
Микотический процесс изначально локализовался в одной из придаточных пазух носа с последующим постепенным вовлечением остальных пазух и развитием пансинусита у всех пациентов. Первоначальная локализация микотического процесса в верхнечелюстной пазухе и решетчатом лабиринте выявлялась у большинства пациентов, лишь у 2 больных микотический процесс начинался с клиновидной пазухи, еще у 1 пациента инфекция прогрессировала путем инвазии глубоких пространств лица с распространением гиф гриба на периневральные пространства верхнечелюстного и нижнечелюстного нервов.
Наиболее частым неврологическим осложнением было поражение черепных нервов, возникшее вследствие распространения микотического процесса в глубокие пространства лица (2 и 3-я ветви V, VII черепные нервы), орбиту (II, III, IV, VI, 1-я ветвь V черепного нерва).
Поражение зрительного нерва с развитием острой прогрессирующей потери зрения встречалось в 6 из 8 случаев. Невропатия глазодвигательных нервов (III, IV, VI пары черепных нервов) наблюдалась у 3 пациентов, проявлялась птозом, экзофтальмом, офтальмопарезом. Основной причиной поражения зрительного и глазодвигательных нервов была их компрессия распространяющимся воспалительным процессом в области орбиты. У 2 пациентов вероятной причиной развития острого амавроза послужил ишемический тромбоз артерии сетчатки без повреждения глазодвигательных нервов.
 У 7 из 8 пациентов при распространении некротических масс в пространства лица возникала невропатия лицевого, верхнечелюстного и нижнечелюстного нервов, что клинически проявлялось асимметрией лица, онемением в зоне иннервации 2 и 3-й ветви тройничного нерва, прозопалгией.
У 7 из 8 пациентов при распространении некротических масс в пространства лица возникала невропатия лицевого, верхнечелюстного и нижнечелюстного нервов, что клинически проявлялось асимметрией лица, онемением в зоне иннервации 2 и 3-й ветви тройничного нерва, прозопалгией.
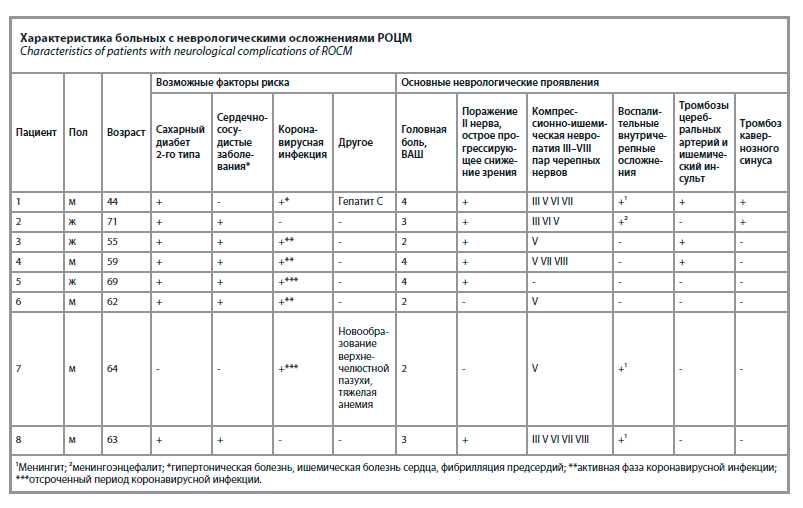
Воспалительные осложнения со стороны оболочек и вещества головного мозга диагностированы у 4 из 8 пациентов. Следует отметить, что клинические проявления внутричерепных воспалительных осложнений РОЦМ у всех больных были «стертыми», что проявлялось в слабой выраженности менингеального и общего интоксикационного синдрома. Диагноз основывался у 2 из 4 больных на результатах анализа цереброспинальной жидкости: у этих пациентов был выявлен небольшой лимфоцитарный плеоцитоз до 40 клеток при умеренном повышении уровня белка до 1 г/л. У 2 пациентов люмбальная пункция не проводилась в связи с наличием противопоказаний, а диагноз внутричерепного воспалительного процесса имел вероятностный характер, основываясь на данных МРТ. Локальный базальный менингит диагностирован на основании данных люмбальной пункции и МРТ у пациентов №1 и 8. Локализация поражения у этих больных была объяснена распространением грибкового поражения из основной пазухи на скат черепа в среднюю черепную ямку. Еще у 1 пациента (№7) инфекция распространилась в среднюю черепную ямку через пещеру Меккеля по данным МРТ. У другой пациентки (№2) возникли структурные изменения в области ольфакторной ямки (обнаруженные на МРТ; рис. 1) в рамках локального менингоэнцефалита за счет распространения инфекции через верхнюю глазничную щель и вовлечения в процесс орбиты.
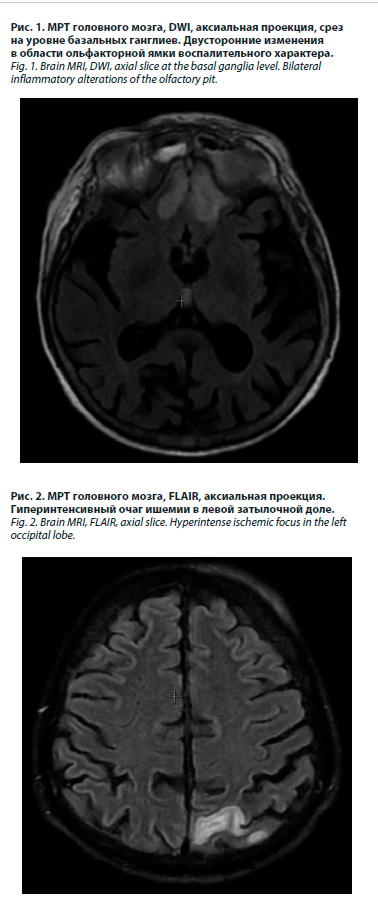
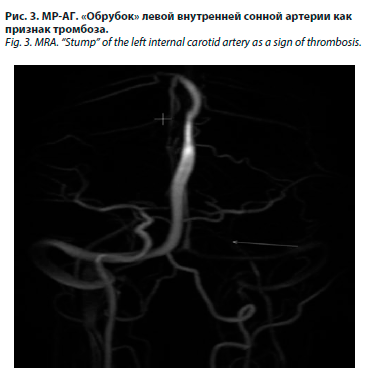
Сосудистые внутричерепные нарушения в виде тромбозов артерий (внутренней сонной и средней мозговой артерии), венозных синусов и вен головного мозга наблюдались у 1/2 пациентов. Тромбоз кавернозного синуса диагностирован у пациентов №1 и 2. Он, вероятно, развился вследствие распространения инфекции из орбиты в среднюю черепную ямку и проявился характерным комплексом симптомов с поражением трех обеспечивающих движения глаз черепных нервов, 1-й ветви тройничного нерва, птозом, хемозом, экзофтальмом. Тромбоз церебральных артерий был выявлен у пациентов №1 (рис. 2) и №3 (рис. 3) с развитием обширных ишемических полушарных инсультов. У пациента №1 выявлялся одновременно как тромбоз кавернозного синуса, так и полушарный инсульт. У пациента №4 в дебюте РОЦМ развился лакунарный инсульт с малым неврологическим дефицитом.
Перечисленные нарушения у больных чаще всего сочетались между собой будучи выражены в разной степени.
Всем 8 пациентам после установления диагноза РОЦМ и пансинусита проводилась эндоскопическая полисинусотомия. В дальнейшем 5 пациентам понадобилось расширенное оперативное лечение с резекцией структур лицевого скелета (носовая перегородка, верхняя челюсть, стенки орбиты, сошник, твердое небо), из них 1 пациенту проведена экзентрация орбиты. Остеонекрэктомия костей основания черепа была осуществлена у 2 пациентов.
Наряду с хирургическим лечением всем пациентам проводилась специфическая противогрибковая терапия. Основным препаратом для лечения РОЦМ является амфотерицин В. Терапия амфотерицином В была начата у 4 пациентов, у 1 пациента препарат был отменен ввиду развития анафилактической реакции, у другого больного – в связи с нараставшей почечной недостаточностью. Завершили весь курс терапии 2 пациента.
При наличии противопоказаний или непереносимости амфотерицина В применялся изавуконазол и вориконазол. Вориконазол получали 3 пациента. Изавуконазол был назначен 2 пациентам (1 пациенту изначально, а 1 пациента перевели на прием этого препарата после развития у него анафилактической реакции на амфотерицин В).
Лечение всех пациентов потребовало длительных сроков госпитализации, при этом 4 пациента в течение определенного периода времени находились в отделении реанимации, из них 1 больному с сепсисом проводились интубация трахеи и искусственная вентиляция легких.
За время госпитализации зарегистрировано 2 летальных исхода. Причиной послужили сепсис у 1 пациента и полиорганная недостаточность с наличием тяжелой коморбидной сопутствующей патологии и непереносимости амфотерицина В у другого пациента. Были выписаны из стационара под наблюдение невролога и оториноларинголога по месту жительства 6 из 8 пациентов. Через 2 нед после выписки из стационара 1 пациентка 71 года скончалась в результате развития обширного полушарного инсульта; 5 из 8 пациентов остаются живы по настоящий момент.
Приводим краткое описание наиболее яркого клинического случая РОЦМ.
Мужчина 44 лет поступил под наблюдение с признаками синусита, развившегося на фоне коронавирусной инфекции. В анамнезе имел гепатит С. Первые симптомы заболевания включали общеинфекционный синдром, заложенность носа, боль в области придаточных пазух носа слева, остро возникшую асимметрию лица. По данным КТ придаточных пазух носа выявлены признаки полисинусита, утолщение мягких тканей инфраорбитальной области слева. Выставлен диагноз «острый полисинусит».
Через 7 дней после госпитализации у пациента диагностированы неврологические симптомы: двоение в глазах, боль и асимметрия в левой половине лица. Объективно выявлялись птоз слева, левосторонняя офтальмоплегия, экзофтальм и хемоз. Наряду с этим были выявлены менингеальные знаки: ригидность затылочных мышц, положительный симптом Кернига с угла 160°. МР-ангиография головного мозга указала на признаки тромбоза кавернозного синуса. В анализе ликвора отмечался цитоз 14 клеток в 1 мкл (лимфоциты – 4, нейтрофилы – 10) и повышение белка до 0,77 г/л. Пациенту был установлен диагноз: «Вторичный риногенный менингит. Тромбоз кавернозного синуса. Невропатия V, VI, VII черепных нервов слева». В этот же период был заподозрен РОЦМ. Соответствующий диагноз был подтвержден в ходе выполнения эндоскопической полисинусотомии на основании характерной картины в виде наличия признака «черной плесени» в носовых пазухах как результата некроза тканей.
 На 14-й день у пациента к имевшимся проявлениям болезни присоединилось остро возникшее снижение зрения и слуха слева. В ходе обследования на МРТ головного мозга были выявлены зона острой ишемии теменной доли, а также признаки зон ишемии в левой затылочной и лобной долях, окклюзия левой внутренней сонной артерии.
На 14-й день у пациента к имевшимся проявлениям болезни присоединилось остро возникшее снижение зрения и слуха слева. В ходе обследования на МРТ головного мозга были выявлены зона острой ишемии теменной доли, а также признаки зон ишемии в левой затылочной и лобной долях, окклюзия левой внутренней сонной артерии.
Пациенту командой специалистов было выполнено хирургическое вмешательство. Начальными этапами являлись эндоскопическая полисинусотомия и вскрытие флегмоны левой щеки. В дальнейшем появилась необходимость в расширенном оперативном вмешательстве с резекцией структур лицевого скелета.
Параллельно с хирургическим лечением была назначена противогрибковая терапия вориконазолом с учетом всех сопутствующих состояний. После длительной терапии у больного наступило выздоровление с резидуальным неврологическим и косметическим дефицитом.
Тяжесть инфекции обусловлена способностью грибковых гиф проникать в стенки кровеносных сосудов, приводя к их некрозу и способствуя тромбозу этих сосудов. Возможны отрыв таких тромбов, содержащих гифы грибка, и диссеминация инфекции.
Во время пандемии новой коронавирусной инфекции заболеваемость РОЦМ в мире также возросла [3]. Этот факт объясняют не только влиянием самого этого вируса, но и активным назначением для лечения новой коронавирусной инфекции глюкокортикостероидов и других препаратов, оказывающих иммунодепрессивное действие [5].
По данным G. Singh и соавт. (2021 г.), РОЦМ чаще развивается через 1–3 нед после стихания острых клинических проявлений пневмонии, связанной с коронавирусной инфекцией, хотя может возникнуть и во время активной фазы заболевания, а также при асимптомном носительстве SARS-CoV-2. Из 8 наблюдавшихся нами больных у 6 человек РОЦМ возник после (через 3 нед) перенесенной коронавирусной инфекции, что согласуется с данными [11].
Обзор научных публикаций привел R. Al-Ani (2022 г.) к выводу, что РОЦМ чаще всего встречается у лиц мужского пола, а также у лиц старше 60 лет. В числе наблюдавшихся нами больных также преобладали мужчины (5 из 8 человек) и 5 человек из 8 были старше 60 лет [3].
Среди факторов риска РОЦМ наиболее важная роль отводится сахарному диабету с осложненным течением. Полагают, что неконтролируемая гипергликемия при наличии кетоацидоза создает высокий риск распространения инфекции, нарушая функцию нейтрофилов [12]. Наши данные подтверждают такое мнение (у 6 пациентов отмечалось осложненное течение сахарного диабета).
Первые симптомы РОЦМ неспецифичны, соответствуют клинике острого синусита [2]. Первоначальными жалобами у наблюдавшихся нами больных являлись лихорадка, головная боль, тошнота и общая слабость. Также имели место такие ринологические симптомы, как заложенность носа, боль в области придаточных пазух, отечность лица, выделения из носовых ходов с неприятным гнилостным запахом. При объективном осмотре отмечались изъязвления слизистой оболочки полости рта и неба, образование «корочек» в полости носа, отечность тканей. К особенностям общего инфекционного синдрома при РОЦМ относят невысокий характер лихорадки или ее отсутствие, а также невыраженные воспалительные изменения в общем анализе крови (лейкоцитоз до 17 000–109, с относительным и абсолютным нейтрофилезом и выраженной лимфопенией), что и наблюдалось у всех обследованных нами больных [6]. Также для РОЦМ характерна специфическая для грибкового поражения эндоскопическая картина в виде черного налета на слизистой оболочке носа [13, 14].
У большинства наблюдавшихся нами пациентов группы отмечались все описанные первоначальные клинические проявления РОЦМ и у всех больных имелись специфические для грибкового поражения изменения по данным эндоскопической полисинусотомии.
Микотический процесс со слизистой оболочки носовой полости распространялся на слизистую оболочку придаточных пазух. Чаще первой поражалась верхнечелюстная пазуха с последующим вовлечением решетчатой и клиновидной пазух с развитием пансинусита [15].
По данным литературы, дальнейший путь распространения инфекции в центральную нервную систему может быть различным.
Проникновение микотических масс, во-первых, может происходить через латеральную стенку решетчатого лабиринта (которая одновременно служит медиальной стенкой глазницы) в орбиту, а из нее, через верхнюю глазничную щель, – в полость черепа и затем в кавернозный синус [16]. Такой путь распространения инфекции отмечался у 3 наблюдавшихся нами больных.
Во-вторых, гифы гриба способны инвазировать нижнюю стенку орбиты через верхнюю челюстную пазуху, а затем вновь через верхнюю глазничную щель проникать в кавернозный синус и среднюю черепную ямку. Данный вариант отмечался у 2 наших пациентов [17].
В-третьих, попадание грибковой инфекции в центральную нервную систему может осуществляться путем расплавления клиновидной пазухи с переходом на скат и проникновением в среднюю черепную ямку и развитием базального менингита. Данный путь проникновения диагностирован у 2 пациентов [11].
В-четвертых, возможна грибковая инвазия глубоких пространств лица с периневральным распространением спор по верхнечелюстному и нижнечелюстному нерву в пространство Меккеля, далее в среднюю черепную ямку с развитием базального менингита. Данный вариант считается наиболее редким [11], он отмечался у 1 из наблюдавшихся нами пациентов.
Наряду с указанными описан пятый путь проникновения микотических масс во внутричерепное пространство путем инвазии стенки лобной пазухи, с переходом через переднее продырявленное вещество непосредственно в переднюю черепную ямку на лобные доли головного мозга. Данный путь не встречался ни у одного из пациентов [18].
Поражения нервной системы при РОЦМ разнообразны, могут быть представлены невропатией черепных нервов, внутричерепными сосудистыми и воспалительными осложнениями.
Нейропатия зрительного и глазодвигательных нервов обусловлена некротическим струпом на вершине глазницы и отеком экстраокулярных мышц и орбитальной жировой клетчатки [5]. Клинические признаки включают офтальмоплегию, экзофтальм. При вовлечении зрительного нерва развивается частичная или полная потеря зрения, которая диагностирована у 6 наблюдавшихся нами пациентов. Помимо компрессионного, инфильтративного генеза нейропатии зрительного нерва, приводящей чаще к амблиопии, возможен ишемический амавроз вследствие задней ишемической нейропатии или окклюзии центральной артерии сетчатки [11]. Вторая и 3-я ветви тройничного нерва, а также лицевой нерв поражаются при инвазии грибковыми массами жевательного пространства, подвисочной и крыловидно-небной ямок. Это достаточно частое неврологическое осложнение, в нашей выборке отмечено у всех больных [5].
Среди сосудистых осложнений диагностированы артериальные и венозные тромбозы, главным образом в бассейне внутренней сонной артерии, и тромбоз кавернозного синуса [5]. Тромбозы высокоспецифичны для течения РОЦМ вследствие склонности возбудителя инвазировать сосудистую стенку и образовывать грибковые тромбы в просвете сосуда.
Поражение решетчатого лабиринта сопровождается высоким риском тромбоза кавернозного синуса, так как бесклапанные эмиссарные вены, дренирующие его, пересекают бумажную пластинку решетчатой кости, что способствует распространению грибковой инфекции в периорбитальную ткань, верхушку глазницы и сам синус. Кавернозный синус часто является первой внутричерепной структурой, которая поражается при РОЦМ. Тромбоз кавернозного синуса проявляется классическими симптомами невропатии зрительного, глазодвигательных, а также 1 и 2-й ветвей тройничного нерва, хемозом, экзофтальмом. Тромбоз кавернозного синуса был диагностирован у 2 пациентов из нашей группы. Реже встречается тромбоз сагиттального синуса с последующим формированием эпидурального и субдурального абсцессов. Он характеризуется появлением гемипареза, изменением сознания и фокальными судорогами [19].
По данным S. Dubey и соавт. (2021 г.), артериальные тромбозы с развитием ишемического инсульта при РОЦМ не являются редкостью. Настороженность в отношении ишемических инсультов должна быть высокой, так как протекают они с неярко выраженной симптоматикой, проявляющейся, например, в виде лакунарных синдромов с двигательными и речевыми нарушениями. Также описаны случаи асимптомного течения, когда диагноз инсульта устанавливался лишь на основании данных нейровизуализации [19]. Артериальные сосудистые тромбозы диагностированы у 4 пациентов нашей группы, из них у 3 отмечался малый неврологический дефицит, 1 пациентка умерла от обширного полушарного инсульта.
Воспалительные осложнения при РОЦМ могут проявляться в виде лептоменингита и энцефалита [5]. В исследовании S. Dubey и соавт. (2021 г.) отмечается частое (у 1/2 больных) возникновение ограниченного поражения оболочек головного мозга («локального» менингита). Для такого менингита характерно отсутствие яркого менингеального синдрома и ригидности шеи, что объясняется ограниченностью области поражения. Менингит может сочетаться с поражением близлежащего вещества височных и лобных долей головного мозга. Преимущественное поражение лобной или височной долей объясняется распространением грибковых масс из лобной пазухи или кавернозного синуса соответственно [20]. Энцефалит может осложняться образованием гранулемы или абсцесса. Грибковые абсцессы часто формируются в базальных ганглиях и в подкорковом слое. Как правило, они множественные, имеют неровные края и внутриполостные выступы. Описанные осложнения, однако, в нашей серии наблюдений не встречались [5].
КТ является первоочередным исследованием, которое проводится при подозрении на РОЦМ, ввиду первичных проявлений инфекции со стороны полости носа и придаточных пазух. Результаты ее неспецифичны, в виде недифференцированных воспалительных изменений в придаточных пазухах носа. Начальные изменения на КТ включают утолщение слизистой оболочки, костные эрозии и помутнение пазух из-за массивного их разрушения [5]. Для РОЦМ характерно наличие участков повышенной плотности в придаточных пазухах, что свидетельствует о присутствии грибковых гифов и очагов костной деструкции. Данные изменения наблюдались у всех пациентов на начальных этапах развития инфекции [21]. При распространении процесса за пределы пазух по данным КТ выявляется усиление сигнала от жировой клетчатки орбиты и поверхностной жировой клетчатки лица [22].
Поражение орбитальных и внутричерепных структур лучше визуализируются при использовании на МРТ. Начальные МР-симптомы включают утолщение слизистой оболочки носа и пазух, гипоинтенсивные на
Т1-взвешенном изображении (Т1-ВИ) и гиперинтенсивные на Т2-взвешенном изображении (Т2-ВИ). Инвазия паренхимы головного мозга визуализируется в виде гранулем, что при грибковых процессах характеризуется слабым усилением сигнала и окружающим отеком [5].
Грибковые абсцессы единичные или множественные образуются субкортикально и в базальных ганглиях, имеют неровные фестончатые края, сигнал от них гипоинтенсивен на T1-ВИ и гиперинтенсивен на T2-ВИ [23].
При тромбозе кавернозного синуса выявляются гипоинтенсивые на T1-ВИ и T2-ВИ тромботические массы, при контрастировании – неоднородное интенсивное повышение МР-сигнала в области синуса [24].
Специфического серологического лабораторного маркера мукормикоза до сих пор не описано. Достоверный диагноз основывается на микробиологическом анализе ткани, полученной при биопсии или хирургической обработке и взятой на посев на декстрозный агар Сабуро, содержащий циклогексимид и хлорамфеникол. Рост микроорганизмов отмечается в течение 3–5 дней при температуре 25–30 °С. Для некоторых видов (Cunnighamella и Rhizopus) требуются микроаэрофильные условия, подобные тем, которые имеются в поврежденных тканях [25].
Вероятный диагноз может быть поставлен путем прямого микроскопического исследования ткани придаточных пазух и легких на основании обнаружения специфических гифов гриба. Прямую визуализацию можно осуществить с помощью добавления к микропрепарату гидроксида калия с использованием яркого микроскопа или флуоресцентного микроскопа после окрашивания флуоресцентными красителями Бланкофор и Калькофлюор Уайт. Морфологически гифы Mucorales лишены перегородок, имеют характерное лентовидное строение с разветвлением от 45 до 90°. Гифы Mucorales слабо окрашиваются метенаминовым серебром Гомори и методами периодной кислоты Шиффа из-за их тонкой стенки [26].
Всем пациентам в нашей группе выполнялось микроскопическое исследование биопсийного операционного материала и диагноз устанавливался после обнаружения характерных гифов гриба.
Лечение РОЦМ необходимо начинать незамедлительно, как только возникло подозрение на данное заболевание. Вначале терапия имеет эмпирический характер. Наиболее эффективным является трехкомпонентный подход, заключающийся в исключении (по возможности) всех иммуносупрессивных влияний на организм, назначении специфических противогрибковых препаратов и радикальной хирургической обработке всех пораженных структур.
Основным противогрибковым средством является амфотерицин В, который нами был изначально назначен 4 пациентам [6]. Препарат обладает выраженной нефротоксичностью и с осторожностью должен применяться при сахарном диабете. Ввиду указанных причин, а также выявленной его непереносимости препарат в итоге был отменен у 2 из 4 указанных пациентов.
Амфотерицин В является лучшим из доступных лекарственных средств, влияющим на грибы порядка Mucorales [27]. Липосомальный амфотерицин В является менее токсичным по сравнению с дезоксихолятом амфотерицина В, что позволяет использовать его в высоких дозировках в течение длительного периода времени [28]. Оптимальная суточная доза при лечении РОЦМ составляет 10 мг/кг в течение нескольких недель, что обеспечивает быстрое снижение грибковой нагрузки и более эффективную элиминацию спор гриба [29]. После клинического улучшения переходят на пероральную поддерживающую терапию позаконазолом и изавуконазолом.
Изавуконазол и позаконазол могут служить альтернативой амфотерицину [23], однако в качестве первоначальной терапии они назначаются только при непереносимости амфотерицина В, который является более эффективным фунгицидом. Комбинированное лечение амфотерицином В и позаконазолом не продемонстрировало превосходства перед монотерапией [28]. Позаконазол используется в качестве пероральной поддерживающей терапии в дозе 300 мг 2 раза в первые сутки с дальнейшим переходом на дозу 300 мг 1 раз в день в течение 2 нед. Суточная доза изавуконазола составляет 372 мг; препарат назначается через каждые 8 ч в течение 2 сут, затем по 372 мг 1 раз в день в течение 2 нед [24].
Хирургическая санация считается основой лечения мукормикоза, заключается в обширной резекции инфицированных и некротизированных тканей. При раннем локализованном инвазивном грибковом синусите рекомендуется проведение эндоскопической полисинусотомии, которая была проведена всем нашим пациентам. Открытая расширенная санация с экзентрацией орбиты, черепно-лицевой резекцией проводится пациентам с поражением орбиты, костей лицевого скелета, внутричерепной инвазией. Как правило, такие сложные оперативные вмешательства осуществляются в несколько этапов и проводятся командой специалистов с участием оториноларингологов, нейрохирургов, челюстно-лицевых хирургов, окулистов. Расширенная санация проведена большинству описанных нами пациентов [26].
Мукормикоз характеризуется глубокой инвалидизацией больных и высоким риском летального исхода [2]. Из числа наблюдавшихся нами 8 пациентов выжили 5 человек, во многом за счет своевременной диагностики заболевания и осуществления лечения с участием большой команды специалистов самого разного профиля, включая неврологов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Руина Екатерина Андреевна – канд. мед. наук, доц. каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ, врач-невролог. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Ekaterina A. Ruina – Cand. Sci. (Med.), Privolzhsky Research Medical University. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Королев Игорь Андреевич – врач-оториноларинголог высшей категории, зав. лор-отд-нием, ГБУЗ НО «НОКБ им. Н.А. Семашко»
Igor A. Korolev – otorhinolaryngologist, Semashko Regional Clinical Hospital
Григорьева Вера Наумова – д-р мед. наук, проф., зав. каф. нервных болезней, ФГБОУ ВО ПИМУ, врач-невролог
Vera N. Grigoreva – Dr. Sci. (Med.), Prof., Privolzhsky Research Medical University
Антипенко Елена Альбертовна – д-р мед. наук, доц., зав. каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ, врач-невролог
Elena A. Antipenko – Dr. Sci. (Med.), Assoc. Prof., Privolzhsky Research Medical University
Мисник Алина Сергеевна – ординатор-невролог 2-го года каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ
Alina S. Misnik – Resident neurologist, Privolzhsky Research Medical University
Головина Ксения Андреевна – ординатор-невролог 2-го года каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ
Ksenija A. Golovina – Resident neurologist, Privolzhsky Research Medical University
Поступила в редакцию: 21.10.2024
Поступила после рецензирования: 05.11.2024
Принята к публикации: 14.11.2024
Received: 21.10.2024
Revised: 05.11.2024
Accepted: 14.11.2024
Neurological manifestations of rhino-orbito-cerebral mucormycosis
Ekaterina A. Ruina1, Igor A. Korolev2, Vera N. Grigoreva1, Elena A.Antipenko1, Alina S. Misnik1,Ksenija A. Golovina1
1 Privolzhsky Research Medical University, Nizhny Novgorod, Russia;
² Semashko Regional Clinical Hospital, Nizhny Novgorod, Russia
ekaterina_ruina@mail.ru
Abstract
Mucormycosis is a severe fungal infection that develops in immunocompromised patients. Rhino-orbito-cerebral mucormycosis (ROCM) is the most common and dangerous clinical form of infection, characterized by infection of the nasal cavities, paranasal sinuses, cervical spaces, orbits and intracranial structures.
Aim. To describe a series of clinical observations, including 8 patients with ROCM from 2019 to 2023, to identify the features of neurological manifestations of ROCM.
Materials and methods. This article describes our own experience in the management of 8 patients with rhino-orbito-cerebral mucormycosis (ROCM). Neurological syndromes of cranial nerve damage, vascular and inflammatory lesions of the nervous system within the framework of this syndrome are described.
Results. Neurological complications of RCM were present in all patients and included damage to cranial nerves (in all cases), thrombosis of the cavernous sinuses, strokes and damage to the membranes of the brain. The algorithm of diagnosis of ROCM is presented, the tactics of selection of drug therapy and surgical care in the rehabilitation of foci of mucormycosis are described. The catamnesis was traced in each described case.
Keywords: mucormycosis, rhinocerebral mucormycosis, coronavirus infection, diabetes mellitus.
For citation: Ruina E.A., Korolev I.A., Grigoreva V.N., Antipenko E.A., Misnik A.S., Golovina K.A. Neurological manifestations of rhino-orbito-cerebral mucormycosis. Clinical review for general practice. 2025; 6 (1): 65–73 (In Russ.). DOI: 10.47407/kr2024.6.1.00552
Мукормикоз – опасная, молниеносно протекающая, потенциально смертельная инфекция, вызываемая грибами порядка Mucorales. Возбудителями данной инфекции являются грибы Rhizopus spp., Mucor spp. и Lichtheimia spp., значительно реже Rhizomucor spp., Cunninghamella spp., Apophysomyces spp. [1]. Источником инфекции служат споры грибов рода Mucorales, находящиеся в воздухе. Основной путь передачи инфекции воздушно-капельный, возможен фекально-оральный и контактный [2]. Возбудитель мукормикоза отличается высокой ангиоинвазивностью, приводящей к сосудистым тромбозам с последующим распространенным некрозом тканей и системной диссеминацией процесса.
Частота встречаемости мукормикоза в разных странах различна. Так, например, в Индии до 2019 г. заболеваемость мукормикозом составляла 0,005–1,7 на 1 млн населения, что в 80 раз выше, чем в мире (0,14 на 1 тыс. населения) [3]. В период пандемии новой коронавирусной инфекции число случаев мукормикоза в Индии увеличилось в 2,1 раза по сравнению с периодом до COVID [4].
При нормальном функционировании защитных механизмов организма риск заражения мукормикозом минимальный. В условиях иммунодефицита вследствие таких состояний, как сахарный диабет, инфекция COVID-19, онкологические, хронические инфекционные, гематологические заболевания, трансплантация органов и тканей, а также при лечении иммуносупрессивными препаратами происходят заражение и дальнейшее развитие различных форм инфекции [5].
Мукормикоз может проявляться полиморфными клиническими синдромами с изолированным поражением придаточных пазух носа, желудочно-кишечного тракта, легких, кожи, почек и нервной системы. Наиболее распространенным и опасным проявлением считается рино-орбито-церебральный мукормикоз (РОЦМ).
РОЦМ – это особая форма грибковой инфекции, характеризующаяся колонизацией и инвазией слизистой оболочки носа, пазух с переходом процесса на соседние области – орбиту, кости лицевого скелета и основания черепа, шейные пространства и внутричерепные структуры [6].
Неврологические осложнения РОЦМ опасны, трудно диагностируемы, их наличие ассоциировано с высокой инвалидизацией и летальным исходом. Представления о неврологических проявлениях РОЦМ в России требуют уточнения, поскольку данные в имеющихся отечественных литературных источниках единичны и противоречивы [7, 8].
Цель исследования – описание серии клинических наблюдений, включавших 8 пациентов с РОЦМ с 2019 по 2023 г., для выявления особенностей неврологических проявлений РОЦМ.
Материалы и методы
Мы наблюдали 8 пациентов с РОЦМ, которые находились на лечении в ГБУЗ «Нижегородская областная клиническая больница им. Н.А. Семашко» г. Нижнего Новгорода в период с 2019 по 2023 г. Обследование включало соматический, неврологический, оториноларингологический осмотры, компьютерную томографию (КТ) и/или магнитно-резонансную томографию (МРТ) головного мозга. Отдельное внимание уделено неврологическим осложнениям РОЦМ. Наряду с этим проводился анализ медицинской документации за предшествовавшие месяцы и выкопировывались данные о преморбидной патологии.Поскольку число наблюдений было менее 10, далее приводятся лишь абсолютные значения признаков.
Результаты
Из обследованных пациентов были 3 женщины и 5 мужчин; 1 пациент молодого возраста (44 года), 2 пациента среднего возраста (55–59 лет), 5 – пожилого возраста (старше 60 лет); см. таблицу. Наиболее частой преморбидной патологией РОЦМ являлся сахарный диабет – у 7 из 8 больных. Хронические вирусные инфекции (гепатит С) наблюдались у 1 пациента, новообразование верхнечелюстной пазухи и тяжелая анемия – также у 1 больного (впервые выявленные).Развитие симптоматики РОЦМ у большинства (6 из 8) пациентов было ассоциировано с новой коронавирусной инфекцией. У всех пациентов коронавирусная инфекция протекала в форме пневмонии среднетяжелой степени без симптомов дыхательной недостаточности. У 4 пациентов первые симптомы РОЦМ манифестировали в острый период коронавирусной инфекции, у 2 – через 2 мес после перенесенной инфекции. У 2 пациентов связи с коронавирусной инфекцией не прослеживалось: 1 мужчина заболел РОЦМ в 2019 г. до пандемии, а другая пациентка – после завершения пандемии в 2023 г.
У большинства пациентов (7 из 8) в анамнезе имелись сердечно-сосудистые заболевания, такие как ишемическая болезнь сердца, гипертоническая болезнь, нарушения сердечного ритма по типу фибрилляции предсердий (см. таблицу).

Начальные симптомы РОЦМ включали повышение температуры, головную боль, общую слабость, симптомы воспаления придаточных пазух носа. Обращал на себя внимание субфебрильный характер лихорадки до 37,5 °С у 4 из 8 пациентов, у остальных повышения температуры вовсе не отмечалось. На головную боль средней интенсивности двусторонней локализации без тошноты и рвоты жаловались большинство пациентов. Симптомы воспаления придаточных пазух носа включали ощущение заложенности носа, боль в области придаточных пазух носа, гнойные выделения из носовых ходов, неприятный гнилостный запах из носа, отечность лица. Данная симптоматика отмечалась у всех пациентов.
В общем анализе крови при поступлении были выявлены умеренные воспалительные изменения в виде двукратного повышения уровня лейкоцитов крови, абсолютный нейтрофилез, абсолютная лимфопения у 6 пациентов. У 1 пациента изменения в общем анализе крови отсутствовали, еще у 1 пациента наблюдались признаки выраженной трехростковой цитопении, требующей переливания компонентов крови.
Микотический процесс изначально локализовался в одной из придаточных пазух носа с последующим постепенным вовлечением остальных пазух и развитием пансинусита у всех пациентов. Первоначальная локализация микотического процесса в верхнечелюстной пазухе и решетчатом лабиринте выявлялась у большинства пациентов, лишь у 2 больных микотический процесс начинался с клиновидной пазухи, еще у 1 пациента инфекция прогрессировала путем инвазии глубоких пространств лица с распространением гиф гриба на периневральные пространства верхнечелюстного и нижнечелюстного нервов.
Наиболее частым неврологическим осложнением было поражение черепных нервов, возникшее вследствие распространения микотического процесса в глубокие пространства лица (2 и 3-я ветви V, VII черепные нервы), орбиту (II, III, IV, VI, 1-я ветвь V черепного нерва).
Поражение зрительного нерва с развитием острой прогрессирующей потери зрения встречалось в 6 из 8 случаев. Невропатия глазодвигательных нервов (III, IV, VI пары черепных нервов) наблюдалась у 3 пациентов, проявлялась птозом, экзофтальмом, офтальмопарезом. Основной причиной поражения зрительного и глазодвигательных нервов была их компрессия распространяющимся воспалительным процессом в области орбиты. У 2 пациентов вероятной причиной развития острого амавроза послужил ишемический тромбоз артерии сетчатки без повреждения глазодвигательных нервов.
 У 7 из 8 пациентов при распространении некротических масс в пространства лица возникала невропатия лицевого, верхнечелюстного и нижнечелюстного нервов, что клинически проявлялось асимметрией лица, онемением в зоне иннервации 2 и 3-й ветви тройничного нерва, прозопалгией.
У 7 из 8 пациентов при распространении некротических масс в пространства лица возникала невропатия лицевого, верхнечелюстного и нижнечелюстного нервов, что клинически проявлялось асимметрией лица, онемением в зоне иннервации 2 и 3-й ветви тройничного нерва, прозопалгией. Воспалительные осложнения со стороны оболочек и вещества головного мозга диагностированы у 4 из 8 пациентов. Следует отметить, что клинические проявления внутричерепных воспалительных осложнений РОЦМ у всех больных были «стертыми», что проявлялось в слабой выраженности менингеального и общего интоксикационного синдрома. Диагноз основывался у 2 из 4 больных на результатах анализа цереброспинальной жидкости: у этих пациентов был выявлен небольшой лимфоцитарный плеоцитоз до 40 клеток при умеренном повышении уровня белка до 1 г/л. У 2 пациентов люмбальная пункция не проводилась в связи с наличием противопоказаний, а диагноз внутричерепного воспалительного процесса имел вероятностный характер, основываясь на данных МРТ. Локальный базальный менингит диагностирован на основании данных люмбальной пункции и МРТ у пациентов №1 и 8. Локализация поражения у этих больных была объяснена распространением грибкового поражения из основной пазухи на скат черепа в среднюю черепную ямку. Еще у 1 пациента (№7) инфекция распространилась в среднюю черепную ямку через пещеру Меккеля по данным МРТ. У другой пациентки (№2) возникли структурные изменения в области ольфакторной ямки (обнаруженные на МРТ; рис. 1) в рамках локального менингоэнцефалита за счет распространения инфекции через верхнюю глазничную щель и вовлечения в процесс орбиты.
Сосудистые внутричерепные нарушения в виде тромбозов артерий (внутренней сонной и средней мозговой артерии), венозных синусов и вен головного мозга наблюдались у 1/2 пациентов. Тромбоз кавернозного синуса диагностирован у пациентов №1 и 2. Он, вероятно, развился вследствие распространения инфекции из орбиты в среднюю черепную ямку и проявился характерным комплексом симптомов с поражением трех обеспечивающих движения глаз черепных нервов, 1-й ветви тройничного нерва, птозом, хемозом, экзофтальмом. Тромбоз церебральных артерий был выявлен у пациентов №1 (рис. 2) и №3 (рис. 3) с развитием обширных ишемических полушарных инсультов. У пациента №1 выявлялся одновременно как тромбоз кавернозного синуса, так и полушарный инсульт. У пациента №4 в дебюте РОЦМ развился лакунарный инсульт с малым неврологическим дефицитом.
Перечисленные нарушения у больных чаще всего сочетались между собой будучи выражены в разной степени.
Всем 8 пациентам после установления диагноза РОЦМ и пансинусита проводилась эндоскопическая полисинусотомия. В дальнейшем 5 пациентам понадобилось расширенное оперативное лечение с резекцией структур лицевого скелета (носовая перегородка, верхняя челюсть, стенки орбиты, сошник, твердое небо), из них 1 пациенту проведена экзентрация орбиты. Остеонекрэктомия костей основания черепа была осуществлена у 2 пациентов.
Наряду с хирургическим лечением всем пациентам проводилась специфическая противогрибковая терапия. Основным препаратом для лечения РОЦМ является амфотерицин В. Терапия амфотерицином В была начата у 4 пациентов, у 1 пациента препарат был отменен ввиду развития анафилактической реакции, у другого больного – в связи с нараставшей почечной недостаточностью. Завершили весь курс терапии 2 пациента.
При наличии противопоказаний или непереносимости амфотерицина В применялся изавуконазол и вориконазол. Вориконазол получали 3 пациента. Изавуконазол был назначен 2 пациентам (1 пациенту изначально, а 1 пациента перевели на прием этого препарата после развития у него анафилактической реакции на амфотерицин В).
Лечение всех пациентов потребовало длительных сроков госпитализации, при этом 4 пациента в течение определенного периода времени находились в отделении реанимации, из них 1 больному с сепсисом проводились интубация трахеи и искусственная вентиляция легких.
За время госпитализации зарегистрировано 2 летальных исхода. Причиной послужили сепсис у 1 пациента и полиорганная недостаточность с наличием тяжелой коморбидной сопутствующей патологии и непереносимости амфотерицина В у другого пациента. Были выписаны из стационара под наблюдение невролога и оториноларинголога по месту жительства 6 из 8 пациентов. Через 2 нед после выписки из стационара 1 пациентка 71 года скончалась в результате развития обширного полушарного инсульта; 5 из 8 пациентов остаются живы по настоящий момент.
Приводим краткое описание наиболее яркого клинического случая РОЦМ.
Мужчина 44 лет поступил под наблюдение с признаками синусита, развившегося на фоне коронавирусной инфекции. В анамнезе имел гепатит С. Первые симптомы заболевания включали общеинфекционный синдром, заложенность носа, боль в области придаточных пазух носа слева, остро возникшую асимметрию лица. По данным КТ придаточных пазух носа выявлены признаки полисинусита, утолщение мягких тканей инфраорбитальной области слева. Выставлен диагноз «острый полисинусит».
Через 7 дней после госпитализации у пациента диагностированы неврологические симптомы: двоение в глазах, боль и асимметрия в левой половине лица. Объективно выявлялись птоз слева, левосторонняя офтальмоплегия, экзофтальм и хемоз. Наряду с этим были выявлены менингеальные знаки: ригидность затылочных мышц, положительный симптом Кернига с угла 160°. МР-ангиография головного мозга указала на признаки тромбоза кавернозного синуса. В анализе ликвора отмечался цитоз 14 клеток в 1 мкл (лимфоциты – 4, нейтрофилы – 10) и повышение белка до 0,77 г/л. Пациенту был установлен диагноз: «Вторичный риногенный менингит. Тромбоз кавернозного синуса. Невропатия V, VI, VII черепных нервов слева». В этот же период был заподозрен РОЦМ. Соответствующий диагноз был подтвержден в ходе выполнения эндоскопической полисинусотомии на основании характерной картины в виде наличия признака «черной плесени» в носовых пазухах как результата некроза тканей.
 На 14-й день у пациента к имевшимся проявлениям болезни присоединилось остро возникшее снижение зрения и слуха слева. В ходе обследования на МРТ головного мозга были выявлены зона острой ишемии теменной доли, а также признаки зон ишемии в левой затылочной и лобной долях, окклюзия левой внутренней сонной артерии.
На 14-й день у пациента к имевшимся проявлениям болезни присоединилось остро возникшее снижение зрения и слуха слева. В ходе обследования на МРТ головного мозга были выявлены зона острой ишемии теменной доли, а также признаки зон ишемии в левой затылочной и лобной долях, окклюзия левой внутренней сонной артерии. Пациенту командой специалистов было выполнено хирургическое вмешательство. Начальными этапами являлись эндоскопическая полисинусотомия и вскрытие флегмоны левой щеки. В дальнейшем появилась необходимость в расширенном оперативном вмешательстве с резекцией структур лицевого скелета.
Параллельно с хирургическим лечением была назначена противогрибковая терапия вориконазолом с учетом всех сопутствующих состояний. После длительной терапии у больного наступило выздоровление с резидуальным неврологическим и косметическим дефицитом.
Обсуждение
Мукормикоз – опасная оппортунистическая инфекция, вызываемая грибами порядка Mucorales, которые распространены в почве, разлагающихся органических веществах, компосте и могут обнаруживаться в загрязненных пищевых продуктах [9]. Эта инфекция поражает людей с ослабленным иммунитетом. Принято считать, что мукормикоз является редким инфекционным заболеванием, однако анализ современных данных показывает, что заболеваемость мукормикозом растет во всем мире [10]. Особенно увеличилась она в Индии в период пандемии новой коронавирусной инфекции, когда число заболевших достигло 900 тыс. случаев (за 2019–2022 гг.) [3, 4]. РОЦМ относится к ее наиболее распространенной и опасной клинической форме и характеризуется инфицированием полостей носа, околоносовых пазух, шейных пространств, орбит и внутричерепных структур [6].Тяжесть инфекции обусловлена способностью грибковых гиф проникать в стенки кровеносных сосудов, приводя к их некрозу и способствуя тромбозу этих сосудов. Возможны отрыв таких тромбов, содержащих гифы грибка, и диссеминация инфекции.
Во время пандемии новой коронавирусной инфекции заболеваемость РОЦМ в мире также возросла [3]. Этот факт объясняют не только влиянием самого этого вируса, но и активным назначением для лечения новой коронавирусной инфекции глюкокортикостероидов и других препаратов, оказывающих иммунодепрессивное действие [5].
По данным G. Singh и соавт. (2021 г.), РОЦМ чаще развивается через 1–3 нед после стихания острых клинических проявлений пневмонии, связанной с коронавирусной инфекцией, хотя может возникнуть и во время активной фазы заболевания, а также при асимптомном носительстве SARS-CoV-2. Из 8 наблюдавшихся нами больных у 6 человек РОЦМ возник после (через 3 нед) перенесенной коронавирусной инфекции, что согласуется с данными [11].
Обзор научных публикаций привел R. Al-Ani (2022 г.) к выводу, что РОЦМ чаще всего встречается у лиц мужского пола, а также у лиц старше 60 лет. В числе наблюдавшихся нами больных также преобладали мужчины (5 из 8 человек) и 5 человек из 8 были старше 60 лет [3].
Среди факторов риска РОЦМ наиболее важная роль отводится сахарному диабету с осложненным течением. Полагают, что неконтролируемая гипергликемия при наличии кетоацидоза создает высокий риск распространения инфекции, нарушая функцию нейтрофилов [12]. Наши данные подтверждают такое мнение (у 6 пациентов отмечалось осложненное течение сахарного диабета).
Первые симптомы РОЦМ неспецифичны, соответствуют клинике острого синусита [2]. Первоначальными жалобами у наблюдавшихся нами больных являлись лихорадка, головная боль, тошнота и общая слабость. Также имели место такие ринологические симптомы, как заложенность носа, боль в области придаточных пазух, отечность лица, выделения из носовых ходов с неприятным гнилостным запахом. При объективном осмотре отмечались изъязвления слизистой оболочки полости рта и неба, образование «корочек» в полости носа, отечность тканей. К особенностям общего инфекционного синдрома при РОЦМ относят невысокий характер лихорадки или ее отсутствие, а также невыраженные воспалительные изменения в общем анализе крови (лейкоцитоз до 17 000–109, с относительным и абсолютным нейтрофилезом и выраженной лимфопенией), что и наблюдалось у всех обследованных нами больных [6]. Также для РОЦМ характерна специфическая для грибкового поражения эндоскопическая картина в виде черного налета на слизистой оболочке носа [13, 14].
У большинства наблюдавшихся нами пациентов группы отмечались все описанные первоначальные клинические проявления РОЦМ и у всех больных имелись специфические для грибкового поражения изменения по данным эндоскопической полисинусотомии.
Микотический процесс со слизистой оболочки носовой полости распространялся на слизистую оболочку придаточных пазух. Чаще первой поражалась верхнечелюстная пазуха с последующим вовлечением решетчатой и клиновидной пазух с развитием пансинусита [15].
По данным литературы, дальнейший путь распространения инфекции в центральную нервную систему может быть различным.
Проникновение микотических масс, во-первых, может происходить через латеральную стенку решетчатого лабиринта (которая одновременно служит медиальной стенкой глазницы) в орбиту, а из нее, через верхнюю глазничную щель, – в полость черепа и затем в кавернозный синус [16]. Такой путь распространения инфекции отмечался у 3 наблюдавшихся нами больных.
Во-вторых, гифы гриба способны инвазировать нижнюю стенку орбиты через верхнюю челюстную пазуху, а затем вновь через верхнюю глазничную щель проникать в кавернозный синус и среднюю черепную ямку. Данный вариант отмечался у 2 наших пациентов [17].
В-третьих, попадание грибковой инфекции в центральную нервную систему может осуществляться путем расплавления клиновидной пазухи с переходом на скат и проникновением в среднюю черепную ямку и развитием базального менингита. Данный путь проникновения диагностирован у 2 пациентов [11].
В-четвертых, возможна грибковая инвазия глубоких пространств лица с периневральным распространением спор по верхнечелюстному и нижнечелюстному нерву в пространство Меккеля, далее в среднюю черепную ямку с развитием базального менингита. Данный вариант считается наиболее редким [11], он отмечался у 1 из наблюдавшихся нами пациентов.
Наряду с указанными описан пятый путь проникновения микотических масс во внутричерепное пространство путем инвазии стенки лобной пазухи, с переходом через переднее продырявленное вещество непосредственно в переднюю черепную ямку на лобные доли головного мозга. Данный путь не встречался ни у одного из пациентов [18].
Поражения нервной системы при РОЦМ разнообразны, могут быть представлены невропатией черепных нервов, внутричерепными сосудистыми и воспалительными осложнениями.
Нейропатия зрительного и глазодвигательных нервов обусловлена некротическим струпом на вершине глазницы и отеком экстраокулярных мышц и орбитальной жировой клетчатки [5]. Клинические признаки включают офтальмоплегию, экзофтальм. При вовлечении зрительного нерва развивается частичная или полная потеря зрения, которая диагностирована у 6 наблюдавшихся нами пациентов. Помимо компрессионного, инфильтративного генеза нейропатии зрительного нерва, приводящей чаще к амблиопии, возможен ишемический амавроз вследствие задней ишемической нейропатии или окклюзии центральной артерии сетчатки [11]. Вторая и 3-я ветви тройничного нерва, а также лицевой нерв поражаются при инвазии грибковыми массами жевательного пространства, подвисочной и крыловидно-небной ямок. Это достаточно частое неврологическое осложнение, в нашей выборке отмечено у всех больных [5].
Среди сосудистых осложнений диагностированы артериальные и венозные тромбозы, главным образом в бассейне внутренней сонной артерии, и тромбоз кавернозного синуса [5]. Тромбозы высокоспецифичны для течения РОЦМ вследствие склонности возбудителя инвазировать сосудистую стенку и образовывать грибковые тромбы в просвете сосуда.
Поражение решетчатого лабиринта сопровождается высоким риском тромбоза кавернозного синуса, так как бесклапанные эмиссарные вены, дренирующие его, пересекают бумажную пластинку решетчатой кости, что способствует распространению грибковой инфекции в периорбитальную ткань, верхушку глазницы и сам синус. Кавернозный синус часто является первой внутричерепной структурой, которая поражается при РОЦМ. Тромбоз кавернозного синуса проявляется классическими симптомами невропатии зрительного, глазодвигательных, а также 1 и 2-й ветвей тройничного нерва, хемозом, экзофтальмом. Тромбоз кавернозного синуса был диагностирован у 2 пациентов из нашей группы. Реже встречается тромбоз сагиттального синуса с последующим формированием эпидурального и субдурального абсцессов. Он характеризуется появлением гемипареза, изменением сознания и фокальными судорогами [19].
По данным S. Dubey и соавт. (2021 г.), артериальные тромбозы с развитием ишемического инсульта при РОЦМ не являются редкостью. Настороженность в отношении ишемических инсультов должна быть высокой, так как протекают они с неярко выраженной симптоматикой, проявляющейся, например, в виде лакунарных синдромов с двигательными и речевыми нарушениями. Также описаны случаи асимптомного течения, когда диагноз инсульта устанавливался лишь на основании данных нейровизуализации [19]. Артериальные сосудистые тромбозы диагностированы у 4 пациентов нашей группы, из них у 3 отмечался малый неврологический дефицит, 1 пациентка умерла от обширного полушарного инсульта.
Воспалительные осложнения при РОЦМ могут проявляться в виде лептоменингита и энцефалита [5]. В исследовании S. Dubey и соавт. (2021 г.) отмечается частое (у 1/2 больных) возникновение ограниченного поражения оболочек головного мозга («локального» менингита). Для такого менингита характерно отсутствие яркого менингеального синдрома и ригидности шеи, что объясняется ограниченностью области поражения. Менингит может сочетаться с поражением близлежащего вещества височных и лобных долей головного мозга. Преимущественное поражение лобной или височной долей объясняется распространением грибковых масс из лобной пазухи или кавернозного синуса соответственно [20]. Энцефалит может осложняться образованием гранулемы или абсцесса. Грибковые абсцессы часто формируются в базальных ганглиях и в подкорковом слое. Как правило, они множественные, имеют неровные края и внутриполостные выступы. Описанные осложнения, однако, в нашей серии наблюдений не встречались [5].
КТ является первоочередным исследованием, которое проводится при подозрении на РОЦМ, ввиду первичных проявлений инфекции со стороны полости носа и придаточных пазух. Результаты ее неспецифичны, в виде недифференцированных воспалительных изменений в придаточных пазухах носа. Начальные изменения на КТ включают утолщение слизистой оболочки, костные эрозии и помутнение пазух из-за массивного их разрушения [5]. Для РОЦМ характерно наличие участков повышенной плотности в придаточных пазухах, что свидетельствует о присутствии грибковых гифов и очагов костной деструкции. Данные изменения наблюдались у всех пациентов на начальных этапах развития инфекции [21]. При распространении процесса за пределы пазух по данным КТ выявляется усиление сигнала от жировой клетчатки орбиты и поверхностной жировой клетчатки лица [22].
Поражение орбитальных и внутричерепных структур лучше визуализируются при использовании на МРТ. Начальные МР-симптомы включают утолщение слизистой оболочки носа и пазух, гипоинтенсивные на
Т1-взвешенном изображении (Т1-ВИ) и гиперинтенсивные на Т2-взвешенном изображении (Т2-ВИ). Инвазия паренхимы головного мозга визуализируется в виде гранулем, что при грибковых процессах характеризуется слабым усилением сигнала и окружающим отеком [5].
Грибковые абсцессы единичные или множественные образуются субкортикально и в базальных ганглиях, имеют неровные фестончатые края, сигнал от них гипоинтенсивен на T1-ВИ и гиперинтенсивен на T2-ВИ [23].
При тромбозе кавернозного синуса выявляются гипоинтенсивые на T1-ВИ и T2-ВИ тромботические массы, при контрастировании – неоднородное интенсивное повышение МР-сигнала в области синуса [24].
Специфического серологического лабораторного маркера мукормикоза до сих пор не описано. Достоверный диагноз основывается на микробиологическом анализе ткани, полученной при биопсии или хирургической обработке и взятой на посев на декстрозный агар Сабуро, содержащий циклогексимид и хлорамфеникол. Рост микроорганизмов отмечается в течение 3–5 дней при температуре 25–30 °С. Для некоторых видов (Cunnighamella и Rhizopus) требуются микроаэрофильные условия, подобные тем, которые имеются в поврежденных тканях [25].
Вероятный диагноз может быть поставлен путем прямого микроскопического исследования ткани придаточных пазух и легких на основании обнаружения специфических гифов гриба. Прямую визуализацию можно осуществить с помощью добавления к микропрепарату гидроксида калия с использованием яркого микроскопа или флуоресцентного микроскопа после окрашивания флуоресцентными красителями Бланкофор и Калькофлюор Уайт. Морфологически гифы Mucorales лишены перегородок, имеют характерное лентовидное строение с разветвлением от 45 до 90°. Гифы Mucorales слабо окрашиваются метенаминовым серебром Гомори и методами периодной кислоты Шиффа из-за их тонкой стенки [26].
Всем пациентам в нашей группе выполнялось микроскопическое исследование биопсийного операционного материала и диагноз устанавливался после обнаружения характерных гифов гриба.
Лечение РОЦМ необходимо начинать незамедлительно, как только возникло подозрение на данное заболевание. Вначале терапия имеет эмпирический характер. Наиболее эффективным является трехкомпонентный подход, заключающийся в исключении (по возможности) всех иммуносупрессивных влияний на организм, назначении специфических противогрибковых препаратов и радикальной хирургической обработке всех пораженных структур.
Основным противогрибковым средством является амфотерицин В, который нами был изначально назначен 4 пациентам [6]. Препарат обладает выраженной нефротоксичностью и с осторожностью должен применяться при сахарном диабете. Ввиду указанных причин, а также выявленной его непереносимости препарат в итоге был отменен у 2 из 4 указанных пациентов.
Амфотерицин В является лучшим из доступных лекарственных средств, влияющим на грибы порядка Mucorales [27]. Липосомальный амфотерицин В является менее токсичным по сравнению с дезоксихолятом амфотерицина В, что позволяет использовать его в высоких дозировках в течение длительного периода времени [28]. Оптимальная суточная доза при лечении РОЦМ составляет 10 мг/кг в течение нескольких недель, что обеспечивает быстрое снижение грибковой нагрузки и более эффективную элиминацию спор гриба [29]. После клинического улучшения переходят на пероральную поддерживающую терапию позаконазолом и изавуконазолом.
Изавуконазол и позаконазол могут служить альтернативой амфотерицину [23], однако в качестве первоначальной терапии они назначаются только при непереносимости амфотерицина В, который является более эффективным фунгицидом. Комбинированное лечение амфотерицином В и позаконазолом не продемонстрировало превосходства перед монотерапией [28]. Позаконазол используется в качестве пероральной поддерживающей терапии в дозе 300 мг 2 раза в первые сутки с дальнейшим переходом на дозу 300 мг 1 раз в день в течение 2 нед. Суточная доза изавуконазола составляет 372 мг; препарат назначается через каждые 8 ч в течение 2 сут, затем по 372 мг 1 раз в день в течение 2 нед [24].
Хирургическая санация считается основой лечения мукормикоза, заключается в обширной резекции инфицированных и некротизированных тканей. При раннем локализованном инвазивном грибковом синусите рекомендуется проведение эндоскопической полисинусотомии, которая была проведена всем нашим пациентам. Открытая расширенная санация с экзентрацией орбиты, черепно-лицевой резекцией проводится пациентам с поражением орбиты, костей лицевого скелета, внутричерепной инвазией. Как правило, такие сложные оперативные вмешательства осуществляются в несколько этапов и проводятся командой специалистов с участием оториноларингологов, нейрохирургов, челюстно-лицевых хирургов, окулистов. Расширенная санация проведена большинству описанных нами пациентов [26].
Мукормикоз характеризуется глубокой инвалидизацией больных и высоким риском летального исхода [2]. Из числа наблюдавшихся нами 8 пациентов выжили 5 человек, во многом за счет своевременной диагностики заболевания и осуществления лечения с участием большой команды специалистов самого разного профиля, включая неврологов.
Заключение
Мукормикоз является тяжелым осложнением иммунодефицитных состояний, таких как инфекция COVID-19, сахарный диабет, глюкокортикостероидная терапия, гепатит С. Наиболее яркие вспышки инфекции ассоциированы с периодом инфекции COVID-19. Особенностью данной инфекции является высокая ангиоинвазивность, приводящая к развитию артериальных и венозных тромбозов, что сопровождается частыми цереброваскулярными осложнениями. Сосудистая патология головного мозга во многих случаях сочетается с ограниченными воспалительными изменениями оболочек и вещества головного мозга, что усугубляет тяжесть состояния больных. Успех терапии и благоприятный исход напрямую зависят от ранней диагностики, радикальности хирургического вмешательства, а также правильного подбора противогрибковой терапии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Руина Екатерина Андреевна – канд. мед. наук, доц. каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ, врач-невролог. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Ekaterina A. Ruina – Cand. Sci. (Med.), Privolzhsky Research Medical University. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Королев Игорь Андреевич – врач-оториноларинголог высшей категории, зав. лор-отд-нием, ГБУЗ НО «НОКБ им. Н.А. Семашко»
Igor A. Korolev – otorhinolaryngologist, Semashko Regional Clinical Hospital
Григорьева Вера Наумова – д-р мед. наук, проф., зав. каф. нервных болезней, ФГБОУ ВО ПИМУ, врач-невролог
Vera N. Grigoreva – Dr. Sci. (Med.), Prof., Privolzhsky Research Medical University
Антипенко Елена Альбертовна – д-р мед. наук, доц., зав. каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ, врач-невролог
Elena A. Antipenko – Dr. Sci. (Med.), Assoc. Prof., Privolzhsky Research Medical University
Мисник Алина Сергеевна – ординатор-невролог 2-го года каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ
Alina S. Misnik – Resident neurologist, Privolzhsky Research Medical University
Головина Ксения Андреевна – ординатор-невролог 2-го года каф. неврологии, психиатрии и наркологии, ФДПО ФГБОУ ВО ПИМУ
Ksenija A. Golovina – Resident neurologist, Privolzhsky Research Medical University
Поступила в редакцию: 21.10.2024
Поступила после рецензирования: 05.11.2024
Принята к публикации: 14.11.2024
Received: 21.10.2024
Revised: 05.11.2024
Accepted: 14.11.2024
Список исп. литературыСкрыть список1. Cornely OA, Alastruey-Izquierdo A, Arenz D et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium. Lancet Infect Dis 2019;19(12):e405-e421. DOI: 10.1016/S1473-3099(19)30312-3
2. Pai V, Sansi R, Kharche R et al. Rhino-orbito-cerebral Mucormycosis: Pictorial Review. Insights Imaging 2021;12(1):167. DOI: 10.1186/s13244-021-01109-z
3. Al-Ani RM. Rhino-orbital-cerebral mucormycosis as a complication of coronavirus disease 2019. World J Virol 2022;11(5):293-9. DOI: 10.5501/wjv.v11.i5.293
4. Patel A, Agarwal R, Rudramurthy SM, et al. Multicenter Epidemiologic Study of Coronavirus Disease-Associated Mucormycosis, India. Emerg Infect Dis 2021;27(9):2349-59. DOI: 10.3201/eid2709.210934
5. Saneesh PS, Morampudi SC, Yelamanchi R. Radiological review of rhinocerebral mucormycosis cases during the COVID-19 Pandemic: A single-center experience. World J Radiol 2022;14(7):209-18. DOI: 10.4329/wjr.v14.i7.209
6. AK AK, Gupta V. Rhino-Orbital Cerebral Mucormycosis. 2023 Apr 24. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan. PMID: 32491361.
7. Иванюта С.О., Христофорандо Д.Ю., Спевак Е.М., Цымбал А.Н. Постковидный некроз черепно-челюстно-лицевой области. Казанский медицинский журнал. 2023;104(4):552-63. DOI: 10.17816/KMJ119997
Ivanyuta S.O., Christoforando D.Yu., Spivak E.M., Tsymbal A.N. Waxy necrosis of the craniofacial region. Kazan Medical Journal. 2023;104(4):552-63. DOI: 10.17816/KMJ119997 (in Russian).
8. Макаров А.А., Оразвалиев А.И., Ушаков Р.В., Жабко Е.В. Рино-орбито-церебральный мукормикоз, ассоциированный с COVID-19 и диабетом. Российская ринология. 2022;30(3):210-6. DOI: 10.17116/rosrino202230031210
Makarov A.A., Orazaliev A.I., Ushakov R.V., Zhabko E.V. Rhino-orbit-cerebral mucormycosis associated with COVID-19 and diabetes. Russian rhinology. 2022;30(3):210-6. DOI: 10.17116/rosrino202230031210 (in Russian).
9. Steinbrink JM, Miceli MH. Mucormycosis. Infect Dis Clin North Am 2021;35(2):435-52. DOI: 10.1016/j.idc.2021.03.009
10. Prakash H, Chakrabarti A. Global Epidemiology of Mucormycosis. J Fungi (Basel) 2019;5(1):26. DOI: 10.3390/jof5010026
11. Singh G, Vishnu VY. Neurological manifestations of rhino-oculo-cerebral mucormycosis in the COVID-19 era. Nat Rev Neurol 2021; 17(11):657-8. DOI: 10.1038/s41582-021-00560-2
12. Hoenigl M, Seidel D, Carvalho A et al. The emergence of COVID-19 associated mucormycosis: a review of cases from 18 countries. Lancet Microbe 2022;3(7):e543-e552. DOI: 10.1016/S2666-5247(21)00237-8
13. Saravanam PK, Thattarakkal VR, Arun A. Rhino-Orbito-Cerebral Mucormycosis: An Audit. Indian J Otolaryngol Head Neck Surg 2022;74(Suppl. 2):2686-92. DOI: 10.1007/s12070-020-02033-2
14. Ohadi MAD, Banihashemi G, Dilmaghani NA et al. COVID-19-related rhino-orbital-cerebral mucormycosis: Neurological manifestation and related risk factors in two cases. Clin Case Rep 2022;10(10):e6352. DOI: 10.1002/ccr3.6352
15. Abdollahi A, Shokohi T, Amirrajab N et al. Clinical features, diagnosis, and outcomes of rhino-orbito-cerebral mucormycosis – A retrospective analysis. Curr Med Mycol 2016;2(4):15-23. DOI: 10.18869/acadpub. cmm.2.4.15
16. Kulkarni NS, Bhide AR, Wadia RS. Rhinocerebral mucormycosis: An analysis of probable mode of spread and its implication in an early diagnosis and treatment. Indian J Otolaryngol Head Neck Surg 2005;57(2):121-4. DOI: 10.1007/BF02907665
17. Hosseini SM, Borghei P. Rhinocerebral mucormycosis: pathways of spread. Eur Arch Otorhinolaryngol 2005;262(11):932-8. DOI: 10.1007/s00405-005-0919-0
18. Sravani T, Uppin SG, Uppin MS, Sundaram C. Rhinocerebral mucormycosis: Pathology revisited with emphasis on perineural spread. Neurol India 2014;62(4):383-6. DOI: 10.4103/0028-3886.141252
19. Dubey S, Mukherjee D, Sarkar P et al. COVID-19 associated rhino-orbital-cerebral mucormycosis: An observational study from Eastern India, with special emphasis on neurological spectrum. Diabetes Metab Syndr 2021;15(5):102267. DOI: 10.1016/j.dsx.2021.10
2267
20. Azhar A, Khan WH, Khan PA et al. Mucormycosis and COVID-19 pandemic: Clinical and diagnostic approach. J Infect Public Health 2022;15(4):466-79. DOI: 10.1016/j.jiph.2022.02.007
21. Patel DD, Adke S, Badhe PV et al. COVID-19 associated Rhino-Orbito-Cerebral Mucormycosis: Imaging spectrum and Clinico-radiological correlation- a single Centre experience. Clin Imaging 2022;82:172-8. DOI: 10.1016/j.clinimag.2021.10.014
22. Luthra G, Parihar A, Nath K et al. Comparative evaluation of fungal, tubercular, and pyogenic brain abscesses with conventional and diffusion MR imaging and proton MR spectroscopy. AJNR Am J Neuroradiol 2007;28(7):1332-8. DOI: 10.3174/ajnr.A0548
23. Razek AA, Castillo M. Imaging lesions of the cavernous sinus [published correction appears in AJNR. Am J Neuroradiol. 2009 Aug;30(7):E115]. AJNR Am J Neuroradiol 2009;30(3):444-52. DOI: 10.3174/ajnr.A1398
24. Arikan S, Sancak B, Alp S et al. Comparative in vitro activities of posaconazole, voriconazole, itraconazole, and amphotericin B against Aspergillus and Rhizopus, and synergy testing for Rhizopus. Med Mycol 2008;46(6):567-73. DOI: 10.1080/13693780801975576
25. Lackner M, Caramalho R, Lass-Flörl C. Laboratory diagnosis of mucormycosis: current status and future perspectives. Future Microbiol 2014;9(5):683-95. DOI: 10.2217/fmb.14.23
26. Chikley A, Ben-Ami R, Kontoyiannis DP. Mucormycosis of the Central Nervous System. J Fungi (Basel) 2019;5(3):59. DOI: 10.3390/ jof5030059
27. Pagano L, Offidani M, Fianchi L et al; GIMEMA (Gruppo Italiano Malattie EMatologiche dell'Adulto) Infection Program. Mucormycosis in hematologic patients. Haematologica 2004;89(2):207-14. PMID: 15003897.
28. Ibrahim AS, Gebremariam T, Schwartz JA et al. Posaconazole mono- or combination therapy for treatment of murine zygomycosis. Antimicrob Agents Chemother 2009;53(2):772-5. DOI: 10.1128/AAC.01124-08
29. Singh N, Aguado JM, Bonatti H et al. Zygomycosis in solid organ transplant recipients: a prospective, matched case-control study to assess risks for disease and outcome. J Infect Dis 2009;200(6):1002-11. DOI: 10.1086/605445
24 февраля 2025
Количество просмотров: 9532

