Клинический разбор в общей медицине №2 2025
Evgenii D. Dolgov1
1 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
2 Avtsyn Research Institute of Human Morphology of Petrovsky National Research Centre of Surgery, Moscow, Russia;
3 Clinical Hospital "Lapino-1" of the group of companies "Mother and Child", Lapino, Moscow Region, Moscow, Russia
omekan@mail.ru
Abstract
Early reproductive losses represent one of the most relevant but unresolved issues of today’s reproductive medicine. To date, it has been proven that embryonic and endometrial factors play equal roles in realization of reproductive failures. Endometrial dysfunction, fibrosis, impaired endometrial receptivity/selectivity are the main causes of the endometrium-associated reproductive losses, which are most common in patients with the morphologically verified chronic endometritis (CE). To date, the world lacks the criteria for CE grading based on its severity. The paper reports new approaches to CE stratification based on severity, as well as options for pathogenetically justified therapy, based on domestic and international data.
Keywords: reproductive losses, implantation failures, endometrial factor, chronic endometritis, physical therapy, antifibrotic therapy, bovhyaluronidase azoximer.
For citation: Orazov M.R., Radzinskii V.E., Mikhaleva L.M., Silantieva E.S., Dolgov E.D. "Renaissance of reproductive losses", or New possibilities for overcoming implantation failures associated with chronic endometritis. Clinical review for general practice. 2025; 6 (2): 66–72 (In Russ.). DOI: 10.47407/kr2025.6.2.00571
Глобально репродуктивные потери (РП) можно стратифицировать на две основные группы: возникшие в ходе спонтанно наступившей гестации или же в ходе использования различных вариантов вспомогательных репродуктивных технологий (ВРТ). Однако суть данных вариантов РРП едина и заключается в дефектной имплантации, которая может быть обусловлена как особенностями эмбриона (хромосомные аномалии, генные нарушения и др.), так и эндометриальными нарушениями, значение которых сегодня существенно превалирует. Согласно имеющимся эпидемиологическим данным, ежегодно в мире отмечается более 23 млн РРП, а каждую минуту прерывается 44 беременности, при этом совокупный риск РП достигает 15,3%. Более того, неудачи имплантации наносят значимый экономический ущерб мировой системе здравоохранения: только в Великобритании ежегодно тратится 471 млн фунтов стерлингов, а общемировые затраты остаются колоссальными и не могут быть подвергнуты объективной оценке [2]. Вместе с тем важно отметить ключевые факторы риска РРП, обусловливающие столь высокие показатели их распространенности в мире [2, 3]:
• возраст (матери) женщины более 35 лет;
• возраст мужа более 40 лет;
• ожирение;
• дефицит массы тела;
• хронический стресс;
• вредные привычки;
• неблагоприятные условия труда.
При этом важно отметить, что в последнее время отмечается особая роль адекватного морфофункционального состояния эндометрия в поддержании процесса имплантации. Так, по результатам крупного исследования, проанализировавшего исходы более 15 тыс. беременностей, наступивших в ходе использования ВРТ, было выявлено, что снижение толщины эндометрия на каждый 1 мм ассоциировано с повышением риска имплантационных неудач на 22% [3]. Нарушение гистоархитектоники эндометрия (уменьшение толщины, фиброз, воспалительные изменения) приводит к нарушению эмбрио-децидуальных взаимодействий за счет ослабления биосенсоринга эмбриона и нарушения экспрессии важнейших генов имплантации [4]. Одной из главных причин РП на фоне эндометриальной дисфункции, способствующих развитию представленных изменений гистоархитектоники эндометрия, безусловно, является хронический эндометрит (ХЭ).
ХЭ представляет собой недооцененную проблему современной гинекологии ввиду значительного всплеска частоты внутриматочных вмешательств (особенно раздельных диагностических выскабливаний слизистой оболочки полости матки). Негативным отражением этого служит «бесплодие неясного генеза» или «рецидивирующие неудачи имплантации», поскольку в ходе комплексного обследования определить основную причину недостижения цели не удалось. Однако часто клиницисты могут недооценивать значение латентного или малосимптомного воспаления эндометрия в реализации РП и упустить его из виду. Согласно результатам исследования A. Morimune и соавт. (2021 г.) было доказано, что наличие морфологически верифицированного ХЭ статистически значимо повышает риск самопроизвольного аборта (p<0,03) и снижает вероятность живорождения (p<0,03) и доношенной беременности (p<0,001) [5]. Исходя из этого не остается никаких сомнений в актуальности проблемы ХЭ и его роли в реализации РП. В этой связи необходимо рассмотреть современные стратегии ведения пациенток с ХЭ и отметить современные и персонифицированные стратегии их клинического менеджмента в зависимости от степени тяжести патологического процесса.
Вместе с тем наибольшей проблемой является клиническая латентность ХЭ. В настоящее время доказано, что ХЭ проявляется рядом типичных и нетипичных симптомов. К первым относятся хроническая тазовая боль, аномальные маточные кровотечения, диспареуния, патологические выделения из влагалища, при этом атипичная симптоматика представлена развитием рецидивирующего цистита, вагинита и дискомфорта в желудочно-кишечном тракте [9]. Таким образом, клиническая палитра ХЭ мало о чем говорит, и особую актуальность приобретает наличие РП и/или внутриматочных вмешательств в анамнезе.
Ключевые морфологические изменения эндометрия на фоне ХЭ, ассоциированные с неудачами имплантации [10–14]:
• Снижение колонизации полости матки полезными лактобактериями. Доказано, что абсолютное преобладание лактобацилл (>90%) напрямую коррелирует с успешной имплантацией, а активация условно-патогенной флоры, в свою очередь, ассоциирована с РП и снижением показателя живорождения.
• Повышение экспрессии провоспалительных цитокинов – интерлейкина (ИЛ)-1β, ИЛ-6 и фактора некроза опухоли α.
• Снижение экспрессии ИЛ-11, участвующего в регуляции имплантации и адекватной инвазии трофобласта.
• Развитие дисбаланса Т-хелперов 1 и 2-го типа.
• Активация рекрутинга цитотоксических Т- (CD-8) и B-лимфоцитов (CD-20).
• Накопление в строме плазматических клеток
CD-138), отражающих хронический воспалительный процесс.
Вместе с тем, согласно результатам недавнего метаанализа M. Mazloomi и соавт. (2025 г.), была доказана значимая роль нарушения экспрессии ИЛ-33 в реализации повторных РП. Установлено, что снижение концентрации и наличие полиморфизма GG в гене ИЛ-33 были ассоциированы со значимым увеличением риска повторных РП (относительный риск -0,45; 95% доверительный интервал -0,67–-0,23) [15].
Таким образом, патогенетические особенности реализации ХЭ носят мультифакториальных характер и включают как дисбиоз полости матки, так и аномальную экспрессию ряда провоспалительных цитокинов, препятствующих адекватной имплантации. В этой связи важно отметить, что ХЭ является сугубо морфологическим диагнозом и должен верифицироваться в ходе гистологической оценки. Вместе с тем наиболее чувствительным маркером ХЭ являются именно плазматические клетки (CD-138), обнаружение которых в настоящее время представляет собой «золотой стандарт» диагностики. Необходимо отметить, что долгое время необходимое количество CD-138 для постановки диагноза не было определено. Ранее полагалось, что обнаружение лишь 1 клетки в 10 полях зрения было достаточным для морфологической верификации ХЭ, однако данный критерий нередко мог приводить к гипердиагностике заболевания [16]. Недавно было доказано, что наибольшей диагностической ценностью обладает обнаружение 5 и более плазмоцитов в 10 полях зрения, поскольку именно такая интенсивность воспалительной инфильтрации эндометрия ассоциирована с развитием РП (p=0,007) [17].
Особую актуальность имеют гистероскопические критерии ХЭ, определение которых также необходимо перед взятием биоптата эндометрия. Так, согласно собственным данным и международным рекомендациям, к гистероскопическим критериям ХЭ относятся [18, 35]:
• микрополипы эндометрия (до 1–2 мм);
• локальная или диффузная гиперемия эндометрия;
• стромальный отек с утолщением и побледнением ткани в фолликулярной фазе.
Небезынтересен тот факт, что микрополипоз эндометрия является наиболее патогномоничным симптомом ХЭ с высокой диагностической ценностью, которая достигает 93,4% [9]. Следует резюмировать, что объединение патоморфологических и гистероскопических критериев играет важную роль в эффективной верификации диагноза и ассоциировано со значимым повышением диагностической ценности каждого. Однако в настоящее время отсутствуют конкретные критерии градации степеней тяжести ХЭ, необходимой для осуществления эффективного клинического менеджмента пациенток данной когорты. В этой связи мы представляем собственную классификацию/стратификацию ХЭ 2025 г., основанную на результатах гистероскопического и иммуногистохимического исследования, которая поможет клиницисту оценить степень тяжести заболевания на основе международных критериев его диагностики:
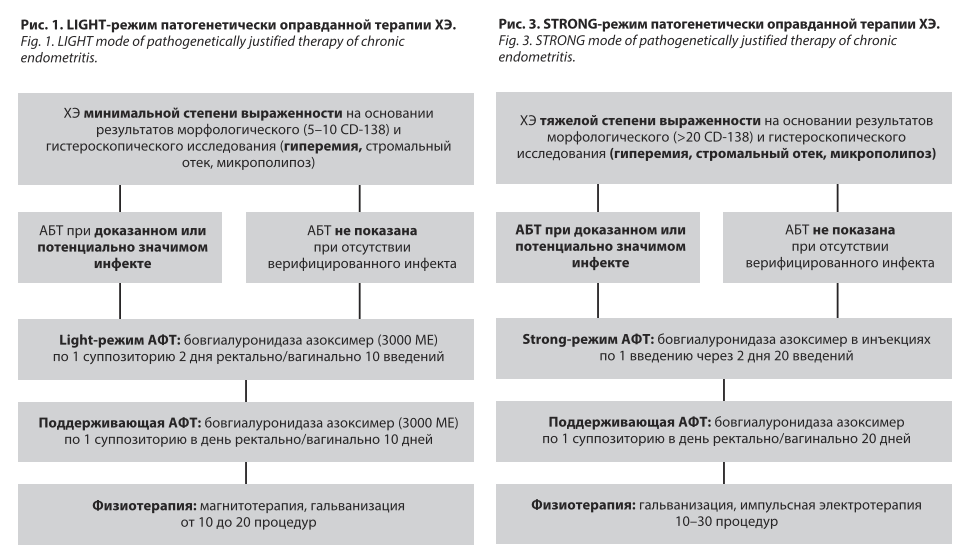
• ХЭ минимальной степени выраженности верифицируется при обнаружении 5–10 CD-138 в 10 полях зрения и/или 1 из 3 гистероскопических критериев ХЭ.
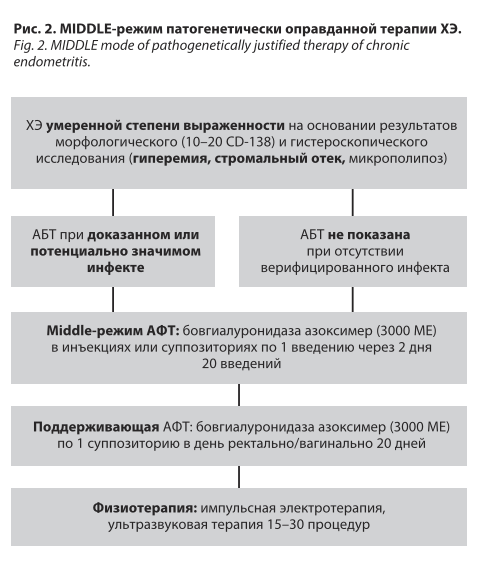
• ХЭ умеренной степени выраженности верифицируется при обнаружении 10–20 CD-138 в 10 полях зрения и/или 2 из 3 гистероскопических критериев ХЭ.
• ХЭ тяжелой степени выраженности верифицируется при обнаружении более 20 CD-138 в 10 полях зрения и/или 3 из 3 гистероскопических критериев ХЭ.
• антибактериальная терапия (АБТ) – только при обнаружении доказанного или потенциально значимого инфекта [19–23];
• пробиотическая терапия [24, 25];
• физиотерапевтическое лечение;
• антифиброзная терапия (АФТ).
При этом важно отметить, что физиотерапевтическое лечение и АФТ являются наиболее значимыми стратегиями патогенетически оправданной адъювантной терапии ХЭ. Данные варианты терапии приобретают особую актуальность после редукции этиотропного фактора (при его наличии) или же могут использоваться изолированно, минуя этап АБТ (при отсутствии инфекта). Основываясь на результатах ряда клинических исследований, важно отметить, что в настоящее время в арсенале клинициста имеется полноценный спектр физиотерапевтических методов лечения ХЭ (электроимпульсная терапия и лекарственный электрофорез, ультразвуковая и магнитотерапия), основными эффектами которых являются [26, 27]:
• индукция саногенетических механизмов;
• редукция воспалительных изменений эндометрия;
• модуляция локального иммунного ответа;
• стимуляция неоангиогенеза;
• активация регенераторного потенциала эндометрия;
• улучшение перфузии эндометрия.
Вместе с тем АФТ с использованием бовгиалуронидазы азоксимера (Лонгидаза) оказывает синергичный эффект за счет редуцирования последствий латентного воспаления в виде фиброза эндометрия и аномального цитокинового профиля. Так, согласно результатам ряда отечественных и международных исследований, использование АФТ реализует целый ряд патогенетически оправданных эффектов, включая [28–31]:
• снижение выраженности плазмоцитарной инфильтрации;
• снижение выраженности фиброза;
• нормализацию перфузионных показателей эндометрия и его пролиферативного потенциала;
• повышение биодоступности и эффективности АБТ (при ее необходимости).
 Суммационным результатом всех отмеченных эффектов АФТ является повышение частоты наступления клинической беременности, а также успешной имплантации и живорождения как в естественном цикле, так и в ходе использования ВРТ.
Суммационным результатом всех отмеченных эффектов АФТ является повышение частоты наступления клинической беременности, а также успешной имплантации и живорождения как в естественном цикле, так и в ходе использования ВРТ.
Важно отметить, что в настоящее время отсутствуют регламентированные персонифицированные стратегии патогенетически оправданной терапии ХЭ. Ниже представлены основанные на результатах собственного опыта авторские практичные схемы патогенетически оправданной терапии исходя из степени тяжести ХЭ
в 3 режимах: light, middle и strong (М.Р. Оразов,
В.Е. Радзинский, Л.М. Михалева, Е.С. Силантьева,
Е.Д. Долгов, 2025); рис. 1–3.
Вместе с тем особым и, пожалуй, наиболее контраверсионным вопросом остается лечение ХЭ, которое должно быть комплексным и патогенетически оправданным. В настоящее время стало очевидно, что АБТ не является панацеей и должна использоваться только при обнаружении доказанного/потенциально значимого инфекта. В этой связи особую актуальность приобрели адъювантные стратегии патогенетической терапии ХЭ, включая антифиброзное и физиотерапевтическое лечение, позволяющее улучшить исходы беременности и достичь долгожданного материнства.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – D. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – чл.-кор. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН, засл. деят. науки РФ. E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinskii – Corr. Memb. RAS, Dr. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Михалева Людмила Михайловна – чл.-кор. РАН, д-р мед. наук, проф., дир. НИИМЧ им. акад. А.П. Авцына ФГБНУ «РНЦХ им. акад. Б.В. Петровского», засл. деят. науки РФ. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Corr. Memb. RAS, Dr. Sci. (Med.), Professor, Director of Avtsyn Research Institute of Human Morphology of Petrovsky National Research Centre of Surgery. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X
Силантьева Елена Сергеевна – д-р мед. наук, зам. глав. врача Клинического госпиталя «Лапино-1» группы компаний «Мать и дитя». E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Elena S. Silantieva – Dr. Sci. (Med.), Clinical Hospital "Lapino-1", Lapino, Moscow Region. E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgenii D. Dolgov – Medical Resident, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 23.01.2025
Поступила после рецензирования: 05.02.2025
Принята к публикации: 06.02.2025
Received: 23.01.2025
Revised: 05.02.2025
Accepted: 06.02.2025
Клинический разбор в общей медицине №2 2025
«Ренессанс репродуктивных потерь», или Новые возможности преодоления неудач имплантации, ассоциированных с хроническим эндометритом
Номера страниц в выпуске:66-72
Аннотация
Одним из наиболее актуальных и вместе с тем до конца не решенных вопросов современной репродуктивной медицины являются ранние репродуктивные потери. В настоящее время доказано, что равнозначные роли в реализации репродуктивных неудач играет как эмбриональный, так и эндометриальный фактор. Дисфункция эндометрия, фиброз и нарушение его рецептивности/селективности являются основными причинами эндометрий-ассоциированных репродуктивных потерь, которые наиболее часто встречаются у пациенток с морфологически верифицированным хроническим эндометритом (ХЭ). К настоящему моменту в мире отсутствуют критерии градации ХЭ в зависимости от его степени выраженности. В статье освещены новые подходы к стратификации ХЭ в зависимости от степени выраженности, а также возможности патогенетически оправданной терапии на основе отечественных и международных данных.
Ключевые слова: репродуктивные потери, неудачи имплантации, эндометриальный фактор, хронический эндометрит, физиотерапия, антифиброзная терапия, бовгиалуронидаза азоксимер.
Для цитирования: Оразов М.Р., Радзинский В.Е., Михалева Л.М., Силантьева Е.С., Долгов Е.Д. «Ренессанс репродуктивных потерь», или Новые возможности преодоления неудач имплантации, ассоциированных с хроническим эндометритом. Клинический разбор в общей медицине. 2025; 6 (2): 66–72. DOI: 10.47407/kr2025.6.2.00571
Одним из наиболее актуальных и вместе с тем до конца не решенных вопросов современной репродуктивной медицины являются ранние репродуктивные потери. В настоящее время доказано, что равнозначные роли в реализации репродуктивных неудач играет как эмбриональный, так и эндометриальный фактор. Дисфункция эндометрия, фиброз и нарушение его рецептивности/селективности являются основными причинами эндометрий-ассоциированных репродуктивных потерь, которые наиболее часто встречаются у пациенток с морфологически верифицированным хроническим эндометритом (ХЭ). К настоящему моменту в мире отсутствуют критерии градации ХЭ в зависимости от его степени выраженности. В статье освещены новые подходы к стратификации ХЭ в зависимости от степени выраженности, а также возможности патогенетически оправданной терапии на основе отечественных и международных данных.
Ключевые слова: репродуктивные потери, неудачи имплантации, эндометриальный фактор, хронический эндометрит, физиотерапия, антифиброзная терапия, бовгиалуронидаза азоксимер.
Для цитирования: Оразов М.Р., Радзинский В.Е., Михалева Л.М., Силантьева Е.С., Долгов Е.Д. «Ренессанс репродуктивных потерь», или Новые возможности преодоления неудач имплантации, ассоциированных с хроническим эндометритом. Клинический разбор в общей медицине. 2025; 6 (2): 66–72. DOI: 10.47407/kr2025.6.2.00571
"Renaissance of reproductive losses", or New possibilities for overcoming implantation failures associated with chronic endometritis
Mekan R. Orazov1, Viktor E. Radzinskii1, Lyudmila M. Mikhaleva2, Elena S. Silantieva3,Evgenii D. Dolgov1
1 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia;
2 Avtsyn Research Institute of Human Morphology of Petrovsky National Research Centre of Surgery, Moscow, Russia;
3 Clinical Hospital "Lapino-1" of the group of companies "Mother and Child", Lapino, Moscow Region, Moscow, Russia
omekan@mail.ru
Abstract
Early reproductive losses represent one of the most relevant but unresolved issues of today’s reproductive medicine. To date, it has been proven that embryonic and endometrial factors play equal roles in realization of reproductive failures. Endometrial dysfunction, fibrosis, impaired endometrial receptivity/selectivity are the main causes of the endometrium-associated reproductive losses, which are most common in patients with the morphologically verified chronic endometritis (CE). To date, the world lacks the criteria for CE grading based on its severity. The paper reports new approaches to CE stratification based on severity, as well as options for pathogenetically justified therapy, based on domestic and international data.
Keywords: reproductive losses, implantation failures, endometrial factor, chronic endometritis, physical therapy, antifibrotic therapy, bovhyaluronidase azoximer.
For citation: Orazov M.R., Radzinskii V.E., Mikhaleva L.M., Silantieva E.S., Dolgov E.D. "Renaissance of reproductive losses", or New possibilities for overcoming implantation failures associated with chronic endometritis. Clinical review for general practice. 2025; 6 (2): 66–72 (In Russ.). DOI: 10.47407/kr2025.6.2.00571
Проблема репродуктивных потерь в XXI веке
«Материнское счастье…» Что же заложено в этом простом и одновременно одном из самых загадочных феноменов в жизни человека? Каждая женщина ответит на этот вопрос по-разному, однако все будет сводиться к единому объяснению: материнское счастье – это возможность сначала увидеть заветные «две полоски», затем успешно выносить ребенка и услышать первый крик своего небольшого, но такого долгожданного «чуда». С другой стороны, материнство – это не только рождение детей, это достижения и ошибки, обретения и потери, праздники и будни, огромные усилия. Безусловно, вектор развития репродуктивной медицины в XXI в. привел нас к пониманию того, что намного легче и эффективнее предотвращать развитие неблагоприятных исходов гестации, чем справляться с их последствиями. В частности, прямым отражением этого является существенное снижение материнской смертности в Российской Федерации за первую четверть XXI в. за счет активного внедрения в повседневную практику стратегии перинатального риска и трехуровневой системы здравоохранения [1]. Однако, несмотря на все инновационные внедрения и то, что мы научились эффективно предотвращать управляемые причины материнской смертности, нам не удалось решить не менее важную проблему современной репродуктивной медицины – проблему ранних репродуктивных потерь (РРП).Глобально репродуктивные потери (РП) можно стратифицировать на две основные группы: возникшие в ходе спонтанно наступившей гестации или же в ходе использования различных вариантов вспомогательных репродуктивных технологий (ВРТ). Однако суть данных вариантов РРП едина и заключается в дефектной имплантации, которая может быть обусловлена как особенностями эмбриона (хромосомные аномалии, генные нарушения и др.), так и эндометриальными нарушениями, значение которых сегодня существенно превалирует. Согласно имеющимся эпидемиологическим данным, ежегодно в мире отмечается более 23 млн РРП, а каждую минуту прерывается 44 беременности, при этом совокупный риск РП достигает 15,3%. Более того, неудачи имплантации наносят значимый экономический ущерб мировой системе здравоохранения: только в Великобритании ежегодно тратится 471 млн фунтов стерлингов, а общемировые затраты остаются колоссальными и не могут быть подвергнуты объективной оценке [2]. Вместе с тем важно отметить ключевые факторы риска РРП, обусловливающие столь высокие показатели их распространенности в мире [2, 3]:
• возраст (матери) женщины более 35 лет;
• возраст мужа более 40 лет;
• ожирение;
• дефицит массы тела;
• хронический стресс;
• вредные привычки;
• неблагоприятные условия труда.
При этом важно отметить, что в последнее время отмечается особая роль адекватного морфофункционального состояния эндометрия в поддержании процесса имплантации. Так, по результатам крупного исследования, проанализировавшего исходы более 15 тыс. беременностей, наступивших в ходе использования ВРТ, было выявлено, что снижение толщины эндометрия на каждый 1 мм ассоциировано с повышением риска имплантационных неудач на 22% [3]. Нарушение гистоархитектоники эндометрия (уменьшение толщины, фиброз, воспалительные изменения) приводит к нарушению эмбрио-децидуальных взаимодействий за счет ослабления биосенсоринга эмбриона и нарушения экспрессии важнейших генов имплантации [4]. Одной из главных причин РП на фоне эндометриальной дисфункции, способствующих развитию представленных изменений гистоархитектоники эндометрия, безусловно, является хронический эндометрит (ХЭ).
ХЭ представляет собой недооцененную проблему современной гинекологии ввиду значительного всплеска частоты внутриматочных вмешательств (особенно раздельных диагностических выскабливаний слизистой оболочки полости матки). Негативным отражением этого служит «бесплодие неясного генеза» или «рецидивирующие неудачи имплантации», поскольку в ходе комплексного обследования определить основную причину недостижения цели не удалось. Однако часто клиницисты могут недооценивать значение латентного или малосимптомного воспаления эндометрия в реализации РП и упустить его из виду. Согласно результатам исследования A. Morimune и соавт. (2021 г.) было доказано, что наличие морфологически верифицированного ХЭ статистически значимо повышает риск самопроизвольного аборта (p<0,03) и снижает вероятность живорождения (p<0,03) и доношенной беременности (p<0,001) [5]. Исходя из этого не остается никаких сомнений в актуальности проблемы ХЭ и его роли в реализации РП. В этой связи необходимо рассмотреть современные стратегии ведения пациенток с ХЭ и отметить современные и персонифицированные стратегии их клинического менеджмента в зависимости от степени тяжести патологического процесса.
ХЭ: особенности клинического менеджмента
Согласно классическим представлениям, ХЭ – это локализованное латентное воспаление слизистой оболочки полости матки, характеризующееся наличием отека, повышенной плотностью стромальных клеток, диссоциированным созреванием эпителиальных клеток и фибробластов стромы, а также наличием плазмоклеточного инфильтрата в строме [6]. При этом указанные выше альтерации неизбежно приводят к нарушению рецептивности/селективности эндометрия, способствующей нарушению уже упомянутого биосенсоринга эмбриона [7]. Глобальная распространенность ХЭ среди пациенток с бесплодием составляет 2,8–50,6%, а в когорте женщин с повторными РП достигает 14–30,3% [8].Вместе с тем наибольшей проблемой является клиническая латентность ХЭ. В настоящее время доказано, что ХЭ проявляется рядом типичных и нетипичных симптомов. К первым относятся хроническая тазовая боль, аномальные маточные кровотечения, диспареуния, патологические выделения из влагалища, при этом атипичная симптоматика представлена развитием рецидивирующего цистита, вагинита и дискомфорта в желудочно-кишечном тракте [9]. Таким образом, клиническая палитра ХЭ мало о чем говорит, и особую актуальность приобретает наличие РП и/или внутриматочных вмешательств в анамнезе.
Ключевые морфологические изменения эндометрия на фоне ХЭ, ассоциированные с неудачами имплантации [10–14]:
• Снижение колонизации полости матки полезными лактобактериями. Доказано, что абсолютное преобладание лактобацилл (>90%) напрямую коррелирует с успешной имплантацией, а активация условно-патогенной флоры, в свою очередь, ассоциирована с РП и снижением показателя живорождения.
• Повышение экспрессии провоспалительных цитокинов – интерлейкина (ИЛ)-1β, ИЛ-6 и фактора некроза опухоли α.
• Снижение экспрессии ИЛ-11, участвующего в регуляции имплантации и адекватной инвазии трофобласта.
• Развитие дисбаланса Т-хелперов 1 и 2-го типа.
• Активация рекрутинга цитотоксических Т- (CD-8) и B-лимфоцитов (CD-20).
• Накопление в строме плазматических клеток
CD-138), отражающих хронический воспалительный процесс.
Вместе с тем, согласно результатам недавнего метаанализа M. Mazloomi и соавт. (2025 г.), была доказана значимая роль нарушения экспрессии ИЛ-33 в реализации повторных РП. Установлено, что снижение концентрации и наличие полиморфизма GG в гене ИЛ-33 были ассоциированы со значимым увеличением риска повторных РП (относительный риск -0,45; 95% доверительный интервал -0,67–-0,23) [15].
Таким образом, патогенетические особенности реализации ХЭ носят мультифакториальных характер и включают как дисбиоз полости матки, так и аномальную экспрессию ряда провоспалительных цитокинов, препятствующих адекватной имплантации. В этой связи важно отметить, что ХЭ является сугубо морфологическим диагнозом и должен верифицироваться в ходе гистологической оценки. Вместе с тем наиболее чувствительным маркером ХЭ являются именно плазматические клетки (CD-138), обнаружение которых в настоящее время представляет собой «золотой стандарт» диагностики. Необходимо отметить, что долгое время необходимое количество CD-138 для постановки диагноза не было определено. Ранее полагалось, что обнаружение лишь 1 клетки в 10 полях зрения было достаточным для морфологической верификации ХЭ, однако данный критерий нередко мог приводить к гипердиагностике заболевания [16]. Недавно было доказано, что наибольшей диагностической ценностью обладает обнаружение 5 и более плазмоцитов в 10 полях зрения, поскольку именно такая интенсивность воспалительной инфильтрации эндометрия ассоциирована с развитием РП (p=0,007) [17].
Особую актуальность имеют гистероскопические критерии ХЭ, определение которых также необходимо перед взятием биоптата эндометрия. Так, согласно собственным данным и международным рекомендациям, к гистероскопическим критериям ХЭ относятся [18, 35]:
• микрополипы эндометрия (до 1–2 мм);
• локальная или диффузная гиперемия эндометрия;
• стромальный отек с утолщением и побледнением ткани в фолликулярной фазе.
Небезынтересен тот факт, что микрополипоз эндометрия является наиболее патогномоничным симптомом ХЭ с высокой диагностической ценностью, которая достигает 93,4% [9]. Следует резюмировать, что объединение патоморфологических и гистероскопических критериев играет важную роль в эффективной верификации диагноза и ассоциировано со значимым повышением диагностической ценности каждого. Однако в настоящее время отсутствуют конкретные критерии градации степеней тяжести ХЭ, необходимой для осуществления эффективного клинического менеджмента пациенток данной когорты. В этой связи мы представляем собственную классификацию/стратификацию ХЭ 2025 г., основанную на результатах гистероскопического и иммуногистохимического исследования, которая поможет клиницисту оценить степень тяжести заболевания на основе международных критериев его диагностики:
• ХЭ минимальной степени выраженности верифицируется при обнаружении 5–10 CD-138 в 10 полях зрения и/или 1 из 3 гистероскопических критериев ХЭ.
• ХЭ умеренной степени выраженности верифицируется при обнаружении 10–20 CD-138 в 10 полях зрения и/или 2 из 3 гистероскопических критериев ХЭ.
• ХЭ тяжелой степени выраженности верифицируется при обнаружении более 20 CD-138 в 10 полях зрения и/или 3 из 3 гистероскопических критериев ХЭ.
Персонификация клинического менеджмента ХЭ
Современные стандарты лечения ХЭ прежде всего подразумевают комплексный подход. Согласно современным международным данным, основными подходами к лечению ХЭ являются:• антибактериальная терапия (АБТ) – только при обнаружении доказанного или потенциально значимого инфекта [19–23];
• пробиотическая терапия [24, 25];
• физиотерапевтическое лечение;
• антифиброзная терапия (АФТ).
При этом важно отметить, что физиотерапевтическое лечение и АФТ являются наиболее значимыми стратегиями патогенетически оправданной адъювантной терапии ХЭ. Данные варианты терапии приобретают особую актуальность после редукции этиотропного фактора (при его наличии) или же могут использоваться изолированно, минуя этап АБТ (при отсутствии инфекта). Основываясь на результатах ряда клинических исследований, важно отметить, что в настоящее время в арсенале клинициста имеется полноценный спектр физиотерапевтических методов лечения ХЭ (электроимпульсная терапия и лекарственный электрофорез, ультразвуковая и магнитотерапия), основными эффектами которых являются [26, 27]:
• индукция саногенетических механизмов;
• редукция воспалительных изменений эндометрия;
• модуляция локального иммунного ответа;
• стимуляция неоангиогенеза;
• активация регенераторного потенциала эндометрия;
• улучшение перфузии эндометрия.

Вместе с тем АФТ с использованием бовгиалуронидазы азоксимера (Лонгидаза) оказывает синергичный эффект за счет редуцирования последствий латентного воспаления в виде фиброза эндометрия и аномального цитокинового профиля. Так, согласно результатам ряда отечественных и международных исследований, использование АФТ реализует целый ряд патогенетически оправданных эффектов, включая [28–31]:
• снижение выраженности плазмоцитарной инфильтрации;
• снижение выраженности фиброза;
• нормализацию перфузионных показателей эндометрия и его пролиферативного потенциала;
• повышение биодоступности и эффективности АБТ (при ее необходимости).
 Суммационным результатом всех отмеченных эффектов АФТ является повышение частоты наступления клинической беременности, а также успешной имплантации и живорождения как в естественном цикле, так и в ходе использования ВРТ.
Суммационным результатом всех отмеченных эффектов АФТ является повышение частоты наступления клинической беременности, а также успешной имплантации и живорождения как в естественном цикле, так и в ходе использования ВРТ.Важно отметить, что в настоящее время отсутствуют регламентированные персонифицированные стратегии патогенетически оправданной терапии ХЭ. Ниже представлены основанные на результатах собственного опыта авторские практичные схемы патогенетически оправданной терапии исходя из степени тяжести ХЭ
в 3 режимах: light, middle и strong (М.Р. Оразов,
В.Е. Радзинский, Л.М. Михалева, Е.С. Силантьева,
Е.Д. Долгов, 2025); рис. 1–3.
Заключение
Резюмируя сказанное, важно отметить, что РРП по-прежнему остаются нерешенной проблемой современной репродуктивной медицины. Данные крупных международных исследований демонстрируют высокую актуальность эндометриального фактора в реализации неудач имплантации, основной причиной которого, к сожалению, служит персистирующее аномальное воспаление слизистой оболочки полости матки.Вместе с тем особым и, пожалуй, наиболее контраверсионным вопросом остается лечение ХЭ, которое должно быть комплексным и патогенетически оправданным. В настоящее время стало очевидно, что АБТ не является панацеей и должна использоваться только при обнаружении доказанного/потенциально значимого инфекта. В этой связи особую актуальность приобрели адъювантные стратегии патогенетической терапии ХЭ, включая антифиброзное и физиотерапевтическое лечение, позволяющее улучшить исходы беременности и достичь долгожданного материнства.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – D. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – чл.-кор. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН, засл. деят. науки РФ. E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinskii – Corr. Memb. RAS, Dr. Sci. (Med.), Professor, Patrice Lumumba Peoples' Friendship University of Russia.
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Михалева Людмила Михайловна – чл.-кор. РАН, д-р мед. наук, проф., дир. НИИМЧ им. акад. А.П. Авцына ФГБНУ «РНЦХ им. акад. Б.В. Петровского», засл. деят. науки РФ. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Corr. Memb. RAS, Dr. Sci. (Med.), Professor, Director of Avtsyn Research Institute of Human Morphology of Petrovsky National Research Centre of Surgery. E-mail: mikhalevam@yandex.ru; ORCID: 0000-0003-2052-914X
Силантьева Елена Сергеевна – д-р мед. наук, зам. глав. врача Клинического госпиталя «Лапино-1» группы компаний «Мать и дитя». E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Elena S. Silantieva – Dr. Sci. (Med.), Clinical Hospital "Lapino-1", Lapino, Moscow Region. E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgenii D. Dolgov – Medical Resident, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 23.01.2025
Поступила после рецензирования: 05.02.2025
Принята к публикации: 06.02.2025
Received: 23.01.2025
Revised: 05.02.2025
Accepted: 06.02.2025
Список исп. литературыСкрыть список1. Предиктивное акушерство. Под ред. В.Е. Радзинского, С.А. Князева, И.Н. Костина. М.: Редакция журнала StatusPraesens, 2021.
Predictive obstetrics. Edited by V.E. Radzinsky, S.A. Knyazev,
I.N. Kostin. Moscow: Editorial Board of the StatusPraesens Journal, 2021 (in Russian).
2. Quenby S et al. Miscarriage matters: the epidemiological, physical, psychological, and economic costs of early pregnancy loss. Lancet 2021;397(10285):1658-67.
3. Yang AM, Xu X, Han Y et al. Risk factors for different types of pregnancy losses: analysis of 15,210 pregnancies after embryo transfer. Frontiers Endocrinol 2021;(12):683236.
4. Annual Capri Workshop Group. Early pregnancy loss: the default outcome for fertilized human oocytes. J Assisted Reprod Gen 2020;37(5):1057-63.
5. Morimune A, Kimura F, Nakamura A et al. The effects of chronic endometritis on the pregnancy outcomes. Am J Reprod Immunol 2021;85(3):e13357.
6. Michels TC. Chronic endometritis. Am Fam Physician 1995;52(1):217-22.
7. Wiesenfeld HC, Hillier SL, Meyin LA et al. Subclinical pelvic inflammatory disease and infertility. Obstet Gynecol 2012;120(1):37-43. DOI: 10.1097/AOG.0b013e31825a6bc9
8. Li J et al. Analysis of pregnancy outcomes in patients with recurrent implantation failure complicated with chronic endometritis. Frontiers Cell Dev Biol 2023;(11):1088586.
9. Puente E, Alonso L, Laganà AS et al. Chronic endometritis: old problem, novel insights and future challenges. Int J Fertil Steril 2020;13(4):250.
10. Moreno I, Codoñer FM, Vilella F et al. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am J Obstet Gynecol 2016;215(6):684-703.
11. Petrova MI, Lievens E, Malik S et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Frontiers Physiol 2015;(6):129628.
12. Дикке Г.Б., Остроменский В.В. Нарушение иммунного статуса при хроническом эндометрите и опыт его коррекции посредством локальной цитокинотерапии. Акушерство и гинекология. 2019;(9):139-46. DOI: 10.18565/aig.2019.9.139-146
Dikke G.B., Ostromensky V.V. Immune status impairment in chronic endometritis and experience of its correction by means of local cytokine therapy. Obstetrics and Gynecology. 2019;(9):139-46. DOI: 10.18565/aig.2019.9.139-146 (in Russian).
13. Толибова Г.Х., Траль Т.Г, Клещев М.А. и др. Эндометриальная дисфункция: алгоритм гистологического и иммуногистохимического исследования. Журнал акушерства и женских болезней. 2015;64(4):69-77.
Tolibova G.Kh., Tral T.G., Kleshchev M.A., et al. Endometrial dysfunction: algorithm of histological and immunohistochemical study. Journal of obstetrics and women's diseases. 2015;64(4):69-77 (in Russian).
14. Li Y, Yu S, Huang C et al. Evaluation of peripheral and uterine immune status of chronic endometritis in patients with recurrent reproductive failure. Fertil Steril 2020;113(1):187-196.e1. DOI: 10.1016/j. fertnstert.2019.09.001
15. Mazloomi M et al. Association of Interleukin-33 with Recurrent Pregnancy Loss: A Systematic Review and Meta-Analysis Study. Int J Fertil Steril 2025.
16. McQueen DB, Maniar KP, Hutchinson A et al. Redefining chronic endometritis: the importance of endometrial stromal changes. Fertil Steril 2021;116(3):855-61.
17. Santoro A, Travaglino A, Inzani F et al. The role of plasma cells as a marker of chronic endometritis: a systematic review and meta-analysis. Biomedicines 2023;11(6):1714.
18. Taylor M, Jenkins SM, Pillarisetty LS. Endometritis. [Updated 2023 Oct 26]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2024.
19. Song D, He Y, Wang Y et al. Impact of antibiotic therapy on the rate of negative test results for chronic endometritis: a prospective randomized control trial. Fertil Steril 2021;115(6):1549-56. DOI: 10.1016/j.fertnstert.2020.12.019
20. Cicinelli E, Resta L, Loizzi V et al. Antibiotic therapy versus no treatment for chronic endometritis: a case-control study. Fertil Steril 2021;115(6):1541-8. DOI: 10.1016/j.fertnstert.2021.01.018
21. Duan H, Li X, Hao Y et al. Risk of spontaneous abortion after antibiotic therapy for chronic endometritis before in vitro fertilization and intracytoplasmic sperm injection stimulation. Fertil Steril 2022;118(2):337-46. DOI: 10.1016/j.fertnstert.2022.04.026
22. Cheng X, Huang Z, Xiao Z, Bai Y. Does antibiotic therapy for chronic endometritis improve clinical outcomes of patients with recurrent implantation failure in subsequent IVF cycles? A systematic review and meta-analysis. J Assist Reprod Genet 2022;39(8):1797-813. DOI: 10.1007/s10815-022-02558-1
23. Kitaya K, Yasuo T. Commonalities and Disparities between Endometriosis and Chronic Endometritis: Therapeutic Potential of Novel Antibiotic Treatment Strategy against Ectopic Endometrium. Int J Mol Sci 2023;24(3):2059.
24. Jafarabadi MN et al. Intravaginal probiotics before embryo transfer do not improve pregnancy rates in recurrent implantation failure cases: An RCT. Int J Reprod BioMed 2024;p.363-74.
25. Abdolmohammadi-Vahid S et al. P-395 Vaginal probiotics and vitamin D, as immunomodulatory approaches in improving the implantation and live birth in repeated implantation failure (RIF) women with imbalanced immune system. Hum Reprod 2024;39(Suppl.1):
С. deae108.750.
26. Оразов М.Р. и др. Повторные неудачи имплантации: этиология и возможности физиотерапии. Трудный пациент. 2020;18(8-9):20-4.
Orazov MR et al. Repeated implantation failures: etiology and possibilities of physiotherapy. Difficult patient. 2020;18(8-9):20-4 (in Russian).
27. Зиновьева О.С. и др. Влияние сочетанной плацентарной терапии и инфракрасного спектра лазера на гемодинамические нарушения в гипопластичном эндометрии. Медицинский альманах. 2018;6(57):94-7. DOI: 10.21145/2499-9954-2018-6-94-97
Zinovieva O.S. et al. Effect of combined placental therapy and infrared laser spectrum on hemodynamic disturbances in hypoplastic endometrium. Medical almanac. 2018; 6 (57): 94-7. DOI: 10.21145/2499-9954-2018-6-94-97 (in Russian).
28. Тапильская Н.И., Савичева А.М., Шалепо К.В., Копылова А.А. Опыт лечения хронического эндометрита. Гинекология. 2020;22(4):68-70.
Tapilskaya N.I., Savicheva A.M., Shalepo K.V., Kopylova A.A. Experience in the treatment of chronic endometritis. Gynecology. 2020;22(4):68-70. DOI: 10.26442/20795696.2020.4.200312 (in Russian).
29. Вартанян Э.В., Девятова Е.А., Цатурова К.А., Аглямова Д.Р. Роль системной терапии при бесплодии и неудачах реализации репродуктивной функции. Акушерство, гинекология и репродукция. 2018;12(1):5-16.
Vartanyan E.V., Devyatova E.A., Tsaturova K.A., Aglyamova D.R. The role of systemic therapy in infertility and failures of reproductive function. Obstetrics, Gynecology and Reproduction. 2018;12(1):5-16 (in Russian).
30. Trizna E et al. Improving the efficacy of antimicrobials against biofilm-embedded bacteria using bovine hyaluronidase azoximer (Longidaza®). Pharmaceutics 2021;13(11):1740.
31. Локшин В.Н., Аскар Е., Рыбина А.Н. и др. Опыт применения бовгиалуронидазы азоксимера в комплексном лечении хронического эндометрита у женщин с повторными неудачами имплантации. Акушерство и гинекология. 2023; DOI: 10.18565/aig.2023.119
Lokshin V.N., Askar E., Rybina A.N., et al. Experience with the use of bovhyaluronidase azoximer in the complex treatment of chronic endometritis in women with repeated implantation failures. Obstetrics and Gynecology. 2023; DOI: 10.18565/aig.2023.119 (in Russian).
32. Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Хронический эндометрит на современном этапе: в фокусе внимания преодоление неудач имплантации. Клинический разбор в общей медицине. 2024;5(3):18-26. DOI: 10.47407/kr2023.5.3.00370
Orazov M.R., Radzinsky V.E., Dolgov E.D. Chronic endometritis at the present stage: in focus on overcoming implantation failures. Clinical review for general practice. 2024;5(3):18-26. DOI: 10.47407/ kr2023.5.3.00370 (in Russian).
33. Краснопольская К.В., Михалева Л.М., Оразов М.Р., Долгов Е.Д. Возможности преодоления неудач имплантации при бесплодии маточного генеза, обусловленных хроническим эндометритом. Гинекология. 2022;24(5):400-7. DOI: 10.26442/20795696.2022.5.201892
Krasnopolskaya K.V., Mikhaleva L.M., Orazov M.R., Dolgov E.D. Possibilities of overcoming implantation failures in infertility of uterine genesis caused by chronic endometritis. Gynecology. 2022;24(5):400-7. DOI: 10.26442/20795696.2022.5.201892 (in Russian).
34. Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Микромир, сыгравший злую шутку: дефектный микробиом и неудачи имплантации на фоне хронического эндометрита. Women’s Clinic. 2024;(2-3):53-60.
Orazov M.R., Radzinsky V.E., Dolgov E.D. Microworld that played a cruel joke: defective microbiome and implantation failures against the background of chronic endometritis. Women’s Clinic. 2024;(2-3):53-60 (in Russian).
35. Женская консультация: руководство. Под ред. В.Е. Радзинского.
4-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2021.
Women's consultation: manual. Edited by V.E. Radzinsky. 4th ed., revised and enlarged. Moscow: GEOTAR-Media, 2021 (in Russian).
2 апреля 2025
Количество просмотров: 234

