Клинический разбор в общей медицине №3 2025
Клинический разбор в общей медицине №3 2025
Аспергиллез легких в практике фтизиатра: состояние проблемы, дифференциальный диагноз, клинические наблюдения
Номера страниц в выпуске:82-90
Аннотация
В статье приведены литературных данные о патогенезе, классификации, клинике и диагностике аспергиллеза, представлены собственные клинические наблюдения, демонстрирующие особенности развития аспергиллеза легких в зависимости от преморбидного фона пациентов. У ВИЧ-негативных пациентов аспергиллез от туберкулеза отличало отсутствие микобактерий туберкулеза в мокроте при наличии полостных образований и характерная картина на компьютерных томограммах с наличием плотных масс внутри полости.
У ВИЧ-инфицированных лиц дифференциальная диагностика аспергиллеза затруднена из-за острого течения, развития легочных диссеминаций, отсутствия грибных масс внутри полостей. В качестве важных диагностических моментов рассматривается развитие микоза при уровне CD4 менее 100 кл/мкл, отсутствие микобактерий туберкулеза в мокроте при наличии полостей, выраженные интерстициальные изменения в легочной ткани, выявляемые на компьютерных томограммах легких.
Ключевые слова: аспергиллез, туберкулез, клинические наблюдения.
Для цитирования: Корж Е.В. Аспергиллез легких в практике фтизиатра: состояние проблемы, дифференциальный диагноз, клинические наблюдения. Клинический разбор в общей медицине. 2025; 6 (3): 82–90. DOI: 10.47407/kr2024.6.3.00584
В статье приведены литературных данные о патогенезе, классификации, клинике и диагностике аспергиллеза, представлены собственные клинические наблюдения, демонстрирующие особенности развития аспергиллеза легких в зависимости от преморбидного фона пациентов. У ВИЧ-негативных пациентов аспергиллез от туберкулеза отличало отсутствие микобактерий туберкулеза в мокроте при наличии полостных образований и характерная картина на компьютерных томограммах с наличием плотных масс внутри полости.
У ВИЧ-инфицированных лиц дифференциальная диагностика аспергиллеза затруднена из-за острого течения, развития легочных диссеминаций, отсутствия грибных масс внутри полостей. В качестве важных диагностических моментов рассматривается развитие микоза при уровне CD4 менее 100 кл/мкл, отсутствие микобактерий туберкулеза в мокроте при наличии полостей, выраженные интерстициальные изменения в легочной ткани, выявляемые на компьютерных томограммах легких.
Ключевые слова: аспергиллез, туберкулез, клинические наблюдения.
Для цитирования: Корж Е.В. Аспергиллез легких в практике фтизиатра: состояние проблемы, дифференциальный диагноз, клинические наблюдения. Клинический разбор в общей медицине. 2025; 6 (3): 82–90. DOI: 10.47407/kr2024.6.3.00584
Review and Clinical Case
Gorky Donetsk State Medical University, Donetsk, Russia;
Republican Clinical Tuberculosis Hospital, Donetsk, Russia
Korzh191061@mail.ru
Abstract
The article presents literature data on the pathogenesis, classification, clinic and diagnosis of aspergillosis, own clinical observations demonstrating the development of aspergillosis depending on the premorbid background of patientsare presented.In HIV-negative patients, aspergillosis differs from tuberculosis in the absence of MBT in sputum despite presence of cavities and a characteristic pattern on CT scans with dense masses inside the cavity. In HIV-infected individuals, the differential diagnosis of aspergillosis is difficult due to its acute course, development of pulmonary dissemination, and the absence of fungal masses inside the cavities. The development of mycosis at CD4 count less than 100 cells/µl, the absence of MBT in sputum despite presence of cavities, pronounced interstitial changes in lung tissue detected with CT are considered as important diagnostic points.
Keywords: aspergillosis, tuberculosis, clinical observations.
For citation: Korzh E.V. Pulmonary aspergillosis in phthisiatric practice: problem status, differential diagnosis, clinical observations. Clinical review for general practice. 2025; 6 (3): 82–90 (In Russ.). DOI: 10.47407/kr2024.6.3.00584
Аспергиллез вызывается плесневыми грибками рода Aspergillus, которые широко распространены в окружающей среде и устойчивы к воздействию внешних факторов. Грибки находят в почве, зерне, сене, сырье для производства тканей, комбикормов, некоторых пищевых продуктов. Аспергиллез легких регистрируется во всех регионах мира, составляя до 10% среди больных хроническими бронхолегочными заболеваниями [1–3]. Инфицирование происходит аэрогенным путем, аспергиллы способны проникать в системы кондиционирования воздуха и распространяться внутри помещений, составляя значительную часть среди всех грибков, выявляемых в воздухе бытовых и больничных помещений. В связи с этим многие клиницисты считают аспергиллез госпитальной инфекцией, рост которой в последнее время наблюдается в хирургических, ожоговых отделениях, отделениях реанимации и интенсивной терапии [2, 4]. В условиях стационарных отделений заболевание характеризуется тяжестью клинических проявлений и высокой летальностью, основным предрасполагающим фактором является длительная терапия антибиотиками и глюкокортикоидами. В настоящее время аспергиллез развивается главным образом у ВИЧ-инфицированных лиц с глубокой иммуносупрессией, у интактного населения развитию микоза способствуют состояния, приводящие к снижению резистентности организма, контакт с большим объемом зараженного материала, прием глюкокортикоидов и цитостатиков [1, 5, 6].
Попавшие в легкие споры аспергилл прорастают в активные формы и образуют грибной мицелий, что способствует активации комплемента, продукции факторов хемотаксиса, клеточной инфильтрации бронхов.
В перибронхиальном пространстве формируются гранулемы, содержащие фокусы некроза с мицелием грибка в центре, многоядерные гигантские клетки, эозинофилы, лимфоциты, нейтрофильные гранулоциты. Результатом тканевой воспалительно-некротической реакции становятся множественные полости, внутри которых разрастается грибной мицелий. В образцах тканей при прямой микроскопии определяются характерные гифы грибов с членистым строением и дихотомичным ветвлением под углом в 45°. Макроскопически легочная ткань на разрезе имеет мелкоячеистое губчатое строение с наличием множественных, местами сливающихся, гнойных абсцессов зеленоватого или серовато-желтого цвета. Изменения в бронхах характеризуются развитием деформирующего гнойного бронхита с изъязвлениями и бронхоэктазами [7, 8]. Активное кровоснабжение стенки полости часто приводит к легочному кровотечению и кровохарканью, которые наблюдаются у 70% пациентов [9]. Аспергиллы способны прорастать в лимфатические и кровеносные сосуды с развитием тромбозов и геморрагий. При тяжелом угнетении иммунитета, что наблюдается преимущественно у ВИЧ-инфицированных лиц, нередко происходит гематогенное распространение аспергилл с множественным поражением внутренних органов [10].
По степени инвазии грибка и патогенетическим механизмам выделяют неинвазивный аспергиллез легких (единичные или множественные аспергиллемы), инвазивный (некротический аспергиллез бронхов, пневмония, плеврит, грибковая диссеминация) и аллергический аспергиллез с развитием экзогенных аллергических альвеолитов и бронхиальной астмы [3, 11, 12].
В 2002 г. Европейской организацией по исследованию и лечению рака (EORTC) и Исследовательской группой по микозам Национального института аллергии и инфекционных заболеваний (MSG) были определены критерии инвазивных грибковых инфекций, в том числе аспергиллеза, которые предлагалось использовать для клинических и эпидемиологических исследований [6]. Выделяли 3 уровня вероятности инвазивной грибковой инфекции: доказанная, вероятная и возможная. Патология считалась доказанной, если грибок был обнаружен гистологически в образце ткани, взятой из очага поражения. Вероятные и возможные случаи требовали наличия критериев, включающих факторы риска хозяина (продолжительные нейтропении, трансплантация органов, длительный прием кортикостероидов и иммунодепрессантов, иммунодефицитные состояния), клинические признаки и симптомы предполагаемого микоза, доказательства инфекции в виде культурального и микроскопического определения грибка, тестов, выявляющих антиген возбудителя.
Указанные критерии были пересмотрены EORTC/MSG в 2008 г. [13]. Для более точного отражения связи заболевания с грибковой инфекцией был принят термин «инвазивное грибковое заболевание». Группа экспертов подтвердила, что определения доказанного, вероятного и возможного инвазивного грибкового заболевания будут сохранены, и что критерии должны использоваться только для научных исследований. В качестве обязательного условия диагностики предусматривалось исключение альтернативной этиологии легочного процесса. Таким образом, при отсутствии гистологической верификации к вероятным инвазивным грибковым заболеванием относили случаи, сочетающие факторы хозяина, клинические и микологические критерии. Случаи, которые включали только факторы хозяина и клинические признаки, но для которых отсутствовало микологическое подтверждение, классифицировали как возможные.
В настоящее время лечение аспергиллеза легких проводят пероральными триазолами, из которых предпочтение отдается вориконазолу, а также амфотерицином В и его липосомальной формой, обладающей менее выраженными нежелательными побочными реакциями [12, 14]. При хорошей переносимости в качестве стартового препарата рекомендуют вориконазол, достаточно эффективным средством зарекомендовал себя итраконазол, который используют для продолжения лечения или в случае отсутствия возможности терапии вориконазолом [15]. Также имеются данные об успешном применении каспофунгина и позаконазола [12, 15].
Для лиц, не инфицированных ВИЧ, основное клиническое значение имеет хронический аспергиллез легких (ХАЛ). Развивается ХАЛ у лиц без выраженных нарушений иммунного статуса, преимущественно в среднем и пожилом возрасте в силу часто встречающейся коморбидности (сахарный диабет, сердечно-сосудистые и системные заболевания, патология почек, желудочно-кишечного тракта и др.) [1, 3, 15]. Заболевание считается трудно диагностируемым, может протекать со скудной клинической симптоматикой и атипичными лучевыми признаками. Предрасполагают к развитию ХАЛ различного генеза структурные изменения легочной ткани, оставляющие после себя полостные образования, куда впоследствии проникают споры аспергилл (туберкулезные каверны, кисты после абсцессов, бронхоэктазы, эмфизематозные буллы, полостной рак и др.), однако основным фактором риска считается туберкулез легких [1, 15, 16]. Замечено, что в странах, эндемичных по туберкулезу, выявляется высокая заболеваемость ХАЛ [3]. Диагностика аспергиллеза на поздних стадиях существенно ухудшает прогноз, а отсутствие специфического противогрибкового лечения в течение 5 лет приводит к летальному исходу 80% больных [1, 9, 12].
В 2016 г. Европейским респираторным обществом совместно с Европейским обществом клинической микробиологии и инфекционных болезней сформулированы диагностические критерии ХАЛ: хроническое, более 3 мес, течение заболевания, стойкие изменения на компьютерных томограммах (КТ) легких в виде одной или нескольких полостей с наличием (реже отсутствием) внутри плотных грибковых масс, прямые доказательства аспергиллезной инфекции путем выявлением специфического иммуноглобулина G или преципитинов к Aspergillus в сыворотке крови, мицелия грибка в окрашенных мазках или биопсийном материале, выделение Aspergillus при посеве биопсийного материала, бронхоальвеолярного лаважа, мокроты. Обязательным условием являлось исключение альтернативных заболеваний [6]. В настоящее время признается диагностическая ценность определения галактоманнанового антигена, который является главным компонентом клеточных стенок грибов рода Aspergillus и высвобождается во время роста мицелия [17].
Согласно предложенным рекомендациям, выделяют следующие клинико-рентгенологические формы ХАЛ: одиночная аспергиллома, узловой аспергиллез, хронический кавернозный аспергиллез и фиброзирующий аспергиллез [3, 12]. Наиболее распространенной формой считается кавернозный, который при отсутствии лечения может трансформироваться в хронический фиброзирующий, к менее частым проявлениям относят аспергиллезные узлы и одиночную аспергиллему. Все перечисленные формы регистрируют у пациентов без выраженных нарушений иммунитета, но с различными заболеваниями легких. По данным [15, 18] аспергиллез чаще развивается в существовавшей ранее полости, однако если заболевание начинается с аспергиллезной пневмонии, то особенностью ее течения является образование множества полостей, которые со временем могут увеличиваться в размерах и заполняться шаровидным мицелием. В других исследованиях изучение данных 60 пациентов, оперированных по поводу ХАЛ, показало, что в структуре клинических форм наибольший удельный вес (46,7%) составлял хронический кавернозный аспергиллез. Одиночная аспергиллема встречалась реже, на КТ имела вид полости с внутриполостным содержимым, отделенным от стенки прослойкой воздуха, что в совокупности формировало характерный симптом полумесяца или симптом «погремушки», при котором грибной шар смещается вместе с изменением положения тела [19].
Клинические проявления ХАЛ неспецифичны, больных беспокоит продуктивный кашель, кровохарканье, субфебрилитет, общая слабость, снижение массы тела. Данные объективного и общелабораторного обследования не информативны, основным инструментальным методом диагностики ХАЛ, необходимым для определения формы заболевания, выбора тактики лечения и его мониторинга является спиральная компьютерная томография (СКТ) [1].
Дифференциальная диагностика аспергиллеза с туберкулезом легких может быть довольно затруднительной, поскольку оба заболевания характеризуются схожими клиническими симптомами и результатами рутинного лабораторного обследования, а гистологическая верификация часто невозможна. За последние 5 лет мы наблюдали троих пациентов, не инфицированных ВИЧ, направленных в Республиканскую клиническую туберкулезную больницу (РКТБ) с предварительным диагнозом туберкулеза легких. После обследования туберкулез был исключен, пациентам выставлен клинический диагноз аспергиллеза легких. Диагноз устанавливали в соответствии с представленными выше критериями, за исключением прямых доказательств аспергиллезной инфекции и микологического обследования. Во всех случаях заболевание протекало более трех месяцев и не сопровождалось картиной тяжелой легочной патологии, все пациенты были пожилого возраста (59, 60 и 78 лет), перед развитием ХАЛ находились на лечении в стационарных условиях (460, 30 и 24 дня), причиной госпитализации были туберкулез, ишемический инсульт, внебольничная пневмония. У двух больных наблюдалось кровохарканье, прекратившееся на фоне приема противогрибковых препаратов. У всех пациентов рентгенологически в легких определялись полостные образования, частично заполненные плотными массами, под влиянием противогрибковых препаратов (вориконазол, итраконазол) наблюдалась умеренно выраженная положительная клинико-рентгенологическая динамика.
Ниже мы приводим два собственных наблюдения хронического легочного аспергиллеза, что позволит расширить клинический опыт и повысить качество диагностики.
Больной П., 58 лет, разнорабочий, поступил с жалобами на резкую слабость, кашель с небольшим количеством слизисто-гнойной мокроты, кровохарканье, одышку при физической нагрузке. Два года назад заболел туберкулезом легких, лечился в стационарном отделении РКТБ с диагнозом двусторонней казеозной пневмонии. Заболевание протекало тяжело, с длительной фебрильной лихорадкой, тяжелой интоксикацией, одышкой. Рентгенологически в верхних долях легких определялись участки массивной инфильтрации с множественными полостями. В противотуберкулезном стационаре находился 460 дней, в результате лечения улучшилось общее состояние, прекратилось бактериовыделение, определялась положительная рентгенологическая динамика. Больной был выписан, продолжил лечение амбулаторно в течение 75 дней, после чего переведен в III группу диспансерного наблюдения как эффективно излеченный. После завершения лечения в легких сохранялись большие остаточные изменения в виде крупных полостей, в том числе гигантской полости до 12 см в верхней доле левого легкого (рис. 1, а).
Спустя 6 мес состояние ухудшилось: появились кашель с мокротой, кровохарканье, повышение температуры до 37,5 °С. Самостоятельно обратился к фтизиатру, выполнена СКТ, в легких обнаружены признаки очаговой диссеминации, лимфаденопатия средостения, в верхней доле слева определялась большая полость с плотными массами внутри, в верхней доле справа – парасептальные буллы (рис. 1, б). С подозрением на рецидив туберкулеза госпитализирован в противотуберкулезное отделение РКТБ. При поступлении состояние удовлетворительное, дефицит массы тела (рост – 178 см, масса тела – 54 кг). Над легкими выслушивалось жестковатое дыхание, в верхних отделах слева – амфорическое. Частота дыхательных движений (ЧДД) – 17/мин, артериальное давление (АД) – 100/70 мм рт. ст. Температура тела – 37,0 °С. Остальные данные без особенностей.
В мокроте методами бактериоскопии, молекулярно-генетическими (GeenXpert MBT/Rif) и посева на питательные среды микобактерии туберкулеза (МБТ) не обнаружены. В крови определялась умеренная нормохромная анемия (Hb – 112 г/л, цветовой показатель – 0,88), количество лейкоцитов и лейкоцитарная формула не изменены, СОЭ – 57 мм/ч. Показатели биохимического состава крови (общий белок, мочевина, креатинин, глюкоза, билирубин, активность трансаминаз) в пределах физиологической нормы. В моче – умеренная протеинурия до 0,14 г/л.
В отделении выставлен предварительный диагноз рецидива туберкулеза легких, с учетом выявленной ранее множественной лекарственной устойчивости МБТ назначено лечение препаратами 2-го ряда (бедаквилин, линезолид, левофлоксацин, циклосерин, пиразинамид, парааминосалициловая кислота). Несмотря на проводимое лечение, состояние больного не улучшалось, сохранялись субфебрильная лихорадка, кровохарканье, появились головокружение и тремор конечностей. Невролог диагностировал острое нарушение мозгового кровообращения.
С учетом отсутствия бактериовыделения при исследовании мокроты всеми методами, упорного кровохарканья, наличия остаточной полости после перенесенного ранее туберкулеза с появлением в ней плотных объемных масс диагноз туберкулеза вызвал сомнение, заподозрен аспергиллез легких. Противотуберкулезные препараты были отменены, проводили лечение неврологических нарушений. Больной консультирован в ФГБУ «НМИЦ ФПИ» Минздрава России, заключение: фиброзно-кавернозный туберкулез легких, МБТ, рецидив. Инвазивный аспергилез левого легкого. Рекомендовано назначить лечение итраконазолом с последующим СКТ-контролем через 2 мес.
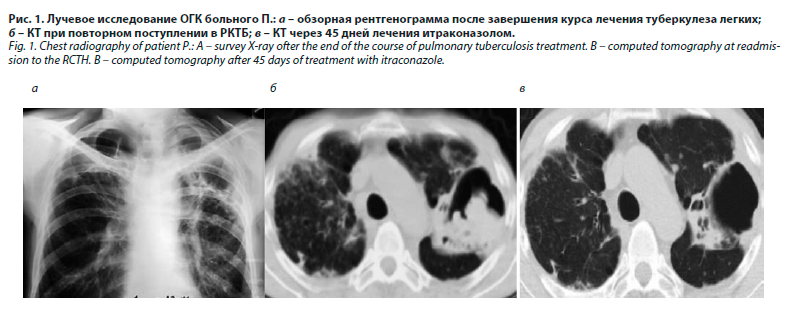
Больному начато лечение итраконазолом по 200 мг 2 раза в день, в связи с усилением неврологической симптоматики на фоне приема противотуберкулезных препаратов, химиотерапия туберкулеза была прекращена, пациент переведен в группу динамического наблюдения. В результате лечения итраконазолом улучшилось общее состояние, нормализовалась температура тела, прекратилось кровохарканье. Через 45 дней выполнена контрольная СКТ органов грудной клетки (ОГК), отмечена положительная динамика очищения полости, частичного рассасывания очагов в легких (рис. 1, в). Больной выписан из отделения, рекомендовано продлить лечение итраконазолом, наблюдение у фтизиатра по месту жительства.
В данном случае можно было говорить об образовании аспергиллемы в результате инвазии грибка в санированную туберкулезную каверну, оставшуюся после излечения туберкулеза легких. Рассасывание инфильтративных изменений и очищение полости на фоне лечения итраконазолом было обусловлено, на наш взгляд, свежестью процесса и своевременной диагностикой.
Успех консервативного лечения легочного аспергиллеза зависит от клинической формы и общей резистентности организма, достигая по данным различных авторов 23–56% [14, 15]. В случае неэффективности терапии, особенно при упорном кровохарканье, возникает необходимость хирургического вмешательства, однако, если последнее по тем или иным причинам невозможно, основным методом становится длительная терапия противогрибковыми препаратами. Примером может служить следующее наблюдение.
Больной К., 78 лет, пенсионер, направлен на консультацию для исключения туберкулеза легких. Предъявлял жалобы на общую слабость, субфебрилитет, кашель со слизисто-гнойной мокротой, кровохарканье.
Состоит на учете по поводу ишемической болезни сердца, гипертонической болезни III стадии. Вредных привычек нет.
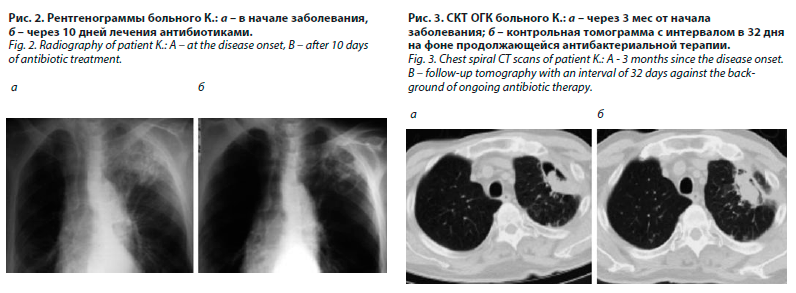
Пять месяцев назад развился ишемический инсульт в бассейне левой среднемозговой артерии с сенсорно-мнестической и моторной афазией, умеренным правосторонним гемипарезом. В течение месяца лечился в неврологическом отделении местной больницы с положительной динамикой частичного восстановления двигательных функций. Спустя 20 дней после госпитализации в неврологическое отделение поднялась температура тела до 38,0 °С, появились саднящие боли за грудиной и в левой половине грудной клетки, кашель со слизисто-гнойной мокротой. Рентгенологически в верхней доле левого легкого определялось обширное неоднородное затемнение, расцененное как пневмония (рис. 2, а).
Больному проведен курс лечения цефтриаксоном и левофлоксацином в течение 10 дней. Состояние улучшилось, но сохранялись продуктивный кашель и субфебрилитет, на контрольном снимке определялось частичное рассасывание инфильтрации, появление множества тонкостенных воздухсодержащих полостей (рис. 2, б). Для дальнейшей неврологической реабилитации больной был выписан из отделения, рекомендовано продлить лечение пневмонии по месту жительства. В течение месяца амбулаторно проведены два курса антибактериальной терапии, в течение 20 дней парентерально вводили 4–8 мг дексаметазона. На фоне лечения состояние не улучшалось, продолжался продуктивный кашель, сохранялась субфебрильная лихорадка с периодическими подъемами до 38,0–38,5 °С.
К концу второго курса лечения появилось обильное кровохарканье, интенсивность которого немного уменьшалась после приема таблетированного этамзилата. Рентгенологически в левом легком сохранялись тонкостенные полости, в одной из которых появился шарообразный секвестр. Больной осмотрен пульмонологом, диагноз пневмонии подтвержден, рекомендовано продлить антибактериальную терапию. Консультирован в Донецком Республиканском онкологическом центре (РОЦ), выполнена СКТ ОГК, выявлено уменьшение верхней доли левого легкого, наличие в ней участков инфильтрации и тонкостенной полости с плотными массами внутри (рис. 3, а).
Диагностическая фибробронхоскопия не сделана из-за выраженных неврологических расстройств. Онкологом диагноз рака легких был исключен. В течение всего периода обследования больной продолжал неспецифическую антибактериальную терапию без клинического улучшения. С предварительным диагнозом фиброзно-кавернозного туберкулеза легких направлен на консультацию фтизиатра.
На момент осмотра состояние средней тяжести из-за неврологических нарушений. Сознание ясное, разговаривает с трудом, жалобы и анамнез собраны преимущественно со слов родственников. При объективном осмотре больной повышенного питания, в легких выслушивалось ослабленное дыхание, слева от медиального края лопатки – единичные сухие хрипы. Сердце расширено влево до среднеключичной линии, тоны глухие, акцент 2 тона над аортой, короткий систолический шум на верхушке. Ритм правильный, частота сердечных сокращений (ЧСС) – 90 уд/мин. АД – 145/70 мм рт. ст. Живот мягкий, при пальпации безболезненный, печень увеличена на 4–5 см. Со стороны неврологического статуса определялись явления перенесенного ишемического инсульта с соответствующей симптоматикой.
В лаборатории РКТБ исследована мокрота, методом микроскопии и GeenXpert MBT/Rif МБТ не выявлены, в дальнейшем роста на питательных средах не получено. Для уточнения диагноза проведен анализ рентгенологического архива. Быстрые сроки рассасывания инфильтрации и образования тонкостенных полостей после первого курса антибактериальной терапии в начале заболевания свидетельствовали против туберкулеза. Деструкции являются характерным признаком специфического процесса, однако туберкулезный инфильтрат даже под влиянием этиотропной терапии уменьшается медленно, в течение многих месяцев, при этом полости вначале имеют неравномерно толстые стенки и только после продолжительного лечения становятся тонкостенными. При туберкулезе наличие полостей практически всегда сопровождается бактериовыделением, однако у больного МБТ в мокроте обнаружены не были.
Такие признаки, как пожилой возраст, развитие накануне тяжелой патологии с длительным пребыванием в стационаре, повторные курсы антибиотиков и кортикостероидов, упорное кровохарканье, быстрая рентгенологическая динамика процесса с образованием полостей и заполнением их плотным содержимым, укладывались в картину аспергиллеза легких. С учетом того, что после первой СКТ ОГК прошло более месяца, в течение которого больной продолжал лечение антибиотиками, для уточнения диагноза выполнено повторное исследование, которое показало увеличение полости с практически полным заполнением ее плотными массами овальной формы (рис. 3, б).
Принимая во внимание наличие факторов риска, характерных клинических и лучевых симптомов, динамику процесса с течением времени был вынесен диагноз – хронический аспергиллез легких. Микологическое исследование не проводили ввиду ограниченных технических возможностей на территории ДНР. В данном случае мы считаем, что заболевание началось с аспергиллезной пневмонии, что подтверждает известное мнение о госпитальном характере аспергиллеза. Больному назначена тест-терапия вориконазолом в течение двух недель. За время лечения уменьшилось количество мокроты, стойко прекратилось кровохарканье. Рентгенологически наблюдалось незначительное рассасывание инфильтрации, размеры полости и внутриполостного содержимого не изменились. В связи с отсутствием возможности приобретения вориконазола больному рекомендовано продолжить лечение итраконазолом под наблюдением профильного специалиста.
У ВИЧ-инфицированных лиц аспергиллез развивается на стадии глубокой иммуносупрессии, количество зарегистрированных случаев легочного аспергиллеза у ВИЧ-инфицированных лиц не достигает больших цифр, что, по нашему мнению, является результатом недостаточной осведомленности практических врачей и ограниченных диагностических возможностей. Для ВИЧ-инфицированных пациентов, госпитализированных с предварительным диагнозом туберкулеза легких, большее значение имеет не только подтверждение (исключение) туберкулеза, но и выявление диагностически значимых критериев аспергиллеза, таких как характерная клинико-лучевая картина, высевание аспергилл из стерильного в норме биологического материала, гистоморфологические признаки. Считается, что для ВИЧ-инфицированных лиц, имеющих симптомы бронхолегочного поражения и/или инфильтративные изменения в легких, достаточным основанием для назначения противогрибковой терапии является выделение Aspergillus из бронхоальвеолярного лаважа. Из 15 ВИЧ-инфицированных больных, у которых диагноз установили подобным образом, аспергиллез гистологически или на аутопсии был подтвержден у 14 [10].
На фоне глубокой иммуносупрессии аспергиллез часто приобретает генерализованный характер с развитием диссеминаций и полостей в легких, плевральных выпотов, внутригрудной лимфаденопатии. Схожесть клинико-лучевых проявлений аспергиллеза с туберкулезом, который на последних стадиях ВИЧ-инфекции также характеризуется гематогенной диссеминацией с множественным поражением внутренних органов, диктует необходимость дифференциальной диагностики и проведения дополнительных исследований с целью уточнения диагноза, предупреждения необоснованной полипрагмазии и улучшения прогноза.
За последние годы мы наблюдали трех ВИЧ-инфицированных больных аспергиллезом легких, госпитализированных в РКТБ с предварительным диагнозом диссеминированного туберкулеза. Аспергиллез во всех случаях был верифицирован на аутопсии, макро- и микроскопические признаки активного туберкулеза отсутствовали. Все пациенты были моложе 40 лет (26, 36, 38), в крови всех больных содержание CD4-лимфоцитов не превышало 30 кл/мкл (23, 18, 10). С учетом небольшого количества наблюдений окончательно судить о характере течения патологии в зависимости от ВИЧ-инфицирования не предоставляется возможным, однако было замечено, что по сравнению с интактными лицами аспергиллез на фоне иммуносупрессии протекал остро, начинался с аспергиллезной пневмонии, внутри полостей отсутствовали секвестры, на КТ легких определялись выраженные интерстициальные изменения и участки снижения прозрачности по типу «матового стекла». Последние изменения на КТ являлись наиболее противоречащими туберкулезу, что наряду с быстрой динамикой и отсутствием бактериовыделения при наличии полостей позволяло исключить туберкулез у ВИЧ-инфицированных лиц.
Однако даже своевременное выявление легочных микозов не всегда является залогом эффективности лечения, основными причинами неблагоприятных исходов становятся осложнения, способные развиваться даже на фоне адекватной этиотропной терапии. В качестве примера приводим следующее наблюдение.
Больная С., 38 лет, при поступлении жаловалась на кашель со слизисто-гнойной мокротой, резкую слабость, одышку при незначительной физической нагрузке, повышение температуры тела до 39 °C, снижение массы тела на 2 кг за последние полтора месяца.
Туберкулезом ранее не болела, последнее флюорографическое обследование проходила 2 года назад, патологии не было. Вредных привычек нет.
Заболела около двух месяцев назад, когда на фоне полного здоровья периодически стала повышаться температура тела до 38,0–38,5 °С. В течение двух недель лечилась самостоятельно (парацетамол, ибупрофен), однако лихорадка сохранялась. При обращении к семейному врачу рентгенологически в легких с двух сторон выявлены множественные участки уплотнения легочной ткани, расцененные как внебольничная полисегментарная пневмония. В терапевтическом стационаре по месту жительства проведено лечение антибиотиками в течение 14 дней, однако общее состояние не улучшилось, при контрольной рентгенографии легких определялось увеличение размеров теней и появление воздухсодержащих полостей. Больная направлена на консультацию к пульмонологу, в ходе дополнительного обследования обнаружены антитела к ВИЧ, назначен повторный курс терапии ровамицином и флуконазолом в течение 10 дней амбулаторно. По окончании лечения в связи с нарастающей одышкой вновь госпитализирована в терапевтический стационар, где сразу была начата антиретровирусная терапия (АРТ) – тенофовир, эмтрицитабин, долутегравир. Одновременно пациентка консультирована фтизиатром, для дальнейшего обследования и лечения переведена в противотуберкулезное отделение РКТБ.
При поступлении общее состояние средней тяжести, выражена астенизация, питание понижено. Температура тела 38,5 °С. Кожа и видимые слизистые чистые, бледные. Пальпируются подвижные, эластичные, безболезненные заднешейные лимфоузлы до 0,5 см в виде цепочки, подмышечные – до 1,0 см. ЧДД – 20 в минуту. Над легкими выслушивается ослабленное дыхание, слева книзу от угла лопатки – нежные мелкопузырчатые хрипы. Сатурация кислорода – 95–96%. Частота сердечных сокращений (ЧСС) – 90 уд/мин, АД – 115/70 мм рт. ст. Остальные данные без особенностей.
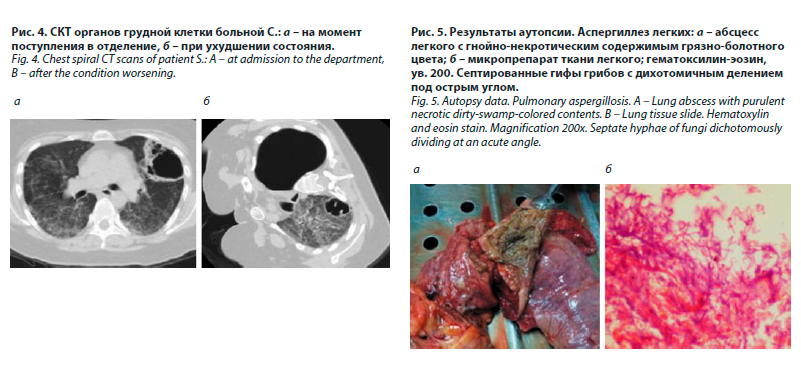
В отделении обследована. При СКТ органов грудной клетки (рис. 4, а) в легких определялось выраженное усиление легочного рисунка за счет интерстициального компонента с наличием множественных мелкоочаговых уплотнений легочной ткани и участков «матового стекла»», в S3 слева – воздухсодержащая многокамерная полость размерами 72×63×45 мм с толстыми неравномерно инфильтрированными стенками. В средостении – единичные мелкие парааортальные лимфоузлы до 5–6 мм в диаметре.
В мокроте методом микроскопии и GeenXpert MBT/Rif МБТ не обнаружены, в дальнейшем на питательных средах роста культуры МБТ не получено.
В крови: эритроциты – 4,5 Т/л, Нb – 143 г/л, цветовой показатель – 0,97, лейкоциты – 9,1 г/л, палочкоядерные нейтрофилы – 1%, сегментоядерные нейтрофилы – 89%, эозинофилы – 1%, лимфоциты – 8%, (абсолютное число – 720 кл/мкл), моноциты – 1%, СОЭ – 17 мм/ч. Биохимические показатели (содержание общего белка, мочевины, креатинина, билирубина, глюкозы, активность трансаминаз, тимоловая проба) – в пределах физиологической нормы. Содержание CD4 в крови –
10 кл/мкл (0,98%), вирусная нагрузка – 2730 РНК-копий/мл. В моче – протеинурия до 0,32 г/л, эритроциты – 0-0-1 в поле зрения, лейкоциты – до 30 в поле зрения, единичные гиалиновые цилиндры.
Больной выставлен предварительный диагноз диссеминированного туберкулеза легких, начато лечение препаратами 1-го ряда (изониазид, рифампицин, пиразинамид, этамбутол) на фоне патогенетической терапии и профилактики оппортунистических инфекций (бисептол, флуконазол, азитромицин). Продолжена АРТ по прежней схеме.
На фоне лечения состояние оставалось тяжелым, сохранялись лихорадка, кашель, одышка. На 5-й день пребывания в отделении возникло легочное кровотечение, остановленное консервативно. Через неделю от момента поступления с учетом результатов обследования и анализа клинико-рентгенологической картины наличие активного туберкулеза было подвергнуто сомнению, больной выставлен диагноз грибковой пневмонии, не исключался инвазивный аспергиллез. Противотуберкулезные препараты были отменены, в лечебных дозах назначены бисептол, флуконазол, итраконазол на фоне дезинтоксикационной и патогенетической терапии, продолжена АРТ. В результате через 4 дня нормализовалась температура тела, уменьшились слабость и одышка. Затем состояние резко ухудшилось: после приступа сильного кашля возникла боль в левой половине грудной клетки, стала нарастать одышка, дыхание над левым легким не прослушивалось, сатурация кислорода снизилась до 65%. Диагностирован спонтанный пневмоторакс, выполнена СКТ: левое легкое полностью коллабировано, фиксировано спайками в нижнем отделе, в правом легком – нарастание интерстициальных изменений, появление в S1-2 воздухсодержащей полости до 36 мм в диаметре (рис. 4, б).
Больная переведена в отделение интенсивной терапии, выполнено дренирование левой плевральной полости. Несмотря на проводимое лечение, состояние прогрессивно ухудшалось и при нарастающих явлениях дыхательной недостаточности наступила смерть.
На аутопсии признаков туберкулеза выявлено не было. В верхних долях легких обнаружены множественные полостные образования (абсцессы) с внутренним содержимым грязно-болотного цвета, распад и вскрытие полости абсцесса с развитием бронхоплеврального свища (рис. 5, а).
Гистологически в препарате легочной ткани определялось большое количество характерных септированных гифов с дихотомичным делением под острым углом (рис. 5, б). Полученные данные позволили верифицировать диагноз легочного аспергиллеза.
В представленном случае у ВИЧ-инфицированной пациентки аспергиллез носил генерализованный характер с диффузным поражением легочной ткани. На КТ легких это отражалось усилением интерстициального компонента, наличием множественных узелковых образований и участков снижения прозрачности по типу матового стекла. Течение заболевания отличалось отрицательной клинико-рентгенологической динамикой на фоне противотуберкулезной и антибактериальной терапии, но положительным клиническим эффектом от противогрибковых препаратов, что, однако, не предотвратило развитие спонтанного пневмоторакса, послужившего непосредственной причиной смерти.
Таким образом, у больных, не инфицированных ВИЧ, постановка диагноза аспергиллеза легких не вызывала значительных затруднений и осуществлялась согласно рекомендованным критериям. У данной категории пациентов в качестве важных моментов для дифференциальной диагностики с туберкулезом мы бы выделили быструю рентгенологическую динамику образования тонкостенных полостей в легких, стойкое отсутствие МБТ в мокроте при наличии полостных образований, характерную картину аспергиллеза на КТ с наличием плотных масс грибного мицелия внутри полости.
У ВИЧ-инфицированных лиц дифференциальная диагностика аспергиллеза была затруднена из-за острого течения, генерализованного характера с развитием синдрома диссеминации, образования полостей без плотного содержимого внутри, что делало заболевание похожим на туберкулез. Отсутствие грибного мицелия в полостях у ВИЧ-инфицированных лиц мы объясняли неблагоприятным течением аспергиллеза с быстрым наступлением летального исхода до момента формирования мицетомы. Важным дифференциально-диагностическим критерием можно считать развитие микоза при глубокой иммуносупрессии (в наших случаях у всех трех больных уровень CD4 был менее 30 кл/мкл), при этом содержание CD4 более 200 кл/мкл не исключает туберкулез, но ставит под сомнение диагноз инвазивного аспергиллеза. Туберкулезному процессу противоречит также отсутствие МБТ в мокроте при наличии полостей, а также выраженные интерстициальные изменения в легочной ткани, выявляемые при СКТ. Для своевременной диагностики аспергиллеза легких необходима микологическая и серологическая верификация возбудителя, проведение которой в условиях ДНР на сегодняшний момент невозможно из-за ограниченных ресурсов. Особую актуальность приобретает своевременное выявление ВИЧ-инфекции и начало АРТ, что позволит предотвратить развитие тяжелых иммунодефицитов и опасных для жизни оппортунистических инфекций.
Информация об авторе
Information about the author
Корж Елена Владимировна – д-р мед. наук, проф. каф. фтизиатрии и пульмонологии, ФГБОУ ВО «Донецкий государственный медицинский университет им. М. Горького», врач-фтизиатр туберкулезно-легочного отделения для взрослых №1, Республиканская клиническая туберкулезная больница.
Е-mail: Korzh191061@mail.ru; ORCID: 0000-0003-0571-9666
Elena V. Korzh – Dr. Sci. (Med.), Prof., Gorky Donetsk State Medical University; Phthisiologist, City Tuberculosis Hospital.
Е-mail: Korzh191061@mail.ru; ORCID: 0000-0003-0571-9666
Поступила в редакцию: 03.02.2025
Поступила после рецензирования: 07.02.2025
Принята к публикации: 13:02.2025
Received: 03.02.2025
Revised: 07.02.2025
Accepted: 13:02.2025
Pulmonary aspergillosis in phthisiatric practice: problem status, differential diagnosis, clinical observations
Elena V. KorzhGorky Donetsk State Medical University, Donetsk, Russia;
Republican Clinical Tuberculosis Hospital, Donetsk, Russia
Korzh191061@mail.ru
Abstract
The article presents literature data on the pathogenesis, classification, clinic and diagnosis of aspergillosis, own clinical observations demonstrating the development of aspergillosis depending on the premorbid background of patientsare presented.In HIV-negative patients, aspergillosis differs from tuberculosis in the absence of MBT in sputum despite presence of cavities and a characteristic pattern on CT scans with dense masses inside the cavity. In HIV-infected individuals, the differential diagnosis of aspergillosis is difficult due to its acute course, development of pulmonary dissemination, and the absence of fungal masses inside the cavities. The development of mycosis at CD4 count less than 100 cells/µl, the absence of MBT in sputum despite presence of cavities, pronounced interstitial changes in lung tissue detected with CT are considered as important diagnostic points.
Keywords: aspergillosis, tuberculosis, clinical observations.
For citation: Korzh E.V. Pulmonary aspergillosis in phthisiatric practice: problem status, differential diagnosis, clinical observations. Clinical review for general practice. 2025; 6 (3): 82–90 (In Russ.). DOI: 10.47407/kr2024.6.3.00584
Аспергиллез вызывается плесневыми грибками рода Aspergillus, которые широко распространены в окружающей среде и устойчивы к воздействию внешних факторов. Грибки находят в почве, зерне, сене, сырье для производства тканей, комбикормов, некоторых пищевых продуктов. Аспергиллез легких регистрируется во всех регионах мира, составляя до 10% среди больных хроническими бронхолегочными заболеваниями [1–3]. Инфицирование происходит аэрогенным путем, аспергиллы способны проникать в системы кондиционирования воздуха и распространяться внутри помещений, составляя значительную часть среди всех грибков, выявляемых в воздухе бытовых и больничных помещений. В связи с этим многие клиницисты считают аспергиллез госпитальной инфекцией, рост которой в последнее время наблюдается в хирургических, ожоговых отделениях, отделениях реанимации и интенсивной терапии [2, 4]. В условиях стационарных отделений заболевание характеризуется тяжестью клинических проявлений и высокой летальностью, основным предрасполагающим фактором является длительная терапия антибиотиками и глюкокортикоидами. В настоящее время аспергиллез развивается главным образом у ВИЧ-инфицированных лиц с глубокой иммуносупрессией, у интактного населения развитию микоза способствуют состояния, приводящие к снижению резистентности организма, контакт с большим объемом зараженного материала, прием глюкокортикоидов и цитостатиков [1, 5, 6].
Попавшие в легкие споры аспергилл прорастают в активные формы и образуют грибной мицелий, что способствует активации комплемента, продукции факторов хемотаксиса, клеточной инфильтрации бронхов.
В перибронхиальном пространстве формируются гранулемы, содержащие фокусы некроза с мицелием грибка в центре, многоядерные гигантские клетки, эозинофилы, лимфоциты, нейтрофильные гранулоциты. Результатом тканевой воспалительно-некротической реакции становятся множественные полости, внутри которых разрастается грибной мицелий. В образцах тканей при прямой микроскопии определяются характерные гифы грибов с членистым строением и дихотомичным ветвлением под углом в 45°. Макроскопически легочная ткань на разрезе имеет мелкоячеистое губчатое строение с наличием множественных, местами сливающихся, гнойных абсцессов зеленоватого или серовато-желтого цвета. Изменения в бронхах характеризуются развитием деформирующего гнойного бронхита с изъязвлениями и бронхоэктазами [7, 8]. Активное кровоснабжение стенки полости часто приводит к легочному кровотечению и кровохарканью, которые наблюдаются у 70% пациентов [9]. Аспергиллы способны прорастать в лимфатические и кровеносные сосуды с развитием тромбозов и геморрагий. При тяжелом угнетении иммунитета, что наблюдается преимущественно у ВИЧ-инфицированных лиц, нередко происходит гематогенное распространение аспергилл с множественным поражением внутренних органов [10].
По степени инвазии грибка и патогенетическим механизмам выделяют неинвазивный аспергиллез легких (единичные или множественные аспергиллемы), инвазивный (некротический аспергиллез бронхов, пневмония, плеврит, грибковая диссеминация) и аллергический аспергиллез с развитием экзогенных аллергических альвеолитов и бронхиальной астмы [3, 11, 12].
В 2002 г. Европейской организацией по исследованию и лечению рака (EORTC) и Исследовательской группой по микозам Национального института аллергии и инфекционных заболеваний (MSG) были определены критерии инвазивных грибковых инфекций, в том числе аспергиллеза, которые предлагалось использовать для клинических и эпидемиологических исследований [6]. Выделяли 3 уровня вероятности инвазивной грибковой инфекции: доказанная, вероятная и возможная. Патология считалась доказанной, если грибок был обнаружен гистологически в образце ткани, взятой из очага поражения. Вероятные и возможные случаи требовали наличия критериев, включающих факторы риска хозяина (продолжительные нейтропении, трансплантация органов, длительный прием кортикостероидов и иммунодепрессантов, иммунодефицитные состояния), клинические признаки и симптомы предполагаемого микоза, доказательства инфекции в виде культурального и микроскопического определения грибка, тестов, выявляющих антиген возбудителя.
Указанные критерии были пересмотрены EORTC/MSG в 2008 г. [13]. Для более точного отражения связи заболевания с грибковой инфекцией был принят термин «инвазивное грибковое заболевание». Группа экспертов подтвердила, что определения доказанного, вероятного и возможного инвазивного грибкового заболевания будут сохранены, и что критерии должны использоваться только для научных исследований. В качестве обязательного условия диагностики предусматривалось исключение альтернативной этиологии легочного процесса. Таким образом, при отсутствии гистологической верификации к вероятным инвазивным грибковым заболеванием относили случаи, сочетающие факторы хозяина, клинические и микологические критерии. Случаи, которые включали только факторы хозяина и клинические признаки, но для которых отсутствовало микологическое подтверждение, классифицировали как возможные.
В настоящее время лечение аспергиллеза легких проводят пероральными триазолами, из которых предпочтение отдается вориконазолу, а также амфотерицином В и его липосомальной формой, обладающей менее выраженными нежелательными побочными реакциями [12, 14]. При хорошей переносимости в качестве стартового препарата рекомендуют вориконазол, достаточно эффективным средством зарекомендовал себя итраконазол, который используют для продолжения лечения или в случае отсутствия возможности терапии вориконазолом [15]. Также имеются данные об успешном применении каспофунгина и позаконазола [12, 15].
Для лиц, не инфицированных ВИЧ, основное клиническое значение имеет хронический аспергиллез легких (ХАЛ). Развивается ХАЛ у лиц без выраженных нарушений иммунного статуса, преимущественно в среднем и пожилом возрасте в силу часто встречающейся коморбидности (сахарный диабет, сердечно-сосудистые и системные заболевания, патология почек, желудочно-кишечного тракта и др.) [1, 3, 15]. Заболевание считается трудно диагностируемым, может протекать со скудной клинической симптоматикой и атипичными лучевыми признаками. Предрасполагают к развитию ХАЛ различного генеза структурные изменения легочной ткани, оставляющие после себя полостные образования, куда впоследствии проникают споры аспергилл (туберкулезные каверны, кисты после абсцессов, бронхоэктазы, эмфизематозные буллы, полостной рак и др.), однако основным фактором риска считается туберкулез легких [1, 15, 16]. Замечено, что в странах, эндемичных по туберкулезу, выявляется высокая заболеваемость ХАЛ [3]. Диагностика аспергиллеза на поздних стадиях существенно ухудшает прогноз, а отсутствие специфического противогрибкового лечения в течение 5 лет приводит к летальному исходу 80% больных [1, 9, 12].
В 2016 г. Европейским респираторным обществом совместно с Европейским обществом клинической микробиологии и инфекционных болезней сформулированы диагностические критерии ХАЛ: хроническое, более 3 мес, течение заболевания, стойкие изменения на компьютерных томограммах (КТ) легких в виде одной или нескольких полостей с наличием (реже отсутствием) внутри плотных грибковых масс, прямые доказательства аспергиллезной инфекции путем выявлением специфического иммуноглобулина G или преципитинов к Aspergillus в сыворотке крови, мицелия грибка в окрашенных мазках или биопсийном материале, выделение Aspergillus при посеве биопсийного материала, бронхоальвеолярного лаважа, мокроты. Обязательным условием являлось исключение альтернативных заболеваний [6]. В настоящее время признается диагностическая ценность определения галактоманнанового антигена, который является главным компонентом клеточных стенок грибов рода Aspergillus и высвобождается во время роста мицелия [17].
Согласно предложенным рекомендациям, выделяют следующие клинико-рентгенологические формы ХАЛ: одиночная аспергиллома, узловой аспергиллез, хронический кавернозный аспергиллез и фиброзирующий аспергиллез [3, 12]. Наиболее распространенной формой считается кавернозный, который при отсутствии лечения может трансформироваться в хронический фиброзирующий, к менее частым проявлениям относят аспергиллезные узлы и одиночную аспергиллему. Все перечисленные формы регистрируют у пациентов без выраженных нарушений иммунитета, но с различными заболеваниями легких. По данным [15, 18] аспергиллез чаще развивается в существовавшей ранее полости, однако если заболевание начинается с аспергиллезной пневмонии, то особенностью ее течения является образование множества полостей, которые со временем могут увеличиваться в размерах и заполняться шаровидным мицелием. В других исследованиях изучение данных 60 пациентов, оперированных по поводу ХАЛ, показало, что в структуре клинических форм наибольший удельный вес (46,7%) составлял хронический кавернозный аспергиллез. Одиночная аспергиллема встречалась реже, на КТ имела вид полости с внутриполостным содержимым, отделенным от стенки прослойкой воздуха, что в совокупности формировало характерный симптом полумесяца или симптом «погремушки», при котором грибной шар смещается вместе с изменением положения тела [19].
Клинические проявления ХАЛ неспецифичны, больных беспокоит продуктивный кашель, кровохарканье, субфебрилитет, общая слабость, снижение массы тела. Данные объективного и общелабораторного обследования не информативны, основным инструментальным методом диагностики ХАЛ, необходимым для определения формы заболевания, выбора тактики лечения и его мониторинга является спиральная компьютерная томография (СКТ) [1].
Дифференциальная диагностика аспергиллеза с туберкулезом легких может быть довольно затруднительной, поскольку оба заболевания характеризуются схожими клиническими симптомами и результатами рутинного лабораторного обследования, а гистологическая верификация часто невозможна. За последние 5 лет мы наблюдали троих пациентов, не инфицированных ВИЧ, направленных в Республиканскую клиническую туберкулезную больницу (РКТБ) с предварительным диагнозом туберкулеза легких. После обследования туберкулез был исключен, пациентам выставлен клинический диагноз аспергиллеза легких. Диагноз устанавливали в соответствии с представленными выше критериями, за исключением прямых доказательств аспергиллезной инфекции и микологического обследования. Во всех случаях заболевание протекало более трех месяцев и не сопровождалось картиной тяжелой легочной патологии, все пациенты были пожилого возраста (59, 60 и 78 лет), перед развитием ХАЛ находились на лечении в стационарных условиях (460, 30 и 24 дня), причиной госпитализации были туберкулез, ишемический инсульт, внебольничная пневмония. У двух больных наблюдалось кровохарканье, прекратившееся на фоне приема противогрибковых препаратов. У всех пациентов рентгенологически в легких определялись полостные образования, частично заполненные плотными массами, под влиянием противогрибковых препаратов (вориконазол, итраконазол) наблюдалась умеренно выраженная положительная клинико-рентгенологическая динамика.
Ниже мы приводим два собственных наблюдения хронического легочного аспергиллеза, что позволит расширить клинический опыт и повысить качество диагностики.
Больной П., 58 лет, разнорабочий, поступил с жалобами на резкую слабость, кашель с небольшим количеством слизисто-гнойной мокроты, кровохарканье, одышку при физической нагрузке. Два года назад заболел туберкулезом легких, лечился в стационарном отделении РКТБ с диагнозом двусторонней казеозной пневмонии. Заболевание протекало тяжело, с длительной фебрильной лихорадкой, тяжелой интоксикацией, одышкой. Рентгенологически в верхних долях легких определялись участки массивной инфильтрации с множественными полостями. В противотуберкулезном стационаре находился 460 дней, в результате лечения улучшилось общее состояние, прекратилось бактериовыделение, определялась положительная рентгенологическая динамика. Больной был выписан, продолжил лечение амбулаторно в течение 75 дней, после чего переведен в III группу диспансерного наблюдения как эффективно излеченный. После завершения лечения в легких сохранялись большие остаточные изменения в виде крупных полостей, в том числе гигантской полости до 12 см в верхней доле левого легкого (рис. 1, а).
Спустя 6 мес состояние ухудшилось: появились кашель с мокротой, кровохарканье, повышение температуры до 37,5 °С. Самостоятельно обратился к фтизиатру, выполнена СКТ, в легких обнаружены признаки очаговой диссеминации, лимфаденопатия средостения, в верхней доле слева определялась большая полость с плотными массами внутри, в верхней доле справа – парасептальные буллы (рис. 1, б). С подозрением на рецидив туберкулеза госпитализирован в противотуберкулезное отделение РКТБ. При поступлении состояние удовлетворительное, дефицит массы тела (рост – 178 см, масса тела – 54 кг). Над легкими выслушивалось жестковатое дыхание, в верхних отделах слева – амфорическое. Частота дыхательных движений (ЧДД) – 17/мин, артериальное давление (АД) – 100/70 мм рт. ст. Температура тела – 37,0 °С. Остальные данные без особенностей.
В мокроте методами бактериоскопии, молекулярно-генетическими (GeenXpert MBT/Rif) и посева на питательные среды микобактерии туберкулеза (МБТ) не обнаружены. В крови определялась умеренная нормохромная анемия (Hb – 112 г/л, цветовой показатель – 0,88), количество лейкоцитов и лейкоцитарная формула не изменены, СОЭ – 57 мм/ч. Показатели биохимического состава крови (общий белок, мочевина, креатинин, глюкоза, билирубин, активность трансаминаз) в пределах физиологической нормы. В моче – умеренная протеинурия до 0,14 г/л.
В отделении выставлен предварительный диагноз рецидива туберкулеза легких, с учетом выявленной ранее множественной лекарственной устойчивости МБТ назначено лечение препаратами 2-го ряда (бедаквилин, линезолид, левофлоксацин, циклосерин, пиразинамид, парааминосалициловая кислота). Несмотря на проводимое лечение, состояние больного не улучшалось, сохранялись субфебрильная лихорадка, кровохарканье, появились головокружение и тремор конечностей. Невролог диагностировал острое нарушение мозгового кровообращения.
С учетом отсутствия бактериовыделения при исследовании мокроты всеми методами, упорного кровохарканья, наличия остаточной полости после перенесенного ранее туберкулеза с появлением в ней плотных объемных масс диагноз туберкулеза вызвал сомнение, заподозрен аспергиллез легких. Противотуберкулезные препараты были отменены, проводили лечение неврологических нарушений. Больной консультирован в ФГБУ «НМИЦ ФПИ» Минздрава России, заключение: фиброзно-кавернозный туберкулез легких, МБТ, рецидив. Инвазивный аспергилез левого легкого. Рекомендовано назначить лечение итраконазолом с последующим СКТ-контролем через 2 мес.

Больному начато лечение итраконазолом по 200 мг 2 раза в день, в связи с усилением неврологической симптоматики на фоне приема противотуберкулезных препаратов, химиотерапия туберкулеза была прекращена, пациент переведен в группу динамического наблюдения. В результате лечения итраконазолом улучшилось общее состояние, нормализовалась температура тела, прекратилось кровохарканье. Через 45 дней выполнена контрольная СКТ органов грудной клетки (ОГК), отмечена положительная динамика очищения полости, частичного рассасывания очагов в легких (рис. 1, в). Больной выписан из отделения, рекомендовано продлить лечение итраконазолом, наблюдение у фтизиатра по месту жительства.
В данном случае можно было говорить об образовании аспергиллемы в результате инвазии грибка в санированную туберкулезную каверну, оставшуюся после излечения туберкулеза легких. Рассасывание инфильтративных изменений и очищение полости на фоне лечения итраконазолом было обусловлено, на наш взгляд, свежестью процесса и своевременной диагностикой.
Успех консервативного лечения легочного аспергиллеза зависит от клинической формы и общей резистентности организма, достигая по данным различных авторов 23–56% [14, 15]. В случае неэффективности терапии, особенно при упорном кровохарканье, возникает необходимость хирургического вмешательства, однако, если последнее по тем или иным причинам невозможно, основным методом становится длительная терапия противогрибковыми препаратами. Примером может служить следующее наблюдение.
Больной К., 78 лет, пенсионер, направлен на консультацию для исключения туберкулеза легких. Предъявлял жалобы на общую слабость, субфебрилитет, кашель со слизисто-гнойной мокротой, кровохарканье.
Состоит на учете по поводу ишемической болезни сердца, гипертонической болезни III стадии. Вредных привычек нет.
Пять месяцев назад развился ишемический инсульт в бассейне левой среднемозговой артерии с сенсорно-мнестической и моторной афазией, умеренным правосторонним гемипарезом. В течение месяца лечился в неврологическом отделении местной больницы с положительной динамикой частичного восстановления двигательных функций. Спустя 20 дней после госпитализации в неврологическое отделение поднялась температура тела до 38,0 °С, появились саднящие боли за грудиной и в левой половине грудной клетки, кашель со слизисто-гнойной мокротой. Рентгенологически в верхней доле левого легкого определялось обширное неоднородное затемнение, расцененное как пневмония (рис. 2, а).
Больному проведен курс лечения цефтриаксоном и левофлоксацином в течение 10 дней. Состояние улучшилось, но сохранялись продуктивный кашель и субфебрилитет, на контрольном снимке определялось частичное рассасывание инфильтрации, появление множества тонкостенных воздухсодержащих полостей (рис. 2, б). Для дальнейшей неврологической реабилитации больной был выписан из отделения, рекомендовано продлить лечение пневмонии по месту жительства. В течение месяца амбулаторно проведены два курса антибактериальной терапии, в течение 20 дней парентерально вводили 4–8 мг дексаметазона. На фоне лечения состояние не улучшалось, продолжался продуктивный кашель, сохранялась субфебрильная лихорадка с периодическими подъемами до 38,0–38,5 °С.
К концу второго курса лечения появилось обильное кровохарканье, интенсивность которого немного уменьшалась после приема таблетированного этамзилата. Рентгенологически в левом легком сохранялись тонкостенные полости, в одной из которых появился шарообразный секвестр. Больной осмотрен пульмонологом, диагноз пневмонии подтвержден, рекомендовано продлить антибактериальную терапию. Консультирован в Донецком Республиканском онкологическом центре (РОЦ), выполнена СКТ ОГК, выявлено уменьшение верхней доли левого легкого, наличие в ней участков инфильтрации и тонкостенной полости с плотными массами внутри (рис. 3, а).

Диагностическая фибробронхоскопия не сделана из-за выраженных неврологических расстройств. Онкологом диагноз рака легких был исключен. В течение всего периода обследования больной продолжал неспецифическую антибактериальную терапию без клинического улучшения. С предварительным диагнозом фиброзно-кавернозного туберкулеза легких направлен на консультацию фтизиатра.
На момент осмотра состояние средней тяжести из-за неврологических нарушений. Сознание ясное, разговаривает с трудом, жалобы и анамнез собраны преимущественно со слов родственников. При объективном осмотре больной повышенного питания, в легких выслушивалось ослабленное дыхание, слева от медиального края лопатки – единичные сухие хрипы. Сердце расширено влево до среднеключичной линии, тоны глухие, акцент 2 тона над аортой, короткий систолический шум на верхушке. Ритм правильный, частота сердечных сокращений (ЧСС) – 90 уд/мин. АД – 145/70 мм рт. ст. Живот мягкий, при пальпации безболезненный, печень увеличена на 4–5 см. Со стороны неврологического статуса определялись явления перенесенного ишемического инсульта с соответствующей симптоматикой.
В лаборатории РКТБ исследована мокрота, методом микроскопии и GeenXpert MBT/Rif МБТ не выявлены, в дальнейшем роста на питательных средах не получено. Для уточнения диагноза проведен анализ рентгенологического архива. Быстрые сроки рассасывания инфильтрации и образования тонкостенных полостей после первого курса антибактериальной терапии в начале заболевания свидетельствовали против туберкулеза. Деструкции являются характерным признаком специфического процесса, однако туберкулезный инфильтрат даже под влиянием этиотропной терапии уменьшается медленно, в течение многих месяцев, при этом полости вначале имеют неравномерно толстые стенки и только после продолжительного лечения становятся тонкостенными. При туберкулезе наличие полостей практически всегда сопровождается бактериовыделением, однако у больного МБТ в мокроте обнаружены не были.
Такие признаки, как пожилой возраст, развитие накануне тяжелой патологии с длительным пребыванием в стационаре, повторные курсы антибиотиков и кортикостероидов, упорное кровохарканье, быстрая рентгенологическая динамика процесса с образованием полостей и заполнением их плотным содержимым, укладывались в картину аспергиллеза легких. С учетом того, что после первой СКТ ОГК прошло более месяца, в течение которого больной продолжал лечение антибиотиками, для уточнения диагноза выполнено повторное исследование, которое показало увеличение полости с практически полным заполнением ее плотными массами овальной формы (рис. 3, б).
Принимая во внимание наличие факторов риска, характерных клинических и лучевых симптомов, динамику процесса с течением времени был вынесен диагноз – хронический аспергиллез легких. Микологическое исследование не проводили ввиду ограниченных технических возможностей на территории ДНР. В данном случае мы считаем, что заболевание началось с аспергиллезной пневмонии, что подтверждает известное мнение о госпитальном характере аспергиллеза. Больному назначена тест-терапия вориконазолом в течение двух недель. За время лечения уменьшилось количество мокроты, стойко прекратилось кровохарканье. Рентгенологически наблюдалось незначительное рассасывание инфильтрации, размеры полости и внутриполостного содержимого не изменились. В связи с отсутствием возможности приобретения вориконазола больному рекомендовано продолжить лечение итраконазолом под наблюдением профильного специалиста.
У ВИЧ-инфицированных лиц аспергиллез развивается на стадии глубокой иммуносупрессии, количество зарегистрированных случаев легочного аспергиллеза у ВИЧ-инфицированных лиц не достигает больших цифр, что, по нашему мнению, является результатом недостаточной осведомленности практических врачей и ограниченных диагностических возможностей. Для ВИЧ-инфицированных пациентов, госпитализированных с предварительным диагнозом туберкулеза легких, большее значение имеет не только подтверждение (исключение) туберкулеза, но и выявление диагностически значимых критериев аспергиллеза, таких как характерная клинико-лучевая картина, высевание аспергилл из стерильного в норме биологического материала, гистоморфологические признаки. Считается, что для ВИЧ-инфицированных лиц, имеющих симптомы бронхолегочного поражения и/или инфильтративные изменения в легких, достаточным основанием для назначения противогрибковой терапии является выделение Aspergillus из бронхоальвеолярного лаважа. Из 15 ВИЧ-инфицированных больных, у которых диагноз установили подобным образом, аспергиллез гистологически или на аутопсии был подтвержден у 14 [10].
На фоне глубокой иммуносупрессии аспергиллез часто приобретает генерализованный характер с развитием диссеминаций и полостей в легких, плевральных выпотов, внутригрудной лимфаденопатии. Схожесть клинико-лучевых проявлений аспергиллеза с туберкулезом, который на последних стадиях ВИЧ-инфекции также характеризуется гематогенной диссеминацией с множественным поражением внутренних органов, диктует необходимость дифференциальной диагностики и проведения дополнительных исследований с целью уточнения диагноза, предупреждения необоснованной полипрагмазии и улучшения прогноза.
За последние годы мы наблюдали трех ВИЧ-инфицированных больных аспергиллезом легких, госпитализированных в РКТБ с предварительным диагнозом диссеминированного туберкулеза. Аспергиллез во всех случаях был верифицирован на аутопсии, макро- и микроскопические признаки активного туберкулеза отсутствовали. Все пациенты были моложе 40 лет (26, 36, 38), в крови всех больных содержание CD4-лимфоцитов не превышало 30 кл/мкл (23, 18, 10). С учетом небольшого количества наблюдений окончательно судить о характере течения патологии в зависимости от ВИЧ-инфицирования не предоставляется возможным, однако было замечено, что по сравнению с интактными лицами аспергиллез на фоне иммуносупрессии протекал остро, начинался с аспергиллезной пневмонии, внутри полостей отсутствовали секвестры, на КТ легких определялись выраженные интерстициальные изменения и участки снижения прозрачности по типу «матового стекла». Последние изменения на КТ являлись наиболее противоречащими туберкулезу, что наряду с быстрой динамикой и отсутствием бактериовыделения при наличии полостей позволяло исключить туберкулез у ВИЧ-инфицированных лиц.
Однако даже своевременное выявление легочных микозов не всегда является залогом эффективности лечения, основными причинами неблагоприятных исходов становятся осложнения, способные развиваться даже на фоне адекватной этиотропной терапии. В качестве примера приводим следующее наблюдение.
Больная С., 38 лет, при поступлении жаловалась на кашель со слизисто-гнойной мокротой, резкую слабость, одышку при незначительной физической нагрузке, повышение температуры тела до 39 °C, снижение массы тела на 2 кг за последние полтора месяца.
Туберкулезом ранее не болела, последнее флюорографическое обследование проходила 2 года назад, патологии не было. Вредных привычек нет.
Заболела около двух месяцев назад, когда на фоне полного здоровья периодически стала повышаться температура тела до 38,0–38,5 °С. В течение двух недель лечилась самостоятельно (парацетамол, ибупрофен), однако лихорадка сохранялась. При обращении к семейному врачу рентгенологически в легких с двух сторон выявлены множественные участки уплотнения легочной ткани, расцененные как внебольничная полисегментарная пневмония. В терапевтическом стационаре по месту жительства проведено лечение антибиотиками в течение 14 дней, однако общее состояние не улучшилось, при контрольной рентгенографии легких определялось увеличение размеров теней и появление воздухсодержащих полостей. Больная направлена на консультацию к пульмонологу, в ходе дополнительного обследования обнаружены антитела к ВИЧ, назначен повторный курс терапии ровамицином и флуконазолом в течение 10 дней амбулаторно. По окончании лечения в связи с нарастающей одышкой вновь госпитализирована в терапевтический стационар, где сразу была начата антиретровирусная терапия (АРТ) – тенофовир, эмтрицитабин, долутегравир. Одновременно пациентка консультирована фтизиатром, для дальнейшего обследования и лечения переведена в противотуберкулезное отделение РКТБ.
При поступлении общее состояние средней тяжести, выражена астенизация, питание понижено. Температура тела 38,5 °С. Кожа и видимые слизистые чистые, бледные. Пальпируются подвижные, эластичные, безболезненные заднешейные лимфоузлы до 0,5 см в виде цепочки, подмышечные – до 1,0 см. ЧДД – 20 в минуту. Над легкими выслушивается ослабленное дыхание, слева книзу от угла лопатки – нежные мелкопузырчатые хрипы. Сатурация кислорода – 95–96%. Частота сердечных сокращений (ЧСС) – 90 уд/мин, АД – 115/70 мм рт. ст. Остальные данные без особенностей.
В отделении обследована. При СКТ органов грудной клетки (рис. 4, а) в легких определялось выраженное усиление легочного рисунка за счет интерстициального компонента с наличием множественных мелкоочаговых уплотнений легочной ткани и участков «матового стекла»», в S3 слева – воздухсодержащая многокамерная полость размерами 72×63×45 мм с толстыми неравномерно инфильтрированными стенками. В средостении – единичные мелкие парааортальные лимфоузлы до 5–6 мм в диаметре.

В мокроте методом микроскопии и GeenXpert MBT/Rif МБТ не обнаружены, в дальнейшем на питательных средах роста культуры МБТ не получено.
В крови: эритроциты – 4,5 Т/л, Нb – 143 г/л, цветовой показатель – 0,97, лейкоциты – 9,1 г/л, палочкоядерные нейтрофилы – 1%, сегментоядерные нейтрофилы – 89%, эозинофилы – 1%, лимфоциты – 8%, (абсолютное число – 720 кл/мкл), моноциты – 1%, СОЭ – 17 мм/ч. Биохимические показатели (содержание общего белка, мочевины, креатинина, билирубина, глюкозы, активность трансаминаз, тимоловая проба) – в пределах физиологической нормы. Содержание CD4 в крови –
10 кл/мкл (0,98%), вирусная нагрузка – 2730 РНК-копий/мл. В моче – протеинурия до 0,32 г/л, эритроциты – 0-0-1 в поле зрения, лейкоциты – до 30 в поле зрения, единичные гиалиновые цилиндры.
Больной выставлен предварительный диагноз диссеминированного туберкулеза легких, начато лечение препаратами 1-го ряда (изониазид, рифампицин, пиразинамид, этамбутол) на фоне патогенетической терапии и профилактики оппортунистических инфекций (бисептол, флуконазол, азитромицин). Продолжена АРТ по прежней схеме.
На фоне лечения состояние оставалось тяжелым, сохранялись лихорадка, кашель, одышка. На 5-й день пребывания в отделении возникло легочное кровотечение, остановленное консервативно. Через неделю от момента поступления с учетом результатов обследования и анализа клинико-рентгенологической картины наличие активного туберкулеза было подвергнуто сомнению, больной выставлен диагноз грибковой пневмонии, не исключался инвазивный аспергиллез. Противотуберкулезные препараты были отменены, в лечебных дозах назначены бисептол, флуконазол, итраконазол на фоне дезинтоксикационной и патогенетической терапии, продолжена АРТ. В результате через 4 дня нормализовалась температура тела, уменьшились слабость и одышка. Затем состояние резко ухудшилось: после приступа сильного кашля возникла боль в левой половине грудной клетки, стала нарастать одышка, дыхание над левым легким не прослушивалось, сатурация кислорода снизилась до 65%. Диагностирован спонтанный пневмоторакс, выполнена СКТ: левое легкое полностью коллабировано, фиксировано спайками в нижнем отделе, в правом легком – нарастание интерстициальных изменений, появление в S1-2 воздухсодержащей полости до 36 мм в диаметре (рис. 4, б).
Больная переведена в отделение интенсивной терапии, выполнено дренирование левой плевральной полости. Несмотря на проводимое лечение, состояние прогрессивно ухудшалось и при нарастающих явлениях дыхательной недостаточности наступила смерть.
На аутопсии признаков туберкулеза выявлено не было. В верхних долях легких обнаружены множественные полостные образования (абсцессы) с внутренним содержимым грязно-болотного цвета, распад и вскрытие полости абсцесса с развитием бронхоплеврального свища (рис. 5, а).
Гистологически в препарате легочной ткани определялось большое количество характерных септированных гифов с дихотомичным делением под острым углом (рис. 5, б). Полученные данные позволили верифицировать диагноз легочного аспергиллеза.
В представленном случае у ВИЧ-инфицированной пациентки аспергиллез носил генерализованный характер с диффузным поражением легочной ткани. На КТ легких это отражалось усилением интерстициального компонента, наличием множественных узелковых образований и участков снижения прозрачности по типу матового стекла. Течение заболевания отличалось отрицательной клинико-рентгенологической динамикой на фоне противотуберкулезной и антибактериальной терапии, но положительным клиническим эффектом от противогрибковых препаратов, что, однако, не предотвратило развитие спонтанного пневмоторакса, послужившего непосредственной причиной смерти.
Таким образом, у больных, не инфицированных ВИЧ, постановка диагноза аспергиллеза легких не вызывала значительных затруднений и осуществлялась согласно рекомендованным критериям. У данной категории пациентов в качестве важных моментов для дифференциальной диагностики с туберкулезом мы бы выделили быструю рентгенологическую динамику образования тонкостенных полостей в легких, стойкое отсутствие МБТ в мокроте при наличии полостных образований, характерную картину аспергиллеза на КТ с наличием плотных масс грибного мицелия внутри полости.
У ВИЧ-инфицированных лиц дифференциальная диагностика аспергиллеза была затруднена из-за острого течения, генерализованного характера с развитием синдрома диссеминации, образования полостей без плотного содержимого внутри, что делало заболевание похожим на туберкулез. Отсутствие грибного мицелия в полостях у ВИЧ-инфицированных лиц мы объясняли неблагоприятным течением аспергиллеза с быстрым наступлением летального исхода до момента формирования мицетомы. Важным дифференциально-диагностическим критерием можно считать развитие микоза при глубокой иммуносупрессии (в наших случаях у всех трех больных уровень CD4 был менее 30 кл/мкл), при этом содержание CD4 более 200 кл/мкл не исключает туберкулез, но ставит под сомнение диагноз инвазивного аспергиллеза. Туберкулезному процессу противоречит также отсутствие МБТ в мокроте при наличии полостей, а также выраженные интерстициальные изменения в легочной ткани, выявляемые при СКТ. Для своевременной диагностики аспергиллеза легких необходима микологическая и серологическая верификация возбудителя, проведение которой в условиях ДНР на сегодняшний момент невозможно из-за ограниченных ресурсов. Особую актуальность приобретает своевременное выявление ВИЧ-инфекции и начало АРТ, что позволит предотвратить развитие тяжелых иммунодефицитов и опасных для жизни оппортунистических инфекций.
Информация об авторе
Information about the author
Корж Елена Владимировна – д-р мед. наук, проф. каф. фтизиатрии и пульмонологии, ФГБОУ ВО «Донецкий государственный медицинский университет им. М. Горького», врач-фтизиатр туберкулезно-легочного отделения для взрослых №1, Республиканская клиническая туберкулезная больница.
Е-mail: Korzh191061@mail.ru; ORCID: 0000-0003-0571-9666
Elena V. Korzh – Dr. Sci. (Med.), Prof., Gorky Donetsk State Medical University; Phthisiologist, City Tuberculosis Hospital.
Е-mail: Korzh191061@mail.ru; ORCID: 0000-0003-0571-9666
Поступила в редакцию: 03.02.2025
Поступила после рецензирования: 07.02.2025
Принята к публикации: 13:02.2025
Received: 03.02.2025
Revised: 07.02.2025
Accepted: 13:02.2025
Список исп. литературыСкрыть список1. Николаева Н.Г., Шадривова О.В., Ицкович И.Э., Климко Н.Н. Хронический аспергиллез легких: обзор литературы и демонстрация собственных наблюдений. Вестник рентгенологии и радиологии. 2021; 102(5):317-328. DOI: 10.20862/0042-4676-2021-102-5-317-328
Nikolaeva N.G., Shadrivova O.V., Itskovich I.E., Klimko N.N. Chronic pulmonary aspergillosis: a review of the literature and a demonstration of their own observations. Bulletin of Radiology and Radiology. 2021; 102(5):317-328. DOI: 10.20862/0042-4676-2021-102-5-317-328 (in Russian).
2. Смирнова А.С. Аспергиллез легких в гериатрической практике. Клиническая геронтология. 2019;(3-4):4-14. DOI: 10.26347/1607-2499201903-04004-009
Smirnova A.S. Aspergillosis of the lungs in geriatric practice. Clinical gerontology. 2019;(3-4):4-14. DOI: 10.26347/1607-2499201903-04004-009 (in Russian).
3. Denning DW, Page ID, Chakaya J et al. Case Definition of Chronic Pulmonary Aspergillosis in Resource-Constrained Settings. Emerg Infect Dis 2018;24(8):171312. DOI: 10.3201/eid2408.171312
4. Dan Li, Liang Chen, Xian Ding et al. Hospital-acquired invasive pulmonary aspergillosis in patients with hepatic failure. 2008; BMC Gastroenterol 2008;8(1):32. DOI: 10.1186/1471-230X-8-32
5. Романова Е.И., Красавцев Е.Л., Тарасенко С.В. Генерализованный аспергиллез на фоне IV клинической стадии ВИЧ-инфекции. Проблемы здоровья и экологии. 2018;56(2):89-94.
Romanova E.I., Krasavtsev E.L., Tarasenko S.V. Generalized aspergillosis in the IV clinical stage of HIV infection. Health and environmental issues. 2018;56(2):89-94 (in Russian).
6. Tsitsikas DA, Amelie Morin, Shamzah Araf et al. EORTC/MSG definitions for invasive fungal disease on the rates of diagnosis of invasive aspergillosis. Medical mycology: official publication of the International Society for Human and Animal Mycology. Source PubMed 2011;50(5):538-42. DOI: 10.3109/13693786.2011.630040
7. Минскер О.Б. Пневмомикозы. В кн. Болезни органов дыхания. Руководство для врачей в 4-х томах. Под ред. акад. Н.Р. Палеева. Т. 2. Частная пульмонология. М.: Медицина, 1989. С. 215-226.
Minsker O.B. Pneumomycosis. In: Respiratory diseases. A guide for doctors in 4 volumes. Edited by Academician N.R. Paleeva. Vol. 2. Private pulmonology. Moscow: Medicine, 1989. Pp. 215-226 (in Russian).
8. Малиновский В.В. Клинико-морфологические особенности первичного аспергиллеза легких (наблюдение из практики). Проблемы здоровья и экологии. 2006;10(4):139-42.
Malinovsky V.V. Clinical and morphological features of primary pulmonary aspergillosis (observation from practice). Health and environmental issues. 2006;10(4):139-42 (in Russian).
9. Chang Ming Shen, Gao Feng Qiao, Cheng Wang et al. Outcomes of surgery for different types of chronic pulmonary aspergillosis: results from a single-center, retrospective cohort study. BMC Pulmonary Medicine 2022;Article number: 40. DOI: 10.1186/s12890-022-01836-z
10. Lortholary O, Meyohas MC, Dupont B et al. Invasive aspergillosis in patients with acquired immunodeficiency syndrome: report of 33 cases. French Cooperative Study Group on Aspergillosis in AIDS. Am J Med 1993;95(2):177-87. DOI: 10.1016/0002-9343(93)90258-q
11. Климко Н.Н., Шадривова О.В., Хостелиди С.Н. и др. Инвазивный аспергиллез: результаты многоцентрового исследования. Онкогематология. 2014;(2):13-19.
Klimko N.N., Shadrikova O.V., Didi S.N. and others. Invasive aspergillosis: results of a multicenter study. Oncohematology. 2014;(2):13-19 (in Russian).
12. Denning DW, Cadranel J, Beigelman-Aubry C et al. European Society for Clinical Microbiology and Infectious Diseases and European Respiratory Society. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J 2016;47(1):45-68. DOI: 10.1183/13993003.00583-2015. PMID: 26699723.
13. De Pauw B, Walsh TJ, Donnelly JP et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46(12):1813-1821. DOI: 10.1086/588660
14. Клясова Г.А., Масчан А.А., Веселов А.В. Лечение инвазивного аспергиллеза легких на основании рекомендаций американского общества по инфекционным болезням. Онкогематология. 2008;(1-2):47-57.
Klyasova G.A., Maschan A.A., Veselov A.V. Treatment of invasive pulmonary aspergillosis based on the recommendations of the American Society for Infectious Diseases. Oncohematology. 2008;(1-2):47-57 (in Russian).
15. Митрофанов В.С., Чернопятова Р.М. Аспергиллемы легких. Проблемы медицинской микологии. 2000;(4):13-20.
Mitrofanov V.S., Chernopyatova R.M. Aspergillomas of the lungs. Problems of medical mycology. 2000;(4):13-20 (in Russian).
16. Page ID, Byanyima R, Hosmane S et al. Chronic pulmonary aspergillosis commonly complicates treated pulmonary tuberculosis with residual cavitation. Eur Respir J 2019;53(3):1801184. DOI: 10.1183/ 13993003.01184-2018
17. Pfeiffer CD, Fine JP, Safdar N. Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis. Clin Infect Dis 2006;42:1417.
18. Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax 2015;70(3):270-7. DOI: 10.1136/thoraxjnl-2014-206291
19. He B, Wan C, Zhou W et al. Clinical profile and surgical outcome for different types of chronic pulmonary aspergillosis. Am J Transl Res 2019; 11(6):3671-79. PMID: 31312378; PMCID: PMC6614639.

