Клинический разбор в общей медицине №3 2025
Клинический разбор в общей медицине №3 2025
Клинический случай гранулематоза Вегенера
Номера страниц в выпуске:97-101
Аннотация
В статье представлен клинический случай гранулематоза Вегенера у 4-летнего ребенка. Описаны проведенные анализы, методы диагностики и терапия. Этот случай может послужить полезным ориентиром для специалистов в диагностике данной патологии, выборе методов лечения и ведения пациента.
Ключевые слова: гранулематоз Вегенера, системный васкулит, дети, клиника, диагностика, лечение.
Для цитирования: Сережкина А.В., Савельева Ю.Е., Разинькова Н.С., Миненкова Т.А., Сентищева Е.А., Хмелевская И.Г. Клинический случай гранулематоза Вегенера. Клинический разбор в общей медицине. 2025; 6 (3): 97–101. DOI: 10.47407/kr2024.6.3.00586
В статье представлен клинический случай гранулематоза Вегенера у 4-летнего ребенка. Описаны проведенные анализы, методы диагностики и терапия. Этот случай может послужить полезным ориентиром для специалистов в диагностике данной патологии, выборе методов лечения и ведения пациента.
Ключевые слова: гранулематоз Вегенера, системный васкулит, дети, клиника, диагностика, лечение.
Для цитирования: Сережкина А.В., Савельева Ю.Е., Разинькова Н.С., Миненкова Т.А., Сентищева Е.А., Хмелевская И.Г. Клинический случай гранулематоза Вегенера. Клинический разбор в общей медицине. 2025; 6 (3): 97–101. DOI: 10.47407/kr2024.6.3.00586
Clinical Case
Elena A. Sentishcheva2, Irina G. Khmelevskaya1
1 Kursk State Medical University, Kursk, Russia;
2 Southwest State University, Kursk, Russia
yulia200204@mail.ru
Abstract
The article presents a clinical case of Wegener's granulomatosis in a 4-year-old child. The conducted analyses, diagnostic methods and therapy are described. This case can serve as a useful guideline for specialists in the diagnosis of this pathology, the choice of treatment methods and patient management.
Keywords: Wegener's granulomatosis, systemic vasculitis, children, clinic, diagnosis, treatment.
For citation: Serezhkina A.V., Savelyeva Yu.E., Razinkova N.S., Minenkova T.A., Sentishcheva E.A., Khmelevskaya I.G. A clinical case of Wegener's granulomatosis. Clinical review for general practice. 2025; 6 (3): 97–101 (In Russ.). DOI: 10.47407/kr2024.6.3.00586
Термин «системный васкулит» охватывает разнородную группу заболеваний, характеризующихся развитием воспалительного процесса кровеносных сосудов, возникающим de novo (например, узелковый полиартериит) или как вторичный признак таких заболеваний, как ревматоидный артрит и системная красная волчанка. Исход заболевания во многом зависит от диаметра пораженных сосудов, и из-за сходства симптомов используют общее собирательное понятие «системный некротизирующий артериит» [1]. Эта группа заболеваний, включая гранулематоз Вегенера (ГВ), несколько десятилетий назад обычно приводила к летальному исходу, однако и в наши дни в данной категории заболеваний отмечается наибольшая частота расхождений в постановке диагноза, так часто происходит на этапе дебюта патологии по причине синдромального сходства, появления неспецифических признаков и маскировки под другие заболевания. Это усложняет алгоритм диагностики и задерживает начало патогенетической терапии, что в дальнейшем может стать причиной развития осложнений [2].
H. Klinger, будучи студентом-медиком, впервые дал характеристику новому заболеванию в 1931 г. В это время он описал два клинических случая, в которых сообщил об умерших от сепсиса пациентах, которые страдали генерализованным воспалением сосудов. Через 5 лет F. Wegener наблюдал аналогичную картину у трех пациентов, у которых обнаружил некротизирующие гранулемы, поражающие дыхательные пути. Вегенер описал заболевание как совокупность нескольких проявлений, среди которых некротическое гранулематозное воспаление дыхательных путей, некротический гломерулонефрит и системный васкулит мелких артерий и вен [3].
Этиология данного заболевания неясна, однако в качестве возможных факторов, запускающих аутоиммунный васкулит на фоне генетической предрасположенности, рассматриваются вирусные и бактериальные инфекции. Определены следующие генотипические ассоциации, связанные с ГВ: наличие дефектного аллеля гена альфа-1 антитрипсина; полиморфизм гена CTLA-4, который играет роль в активации Т-лимфоцитов; аллель PTPN22*620W, ассоциирующийся с положительным статусом ANCA и способствующий активации Т-лимфоцитов; аллель DPB1*0401; а также определенные формы рецептора Fcy IIIb на поверхности нейтрофилов и макрофагов. Исследования показывают значимость микробов и вирусов в патогенезе ГВ. Например, установлено, что носительство золотистого стафилококка связано с частыми рецидивами ГВ, и профилактическая терапия против него может значительно уменьшить риск повторения. К факторам риска также относят жизнь в северных регионах, занятие сельским хозяйством, применение определенных медикаментов, а также загрязнение окружающей среды и контакт с растворителями и кремнеземом [4].
Истинный механизм патогенеза до сих пор остается предметом для исследований, однако известны его ключевые особенности. Воспаленные или некротизированные сосуды организуются в полиморфные гранулемы, содержащие лейкоциты, лимфоциты и гигантские клетки. Известно, что васкулит поражает преимущественно сосуды малого и среднего размера, а также капилляры. В зависимости от стадии заболевания преобладание гранулем и васкулитных элементов может меняться. Часто на ранней стадии заболевания преобладают гранулемы, на поздней – более выражен васкулит.
Вовлечение верхних дыхательных путей и легких в гранулематозное воспаление позволяет предположить, что ГВ может быть вызван аномальным клеточно-опосредованным иммунным ответом на экзогенный или даже эндогенный антиген, который проникает в дыхательные пути или находится в них. Кроме того, развитие ГВ тесно связано с аутоантителами, которые распознают специфические цитоплазматические белки нейтрофилов, что позволяет предположить, что аномалии гуморального иммунитета также играют роль в патогенезе.
Т-клеточный опосредованный иммунитет отвечает за выработку и высвобождение провоспалительных цитокинов, таких как фактор некроза опухоли-α и интерферон-γ, которые стимулируют поверхностную экспрессию антигенов на активированных нейтрофилах. Среди этих антигенов есть протеиназа 3 (PR3) и миелопероксидаза, которые являются мишенями для c (цитоплазматических) и p (перинуклеарных) ANCA (антинуклеарных цитоплазматических антител) соответственно. PR3-ANCA – это преобладающее аутоантитело, обнаруживаемое у пациентов с ГВ, которое присутствует более чем у 90% пациентов с активной формой заболевания [5]. Таким образом, взаимодействие ANCA с их антигенами вызывает дегрануляцию нейтрофилов и образование токсичных продуктов, что приводит к повреждению тканей и сосудов [6].
ВГ может развиться в любом возрасте. Примерно 15% пациентов моложе 19 лет, лишь в редких случаях заболевание проявляется до подросткового возраста; средний возраст начала заболевания составляет примерно 40 лет. ВГ в равной степени поражает мужчин и женщин. Отмечаются сезонные колебания заболеваемости, при этом чаще всего болезнь проявляется в зимние месяцы.
Большинство пациентов обращаются за медицинской помощью из-за симптомов со стороны верхних и нижних дыхательных путей (90%), которые часто сопровождаются общими симптомами: усталостью, лихорадкой или болью в суставах (артралгия). У пациентов часто наблюдаются серьезные нарушения со стороны верхних дыхательных путей, такие как боль и выделения из околоносовых пазух, а также гнойные или кровянистые выделения из носа с изъязвлением слизистой оболочки носа. Может произойти перфорация носовой перегородки, а также эрозия носового хряща, что приводит к деформации носа.
Поражение легких наблюдается в 85–90% случаев и проявляется клинически в виде кашля, кровохарканья (гемоптизиса), одышки (диспноэ) и дискомфорта в груди. При первичном обследовании только у 12–18% пациентов наблюдается гломерулонефрит, однако в конечном итоге он развивается примерно в 80% случаев. Гломерулонефрит часто прогрессирует быстро и, если его не лечить, в большинстве случаев приводит к необратимой почечной недостаточности. Помимо дыхательных путей и почек, ВГ может поражать практически любую систему органов [5].
ГВ обычно подозревают только в том случае, если у пациента в течение длительного времени наблюдаются характерные симптомы. Лабораторное определение ANCA может помочь в постановке диагноза, однако положительный результат не является определяющим в постановке диагноза, а отрицательный не позволяет исключить заболевание. PR3-ANCA – высокоспецифичный признак ГВ.
Если у пациента почечная недостаточность или кожный васкулит, то наиболее логичным местом для взятия биопсии являются эти органы. В редких случаях требуется торакоскопическая биопсия легких. При гистопатологическом исследовании биопсии обнаруживаются лейкоцитокластические васкулиты с некротическими изменениями и гранулематозным воспалением (скоплениями типично расположенных лейкоцитов) при микроскопическом исследовании. Гранулемы являются основной причиной, по которой заболевание называют «гранулематозом Вегенера», хотя это не является обязательным признаком. К сожалению, многие биопсии могут быть неспецифическими, и в 50% случаев они дают слишком мало информации для постановки диагноза [7].
Дифференциальная диагностика обширна. Антитела к ядерным антигенам могут быть положительными после приема некоторых препаратов, а другие формы васкулита могут проявляться очень похожими симптомами. Деформация носа также наблюдается при рецидивирующем полихондрите, злоупотреблении кокаином и врожденном сифилисе.
В 1990 г. Американский колледж ревматологии принял классификационные критерии ГВ. Эти критерии предназначались не для диагностики, а для включения в рандомизированные контролируемые исследования. Два или более положительных критерия имеют чувствительность 88,2% и специфичность 92,0% при описании ГВ:
• воспаление носа или полости рта: язвы во рту или гнойные, кровянистые выделения из носа;
• легкие: аномальная рентгенография грудной клетки с узелками, инфильтратами или полостями;
• почки: осадок мочи с микрогематурией;
• биопсия: гранулематозное воспаление в стенке артерии или в периваскулярной области.
Согласно Консенсусной конференции в Чапел-Хилл (Chapel Hill Consensus Conference – CHCC) по номенклатуре системных васкулитов (1992 г.) для постановки диагноза ГВ необходимо наличие гранулематозного воспаления, затрагивающего дыхательные пути, и васкулита мелких и средних сосудов [1].
Цель исследования – изучение клинического течения и лечения клинического случая ГВ у ребенка.
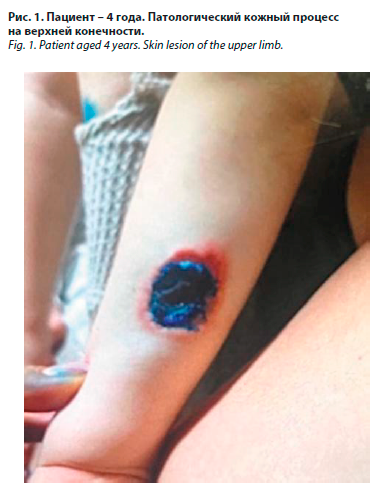 Девочка, 4 года, находилась на плановой госпитализации в отделении дерматовенерологии РДКБ с 15.09.2024 по 15.09.2024. В связи с положительным результатом ПЦР-диагностики на SARS-CoV-2 госпитализирована в отделение РДКБ для детей с новой коронавирусной инфекцией, не нуждающихся в искусственной вентиляции легких. Раннее физическое развитие: с отставанием роста и массы. Раннее нервно-психическое развитие: с задержкой психо-речевого.
Девочка, 4 года, находилась на плановой госпитализации в отделении дерматовенерологии РДКБ с 15.09.2024 по 15.09.2024. В связи с положительным результатом ПЦР-диагностики на SARS-CoV-2 госпитализирована в отделение РДКБ для детей с новой коронавирусной инфекцией, не нуждающихся в искусственной вентиляции легких. Раннее физическое развитие: с отставанием роста и массы. Раннее нервно-психическое развитие: с задержкой психо-речевого.
Жалобы при поступлении на язвенные высыпания на коже (рис. 1), выраженные моторные нарушения, неуверенность походки, редкий влажный кашель, бледность, задержку психо-речевого развития, периодически – повышение температуры тела.
Впервые высыпания в области голеней появились в возрасте 6–7 мес. Осмотрена дерматологом в Кожно-венерологическом диспансере, диагноз выставлен не был, высыпания в течение нескольких месяцев прошли самостоятельно. На фоне терапии ингаляционными глюкокортикоидами отмечалась положительная динамика, но нестойкая.
Второй эпизод высыпаний – в 1,5–1,7 года (длится по настоящее время). Получено направление на прием к педиатру. Девочка неоднократно консультирована различными специалистами: иммунологами, дерматологами, гематологами. Обследована амбулаторно: были положительны результаты анализов на антитела к цитомегаловирусу и капсидный белок вируса Эпштейна–Барр. Показатели биохимического анализа крови были следующими: повышение трансаминаз, лактатдегидрогеназы, С-реактивного белка до 32 мг/л. Рекомендована консультация иммунолога с целью исключения иммунодефицита. Показатели представлены не в полном объеме: IgA – 0,27 Ед/мл, IgM – 1,92 Ед/мл, IgG – 8,10 Ед/мл. Со слов мамы, находилась на стационарном лечении с диагнозом: правосторонняя пневмония. От дальнейшего лечения в стационаре мама отказалась, получала амбулаторно Беродуал и Пульмикорт.
В 2024 г., аллерголог на приеме услышал хрипы в легких, направил в стационар. 18.01.2024, направлена в инфекционную больницу (ОКИБ), где находилась с 18.01.2024 по 09.02.2024 с диагнозом: инфекция Эпштейна–Барр; вирус простого герпеса человека б типа; острый назофарингит; афтозный стоматит; реактивный гепатит; двусторонняя полисегментарная внебольничная пневмония, средней степени тяжести, острое течение ДНО ст.; синдром ВИД. Выписана с незначительной положительной динамикой на амбулаторное лечение, так как мать ребенка отказалась от дальнейшего лечения в стационаре. На рентгене грудной клетки от 09.02.2024 – признаки двухсторонней полисегментарной пневмонии, более выраженной справа с ателектатическим компонентом, с некоторой положительной динамикой, за счет уменьшения интенсивности инфильтрации легочной ткани. Ребенок консультирован в ДКДЦ аллергологом-иммунологом 12.02.2024. Направлен в 4-е отделение КОДКБ для лечения пневмонии. В стационаре впервые выставлен диагноз: лихорадочный нейтрофильный дерматоз Свита.
Первая госпитализация в РДКБ – апрель 2024 г. – после осмотра выставлен предварительный диагноз дерматоза Свита и ребенок переведен в отделение РПХ для проведения биопсии кожи. По результатам биопсии диагноз был изменен на гранулематозный дерматит в пределах первичного иммунодефицита.
Вторая госпитализация в РДКБ – июнь 2024 г. Ребенок поступил с выраженным обострением кожного и легочного процесса, интоксикацией. Проведенное обследование и терапия привели к улучшению состояния ребенка. Решение консилиума от 08.07.2024: на основании клинико-анамнестических данных, у ребенка с интерстициальным гранулематозным дерматитом необходимо исключить врожденную аномалию иммунной системы – аутовоспалительный синдром или первичный иммунодефицит. С целью дообследования необходимо проведение:
• иммунофенотипирования лимфоцитов (с определением Т- и В-клеток памяти);
• секвенирование экзома.
В плане терапии рекомендовано:
1) продолжение терапии внутривенными иммуноглобулинами (ВВИГ) в дозе 0,4 г/кг 1 раз в 7 дней №3–4;
2) смена антибактериальной терапии на основании данных бактериологического исследования: меропенем 100 мг/кг/сут в два введения внутривенно капельно + ЦС в дозировке 30 мг/кг/сут в два приема перорально;
3) продолжить терапию дапсоном в дозировке
1,5 мг/кт/сут в два приема;
4) при недостаточном эффекте – добавить к проводимой терапии тофацитиниб в дозировке 5 мг/сут в два приема перорально;
5) при нарастании признаков аутовоспаления – генно-инженерная биологическая терапия ингибиторами интерлейкина 1 (анакинрой).
Третья госпитализация – в июле 2024 г. – ребенок госпитализирован для проведения второго этапа терапии – введения ВВИГ. Процедуру перенесла хорошо, отмечается положительная динамика по кожному и соматическому состоянию.
Четвертая госпитализация – в июле 2024 г. – сдана кровь на секвенирование экзома. Учитывая недостаточный клинический эффект от проводимой терапии и некоторое ухудшение кожного процесса, к проводимой терапии добавлен тофацитиниб в дозировке 5 мг/сут.
Пятая госпитализация – в июле 2024 г., шестая в августе 2024 г. – ребенок госпитализирован для введения ВВИГ. Процедуру перенесла хорошо, отмечается положительная динамика по кожному и соматическому состоянию.
Поступает в отделение дерматологии повторно для продолжения обследования и коррекции терапии.
Во время осмотра выявлены единичные сухие свистящие хрипы, влажные мелкопузырчатые хрипы справа в области верхней доли, аускультативно дыхание жесткое, проводится неравномерно, отмечается незначительное ослабление справа спереди, наблюдается бронхиальное дыхание справа сзади. Притупление перкуторного звука в области верхней доли справа. Задержка психо-речевого развития, рефлексы заторможенные. Отмечаются постоянные хореяподобные моторные гиперкинезы, затрагивающие голову, руки, туловище, ноги. Походка неуверенная. Визуальный контакт поддерживается с трудом – невозможность длительной фиксации взора, вербальный контакт невозможен – задержка речевого развития.
Патологический кожный процесс подостровоспалительного характера, распространенный, симметричный, локализован на коже ягодиц, верхних и нижних конечностей. Представлен множественными узлами и бляшками размерами 0,5–2 см ярко-розового цвета с ровными четкими краями, плотной консистенции. На поверхности отдельных бляшек – корки и эрозии.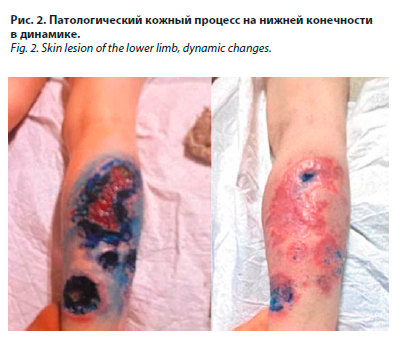 Также на коже голеней и предплечий отмечаются язвенные высыпания на разных стадиях эпителизации. Язвы с ровными гладкими краями, дно покрыто грануляциями и скудным серозно-гнойным отделяемым (рис. 2). На коже лица (щеках преимущественно) отмечаются единичные линейные телеангиэктазии. Вне очагов кожа повсеместно истончена, сухая, эластичность снижена. Ногти и волосы истончены.
Также на коже голеней и предплечий отмечаются язвенные высыпания на разных стадиях эпителизации. Язвы с ровными гладкими краями, дно покрыто грануляциями и скудным серозно-гнойным отделяемым (рис. 2). На коже лица (щеках преимущественно) отмечаются единичные линейные телеангиэктазии. Вне очагов кожа повсеместно истончена, сухая, эластичность снижена. Ногти и волосы истончены.
Назначено – стол г/a, антибактериальная терапия: азитромиции 10 мг/кг/доза 3 раза в неделю, ВВИГ 0,4 г/кг/доза №1 – 5500 мг инфузионно, тофацитиниб 2,5 мг 2 раза в день, урсодезоксихолевая кислота 200 мг 1 раз в день, ингаляции через небулайзер: будесонид 250 мкг 2 раз в день, Беродуал 10 капель 2 раза в день, амброксол 1,0 мл 2 раза в день; физиологический раствор 3,0 мл 2 раза в день. На фоне проводимой терапии отмечена положительная динамика.
Было рекомендовано исключить из рациона ребенка цельное молоко (при необходимости заменить на безлактозную смесь), ограничить употребление газообразующих продуктов, шоколада, консервированных, копченых и маринованных продуктов, питаться не реже 5 раз в день, после еды не принимать горизонтальное положение минимум 30 мин; обязательное обследование всех членов семьи (мама, папа, сиблинги) на носительство мутации в гене АТМ, соблюдать строго охранительный режим, кожу не травмировать, не ходить в открытой одежде, полностью исключить контакт ребенка с животными, почвой, открытыми водоемами; наблюдение специалистами по месту жительства: педиатр – 1 раз в 7 дней, пульмонолог – 1 раз в 14 дней, гастроэнтеролог – 1 раз в 30 дней. Учитывая тяжесть заболевания, нарушающего качество жизни ребенка, а также торпидность к проводимой терапии, рекомендовано в амбулаторных условиях продолжить терапию тофацитинибом в дозировке 2,5 мг 2 раза в день до следующей госпитализации. Весь период терапии контролировать основные показатели крови. Сопроводительная медикаментозная терапия: азитромицин 10 мг/кг/доза (130 мг) – три раза в неделю, при недостаточной эффективности и ухудшении состояния легких – рассмотреть вопрос о назначении ципрофлоксацина, дапсон 12,5 мг 2 раза в день, холекальциферол по 1000 МЕ 1 раз в день, урсодезоксихолевая кислота 250 мг 1 раз в день, аминофенилмасляная кислота по 125 мг 3 раза в день – до следующей госпитализации. Ингаляционная терапия – до следующей госпитализации: будесонид (Пульмикорт или Буденокорт), ипратропия бромид, фенотерол (Беродуал). Необходимо обрабатывать кожу ежедневно водным раствором 1% метиленовой синьки, порошком Банеоцин, затем нанести атравматическую сетку (на выбор): Атрауман, Атрауман Ag/Atrauman, Бранолинд Н, Васкопран, ФиброТюль, закрыть кожу трубчатым бинтом Tubifast.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сережкина Александра Владимировна – ассистент каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: aleksandra.ykv@gmail.com;
ORCID: 0000-0002-0283-2498
Aleksandra V. Serezhkina – Assistant, Kursk State Medical University. E-mail: aleksandra.ykv@gmail.com; ORCID: 0000-0002-0283-2498
Савельева Юлия Евгеньевна – студентка 5-го курса лечебного факультета, ФГБОУ ВО КГМУ. E-mail: yulia200204@mail.ru;
ORCID: 0009-0009-0747-0404
Yulia E. Savelyeva – 5th year student, Kursk State Medical University. E-mail: yulia200204@mail.ru; ORCID: 0009-0009-0747-0404
Разинькова Наталья Сергеевна – канд. мед. наук, доц. каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: nrazin79@ya.ru; ORCID: 0000-0001-7711-8865
Natalia S. Razinkova – Cand. Sci. (Med.), Assoc. Prof., Kursk State Medical University. E-mail: nrazin79@ya.ru; ORCID: 0000-0001-7711-8865
Миненкова Татьяна Александровна – канд. мед. наук, ассистент каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: minenkovata@mail.ru; ORCID: 0000-0001-5099-4734
Tatiana A. Minenkova – Cand. Sci. (Med.), Assistant, Kursk State Medical University. E-mail: minenkovata@mail.ru; ORCID: 0000-0001-5099-4734
Сентищева Елена Александровна – канд. психол. наук, ст. преподаватель каф. международных отношений и государственного управления, ФГБОУ ВО «Юго-Западный государственный университет». E-mail: elenasentischeva@yandex.ru; ORCID: 0000-0003-3769-0490
Elena A. Sentishcheva – Dr. Sci. (Psychol.), Senior Lecturer, Southwest State University. E-mail: elenasentischeva@yandex.ru; ORCID: 0000-0003-3769-0490
Хмелевская Ирина Григорьевна – д-р мед. наук, проф., зав. каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: KhmIG@ya.ru; ORCID: 0000-0003-2621-0180
Irina G. Khmelevskaya – Dr. Sci. (Med.), Full Prof., Kursk State Medical University. E-mail: KhmIG@ya.ru; ORCID: 0000-0003-2621-0180
Поступила в редакцию: 22.01.2025
Поступила после рецензирования: 23.01.2025
Принята к публикации: 30.01.2025
Received: 22.01.2025
Revised: 23.01.2025
Accepted: 30.01.2025
A clinical case of Wegener's granulomatosis
Aleksandra V. Serezhkina1, Yulia E. Savelyeva1, Natalia S. Razinkova1, Tatiana A. Minenkova1,Elena A. Sentishcheva2, Irina G. Khmelevskaya1
1 Kursk State Medical University, Kursk, Russia;
2 Southwest State University, Kursk, Russia
yulia200204@mail.ru
Abstract
The article presents a clinical case of Wegener's granulomatosis in a 4-year-old child. The conducted analyses, diagnostic methods and therapy are described. This case can serve as a useful guideline for specialists in the diagnosis of this pathology, the choice of treatment methods and patient management.
Keywords: Wegener's granulomatosis, systemic vasculitis, children, clinic, diagnosis, treatment.
For citation: Serezhkina A.V., Savelyeva Yu.E., Razinkova N.S., Minenkova T.A., Sentishcheva E.A., Khmelevskaya I.G. A clinical case of Wegener's granulomatosis. Clinical review for general practice. 2025; 6 (3): 97–101 (In Russ.). DOI: 10.47407/kr2024.6.3.00586
Термин «системный васкулит» охватывает разнородную группу заболеваний, характеризующихся развитием воспалительного процесса кровеносных сосудов, возникающим de novo (например, узелковый полиартериит) или как вторичный признак таких заболеваний, как ревматоидный артрит и системная красная волчанка. Исход заболевания во многом зависит от диаметра пораженных сосудов, и из-за сходства симптомов используют общее собирательное понятие «системный некротизирующий артериит» [1]. Эта группа заболеваний, включая гранулематоз Вегенера (ГВ), несколько десятилетий назад обычно приводила к летальному исходу, однако и в наши дни в данной категории заболеваний отмечается наибольшая частота расхождений в постановке диагноза, так часто происходит на этапе дебюта патологии по причине синдромального сходства, появления неспецифических признаков и маскировки под другие заболевания. Это усложняет алгоритм диагностики и задерживает начало патогенетической терапии, что в дальнейшем может стать причиной развития осложнений [2].
H. Klinger, будучи студентом-медиком, впервые дал характеристику новому заболеванию в 1931 г. В это время он описал два клинических случая, в которых сообщил об умерших от сепсиса пациентах, которые страдали генерализованным воспалением сосудов. Через 5 лет F. Wegener наблюдал аналогичную картину у трех пациентов, у которых обнаружил некротизирующие гранулемы, поражающие дыхательные пути. Вегенер описал заболевание как совокупность нескольких проявлений, среди которых некротическое гранулематозное воспаление дыхательных путей, некротический гломерулонефрит и системный васкулит мелких артерий и вен [3].
Этиология данного заболевания неясна, однако в качестве возможных факторов, запускающих аутоиммунный васкулит на фоне генетической предрасположенности, рассматриваются вирусные и бактериальные инфекции. Определены следующие генотипические ассоциации, связанные с ГВ: наличие дефектного аллеля гена альфа-1 антитрипсина; полиморфизм гена CTLA-4, который играет роль в активации Т-лимфоцитов; аллель PTPN22*620W, ассоциирующийся с положительным статусом ANCA и способствующий активации Т-лимфоцитов; аллель DPB1*0401; а также определенные формы рецептора Fcy IIIb на поверхности нейтрофилов и макрофагов. Исследования показывают значимость микробов и вирусов в патогенезе ГВ. Например, установлено, что носительство золотистого стафилококка связано с частыми рецидивами ГВ, и профилактическая терапия против него может значительно уменьшить риск повторения. К факторам риска также относят жизнь в северных регионах, занятие сельским хозяйством, применение определенных медикаментов, а также загрязнение окружающей среды и контакт с растворителями и кремнеземом [4].
Истинный механизм патогенеза до сих пор остается предметом для исследований, однако известны его ключевые особенности. Воспаленные или некротизированные сосуды организуются в полиморфные гранулемы, содержащие лейкоциты, лимфоциты и гигантские клетки. Известно, что васкулит поражает преимущественно сосуды малого и среднего размера, а также капилляры. В зависимости от стадии заболевания преобладание гранулем и васкулитных элементов может меняться. Часто на ранней стадии заболевания преобладают гранулемы, на поздней – более выражен васкулит.
Вовлечение верхних дыхательных путей и легких в гранулематозное воспаление позволяет предположить, что ГВ может быть вызван аномальным клеточно-опосредованным иммунным ответом на экзогенный или даже эндогенный антиген, который проникает в дыхательные пути или находится в них. Кроме того, развитие ГВ тесно связано с аутоантителами, которые распознают специфические цитоплазматические белки нейтрофилов, что позволяет предположить, что аномалии гуморального иммунитета также играют роль в патогенезе.
Т-клеточный опосредованный иммунитет отвечает за выработку и высвобождение провоспалительных цитокинов, таких как фактор некроза опухоли-α и интерферон-γ, которые стимулируют поверхностную экспрессию антигенов на активированных нейтрофилах. Среди этих антигенов есть протеиназа 3 (PR3) и миелопероксидаза, которые являются мишенями для c (цитоплазматических) и p (перинуклеарных) ANCA (антинуклеарных цитоплазматических антител) соответственно. PR3-ANCA – это преобладающее аутоантитело, обнаруживаемое у пациентов с ГВ, которое присутствует более чем у 90% пациентов с активной формой заболевания [5]. Таким образом, взаимодействие ANCA с их антигенами вызывает дегрануляцию нейтрофилов и образование токсичных продуктов, что приводит к повреждению тканей и сосудов [6].
ВГ может развиться в любом возрасте. Примерно 15% пациентов моложе 19 лет, лишь в редких случаях заболевание проявляется до подросткового возраста; средний возраст начала заболевания составляет примерно 40 лет. ВГ в равной степени поражает мужчин и женщин. Отмечаются сезонные колебания заболеваемости, при этом чаще всего болезнь проявляется в зимние месяцы.
Большинство пациентов обращаются за медицинской помощью из-за симптомов со стороны верхних и нижних дыхательных путей (90%), которые часто сопровождаются общими симптомами: усталостью, лихорадкой или болью в суставах (артралгия). У пациентов часто наблюдаются серьезные нарушения со стороны верхних дыхательных путей, такие как боль и выделения из околоносовых пазух, а также гнойные или кровянистые выделения из носа с изъязвлением слизистой оболочки носа. Может произойти перфорация носовой перегородки, а также эрозия носового хряща, что приводит к деформации носа.
Поражение легких наблюдается в 85–90% случаев и проявляется клинически в виде кашля, кровохарканья (гемоптизиса), одышки (диспноэ) и дискомфорта в груди. При первичном обследовании только у 12–18% пациентов наблюдается гломерулонефрит, однако в конечном итоге он развивается примерно в 80% случаев. Гломерулонефрит часто прогрессирует быстро и, если его не лечить, в большинстве случаев приводит к необратимой почечной недостаточности. Помимо дыхательных путей и почек, ВГ может поражать практически любую систему органов [5].
ГВ обычно подозревают только в том случае, если у пациента в течение длительного времени наблюдаются характерные симптомы. Лабораторное определение ANCA может помочь в постановке диагноза, однако положительный результат не является определяющим в постановке диагноза, а отрицательный не позволяет исключить заболевание. PR3-ANCA – высокоспецифичный признак ГВ.
Если у пациента почечная недостаточность или кожный васкулит, то наиболее логичным местом для взятия биопсии являются эти органы. В редких случаях требуется торакоскопическая биопсия легких. При гистопатологическом исследовании биопсии обнаруживаются лейкоцитокластические васкулиты с некротическими изменениями и гранулематозным воспалением (скоплениями типично расположенных лейкоцитов) при микроскопическом исследовании. Гранулемы являются основной причиной, по которой заболевание называют «гранулематозом Вегенера», хотя это не является обязательным признаком. К сожалению, многие биопсии могут быть неспецифическими, и в 50% случаев они дают слишком мало информации для постановки диагноза [7].
Дифференциальная диагностика обширна. Антитела к ядерным антигенам могут быть положительными после приема некоторых препаратов, а другие формы васкулита могут проявляться очень похожими симптомами. Деформация носа также наблюдается при рецидивирующем полихондрите, злоупотреблении кокаином и врожденном сифилисе.
В 1990 г. Американский колледж ревматологии принял классификационные критерии ГВ. Эти критерии предназначались не для диагностики, а для включения в рандомизированные контролируемые исследования. Два или более положительных критерия имеют чувствительность 88,2% и специфичность 92,0% при описании ГВ:
• воспаление носа или полости рта: язвы во рту или гнойные, кровянистые выделения из носа;
• легкие: аномальная рентгенография грудной клетки с узелками, инфильтратами или полостями;
• почки: осадок мочи с микрогематурией;
• биопсия: гранулематозное воспаление в стенке артерии или в периваскулярной области.
Согласно Консенсусной конференции в Чапел-Хилл (Chapel Hill Consensus Conference – CHCC) по номенклатуре системных васкулитов (1992 г.) для постановки диагноза ГВ необходимо наличие гранулематозного воспаления, затрагивающего дыхательные пути, и васкулита мелких и средних сосудов [1].
Цель исследования – изучение клинического течения и лечения клинического случая ГВ у ребенка.
Клинический случай
 Девочка, 4 года, находилась на плановой госпитализации в отделении дерматовенерологии РДКБ с 15.09.2024 по 15.09.2024. В связи с положительным результатом ПЦР-диагностики на SARS-CoV-2 госпитализирована в отделение РДКБ для детей с новой коронавирусной инфекцией, не нуждающихся в искусственной вентиляции легких. Раннее физическое развитие: с отставанием роста и массы. Раннее нервно-психическое развитие: с задержкой психо-речевого.
Девочка, 4 года, находилась на плановой госпитализации в отделении дерматовенерологии РДКБ с 15.09.2024 по 15.09.2024. В связи с положительным результатом ПЦР-диагностики на SARS-CoV-2 госпитализирована в отделение РДКБ для детей с новой коронавирусной инфекцией, не нуждающихся в искусственной вентиляции легких. Раннее физическое развитие: с отставанием роста и массы. Раннее нервно-психическое развитие: с задержкой психо-речевого.Жалобы при поступлении на язвенные высыпания на коже (рис. 1), выраженные моторные нарушения, неуверенность походки, редкий влажный кашель, бледность, задержку психо-речевого развития, периодически – повышение температуры тела.
Впервые высыпания в области голеней появились в возрасте 6–7 мес. Осмотрена дерматологом в Кожно-венерологическом диспансере, диагноз выставлен не был, высыпания в течение нескольких месяцев прошли самостоятельно. На фоне терапии ингаляционными глюкокортикоидами отмечалась положительная динамика, но нестойкая.
Второй эпизод высыпаний – в 1,5–1,7 года (длится по настоящее время). Получено направление на прием к педиатру. Девочка неоднократно консультирована различными специалистами: иммунологами, дерматологами, гематологами. Обследована амбулаторно: были положительны результаты анализов на антитела к цитомегаловирусу и капсидный белок вируса Эпштейна–Барр. Показатели биохимического анализа крови были следующими: повышение трансаминаз, лактатдегидрогеназы, С-реактивного белка до 32 мг/л. Рекомендована консультация иммунолога с целью исключения иммунодефицита. Показатели представлены не в полном объеме: IgA – 0,27 Ед/мл, IgM – 1,92 Ед/мл, IgG – 8,10 Ед/мл. Со слов мамы, находилась на стационарном лечении с диагнозом: правосторонняя пневмония. От дальнейшего лечения в стационаре мама отказалась, получала амбулаторно Беродуал и Пульмикорт.
В 2024 г., аллерголог на приеме услышал хрипы в легких, направил в стационар. 18.01.2024, направлена в инфекционную больницу (ОКИБ), где находилась с 18.01.2024 по 09.02.2024 с диагнозом: инфекция Эпштейна–Барр; вирус простого герпеса человека б типа; острый назофарингит; афтозный стоматит; реактивный гепатит; двусторонняя полисегментарная внебольничная пневмония, средней степени тяжести, острое течение ДНО ст.; синдром ВИД. Выписана с незначительной положительной динамикой на амбулаторное лечение, так как мать ребенка отказалась от дальнейшего лечения в стационаре. На рентгене грудной клетки от 09.02.2024 – признаки двухсторонней полисегментарной пневмонии, более выраженной справа с ателектатическим компонентом, с некоторой положительной динамикой, за счет уменьшения интенсивности инфильтрации легочной ткани. Ребенок консультирован в ДКДЦ аллергологом-иммунологом 12.02.2024. Направлен в 4-е отделение КОДКБ для лечения пневмонии. В стационаре впервые выставлен диагноз: лихорадочный нейтрофильный дерматоз Свита.
Первая госпитализация в РДКБ – апрель 2024 г. – после осмотра выставлен предварительный диагноз дерматоза Свита и ребенок переведен в отделение РПХ для проведения биопсии кожи. По результатам биопсии диагноз был изменен на гранулематозный дерматит в пределах первичного иммунодефицита.
Вторая госпитализация в РДКБ – июнь 2024 г. Ребенок поступил с выраженным обострением кожного и легочного процесса, интоксикацией. Проведенное обследование и терапия привели к улучшению состояния ребенка. Решение консилиума от 08.07.2024: на основании клинико-анамнестических данных, у ребенка с интерстициальным гранулематозным дерматитом необходимо исключить врожденную аномалию иммунной системы – аутовоспалительный синдром или первичный иммунодефицит. С целью дообследования необходимо проведение:
• иммунофенотипирования лимфоцитов (с определением Т- и В-клеток памяти);
• секвенирование экзома.
В плане терапии рекомендовано:
1) продолжение терапии внутривенными иммуноглобулинами (ВВИГ) в дозе 0,4 г/кг 1 раз в 7 дней №3–4;
2) смена антибактериальной терапии на основании данных бактериологического исследования: меропенем 100 мг/кг/сут в два введения внутривенно капельно + ЦС в дозировке 30 мг/кг/сут в два приема перорально;
3) продолжить терапию дапсоном в дозировке
1,5 мг/кт/сут в два приема;
4) при недостаточном эффекте – добавить к проводимой терапии тофацитиниб в дозировке 5 мг/сут в два приема перорально;
5) при нарастании признаков аутовоспаления – генно-инженерная биологическая терапия ингибиторами интерлейкина 1 (анакинрой).
Третья госпитализация – в июле 2024 г. – ребенок госпитализирован для проведения второго этапа терапии – введения ВВИГ. Процедуру перенесла хорошо, отмечается положительная динамика по кожному и соматическому состоянию.
Четвертая госпитализация – в июле 2024 г. – сдана кровь на секвенирование экзома. Учитывая недостаточный клинический эффект от проводимой терапии и некоторое ухудшение кожного процесса, к проводимой терапии добавлен тофацитиниб в дозировке 5 мг/сут.
Пятая госпитализация – в июле 2024 г., шестая в августе 2024 г. – ребенок госпитализирован для введения ВВИГ. Процедуру перенесла хорошо, отмечается положительная динамика по кожному и соматическому состоянию.
Поступает в отделение дерматологии повторно для продолжения обследования и коррекции терапии.
Во время осмотра выявлены единичные сухие свистящие хрипы, влажные мелкопузырчатые хрипы справа в области верхней доли, аускультативно дыхание жесткое, проводится неравномерно, отмечается незначительное ослабление справа спереди, наблюдается бронхиальное дыхание справа сзади. Притупление перкуторного звука в области верхней доли справа. Задержка психо-речевого развития, рефлексы заторможенные. Отмечаются постоянные хореяподобные моторные гиперкинезы, затрагивающие голову, руки, туловище, ноги. Походка неуверенная. Визуальный контакт поддерживается с трудом – невозможность длительной фиксации взора, вербальный контакт невозможен – задержка речевого развития.
Патологический кожный процесс подостровоспалительного характера, распространенный, симметричный, локализован на коже ягодиц, верхних и нижних конечностей. Представлен множественными узлами и бляшками размерами 0,5–2 см ярко-розового цвета с ровными четкими краями, плотной консистенции. На поверхности отдельных бляшек – корки и эрозии.
 Также на коже голеней и предплечий отмечаются язвенные высыпания на разных стадиях эпителизации. Язвы с ровными гладкими краями, дно покрыто грануляциями и скудным серозно-гнойным отделяемым (рис. 2). На коже лица (щеках преимущественно) отмечаются единичные линейные телеангиэктазии. Вне очагов кожа повсеместно истончена, сухая, эластичность снижена. Ногти и волосы истончены.
Также на коже голеней и предплечий отмечаются язвенные высыпания на разных стадиях эпителизации. Язвы с ровными гладкими краями, дно покрыто грануляциями и скудным серозно-гнойным отделяемым (рис. 2). На коже лица (щеках преимущественно) отмечаются единичные линейные телеангиэктазии. Вне очагов кожа повсеместно истончена, сухая, эластичность снижена. Ногти и волосы истончены. Назначено – стол г/a, антибактериальная терапия: азитромиции 10 мг/кг/доза 3 раза в неделю, ВВИГ 0,4 г/кг/доза №1 – 5500 мг инфузионно, тофацитиниб 2,5 мг 2 раза в день, урсодезоксихолевая кислота 200 мг 1 раз в день, ингаляции через небулайзер: будесонид 250 мкг 2 раз в день, Беродуал 10 капель 2 раза в день, амброксол 1,0 мл 2 раза в день; физиологический раствор 3,0 мл 2 раза в день. На фоне проводимой терапии отмечена положительная динамика.
Было рекомендовано исключить из рациона ребенка цельное молоко (при необходимости заменить на безлактозную смесь), ограничить употребление газообразующих продуктов, шоколада, консервированных, копченых и маринованных продуктов, питаться не реже 5 раз в день, после еды не принимать горизонтальное положение минимум 30 мин; обязательное обследование всех членов семьи (мама, папа, сиблинги) на носительство мутации в гене АТМ, соблюдать строго охранительный режим, кожу не травмировать, не ходить в открытой одежде, полностью исключить контакт ребенка с животными, почвой, открытыми водоемами; наблюдение специалистами по месту жительства: педиатр – 1 раз в 7 дней, пульмонолог – 1 раз в 14 дней, гастроэнтеролог – 1 раз в 30 дней. Учитывая тяжесть заболевания, нарушающего качество жизни ребенка, а также торпидность к проводимой терапии, рекомендовано в амбулаторных условиях продолжить терапию тофацитинибом в дозировке 2,5 мг 2 раза в день до следующей госпитализации. Весь период терапии контролировать основные показатели крови. Сопроводительная медикаментозная терапия: азитромицин 10 мг/кг/доза (130 мг) – три раза в неделю, при недостаточной эффективности и ухудшении состояния легких – рассмотреть вопрос о назначении ципрофлоксацина, дапсон 12,5 мг 2 раза в день, холекальциферол по 1000 МЕ 1 раз в день, урсодезоксихолевая кислота 250 мг 1 раз в день, аминофенилмасляная кислота по 125 мг 3 раза в день – до следующей госпитализации. Ингаляционная терапия – до следующей госпитализации: будесонид (Пульмикорт или Буденокорт), ипратропия бромид, фенотерол (Беродуал). Необходимо обрабатывать кожу ежедневно водным раствором 1% метиленовой синьки, порошком Банеоцин, затем нанести атравматическую сетку (на выбор): Атрауман, Атрауман Ag/Atrauman, Бранолинд Н, Васкопран, ФиброТюль, закрыть кожу трубчатым бинтом Tubifast.
Вывод
Таким образом, приведенный клинический пример продемонстрировал определенные особенности ГВ у детей. Этот случай может послужить полезным ориентиром для специалистов в диагностике данной патологии, выборе методов лечения и ведения пациента. Этиология данного заболевания остается в значительной степени неясной, однако такие клинические примеры облегчают процесс диагностирования и терапии схожих состояний у детского населения.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сережкина Александра Владимировна – ассистент каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: aleksandra.ykv@gmail.com;
ORCID: 0000-0002-0283-2498
Aleksandra V. Serezhkina – Assistant, Kursk State Medical University. E-mail: aleksandra.ykv@gmail.com; ORCID: 0000-0002-0283-2498
Савельева Юлия Евгеньевна – студентка 5-го курса лечебного факультета, ФГБОУ ВО КГМУ. E-mail: yulia200204@mail.ru;
ORCID: 0009-0009-0747-0404
Yulia E. Savelyeva – 5th year student, Kursk State Medical University. E-mail: yulia200204@mail.ru; ORCID: 0009-0009-0747-0404
Разинькова Наталья Сергеевна – канд. мед. наук, доц. каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: nrazin79@ya.ru; ORCID: 0000-0001-7711-8865
Natalia S. Razinkova – Cand. Sci. (Med.), Assoc. Prof., Kursk State Medical University. E-mail: nrazin79@ya.ru; ORCID: 0000-0001-7711-8865
Миненкова Татьяна Александровна – канд. мед. наук, ассистент каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: minenkovata@mail.ru; ORCID: 0000-0001-5099-4734
Tatiana A. Minenkova – Cand. Sci. (Med.), Assistant, Kursk State Medical University. E-mail: minenkovata@mail.ru; ORCID: 0000-0001-5099-4734
Сентищева Елена Александровна – канд. психол. наук, ст. преподаватель каф. международных отношений и государственного управления, ФГБОУ ВО «Юго-Западный государственный университет». E-mail: elenasentischeva@yandex.ru; ORCID: 0000-0003-3769-0490
Elena A. Sentishcheva – Dr. Sci. (Psychol.), Senior Lecturer, Southwest State University. E-mail: elenasentischeva@yandex.ru; ORCID: 0000-0003-3769-0490
Хмелевская Ирина Григорьевна – д-р мед. наук, проф., зав. каф. педиатрии, ФГБОУ ВО КГМУ. E-mail: KhmIG@ya.ru; ORCID: 0000-0003-2621-0180
Irina G. Khmelevskaya – Dr. Sci. (Med.), Full Prof., Kursk State Medical University. E-mail: KhmIG@ya.ru; ORCID: 0000-0003-2621-0180
Поступила в редакцию: 22.01.2025
Поступила после рецензирования: 23.01.2025
Принята к публикации: 30.01.2025
Received: 22.01.2025
Revised: 23.01.2025
Accepted: 30.01.2025
Список исп. литературыСкрыть список1. Systemic Vasculitis. International Journal of Dermatology 1985;24(1):667-7. DOI: 10.1111/j.1365-4362.1985.tb05613.x
2. Сигитова О.Н., Бикмухамметова Э.И., Богданова А.Р. Гранулематоз Вегенера (клинический случай из практики). Вестник современной клинической медицины. 2010;(3).
Sigitova O.N., Bikmukhametova E.I., Bogdanova A.R. Wegener's granulomatosis (a clinical case from practice). Bulletin of modern Clinical Medicine. 2010;(3) (in Russian).
3. Olivencia-Simmons I. Wegener’s granulomatosis: Symptoms, diagnosis, and treatment. Journal of the American Academy of Nurse Practitioners 2007;19(6):315-20. DOI: 10.1111/j.1745-7599.2007.00231.x
4. Серебрякова Е.Н., Волосников Д.К., Пищальников А.Ю. и др. Гранулематоз Вегенера (гранулематоз с полиангиитом). Трудный пациент. 2021;(4).
Serebryakova E.N., Volosnikov D.K., Pischalnikov A.Yu. et al.Wegener's granulomatosis (granulomatosis with polyangiitis). A difficult patient. 2021;(4) (in Russian).
5. Sarraf P, Sneller MC. Pathogenesis of Wegener’s granulomatosis: current concepts. Expert Reviews in Molecular Medicine 2005;7(08). DOI: 10.1017/s146239940500921x
6. Marzano AV, Balice Y, Papini M et al. Localized Wegener’s granulomatosis. Journal of the European Academy of Dermatology and Venereology 2011;25(12):1466-70. DOI: 10.1111/j.1468-3083.2010. 03970.x
7. Gaby Alez. Wegener's Granulomatosis: Everything You Need to Know about the Disease Including Signs and Symptoms. Diagnosis, Treatment and More. Publisher: Webster's Digital Services 2012. P. 156.
4 апреля 2025
Количество просмотров: 324

