Клинический разбор в общей медицине №4 2025
Клинический разбор в общей медицине №4 2025
Особенности микробиома кожи у пациентов с атопическим дерматитом
Номера страниц в выпуске:85-91
Аннотация
Неуклонный рост заболеваемости атопическим дерматитом (АтД) в последнее время уже является тревожным событием, а тот факт, что данный дерматоз в подавляющем большинстве случаев затрагивает детское население, в значительной степени увеличивает его социальную значимость. Выявление и изучение различных аспектов этиопатогенеза АтД со всевозможных ракурсов позволяет скорректировать терапевтический подход к таким пациентам, облегчить страдания и улучшить качество жизни больных. Воздействие на измененный микробиом кожи пациентов с АтД является неотъемлемой частью терапевтической стратегии.
Ключевые слова: атопический дерматит, микробиота кожи, патогенез.
Для цитирования: Задионченко Е.В., Звездина И.В., Аркатова М.Е. Особенности микробиома кожи у пациентов с атопическим дерматитом. Клинический разбор в общей медицине. 2025; 6 (4): 85–91. DOI: 10.47407/kr2025.6.4.00599
Неуклонный рост заболеваемости атопическим дерматитом (АтД) в последнее время уже является тревожным событием, а тот факт, что данный дерматоз в подавляющем большинстве случаев затрагивает детское население, в значительной степени увеличивает его социальную значимость. Выявление и изучение различных аспектов этиопатогенеза АтД со всевозможных ракурсов позволяет скорректировать терапевтический подход к таким пациентам, облегчить страдания и улучшить качество жизни больных. Воздействие на измененный микробиом кожи пациентов с АтД является неотъемлемой частью терапевтической стратегии.
Ключевые слова: атопический дерматит, микробиота кожи, патогенез.
Для цитирования: Задионченко Е.В., Звездина И.В., Аркатова М.Е. Особенности микробиома кожи у пациентов с атопическим дерматитом. Клинический разбор в общей медицине. 2025; 6 (4): 85–91. DOI: 10.47407/kr2025.6.4.00599
Review
Russian University of Medicine, Moscow, Russia
z777кat@inbox.ru
Absract
The steady increase in the incidence of atopic dermatitis has recently been an alarming event, and the fact that this dermatosis in the vast majority of cases affects the children's population largely increases its social significance. The identification and study of various aspects of etiopathogenesis of atopic dermatitis from all kinds of angles allows us to adjust the therapeutic approach to such patients, to relieve suffering and improve the quality of life of patients. The impact on the atopics altered by the microbia is an integral part of the therapeutic strategy.
Keywords: atopic dermatitis, microbiota of the skin, pathogenesis.
For citation: Zadionchenko E.V., Zvezdina I.V., Arkatova M.E. Features of skin microbiome in patients with atopic dermatitis. Clinical review for general practice. 2025; 6 (4): 85–91 (In Russ.). DOI: 10.47407/kr2025.6.4.00599
В настоящее время наблюдается непрерывный рост частоты встречаемости АтД в клинической практике, причем данный показатель наиболее выражен в экономически развитых странах [4]. Манифестация АтД в 60% случаев возникает в возрасте до 1 года, в 90% случаев заболевание развивается к 5 годам. Пациенты, страдающие АтД, в наибольшей степени подвержены развитию системных заболеваний, таких как бронхиальная астма, аллергический ринит, пищевые аллергии, эозинофильный эзофагит [5]. АтД неизбежно ведет к снижению качества жизни пациента и членов его семьи, способствует развитию ряда психологических расстройств (тревожность, депрессивное расстройство, синдром дефицита внимания с гиперактивностью) [6, 7].
Многофакторность развития АтД обусловлена сочетанным взаимодействием генетических нарушений в виде мутации гена FLG, дисфункции эпидермального барьера кожи с повышением его проницаемости для бактериальных агентов и аллергенов, изменений иммунного ответа в сторону Th2-воспаления, а также нарушений микробного баланса кожного покрова [1].
Комплекс изменений во врожденном и приобретенном иммунном ответе существенно изменяется при АтД, что в свою очередь оказывает непосредственное влияние на структуру микробиома кожи [8]. В настоящее время активно обсуждаются взаимоотношения кожного барьера и микробиома, участвующего в регуляции воспалительных процессов. Дисбиоз микробиома непременно ассоциирован с нарушением защитной функции кожи и развитием различных воспалительных заболеваний, в частности АтД [9]. Изучение взаимоотношений микроорганизмов с иммунной системой кожи остается важным для понимания механизмов патогенеза АтД и разработки новых терапевтических мишеней для лечения данного дерматоза [8].
Цель настоящего обзора литературы – проанализировать современные данные о роли микробиома кожи в патогенезе АтД, оценить его влияние на течение и тяжесть заболевания, а также рассмотреть корреляцию новых терапевтических подходов к лечению АтД с изменениями микробного баланса кожи.
В ряде исследований продемонстрирована вариативность состава микробиома кожи на различных топографических участках тела [9, 10]. Так, себорейные участки, характеризующиеся гиперпродукцией кожного сала, являются средой для Cutibacterium acnes, которые способны метаболизировать липиды и изменять уровень рН, а во влажных участках кожи, таких как подколенные ямки, паховые складки, локтевые ямки, создаются условия, способствующие росту бактерий рода Staphylococcus и Corynebacterium [10, 11].
Важным комменсальным микроорганизмом, колонизирующим эпителий, является Staphylococcus epidermidis, синтезирующий фенолорастворимые модулины, которые оказывают деструктивное действие на клеточную мембрану патогенных штаммов бактерий, ограничивая их способность вызывать воспаление.
S. epidermidis и Staphylococcus hominis стимулируют экспрессию антимикробных пептидов, усиливая тем самым врожденный иммунный ответ кератиноцитов и дендритных клеток, что уменьшает выраженность воспалительных процессов в коже [12, 13]. Исследование, проведенное T. Iwase и соавт., продемонстрировало, что S. epidermidis способен подавлять формирование биопленок Staphylococcus aureus, тем самым препятствуя дальнейшей колонизации и развитию [14]. Cuticabacterium acnes обладают иммумодулирующими свойствами, а также ферментируют триглицериды кожи в короткоцепочечные жирные кислоты, которые поддерживают низкий pH на ее поверхности, являющейся неблагоприятной средой для развития многих патогенных бактерий внешней среды [15].
Разнообразие грибов как составной части микробиома представлено следующими видами: Malassezia spp., Cryptococcus spp., Rhodotorula spp., Aspergillus spp. и Epicoccum spp., причем около 80% всей грибковой флоры составляет Malassezia spp. [13]. Являясь липидозависимым колонизатором, Malassezia spp. локализуется в зонах с повышенной продукцией кожного сала (грудь, спина, голова). Патогенные свойства гриба могут активироваться при различных дефектах кожного барьера или изменении состава микробиома в виде иммуновоспалительного ответа, что может способствовать более тяжелому течению таких воспалительных заболеваний кожи, как АтД и псориаз [16].
Наряду с бактериями и грибами микробиом кожи включает вирусы и простейшие. В частности, на поверхности кожи были обнаружены три преобладающих семейства вирусов: Papillomaviridae (β-, γ-вирусы папилломы человека), Polyomaviridae и Circoviridae [14].
Существуют данные о двунаправленной связи между кожей и дисбактериозом кишечника, когда многие воспалительные кожные заболевания индуцируются дисбиозом кишечной микробиоты. И наоборот, влияние на кожу ультрафиолетового излучения группы Б (УФБ) способствует повышению уровня витамина D в сыворотке крови, что приводит к увеличению количества типов протеобактерий в кишечнике. Воздействие на кишечную микробиоту как возможную терапевтическую точку приложения при различных дерматозах следует учитывать с целью повышения эффективности стандартного лечения [17].
Микробиота колонизирует кожу при рождении, далее в течение жизни ее состав определяется изменениями во внешней и внутренней среде и контролируется нейроэндокринной системой. К внутренним факторам можно отнести локализацию на поверхности кожи, генетический фактор, возраст, пол, национальную принадлежность. Среди внешних факторов наибольшее значение имеют влияние образа жизни, соблюдение гигиенических норм, использование косметических средств и препаратов с антибактериальным действием, географическое распределение, особенности климата [13, 17, 18].
Нарушение количественного и качественного состава, локализации кожного микробиома может привести к деструкции эпидермального барьера, снижению защитной функции кожи, дисфункции иммунных процессов за счет способности резидентных микроорганизмов проникать в дерму [9, 12]. В настоящее время активно обсуждаются стратегии диагностики, лечения и профилактики кожных заболеваний путем воздействия на микробиоту кожи [17].
На данный момент недостаточно сведений для точного понимания того, является ли дисбиоз кожи триггерным фактором для развития АтД, или же нарушения возникают после манифестации заболевания. В исследовании кожного микробиома, проведенном среди 149 детей в их первые два года жизни, было продемонстрировано, что колонизация кожи S. aureus предшествовала появлению клинической симптоматики среди детей, у которых был впоследствии диагностирован АтД. Это позволяет сделать предположение о том, что воспалительные реакции могут быть инициированы первичным нарушением микробиома кожи [22, 23].
Для пациентов с АтД характерно снижение экспрессии антимикробных пептидов (АМП), а именно – LL-37 и β-дефензинов, что непосредственно ассоциировано с повышенной чувствительностью к патогенным микроорганизмам. Снижение экспрессии данных АМП связано с ингибированием их синтеза за счет интерлейкинов (ИЛ-4 и ИЛ-13), вырабатываемых Th2-клетками, а также с колонизацией кожи штаммами бактерий, которые, в отличие от комменсалов здоровой кожи, не синтезируют АМП или выработка которых значительно уменьшена, в результате чего создаются благоприятные условия для неконтролируемого роста S. aureus [22]. Повышение уровня pH кожи при АтД приводит к значимым изменениям в роговом слое в виде снижения экспрессии сфинголипидов, являющихся важным структурным компонентом клеточных мембран. В результате нестабильности клеток рогового слоя кожи повышаются трансэпидермальная потеря воды, уровень IgE в сыворотки крови, происходит активация эозинофилов и ряда цитокинов, что ведет к ускорению колонизации кожи S. aureus. Также следует учитывать значение продуктов распада филаггрина (filaggrin degradation products, FDP) в ингибировании роста золотистого стафилококка и поддержании оптимального уровня pH. Снижение уровня FDP у пациентов с АтД ассоциировано с более выраженной адгезией S. aureus и наиболее тяжелым течением заболевания [24]. Доминирование S. aureus приводит к количественному уменьшению доли комменсальных бактерий, в особенности родов Cutibacterium, Streptococcus и Corynebacterium, а также к развитию воспалительных процессов на фоне выработки протеаз, токсинов и фенол-растворимых модулинов (phenol-soluble modulins, PSMs). Кроме того, результаты, полученные в ходе метагеномного исследования, позволяют сделать предположение о корреляции между S. aureus и тяжелым течением АтД, в то время как S. epidermidis может быть рассмотрен в качестве вторичного возбудителя АтД средней степени тяжести. Таким образом, не во всех очагах поражения АтД наблюдается преобладание колоний золотистого стафилококка, у многих пациентов колонизация S. epidermidis выражена в наибольшей степени [25].
Повышение колонизации кожи бактериями Malassezia spp. возрастает с тяжестью АтД. Данные бактерии способствуют активации ряда сигнальных путей, таких как MAPK, NF-κB, NFAT, индуцируя тем самым воспалительные реакции. Данные бактерии распознаются Толл-подобными рецепторами 2-го типа (Toll-like receptors 2, TLR2), локализованными на поверхности дендритных клеток и кератиноцитов, что влечет за собой выработку провоспалительных цитокинов, а именно: ИЛ-1, ИЛ-4, ИЛ-5, ИЛ-12p40, ИЛ-13 и CXCL-8. Развитию воспалительного процесса у пациентов с АтД также способствует индукция B-лимфоцитов компонентами Malassezia и продукция Malassezia-специфических антител IgE. Более того, Malassezia spp. инициируют деструкцию эпидермального барьера, секретируя такие ферменты, как липаза и фосфолипаза, нарушающие соотношение между ненасыщенными жирными кислотами и олеиновой кислотой [24, 26, 27]. В проведенных ранее исследованиях с использованием метода полимеразной цепной реакции была продемонстрирована преимущественная колонизация пораженных участков кожи у пациентов с АтД M. restricta и M. globosa; другие виды Malasezzia, такие как M. furfur и M. sympodialis, выявлялись в меньшей степени. При этом, в отличие от здоровой кожи, в очагах поражения АтД отмечается большее разнообразие видов Malasezzia [28]. Недавнее исследование, проведенное L. Storz и соавт., выявило количественное снижение колонизации кожи Malasezzia spp. у пациентов с тяжелым АтД и ее увеличение при легком и умеренном течении заболевания. В то время как в ряде других исследований не выявлено значимой корреляции между степенью тяжести АтД и уровнем колонизации Malassezia spp., отдельные работы демонстрируют тенденцию к увеличению колонизации с нарастанием тяжести заболевания. Примечательно, что при снижении колонизации Malassezia spp. в пораженных участках кожи наблюдалось увеличение количества колоний Candida albicans у пациентов с тяжелым течением АтД [29].
У пациентов с АтД также выявлено распространение C. albicans, которая способна образовывать биопленки и экспрессировать ряд факторов вирулентности (фосфолипазы, кислые протеазы), повреждающих клеточные мембраны и индуцирующих инвазию патогенов в эпителиальные клетки. Формирование биопленок позволяет C. albicans уклоняться от иммунного ответа и антимикотического лечения. Колонизация кожи C. albicans осложняет течение АтД и инициирует обострение клинической симптоматики, в особенности при поражении области шеи и волосистой части головы, что обусловлено дисфункцией иммунной регуляции и повышенной восприимчивостью к воздействию патогенных факторов. Гифы C. albicans продуцируют кандидализин, который интегрируется в клеточные мембраны эпителиоцитов, вызывая их деструкцию, что в конечном итоге приводит к образованию пор и снижению объема цитоплазмы. У пациентов с АтД обнаруживается увеличение уровня специфических IgE к C. albicans, причем наиболее выраженные показатели отмечаются среди пациентов детского возраста и при тяжелой форме заболевания [24, 30, 31]. Имеются противоречивые данные о том, что низкий уровень маннозосвязывающего лектина (mannose-binding lectin, MBL) в сыворотке крови чаще всего наблюдается среди пациентов детского возраста с установленным диагнозом АтД. MBL является ключевым компонентом врожденного иммунитета, обладающим защитным действием против патогенного воздействия C. albicans. Таким образом, дефицит MBL, определяемый при помощи генетических методов исследования, может быть ассоциирован с сенсибилизацией к C. albicans и предрасположенностью к развитию АтД. Однако в настоящее время роль MBL в патогенезе АтД требует более глубокого изучения [31].
Понимание роли микробиома в патогенезе АтД открывает множественные перспективы для разработки целенаправленных терапевтических подходов и выявления новых точек приложения, направленных на редукцию клинических проявлений заболевания и увеличение длительности межрецидивных промежутков.
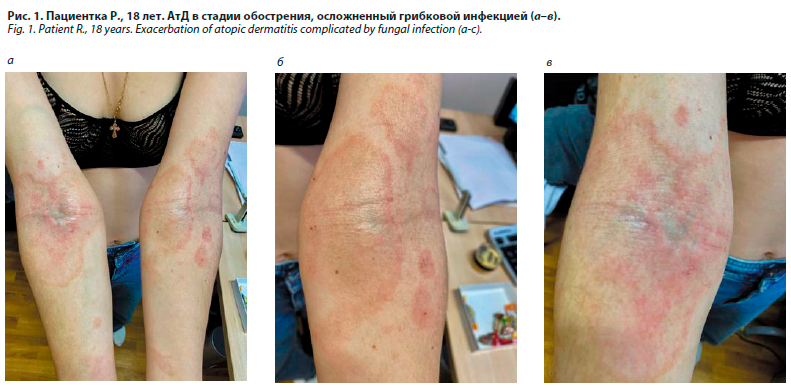
При лечении АтД легкой и средней степени тяжести с целью снижения клинической симптоматики, восстановления целостности эпидермального барьера и уменьшения кожного воспаления в качестве первой линии терапии применяются топические глюкокортикостероиды (ГКС), ингибиторы кальциневрина, эмолиенты. Дополнительно для лечения у конкретных пациентов могут применяться фототерапия, биологические агенты и ингибиторы янус-киназ. В то же время тяжелые случаи обострения АтД требуют дополнительного краткосрочного лечения системными ГКС. Ключевым аспектом при лечении среднетяжелых и тяжелых длительно текущих форм АтД является, наряду с наружной терапией, использование иммунодепрессантов. Наиболее часто препаратом выбора становится циклоспорин, реже в клинической практике используются азатиоприн, метотрексат, микофеноловая кислота [33, 34].
В ряде исследований, в которых изучалась эффективность местного применения кремов с ГКС в отношении изменений кожного микробиома, было продемонстрировано, что при длительности терапии 4–6 нед у пациентов с АтД отмечалось значительное увеличение разнообразия микроорганизмов, в то время как лечение продолжительностью 7–10 сут, несмотря на общее клиническое улучшение, не повлияло на видовое разнообразие бактериального сообщества. Таким образом, эффективность воздействия на микробиом кожи у пациентов с АтД ассоциирована с непрерывной местной терапией ГКС в течение нескольких недель.
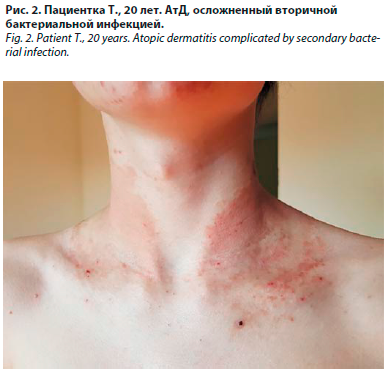 В настоящее время недостаточно исследований, оценивающих влияние эмолиентов на изменения в составе кожного микробиома у пациентов в долгосрочной перспективе. Однако имеются данные о количественном уменьшении Staphylococcus spp. в очагах поражения на фоне применения смягчающих средств [35, 36]. Ежедневное применение эмолиентов с момента рождения может способствовать профилактике АтД [32, 37]. Однако, согласно результатам рандомизированного контролируемого исследования, проведенного среди 50 новорожденных с высоким риском развития АтД, не было получено данных о том, что регулярное использование эмолиентов в течение первого года жизни способно предотвратить развитие АтД. В то же время на фоне терапии отмечалась тенденция к манифестации заболевания в более позднем возрасте. Также при использовании эмолиентов были продемонстрированы изменения в микробиоме кожи в виде раннего увеличения качественного разнообразия микробного сообщества и значительного количественного уменьшения отдельных видов стафилококков и стрептококков, участвующих в развитии АтД [37].
В настоящее время недостаточно исследований, оценивающих влияние эмолиентов на изменения в составе кожного микробиома у пациентов в долгосрочной перспективе. Однако имеются данные о количественном уменьшении Staphylococcus spp. в очагах поражения на фоне применения смягчающих средств [35, 36]. Ежедневное применение эмолиентов с момента рождения может способствовать профилактике АтД [32, 37]. Однако, согласно результатам рандомизированного контролируемого исследования, проведенного среди 50 новорожденных с высоким риском развития АтД, не было получено данных о том, что регулярное использование эмолиентов в течение первого года жизни способно предотвратить развитие АтД. В то же время на фоне терапии отмечалась тенденция к манифестации заболевания в более позднем возрасте. Также при использовании эмолиентов были продемонстрированы изменения в микробиоме кожи в виде раннего увеличения качественного разнообразия микробного сообщества и значительного количественного уменьшения отдельных видов стафилококков и стрептококков, участвующих в развитии АтД [37].
Антисептические препараты могут рассматриваться в качестве альтернативного средства наружной терапии АтД. В частности, результаты применения 2% водного раствора генцианвиолета, обладающего антибактериальным и антимикотическим действием, показали статистически значимое снижение общего количества бактерий, а также количественное уменьшение Staphylococcus spp. (S. aureus, S. capitis, S. cohnii, S. haemolyticus) и Micrococcus spp. (M. lylae, M. luteus). При этом комбинирование генцианвиолета с сильнодействующими местными ГКС коррелирует с более быстрым клиническим улучшением и минимизацией возможных побочных эффектов последних [38].
В клинических исследованиях было продемонстрировано, что снижение колонизации кожи S. aureus при помощи антибактериальных препаратов приводит к улучшению состояния пациентов с АтД, однако длительное применение данных лекарственных средств нецелесообразно ввиду отрицательного воздействия на комменсальные микроорганизмы, а также развития резистентности [36]. В некоторых странах распространено применение фузидовой кислоты, являющейся антибиотиком узкого спектра действия, в качестве наружной терапии у пациентов с АтД. Однако наряду с подавлениемS. aureus фузидовая кислота снижает рост комменсальных микроорганизмов. Имеются данные о высокой распространенности штаммов S. aureus, резистентных к фармакотерапии данным антибактериальным препаратом. Также в качестве местной терапии могут использоваться лизаты грамотрицательных бактерий, а именно – Vitreoscilla filiformis, уменьшающие локальное воспаление при АтД [32, 36].
При обострении АтД рационально использование местных топических ГКС. Наиболее сильным лекарственным средством является клобетазола пропионат, однако в клинической практике наиболее часто используются препараты III класса, такие как бетаметазона дипропионат, будесонид, метилпреднизолона ацепонат и др. [32]. Результаты недавно проведенного исследования продемонстрировали изменения в составе микробиома у пациентов с АтД в виде снижения количества S. aureus и незначительного увеличения численности S. epidermidis и бактерий рода Corynebacterium на фоне терапии эмолиентами в комбинации с местными ГКС. При этом добавление к стандартной терапии ванн с гипохлоритом натрия на протяжении 3 мес привело к более выраженному количественному уменьшению S. aureus в очагах поражения [36]. Однако, согласно исследованию A. Stolarczyk и соавт., двукратный прием подобных ванн каждую неделю на протяжении 3 мес не оказал значимого влияния на численность S. aureus на пораженной и здоровой коже. Вместе с тем клиническое улучшение, наблюдаемое в ходе исследования, может быть связано с уменьшением влияния токсинов или факторов вирулентности стафилококков [39].
Имеются данные о том, что применение ультрафиолетового излучения, в частности узкополосной ультрафиолетовой фототерапии спектра В (УФВ), приводит к снижению колонизации S. aureus в структуре кожного микробиома [20, 40]. В исследовании, изучающем влияние УФВ-фототерапии на состав микробиома кожи, было показано, что лечение в течение 6–8 нед приводит к увеличению разнообразия микроорганизмов у пациентов с АтД [41].
В настоящее время изучаются стратегии для лечения тяжелой степени АтД путем коррекции дисбиоза бактериотерапией с применением комменсальных микроорганизмов. Так, Staphylococcus hominis A9 (ShA9) представляет собой бактерию, выделенную из здоровой кожи и способную подавить выработку токсинов золотистого стафилококка или привести к его гибели. В исследовании, в ходе которого у пациентов со среднетяжелой и тяжелой формой АтД ежедневно в течение
7 дней применялись препараты, содержащие данную бактерию, было показано улучшение показателей SCORAD и EASI, а также уменьшение числа колоний S. aureus на коже [42]. В других исследованиях также отмечаются положительная динамика и безопасность бактериотерапии при лечении АтД [40].
Применение биологической терапии при лечении пациентов со среднетяжелым и тяжелым течением АтД обусловлено таргетным ингибирующим воздействием на рецепторы ИЛ-4 и ИЛ-13. Высокую активность демонстрирует дупилумаб, являющийся человеческим моноклональным антителом IgG4 [43, 44]. Двойное слепое рандомизированное плацебо-контролируемое исследование, проведенное среди 54 пациентов в возрасте старше 18 лет, имеющих в анамнезе АтД средней и тяжелой степени, показало увеличение микробного разнообразия и уменьшение численности S. aureus на фоне лечения дупилумабом. При этом количественное снижение S. aureus коррелировало с клинически значимым улучшением течения АтД [43]. В исследовании, проведенном E.L. Simpson и соавт., лечение дупилумабом привело к выраженному снижению количества S. aureus в очагах поражения в течение первых 3 дней, снижение уровня цитотоксинов S. aureus на 7-й день, а регресс симптоматики наблюдался на 11-е сутки терапии [45].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Задионченко Екатерина Владимировна – канд. мед. наук, ассистент каф. кожных и венерических болезней, ФГБОУ ВО «Российский университет медицины». E-mail: z777кat@inbox.ru;
ORCID: 0000-0001-9295-5178
Ekaterina V. Zadionchenko – Cand. Sci. (Med.), Аssistant, Russian University of Medicine. E-mail: z777кat@inbox.ru; ORCID: 0000-0001-9295-5178
Звездина Ирина Владимирова – канд. мед. наук, ассистент каф. кожных и венерических болезней, ФГБОУ ВО «Российский университет медицины». E-mail: zvezdinhome@mail.ru; ORCID: 0000-0002-5532-0672
Irina V. Zvezdina – Cand. Sci. (Med.), Аssistant, Russian University of Medicine. E-mail: zvezdinhome@mail.ru; ORCID: 0000-0002-5532-0672
Аркатова Мария Евгеньевна – студентка леч. ф-та Научно-образовательного института клинической медицины им. Н.А. Семашко, ФГБОУ ВО «Российский университет медицины». ORCID: 0009-0004-3393-5512
Maria E. Arkatova – Student, Semashko Scientific and Educational Institute of Clinical Medicine, Russian University of Medicine. ORCID: 0009-0004-3393-5512
Поступила в редакцию: 04.02.2025
Поступила после рецензирования: 21.02.2025
Принята к публикации: 27.02.2025
Received: 04.02.2025
Revised: 21.02.2025
Accepted: 27.02.2025
Neurological features in the early recovery period of stroke and rehabilitation tactics
Ekaterina V. Zadionchenko, Irina V. Zvezdina, Maria E. ArkatovaRussian University of Medicine, Moscow, Russia
z777кat@inbox.ru
Absract
The steady increase in the incidence of atopic dermatitis has recently been an alarming event, and the fact that this dermatosis in the vast majority of cases affects the children's population largely increases its social significance. The identification and study of various aspects of etiopathogenesis of atopic dermatitis from all kinds of angles allows us to adjust the therapeutic approach to such patients, to relieve suffering and improve the quality of life of patients. The impact on the atopics altered by the microbia is an integral part of the therapeutic strategy.
Keywords: atopic dermatitis, microbiota of the skin, pathogenesis.
For citation: Zadionchenko E.V., Zvezdina I.V., Arkatova M.E. Features of skin microbiome in patients with atopic dermatitis. Clinical review for general practice. 2025; 6 (4): 85–91 (In Russ.). DOI: 10.47407/kr2025.6.4.00599
Введение
Атопический дерматит (АтД) представляет собой генетически детерминированное хроническое неинфекционное воспалительное заболевание кожи, характеризующееся рецидивирующим течением, сопровождающееся зудом и экземоподобными высыпаниями, такими как эритема, папулы, экксудативные очаги поражения, особенности локализации которых зависят от возраста пациента [1]. По результатам эпидемиологических исследований, распространенность АтД в детской популяции населения составляет 15–20%, во взрослой возрастной группе – до 10% [2]. Общая заболеваемость АтД среди населения варьирует в зависимости от возраста, пола и географического региона [3].В настоящее время наблюдается непрерывный рост частоты встречаемости АтД в клинической практике, причем данный показатель наиболее выражен в экономически развитых странах [4]. Манифестация АтД в 60% случаев возникает в возрасте до 1 года, в 90% случаев заболевание развивается к 5 годам. Пациенты, страдающие АтД, в наибольшей степени подвержены развитию системных заболеваний, таких как бронхиальная астма, аллергический ринит, пищевые аллергии, эозинофильный эзофагит [5]. АтД неизбежно ведет к снижению качества жизни пациента и членов его семьи, способствует развитию ряда психологических расстройств (тревожность, депрессивное расстройство, синдром дефицита внимания с гиперактивностью) [6, 7].
Многофакторность развития АтД обусловлена сочетанным взаимодействием генетических нарушений в виде мутации гена FLG, дисфункции эпидермального барьера кожи с повышением его проницаемости для бактериальных агентов и аллергенов, изменений иммунного ответа в сторону Th2-воспаления, а также нарушений микробного баланса кожного покрова [1].
Комплекс изменений во врожденном и приобретенном иммунном ответе существенно изменяется при АтД, что в свою очередь оказывает непосредственное влияние на структуру микробиома кожи [8]. В настоящее время активно обсуждаются взаимоотношения кожного барьера и микробиома, участвующего в регуляции воспалительных процессов. Дисбиоз микробиома непременно ассоциирован с нарушением защитной функции кожи и развитием различных воспалительных заболеваний, в частности АтД [9]. Изучение взаимоотношений микроорганизмов с иммунной системой кожи остается важным для понимания механизмов патогенеза АтД и разработки новых терапевтических мишеней для лечения данного дерматоза [8].
Цель настоящего обзора литературы – проанализировать современные данные о роли микробиома кожи в патогенезе АтД, оценить его влияние на течение и тяжесть заболевания, а также рассмотреть корреляцию новых терапевтических подходов к лечению АтД с изменениями микробного баланса кожи.
Микробиом кожи в норме
В норме поверхность кожи характеризуется кислым уровнем рН (рН 4–6) и высоким содержанием солей. Кожа является аэробной средой (за исключением фолликулярно-сальных образований, которые относительно анаэробны) для колоний комменсальных микроорганизмов, образующих микробиом, необходимый для осуществления барьерной функции кожи и поддержания гомеостаза. Сбалансированность и состав микробиома напрямую влияют на процессы врожденного и адаптивного иммунного ответа. Обнаружено 18 типов микроорганизмов, среди которых в наибольшем количестве представлены Actinobacteria (51,8%), Firmicutes (24,4%), Proteobacteria (16,5%), Bacteroidetes (6,3%).В ряде исследований продемонстрирована вариативность состава микробиома кожи на различных топографических участках тела [9, 10]. Так, себорейные участки, характеризующиеся гиперпродукцией кожного сала, являются средой для Cutibacterium acnes, которые способны метаболизировать липиды и изменять уровень рН, а во влажных участках кожи, таких как подколенные ямки, паховые складки, локтевые ямки, создаются условия, способствующие росту бактерий рода Staphylococcus и Corynebacterium [10, 11].
Важным комменсальным микроорганизмом, колонизирующим эпителий, является Staphylococcus epidermidis, синтезирующий фенолорастворимые модулины, которые оказывают деструктивное действие на клеточную мембрану патогенных штаммов бактерий, ограничивая их способность вызывать воспаление.
S. epidermidis и Staphylococcus hominis стимулируют экспрессию антимикробных пептидов, усиливая тем самым врожденный иммунный ответ кератиноцитов и дендритных клеток, что уменьшает выраженность воспалительных процессов в коже [12, 13]. Исследование, проведенное T. Iwase и соавт., продемонстрировало, что S. epidermidis способен подавлять формирование биопленок Staphylococcus aureus, тем самым препятствуя дальнейшей колонизации и развитию [14]. Cuticabacterium acnes обладают иммумодулирующими свойствами, а также ферментируют триглицериды кожи в короткоцепочечные жирные кислоты, которые поддерживают низкий pH на ее поверхности, являющейся неблагоприятной средой для развития многих патогенных бактерий внешней среды [15].
Разнообразие грибов как составной части микробиома представлено следующими видами: Malassezia spp., Cryptococcus spp., Rhodotorula spp., Aspergillus spp. и Epicoccum spp., причем около 80% всей грибковой флоры составляет Malassezia spp. [13]. Являясь липидозависимым колонизатором, Malassezia spp. локализуется в зонах с повышенной продукцией кожного сала (грудь, спина, голова). Патогенные свойства гриба могут активироваться при различных дефектах кожного барьера или изменении состава микробиома в виде иммуновоспалительного ответа, что может способствовать более тяжелому течению таких воспалительных заболеваний кожи, как АтД и псориаз [16].
Наряду с бактериями и грибами микробиом кожи включает вирусы и простейшие. В частности, на поверхности кожи были обнаружены три преобладающих семейства вирусов: Papillomaviridae (β-, γ-вирусы папилломы человека), Polyomaviridae и Circoviridae [14].
Существуют данные о двунаправленной связи между кожей и дисбактериозом кишечника, когда многие воспалительные кожные заболевания индуцируются дисбиозом кишечной микробиоты. И наоборот, влияние на кожу ультрафиолетового излучения группы Б (УФБ) способствует повышению уровня витамина D в сыворотке крови, что приводит к увеличению количества типов протеобактерий в кишечнике. Воздействие на кишечную микробиоту как возможную терапевтическую точку приложения при различных дерматозах следует учитывать с целью повышения эффективности стандартного лечения [17].
Микробиота колонизирует кожу при рождении, далее в течение жизни ее состав определяется изменениями во внешней и внутренней среде и контролируется нейроэндокринной системой. К внутренним факторам можно отнести локализацию на поверхности кожи, генетический фактор, возраст, пол, национальную принадлежность. Среди внешних факторов наибольшее значение имеют влияние образа жизни, соблюдение гигиенических норм, использование косметических средств и препаратов с антибактериальным действием, географическое распределение, особенности климата [13, 17, 18].
Нарушение количественного и качественного состава, локализации кожного микробиома может привести к деструкции эпидермального барьера, снижению защитной функции кожи, дисфункции иммунных процессов за счет способности резидентных микроорганизмов проникать в дерму [9, 12]. В настоящее время активно обсуждаются стратегии диагностики, лечения и профилактики кожных заболеваний путем воздействия на микробиоту кожи [17].
Взаимосвязь микробиома и атопического дерматита
Колонизация кожи золотистым стафилококком является ведущим фактором в развитии АтД у большинства пациентов [19], при этом характерно снижение разнообразия родов Cutibacterium, Streptococcus, Acinetobacter, Corynebacterium и Prevotella, которое в наибольшей степени заметно во время обострения заболевания. Нарушение баланса кожного микробиома провоцирует организацию пространства для активного роста патогенных микроорганизмов, способных привести к развитию воспалительных процессов. Золотистый стафилококк представляет собой условно-патогенный микроорганизм, приводящий к деструкции эпидермального барьера и активирующий реакции иммунного ответа. У пациентов с АтД распространенность S. aureus повышена и составляет 30–100%, в отличие от кожи здоровых людей, у которых данный показатель обычно не превышает 20% [20]. Грибковые микроорганизмы в виде Malassezia и вирусы, включая вирус простого герпеса, также могут привести к обострению АтД. Таким образом, сложные взаимодействия между комменсальными и патогенными микроорганизмами, а также иммунными клетками имеют ключевое значение в патогенезе АтД [21].На данный момент недостаточно сведений для точного понимания того, является ли дисбиоз кожи триггерным фактором для развития АтД, или же нарушения возникают после манифестации заболевания. В исследовании кожного микробиома, проведенном среди 149 детей в их первые два года жизни, было продемонстрировано, что колонизация кожи S. aureus предшествовала появлению клинической симптоматики среди детей, у которых был впоследствии диагностирован АтД. Это позволяет сделать предположение о том, что воспалительные реакции могут быть инициированы первичным нарушением микробиома кожи [22, 23].
Для пациентов с АтД характерно снижение экспрессии антимикробных пептидов (АМП), а именно – LL-37 и β-дефензинов, что непосредственно ассоциировано с повышенной чувствительностью к патогенным микроорганизмам. Снижение экспрессии данных АМП связано с ингибированием их синтеза за счет интерлейкинов (ИЛ-4 и ИЛ-13), вырабатываемых Th2-клетками, а также с колонизацией кожи штаммами бактерий, которые, в отличие от комменсалов здоровой кожи, не синтезируют АМП или выработка которых значительно уменьшена, в результате чего создаются благоприятные условия для неконтролируемого роста S. aureus [22]. Повышение уровня pH кожи при АтД приводит к значимым изменениям в роговом слое в виде снижения экспрессии сфинголипидов, являющихся важным структурным компонентом клеточных мембран. В результате нестабильности клеток рогового слоя кожи повышаются трансэпидермальная потеря воды, уровень IgE в сыворотки крови, происходит активация эозинофилов и ряда цитокинов, что ведет к ускорению колонизации кожи S. aureus. Также следует учитывать значение продуктов распада филаггрина (filaggrin degradation products, FDP) в ингибировании роста золотистого стафилококка и поддержании оптимального уровня pH. Снижение уровня FDP у пациентов с АтД ассоциировано с более выраженной адгезией S. aureus и наиболее тяжелым течением заболевания [24]. Доминирование S. aureus приводит к количественному уменьшению доли комменсальных бактерий, в особенности родов Cutibacterium, Streptococcus и Corynebacterium, а также к развитию воспалительных процессов на фоне выработки протеаз, токсинов и фенол-растворимых модулинов (phenol-soluble modulins, PSMs). Кроме того, результаты, полученные в ходе метагеномного исследования, позволяют сделать предположение о корреляции между S. aureus и тяжелым течением АтД, в то время как S. epidermidis может быть рассмотрен в качестве вторичного возбудителя АтД средней степени тяжести. Таким образом, не во всех очагах поражения АтД наблюдается преобладание колоний золотистого стафилококка, у многих пациентов колонизация S. epidermidis выражена в наибольшей степени [25].
Повышение колонизации кожи бактериями Malassezia spp. возрастает с тяжестью АтД. Данные бактерии способствуют активации ряда сигнальных путей, таких как MAPK, NF-κB, NFAT, индуцируя тем самым воспалительные реакции. Данные бактерии распознаются Толл-подобными рецепторами 2-го типа (Toll-like receptors 2, TLR2), локализованными на поверхности дендритных клеток и кератиноцитов, что влечет за собой выработку провоспалительных цитокинов, а именно: ИЛ-1, ИЛ-4, ИЛ-5, ИЛ-12p40, ИЛ-13 и CXCL-8. Развитию воспалительного процесса у пациентов с АтД также способствует индукция B-лимфоцитов компонентами Malassezia и продукция Malassezia-специфических антител IgE. Более того, Malassezia spp. инициируют деструкцию эпидермального барьера, секретируя такие ферменты, как липаза и фосфолипаза, нарушающие соотношение между ненасыщенными жирными кислотами и олеиновой кислотой [24, 26, 27]. В проведенных ранее исследованиях с использованием метода полимеразной цепной реакции была продемонстрирована преимущественная колонизация пораженных участков кожи у пациентов с АтД M. restricta и M. globosa; другие виды Malasezzia, такие как M. furfur и M. sympodialis, выявлялись в меньшей степени. При этом, в отличие от здоровой кожи, в очагах поражения АтД отмечается большее разнообразие видов Malasezzia [28]. Недавнее исследование, проведенное L. Storz и соавт., выявило количественное снижение колонизации кожи Malasezzia spp. у пациентов с тяжелым АтД и ее увеличение при легком и умеренном течении заболевания. В то время как в ряде других исследований не выявлено значимой корреляции между степенью тяжести АтД и уровнем колонизации Malassezia spp., отдельные работы демонстрируют тенденцию к увеличению колонизации с нарастанием тяжести заболевания. Примечательно, что при снижении колонизации Malassezia spp. в пораженных участках кожи наблюдалось увеличение количества колоний Candida albicans у пациентов с тяжелым течением АтД [29].
У пациентов с АтД также выявлено распространение C. albicans, которая способна образовывать биопленки и экспрессировать ряд факторов вирулентности (фосфолипазы, кислые протеазы), повреждающих клеточные мембраны и индуцирующих инвазию патогенов в эпителиальные клетки. Формирование биопленок позволяет C. albicans уклоняться от иммунного ответа и антимикотического лечения. Колонизация кожи C. albicans осложняет течение АтД и инициирует обострение клинической симптоматики, в особенности при поражении области шеи и волосистой части головы, что обусловлено дисфункцией иммунной регуляции и повышенной восприимчивостью к воздействию патогенных факторов. Гифы C. albicans продуцируют кандидализин, который интегрируется в клеточные мембраны эпителиоцитов, вызывая их деструкцию, что в конечном итоге приводит к образованию пор и снижению объема цитоплазмы. У пациентов с АтД обнаруживается увеличение уровня специфических IgE к C. albicans, причем наиболее выраженные показатели отмечаются среди пациентов детского возраста и при тяжелой форме заболевания [24, 30, 31]. Имеются противоречивые данные о том, что низкий уровень маннозосвязывающего лектина (mannose-binding lectin, MBL) в сыворотке крови чаще всего наблюдается среди пациентов детского возраста с установленным диагнозом АтД. MBL является ключевым компонентом врожденного иммунитета, обладающим защитным действием против патогенного воздействия C. albicans. Таким образом, дефицит MBL, определяемый при помощи генетических методов исследования, может быть ассоциирован с сенсибилизацией к C. albicans и предрасположенностью к развитию АтД. Однако в настоящее время роль MBL в патогенезе АтД требует более глубокого изучения [31].
Понимание роли микробиома в патогенезе АтД открывает множественные перспективы для разработки целенаправленных терапевтических подходов и выявления новых точек приложения, направленных на редукцию клинических проявлений заболевания и увеличение длительности межрецидивных промежутков.
Терапевтические подходы
На данный момент лечение АтД требует комплексного и поэтапного подхода, учитывающего возраст пациента, степень тяжести заболевания, интенсивность зуда, локализацию очагов поражения на коже и влияние на качество сна [32].
При лечении АтД легкой и средней степени тяжести с целью снижения клинической симптоматики, восстановления целостности эпидермального барьера и уменьшения кожного воспаления в качестве первой линии терапии применяются топические глюкокортикостероиды (ГКС), ингибиторы кальциневрина, эмолиенты. Дополнительно для лечения у конкретных пациентов могут применяться фототерапия, биологические агенты и ингибиторы янус-киназ. В то же время тяжелые случаи обострения АтД требуют дополнительного краткосрочного лечения системными ГКС. Ключевым аспектом при лечении среднетяжелых и тяжелых длительно текущих форм АтД является, наряду с наружной терапией, использование иммунодепрессантов. Наиболее часто препаратом выбора становится циклоспорин, реже в клинической практике используются азатиоприн, метотрексат, микофеноловая кислота [33, 34].
В ряде исследований, в которых изучалась эффективность местного применения кремов с ГКС в отношении изменений кожного микробиома, было продемонстрировано, что при длительности терапии 4–6 нед у пациентов с АтД отмечалось значительное увеличение разнообразия микроорганизмов, в то время как лечение продолжительностью 7–10 сут, несмотря на общее клиническое улучшение, не повлияло на видовое разнообразие бактериального сообщества. Таким образом, эффективность воздействия на микробиом кожи у пациентов с АтД ассоциирована с непрерывной местной терапией ГКС в течение нескольких недель.
 В настоящее время недостаточно исследований, оценивающих влияние эмолиентов на изменения в составе кожного микробиома у пациентов в долгосрочной перспективе. Однако имеются данные о количественном уменьшении Staphylococcus spp. в очагах поражения на фоне применения смягчающих средств [35, 36]. Ежедневное применение эмолиентов с момента рождения может способствовать профилактике АтД [32, 37]. Однако, согласно результатам рандомизированного контролируемого исследования, проведенного среди 50 новорожденных с высоким риском развития АтД, не было получено данных о том, что регулярное использование эмолиентов в течение первого года жизни способно предотвратить развитие АтД. В то же время на фоне терапии отмечалась тенденция к манифестации заболевания в более позднем возрасте. Также при использовании эмолиентов были продемонстрированы изменения в микробиоме кожи в виде раннего увеличения качественного разнообразия микробного сообщества и значительного количественного уменьшения отдельных видов стафилококков и стрептококков, участвующих в развитии АтД [37].
В настоящее время недостаточно исследований, оценивающих влияние эмолиентов на изменения в составе кожного микробиома у пациентов в долгосрочной перспективе. Однако имеются данные о количественном уменьшении Staphylococcus spp. в очагах поражения на фоне применения смягчающих средств [35, 36]. Ежедневное применение эмолиентов с момента рождения может способствовать профилактике АтД [32, 37]. Однако, согласно результатам рандомизированного контролируемого исследования, проведенного среди 50 новорожденных с высоким риском развития АтД, не было получено данных о том, что регулярное использование эмолиентов в течение первого года жизни способно предотвратить развитие АтД. В то же время на фоне терапии отмечалась тенденция к манифестации заболевания в более позднем возрасте. Также при использовании эмолиентов были продемонстрированы изменения в микробиоме кожи в виде раннего увеличения качественного разнообразия микробного сообщества и значительного количественного уменьшения отдельных видов стафилококков и стрептококков, участвующих в развитии АтД [37]. Антисептические препараты могут рассматриваться в качестве альтернативного средства наружной терапии АтД. В частности, результаты применения 2% водного раствора генцианвиолета, обладающего антибактериальным и антимикотическим действием, показали статистически значимое снижение общего количества бактерий, а также количественное уменьшение Staphylococcus spp. (S. aureus, S. capitis, S. cohnii, S. haemolyticus) и Micrococcus spp. (M. lylae, M. luteus). При этом комбинирование генцианвиолета с сильнодействующими местными ГКС коррелирует с более быстрым клиническим улучшением и минимизацией возможных побочных эффектов последних [38].
В клинических исследованиях было продемонстрировано, что снижение колонизации кожи S. aureus при помощи антибактериальных препаратов приводит к улучшению состояния пациентов с АтД, однако длительное применение данных лекарственных средств нецелесообразно ввиду отрицательного воздействия на комменсальные микроорганизмы, а также развития резистентности [36]. В некоторых странах распространено применение фузидовой кислоты, являющейся антибиотиком узкого спектра действия, в качестве наружной терапии у пациентов с АтД. Однако наряду с подавлениемS. aureus фузидовая кислота снижает рост комменсальных микроорганизмов. Имеются данные о высокой распространенности штаммов S. aureus, резистентных к фармакотерапии данным антибактериальным препаратом. Также в качестве местной терапии могут использоваться лизаты грамотрицательных бактерий, а именно – Vitreoscilla filiformis, уменьшающие локальное воспаление при АтД [32, 36].
При обострении АтД рационально использование местных топических ГКС. Наиболее сильным лекарственным средством является клобетазола пропионат, однако в клинической практике наиболее часто используются препараты III класса, такие как бетаметазона дипропионат, будесонид, метилпреднизолона ацепонат и др. [32]. Результаты недавно проведенного исследования продемонстрировали изменения в составе микробиома у пациентов с АтД в виде снижения количества S. aureus и незначительного увеличения численности S. epidermidis и бактерий рода Corynebacterium на фоне терапии эмолиентами в комбинации с местными ГКС. При этом добавление к стандартной терапии ванн с гипохлоритом натрия на протяжении 3 мес привело к более выраженному количественному уменьшению S. aureus в очагах поражения [36]. Однако, согласно исследованию A. Stolarczyk и соавт., двукратный прием подобных ванн каждую неделю на протяжении 3 мес не оказал значимого влияния на численность S. aureus на пораженной и здоровой коже. Вместе с тем клиническое улучшение, наблюдаемое в ходе исследования, может быть связано с уменьшением влияния токсинов или факторов вирулентности стафилококков [39].
Имеются данные о том, что применение ультрафиолетового излучения, в частности узкополосной ультрафиолетовой фототерапии спектра В (УФВ), приводит к снижению колонизации S. aureus в структуре кожного микробиома [20, 40]. В исследовании, изучающем влияние УФВ-фототерапии на состав микробиома кожи, было показано, что лечение в течение 6–8 нед приводит к увеличению разнообразия микроорганизмов у пациентов с АтД [41].
В настоящее время изучаются стратегии для лечения тяжелой степени АтД путем коррекции дисбиоза бактериотерапией с применением комменсальных микроорганизмов. Так, Staphylococcus hominis A9 (ShA9) представляет собой бактерию, выделенную из здоровой кожи и способную подавить выработку токсинов золотистого стафилококка или привести к его гибели. В исследовании, в ходе которого у пациентов со среднетяжелой и тяжелой формой АтД ежедневно в течение
7 дней применялись препараты, содержащие данную бактерию, было показано улучшение показателей SCORAD и EASI, а также уменьшение числа колоний S. aureus на коже [42]. В других исследованиях также отмечаются положительная динамика и безопасность бактериотерапии при лечении АтД [40].
Применение биологической терапии при лечении пациентов со среднетяжелым и тяжелым течением АтД обусловлено таргетным ингибирующим воздействием на рецепторы ИЛ-4 и ИЛ-13. Высокую активность демонстрирует дупилумаб, являющийся человеческим моноклональным антителом IgG4 [43, 44]. Двойное слепое рандомизированное плацебо-контролируемое исследование, проведенное среди 54 пациентов в возрасте старше 18 лет, имеющих в анамнезе АтД средней и тяжелой степени, показало увеличение микробного разнообразия и уменьшение численности S. aureus на фоне лечения дупилумабом. При этом количественное снижение S. aureus коррелировало с клинически значимым улучшением течения АтД [43]. В исследовании, проведенном E.L. Simpson и соавт., лечение дупилумабом привело к выраженному снижению количества S. aureus в очагах поражения в течение первых 3 дней, снижение уровня цитотоксинов S. aureus на 7-й день, а регресс симптоматики наблюдался на 11-е сутки терапии [45].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Задионченко Екатерина Владимировна – канд. мед. наук, ассистент каф. кожных и венерических болезней, ФГБОУ ВО «Российский университет медицины». E-mail: z777кat@inbox.ru;
ORCID: 0000-0001-9295-5178
Ekaterina V. Zadionchenko – Cand. Sci. (Med.), Аssistant, Russian University of Medicine. E-mail: z777кat@inbox.ru; ORCID: 0000-0001-9295-5178
Звездина Ирина Владимирова – канд. мед. наук, ассистент каф. кожных и венерических болезней, ФГБОУ ВО «Российский университет медицины». E-mail: zvezdinhome@mail.ru; ORCID: 0000-0002-5532-0672
Irina V. Zvezdina – Cand. Sci. (Med.), Аssistant, Russian University of Medicine. E-mail: zvezdinhome@mail.ru; ORCID: 0000-0002-5532-0672
Аркатова Мария Евгеньевна – студентка леч. ф-та Научно-образовательного института клинической медицины им. Н.А. Семашко, ФГБОУ ВО «Российский университет медицины». ORCID: 0009-0004-3393-5512
Maria E. Arkatova – Student, Semashko Scientific and Educational Institute of Clinical Medicine, Russian University of Medicine. ORCID: 0009-0004-3393-5512
Поступила в редакцию: 04.02.2025
Поступила после рецензирования: 21.02.2025
Принята к публикации: 27.02.2025
Received: 04.02.2025
Revised: 21.02.2025
Accepted: 27.02.2025
Список исп. литературыСкрыть список1. Sroka-Tomaszewska J, Trzeciak M. Molecular Mechanisms of Atopic Dermatitis Pathogenesis. Int J Mol Sci. 2021;22(8):4130.
2. Schuler CF 4th, Billi AC, Maverakis E, et al. Novel insights into atopic dermatitis. J Allergy Clin Immunol. 2023;151(5):1145-54. DOI: 10.1016/j.jaci.2022.10.023
3. Tian J, Zhang D, Yang Y, et al. Global epidemiology of atopic dermatitis: a comprehensive systematic analysis and modelling study. Brit J Dermatol. 2024;190(1):55-61.
4. Дроздов В.Н., Арефьев К.И., Сереброва С.Ю. и др. Эффективность и безопасность антигистаминных препаратов при атопическом дерматите у детей. Медицинский совет. 2021;(1):193-201. DOI: 10.21518/2079-701X-2021-1-193-201
Drozdov V.N., Arefev K.I., Serebrova S.Yu., et al. Efficacy and safety of antihistamines in children with atopic dermatitis. Meditsinskiy sovet = Medical Council. 2021;(1):193-201. DOI: 10.21518/2079-701X-2021-1-193-201 (in Russian).
5. Frazier W, Bhardwaj N. Atopic dermatitis: diagnosis and treatment. Am Fam Phys. 2020;101(10):590-8.
6. Siegels D, Heratizadeh A, Abraham S, et al. Systemic treatments in the management of atopic dermatitis: A systematic review and meta-analysis. Allergy. 2021;76(4):1053-76.
7. Ali F, Vyas J, Finlay AY. Counting the burden: atopic dermatitis and health-related quality of life. Acta Derm Venereol. 2020;100(12): adv00161. DOI: 10.2340/00015555-3511
8. Николаева М.Ю., Монахов К.Н., Соколовский Е.В. Нарушения микробиома кожи при атопическом дерматите и псориазе. Вестник дерматологии и венерологии. 2021;97(6):33-43. DOI: 10.25208/vdv1282
Nikolaeva M.Yu., Monakhov K.N., Sokolovskiy E.V. Disorders of the skin microbiome in atopic dermatitis and psoriasis. Vestnik dermatologii i venerologii. 2021;97(6):33-43. DOI: 10.25208/vdv1282 (in Russian).
9. Lee HJ, Kim M. Skin barrier function and the microbiome. Int J Mol Sci. 2022;23(21):13071.
10. Smythe P, Wilkinson HN. The skin microbiome: current landscape and future opportunities. Int J Mol Sci. 2023;24(4):3950.
11. Dréno B, Dagnelie MA, Khammari A, Corvec S. The skin microbiome: a new actor in inflammatory acne. Am J Clin Dermatol. 2020;21(Suppl. 1):18-24.
12. Мурашкин Н.Н., Павлова Е.С., Епишев Р.В. и др. Состав микробиома кожи и ключевые аспекты его барьерной функции. Вопросы современной педиатрии. 2023;22(5):387-92. DOI: 10.15690/vsp. v22i5.2624
Murashkin N.N., Pavlova E.S., Epishev R.V., et al. Skin Microbiome Composition and Key Factors of its Barrier Function. Current Pediatrics. 2023;22(5):387-92. DOI: 10.15690/vsp.v22i5.2624 (in Russian).
13. Carmona-Cruz S, Orozco-Covarrubias L, Sáez-de-Ocariz M. The human skin microbiome in selected cutaneous diseases. Front Cell Infect Microbiol. 2022;12:834135.
14. Iwase T, Uehara Y, Shinji H, et al. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization. Nature. 2010 May 20;465(7296):346-9. DOI: 10.1038/nature09074
15. Wrześniewska M, Wołoszczak J, Świrkosz G, et al. The role of the microbiota in the pathogenesis and treatment of atopic dermatitis: a literature review. Int J Mol Sci. 2024;25(12):6539.
16. Vijaya Chandra SH, Srinivas R, Dawson TL Jr, Common JE. Cutaneous Malassezia: commensal, pathogen, or protector? Front Cell Infect Microbiol. 2021;10:614446.
17. Yang Y, Qu L, Mijakovic I, Wei Y. Advances in the human skin microbiota and its roles in cutaneous diseases. Microb Cell Factor. 2022;21(1):176.
18. Pinto D, Ciardiello T, Franzoni M, et al. Effect of commonly used cosmetic preservatives on skin resident microflora dynamics. Sci Rep. 2021;11(1):8695.
19. Nedoszytko B, Reszka E, Gutowska-Owsiak D, et al. Genetic and epigenetic aspects of atopic dermatitis. Int J Mol Sci. 2020;21(18):6484.
20. Hrestak D, Matijašić M, Čipčić Paljetak H, et al. Skin microbiota in atopic dermatitis. Int J Mol Sci. 2022;23(7):3503.
21. Pothmann A, Illing T, Wiegand C, et al. The microbiome and atopic dermatitis: a review. Am J Clin Dermatol. 2019;20:749-61.
22. Fölster-Holst R. The role of the skin microbiome in atopic dermatitis – correlations and consequences. J Dtsch Dermatol Ges. 2022 May;20(5):571-7. DOI: 10.1111/ddg.14709
23. Qiu Z, Zhu Z, Liu X, et al. A dysregulated sebum-microbial metabolite-IL-33 axis initiates skin inflammation in atopic dermatitis. J Exp Med. 2022 Oct 3;219(10):e20212397. DOI: 10.1084/jem.20212397
24. Zhang XE, Zheng P, Ye SZ, et al. Microbiome: role in inflammatory skin diseases. J Inflamm Res. 2024 Feb 15:17:1057-82. DOI: 10.2147/JIR. S441100
25. Kim K, Jang H, Kim E, et al. Recent advances in understanding the role of the skin microbiome in the treatment of atopic dermatitis. Exp Dermatol. 2023;32(12):2048-61.
26. Chen Y, Knight R, Gallo RL. Evolving approaches to profiling the microbiome in skin diseas. Front Immunol. 2023;14:1151527.
27. Kurniadi I, Hendra Wijaya W, Timotius KH. Malassezia virulence factors and their role in dermatological disorders. Acta Dermatovenerol Alp Pannonica Adriat. 2022 Jun;31(2):65-70.
28. Jung WH. Alteration in skin mycobiome due to atopic dermatitis and seborrheic dermatitis. Biophys Rev (Melville). 2023;4(1):011309.
29. Storz L, Schmid B, Bosshard PP, et al. Decreased skin colonization with Malassezia spp. and increased skin colonization with Candida spp. in patients with severe atopic dermatitis. Front Med (Lausanne). 2024;11:1353784.
30. Kobiela A, Frackowiak JE, Biernacka A, et al. Exposure of keratinocytes to Candida albicans in the context of atopic milieu induces changes in the surface glycosylation pattern of small extracellular vesicles to enhance their propensity to interact with inhibitory Siglec receptors. Front Immunol. 2022;13:884530.
31. Belfrage E, Jinnestål CL, Jönsen A, et al. Role of mannose-binding lectin and association with microbial sensitization in a cohort of patients with atopic dermatitis. Acta Derm Venereol. 2023 Mar 30;103:adv2405. DOI: 10.2340/actadv.v103.2405
32. Salvati L, Cosmi L, Annunziato F. From emollients to biologicals: targeting atopic dermatitis. Int J Mol Sci. 2021;22(19):10381.
33. Elsgaard S, Danielsen AK, Thyssen JP, et al. Drug survival of systemic immunosuppressive treatments for atopic dermatitis in a long-term pediatric cohort. Int J Women’s Dermatol. 2021;7(5):708-15.
34. Ferrucci SM, Tavecchio S, Marzano AV, Buffon S. Emerging systemic treatments for atopic dermatitis. Dermatol Ther (Heidelberg). 2023;13(5):1071-81.
35. Edslev SM, Agner T, Andersen PS. Skin microbiome in atopic dermatitis. Acta Derm Venereol. 2020;100(12):adv00164.
36. Khadka VD, Key FM, Romo-González C, et al. The skin microbiome of patients with atopic dermatitis normalizes gradually during treatment. Front Cell Infect Microbiol. 2021;11:720674.
37. Harder I, Stölzl D, Sander N, et al. Effects of early emollient use in children at high risk of atopic dermatitis: a German pilot study. Acta Derm Venereol. 2023;103:adv5671.
38. Krzysiek J, Żurawska-Olszewska J, Szczerba I, et al. Shift in skin microbiota of children with atopic dermatitis after topical gentian violet application. Postepy Dermatol Alergol. 2023;40(2):308-14.
39. Stolarczyk A, Perez-Nazario N, Knowlden SA, et al. Bleach baths enhance skin barrier, reduce itch but do not normalize skin dysbiosis in atopic dermatitis. Arch Dermatol Res. 2023;315(10):2883-92.
40. Dewi DAR, Perdiyana A, Wiliantari NM, et al. Managing the skin microbiome as a new bacteriotherapy for inflammatory atopic dermatitis. Cureus. 2023;15(11):e48803.
41. Lossius AH, Sundnes O, Ingham AC, et al. Shifts in the skin microbiota after UVB treatment in adult atopic dermatitis. Dermatology. 2022;238(1):109-20.
42. Tsuji G, Yamamura K, Kawamura K, et al. Novel therapeutic targets for the treatment of atopic dermatitis. Biomedicines. 2023;11(5): 1303.
43. Мурашкин Н.Н., Намазова-Баранова Л.С., Опрятин Л.А. и др. Биологическая терапия среднетяжелых и тяжелых форм атопического дерматита в детском возрасте. Вопросы современной педиатрии. 2020;19(6):432-43. DOI: 10.15690/vsp.v19i6.2145
Murashkin N.N., Namazova-Baranova L.S., Opryatin L.A., et al. Biologic Therapy of Moderate and Severe Forms of Atopic Dermatitis in Children. Current Pediatrics. 2020;19(6):432-43. DOI: 10.15690/ vsp.v19i6.2145 (in Russian).
44. Olesen CM, Ingham AC, Thomsen SF, et al. Changes in skin and nasal microbiome and staphylococcal species following treatment of atopic dermatitis with dupilumab. Microorganisms. 2021;9(7):1487.
45. Simpson EL, Schlievert PM, Yoshida T, et al. Rapid reduction in Staphylococcus aureus in atopic dermatitis subjects following dupilumab treatment. J Allergy Clin Immunol. 2023 Nov;152(5): 1179-95. DOI: 10.1016/j.jaci.2023.05.026