Клинический разбор в общей медицине №4 2025
Клинический разбор в общей медицине №4 2025
Иммуноактивные фармаконутриенты в лечении и профилактике острых респираторных вирусных инфекций
Номера страниц в выпуске:105-113
Аннотация
По данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится до 90% всей инфекционной заболеваемости. Масштабы распространенности ОРВИ делают актуальным поиск новых способов профилактики и лечения. Эпидемия COVID-19 стимулировала интенсивное изучение влияния нутритивного статуса на иммунитет и течение инфекций. В частности, дефицит микроэлементов (цинка, селена) и витаминов A и D рассматривается как фактор, способный ослаблять противоинфекционную защиту организма. Возрос интерес к использованию витаминно-минеральных добавок для профилактики и терапии ОРВИ. В статье рассматривается участие микронутриентов в иммунной защите, контроле воспаления, работе антиоксидантной системы. Собраны данные систематических обзоров и метаанализов исследований эффективности применения микронутриентов для профилактики и лечения респираторных заболеваний и постковидного синдрома. Проведен анализ систематических обзоров для определения нутригенетических факторов, способных влиять на предрасположенность к дефициту микронутриентов.
Ключевые слова: нутригенетика витаминов, цинк, селен, антиоксиданты, витамин D, витамин A, COVID-19, постковидный синдром, острые респираторные заболевания, ферроптоз.
Для цитирования: Пономарева Л.А., Ефремова К.Б., Литвинова М.М., Попова Е.Н. Иммуноактивные фармаконутриенты в лечении и профилактике острых респираторных вирусных инфекций. Клинический разбор в общей медицине. 2025; 6 (4): 105–113.
DOI: 10.47407/kr2025.6.4.00603
По данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится до 90% всей инфекционной заболеваемости. Масштабы распространенности ОРВИ делают актуальным поиск новых способов профилактики и лечения. Эпидемия COVID-19 стимулировала интенсивное изучение влияния нутритивного статуса на иммунитет и течение инфекций. В частности, дефицит микроэлементов (цинка, селена) и витаминов A и D рассматривается как фактор, способный ослаблять противоинфекционную защиту организма. Возрос интерес к использованию витаминно-минеральных добавок для профилактики и терапии ОРВИ. В статье рассматривается участие микронутриентов в иммунной защите, контроле воспаления, работе антиоксидантной системы. Собраны данные систематических обзоров и метаанализов исследований эффективности применения микронутриентов для профилактики и лечения респираторных заболеваний и постковидного синдрома. Проведен анализ систематических обзоров для определения нутригенетических факторов, способных влиять на предрасположенность к дефициту микронутриентов.
Ключевые слова: нутригенетика витаминов, цинк, селен, антиоксиданты, витамин D, витамин A, COVID-19, постковидный синдром, острые респираторные заболевания, ферроптоз.
Для цитирования: Пономарева Л.А., Ефремова К.Б., Литвинова М.М., Попова Е.Н. Иммуноактивные фармаконутриенты в лечении и профилактике острых респираторных вирусных инфекций. Клинический разбор в общей медицине. 2025; 6 (4): 105–113.
DOI: 10.47407/kr2025.6.4.00603
Review
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
liubaponomareva18@yandex.ru
Abstract
According to the data of the World Health Organization, acute respiratory viral infections (ARVI) account for up to 90% of all infectious diseases. The ARVI prevalence rate makes the search for new prevention and treatment methods relevant. The COVID-19 outbreak encouraged extensive study of the impact of nutritional status on the immunity and infection course. In particular, mineral (zinc, selenium) deficiency and vitamin A and D deficiency are considered as a factor capable of impairing body’s defense against infection. There is increased interest in the use of vitamin and mineral supplementation for prevention and treatment of respiratory infections. The paper considers micronutrient involvement in immune defense, inflammation control, antioxidant system. The data of systematic reviews and meta-analyses of the studies of efficacy of the use of micronutrients for prevention and treatment of respiratory diseases and post-COVID syndrome have been collected. The analysis of systematic reviews aimed to determine nutrigenetic factors capable of affecting susceptibility to micronutrient deficiency has been conducted.
Keywords: nutrigenetics of vitamins, zinc, selenium, antioxidants, vitamin D, vitamin A, COVID-19, post-COVID syndrome, acute respiratory diseases, ferroptosis.
For citation: Ponomareva L.A., Efremova K.B.. Litvinova M.M., Popova E.N. Immunologically active pharmaconutrients in treatment and prevention of acute respiratory viral infections. Clinical review for general practice. 2025; 6 (4): 105–113 (In Russ.). DOI: 10.47407/kr2025.6.4.00603
Острые респираторные вирусные инфекции (ОРВИ) остаются лидирующими как по числу заболевших в популяции, так и по медико-экономическим и социальным затратам вследствие расходов на лечение и реабилитацию [1]. У части пациентов, особенно из групп риска по сердечно-сосудистым заболеваниям, нарушению толерантности к глюкозе, гиперлипидемии, вирусная контаминация даже при относительно легком течении заболевания может провоцировать нарушения ритма или проявления метаболических сдвигов [2]. Присоединение бактериальных возбудителей и развитие пневмонии значительно увеличивают бремя жизнеугрожающих рисков у госпитализированных больных с хронической сердечной недостаточностью (ХСН). В исследовании L. Shen и соавт. (2021) было показано, что возникновение пневмонии у пациентов с ХСН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) (PARADIGM-HF) было ассоциировано с пятикратным увеличением риска смерти от любых причин, смерти от сердечно-сосудистых осложнений и госпитализации по причине декомпенсации ХСН. При этом частота развития летального исхода составила 7,4 на 100 пациенто-лет у больных с ХСН без пневмонии и 39,5 – у больных с ХСН с пневмонией (ОР 4,34; 95% ДИ 3,73–5,05). В то же время у пациентов с ХСН с сохраненной ФВ ЛЖ (PARAGON-HF) аналогичный показатель составил 4,2 и 21,2 (ОР 3,76; 95% ДИ 3,09–4,58), что указывает на меньшее число случаев заболевания пневмонией у пациентов с сохраненной ФВ ЛЖ [3].
В российском исследовании пациентов с пневмонией было показано, что появление у больных с ХСН пневмонии, ассоциированной с Pseudomonas aeruginosa, многократно повышает риск смерти от сердечно-сосудистых причин, острого коронарного синдрома и тромбоза вен нижних конечностей. Среди наиболее значимых предикторов сердечно-сосудистых осложнений были снижение ФВ ЛЖ, увеличение провоспалительных маркеров и гипопротеинемия. В проведенном эксперименте in vitro были доказаны молекулярные механизмы развития программируемой смерти клетки – ферроптоза – при инфицировании P. aeruginosa и продемонстрирована протекторная роль оксида азота в уменьшении ферроптотической гибели клеток эпителия [4–6].
Эпидемия COVID-19 стимулировала интенсивное изучение влияния нутритивного статуса на иммунитет и течение инфекций. В частности, дефицит микроэлементов (цинка, селена) и витаминов A и D рассматривается как фактор, способный ослаблять противоинфекционную защиту организма. Соответственно, возрос интерес к использованию витаминно-минеральных добавок для профилактики и терапии респираторных инфекций [7]. Цинк, селен, витамины A и D не только потенцируют защитные функции иммунокомпетентных клеток, но и увеличивают антиоксидантный запас в организме, что снижает интенсивность повреждения как в месте внедрения возбудителя, так и по гуморальным механизмам в цепи реакций системного воспалительного ответа. Особый интерес вызывают защитные эффекты микронутриентов как препаратов, ингибирующих процессы программируемой гибели клеток, например в предотвращении ферроптоза эпителиальных клеток дыхательных путей при осложненном течении ОРВИ, постковидном синдроме (ПКС) и COVID-19, пневмониях, вызванных внутрибольничными возбудителями, а также использование их для реабилитации пациентов после инфекции [8].
К ключевым эффекторным иммунокомпетентным клеткам, ответственным за фагоцитоз патогенов, выработку цитокинов, координацию функций лимфоцитов и последующего иммунного ответа, относятся макрофаги. Функциональный потенциал макрофагов определяется обеспечением микронутриентами, которые входят в состав ферментных систем, регулирующих активность генов, участвующих в иммунном ответе. Дефицит ряда питательных веществ способен снизить бактерицидные свойства макрофагов, приводя к нарушению противоинфекционной защиты.
Роль некоторых иммунонутриентов в организации иммунной защиты
Цинк и селен. В макрофагах цинк участвует в работе ферментов антиоксидантной защиты и сигнальных путей, влияя на их способность к фагоцитозу и продукции цитокинов. Дефицит приводит не только к снижению фагоцитарной активности макрофагов, но и к выбросу медиаторов острого повреждения. Также цинк участвует в повреждении и уничтожении бактерий (например, Staphylococcus aureus), так как, с одной стороны, входит в состав ферментов, содержащихся в фаголизосомах макрофагов, а с другой – участвует в реакциях презентации антигена клеткам иммунного ответа и регуляции синтеза интерлейкинов в реакциях врожденного иммунитета [9].
Селен входит в состав selen-протеинов, обладающих антиоксидантными и противовоспалительными свойствами (глутатионпероксидазы, тиоредоксинредуктазы и др.). При достаточном содержании селена обеспечивается более стойкий баланс между активированными (M1) и альтернативно активированными (M2) макрофагами. Показано, что при наличии селена макрофаги смещаются от провоспалительного M1-фенотипа к противовоспалительному цитотоксическому M2-фенотипу. В эксперименте добавление селена к культуре макрофагов грызунов усиливало их фагоцитарную активность, продукцию оксида азота и эффективность уничтожения S. aureus [10]. Также предварительная инкубация макрофагов с селеном приводила к снижению активации ядерного фактора каппа-В (NF-κB) и сокращению высвобождения провоспалительных цитокинов при последующей стимуляции бактериями [10]. Таким образом, селен необходим для поддержания противоинфекционных функций макрофагов и предотвращения избыточной воспалительной реакции.
Витамин A. Витамин A (ретинол и его метаболит ретиноевая кислота) известен своим влиянием на дифференцировку клеток иммунной системы и поддержание барьерных функций эпителия [11]. Ретиноевая кислота влияет на созревание моноцитов и их превращение в макрофаги, а также на поляризацию макрофагов.
В частности, all-trans-ретиноевая кислота (all-trans-retinoic acid, ATRA) подавляет избыточное воспаление, способствуя переключению макрофагов с M1-фенотипа на M2-фенотип. Показано, что ATRA индуцирует дифференцировку моноцитов в направлении противовоспалительных тканевых макрофагов и снижает секрецию провоспалительных цитокинов этими клетками [11]. Кроме того, витамин A участвует в регуляции экспрессии генов, важных для фагоцитоза и бактерицидной функции. Например, было обнаружено, что ретиноиды могут повышать экспрессию в макрофагах белка NPC2, необходимого для работы фаголизосом, что способствует уничтожению внутриклеточных патогенов [11]. Нехватка витамина A, напротив, ассоциирована с ослаблением врожденного иммунитета и повышенной восприимчивостью к инфекциям. Таким образом, витамин A оказывает иммунорегуляторное действие на макрофаги: поддерживает их в состоянии, достаточном для эффективного фагоцитоза, но без избыточной воспалительной реакции.
Витамин D. Витамин D (в активной форме кальци-триола 1,25(OH)2D3) воздействует на различные звенья иммунитета, включая макрофаги. Рецепторы витамина D (vitamin D receptors, VDR) экспрессируются в моноцитах и макрофагах, а сами макрофаги способны локально синтезировать активный кальцитриол из циркулирующего 25(OH)D. Витамин D стимулирует врожденный иммунитет несколькими путями. Под действием кальцитриола активированные макрофаги усиливают синтез кателицидина (LL-37) и дефензина, что повышает микробицидный потенциал макрофагов. Активация Toll-подобных рецепторов в макрофагах запускает каскад, приводящий к образованию 1,25(OH)2D и последующей индукции гена кателицидина, что и приводит к уничтожению внутриклеточных форм бактерий. Витамин D подавляет избыточный синтез провоспалительных цитокинов (например, интерлейкина 6, фактора некроза опухоли α) и способствует относительному повышению противовоспалительных факторов (интерлейкин 10) [12]. Витамин D участвует в реакциях аутофагии, что важно для контроля внутриклеточных инфекций (например, Mycobacterium tuberculosis). Клинически дефицит витамина D связывают с нарушением работы иммунных клеток и повышенной восприимчивостью к инфекциям [12]. В целом витамин D усиливает врожденную защиту: он одновременно повышает непосредственную антибактериальную активность макрофагов (за счет индукции антимикробных пептидов) в отсутствие выраженного повреждения собственных тканей.
Таким образом, микронутриенты выполняют разнообразные функции в организме. Цинк участвует в процессах передачи информации об антигенах и в работе «вторичных мессенджеров» в клетке. Селен можно рассматривать как антиоксидант со сложными функциями защиты от повреждения. Витамин A необходим для дифференцировки и противовоспалительного профиля макрофагов, витамин D – для индукции антимикробных механизмов и контроля воспаления. Баланс данных микроэлементов в организме поддерживает эффективную работу макрофагов и других иммунокомпетентных клеток.
Защитная роль микроэлементов при респираторных инфекциях
Цинк. Различные метаанализы показывают, что применение цинка при первых симптомах простуды способно сократить длительность заболевания примерно на 2 дня и что прием цинка незначительно уменьшает продолжительность проявлений острой инфекции верхних дыхательных путей [13]. Прием цинка при респираторных вирусных инфекциях ассоциирован с более быстрым выздоровлением и в режиме профилактики снижает риск развития пневмонии. Назначение цинка детям дошкольного возраста снижало заболеваемость пневмонией примерно на 19% по сравнению с плацебо [14]. При дефиците цинка, напротив, отмечается повышение восприимчивости к легочным инфекциям. У пациентов с низким уровнем цинка наблюдались более тяжелые осложнения при COVID-19, чаще требовались госпитализация в реанимацию и искусственная вентиляция легких, а прием цинка был ассоциирован с уменьшением летальности на 37% по сравнению с теми, кто не получал его [15]. У больных с нормальным уровнем цинка реже развивался цитокиновый шторм и наблюдалось более быстрое снижение вирусной нагрузки. Последнее объясняется тем, что цинк тормозит репликацию ряда вирусов (например, риновирусов) и повышает выработку интерферона [13, 14].
Витамин D. Метаанализ 25 рандомизированных контролируемых исследований (включавших около 11 тыс. участников) показал, что регулярный прием витамина D достоверно снижает риск ОРВИ [16]. Согласно полученным данным, общий относительный риск заболевания ОРBИ при приеме витамина D уменьшился (OR ~0,88), причем наибольшую пользу получали люди с исходно низким уровнем 25(OH)D. Другое исследование отмечает, что прием витамина D снижает вероятность инфекций дыхательных путей примерно на 30–36% у лиц с выраженным дефицитом этого витамина [17]. Особенно актуальна достаточность витамина D в зимне-весенний период, когда его синтез в коже минимален, а частота ОРВИ максимальна. Дефицит витамина D ассоциирован с более тяжелым и длительным течением пневмонии и вирусных инфекций, тогда как у пациентов с его нормальными уровнями отмечается более легкое течение заболеваний [16]. В контексте COVID-19 низкий уровень 25(OH)D в сыворотке крови коррелировал с повышенным риском госпитализации и осложнений, что также указывает на значимость этого витамина в противовирусной защите.
Витамин A. Известно, что витамин A участвует в сохранении барьерных функций эпителия, поддерживает их целостность и продукцию слизистого секрета с содержанием секреторных IgA-антител [11]. У детей с гиповитаминозом A наблюдается более высокая частота ОРВИ и пневмоний, а добавки ретинола снижают тяжесть и продолжительность этих заболеваний [11]. Например, в регионах, эндемичных по дефициту витамина A, введение этого витамина сократило общее число эпизодов инфекций нижних дыхательных путей. Витамин A опосредует свои эффекты частично через влияние на макрофаги и дендритные клетки, улучшая антиген-презентацию и выработку антител.
Селен. Влияние селена на противовирусную защиту продемонстрировано при инфекции вирусом Коксаки и связанной с этим вирусом кардиомиопатии, вспышка которой наблюдалась в китайской провинции Кешан (болезнь Кешана), отличавшейся дефицитом селена в почве. При недостатке селена вирус более интенсивно мутирует в высокопатогенный штамм, вызывая тяжелое поражение сердца [18]. Аналогично в экспериментах на мышах дефицит селена был связан с повышенной вирулентностью вируса: мыши с дефицитом селена переносили грипп значительно тяжелее, с более выраженными морфологическими изменениями в легких, чем животные с его нормальным уровнем [19]. При дефиците селена ослабляется работа селензависимых антиоксидантных систем (глутатионпероксидазы и др.), что ведет к неконтролируемому накоплению активных форм кислорода. Кроме того, дефицит селена нарушает функцию иммунных клеток (включая макрофаги, NK-клетки), что замедляет элиминацию вируса, тогда как использование пищевых добавок селена, по некоторым данным, ассоциируется с более быстрым снижением вирусной нагрузки (например, вирусом гепатита В и ВИЧ, по результатам отдельных исследований) [10, 19].
В клинических наблюдениях примерно у 50% пациентов с COVID-19 обнаруживали дефицит селена, причем у не выживших пациентов недостаток селена встречался почти в 2 раза чаще, чем у выживших (65% vs 39%) [20]. Другое исследование, проведенное в Китае, обнаружило географическую корреляцию: регионы с более высоким средним потреблением селена (по содержанию в грунте и пище) имели более высокий процент выздоровления от COVID-19, тогда как в регионах с низким содержанием селена смертность была выше [21]. Такие наблюдения согласуются с гипотезой, что селен улучшает противовирусную резистентность при коронавирусной инфекции, вероятно, через поддержание антиоксидантной защиты (глутатионпероксидаза и др.) и иммунитета. Имеются пилотные испытания, в которых больным COVID-19 вводили натрия селенит в дополнение к стандартной терапии: некоторые авторы сообщают о более быстром снижении уровней маркеров воспаления (интерлейкинов), что позволяет рассматривать дефицит селена как прогностически неблагоприятный признак [7].
Селен и защита от ферроптоза
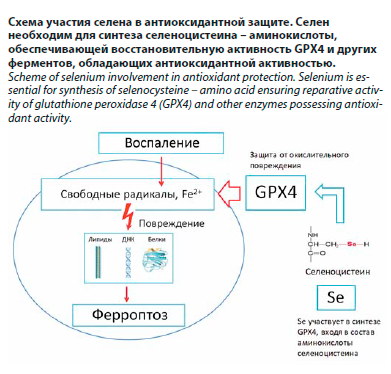 Помимо иммуномодулирующей роли при инфекциях, селен обладает уникальной функцией защиты клеток от ферроптоза (см. рисунок). Ферроптоз – это вид регулируемой клеточной гибели, характеризующийся избыточным перекисным окислением липидов в мембранах и зависящий от наличия двухвалентного железа и реактивных кислородных радикалов [11]. Во время острых воспалительных процессов, в том числе при тяжелых бронхолегочных инфекциях, в очаге бактериального повреждения возникает избыток свободных радикалов и железо высвобождается из разрушенных клеток. В норме клетки защищены от ферроптоза с помощью антиоксидантных систем, ключевую роль среди которых играет фермент глутатионпероксидаза 4 (GPX4). Синтез активной формы GPX4 и ее ферментативная активность напрямую требуют наличия селена. Если в организме существует дефицит селена, уровень GPX4 снижается и фермент может содержать менее эффективный аналог – цистеин, что резко уменьшает его способность восстанавливать липидные перекиси [22]. В противоположность этому, дополнительное введение селена увеличивает экспрессию и эффективность GPX4, укрепляя клеточные мембраны перед лицом оксидативной атаки [22]. Таким образом, достаточный уровень селена может защищать легочную ткань от необратимой гибели клеток вследствие ферроптоза при тяжелом воспалении. Кроме того, ферроптоз связывают с некоторыми хроническими заболеваниями легких и другими состояниями (нейродегенеративные процессы, рак), при которых селен также проявляет защитные свойства [23]. Предполагается, что при COVID-19, для которого характерны гипервоспалительный синдром и оксидативный стресс, селен способен смягчать повреждения органов, предотвращая неконтролируемый ферроптоз клеток легких, миокарда и т.д.
Помимо иммуномодулирующей роли при инфекциях, селен обладает уникальной функцией защиты клеток от ферроптоза (см. рисунок). Ферроптоз – это вид регулируемой клеточной гибели, характеризующийся избыточным перекисным окислением липидов в мембранах и зависящий от наличия двухвалентного железа и реактивных кислородных радикалов [11]. Во время острых воспалительных процессов, в том числе при тяжелых бронхолегочных инфекциях, в очаге бактериального повреждения возникает избыток свободных радикалов и железо высвобождается из разрушенных клеток. В норме клетки защищены от ферроптоза с помощью антиоксидантных систем, ключевую роль среди которых играет фермент глутатионпероксидаза 4 (GPX4). Синтез активной формы GPX4 и ее ферментативная активность напрямую требуют наличия селена. Если в организме существует дефицит селена, уровень GPX4 снижается и фермент может содержать менее эффективный аналог – цистеин, что резко уменьшает его способность восстанавливать липидные перекиси [22]. В противоположность этому, дополнительное введение селена увеличивает экспрессию и эффективность GPX4, укрепляя клеточные мембраны перед лицом оксидативной атаки [22]. Таким образом, достаточный уровень селена может защищать легочную ткань от необратимой гибели клеток вследствие ферроптоза при тяжелом воспалении. Кроме того, ферроптоз связывают с некоторыми хроническими заболеваниями легких и другими состояниями (нейродегенеративные процессы, рак), при которых селен также проявляет защитные свойства [23]. Предполагается, что при COVID-19, для которого характерны гипервоспалительный синдром и оксидативный стресс, селен способен смягчать повреждения органов, предотвращая неконтролируемый ферроптоз клеток легких, миокарда и т.д.
Применение микронутриентов для усиления действия антибиотиков
Эффективность антибактериальной терапии во многом зависит от состояния иммунной системы пациента; витамины и микроэлементы могут служить полезными адъювантами, усиливая бактерицидный эффект лечения. Цинк и витамин D способны стимулировать врожденные механизмы защиты, дополняя действие антибиотиков, что позволяет рассматривать их как «иммунные адъюванты». Метаанализ нескольких рандомизированных клинических исследований показал, что у лиц с рецидивирующими респираторными инфекциями добавление к терапии витамина D сопровождается снижением необходимости в антибиотиках [17].
В группе пациентов с дефицитом витамина D и склонностью к частым бронхитам восполнение уровня этого витамина приводило к сокращению случаев назначения антибиотиков почти на 49% [17]. Цинк напрямую угнетает рост некоторых бактерий; известен синергизм цинка с антибиотиками против Streptococcus pneumoniae и других возбудителей пневмонии. Например, в одном из исследований добавление Zn2+ усиливало действие β-лактамных антибиотиков на резистентные штаммы путем нарушения функции бактериальных мембран. Исследования in vitro демонстрируют, что некоторые витамины в высоких дозах могут потенцировать действие антибиотиков и подавлять образование бактериальных биопленок. Так, комбинированное применение витаминов Е и К с антибиотиками показало значительное снижение минимальных ингибирующих концентраций для P. aeruginosa и Acinetobacter baumannii [24].
Микронутриенты и постковидный синдром
ПКС (или long COVID) – состояние, при котором у переболевших COVID-19 сохраняются или появляются новые симптомы спустя недели и месяцы после острой фазы. Частые проявления – хроническая усталость, когнитивные нарушения, мышечная слабость, депрессия, а также периферические нейропатии. Патогенез ПКС остается неясным, предполагаются как прямое повреждение органов вирусом, так и аутоиммунные процессы, персистенция вируса, микрососудистые нарушения, прямое нейротоксическое действие вируса и т. д. [25].
Дефицит микронутриентов ассоциирован с когнитивными нарушениями и депрессией; селен как антиоксидант участвует в нейрональной защите, поэтому в некоторых клинических рекомендациях по ведению постковидных пациентов упоминаются комплексы, содержащие селен и цинк [26]. В немецком консенсусе по лечению когнитивных нарушений при ПКС рекомендована ежедневная добавка 35–40 мкг селена и 15 мг цинка для пациентов с подозреваемым дефицитом этих микронутриентов, хотя и отмечается невысокий уровень доказанности данной рекомендации [27]. К настоящему времени сведения о контролируемых испытаниях по лечению ПКС цинком или селеном очень скудны и порой противоречивы, хотя общая позиция такова: микронутриентная терапия может рассматриваться как вспомогательное средство у пациентов с ПКС, особенно если выявлен дефицит этих микронутриентов.
Генетические варианты, связанные со статусом микронутриентов
В период пандемии в лечении ОРВИ все шире применяются комбинированные препараты с целью контроля клинических симптомов, что определяет разработку персонифицированных подходов к выбору программы терапии с учетом генетически детерминированных механизмов. Однако результаты нутригенетических исследований, направленных на выявление наследственных предрасположенностей к дефициту микронутриентов и индивидуальных особенностей метаболизма витаминов и микроэлементов, пока не обладают достаточной доказательной базой для их применения в клинической практике.
Данные о том, что статус витамина D частично определяется генетическими факторами, получены в результате многочисленных исследований генов-кандидатов и общегеномных ассоциаций (genome-wide association study, GWAS). Так, полиморфизм генов, по разным оценкам, влияет на уровень витамина D в 29–80% случаев [28].
Несколько генов и генетических вариантов были признаны значимыми модуляторами уровня витамина D и его биодоступности: DHCR7, GC, CYP2R1, CYP24A1 и VDR [29]. Указанные гены кодируют ферменты, участвующие в транспорте и метаболизме витамина D: DHCR7 кодирует ферменты синтеза холекальциферола, экспрессируемые в коже; GC кодирует витамин
D-связывающий белок (vitamin D-binding protein, VDBP), который играет роль в транспорте предшественника витамина D; CYP2R1 кодирует 25-гидроксилазу, участвующую в активации предшественника витамина D, а CYP24A1 – 24-гидроксилазу, которая участвует в инактивации метаболитов витамина D. Было обнаружено, что варианты генов DHCR7 (rs12785878), GC (rs4588, rs7041), CYP2R1 (rs10741657, rs1993116 и rs10766197) и CYP24A1 (rs6013897) связаны с сывороточным уровнем кальцидиола – основной формы, в которой витамин D присутствует в кровотоке. Особое значение имеет ген VDR, кодирующий рецептор витамина D, фактор транскрипции, который регулирует экспрессию многочисленных генов после связывания с активной формой витамина D. Однако варианты в этом гене были связаны не с уровнем витамина D в организме, а с различными фенотипами хронических заболеваний [29].
В недавнем крупном систематическом обзоре было идентифицировано 43 однонуклеотидных полиморфизма (single nucleotide polymorphism, SNP), связанных с уровнем витамина D (табл. 1).
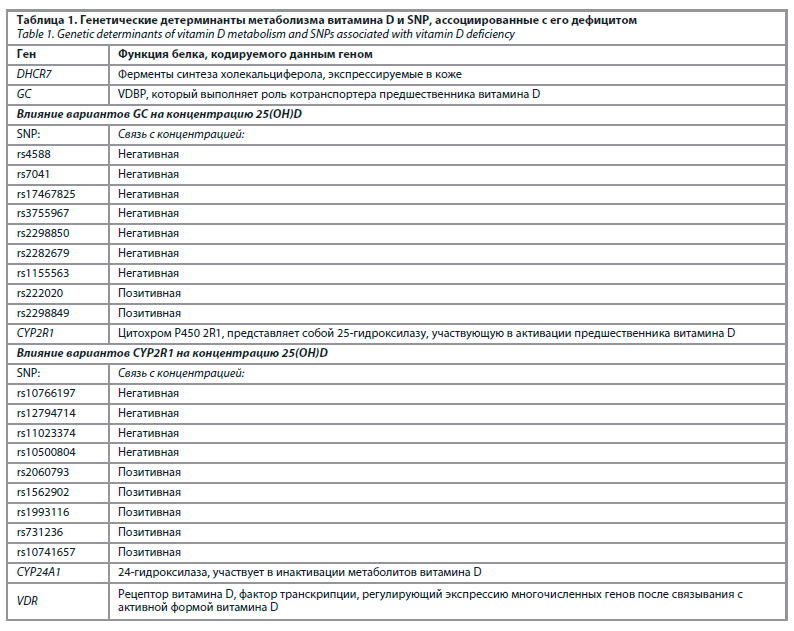
Положительные взаимосвязи были обнаружены для 17, отрицательные – для 19 SNP, для семи полиморфизмов были получены неубедительные результаты. GC был наиболее тщательно исследованным геном и имел наибольшее число SNP, связанных с витамином D. Большинство SNP в гене GC (8/10) снижают концентрацию кальцидиола, поэтому у людей с этими вариантами может быть эффективен прием добавок с витамином D, особенно в зимние месяцы [28]. Ассоциации между геном GC и маркерами витамина D были значительно слабее в зимние месяцы по сравнению с летними, что, вероятно, свидетельствует о взаимодействии GC SNP с ультрафиолетовым излучением. Более того, GC SNP, снижающие концентрацию кальцидиола, также коррелируют с более низким уровнем VDBP. Различия между результатами исследований могут быть вызваны неоднородностью частоты SNP в различных популяциях и этнических группах; требуются дальнейшие исследования в разных когортах.
Генетические варианты нутритивной активности витамина А
Ген PNPLA3 кодирует адипонутрин – липазу, участвующую в высвобождении ретинола из липидных капель в звездчатых клетках печени. Помимо PNPLA3, другие гены, участвующие в поглощении, транспорте и метаболизме витамина А, были связаны с концентрацией этого витамина в крови. Известны два независимых генетических варианта, rs1667255 и rs10882272, связанных с уровнем циркулирующего ретинола. Указанные варианты расположены рядом с генами, кодирующими основные белки – переносчики ретинола: транстиретин (TTR) и ретинолсвязывающий белок 4 (RBP4). Было показано, что уровни RBP4 и TTR снижаются во время активного воспаления, несмотря на достаточное количество витамина А. Эффективность добавок витамина А потенциально может быть ограничена сниженной экспрессией ALDH1a2 (члена семейства альдегиддегидрогеназы 1 A2) и повышенной активностью катаболизирующего фермента рутениевой кислоты CYP26A1 [29].
Селен, цинк и антиоксиданты
Ферменты глутатион-S-трансферазы имеют широкое значение для восприимчивости или резистентности к многофакторным заболеваниям, а также для детоксикации химических веществ и лекарств. Гены суперсемейства глутатион-S-трансфераз – GSTT1, GSTM1 и GSTP1 – характеризуются значительным популяционным полиморфизмом (табл. 2).
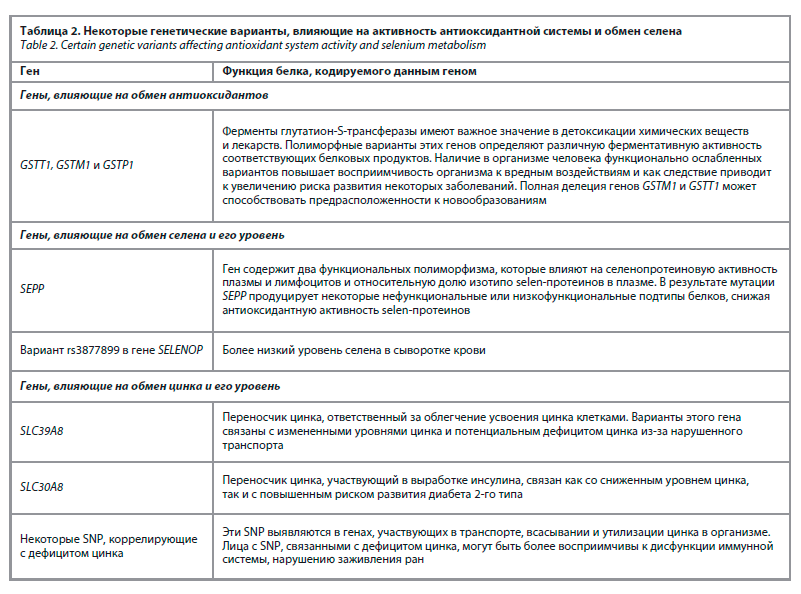
Полиморфные варианты этих генов определяют различную ферментативную активность соответствующих белковых продуктов. Наличие в организме человека функционально ослабленных вариантов повышает восприимчивость организма к вредным воздействиям и как следствие ведет к увеличению риска развития некоторых заболеваний [30]. Более того, возможна полная делеция генов GSTM1 и GSTT1, что может способствовать предрасположенности к новообразованиям и индивидуальной вариабельности в отношении безопасности и эффективности лекарств [31].
Ген SEPP содержит два функциональных полиморфизма, которые влияют на селенопротеиновую активность плазмы и лимфоцитов и относительную долю изотипо selen-протеинов в плазме в экспериментах in vivo. Следовательно, в результате мутации SEPP продуцирует некоторые нефункциональные или низкофункциональные подтипы белков, снижая антиоксидантную активность selen-протеинов [32]. Были выявлены SNP, коррелирующие с дефицитом селена (см. табл.2), их вариации могут воздействовать на экспрессию или активность ферментов, связанных с селеном, что может оказывать влияние на уровень селена и обусловленные этим последствия для здоровья. Однако эффекты этих SNP могут различаться у разных людей, и требуются дополнительные исследования [33].
Исследования, в которых анализировалась активность белков, связанных с GPX1, GPX4 и селенопротеином P (SELENOP), показали, что добавки с селеном влияют на эти гены. Несмотря на то что эти гены важны для действия селена, в исследованиях GWAS они не показали связи со статусом селена и требуют дальнейшего изучения [33].
Было идентифицировано несколько SNP, коррелирующих с дефицитом цинка. Эти SNP выявляются в генах, участвующих в транспорте, всасывании и утилизации цинка в организме. Один из таких SNP обнаружен в гене SLC39A8, кодирующем переносчик цинка, ответственный за облегчение усвоения цинка клетками. Варианты этого гена были связаны с измененными уровнями цинка и потенциальным дефицитом цинка из-за нарушенного транспорта. Другой SNP в гене SLC30A8, который кодирует переносчик цинка, участвующий в выработке инсулина, был связан как со сниженным уровнем цинка, так и с повышенным риском развития диабета 2-го типа. Лица с SNP, связанными с дефицитом цинка, могут быть более восприимчивы к дисфункции иммунной системы, нарушению заживления ран и когнитивному дефициту [33]. Проводилось исследование по установлению ассоциаций SNP, связанных с обменом цинка, с тяжестью протекания COVID-19 [34, 35].
Zn – 8 мг; бета-каротина – 4,8 мг; витамина Е – 35 мг; витамина С – 200 мг. Клинические эффекты Селцинк Плюс® обусловлены свойствами входящих в состав препарата микроэлементов: Se и Zn, а также витаминов С, Е и бета-каротина, обладающих антиоксидантной активностью. В составе комплексной терапии при сезонных ОРВИ и гриппе перспективно применение новой формы препарата Селцинк® компании PRO.MED.CS Praha a. s. – Селцинк® Ультра Флю. Особенность
Селцинк® Ультра Флю, выпущенного на российский рынок в декабре 2022 г., – увеличенное содержание цинка и витамина С: в составе 1 таблетки Se – 50 мкг;
Zn – 20 мг; витамин С – 225 мг. Преимуществом БАД Селцинк® Ультра Флю является тройное действие, направленное на защиту организма от вирусов и поддержание работы иммунитета. Кроме того, в состав БАД Селцинк® Ультра Флю входит аскорбиновая кислота, что также повышает неспецифические и специфические способы защиты от респираторных инфекций.
Перспективы дальнейших исследований включают крупномасштабные клинические испытания витаминно-минеральной поддержки при вирусных пневмониях и постковидном синдроме, что поможет выработать четкие практические рекомендации для врачей. На данный момент уже очевидно, что интеграция знаний о питании и иммунитете открывает дополнительные возможности в повышении эффективности лечения инфекций и улучшении исходов для пациентов.
Информация об авторах
Information about the authors
Пономарева Любовь Андреевна – ассистент, каф. факультетской терапии №2, врач-кардиолог, врач-терапевт, Консультативно-диагностическое отд-ние, ФГАОУ ВО «Первый МГМУ им.
И.М. Сеченова» (Сеченовский Университет). E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Аssistant, therapist, Sechenov
First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Ефремова Кюрелей Борисовна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: kiraefremova776@gmail.com
Kyurelei B. Efremova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kiraefremova776@gmail.com
Литвинова Мария Михайловна – доц. каф. медицинской генетики, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: litvinova_m_m@staff.sechenov.ru
Maria M. Litvinova – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: litvinova_m_m@staff.sechenov.ru
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Поступила в редакцию: 24.03.2025
Поступила после рецензирования: 31.03.2025
Принята к публикации: 24.04.2025
Received: 24.03.2025
Revised: 31.03.2025
Accepted: 24.04.2025
Immunologically active pharmaconutrients in treatment and prevention of acute respiratory viral infections
Liubov A. Ponomareva, Kyurelei B. Efremova, Maria M. Litvinova, Elena N. PopovaSechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
liubaponomareva18@yandex.ru
Abstract
According to the data of the World Health Organization, acute respiratory viral infections (ARVI) account for up to 90% of all infectious diseases. The ARVI prevalence rate makes the search for new prevention and treatment methods relevant. The COVID-19 outbreak encouraged extensive study of the impact of nutritional status on the immunity and infection course. In particular, mineral (zinc, selenium) deficiency and vitamin A and D deficiency are considered as a factor capable of impairing body’s defense against infection. There is increased interest in the use of vitamin and mineral supplementation for prevention and treatment of respiratory infections. The paper considers micronutrient involvement in immune defense, inflammation control, antioxidant system. The data of systematic reviews and meta-analyses of the studies of efficacy of the use of micronutrients for prevention and treatment of respiratory diseases and post-COVID syndrome have been collected. The analysis of systematic reviews aimed to determine nutrigenetic factors capable of affecting susceptibility to micronutrient deficiency has been conducted.
Keywords: nutrigenetics of vitamins, zinc, selenium, antioxidants, vitamin D, vitamin A, COVID-19, post-COVID syndrome, acute respiratory diseases, ferroptosis.
For citation: Ponomareva L.A., Efremova K.B.. Litvinova M.M., Popova E.N. Immunologically active pharmaconutrients in treatment and prevention of acute respiratory viral infections. Clinical review for general practice. 2025; 6 (4): 105–113 (In Russ.). DOI: 10.47407/kr2025.6.4.00603
Острые респираторные вирусные инфекции (ОРВИ) остаются лидирующими как по числу заболевших в популяции, так и по медико-экономическим и социальным затратам вследствие расходов на лечение и реабилитацию [1]. У части пациентов, особенно из групп риска по сердечно-сосудистым заболеваниям, нарушению толерантности к глюкозе, гиперлипидемии, вирусная контаминация даже при относительно легком течении заболевания может провоцировать нарушения ритма или проявления метаболических сдвигов [2]. Присоединение бактериальных возбудителей и развитие пневмонии значительно увеличивают бремя жизнеугрожающих рисков у госпитализированных больных с хронической сердечной недостаточностью (ХСН). В исследовании L. Shen и соавт. (2021) было показано, что возникновение пневмонии у пациентов с ХСН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) (PARADIGM-HF) было ассоциировано с пятикратным увеличением риска смерти от любых причин, смерти от сердечно-сосудистых осложнений и госпитализации по причине декомпенсации ХСН. При этом частота развития летального исхода составила 7,4 на 100 пациенто-лет у больных с ХСН без пневмонии и 39,5 – у больных с ХСН с пневмонией (ОР 4,34; 95% ДИ 3,73–5,05). В то же время у пациентов с ХСН с сохраненной ФВ ЛЖ (PARAGON-HF) аналогичный показатель составил 4,2 и 21,2 (ОР 3,76; 95% ДИ 3,09–4,58), что указывает на меньшее число случаев заболевания пневмонией у пациентов с сохраненной ФВ ЛЖ [3].
В российском исследовании пациентов с пневмонией было показано, что появление у больных с ХСН пневмонии, ассоциированной с Pseudomonas aeruginosa, многократно повышает риск смерти от сердечно-сосудистых причин, острого коронарного синдрома и тромбоза вен нижних конечностей. Среди наиболее значимых предикторов сердечно-сосудистых осложнений были снижение ФВ ЛЖ, увеличение провоспалительных маркеров и гипопротеинемия. В проведенном эксперименте in vitro были доказаны молекулярные механизмы развития программируемой смерти клетки – ферроптоза – при инфицировании P. aeruginosa и продемонстрирована протекторная роль оксида азота в уменьшении ферроптотической гибели клеток эпителия [4–6].
Эпидемия COVID-19 стимулировала интенсивное изучение влияния нутритивного статуса на иммунитет и течение инфекций. В частности, дефицит микроэлементов (цинка, селена) и витаминов A и D рассматривается как фактор, способный ослаблять противоинфекционную защиту организма. Соответственно, возрос интерес к использованию витаминно-минеральных добавок для профилактики и терапии респираторных инфекций [7]. Цинк, селен, витамины A и D не только потенцируют защитные функции иммунокомпетентных клеток, но и увеличивают антиоксидантный запас в организме, что снижает интенсивность повреждения как в месте внедрения возбудителя, так и по гуморальным механизмам в цепи реакций системного воспалительного ответа. Особый интерес вызывают защитные эффекты микронутриентов как препаратов, ингибирующих процессы программируемой гибели клеток, например в предотвращении ферроптоза эпителиальных клеток дыхательных путей при осложненном течении ОРВИ, постковидном синдроме (ПКС) и COVID-19, пневмониях, вызванных внутрибольничными возбудителями, а также использование их для реабилитации пациентов после инфекции [8].
К ключевым эффекторным иммунокомпетентным клеткам, ответственным за фагоцитоз патогенов, выработку цитокинов, координацию функций лимфоцитов и последующего иммунного ответа, относятся макрофаги. Функциональный потенциал макрофагов определяется обеспечением микронутриентами, которые входят в состав ферментных систем, регулирующих активность генов, участвующих в иммунном ответе. Дефицит ряда питательных веществ способен снизить бактерицидные свойства макрофагов, приводя к нарушению противоинфекционной защиты.
Роль некоторых иммунонутриентов в организации иммунной защиты
Цинк и селен. В макрофагах цинк участвует в работе ферментов антиоксидантной защиты и сигнальных путей, влияя на их способность к фагоцитозу и продукции цитокинов. Дефицит приводит не только к снижению фагоцитарной активности макрофагов, но и к выбросу медиаторов острого повреждения. Также цинк участвует в повреждении и уничтожении бактерий (например, Staphylococcus aureus), так как, с одной стороны, входит в состав ферментов, содержащихся в фаголизосомах макрофагов, а с другой – участвует в реакциях презентации антигена клеткам иммунного ответа и регуляции синтеза интерлейкинов в реакциях врожденного иммунитета [9].
Селен входит в состав selen-протеинов, обладающих антиоксидантными и противовоспалительными свойствами (глутатионпероксидазы, тиоредоксинредуктазы и др.). При достаточном содержании селена обеспечивается более стойкий баланс между активированными (M1) и альтернативно активированными (M2) макрофагами. Показано, что при наличии селена макрофаги смещаются от провоспалительного M1-фенотипа к противовоспалительному цитотоксическому M2-фенотипу. В эксперименте добавление селена к культуре макрофагов грызунов усиливало их фагоцитарную активность, продукцию оксида азота и эффективность уничтожения S. aureus [10]. Также предварительная инкубация макрофагов с селеном приводила к снижению активации ядерного фактора каппа-В (NF-κB) и сокращению высвобождения провоспалительных цитокинов при последующей стимуляции бактериями [10]. Таким образом, селен необходим для поддержания противоинфекционных функций макрофагов и предотвращения избыточной воспалительной реакции.
Витамин A. Витамин A (ретинол и его метаболит ретиноевая кислота) известен своим влиянием на дифференцировку клеток иммунной системы и поддержание барьерных функций эпителия [11]. Ретиноевая кислота влияет на созревание моноцитов и их превращение в макрофаги, а также на поляризацию макрофагов.
В частности, all-trans-ретиноевая кислота (all-trans-retinoic acid, ATRA) подавляет избыточное воспаление, способствуя переключению макрофагов с M1-фенотипа на M2-фенотип. Показано, что ATRA индуцирует дифференцировку моноцитов в направлении противовоспалительных тканевых макрофагов и снижает секрецию провоспалительных цитокинов этими клетками [11]. Кроме того, витамин A участвует в регуляции экспрессии генов, важных для фагоцитоза и бактерицидной функции. Например, было обнаружено, что ретиноиды могут повышать экспрессию в макрофагах белка NPC2, необходимого для работы фаголизосом, что способствует уничтожению внутриклеточных патогенов [11]. Нехватка витамина A, напротив, ассоциирована с ослаблением врожденного иммунитета и повышенной восприимчивостью к инфекциям. Таким образом, витамин A оказывает иммунорегуляторное действие на макрофаги: поддерживает их в состоянии, достаточном для эффективного фагоцитоза, но без избыточной воспалительной реакции.
Витамин D. Витамин D (в активной форме кальци-триола 1,25(OH)2D3) воздействует на различные звенья иммунитета, включая макрофаги. Рецепторы витамина D (vitamin D receptors, VDR) экспрессируются в моноцитах и макрофагах, а сами макрофаги способны локально синтезировать активный кальцитриол из циркулирующего 25(OH)D. Витамин D стимулирует врожденный иммунитет несколькими путями. Под действием кальцитриола активированные макрофаги усиливают синтез кателицидина (LL-37) и дефензина, что повышает микробицидный потенциал макрофагов. Активация Toll-подобных рецепторов в макрофагах запускает каскад, приводящий к образованию 1,25(OH)2D и последующей индукции гена кателицидина, что и приводит к уничтожению внутриклеточных форм бактерий. Витамин D подавляет избыточный синтез провоспалительных цитокинов (например, интерлейкина 6, фактора некроза опухоли α) и способствует относительному повышению противовоспалительных факторов (интерлейкин 10) [12]. Витамин D участвует в реакциях аутофагии, что важно для контроля внутриклеточных инфекций (например, Mycobacterium tuberculosis). Клинически дефицит витамина D связывают с нарушением работы иммунных клеток и повышенной восприимчивостью к инфекциям [12]. В целом витамин D усиливает врожденную защиту: он одновременно повышает непосредственную антибактериальную активность макрофагов (за счет индукции антимикробных пептидов) в отсутствие выраженного повреждения собственных тканей.
Таким образом, микронутриенты выполняют разнообразные функции в организме. Цинк участвует в процессах передачи информации об антигенах и в работе «вторичных мессенджеров» в клетке. Селен можно рассматривать как антиоксидант со сложными функциями защиты от повреждения. Витамин A необходим для дифференцировки и противовоспалительного профиля макрофагов, витамин D – для индукции антимикробных механизмов и контроля воспаления. Баланс данных микроэлементов в организме поддерживает эффективную работу макрофагов и других иммунокомпетентных клеток.
Защитная роль микроэлементов при респираторных инфекциях
Цинк. Различные метаанализы показывают, что применение цинка при первых симптомах простуды способно сократить длительность заболевания примерно на 2 дня и что прием цинка незначительно уменьшает продолжительность проявлений острой инфекции верхних дыхательных путей [13]. Прием цинка при респираторных вирусных инфекциях ассоциирован с более быстрым выздоровлением и в режиме профилактики снижает риск развития пневмонии. Назначение цинка детям дошкольного возраста снижало заболеваемость пневмонией примерно на 19% по сравнению с плацебо [14]. При дефиците цинка, напротив, отмечается повышение восприимчивости к легочным инфекциям. У пациентов с низким уровнем цинка наблюдались более тяжелые осложнения при COVID-19, чаще требовались госпитализация в реанимацию и искусственная вентиляция легких, а прием цинка был ассоциирован с уменьшением летальности на 37% по сравнению с теми, кто не получал его [15]. У больных с нормальным уровнем цинка реже развивался цитокиновый шторм и наблюдалось более быстрое снижение вирусной нагрузки. Последнее объясняется тем, что цинк тормозит репликацию ряда вирусов (например, риновирусов) и повышает выработку интерферона [13, 14].
Витамин D. Метаанализ 25 рандомизированных контролируемых исследований (включавших около 11 тыс. участников) показал, что регулярный прием витамина D достоверно снижает риск ОРВИ [16]. Согласно полученным данным, общий относительный риск заболевания ОРBИ при приеме витамина D уменьшился (OR ~0,88), причем наибольшую пользу получали люди с исходно низким уровнем 25(OH)D. Другое исследование отмечает, что прием витамина D снижает вероятность инфекций дыхательных путей примерно на 30–36% у лиц с выраженным дефицитом этого витамина [17]. Особенно актуальна достаточность витамина D в зимне-весенний период, когда его синтез в коже минимален, а частота ОРВИ максимальна. Дефицит витамина D ассоциирован с более тяжелым и длительным течением пневмонии и вирусных инфекций, тогда как у пациентов с его нормальными уровнями отмечается более легкое течение заболеваний [16]. В контексте COVID-19 низкий уровень 25(OH)D в сыворотке крови коррелировал с повышенным риском госпитализации и осложнений, что также указывает на значимость этого витамина в противовирусной защите.
Витамин A. Известно, что витамин A участвует в сохранении барьерных функций эпителия, поддерживает их целостность и продукцию слизистого секрета с содержанием секреторных IgA-антител [11]. У детей с гиповитаминозом A наблюдается более высокая частота ОРВИ и пневмоний, а добавки ретинола снижают тяжесть и продолжительность этих заболеваний [11]. Например, в регионах, эндемичных по дефициту витамина A, введение этого витамина сократило общее число эпизодов инфекций нижних дыхательных путей. Витамин A опосредует свои эффекты частично через влияние на макрофаги и дендритные клетки, улучшая антиген-презентацию и выработку антител.
Селен. Влияние селена на противовирусную защиту продемонстрировано при инфекции вирусом Коксаки и связанной с этим вирусом кардиомиопатии, вспышка которой наблюдалась в китайской провинции Кешан (болезнь Кешана), отличавшейся дефицитом селена в почве. При недостатке селена вирус более интенсивно мутирует в высокопатогенный штамм, вызывая тяжелое поражение сердца [18]. Аналогично в экспериментах на мышах дефицит селена был связан с повышенной вирулентностью вируса: мыши с дефицитом селена переносили грипп значительно тяжелее, с более выраженными морфологическими изменениями в легких, чем животные с его нормальным уровнем [19]. При дефиците селена ослабляется работа селензависимых антиоксидантных систем (глутатионпероксидазы и др.), что ведет к неконтролируемому накоплению активных форм кислорода. Кроме того, дефицит селена нарушает функцию иммунных клеток (включая макрофаги, NK-клетки), что замедляет элиминацию вируса, тогда как использование пищевых добавок селена, по некоторым данным, ассоциируется с более быстрым снижением вирусной нагрузки (например, вирусом гепатита В и ВИЧ, по результатам отдельных исследований) [10, 19].
В клинических наблюдениях примерно у 50% пациентов с COVID-19 обнаруживали дефицит селена, причем у не выживших пациентов недостаток селена встречался почти в 2 раза чаще, чем у выживших (65% vs 39%) [20]. Другое исследование, проведенное в Китае, обнаружило географическую корреляцию: регионы с более высоким средним потреблением селена (по содержанию в грунте и пище) имели более высокий процент выздоровления от COVID-19, тогда как в регионах с низким содержанием селена смертность была выше [21]. Такие наблюдения согласуются с гипотезой, что селен улучшает противовирусную резистентность при коронавирусной инфекции, вероятно, через поддержание антиоксидантной защиты (глутатионпероксидаза и др.) и иммунитета. Имеются пилотные испытания, в которых больным COVID-19 вводили натрия селенит в дополнение к стандартной терапии: некоторые авторы сообщают о более быстром снижении уровней маркеров воспаления (интерлейкинов), что позволяет рассматривать дефицит селена как прогностически неблагоприятный признак [7].
Селен и защита от ферроптоза
 Помимо иммуномодулирующей роли при инфекциях, селен обладает уникальной функцией защиты клеток от ферроптоза (см. рисунок). Ферроптоз – это вид регулируемой клеточной гибели, характеризующийся избыточным перекисным окислением липидов в мембранах и зависящий от наличия двухвалентного железа и реактивных кислородных радикалов [11]. Во время острых воспалительных процессов, в том числе при тяжелых бронхолегочных инфекциях, в очаге бактериального повреждения возникает избыток свободных радикалов и железо высвобождается из разрушенных клеток. В норме клетки защищены от ферроптоза с помощью антиоксидантных систем, ключевую роль среди которых играет фермент глутатионпероксидаза 4 (GPX4). Синтез активной формы GPX4 и ее ферментативная активность напрямую требуют наличия селена. Если в организме существует дефицит селена, уровень GPX4 снижается и фермент может содержать менее эффективный аналог – цистеин, что резко уменьшает его способность восстанавливать липидные перекиси [22]. В противоположность этому, дополнительное введение селена увеличивает экспрессию и эффективность GPX4, укрепляя клеточные мембраны перед лицом оксидативной атаки [22]. Таким образом, достаточный уровень селена может защищать легочную ткань от необратимой гибели клеток вследствие ферроптоза при тяжелом воспалении. Кроме того, ферроптоз связывают с некоторыми хроническими заболеваниями легких и другими состояниями (нейродегенеративные процессы, рак), при которых селен также проявляет защитные свойства [23]. Предполагается, что при COVID-19, для которого характерны гипервоспалительный синдром и оксидативный стресс, селен способен смягчать повреждения органов, предотвращая неконтролируемый ферроптоз клеток легких, миокарда и т.д.
Помимо иммуномодулирующей роли при инфекциях, селен обладает уникальной функцией защиты клеток от ферроптоза (см. рисунок). Ферроптоз – это вид регулируемой клеточной гибели, характеризующийся избыточным перекисным окислением липидов в мембранах и зависящий от наличия двухвалентного железа и реактивных кислородных радикалов [11]. Во время острых воспалительных процессов, в том числе при тяжелых бронхолегочных инфекциях, в очаге бактериального повреждения возникает избыток свободных радикалов и железо высвобождается из разрушенных клеток. В норме клетки защищены от ферроптоза с помощью антиоксидантных систем, ключевую роль среди которых играет фермент глутатионпероксидаза 4 (GPX4). Синтез активной формы GPX4 и ее ферментативная активность напрямую требуют наличия селена. Если в организме существует дефицит селена, уровень GPX4 снижается и фермент может содержать менее эффективный аналог – цистеин, что резко уменьшает его способность восстанавливать липидные перекиси [22]. В противоположность этому, дополнительное введение селена увеличивает экспрессию и эффективность GPX4, укрепляя клеточные мембраны перед лицом оксидативной атаки [22]. Таким образом, достаточный уровень селена может защищать легочную ткань от необратимой гибели клеток вследствие ферроптоза при тяжелом воспалении. Кроме того, ферроптоз связывают с некоторыми хроническими заболеваниями легких и другими состояниями (нейродегенеративные процессы, рак), при которых селен также проявляет защитные свойства [23]. Предполагается, что при COVID-19, для которого характерны гипервоспалительный синдром и оксидативный стресс, селен способен смягчать повреждения органов, предотвращая неконтролируемый ферроптоз клеток легких, миокарда и т.д.Применение микронутриентов для усиления действия антибиотиков
Эффективность антибактериальной терапии во многом зависит от состояния иммунной системы пациента; витамины и микроэлементы могут служить полезными адъювантами, усиливая бактерицидный эффект лечения. Цинк и витамин D способны стимулировать врожденные механизмы защиты, дополняя действие антибиотиков, что позволяет рассматривать их как «иммунные адъюванты». Метаанализ нескольких рандомизированных клинических исследований показал, что у лиц с рецидивирующими респираторными инфекциями добавление к терапии витамина D сопровождается снижением необходимости в антибиотиках [17].
В группе пациентов с дефицитом витамина D и склонностью к частым бронхитам восполнение уровня этого витамина приводило к сокращению случаев назначения антибиотиков почти на 49% [17]. Цинк напрямую угнетает рост некоторых бактерий; известен синергизм цинка с антибиотиками против Streptococcus pneumoniae и других возбудителей пневмонии. Например, в одном из исследований добавление Zn2+ усиливало действие β-лактамных антибиотиков на резистентные штаммы путем нарушения функции бактериальных мембран. Исследования in vitro демонстрируют, что некоторые витамины в высоких дозах могут потенцировать действие антибиотиков и подавлять образование бактериальных биопленок. Так, комбинированное применение витаминов Е и К с антибиотиками показало значительное снижение минимальных ингибирующих концентраций для P. aeruginosa и Acinetobacter baumannii [24].
Микронутриенты и постковидный синдром
ПКС (или long COVID) – состояние, при котором у переболевших COVID-19 сохраняются или появляются новые симптомы спустя недели и месяцы после острой фазы. Частые проявления – хроническая усталость, когнитивные нарушения, мышечная слабость, депрессия, а также периферические нейропатии. Патогенез ПКС остается неясным, предполагаются как прямое повреждение органов вирусом, так и аутоиммунные процессы, персистенция вируса, микрососудистые нарушения, прямое нейротоксическое действие вируса и т. д. [25].
Дефицит микронутриентов ассоциирован с когнитивными нарушениями и депрессией; селен как антиоксидант участвует в нейрональной защите, поэтому в некоторых клинических рекомендациях по ведению постковидных пациентов упоминаются комплексы, содержащие селен и цинк [26]. В немецком консенсусе по лечению когнитивных нарушений при ПКС рекомендована ежедневная добавка 35–40 мкг селена и 15 мг цинка для пациентов с подозреваемым дефицитом этих микронутриентов, хотя и отмечается невысокий уровень доказанности данной рекомендации [27]. К настоящему времени сведения о контролируемых испытаниях по лечению ПКС цинком или селеном очень скудны и порой противоречивы, хотя общая позиция такова: микронутриентная терапия может рассматриваться как вспомогательное средство у пациентов с ПКС, особенно если выявлен дефицит этих микронутриентов.
Генетические варианты, связанные со статусом микронутриентов
В период пандемии в лечении ОРВИ все шире применяются комбинированные препараты с целью контроля клинических симптомов, что определяет разработку персонифицированных подходов к выбору программы терапии с учетом генетически детерминированных механизмов. Однако результаты нутригенетических исследований, направленных на выявление наследственных предрасположенностей к дефициту микронутриентов и индивидуальных особенностей метаболизма витаминов и микроэлементов, пока не обладают достаточной доказательной базой для их применения в клинической практике.
Данные о том, что статус витамина D частично определяется генетическими факторами, получены в результате многочисленных исследований генов-кандидатов и общегеномных ассоциаций (genome-wide association study, GWAS). Так, полиморфизм генов, по разным оценкам, влияет на уровень витамина D в 29–80% случаев [28].
Несколько генов и генетических вариантов были признаны значимыми модуляторами уровня витамина D и его биодоступности: DHCR7, GC, CYP2R1, CYP24A1 и VDR [29]. Указанные гены кодируют ферменты, участвующие в транспорте и метаболизме витамина D: DHCR7 кодирует ферменты синтеза холекальциферола, экспрессируемые в коже; GC кодирует витамин
D-связывающий белок (vitamin D-binding protein, VDBP), который играет роль в транспорте предшественника витамина D; CYP2R1 кодирует 25-гидроксилазу, участвующую в активации предшественника витамина D, а CYP24A1 – 24-гидроксилазу, которая участвует в инактивации метаболитов витамина D. Было обнаружено, что варианты генов DHCR7 (rs12785878), GC (rs4588, rs7041), CYP2R1 (rs10741657, rs1993116 и rs10766197) и CYP24A1 (rs6013897) связаны с сывороточным уровнем кальцидиола – основной формы, в которой витамин D присутствует в кровотоке. Особое значение имеет ген VDR, кодирующий рецептор витамина D, фактор транскрипции, который регулирует экспрессию многочисленных генов после связывания с активной формой витамина D. Однако варианты в этом гене были связаны не с уровнем витамина D в организме, а с различными фенотипами хронических заболеваний [29].
В недавнем крупном систематическом обзоре было идентифицировано 43 однонуклеотидных полиморфизма (single nucleotide polymorphism, SNP), связанных с уровнем витамина D (табл. 1).

Положительные взаимосвязи были обнаружены для 17, отрицательные – для 19 SNP, для семи полиморфизмов были получены неубедительные результаты. GC был наиболее тщательно исследованным геном и имел наибольшее число SNP, связанных с витамином D. Большинство SNP в гене GC (8/10) снижают концентрацию кальцидиола, поэтому у людей с этими вариантами может быть эффективен прием добавок с витамином D, особенно в зимние месяцы [28]. Ассоциации между геном GC и маркерами витамина D были значительно слабее в зимние месяцы по сравнению с летними, что, вероятно, свидетельствует о взаимодействии GC SNP с ультрафиолетовым излучением. Более того, GC SNP, снижающие концентрацию кальцидиола, также коррелируют с более низким уровнем VDBP. Различия между результатами исследований могут быть вызваны неоднородностью частоты SNP в различных популяциях и этнических группах; требуются дальнейшие исследования в разных когортах.
Генетические варианты нутритивной активности витамина А
Ген PNPLA3 кодирует адипонутрин – липазу, участвующую в высвобождении ретинола из липидных капель в звездчатых клетках печени. Помимо PNPLA3, другие гены, участвующие в поглощении, транспорте и метаболизме витамина А, были связаны с концентрацией этого витамина в крови. Известны два независимых генетических варианта, rs1667255 и rs10882272, связанных с уровнем циркулирующего ретинола. Указанные варианты расположены рядом с генами, кодирующими основные белки – переносчики ретинола: транстиретин (TTR) и ретинолсвязывающий белок 4 (RBP4). Было показано, что уровни RBP4 и TTR снижаются во время активного воспаления, несмотря на достаточное количество витамина А. Эффективность добавок витамина А потенциально может быть ограничена сниженной экспрессией ALDH1a2 (члена семейства альдегиддегидрогеназы 1 A2) и повышенной активностью катаболизирующего фермента рутениевой кислоты CYP26A1 [29].
Селен, цинк и антиоксиданты
Ферменты глутатион-S-трансферазы имеют широкое значение для восприимчивости или резистентности к многофакторным заболеваниям, а также для детоксикации химических веществ и лекарств. Гены суперсемейства глутатион-S-трансфераз – GSTT1, GSTM1 и GSTP1 – характеризуются значительным популяционным полиморфизмом (табл. 2).

Полиморфные варианты этих генов определяют различную ферментативную активность соответствующих белковых продуктов. Наличие в организме человека функционально ослабленных вариантов повышает восприимчивость организма к вредным воздействиям и как следствие ведет к увеличению риска развития некоторых заболеваний [30]. Более того, возможна полная делеция генов GSTM1 и GSTT1, что может способствовать предрасположенности к новообразованиям и индивидуальной вариабельности в отношении безопасности и эффективности лекарств [31].
Ген SEPP содержит два функциональных полиморфизма, которые влияют на селенопротеиновую активность плазмы и лимфоцитов и относительную долю изотипо selen-протеинов в плазме в экспериментах in vivo. Следовательно, в результате мутации SEPP продуцирует некоторые нефункциональные или низкофункциональные подтипы белков, снижая антиоксидантную активность selen-протеинов [32]. Были выявлены SNP, коррелирующие с дефицитом селена (см. табл.2), их вариации могут воздействовать на экспрессию или активность ферментов, связанных с селеном, что может оказывать влияние на уровень селена и обусловленные этим последствия для здоровья. Однако эффекты этих SNP могут различаться у разных людей, и требуются дополнительные исследования [33].
Исследования, в которых анализировалась активность белков, связанных с GPX1, GPX4 и селенопротеином P (SELENOP), показали, что добавки с селеном влияют на эти гены. Несмотря на то что эти гены важны для действия селена, в исследованиях GWAS они не показали связи со статусом селена и требуют дальнейшего изучения [33].
Было идентифицировано несколько SNP, коррелирующих с дефицитом цинка. Эти SNP выявляются в генах, участвующих в транспорте, всасывании и утилизации цинка в организме. Один из таких SNP обнаружен в гене SLC39A8, кодирующем переносчик цинка, ответственный за облегчение усвоения цинка клетками. Варианты этого гена были связаны с измененными уровнями цинка и потенциальным дефицитом цинка из-за нарушенного транспорта. Другой SNP в гене SLC30A8, который кодирует переносчик цинка, участвующий в выработке инсулина, был связан как со сниженным уровнем цинка, так и с повышенным риском развития диабета 2-го типа. Лица с SNP, связанными с дефицитом цинка, могут быть более восприимчивы к дисфункции иммунной системы, нарушению заживления ран и когнитивному дефициту [33]. Проводилось исследование по установлению ассоциаций SNP, связанных с обменом цинка, с тяжестью протекания COVID-19 [34, 35].
Заключение
Таким образом, цинк, селен, витамины A и D, а также витамины С, Е являются важными факторами иммунной резистентности к респираторным инфекциям. Их достаточное поступление следует обеспечивать в процессе контроля нормального уровня потребления как у относительно здоровых лиц, так и в группах риска (пожилые, лица с хроническими заболеваниями), а при наличии дефицита – своевременно корректировать. В условиях пандемий и сезонных вспышек ОРВИ поддержание оптимального микронутриентного статуса населения может повысить эффективность мероприятий профилактики и терапии. Среди известных комплексных противовирусных иммунонутриентов одним из препаратов для профилактики ОРВИ и реабилитации после них является комбинированный витаминно-минеральный комплекс Селцинк Плюс® (PRO.MED.CS Praha a. s., Czech Republic). Одна таблетка препарата содержит: Se – 50 мкг;Zn – 8 мг; бета-каротина – 4,8 мг; витамина Е – 35 мг; витамина С – 200 мг. Клинические эффекты Селцинк Плюс® обусловлены свойствами входящих в состав препарата микроэлементов: Se и Zn, а также витаминов С, Е и бета-каротина, обладающих антиоксидантной активностью. В составе комплексной терапии при сезонных ОРВИ и гриппе перспективно применение новой формы препарата Селцинк® компании PRO.MED.CS Praha a. s. – Селцинк® Ультра Флю. Особенность
Селцинк® Ультра Флю, выпущенного на российский рынок в декабре 2022 г., – увеличенное содержание цинка и витамина С: в составе 1 таблетки Se – 50 мкг;
Zn – 20 мг; витамин С – 225 мг. Преимуществом БАД Селцинк® Ультра Флю является тройное действие, направленное на защиту организма от вирусов и поддержание работы иммунитета. Кроме того, в состав БАД Селцинк® Ультра Флю входит аскорбиновая кислота, что также повышает неспецифические и специфические способы защиты от респираторных инфекций.
Перспективы дальнейших исследований включают крупномасштабные клинические испытания витаминно-минеральной поддержки при вирусных пневмониях и постковидном синдроме, что поможет выработать четкие практические рекомендации для врачей. На данный момент уже очевидно, что интеграция знаний о питании и иммунитете открывает дополнительные возможности в повышении эффективности лечения инфекций и улучшении исходов для пациентов.
Информация об авторах
Information about the authors
Пономарева Любовь Андреевна – ассистент, каф. факультетской терапии №2, врач-кардиолог, врач-терапевт, Консультативно-диагностическое отд-ние, ФГАОУ ВО «Первый МГМУ им.
И.М. Сеченова» (Сеченовский Университет). E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Аssistant, therapist, Sechenov
First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Ефремова Кюрелей Борисовна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: kiraefremova776@gmail.com
Kyurelei B. Efremova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kiraefremova776@gmail.com
Литвинова Мария Михайловна – доц. каф. медицинской генетики, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: litvinova_m_m@staff.sechenov.ru
Maria M. Litvinova – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: litvinova_m_m@staff.sechenov.ru
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Поступила в редакцию: 24.03.2025
Поступила после рецензирования: 31.03.2025
Принята к публикации: 24.04.2025
Received: 24.03.2025
Revised: 31.03.2025
Accepted: 24.04.2025
Список исп. литературыСкрыть список1. Острые респираторные вирусные инфекции (ОРВИ) у взрослых. Клинические рекомендации 2024.
Acute respiratory viral infections (ARVI) for adults. Clinical guidelines 2024 (in Russian).
2. 2021 Рекомендации ESC по профилактике сердечно-сосудистых заболеваний в клинической практике. Российский кардиологический журнал. 2022;27(7):5155. DOI: 10.15829/1560-4071-2022-5155
2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Russian Journal of Cardiology. 2022;27(7):5155. DOI: 10.15829/1560-4071-2022-5155 (in Russian).
3. Shen L, Jhund PS, Anand IS, et al. Incidence and Outcomes of Pneumonia in Patients With Heart Failure. J Am Coll Cardiol. 2021;77(16):1961-73. DOI: 10.1016/j.jacc.2021.03.001
4. Подзолков В.И., Тарзиманова А.И., Пономарева Л.А. и др. Значение пневмонии, вызванной Pseudomonas aeruginosa, в развитии сердечно-сосудистых осложнений у больных с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2024;23(3):3853. DOI: 10.15829/1728-8800-2024-3853
Podzolkov V.I., Tarzimanova A.I., Ponomareva L.A., et al. The role of Pseudomonas aeruginosa pneumonia in the development of cardiovascular events in patients with heart failure. Cardiovascular Therapy and Prevention. 2024;23(3):3853. DOI: 10.15829/1728-8800-2024-3853 (in Russian).
5. Подзолков В.И., Тарзиманова А.И., Пономарева Л.А. и др. Предикторы развития сердечно-сосудистых осложнений у больных с хронической сердечной недостаточностью и пневмонией, вызванной Pseudomonas aeruginosa. Российский кардиологический журнал. 2024;29(4):5817. DOI: 10.15829/1560-4071-2024-5817
Podzolkov V.I., Tarzimanova A.I., Ponomareva L.A., et al. Predictors of cardiovascular events in patients with heart failure and Pseudomonas aeruginosa pneumonia. Russian Journal of Cardiology. 2024;29(4):5817. DOI: 10.15829/1560-4071-2024-5817 (in Russian).
6. Dar HH, Anthonymuthu TS, Ponomareva LA, et al. A new thiol-independent mechanism of epithelial host defense against Pseudomonas aeruginosa: iNOS/NO sabotage of theft-ferroptosis. Redox Biol. 2021;45:102045. DOI: 10.1016/j.redox.2021.102045
7. Трухан Д.И., Турутина Н.М. Витаминно-минеральные комплексы в лечении острых респираторных вирусных инфекций. Клинический разбор в общей медицине. 2022;(6):52-60. DOI: 10.47407/ kr2022.3.6.00177
Trukhan D.I., Turutina N.M. Vitamin and mineral complexes in the treatment of acute respiratory viral infections. Clinical review for general practice. 2022;(6):52-60. DOI: 10.47407/kr2022.3.6.00177 (in Russian).
8. Попова Е.Н., Митькина М.И., Чинова А.А., Пономарева Л.А. Роль витаминов и микроэлементов в профилактике и лечении бронхолегочных заболеваний у взрослых. Клинический разбор в общей медицине. 2023;4(2):36-42. DOI: 10.47407/kr2023.4.2.00202
Popova E.N., Mitkina M.I., Chinova A.A., Ponomareva L.A. The role of vitamins and minerals in prevention and treatment of bronchopulmonary diseases in adults. Clinical review for general practice. 2023;4(2):36-42. DOI: 10.47407/kr2023.4.2.00202
9. Gao H. et al. The Role of Zinc and Zinc Homeostasis in Macrophage Function. Int J Mol Sci. 2018;19(8):2142. DOI: 10.3390/ijms19082142
10. Avery J.C., Hoffmann P.R. Selenium, Selenoproteins, and Immunity. Nutrients. 2018;10(9):1203. DOI: 10.3390/nu10091203
11. Huang Z, Liu Y, Qi G, et al. Role of Vitamin A in the Immune System.
J Clin Med. 2018;7(9):258. DOI: 10.3390/jcm7090258
12. White JH. Vitamin D as an Immunomodulator. Mol Endocrinol. 2010;25(12):321-9. DOI: 10.1210/me.2010-0367
13. Singh M, Das RR. Zinc for the common cold. Cochrane Database Syst Rev. 2013 Jun 18;(6):CD001364. DOI: 10.1002/14651858.CD001364.pub4
14. Nault D, Machingo TA, Shipper AG, et al. Zinc for prevention and treatment of the common cold. Cochrane Database Syst Rev. 2024;5(5):CD014914. DOI: 10.1002/14651858.CD014914.pub2
15. Brown N, Kukka AJ, Mårtensson A. Efficacy of zinc as adjunctive pneumonia treatment in children aged 2 to 60 months in low-income and middle-income countries: a systematic review and metaanalysis. BMJ Paediatrics Open. 2020;4:e000662. DOI: 10.1136/bmjpo-2020-000662
16. Tabatabaeizadeh SA. Zinc supplementation and COVID-19 mortality: a meta-analysis. Eur J Med Res. 2022;27(1):70. DOI: 10.1186/s40001-022-00694-z
17. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. DOI: 10.1136/bmj.i6583
18. Wang M, Wu Y, Xiang Z, et al. The effect of vitamin D supplementation on antibiotic use: a meta-analysis based on randomized controlled trials. Front Nutr. 2024;11:1502835. DOI: 10.3389/fnut.2024.1502835
19. Beck MA. Selenium and viral infection. Br Med Bull. 2003;68:105-19. DOI: 10.1093/bmb/ldg098
20. Beck MA, Nelson HK, Shi Q, et al. Selenium deficiency increases the pathology of an influenza virus infection. FASEB J. 2001 Jun;15(8):1481-3.
21. Moghaddam A, Heller RA, Sun Q, et al. Selenium Deficiency Is Associated with Mortality Risk from COVID-19. Nutrients. 2020;12(7):2098. DOI: 10.3390/nu12072098
22. Ingold I, Berndt C, Schmitt S, et al. Selenium Utilization by GPX4 Is Required to Prevent Hydroperoxide-Induced Ferroptosis. Cell. 2018 Jan 25;172(3):409-22. DOI: 10.1016/j.cell.2017.11.048
23. Weaver K, Skouta R. The Selenoprotein Glutathione Peroxidase 4: From Molecular Mechanisms to Novel Therapeutic Opportunities. Biomedicines. 2022;10(4):891. DOI: 10.3390/biomedicines10040891
24. Çelebi Ö, Çelebi D, Başer S, et al. Vitamins Can Increase Antibiotic Effects Against Multidrug-Resistant Pseudomonas aeruginosa and Acinetobacter baumannii in an In Vitro Infection Model. Eurasian J Med. 2024;56(2):91-7. DOI: 10.5152/eurasianjmed.2024.23145
25. Zifko U, Guendling K, Seet R, Kasper S. Management of cognitive impairment associated with post-COVID-19 syndrome: recommendations for primary care. Front Pharmacol. 2024;15:1338235. DOI: 10.3389/ fphar.2024.1338235
26. Skalny AV et al. Zinc and neuroinfections: COVID-19-related neurological complications. Int J Mol Med. 2021;47(1):11-20. DOI: 10.3892/ ijmm.2020.4766
27. Córdova-Martínez A, Caballero-García A, Pérez-Valdecantos D, et al. Peripheral Neuropathies Derived from COVID-19: New Perspectives for Treatment. Biomedicines. 2022;10(5):1051. DOI: 10.3390/biomedicines10051051
28. Bösch ES, Spörri J, Scherr J. Vitamin Metabolism and Its Dependency on Genetic Variations Among Healthy Adults: A Systematic Review for Precision Nutrition Strategies. Nutrients. 2025;17(2):242. DOI: 10.3390/nu17020242
29. Dragasevic S, Stankovic B, Kotur N, et al. Genetic Aspects of Micronutrients Important for Inflammatory Bowel Disease. Life (Basel). 2022;12(10):1623. DOI: 10.3390/life12101623
30. Никитина О.А., Даренская М.А, Семёнова Н. В., Колесникова Л.И. Система антиоксидантной защиты: регуляция метаболических процессов, генетические детерминанты, методы определения. Сибирский научный медицинский журнал. 2022;42(3):4-17. DOI: 10.18699/SSMJ20220301
Nikitina O.A., Darenskaya M.A., Semenova N.V., Kolesnikova L.I. Antioxidant defense system: regulation of metabolic processes, genetic determinants, methods of determination. Siberian Scientific Medical Journal. 2022;42(3):4-17. DOI: 10.18699/SSMJ20220301 (in Russian).
31. Nakanishi G, Pita-Oliveira M, Bertagnolli LS, et al. Worldwide Systematic Review of GSTM1 and GSTT1 Null Genotypes by Continent, Ethnicity, and Therapeutic Area. OMICS. 2022;26(10):528-41. DOI: 10.1089/omi.2022.0090
32. Xu H, Mo F, Zhou J, et al. Lack of Association between Common Polymorphisms in Selenoprotein P Gene and Susceptibility to Colorectal Cancer, Breast Cancer, and Prostate Cancer: A Meta-Analysis. Biomed Res Int. 2021;2021:6525449. DOI: 10.1155/2021/6525449
33. Dhuli K, Medori MC, Bonetti G, et al. Nutrigenomics: SNPs correlated to minerals' deficiencies. Clin Ter. 2023;174(Suppl 2(6)):193-9. DOI: 10.7417/CT.2023.2487
34. Kotur N, Skakic A, Klaassen K, et al. Association of Vitamin D, Zinc and Selenium Related Genetic Variants With COVID-19 Disease Severity. Front Nutr. 2021;8:689419. DOI: 10.3389/fnut.2021.689419
35. Day KJ, Adamski MM, Dordevic AL, Murgia C. Genetic Variations as Modifying Factors to Dietary Zinc Requirements – A Systematic Review. Nutrients. 2017;9(2):148. DOI: 10.3390/nu9020148