Клинический разбор в общей медицине №4 2025
Клинический разбор в общей медицине №4 2025
Коррекция воспаления в легочной ткани в процессе комплексного лечения злокачественной тимомы
Номера страниц в выпуске:114-118
Аннотация
Тимома относится к редким злокачественным образованиям, ее клинические признаки неспецифичны, длительное время заболевание может развиваться бессимптомно. Цель данного сообщения – осветить сложность лечения пациента с IV cтадией заболевания. В работе использованы такие методы исследования, как наблюдение и анализ данных, полученных в результате коррекции осложнений противоопухолевого лечения пациента. Согласно полученным результатам, в рамках мультимодального подхода к комплексному лечению пациентов с местно-распространенным процессом целесообразны наблюдение по поводу постлучевых и послеоперационных осложнений и их коррекция.
Ключевые слова: тимома, спиральная компьютерная томография, дистанционная лучевая терапия, химиотерапия, пневмонит, пневмония, глюкокортикостероиды, антибактериальные препараты.
Для цитирования: Курсова Л.В., Усачева А.Ю., Иванов С.А., Каприн А.Д. Коррекция воспаления в легочной ткани в процессе комплексного лечения злокачественной тимомы. Клинический разбор в общей медицине. 2025; 6 (4): 114–118. DOI: 10.47407/kr2025.6.4.00604
Тимома относится к редким злокачественным образованиям, ее клинические признаки неспецифичны, длительное время заболевание может развиваться бессимптомно. Цель данного сообщения – осветить сложность лечения пациента с IV cтадией заболевания. В работе использованы такие методы исследования, как наблюдение и анализ данных, полученных в результате коррекции осложнений противоопухолевого лечения пациента. Согласно полученным результатам, в рамках мультимодального подхода к комплексному лечению пациентов с местно-распространенным процессом целесообразны наблюдение по поводу постлучевых и послеоперационных осложнений и их коррекция.
Ключевые слова: тимома, спиральная компьютерная томография, дистанционная лучевая терапия, химиотерапия, пневмонит, пневмония, глюкокортикостероиды, антибактериальные препараты.
Для цитирования: Курсова Л.В., Усачева А.Ю., Иванов С.А., Каприн А.Д. Коррекция воспаления в легочной ткани в процессе комплексного лечения злокачественной тимомы. Клинический разбор в общей медицине. 2025; 6 (4): 114–118. DOI: 10.47407/kr2025.6.4.00604
Clinical Case
1 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2 Patrice Lumumba People’s Friendship university of Russia (RUDN University), Moscow, Russia;
3 National Medical Research Radiological Centre, Obninsk, Russia;
4 Herzen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
larisa@mrrc.obninsk.ru
Abstract
Thymoma is a rare malignancy, clinical signs are non-specific, and the disease may be asymptomatic for a long time. The aim of this report is to highlight the complexity of treatment of a patient with IV stage of the disease. Research methods such as observation and analysis of data obtained as a result of correction of complications of antitumour treatment of the patient were used in the work. According to the results obtained, the multimodal approach to the complex treatment of patients with locally advanced process makes it advisable to observe for post-radiation and postoperative complications and their correction.
Keywords: thymoma, spiral computed tomography, remote radiation therapy, chemotherapy, pneumonitis, pneumonia, glucocorticosteroids, antibacterial drugs.
For citation: Kursova L.V., Usacheva A.Yu., Ivanov S.A., Kaprin A.D. Correction of changes in lung tissue during complex treatment malignant thymoma. Clinical review for general practice. 2025; 6 (4): 114–118 (In Russ.). DOI: 10.47407/kr2025.6.4.00604
(0,13 случая на 100 тыс. населения, по данным канцер-регистра США [1]).
В 1999 г. международный комитет Всемирной организации здравоохранения предложил морфологическую классификацию, основанную на оценке соотношения лимфоцитарных и эпителиальных клеток. По этой классификации выделяют шесть различных типов тимом: А, АВ, В1, В2, В3, С. Современная TNM-система стадирования тимом и рака тимуса основана на объединенных данных Международной группы по изучению опухолей вилочковой железы и Международной ассоциации по изучению рака легкого. В клинической практике применяются обе классификации [2].
Основным методом диагностики тимом и оценки распространенности опухолевого процесса является спиральная компьютерная томография (СКТ) грудной полости с внутривенным контрастированием.
В случае резектабельной тимомы I–III стадии на первом этапе показано хирургическое лечение. При местно-распространенном опухолевом процессе с целью повышения резектабельности применяется неоадъювантная химиолучевая терапия. Одним из вариантов является проведение индукционной химиотерапии (ХТ) по схеме ЕР (цисплатин, этопозид) или по схеме CAP (циклофосфамид, доксорубицин, цисплатин) с последующим курсом дистанционной лучевой терапии (ДЛТ) до суммарной очаговой дозы (СОД) 60 Гр. При диссеминированной тимоме рекомендуется ДЛТ до СОД 30 Гр фракциями по 3 Гр с паллиативной целью [3]. Толерантная доза гамма-излучения для легочной ткани, по разным данным, составляет от 35–40 Гр [4] до 50 Гр при фракциях 2 Гр 5 раз в неделю [5, 6]. При превышении толерантной дозы частота развития лучевого пневмонита составляет 5% и более. Очевидно, что доза, необходимая для эрадикации тимомы, превышает толерантную для легочной ткани. Снижают толерантность облучаемых тканей объем облучения, ХТ, наличие сопутствующей патологии, предшествующее хирургическое вмешательство. В доступной литературе не удалось найти данных о частоте развития пневмонита после ДЛТ у больных со злокачественной тимомой.
Серьезным осложнением хирургического лечения опухолей грудной полости является послеоперационная пневмония. У 12% пациентов, получающих лечение в стационаре по поводу онкопатологии нижних дыхательных путей, развивается пневмония с увеличением продолжительности госпитализации в среднем до 1 мес [7]. Предшествующее химиолучевое воздействие усугубляет тяжесть течения пневмонии.
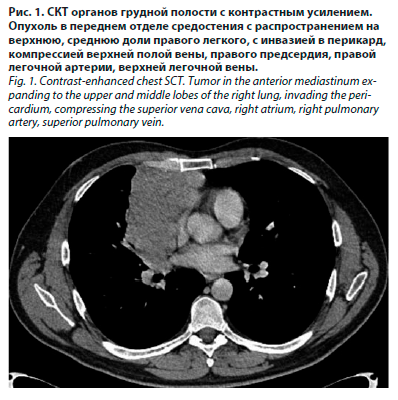 Пациент К., 42 лет, обратился к радиологу отделения лечения лучевых повреждений МРНЦ в мае 2023 г. с жалобами на одышку при умеренной нагрузке, боли в грудной клетке, надсадный кашель с небольшим количеством слизисто-гнойной мокроты, повышение температуры тела до субфебрильных значений. В анамнезе – тимома, тип В3, ycT4N0M1a, IV стадия, с инвазией в перикард, инфильтрацией клетчатки средостения, верхней полой вены, правого предсердия, правой легочной артерии, верхней легочной вены, верхней и средней долей легкого, междолевой плевры, лимфатических узлов корня легкого, диссеминацией по плевре (рис. 1).
Пациент К., 42 лет, обратился к радиологу отделения лечения лучевых повреждений МРНЦ в мае 2023 г. с жалобами на одышку при умеренной нагрузке, боли в грудной клетке, надсадный кашель с небольшим количеством слизисто-гнойной мокроты, повышение температуры тела до субфебрильных значений. В анамнезе – тимома, тип В3, ycT4N0M1a, IV стадия, с инвазией в перикард, инфильтрацией клетчатки средостения, верхней полой вены, правого предсердия, правой легочной артерии, верхней легочной вены, верхней и средней долей легкого, междолевой плевры, лимфатических узлов корня легкого, диссеминацией по плевре (рис. 1).
В марте 2022 г. проведено 4 цикла неоадъювантной ХТ по схеме САР с положительной динамикой, торакотомия с биопсией плевры, процесс признан нерезектабельным. В августе – ноябре 2022 г. пациент получил
6 циклов ХТ по схеме ЕР, достигнута стабилизация, после чего обратился к торакальному онкологу МРНЦ. С учетом распространенности опухолевого процесса, объема и сроков проведенной ранее ХТ онкологическим консилиумом МРНЦ было принято решение о попытке проведения курса конформной ДЛТ на область опухоли тимуса в режиме традиционного фракционирования. В феврале – апреле 2023 г. в МРНЦ проведена конформная ДЛТ на ЛУЭ Varian TrueBeam в СОД 60 Гр.
В процессе лечения применены технологии 3D-дозиметрического планирования с модуляцией излучения по интенсивности (IMRT), ежедневным контролем укладки (CBCT).
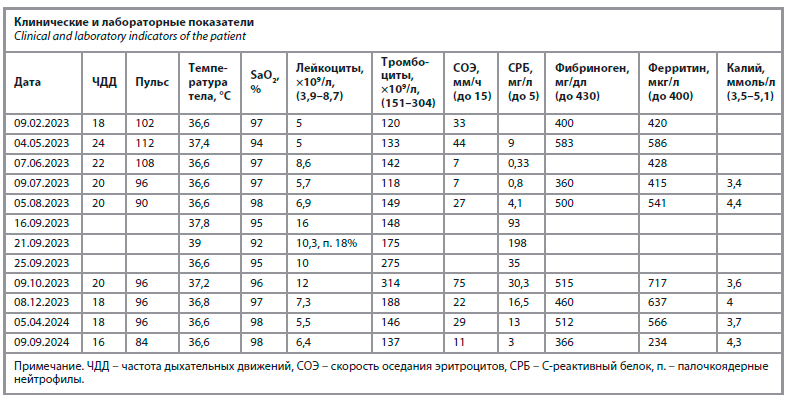
Хроническими заболеваниями пациент ранее не страдал, перед госпитализацией в МРНЦ жаловался на одышку при умеренной нагрузке, при осмотре и обследовании основные клинические и лабораторные показатели были в пределах нормы (см. таблицу). Курс ЛТ перенес удовлетворительно. В процессе лечения развился лучевой эзофагит 1-й степени по шкале токсичности RTOG [8], усилилась одышка без изменения аускультативной, рентгенологической, электрокардиографической и ультразвуковой картины, что было расценено как кардиомиопатия на фоне противоопухолевой терапии.
В мае 2023 г. обратился на амбулаторный прием с указанными жалобами. При осмотре выявлены бледность кожных покровов, умеренная гипотония, тахикардия, SaO2 – 94%, в легких выслушивались немногочисленные влажные хрипы и ослабление везикулярного дыхания в нижних отделах правого легкого. Уровень неспецифических воспалительных маркеров в крови был повышен (см. таблицу).
В микробиологическом анализе мокроты обнаружен рост золотистого стафилококка в титре, близком к диагностическому. При контрольном КТ-исследовании обнаружены уменьшение размеров опухоли, появление интерстициальных изменений, участков консолидации легочной ткани в зонах облучения и жидкости в правой плевральной полости, что расценено как признаки лучевого плевропневмонита 2-й степени по шкале RTOG (рис. 2).
При формировании схемы лечебных мероприятий руководствовались принципами лечения лучевых повреждений легких, изложенными в патенте RU 2487706 [9]. Для применения в амбулаторных условиях был назначен комплекс противовоспалительных средств, включавший антибиотикотерапию с учетом чувствительности микрофлоры (цефтриаксон 2 г/сут в течение 10 дней), преднизолон в суточной дозе из расчета 1 мг/кг на 2 нед внутрь с постепенным снижением дозы, будесонид через небулайзер от 1000 мг/сут с дальнейшим снижением дозы, флуконазол, антигистаминные и отхаркивающие средства, омепразол, калия и магния аспарагинат. Через 1 мес состояние пациента стабилизировалось: нормализовалась температура тела, уменьшилась одышка, повысилась толерантность к физической нагрузке. Фиксировалась выраженная положительная динамика показателей воспаления. Динамика уровней лейкоцитов и тромбоцитов в клиническом анализе крови не была показательна вследствие химиолучевого лечения в анамнезе. Через 2 мес пациент жаловался на сердцебиение, боль в мышцах ног, одышку при нагрузках, сохранялись умеренная гипотензия и тахикардия, в легких аускультативно определялись немногочисленные сухие хрипы справа, дыхание проводилось во все отделы. В анализах крови фиксировалось снижение маркеров воспаления. При контрольном КТ-исследовании зафиксированы дальнейшее уменьшение размеров опухоли, регресс инфильтративных изменений в легочной ткани с появлением признаков фибротизации, отсутствие жидкости в правой плевральной полости (рис. 3).
Состояние лучевого повреждения легочной ткани расценивалось как соответствующее 1–2-й степени тяжести по шкале RTOG/EORTC. Учитывая положительный ответ опухоли на химиолучевое воздействие, на очередном онкологическом консилиуме принято решение о хирургическом вмешательстве. В сентябре 2023 г. в МРНЦ выполнены стерноторакотомия справа, удаление опухоли средостения с резекцией и пластикой перикарда, резекцией правого диафрагмального нерва, верхняя и средняя лобэктомия с апикальной плеврэктомией, прецизионное удаление образований париетальной плевры. На 5-е сутки после операции у пациента повысилась температура тела до 39 ºС с ознобом, в анализах крови повысились уровни лейкоцитов и С-реактивного белка, зафиксирован палочкоядерный сдвиг (см. таблицу), состояние было расценено как нозокомиальная пневмония в раннем послеоперационном периоде, что было подтверждено с помощью СКТ (рис. 4).
С учетом спектра персистирующей в стационаре флоры назначенный ранее цефтриаксон был заменен на пиперациллин/тазобактам в дозе 4,5 г 4 раза в сутки с положительным эффектом в виде нормализации температуры тела, улучшения общего состояния, снижения острофазовых показателей. На 12-е сутки после операции пациент был выписан в удовлетворительном состоянии с рекомендациями приема в амбулаторных условиях комбинации ципрофлоксацин/амоксиклав в течение 5 дней, к лечению добавлен дексаметазон коротким курсом с дальнейшим переходом на метилпреднизолон и будесонид по прежней схеме в течение 1 мес со снижением дозы до отмены обоих препаратов на фоне применения бронхолитических и отхаркивающих средств. Через 3 мес после операции (декабрь 2023 г.) на СКТ в паренхиме нижней доли правого легкого определялись участки фиброза, в плевральной полости – стабильный гидроторакс (рис. 5).
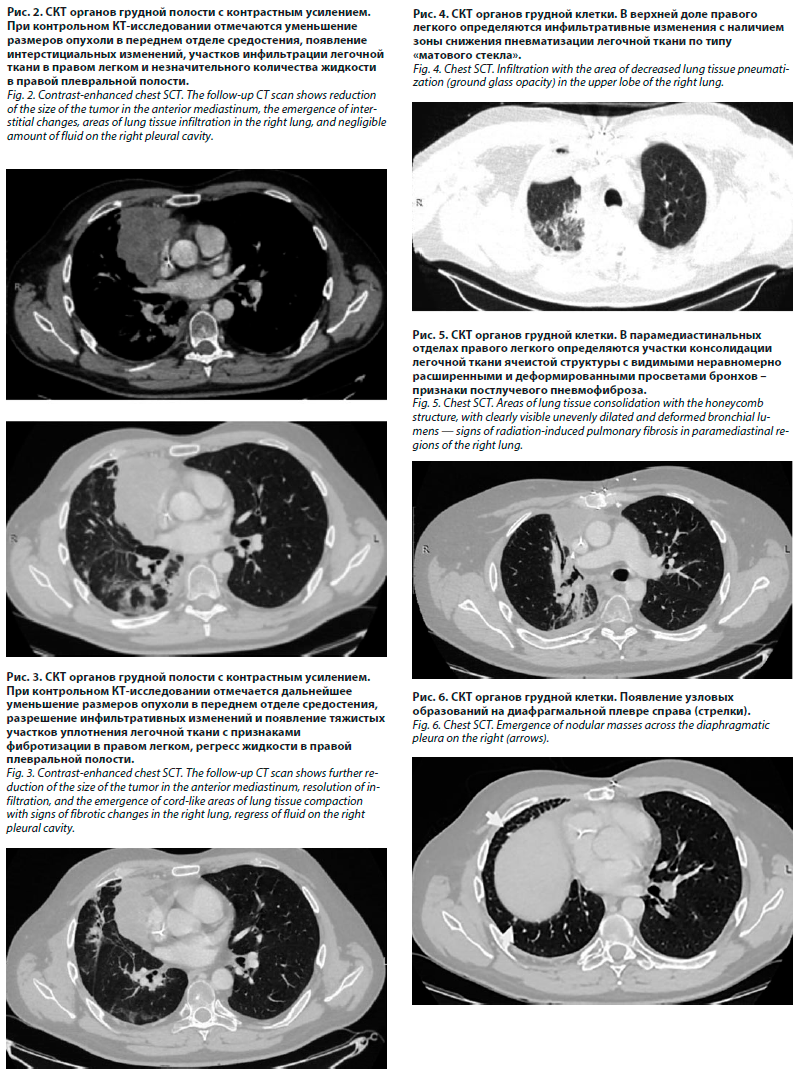
В дальнейшем, в результате ухудшения на фоне острой респираторной вирусной инфекции, была проведена противовоспалительная терапия, включавшая короткий курс системных и топических глюкокортикостероидов (ГКС), антибиотика, бронхо- и муколитиков. Из побочных эффектов противовоспалительной терапии имела место гастропатия, купированная приемом ингибиторов протонной помпы, и кратковременная гипокалиемия, регрессировавшая после отмены ГКС. В настоящее время пациент стабилен; одышка возникает при подъеме на 4-й этаж; дыхание в легких везикулярное, ослаблено в нижних отделах справа, на форсированном выдохе – единичные сухие проводные хрипы; показатели крови в пределах нормы; постоянно получает спирива респимат в соответствии с данными спирографии. Выполняет домашнюю работу, трудится по специальности, находится под наблюдением онколога. При анализе данных СКТ в динамике выявлен рост опухолевых образований по париетальной плевре справа при стабилизации лучевых, послеоперационных и поствоспалительных изменений (рис. 6).
Осуществляется системное противоопухолевое лечение на основании клинических рекомендаций по лечению рецидивной тимомы.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Курсова Лариса Викторовна – канд. мед. наук, вед. науч. сотр., врач-радиолог МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: larisa@mrrc.obninsk.ru; Scopus ID: 6507375401, ORCID: 0000-0001-6374-2640
Larisa V. Kursova – Dr. Sci. (Med.), Leading Res. Officer, radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: larisa@mrrc.obninsk.ru; Scopus ID: 6507375401, ORCID: 0000-0001-6374-2640
Усачева Анна Юрьевна – врач-рентгенолог МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: annyshka-888@yandex.ru; Scopus ID: 57200540933
Anna Yu. Usacheva – radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: annyshka-888@yandex.ru; Scopus ID: 57200540933
Иванов Сергей Анатольевич – член-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, дир. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 16070399200, ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Prof. of the Kharchenko Department of Oncology and Roentgenology, Medical Institute of the RUDN University, Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 16070399200, ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, дир. МНИОИ им. П.А. Герцена, ген. дир. ФГБУ «НМИЦ радиологии». E-mail: mrrc@mrrc. obninsk.ru; Scopus ID: 6602709853, ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Head of the Kharchenko Department of Oncology and Roentgenology, Medical Institute of the RUDN University, Director of the Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, General Director of the National Medical Research Radiological Centre. E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 6602709853, ORCID: 0000-0001-8784-8415
Поступила в редакцию: 15.01.2025
Поступила после рецензирования: 22.01.2025
Принята к публикации: 23.01.2025
Received: 15.01.2025
Revised: 22.01.2025
Accepted: 23.01.2025
Correction of changes in lung tissue during complex treatment malignant thymoma
Larisa V. Kursova1, Anna Yu. Usacheva1, Sergey A. Ivanov1,2, Andrey D. Kaprin2–41 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2 Patrice Lumumba People’s Friendship university of Russia (RUDN University), Moscow, Russia;
3 National Medical Research Radiological Centre, Obninsk, Russia;
4 Herzen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
larisa@mrrc.obninsk.ru
Abstract
Thymoma is a rare malignancy, clinical signs are non-specific, and the disease may be asymptomatic for a long time. The aim of this report is to highlight the complexity of treatment of a patient with IV stage of the disease. Research methods such as observation and analysis of data obtained as a result of correction of complications of antitumour treatment of the patient were used in the work. According to the results obtained, the multimodal approach to the complex treatment of patients with locally advanced process makes it advisable to observe for post-radiation and postoperative complications and their correction.
Keywords: thymoma, spiral computed tomography, remote radiation therapy, chemotherapy, pneumonitis, pneumonia, glucocorticosteroids, antibacterial drugs.
For citation: Kursova L.V., Usacheva A.Yu., Ivanov S.A., Kaprin A.D. Correction of changes in lung tissue during complex treatment malignant thymoma. Clinical review for general practice. 2025; 6 (4): 114–118 (In Russ.). DOI: 10.47407/kr2025.6.4.00604
Введение
Тимома – злокачественная опухоль вилочковой железы эпителиальной природы, характеризующаяся медленным ростом и склонностью к местному распространению. Типичная локализация метастазов – в пределах гемиторакса, по плевре, перикарду, диафрагме. Тимома – редкое злокачественное образование(0,13 случая на 100 тыс. населения, по данным канцер-регистра США [1]).
В 1999 г. международный комитет Всемирной организации здравоохранения предложил морфологическую классификацию, основанную на оценке соотношения лимфоцитарных и эпителиальных клеток. По этой классификации выделяют шесть различных типов тимом: А, АВ, В1, В2, В3, С. Современная TNM-система стадирования тимом и рака тимуса основана на объединенных данных Международной группы по изучению опухолей вилочковой железы и Международной ассоциации по изучению рака легкого. В клинической практике применяются обе классификации [2].
Основным методом диагностики тимом и оценки распространенности опухолевого процесса является спиральная компьютерная томография (СКТ) грудной полости с внутривенным контрастированием.
В случае резектабельной тимомы I–III стадии на первом этапе показано хирургическое лечение. При местно-распространенном опухолевом процессе с целью повышения резектабельности применяется неоадъювантная химиолучевая терапия. Одним из вариантов является проведение индукционной химиотерапии (ХТ) по схеме ЕР (цисплатин, этопозид) или по схеме CAP (циклофосфамид, доксорубицин, цисплатин) с последующим курсом дистанционной лучевой терапии (ДЛТ) до суммарной очаговой дозы (СОД) 60 Гр. При диссеминированной тимоме рекомендуется ДЛТ до СОД 30 Гр фракциями по 3 Гр с паллиативной целью [3]. Толерантная доза гамма-излучения для легочной ткани, по разным данным, составляет от 35–40 Гр [4] до 50 Гр при фракциях 2 Гр 5 раз в неделю [5, 6]. При превышении толерантной дозы частота развития лучевого пневмонита составляет 5% и более. Очевидно, что доза, необходимая для эрадикации тимомы, превышает толерантную для легочной ткани. Снижают толерантность облучаемых тканей объем облучения, ХТ, наличие сопутствующей патологии, предшествующее хирургическое вмешательство. В доступной литературе не удалось найти данных о частоте развития пневмонита после ДЛТ у больных со злокачественной тимомой.
Серьезным осложнением хирургического лечения опухолей грудной полости является послеоперационная пневмония. У 12% пациентов, получающих лечение в стационаре по поводу онкопатологии нижних дыхательных путей, развивается пневмония с увеличением продолжительности госпитализации в среднем до 1 мес [7]. Предшествующее химиолучевое воздействие усугубляет тяжесть течения пневмонии.
Клинический пример
 Пациент К., 42 лет, обратился к радиологу отделения лечения лучевых повреждений МРНЦ в мае 2023 г. с жалобами на одышку при умеренной нагрузке, боли в грудной клетке, надсадный кашель с небольшим количеством слизисто-гнойной мокроты, повышение температуры тела до субфебрильных значений. В анамнезе – тимома, тип В3, ycT4N0M1a, IV стадия, с инвазией в перикард, инфильтрацией клетчатки средостения, верхней полой вены, правого предсердия, правой легочной артерии, верхней легочной вены, верхней и средней долей легкого, междолевой плевры, лимфатических узлов корня легкого, диссеминацией по плевре (рис. 1).
Пациент К., 42 лет, обратился к радиологу отделения лечения лучевых повреждений МРНЦ в мае 2023 г. с жалобами на одышку при умеренной нагрузке, боли в грудной клетке, надсадный кашель с небольшим количеством слизисто-гнойной мокроты, повышение температуры тела до субфебрильных значений. В анамнезе – тимома, тип В3, ycT4N0M1a, IV стадия, с инвазией в перикард, инфильтрацией клетчатки средостения, верхней полой вены, правого предсердия, правой легочной артерии, верхней легочной вены, верхней и средней долей легкого, междолевой плевры, лимфатических узлов корня легкого, диссеминацией по плевре (рис. 1).В марте 2022 г. проведено 4 цикла неоадъювантной ХТ по схеме САР с положительной динамикой, торакотомия с биопсией плевры, процесс признан нерезектабельным. В августе – ноябре 2022 г. пациент получил
6 циклов ХТ по схеме ЕР, достигнута стабилизация, после чего обратился к торакальному онкологу МРНЦ. С учетом распространенности опухолевого процесса, объема и сроков проведенной ранее ХТ онкологическим консилиумом МРНЦ было принято решение о попытке проведения курса конформной ДЛТ на область опухоли тимуса в режиме традиционного фракционирования. В феврале – апреле 2023 г. в МРНЦ проведена конформная ДЛТ на ЛУЭ Varian TrueBeam в СОД 60 Гр.
В процессе лечения применены технологии 3D-дозиметрического планирования с модуляцией излучения по интенсивности (IMRT), ежедневным контролем укладки (CBCT).
Хроническими заболеваниями пациент ранее не страдал, перед госпитализацией в МРНЦ жаловался на одышку при умеренной нагрузке, при осмотре и обследовании основные клинические и лабораторные показатели были в пределах нормы (см. таблицу). Курс ЛТ перенес удовлетворительно. В процессе лечения развился лучевой эзофагит 1-й степени по шкале токсичности RTOG [8], усилилась одышка без изменения аускультативной, рентгенологической, электрокардиографической и ультразвуковой картины, что было расценено как кардиомиопатия на фоне противоопухолевой терапии.
В мае 2023 г. обратился на амбулаторный прием с указанными жалобами. При осмотре выявлены бледность кожных покровов, умеренная гипотония, тахикардия, SaO2 – 94%, в легких выслушивались немногочисленные влажные хрипы и ослабление везикулярного дыхания в нижних отделах правого легкого. Уровень неспецифических воспалительных маркеров в крови был повышен (см. таблицу).

В микробиологическом анализе мокроты обнаружен рост золотистого стафилококка в титре, близком к диагностическому. При контрольном КТ-исследовании обнаружены уменьшение размеров опухоли, появление интерстициальных изменений, участков консолидации легочной ткани в зонах облучения и жидкости в правой плевральной полости, что расценено как признаки лучевого плевропневмонита 2-й степени по шкале RTOG (рис. 2).
При формировании схемы лечебных мероприятий руководствовались принципами лечения лучевых повреждений легких, изложенными в патенте RU 2487706 [9]. Для применения в амбулаторных условиях был назначен комплекс противовоспалительных средств, включавший антибиотикотерапию с учетом чувствительности микрофлоры (цефтриаксон 2 г/сут в течение 10 дней), преднизолон в суточной дозе из расчета 1 мг/кг на 2 нед внутрь с постепенным снижением дозы, будесонид через небулайзер от 1000 мг/сут с дальнейшим снижением дозы, флуконазол, антигистаминные и отхаркивающие средства, омепразол, калия и магния аспарагинат. Через 1 мес состояние пациента стабилизировалось: нормализовалась температура тела, уменьшилась одышка, повысилась толерантность к физической нагрузке. Фиксировалась выраженная положительная динамика показателей воспаления. Динамика уровней лейкоцитов и тромбоцитов в клиническом анализе крови не была показательна вследствие химиолучевого лечения в анамнезе. Через 2 мес пациент жаловался на сердцебиение, боль в мышцах ног, одышку при нагрузках, сохранялись умеренная гипотензия и тахикардия, в легких аускультативно определялись немногочисленные сухие хрипы справа, дыхание проводилось во все отделы. В анализах крови фиксировалось снижение маркеров воспаления. При контрольном КТ-исследовании зафиксированы дальнейшее уменьшение размеров опухоли, регресс инфильтративных изменений в легочной ткани с появлением признаков фибротизации, отсутствие жидкости в правой плевральной полости (рис. 3).
Состояние лучевого повреждения легочной ткани расценивалось как соответствующее 1–2-й степени тяжести по шкале RTOG/EORTC. Учитывая положительный ответ опухоли на химиолучевое воздействие, на очередном онкологическом консилиуме принято решение о хирургическом вмешательстве. В сентябре 2023 г. в МРНЦ выполнены стерноторакотомия справа, удаление опухоли средостения с резекцией и пластикой перикарда, резекцией правого диафрагмального нерва, верхняя и средняя лобэктомия с апикальной плеврэктомией, прецизионное удаление образований париетальной плевры. На 5-е сутки после операции у пациента повысилась температура тела до 39 ºС с ознобом, в анализах крови повысились уровни лейкоцитов и С-реактивного белка, зафиксирован палочкоядерный сдвиг (см. таблицу), состояние было расценено как нозокомиальная пневмония в раннем послеоперационном периоде, что было подтверждено с помощью СКТ (рис. 4).
С учетом спектра персистирующей в стационаре флоры назначенный ранее цефтриаксон был заменен на пиперациллин/тазобактам в дозе 4,5 г 4 раза в сутки с положительным эффектом в виде нормализации температуры тела, улучшения общего состояния, снижения острофазовых показателей. На 12-е сутки после операции пациент был выписан в удовлетворительном состоянии с рекомендациями приема в амбулаторных условиях комбинации ципрофлоксацин/амоксиклав в течение 5 дней, к лечению добавлен дексаметазон коротким курсом с дальнейшим переходом на метилпреднизолон и будесонид по прежней схеме в течение 1 мес со снижением дозы до отмены обоих препаратов на фоне применения бронхолитических и отхаркивающих средств. Через 3 мес после операции (декабрь 2023 г.) на СКТ в паренхиме нижней доли правого легкого определялись участки фиброза, в плевральной полости – стабильный гидроторакс (рис. 5).

В дальнейшем, в результате ухудшения на фоне острой респираторной вирусной инфекции, была проведена противовоспалительная терапия, включавшая короткий курс системных и топических глюкокортикостероидов (ГКС), антибиотика, бронхо- и муколитиков. Из побочных эффектов противовоспалительной терапии имела место гастропатия, купированная приемом ингибиторов протонной помпы, и кратковременная гипокалиемия, регрессировавшая после отмены ГКС. В настоящее время пациент стабилен; одышка возникает при подъеме на 4-й этаж; дыхание в легких везикулярное, ослаблено в нижних отделах справа, на форсированном выдохе – единичные сухие проводные хрипы; показатели крови в пределах нормы; постоянно получает спирива респимат в соответствии с данными спирографии. Выполняет домашнюю работу, трудится по специальности, находится под наблюдением онколога. При анализе данных СКТ в динамике выявлен рост опухолевых образований по париетальной плевре справа при стабилизации лучевых, послеоперационных и поствоспалительных изменений (рис. 6).
Осуществляется системное противоопухолевое лечение на основании клинических рекомендаций по лечению рецидивной тимомы.
Обсуждение
Приведенное клиническое наблюдение демонстрирует успех мультидисциплинарного подхода к лечению местно-распространенного опухолевого процесса в грудной полости. Неизбежное в данной ситуации осложнение ДЛТ не выходило за рамки 2-й степени по шкале RTOG/EORTC и было успешно купировано в амбулаторных условиях. Комплекс противовоспалительных мероприятий, назначенных с учетом этиологии и патогенеза воспалительного процесса, позволил осуществить хирургическое вмешательство по удалению первичной опухоли, видимых метастазов и, в целом, осуществить индивидуальный план лечения злокачественной тимомы у данного пациента. Ведущими противовоспалительными средствами при лечении лучевого пневмонита были ГКС, в лечении пневмонии первенство принадлежит антибактериальным средствам. Амбулаторная консультативная поддержка в лечении послеоперационной пневмонии и реабилитации после хирургического вмешательства позволила пациенту вернуться к активной трудовой деятельности по специальности.Заключение
Таким образом, для успешного лечения опухолей грудной полости необходим терапевтический и радиологический мониторинг состояния пациента с начала курса ДЛТ и до окончательного завершения комбинированного лечения. Такой подход позволит вовремя обнаружить осложнения противоопухолевого лечения, провести их коррекцию и оптимизировать расходы.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Курсова Лариса Викторовна – канд. мед. наук, вед. науч. сотр., врач-радиолог МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: larisa@mrrc.obninsk.ru; Scopus ID: 6507375401, ORCID: 0000-0001-6374-2640
Larisa V. Kursova – Dr. Sci. (Med.), Leading Res. Officer, radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: larisa@mrrc.obninsk.ru; Scopus ID: 6507375401, ORCID: 0000-0001-6374-2640
Усачева Анна Юрьевна – врач-рентгенолог МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: annyshka-888@yandex.ru; Scopus ID: 57200540933
Anna Yu. Usacheva – radiologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: annyshka-888@yandex.ru; Scopus ID: 57200540933
Иванов Сергей Анатольевич – член-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, дир. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 16070399200, ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Prof. of the Kharchenko Department of Oncology and Roentgenology, Medical Institute of the RUDN University, Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 16070399200, ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института РУДН, дир. МНИОИ им. П.А. Герцена, ген. дир. ФГБУ «НМИЦ радиологии». E-mail: mrrc@mrrc. obninsk.ru; Scopus ID: 6602709853, ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Head of the Kharchenko Department of Oncology and Roentgenology, Medical Institute of the RUDN University, Director of the Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, General Director of the National Medical Research Radiological Centre. E-mail: mrrc@mrrc.obninsk.ru; Scopus ID: 6602709853, ORCID: 0000-0001-8784-8415
Поступила в редакцию: 15.01.2025
Поступила после рецензирования: 22.01.2025
Принята к публикации: 23.01.2025
Received: 15.01.2025
Revised: 22.01.2025
Accepted: 23.01.2025
Список исп. литературыСкрыть список1. Engels EA. Epidemiology of thymoma and associated malignancies. Journal of thoracic oncology: official publication of the International Association for the Study of Lung Cancer. J Thorac Oncol. 2010;(5):S260-5. DOI: 10.1097/JTO.0b013e3181f1f62d
2. Александров О.А., Рябов А.Б., Пикин О.В. Тимома (обзор литературы). Сибирский онкологический журнал. 2017;16(4):76-83.
Aleksandrov O.A., Ryabov A.B., Pikin O.V. Thymoma (literature review). Siberian Journal of Oncology. 2017;16(4):76-83 (in Russian).
3. Барболина Т.Д., Алахвердиев А.К., Владимирова Л.Ю и др. Практические рекомендации по лечению опухолей вилочковой железы (тимомы и рака тимуса). Злокачественные опухоли. 2022;1(3s2):659-71.
Barbolina T.D., Alakhverdiev A.K., Vladimirova L.Yu., et al. Practical recommendations for the treatment of thymus tumors (thymoma and thymus cancer). Malignant Tumors. 2022;1(3s2):659-71 (in Russian).
4. Бардычев М.С. Местные лучевые повреждения. М.: Медицина, 1985.
Bardychev M.S. Local radiation injuries. Moscow: Medicine, 1985 (in Russian).
5. Консервативное лечение рака легкого. Под ред. В.А. Горбуновой. М.: Литтерра, 2005.
Conservative treatment of lung cancer. Ed. VA Gorbunova. Moscow: Litterra, 2005 (in Russian).
6. Линденбратен Л.Д., Королюк И.П. Медицинская радиология. 2-е изд. М.: Медицина, 2000.
Lindenbraten L.D., Korolyuk I.P. Medical radiology. 2nd ed. Moscow: Medicine; 2000 (in Russian).
7. Серебряков В.С., Плоскирева А.А., Мельников В.Л. Оценка факторов риска развития пневмоний, связанных с оказанием медицинской помощи, у пациентов с онкологической патологией. Лечащий врач. 2018;(1):67-70.
Serebryakov V.S., Ploskireva A.A., Melnikov V.L. Assessment of risk factors for the development of pneumonia associated with the provision of medical care in patients with oncological pathology. Attending Physician. 2018;(1):67-70 (in Russian).
8. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys. 1995;31(5):1341-6. DOI: 10.1016/0360-3016(95)00060-C
9. Курсова Л.В. Способ лечения лучевых повреждений легких. Патент RU 2487706 C1. Опубл. 20.07.2013. Бюл. № 20.
Kursova L.V. Method of treatment of radiation injuries of lungs. Patent RU 2487706 C1. Application 20.07.2013. Byul. No. 20 (in Russian).
15 мая 2025
Количество просмотров: 306