Клинический разбор в общей медицине №6 2025
Kuban State Medical University, Krasnodar, Russia
gorbanvv@mail.ru
Abstract
The relevance of the work is due to the need to increase oncological alertness among primary health care doctors in relation to comorbid patients due to the increase in the prevalence of hepatocellular carcinoma, metastatic liver lesions, cholangiocellular cancer, as well as their late detection and difficulties diagnostics due to the absence of not only pathognomonic, but also relatively specific laboratory and instrumental signs. The article describes the stages of a difficult diagnostic search in a comorbid patient with intrahepatic cholangiocarcinoma, which led to a fatal outcome, which served as the basis for relatives to file a claim for compensation for moral harm, since the diagnosis of the oncoprocess, in their opinion, could be established at the polyclinical stage of observation. Purpose of the clinical case intrahepatic cholangiocarcinoma is the accumulation of actual material for early differentiated hepatobiliary oncological diagnosis.
Keywords: intrahepatic cholangiocarcinoma, hepatocellular carcinoma, diagnosis, markers of cancer.
For citation: Gorban V.V., Travenko E.N., Porodenko V.A. Intrahepatic cholangocarcinoma in a comorbid patient: is a rare diagnosis – a difficult diagnostic search. Clinical example and review literature. Clinical review for general practice. 2025; 6 (6): 47–53 (In Russ.).
DOI: 10.47407/kr2025.6.6.00629
С середины 2021 г. (в течение года) гражданка А. в поликлинику не обращалась, но в мае 2022 г. за один месяц до госпитализации ее состояние ухудшилось. На приеме у терапевта пациентка рассказала о жалобах на повышение температуры, одышку при ходьбе, повышение артериального давления, головокружение. При объективном осмотре определялись боли в правом подреберье и в шейном отделе позвоночника.
Помимо поликлиники, гр-ка А. в этот же период обращалась в ведомственную медицинскую организацию, где терапевт установил диагноз «острый пиелонефрит; анемия легкой степени; ревматоидный артрит(?), гипертоническая болезнь 2-й стадии», а невролог – «дорсопатия шейного отдела позвоночника; цервикобрахиалгия справа; миофасциальный болевой и умеренно-мышечно-тонический синдромы». В крови – повышение С-реактивого белка (СРБ) до 53 мг/л, мочевой кислоты до 387,9 мкмоль/л. При ультразвуковом исследовании (УЗИ) органов брюшной полости выявлены ЖКБ, хронический калькулезный холецистит, диффузные изменения поджелудочной железы. В мае–июне 2022 г. дважды вызывала бригаду скорой медицинской помощи по поводу жалоб на повышение температуры, кашель, одышку, общую слабость, обморочные состояния. После повторного вызова тест на COVID-19 дал положительный результат, и больная была госпитализирована «по скорой помощи» в инфекционную больницу. Предъявляла жалобы на слабость, повышение температуры тела до 38 °С. При физикальном обследовании кожные покровы обычной окраски, печень у края реберной дуги, увеличена, плотная, безболезненная. В стационаре при проведении КТ органов грудной клетки данных, подтверждающих пневмонию, не обнаружено, а со стороны органов брюшной полости выявлены признаки гепатомегалии, «гиподенсных образований печени, деформирующих ее контуры», камни в желчном пузыре. После проведения КТ и магнитно-резонансной томографии (МРТ) поставлен диагноз: «NEO неуточненной локализации с депозитами в печень».
В инфекционном стационаре состояние больной улучшилось. Однако в связи с обострением хронического пиелонефрита (лейкоцитурия) через трое суток была переведена в терапевтическое отделение с диагнозом: хронический пиелонефрит, обострение; злокачественное новообразование печени неуточненное; интоксикационный синдром; ИБС; гипертоническая болезнь 3-й стадии; риск сердечно-сосудистых осложнений; хроническая сердечная недостаточность 2-а стадии, II функциональный класс; ХВН 1–2-й степени.
В ходе наблюдения и лечения состояние пациентки было без ухудшения. Однако на 3-й неделе стали нарастать явления энцефалопатии, уровни трансаминаз, билирубина, аланинаминотрансферазы и аспартатаминотрансферазы, появились признаки нарушения гемодинамики. В анализах отмечалось снижение количества эритроцитов, гемоглобина, гематокрита; повышение уровня CРБ, креатинина и мочевины; нарушения кислотно основного состояния и водно-электролитного баланса. На рентгенографии органов грудной клетки обнаружили жидкость в плевральных полостях. На УЗИ органов брюшной полости – жидкость в малом тазу. Больная была переведена в отделение реанимации, где через несколько дней скончалась. Был установлен заключительный клинический диагноз. Основной диагноз: – хронический пиелонефрит, ассоциированный с Klebsiella pneumonia; злокачественное новообразование без первичной локализации с метастазами в печень; ИБС; атеросклеротический кардиосклероз; гипертоническая болезнь 3-й стадии; стратификационный риск сердечно-сосудистых осложнений. Осложнения: интоксикационно-воспалительный синдром; паранеопластический синдром; раковая интоксикация; хроническая сердечная недостаточность IIа степени, II ФК; двусторонний гидроторакс; асцит; хроническая нормохромная нормоцитарная анемия средней степени. Сопутствующий диагноз: ЖКБ, холецистит; варикозная болезнь нижних конечностей, ХВН 1–2-й степени; цереброваскулярная болезнь; энцефалопатия 2-й степени смешанного характера; дегенеративно-дистрофическое заболевание позвоночника, распространенный остеохондроз.
После патолого-анатомического исследования диагноз был уточнен: злокачественное поражение печени, исходящее из гепатоцитов – гепатоцеллюлярный рак или ГЦК с метастазами в легкие.
ГЦК является пятой по распространенности причиной смерти от рака во всем мире [11] и наиболее распространенным типом (до 90%) всех первичных злокачественных новообразований печени [12–14]. ГЦК почти всегда развивается у пациентов с хроническими заболеваниями печени, наиболее значимыми из которых являются хронический гепатит В (HBV) и C (HCV), хроническое употребление алкоголя, неалкогольная жировая болезнь печени и метаболические заболевания печени, воздействие пищевых токсинов, таких как афлатоксин-B1 [12]. Практически все состояния, вызывающие цирроз печени, могут вызывать ГЦК. Ранняя диагностика ГЦК остается ключом к улучшению прогноза [13].
Необходимо отметить, что главной терапевтической установкой при оказании первичной медико-санитарной помощи (ПМСП) является онконастороженность. Согласно нормативным актам на этапе оказания ПМСП объектом скрининга являются хронические неинфекционные заболевания, включая злокачественные новообразования. Дополнительное обследование, не входящее в объем диспансеризации, в том числе осмотр врачом-онкологом проводится при подозрении на онкологическое заболевание печени в соответствии с Порядком оказания медицинской помощи взрослому населению при онкологических заболеваниях1. Согласно методическим руководствам по раннему выявлению онкологических заболеваний печени и билиарного тракта для врачей первичного звена здравоохранения2 к ним относятся пациенты, имеющие хотя бы одно из следующих заболеваний: 1) цирроз печени вирусной этиологии класс А/B по Чайлд–Пью; 2) хронический гепатит В, без формирования цирроза печени с признаками активности гепатита или после проведения противовирусной терапии и наличием ГЦК у родственников 1-й линии;
3) хронический гепатит С на стадии выраженного фиброза (F3-F4 по METAVIR), в том числе пациенты после успешного противовирусного лечения. Кроме того, необходимость скринингового обследования доказана для следующих категорий пациентов: мужчин азиатского происхождения старше 40 лет и женщин старше 50 лет с алкогольной болезнью печени; с болезнями накопления (болезнь Вильсона–Коновалова, наследственный гемохроматоз); с неалкогольным стеатогепатитом, ассоциированным с сахарным диабетом и ожирением; с первичным билиарным циррозом. Исходя из этого, подлежат диагностике в соответствии со стандартом медицинской помощи только лица, имеющие симптомы и признаки подозрительного заболевания, что согласуется с рекомендациями Всемирной организации здравоохранения3.
Для раннего выявления рака печени применяются исследования уровня опухолевых маркеров, в частности альфа-фетопротеина (АФП), в группах повышенного риска. Однако скрининг малоэффективен из-за низкой чувствительности и специфичности АФП (часто отмечается нормальный уровень), а процент диагностированных ГЦК достаточно низкий [15, 16]. Следует говорить о положительной прогностической ценности биомаркера АФП только в случаях его роста при регулярном проведении каждые 4–6 мес [17]. Поэтому АФП не считается идеальным маркером для диагностирования ранних стадий ГЦК [18]. В последние годы при более глубоком анализе биологического механизма, лежащего в основе ГЦК, для дифференциальной диагностики, помимо сывороточных маркеров [19], стали шире внедряться методы визуализации, гистологические, гистохимические и методы молекулярной диагностики [13]. Внедрение программы искусственного интеллекта может существенно повысить точность выявления ГЦК у пациентов, подверженным риску ее развития [11].
Для скрининга ГЦК на ранней стадии Общероссийский национальный союз4, Европейская ассоциация по изучению печени5 и Американская ассоциация по изучению заболеваний печени6 рекомендуют проводить УЗИ брюшной полости с мониторингом АФП или без него каждые 6 мес у пациентов с высоким риском ГЦК, т.е. с хроническим заболеванием печени или циррозом. Однако эксплуатационные характеристики этих методов, включая чувствительность, специфичность и прогностическую ценность, также относительно низкие. При этом вероятность выявления ГЦК повышается на 6–8%. Клиническими рекомендациями «Гепатоцеллюлярная карцинома и рак внепеченочных желчных протоков и желчного пузыря» и «Рак желчевыводящей системы»7 опухолевые маркеры, такие как АФП, определяются не только при ГЦК и ВПХ, но и в группе повышенного риска (желчнокаменная болезнь, полипы желчного пузыря, первичный склерозирующий холангит, паразитарная инвазия).
Из медицинской карты пациента, получающего помощь в амбулаторных условиях известно, что больная А. страдала ЖКБ, хроническим холециститом, однако не зафиксированы дата впервые установленного диагноза и факт последующей систематической обращаемости в данное учреждении по поводу этого заболевания и других состояний, указанных в методических руководствах, требующих онкологической настороженности.
Анализ медицинской карты свидетельствует, что при обращениях гр-ки А. в медицинские организации, оказывающие ПМСП, у нее до инфицирования COVID-19 отсутствовали жалобы и клинико-инструментальные данные, которые могли бы насторожить врачей в отношении злокачественного новообразования печени (дискомфорт, боли в правом боку; резкое снижение массы тела; выраженная интоксикация; изменение цвета кала и мочи; пожелтение кожи и склер; немотивированная слабость, утомляемость, обнаружение опухолевых узлов в печени при проведении УЗИ); не имелось заболеваний, относящихся к группе риска по развитию гепатоцеллюлярного рака, что требовало бы оснований для включения гражданки А. в группу риска по злокачественным новообразованиям печени или необходимости направления ее к другим специалистам для оценки этих рисков и реализации скрининговых дополнительных визуализирующих и лабораторных диагностических исследований с целью более раннего установления диагноза злокачественного новообразования.
Однако родственники гр-ки А. обратились в суд с иском к организации оказания первичной медицинской помощи, где наблюдалась пациентка, о взыскании морального вреда в связи с поздним обнаружением злокачественного новообразования печени. Была назначена судебно-медицинская экспертиза.
1 Порядок оказания медицинской помощи взрослому населению при онкологических заболеваниях, утвержденный Приказом Минздрава России от 19.02.2021 №116н.
2 Методические руководства «Раннее выявление онкологических заболеваний органов пищеварения (для врачей первичного здравоохранения)», 2019 г., раздел 5 «Гепатоцеллюлярная карцинома и рак внепеченочных желчных протоков и желчного пузыря».
3 Guide to cancer early diagnosis. World Health Organization, 2017.
4 Клинические рекомендации «Рак желчевыводящей системы», 2020 г. Общероссийский национальный союз «Ассоциация онкологов России», Общероссийская общественная организация «Российское общество клинической онкологии».
5 Европейская ассоциация по изучению печени (ECSL).
6 Американская ассоциация по изучению заболеваний печени (AASLD).
7 Клинические рекомендации «Рак желчевыводящей системы», 2020–2022 гг., методические руководства «Раннее выявление онкологических заболеваний органов пищеварения, 2019 г.
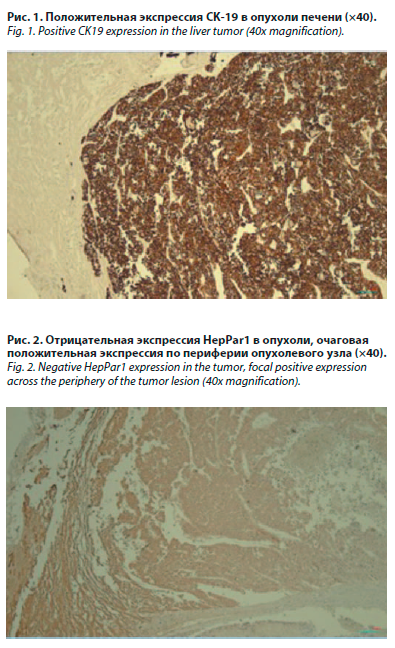 В рамках судебно-медицинской экспертизы с выполнением повторного патогистологического исследования был выявлен гистогенетический характер первичной опухоли печени – «внутрипеченочная холангиокарцинома (опухоль, исходящая из эпителия желчных протоков) с прорастанием в ткань печени, лимфоузлы и метастазами в легкие». При иммуногистохимическом исследовании была установлена положительная реакция на цитокератин 19 (CK-19) и отсутствие реакции на гепацитарный антиген (рис. 1, 2).
В рамках судебно-медицинской экспертизы с выполнением повторного патогистологического исследования был выявлен гистогенетический характер первичной опухоли печени – «внутрипеченочная холангиокарцинома (опухоль, исходящая из эпителия желчных протоков) с прорастанием в ткань печени, лимфоузлы и метастазами в легкие». При иммуногистохимическом исследовании была установлена положительная реакция на цитокератин 19 (CK-19) и отсутствие реакции на гепацитарный антиген (рис. 1, 2).
К факторам риска развития как ВПХ, так и ГЦК относят не только пожилой возраст, но и хронический вирусный гепатит (HBV и HCV), цирроз печени, неалкогольную жировую болезнь печени, алкогольную болезнь печени, гемохроматоз, сахарный диабет, ожирение, метаболический синдром [1, 5, 10], дислипидемию [22].
Другими факторами риска ВПХ являются пороки развития билиарного тракта, такие как болезнь Кароли, врожденный фиброз печени, киста холедоха; воздействие таких веществ, как радон, диоксины, дихлорпропан, дихлорметан [1, 5], асбест [23]. Нередко с ВПХ ассоциируются воспалительные заболевания кишечника, табакокурение [23].
У большинства больных с холангиокарциномой не отмечается никаких предрасполагающих факторов. Тем не менее не исключена связь с холангиокарциномой таких заболеваний, как холедохолитиаз [1, 5, 24, 25] длительностью более 10 лет [26], наличие конкрементов в протоках обеих долей печени или билиарных стриктур, потерей на этом фоне массы тела и повышением уровня щелочной фосфатазы; наличие кист, полипов, первичного склерозирующего холангиолита. Холецистолитиаз ряд исследователей относят к противоречивым факторам риска холангиокарциномы.
Шансы на выживание для людей с раком желчных протоков во многом зависят от его местоположения, степени поражения и времени установления диагноза. ВПХ (тип аденокарциномы) чаще диагностируется на поздних стадиях, так как на ранних сроках диагноз затруднен, поскольку ВПХ протекает бессимптомно или с различными неспецифическими симптомами [5, 27–29], такими как общее недомогание, ночные поты, отвращение к пище, тошнота, боли в правом подреберье, рвота, потеря массы тела, увеличение живота. У пожилых пациентов ВПХ с поражением мелких желчных протоков часто не вызывает никаких симптомов, пока они не достигнут размера, вызывающего обструкцию желчного протока и появление синдрома желтухи или холангита [1, 5].
У больных ВПХ часто наблюдаемыми измененными неспецифическими лабораторными показателями функции печени являются альбумин, общий белок, количество тромбоцитов, общий и прямой билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, щелочная фосфатаза, протромбиновое время или международное нормализованное отношение [1, 5]. Любые изменения маркеров, отражающих нарушение функции печени при хроническом заболевании печени, должны служить показанием к детальному исследованию [5].
Особое внимание придается СРБ как показателю острофазового воспаления. Однако, несмотря на то, что СРБ является маркером с высокой чувствительностью и специфичностью для обнаружения подтипа ВПХ с поражением мелких желчных протоков с предсказательной 95%-ценностью положительного результата, его предсказательная ценность у больных с подтипом ВПХ с поражением крупных желчных протоков составляет только 5% [1]. Одним из новых оценочных маркеров функций печени у пациентов с холангиокарциномой является альбумин-билирубиновый (ALBI) коэффициент [3]. ALBI может считаться надежным и клинически полезным прогностическим показателем, особенно у больных с ВПХ, потому что более высокий уровень ALBI, по данным Omouri-Kharashtomi и соавт., коррелировал не только с более низкой общей выживаемостью, но и с уменьшением выживаемости без рецидивов [3].
ВПХ имеет плохой прогноз с непредотвратимым летальным исходом [30], поэтому ранняя идентификация очень важна для достижения наилучшего результата [20]. У коморбидных больных клиническая симптоматика ВПХ маскируется сопутствующей хронической фоновой патологией [31]. На этом этапе в значительной степени недостаточно информативны результаты лабораторных данных и ультразвукового, КТ или МРТ-исследований органов брюшной полости [11, 32]. Среди различных методов визуализации УЗИ органов брюшной полости представляет собой процедуру первого уровня, мультидекторная КТ (МДКТ) и МРТ представляют собой диагностические инструменты второго и третьего уровня соответственно [20]. При выполнении названных методов диагностики у больных и без особых клинических проявлений случайно, в 12–30% случаев, могут выявляться распространенные опухолевые процессы [33].
Частота заболеваемости холангиокарциномой увеличивается, а прогноз остается плохим. Большинство пациентов имеют запущенное заболевание, для которого характерна обструкция желчных протоков (44%) и обусловленные ею кожный зуд и желтуха, а единственным методом лечения является паллиативная химиотерапия [27].
Жалобы и данные клинико-лабораторного исследования пациентки до поступления в стационар также не свидетельствовали о развернутой картине опухолевого процесса. Вместе с тем ухудшение состояния больной с эпизодами подъема температуры, остеоартропатиями, болями различной локализации, периодическим головокружением, слабостью, неспецифическими изменениями в анализах крови, мочи и биохимических показателях, возможно, являлись проявлениями нарастающего паранеопластического синдрома.
Таким образом, холангиокарцинома, являясь злокачественной опухолью, возникающей из билиарной системы, представляет собой спорадический рак у пациентов без определенных факторов риска и чаще диагностируется на поздних стадиях с последующим плохим прогнозом.
ВПХ является молекулярно неоднородной патологией и демонстрирует широкий спектр клинически и гистопатологически гетерогенных опухолей с растущей заболеваемостью во всем мире. Поэтому диагноз ВПХ представляет собой серьезную проблему для патологоанатомов [1]. Классификация предусматривает наличие двух типов ВПХ: с поражением мелких и крупных желчных протоков. Разделение типов ВПХ основано на морфологических особенностях, а среди многих иммуногистохимических маркеров специфичными для обоих типов ВПХ являются цитокератин (CK-7, CK-19) и MUC1 [1]. Помимо гистохимических признаков для ВПХ характерны многочисленные молекулярные изменения [1]. Большое значение имеет оценка экспрессии анти-Hep Par 1 (моноклональное антитело к гепатоцитарному парафину 1) [34]. Несмотря на то что anti-Hep Par 1 в качестве чувствительного маркера для ВПХ не является полностью специфическим [35], его включение в панель методов обследования вместе с CK-19 максимально увеличивает точность диагностики [36].
Именно этот набор проведенных исследований с положительной экспрессией CK-19 и отсутствием реакции на гепацитарный антиген предопределил окончательный диагноз ВПХ у гр-ки А.
Последние исследования подтипов ВПХ предлагают широкий спектр биомаркеров на тканевых и молекулярных уровнях с учетом их потенциальной диагностической, прогностической и терапевтической эффективности. Определены ограничения в применении существующих биомаркеров, а также конкретные перспективы приоритетных исследований по разработке новых, включая использование искусственного интеллекта и органоидов, полученных от пациентов [33].
В последнее время уделяется внимание фактору молекулярно-генетических мутаций различных генов [37]. За последние несколько лет был изучен геномный ландшафт рака желчных путей и разработано несколько целевых методов лечения [33].
Точный диагноз ВПХ является мультидисциплинарной проблемой с многопрофильным подходом [7] и требует комбинации клинических, радиологических, гистологических результатов, а также иммуногистохимического и молекулярного анализа. ВПХ остается заболеванием с высоким риском смертности [1]. Диагностика ВПХ у коморбидных пациентов является еще более сложной, так как зачастую клиническая картина ВПХ возникает на поздних этапах развития опухоли (4-я клиническая стадия), а сопутствующая патология, в том числе и COVID-19, нередко опережает и маскирует основное заболевание [14, 31].
Экспертная комиссия не установила дефектов медицинской помощи на этапе оказания ПМСП в условиях кратковременного наблюдения гр-ки А. и не усмотрела каких-либо причинных связей между проводимым амбулаторным наблюдением, лечением и смертью гр-ки А. от прогрессирующего злокачественного онкологического заболевания печени, установленного по объективным причинам на последнем этапе диагностического процесса.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. В.В. Горбань – обзор литературных данных, касающихся диагностики и ведения больных с онкологическими заболеваниями гепатобилиарной системы, редактирование дизайна и текста статьи. Е.Н. Травенко – концепция статьи, сбор, анализ и интерпретация данных. В.А. Породенко – редактирование черновика рукописи с внесением ценного замечания интеллектуального содержания. Все авторы дали окончательное согласие на подачу рукописи и согласились нести ответственность за все аспекты работы, ручаясь за их точность и безупречность.
Contribution of authors. Gorban V.V. reviewed literary data regarding the diagnosis and conduct of patients with oncological diseases of the hepatobiliary system, edited the design and text of the article. Travenko E.N. proposed and developed the concept of an article, provided patients who formed the basis of a clinical case. Porodenko V.A. – editing draft of the manuscript with the introduction of a valuable remark of intellectual content. All authors gave the final consent to the manuscript and agreed to bear responsibility for all aspects of the work, vouching for their accuracy and impeccability.
Информация об авторах
Information about the authors
Горбань Виталий Васильевич – д-р мед. наук, зав. каф. поликлинической терапии с курсом общей врачебной практики (семейной медицины), ФГБОУ ВО КубГМУ. E-mail: gorbanvv@mail.ru;
ORCID: 0000-0001-8665-6796; eLibrary SPIN: 6305-6187
Vitaly V. Gorban – Dr. Sci. (Med.), Kuban State Medical University. E-mail: gorbanvv@mail.ru; ORCID: 0000-0001-8665-6796; eLibrary SPIN: 6305–6187
Травенко Елена Николаевна – д-р мед. наук, доцент, проф. каф. судебной медицины, ФГБОУ ВО КубГМУ. E-mail:
elenaschon@yandex.ru; ORCID: 0000-0001-7403-2521; eLibrary SPIN: 8748-3506
Elena N. Travenko – Dr. Sci. (Med.), Assoc. Prof., Kuban State Medical University. E-mail: elenaschon@yandex.ru; ORCID: 0000-0001-7403-2521; eLibrary SPIN: 8748-3506
Породенко Валерий Анатольевич – д-р мед. наук, проф., зав. каф. судебной медицины, ФГБОУ ВО КубГМУ. E-mail:
porodenko52@mail.ru; ORCID: 0000-0001-6353-7380; eLibrary SPIN: 6685-8824
Valery A. Porodenko – Dr. Sci. (Med.), Full Prof., Kuban State Medical University. E-mail: porodenko52@mail.ru; ORCID: 0000-0001-6353-7380; eLibrary SPIN: 6685-8824
Поступила в редакцию: 13.03.2025
Поступила после рецензирования: 18.03.2025
Принята к публикации: 29.03.2025
Received: 13.03.2025
Revised: 18.03.2025
Accepted: 29.03.2025
Клинический разбор в общей медицине №6 2025
Внутрипеченочная холангиокарцинома у коморбидной больной: трудный диагностический поиск. Клинический случай и обзор литературы
Номера страниц в выпуске:47-52
Аннотация
Актуальность работы обусловлена необходимостью повышения онкологической настороженности у врачей первичного звена здравоохранения по отношению к коморбидным больным ввиду увеличения распространенности гепатоцеллюлярной карциномы, метастатических поражений печени, холангиоцеллюлярного рака, а также запоздалого их выявления и трудностей диагностики, обусловленных отсутствием не только патогномоничных, но и относительно специфичных лабораторных и инструментальных признаков. В статье описаны этапы трудного диагностического поиска внутрипеченочной холангиокарциномы, приведшей к летальному исходу у коморбидной больной, что послужило основанием для родственников подачи искового заявления о возмещении морального вреда, так как диагноз онкопроцесса, по их мнению, мог быть установлен на поликлиническом этапе. Целью разбора клинического случая внутрипеченочной холангиокарциномы является накопление фактического материала для ранней дифференцированной гепатобилиарной онкологической диагностики.
Ключевые слова: внутрипеченочная холангиокарцинома, гепатоцеллюлярная карцинома, диагностика, маркеры рака.
Для цитирования: Горбань В.В., Травенко Е.Н. Породенко В.А. Внутрипеченочная холангиокарцинома у коморбидной больной: трудный диагностический поиск. Клинический случай и обзор литературы. Клинический разбор в общей медицине. 2025; 6 (6): 47–52. DOI: 10.47407/kr2025.6.6.00629
Актуальность работы обусловлена необходимостью повышения онкологической настороженности у врачей первичного звена здравоохранения по отношению к коморбидным больным ввиду увеличения распространенности гепатоцеллюлярной карциномы, метастатических поражений печени, холангиоцеллюлярного рака, а также запоздалого их выявления и трудностей диагностики, обусловленных отсутствием не только патогномоничных, но и относительно специфичных лабораторных и инструментальных признаков. В статье описаны этапы трудного диагностического поиска внутрипеченочной холангиокарциномы, приведшей к летальному исходу у коморбидной больной, что послужило основанием для родственников подачи искового заявления о возмещении морального вреда, так как диагноз онкопроцесса, по их мнению, мог быть установлен на поликлиническом этапе. Целью разбора клинического случая внутрипеченочной холангиокарциномы является накопление фактического материала для ранней дифференцированной гепатобилиарной онкологической диагностики.
Ключевые слова: внутрипеченочная холангиокарцинома, гепатоцеллюлярная карцинома, диагностика, маркеры рака.
Для цитирования: Горбань В.В., Травенко Е.Н. Породенко В.А. Внутрипеченочная холангиокарцинома у коморбидной больной: трудный диагностический поиск. Клинический случай и обзор литературы. Клинический разбор в общей медицине. 2025; 6 (6): 47–52. DOI: 10.47407/kr2025.6.6.00629
Intrahepatic cholangocarcinoma in a comorbid patient: is a rare diagnosis – a difficult diagnostic search. Clinical example and review literature
Vitaly V. Gorban, Elena N. Travenko, Valery A. PorodenkoKuban State Medical University, Krasnodar, Russia
gorbanvv@mail.ru
Abstract
The relevance of the work is due to the need to increase oncological alertness among primary health care doctors in relation to comorbid patients due to the increase in the prevalence of hepatocellular carcinoma, metastatic liver lesions, cholangiocellular cancer, as well as their late detection and difficulties diagnostics due to the absence of not only pathognomonic, but also relatively specific laboratory and instrumental signs. The article describes the stages of a difficult diagnostic search in a comorbid patient with intrahepatic cholangiocarcinoma, which led to a fatal outcome, which served as the basis for relatives to file a claim for compensation for moral harm, since the diagnosis of the oncoprocess, in their opinion, could be established at the polyclinical stage of observation. Purpose of the clinical case intrahepatic cholangiocarcinoma is the accumulation of actual material for early differentiated hepatobiliary oncological diagnosis.
Keywords: intrahepatic cholangiocarcinoma, hepatocellular carcinoma, diagnosis, markers of cancer.
For citation: Gorban V.V., Travenko E.N., Porodenko V.A. Intrahepatic cholangocarcinoma in a comorbid patient: is a rare diagnosis – a difficult diagnostic search. Clinical example and review literature. Clinical review for general practice. 2025; 6 (6): 47–53 (In Russ.).
DOI: 10.47407/kr2025.6.6.00629
Введение
Холангиокарцинома – опухоль, исходящая из эпителия желчных протоков, занимающая по частоте среди злокачественных новообразований печени 2-е место после гепатоцеллюлярной карциномы (ГЦК). Внутрипеченочная ее локализация встречается в 10–20% случаев первичного рака печени и характеризуется агрессивным течением и плохим прогнозом [1–3]. Многочисленные исследования отмечают неуклонный рост заболеваемости внутрипеченочной холангиокарциномой (ВПХ) [4, 5]. Морфологические признаки ВПХ могут быть сходными со склерозирующим типом ГЦК или метастатической аденокарциномой [1], в связи с чем оценка первичных карцином печени является сложной задачей [1, 6]. Проводить дифференциальную диагностику позволяет компьютерная томография (КТ) с внутривенным контрастированием, однако и она в ряде случаев дает определенную схожесть отображения гепатоцеллюлярного рака и ВПХ [7, 8]. Решающим в таком случае является морфологическая верификация опухоли, в том числе гистохимическая [9, 10].Описание клинического случая
Гр. А., 70 лет, регулярно проходила поликлиническое обследование. Однако посещения поликлиники пациенткой по месту жительства преимущественно были обусловлены коморбидной патологией: гипертонической болезнью (2003 г.), острым восходящим тромбофлебитом и флотирующим тромбом большой подкожной вены правой нижней конечности (2012 г.), узловой формой аутоиммунного тиреоидита (2016 г.), наследственной формой тромбофилии, посттромбофлебитическим синдромом правой и левой нижних конечностей (2016 г.), мигрирующим тромбозом поверхностных вен, хронической венозной недостаточностью (ХВН) 2-й степени (2017 г.), хроническим холециститом (2017 г.), ишемической болезнью сердца (ИБС), стабильной стенокардией напряжения II функционального класса (ФК), хронической сердечной недостаточностью II ФК, 2-а стадии (2019 г.), желчнокаменной болезнью (ЖКБ) со множественными (мелкими, средними и большими) камнями в желчном пузыре, перетяжкой желчного пузыря (2020 г.).С середины 2021 г. (в течение года) гражданка А. в поликлинику не обращалась, но в мае 2022 г. за один месяц до госпитализации ее состояние ухудшилось. На приеме у терапевта пациентка рассказала о жалобах на повышение температуры, одышку при ходьбе, повышение артериального давления, головокружение. При объективном осмотре определялись боли в правом подреберье и в шейном отделе позвоночника.
Помимо поликлиники, гр-ка А. в этот же период обращалась в ведомственную медицинскую организацию, где терапевт установил диагноз «острый пиелонефрит; анемия легкой степени; ревматоидный артрит(?), гипертоническая болезнь 2-й стадии», а невролог – «дорсопатия шейного отдела позвоночника; цервикобрахиалгия справа; миофасциальный болевой и умеренно-мышечно-тонический синдромы». В крови – повышение С-реактивого белка (СРБ) до 53 мг/л, мочевой кислоты до 387,9 мкмоль/л. При ультразвуковом исследовании (УЗИ) органов брюшной полости выявлены ЖКБ, хронический калькулезный холецистит, диффузные изменения поджелудочной железы. В мае–июне 2022 г. дважды вызывала бригаду скорой медицинской помощи по поводу жалоб на повышение температуры, кашель, одышку, общую слабость, обморочные состояния. После повторного вызова тест на COVID-19 дал положительный результат, и больная была госпитализирована «по скорой помощи» в инфекционную больницу. Предъявляла жалобы на слабость, повышение температуры тела до 38 °С. При физикальном обследовании кожные покровы обычной окраски, печень у края реберной дуги, увеличена, плотная, безболезненная. В стационаре при проведении КТ органов грудной клетки данных, подтверждающих пневмонию, не обнаружено, а со стороны органов брюшной полости выявлены признаки гепатомегалии, «гиподенсных образований печени, деформирующих ее контуры», камни в желчном пузыре. После проведения КТ и магнитно-резонансной томографии (МРТ) поставлен диагноз: «NEO неуточненной локализации с депозитами в печень».
В инфекционном стационаре состояние больной улучшилось. Однако в связи с обострением хронического пиелонефрита (лейкоцитурия) через трое суток была переведена в терапевтическое отделение с диагнозом: хронический пиелонефрит, обострение; злокачественное новообразование печени неуточненное; интоксикационный синдром; ИБС; гипертоническая болезнь 3-й стадии; риск сердечно-сосудистых осложнений; хроническая сердечная недостаточность 2-а стадии, II функциональный класс; ХВН 1–2-й степени.
В ходе наблюдения и лечения состояние пациентки было без ухудшения. Однако на 3-й неделе стали нарастать явления энцефалопатии, уровни трансаминаз, билирубина, аланинаминотрансферазы и аспартатаминотрансферазы, появились признаки нарушения гемодинамики. В анализах отмечалось снижение количества эритроцитов, гемоглобина, гематокрита; повышение уровня CРБ, креатинина и мочевины; нарушения кислотно основного состояния и водно-электролитного баланса. На рентгенографии органов грудной клетки обнаружили жидкость в плевральных полостях. На УЗИ органов брюшной полости – жидкость в малом тазу. Больная была переведена в отделение реанимации, где через несколько дней скончалась. Был установлен заключительный клинический диагноз. Основной диагноз: – хронический пиелонефрит, ассоциированный с Klebsiella pneumonia; злокачественное новообразование без первичной локализации с метастазами в печень; ИБС; атеросклеротический кардиосклероз; гипертоническая болезнь 3-й стадии; стратификационный риск сердечно-сосудистых осложнений. Осложнения: интоксикационно-воспалительный синдром; паранеопластический синдром; раковая интоксикация; хроническая сердечная недостаточность IIа степени, II ФК; двусторонний гидроторакс; асцит; хроническая нормохромная нормоцитарная анемия средней степени. Сопутствующий диагноз: ЖКБ, холецистит; варикозная болезнь нижних конечностей, ХВН 1–2-й степени; цереброваскулярная болезнь; энцефалопатия 2-й степени смешанного характера; дегенеративно-дистрофическое заболевание позвоночника, распространенный остеохондроз.
После патолого-анатомического исследования диагноз был уточнен: злокачественное поражение печени, исходящее из гепатоцитов – гепатоцеллюлярный рак или ГЦК с метастазами в легкие.
ГЦК является пятой по распространенности причиной смерти от рака во всем мире [11] и наиболее распространенным типом (до 90%) всех первичных злокачественных новообразований печени [12–14]. ГЦК почти всегда развивается у пациентов с хроническими заболеваниями печени, наиболее значимыми из которых являются хронический гепатит В (HBV) и C (HCV), хроническое употребление алкоголя, неалкогольная жировая болезнь печени и метаболические заболевания печени, воздействие пищевых токсинов, таких как афлатоксин-B1 [12]. Практически все состояния, вызывающие цирроз печени, могут вызывать ГЦК. Ранняя диагностика ГЦК остается ключом к улучшению прогноза [13].
Необходимо отметить, что главной терапевтической установкой при оказании первичной медико-санитарной помощи (ПМСП) является онконастороженность. Согласно нормативным актам на этапе оказания ПМСП объектом скрининга являются хронические неинфекционные заболевания, включая злокачественные новообразования. Дополнительное обследование, не входящее в объем диспансеризации, в том числе осмотр врачом-онкологом проводится при подозрении на онкологическое заболевание печени в соответствии с Порядком оказания медицинской помощи взрослому населению при онкологических заболеваниях1. Согласно методическим руководствам по раннему выявлению онкологических заболеваний печени и билиарного тракта для врачей первичного звена здравоохранения2 к ним относятся пациенты, имеющие хотя бы одно из следующих заболеваний: 1) цирроз печени вирусной этиологии класс А/B по Чайлд–Пью; 2) хронический гепатит В, без формирования цирроза печени с признаками активности гепатита или после проведения противовирусной терапии и наличием ГЦК у родственников 1-й линии;
3) хронический гепатит С на стадии выраженного фиброза (F3-F4 по METAVIR), в том числе пациенты после успешного противовирусного лечения. Кроме того, необходимость скринингового обследования доказана для следующих категорий пациентов: мужчин азиатского происхождения старше 40 лет и женщин старше 50 лет с алкогольной болезнью печени; с болезнями накопления (болезнь Вильсона–Коновалова, наследственный гемохроматоз); с неалкогольным стеатогепатитом, ассоциированным с сахарным диабетом и ожирением; с первичным билиарным циррозом. Исходя из этого, подлежат диагностике в соответствии со стандартом медицинской помощи только лица, имеющие симптомы и признаки подозрительного заболевания, что согласуется с рекомендациями Всемирной организации здравоохранения3.
Для раннего выявления рака печени применяются исследования уровня опухолевых маркеров, в частности альфа-фетопротеина (АФП), в группах повышенного риска. Однако скрининг малоэффективен из-за низкой чувствительности и специфичности АФП (часто отмечается нормальный уровень), а процент диагностированных ГЦК достаточно низкий [15, 16]. Следует говорить о положительной прогностической ценности биомаркера АФП только в случаях его роста при регулярном проведении каждые 4–6 мес [17]. Поэтому АФП не считается идеальным маркером для диагностирования ранних стадий ГЦК [18]. В последние годы при более глубоком анализе биологического механизма, лежащего в основе ГЦК, для дифференциальной диагностики, помимо сывороточных маркеров [19], стали шире внедряться методы визуализации, гистологические, гистохимические и методы молекулярной диагностики [13]. Внедрение программы искусственного интеллекта может существенно повысить точность выявления ГЦК у пациентов, подверженным риску ее развития [11].
Для скрининга ГЦК на ранней стадии Общероссийский национальный союз4, Европейская ассоциация по изучению печени5 и Американская ассоциация по изучению заболеваний печени6 рекомендуют проводить УЗИ брюшной полости с мониторингом АФП или без него каждые 6 мес у пациентов с высоким риском ГЦК, т.е. с хроническим заболеванием печени или циррозом. Однако эксплуатационные характеристики этих методов, включая чувствительность, специфичность и прогностическую ценность, также относительно низкие. При этом вероятность выявления ГЦК повышается на 6–8%. Клиническими рекомендациями «Гепатоцеллюлярная карцинома и рак внепеченочных желчных протоков и желчного пузыря» и «Рак желчевыводящей системы»7 опухолевые маркеры, такие как АФП, определяются не только при ГЦК и ВПХ, но и в группе повышенного риска (желчнокаменная болезнь, полипы желчного пузыря, первичный склерозирующий холангит, паразитарная инвазия).
Из медицинской карты пациента, получающего помощь в амбулаторных условиях известно, что больная А. страдала ЖКБ, хроническим холециститом, однако не зафиксированы дата впервые установленного диагноза и факт последующей систематической обращаемости в данное учреждении по поводу этого заболевания и других состояний, указанных в методических руководствах, требующих онкологической настороженности.
Анализ медицинской карты свидетельствует, что при обращениях гр-ки А. в медицинские организации, оказывающие ПМСП, у нее до инфицирования COVID-19 отсутствовали жалобы и клинико-инструментальные данные, которые могли бы насторожить врачей в отношении злокачественного новообразования печени (дискомфорт, боли в правом боку; резкое снижение массы тела; выраженная интоксикация; изменение цвета кала и мочи; пожелтение кожи и склер; немотивированная слабость, утомляемость, обнаружение опухолевых узлов в печени при проведении УЗИ); не имелось заболеваний, относящихся к группе риска по развитию гепатоцеллюлярного рака, что требовало бы оснований для включения гражданки А. в группу риска по злокачественным новообразованиям печени или необходимости направления ее к другим специалистам для оценки этих рисков и реализации скрининговых дополнительных визуализирующих и лабораторных диагностических исследований с целью более раннего установления диагноза злокачественного новообразования.
Однако родственники гр-ки А. обратились в суд с иском к организации оказания первичной медицинской помощи, где наблюдалась пациентка, о взыскании морального вреда в связи с поздним обнаружением злокачественного новообразования печени. Была назначена судебно-медицинская экспертиза.
1 Порядок оказания медицинской помощи взрослому населению при онкологических заболеваниях, утвержденный Приказом Минздрава России от 19.02.2021 №116н.
2 Методические руководства «Раннее выявление онкологических заболеваний органов пищеварения (для врачей первичного здравоохранения)», 2019 г., раздел 5 «Гепатоцеллюлярная карцинома и рак внепеченочных желчных протоков и желчного пузыря».
3 Guide to cancer early diagnosis. World Health Organization, 2017.
4 Клинические рекомендации «Рак желчевыводящей системы», 2020 г. Общероссийский национальный союз «Ассоциация онкологов России», Общероссийская общественная организация «Российское общество клинической онкологии».
5 Европейская ассоциация по изучению печени (ECSL).
6 Американская ассоциация по изучению заболеваний печени (AASLD).
7 Клинические рекомендации «Рак желчевыводящей системы», 2020–2022 гг., методические руководства «Раннее выявление онкологических заболеваний органов пищеварения, 2019 г.
Результаты судебно-медицинской экспертизы
 В рамках судебно-медицинской экспертизы с выполнением повторного патогистологического исследования был выявлен гистогенетический характер первичной опухоли печени – «внутрипеченочная холангиокарцинома (опухоль, исходящая из эпителия желчных протоков) с прорастанием в ткань печени, лимфоузлы и метастазами в легкие». При иммуногистохимическом исследовании была установлена положительная реакция на цитокератин 19 (CK-19) и отсутствие реакции на гепацитарный антиген (рис. 1, 2).
В рамках судебно-медицинской экспертизы с выполнением повторного патогистологического исследования был выявлен гистогенетический характер первичной опухоли печени – «внутрипеченочная холангиокарцинома (опухоль, исходящая из эпителия желчных протоков) с прорастанием в ткань печени, лимфоузлы и метастазами в легкие». При иммуногистохимическом исследовании была установлена положительная реакция на цитокератин 19 (CK-19) и отсутствие реакции на гепацитарный антиген (рис. 1, 2).Обсуждение
ВПХ представляет собой очень агрессивную злокачественную опухоль с высокой смертностью и плохой выживаемостью, которая возникает из билиарных клеток второго порядка и является второй после ГЦК наиболее распространенной первичной опухолью печени [1, 20], встречаясь c частотой 10–20% [5, 10, 21]. ВПХ остается смертельным злокачественным новообразованием у пациентов в возрасте, близком к 70-летию. Распространенность ВПХ увеличивается во всем мире [5], а фактическая частота в настоящее время вероятно более высокая, потому что этот вид рака трудно диагностировать, а некоторые случаи ВПХ могли быть ошибочно классифицированы как другие виды рака [2]. Иногда ВПХ путают с ГЦК, которая встречается гораздо чаще, но это два разных типа рака, и они лечатся по-разному [2]. ВПХ, ввиду вариабельности гистологических и молекулярно-генетических проявлений, все еще трудно диагностировать и лечить. Этиология большинства типов холангиокрциномы остается неясной [1].К факторам риска развития как ВПХ, так и ГЦК относят не только пожилой возраст, но и хронический вирусный гепатит (HBV и HCV), цирроз печени, неалкогольную жировую болезнь печени, алкогольную болезнь печени, гемохроматоз, сахарный диабет, ожирение, метаболический синдром [1, 5, 10], дислипидемию [22].
Другими факторами риска ВПХ являются пороки развития билиарного тракта, такие как болезнь Кароли, врожденный фиброз печени, киста холедоха; воздействие таких веществ, как радон, диоксины, дихлорпропан, дихлорметан [1, 5], асбест [23]. Нередко с ВПХ ассоциируются воспалительные заболевания кишечника, табакокурение [23].
У большинства больных с холангиокарциномой не отмечается никаких предрасполагающих факторов. Тем не менее не исключена связь с холангиокарциномой таких заболеваний, как холедохолитиаз [1, 5, 24, 25] длительностью более 10 лет [26], наличие конкрементов в протоках обеих долей печени или билиарных стриктур, потерей на этом фоне массы тела и повышением уровня щелочной фосфатазы; наличие кист, полипов, первичного склерозирующего холангиолита. Холецистолитиаз ряд исследователей относят к противоречивым факторам риска холангиокарциномы.
Шансы на выживание для людей с раком желчных протоков во многом зависят от его местоположения, степени поражения и времени установления диагноза. ВПХ (тип аденокарциномы) чаще диагностируется на поздних стадиях, так как на ранних сроках диагноз затруднен, поскольку ВПХ протекает бессимптомно или с различными неспецифическими симптомами [5, 27–29], такими как общее недомогание, ночные поты, отвращение к пище, тошнота, боли в правом подреберье, рвота, потеря массы тела, увеличение живота. У пожилых пациентов ВПХ с поражением мелких желчных протоков часто не вызывает никаких симптомов, пока они не достигнут размера, вызывающего обструкцию желчного протока и появление синдрома желтухи или холангита [1, 5].
У больных ВПХ часто наблюдаемыми измененными неспецифическими лабораторными показателями функции печени являются альбумин, общий белок, количество тромбоцитов, общий и прямой билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, щелочная фосфатаза, протромбиновое время или международное нормализованное отношение [1, 5]. Любые изменения маркеров, отражающих нарушение функции печени при хроническом заболевании печени, должны служить показанием к детальному исследованию [5].
Особое внимание придается СРБ как показателю острофазового воспаления. Однако, несмотря на то, что СРБ является маркером с высокой чувствительностью и специфичностью для обнаружения подтипа ВПХ с поражением мелких желчных протоков с предсказательной 95%-ценностью положительного результата, его предсказательная ценность у больных с подтипом ВПХ с поражением крупных желчных протоков составляет только 5% [1]. Одним из новых оценочных маркеров функций печени у пациентов с холангиокарциномой является альбумин-билирубиновый (ALBI) коэффициент [3]. ALBI может считаться надежным и клинически полезным прогностическим показателем, особенно у больных с ВПХ, потому что более высокий уровень ALBI, по данным Omouri-Kharashtomi и соавт., коррелировал не только с более низкой общей выживаемостью, но и с уменьшением выживаемости без рецидивов [3].
ВПХ имеет плохой прогноз с непредотвратимым летальным исходом [30], поэтому ранняя идентификация очень важна для достижения наилучшего результата [20]. У коморбидных больных клиническая симптоматика ВПХ маскируется сопутствующей хронической фоновой патологией [31]. На этом этапе в значительной степени недостаточно информативны результаты лабораторных данных и ультразвукового, КТ или МРТ-исследований органов брюшной полости [11, 32]. Среди различных методов визуализации УЗИ органов брюшной полости представляет собой процедуру первого уровня, мультидекторная КТ (МДКТ) и МРТ представляют собой диагностические инструменты второго и третьего уровня соответственно [20]. При выполнении названных методов диагностики у больных и без особых клинических проявлений случайно, в 12–30% случаев, могут выявляться распространенные опухолевые процессы [33].
Частота заболеваемости холангиокарциномой увеличивается, а прогноз остается плохим. Большинство пациентов имеют запущенное заболевание, для которого характерна обструкция желчных протоков (44%) и обусловленные ею кожный зуд и желтуха, а единственным методом лечения является паллиативная химиотерапия [27].
Жалобы и данные клинико-лабораторного исследования пациентки до поступления в стационар также не свидетельствовали о развернутой картине опухолевого процесса. Вместе с тем ухудшение состояния больной с эпизодами подъема температуры, остеоартропатиями, болями различной локализации, периодическим головокружением, слабостью, неспецифическими изменениями в анализах крови, мочи и биохимических показателях, возможно, являлись проявлениями нарастающего паранеопластического синдрома.
Таким образом, холангиокарцинома, являясь злокачественной опухолью, возникающей из билиарной системы, представляет собой спорадический рак у пациентов без определенных факторов риска и чаще диагностируется на поздних стадиях с последующим плохим прогнозом.
ВПХ является молекулярно неоднородной патологией и демонстрирует широкий спектр клинически и гистопатологически гетерогенных опухолей с растущей заболеваемостью во всем мире. Поэтому диагноз ВПХ представляет собой серьезную проблему для патологоанатомов [1]. Классификация предусматривает наличие двух типов ВПХ: с поражением мелких и крупных желчных протоков. Разделение типов ВПХ основано на морфологических особенностях, а среди многих иммуногистохимических маркеров специфичными для обоих типов ВПХ являются цитокератин (CK-7, CK-19) и MUC1 [1]. Помимо гистохимических признаков для ВПХ характерны многочисленные молекулярные изменения [1]. Большое значение имеет оценка экспрессии анти-Hep Par 1 (моноклональное антитело к гепатоцитарному парафину 1) [34]. Несмотря на то что anti-Hep Par 1 в качестве чувствительного маркера для ВПХ не является полностью специфическим [35], его включение в панель методов обследования вместе с CK-19 максимально увеличивает точность диагностики [36].
Именно этот набор проведенных исследований с положительной экспрессией CK-19 и отсутствием реакции на гепацитарный антиген предопределил окончательный диагноз ВПХ у гр-ки А.
Последние исследования подтипов ВПХ предлагают широкий спектр биомаркеров на тканевых и молекулярных уровнях с учетом их потенциальной диагностической, прогностической и терапевтической эффективности. Определены ограничения в применении существующих биомаркеров, а также конкретные перспективы приоритетных исследований по разработке новых, включая использование искусственного интеллекта и органоидов, полученных от пациентов [33].
В последнее время уделяется внимание фактору молекулярно-генетических мутаций различных генов [37]. За последние несколько лет был изучен геномный ландшафт рака желчных путей и разработано несколько целевых методов лечения [33].
Точный диагноз ВПХ является мультидисциплинарной проблемой с многопрофильным подходом [7] и требует комбинации клинических, радиологических, гистологических результатов, а также иммуногистохимического и молекулярного анализа. ВПХ остается заболеванием с высоким риском смертности [1]. Диагностика ВПХ у коморбидных пациентов является еще более сложной, так как зачастую клиническая картина ВПХ возникает на поздних этапах развития опухоли (4-я клиническая стадия), а сопутствующая патология, в том числе и COVID-19, нередко опережает и маскирует основное заболевание [14, 31].
Экспертная комиссия не установила дефектов медицинской помощи на этапе оказания ПМСП в условиях кратковременного наблюдения гр-ки А. и не усмотрела каких-либо причинных связей между проводимым амбулаторным наблюдением, лечением и смертью гр-ки А. от прогрессирующего злокачественного онкологического заболевания печени, установленного по объективным причинам на последнем этапе диагностического процесса.
Заключение
Внутрипеченочная локализация холангиокарциномы в связи с местным распространением и наличием отдаленных метастазов, в отличие от других ее форм, ввиду бессимптомного течения, низкой специфичности большинства диагностических методов и дефицита абсолютных диагностических критериев, ограничения терапевтических подходов и позднего ее выявления относится к опухолям с непредотвратимым летальным исходом. Сказанное определяет необходимость совершенствования диагностических подходов на ранних этапах ее возникновения и повышенной онкологической настороженности врачей первичного звена здравоохранения, особенно при наличии у пациентов коморбидной патологии. Выводы из сравнения текущих рекомендаций и клинического разбора могут нацелить и сконцентрировать усилия врачей на уточнение клинических рекомендаций и на дальнейшие исследования для улучшения диагностики ВПХ.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. В.В. Горбань – обзор литературных данных, касающихся диагностики и ведения больных с онкологическими заболеваниями гепатобилиарной системы, редактирование дизайна и текста статьи. Е.Н. Травенко – концепция статьи, сбор, анализ и интерпретация данных. В.А. Породенко – редактирование черновика рукописи с внесением ценного замечания интеллектуального содержания. Все авторы дали окончательное согласие на подачу рукописи и согласились нести ответственность за все аспекты работы, ручаясь за их точность и безупречность.
Contribution of authors. Gorban V.V. reviewed literary data regarding the diagnosis and conduct of patients with oncological diseases of the hepatobiliary system, edited the design and text of the article. Travenko E.N. proposed and developed the concept of an article, provided patients who formed the basis of a clinical case. Porodenko V.A. – editing draft of the manuscript with the introduction of a valuable remark of intellectual content. All authors gave the final consent to the manuscript and agreed to bear responsibility for all aspects of the work, vouching for their accuracy and impeccability.
Информация об авторах
Information about the authors
Горбань Виталий Васильевич – д-р мед. наук, зав. каф. поликлинической терапии с курсом общей врачебной практики (семейной медицины), ФГБОУ ВО КубГМУ. E-mail: gorbanvv@mail.ru;
ORCID: 0000-0001-8665-6796; eLibrary SPIN: 6305-6187
Vitaly V. Gorban – Dr. Sci. (Med.), Kuban State Medical University. E-mail: gorbanvv@mail.ru; ORCID: 0000-0001-8665-6796; eLibrary SPIN: 6305–6187
Травенко Елена Николаевна – д-р мед. наук, доцент, проф. каф. судебной медицины, ФГБОУ ВО КубГМУ. E-mail:
elenaschon@yandex.ru; ORCID: 0000-0001-7403-2521; eLibrary SPIN: 8748-3506
Elena N. Travenko – Dr. Sci. (Med.), Assoc. Prof., Kuban State Medical University. E-mail: elenaschon@yandex.ru; ORCID: 0000-0001-7403-2521; eLibrary SPIN: 8748-3506
Породенко Валерий Анатольевич – д-р мед. наук, проф., зав. каф. судебной медицины, ФГБОУ ВО КубГМУ. E-mail:
porodenko52@mail.ru; ORCID: 0000-0001-6353-7380; eLibrary SPIN: 6685-8824
Valery A. Porodenko – Dr. Sci. (Med.), Full Prof., Kuban State Medical University. E-mail: porodenko52@mail.ru; ORCID: 0000-0001-6353-7380; eLibrary SPIN: 6685-8824
Поступила в редакцию: 13.03.2025
Поступила после рецензирования: 18.03.2025
Принята к публикации: 29.03.2025
Received: 13.03.2025
Revised: 18.03.2025
Accepted: 29.03.2025
Список исп. литературыСкрыть списокСписок литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/