Клинический разбор в общей медицине №6 2025
Клинический разбор в общей медицине №6 2025
Буллезная эмфизема: причины, диагностика, осложнения. Клинико-патологоанатомический разбор пациента с буллезной эмфиземой и фатальным спонтанным пневмотораксом
Номера страниц в выпуске:67-74
Аннотация
Представлен клинико-патологоанатомический разбор пациента с буллезной эмфиземой легких, осложненной спонтанным пневмотораксом, причины которых не были диагностированы прижизненно. Фенотипические признаки дисплазии соединительной ткани, синдром Вильямса–Кэмпбелла и микотическая гранулема легкого диагностированы посмертно. Анализ литературных источников в аспекте данных клинического наблюдения подчеркивает необходимость выявления фенотипических и клинических признаков дисплазии соединительной ткани у пациентов с буллезной эмфиземой, прижизненной верификации наследственных нарушений соединительной ткани при своевременном направлении пациентов на генетическое исследование, разработке индивидуальной программы реабилитации и лечения, что позволит профилактировать преждевременную гибель данной категории больных.
Ключевые слова: буллезная эмфизема, спонтанный пневмоторакс, дисплазия соединительной ткани, синдром Вильямса–Кемпбелла.
Для цитирования: Викторов С.И., Иванова Д.С., Уралбаева Д.Б., Викторова И.А. Буллезная эмфизема: причины, диагностика, осложнения. Клинико-патологоанатомический разбор пациента с буллезной эмфиземой и фатальным спонтанным пневмотораксом. Клинический разбор в общей медицине. 2025; 6 (6): 67–74. DOI: 10.47407/kr2025.6.6.00632
Представлен клинико-патологоанатомический разбор пациента с буллезной эмфиземой легких, осложненной спонтанным пневмотораксом, причины которых не были диагностированы прижизненно. Фенотипические признаки дисплазии соединительной ткани, синдром Вильямса–Кэмпбелла и микотическая гранулема легкого диагностированы посмертно. Анализ литературных источников в аспекте данных клинического наблюдения подчеркивает необходимость выявления фенотипических и клинических признаков дисплазии соединительной ткани у пациентов с буллезной эмфиземой, прижизненной верификации наследственных нарушений соединительной ткани при своевременном направлении пациентов на генетическое исследование, разработке индивидуальной программы реабилитации и лечения, что позволит профилактировать преждевременную гибель данной категории больных.
Ключевые слова: буллезная эмфизема, спонтанный пневмоторакс, дисплазия соединительной ткани, синдром Вильямса–Кемпбелла.
Для цитирования: Викторов С.И., Иванова Д.С., Уралбаева Д.Б., Викторова И.А. Буллезная эмфизема: причины, диагностика, осложнения. Клинико-патологоанатомический разбор пациента с буллезной эмфиземой и фатальным спонтанным пневмотораксом. Клинический разбор в общей медицине. 2025; 6 (6): 67–74. DOI: 10.47407/kr2025.6.6.00632
Review and Clinical Case
1 City Hospital No 3, Omsk, Russia;
2 Omsk State Medical University, Omsk, Russia;
3 City Polyclinic No 12, Omsk, Russia
darja.ordinator@mail.ru
Abstract
The clinical and pathological study of the patient having bullous emphysema complicated with spontaneous pneumothorax, the causes of which were not diagnosed antemortem, is reported. Phenotypic signs of connective tissue dysplasia, Williams–Campbell syndrome, and granuloma of the lung caused by fungal infection were diagnosed postmortem. The analysis of literature in terms of this clinical case emphasizes the need for detection of phenotypic and clinical signs of connective tissue dysplasia in patients with bullous emphysema, antemortem verification of hereditary connective tissue disorders with the timely referral of patients to genetic testing, development of individual rehabilitation and treatment program, which will make it possible to prevent premature deaths among this category of patients.
Keywords: bullous emphysema, spontaneous pneumothorax, connective tissue dysplasia, Williams–Campbell syndrome.
For citation: Viktorov S.I., Ivanova D.S., Uralbaeva D.B., Viktorova I.A. Bullous emphysema: causes, diagnosis, complications. Clinical and pathological study of the patient with bullous emphysema and fatal spontaneous pneumothorax. Clinical review for general practice. 2025; 6 (6): 67–74 (In Russ.). DOI: 10.47407/kr2025.6.6.00632
Буллезная эмфизема – состояние, при котором образуются субплевральные воздушные полости (буллы и/или блебы), обычно расположенные в области верхушек легких. Эмфизему легких с множеством крупных булл также называют «буллезная болезнь легких», подчеркивая, что такая эмфизема считается «хирургическим» заболеванием, лечение которого, как и его осложнений (напряженная гигантская булла, пневмоторакс, гемопневмоторакс), нуждающихся в неотложной хирургической помощи, относится в основном к компетенции хирургов. Буллезная эмфизема является наиболее частой причиной спонтанного пневмоторакса [1].
Спонтанный пневмоторакс (СП) – состояние, которое характеризуется скоплением воздуха в плевральной полости при возникновении ее патологического сообщения с воздухоносными путями и не связано с травмой или лечебным воздействием [1].
Первичный СП возникает преимущественно у пациентов молодого возраста (до 30 лет), у мужчин – в 8–10 раз чаще, чем у женщин. Факторами риска являются также семейный анамнез первичного СП, курение табака и астенический тип конституции [1].
Причиной буллезной эмфиземы легких в первую очередь является дефицит фермента α1-антитрипсина, который может быть первичным (генетическим, имеющим аутосомно-рецессивный характер наследования) или вторичным – при выраженном воспалительном процессе. При недостатке α1-антитрипсина продолжительность воздействия «избыточных» агрессивных ферментов на легочную ткань увеличивается с 20 до
80 мс, что приводит к неизбежной деструкции эластических волокон легочной стромы и бронхиальной стенки, протеолитическому разрушению эластических волокон, истончению и разрыву альвеолярных перегородок с формированием эмфиземы [2].
Изучение генетических маркеров и признаков наследственных нарушений соединительной ткани при буллезной эмфиземе показывает ее тесное родство с наследственно детерминированными системными заболеваниями соединительной ткани, такими как синдром Элерса–Данло, синдром Марфана, синдром Берта–Хогга–Дюбе, синдром Вильямса–Кэмпбелла, гистиоцитоз Х, имеющими различную этиологию, но сходные патогенетические факторы, которые приводят к деградации эластических структур соединительной ткани, в том числе и в органах дыхания [3].
Судить о наличии генетически детерминированной патологии соединительной ткани у пациентов с первичным СП также позволяют их фенотипические особенности. Данные пациенты отличаются не только высоким ростом и худощавостью (признаки марфаноидности) – у большинства из них имеются различные виды деформации грудной клетки и позвоночника, плоскостопие, варикозное расширение вен, миопия, гипермобильность суставов, пролапс митрального клапана сердца [4].
При синдроме Элерса–Данло СП описан при двух типах: сосудистом и мышечно-контрактурном.
Диагноз «синдром Элерса–Данло, сосудистый тип» ставится на основании клинических признаков, неинвазивной визуализации и выявления мутации в гене COL3A1, коллаген III типа, α1 – цепь; реже COL1A1, коллаген I типа, α1 – цепь [5].
Большие критерии:
1. Наследственный анамнез, отягощенный по сосудистому типу с зарегистрированными изменениями гена COL3A1.
2. Разрыв аорты в молодом возрасте.
3. Спонтанная перфорация сигмовидной кишки в отсутствие дивертикулов или другой патологии.
4. Спонтанный разрыв матки/промежности.
5. Формирование каротидно-кавернозного соустья в отсутствие травмы.
Малые критерии:
1. Синяки, не связанные с травмой и/или в необычных местах, таких как щеки и спина.
2. Тонкая, полупрозрачная кожа с видимым венозным рисунком.
3. Характерный внешний вид лица – изменение размеров и формы лица (дисморфия). Лицо из-за недостатка подкожно-жирового слоя выглядит истощенным с выступающими скулами и впалыми щеками, глаза – запавшими или выпуклыми, часто с темной пигментацией и тонкими телеангиэктазиями на веках. Нос тонкий, как и губы, особенно верхняя, края которой часто не определяются. Могут быть слегка оттопыренные уши. На коже лица и рук отмечаются признаки раннего старения, что позволило при описании использовать термин «акрогерия». Синдром может также проявляться без характерных черт акрогерии, что, по мнению ряда исследователей, затрудняет клиническую диагностику [5].
4. СП.
5. Акрогерия (атрофия кожи на пальцах стоп и кистей).
6. Эквиноварусная деформация стоп.
7. Врожденный вывих бедра.
8. Гипермобильность мелких суставов.
9. Разрыв сухожилий и мышц.
10. Кератоконус.
11. Рецессия, хрупкость десен.
12. Раннее возникновение варикозной болезни.
Наличие семейной истории заболевания, разрывов или расслоений артерий, спонтанной перфорации сигмовидной кишки или СП в присутствии других малых признаков должны стать поводом для молекулярно-генетического исследования [5].
Диагноз «синдром Элерса–Данло» сосудистого типа основывается на типичных клинических проявлениях, развитии характерных тяжелых осложнений и наследственной отягощенности. Заболевание может быть заподозрено при наличии тонкой ранимой кожи, гипермобильности суставов в сочетании с продольным плоскостопием. Обнаружение мутации в гене COL3A1 обеспечивает точность диагностики синдрома Элерса–Данло [6].
С 1997 г. диагностика синдрома Элерса–Данло велась по большим и малым Вильфраншским диагностическим критериям [7]. В настоящее время для постановки диагноза пользуются Международным консорциумом 2017 г., где критерии диагностики синдрома Элерса–Данло ревизированы и обновлены [5].
Мышечно-контрактурный тип синдрома Элерса–Данло включает пневмоторакс как малый диагностический критерий. Заболевание имеет аутосомно-рецессивное наследование, OMIM 615539. Для диагностики используют совокупность больших и малых критериев [5].
Большие критерии:
1. Врожденные множественные контрактуры, приводяще-сгибательная и/или эквиноварусная деформация стоп.
2. Характерные черепно-лицевые особенности, проявляющиеся при рождении или в раннем возрасте (большой родничок, гипертелоризм, короткие и косые морщины век, голубые склеры, короткий нос с гипоплазией столбика, низко расположенные и перекрученные уши, высокое небо, удлиненный фильтр носа, тонкая верхняя губа, маленький рот, незначительный сдвиг верхней челюсти кзади (микроретрогнатия).
3. Характерные кожные изменения: гиперэластичность кожи, легкая травмируемость, хрупкость, атрофические рубцы, морщинистые ладони.
Малые критерии:
1. Периодические/хронические вывихи.
2. Деформации грудной клетки (плоская, воронкообразная).
3. Деформации позвоночника (сколиоз, кифосколиоз).
4. Характерные пальцы (конусовидные, тонкие, цилиндрические).
5. Прогрессирующие деформации стоп (плоские, вальгусные, полые).
6. Большие подкожные гематомы.
7. Хронический запор.
8. Дивертикулы толстой кишки.
9. Пневмоторакс/гемопневмоторакс.
10. Нефролитиаз/цистолитиаз.
11. Гидронефроз.
12. Крипторхизм.
13. Косоглазие.
14. Нарушения рефракции (близорукость, астигматизм).
15. Глаукома/повышенное внутриглазное давление.
Для постановки диагноза необходимо: при рождении и в периоде раннего детства – сочетание первого и второго больших критериев; в подростковом периоде – сочетание первого и третьего больших критериев [5].
Синдром Марфана – аутосомно-доминантное наследственное нарушение соединительной ткани (мутация гена фибриллина-1 – FBN1). Пересмотренные в 2010 г. Гентские критерии характеризуются клинической ориентированностью. Вместо множества признаков, встречающихся при синдроме Марфана, выделена триада симптомов, обладающая наибольшей специфичностью: 1) дилатация/расслоение аорты, 2) эктопия (подвывих) хрусталика, 3) скелетные аномалии. Наиболее значимые скелетные и клинические признаки оценены в баллах, подсчет которых позволяет оценить наличие системного вовлечения соединительной ткани [8].
Балльная оценка системного вовлечения соединительной ткани при синдроме Марфана [8]:
1. Признак запястья и большого пальца (3 балла).
2. Признак запястья или большого пальца (1 балл).
3. Воронкообразная или асимметричная деформация грудной клетки (1 балл).
4. Килевидная деформация грудной клетки (2 балла).
5. Вальгусная деформация стопы (2 балла).
6. Плоскостопие (1 балл).
7. СП (2 балла).
8. Эктазия твердой мозговой оболочки (2 балла).
9. Протрузия тазобедренного сустава (2 балла).
10. Отношение верх/низ ≤0,86 и размах рук/рост ≥1,05 без выраженного сколиоза (1 балл).
11. Сколиоз или кифоз (1 балл).
12. Неполное (170°) разгибание локтя (1 балл).
13. Три из пяти лицевых признаков: долихоцефалия, энофтальм, скошенные вниз глазные щели, гипоплазия скуловых костей, ретрогнатия (1 балл).
14. Миопия (1 балл).
15. Стрии (1 балл).
16. Пролапс митрального клапана (1 балл).
Синдром Берта–Хогга–Дюбе также известный как синдром Хорнштейна–Кникенберга, вызывается гетерозиготной мутацией в гене FLCN (607273) на хромосоме 17p11. Также известна нозологическая форма под названием первичный СП 173600 – это аллельное заболевание, которое может представлять собой более легкую форму синдрома Берта–Хогга–Дюбе [9].
Синдром Берта–Хогга–Дюбе – это редкий аутосомно-доминантный наследственный генодерматоз, характеризующийся множественными бессимптомными куполообразными папулами на коже головы, шеи, груди, спины и рук. Эти кожные проявления патологически характеризуются как фиброфолликуломы или гамартомы волосяных фолликулов. Синдром Берта–Хогга–Дюбе ассоциируется с наследственными опухолями почек, особенно гибридными онкоцитарными опухолями почек и хромофобной почечно-клеточной карциномой, а также с пневмотораксом и/или множественными кистами легких [10].
Синдром Вильямса–Кэмпбелла характеризуется генерализованным дефектом бронхиальных хрящей. Этот порок впервые был описан H. Williams и P. Campbell в 1960 г. у 5 пациентов с необычными генерализованными бронхоэктазами, которые расширялись на вдохе и спадались на выдохе. Предполагается аутосомно-рецессивное наследование порока, однако патологический ген не выявлен. При синдроме Вильямса–Кэмпбелла имеет место отсутствие или недоразвитие хрящевых колец бронхов на уровне от 2-й до 6–8-й генераций. В большинстве случаев дефект имеет распространенный двусторонний характер, хотя описаны и односторонние поражения. Доказательством врожденного происхождения синдрома считают наличие однотипного хрящевого дефекта проксимальных бронхов, отсутствие повреждений других элементов бронхиальной стенки, что наблюдается при обычном воспалительном процессе, несоответствие больших анатомических изменений, выявляемых при бронхографии, степени бронхопульмональной инфекции. В зонах дефектов бронхиальные стенки лишены хрящевой опоры, поэтому легко расширяются на вдохе и коллабируют на выдохе, вследствие чего формируются характерные «баллонирующие» бронхоэктазы. При этом поражаются преимущественно нижние доли легких [11].
Легочный гистиоцитоз X — системное заболевание, характеризующееся образованием в тканях гранулем из клеток Лангерганса (дендритные клетки — один из вариантов клеток мононуклеарного ряда) [12]. Распространенность гистиоцитоза Х у мужчин – 0,27 на 100 тыс. населения, у женщин заболевание встречается в 2–4 раза реже. Гистиоцитоз Х – заболевание преимущественно пациентов молодого возраста, пик заболеваемости приходится на возраст 20–40 лет [13].
Основные патогенетические звенья включают накопление клеток Лангерганса с перестройкой бронхиального дерева и нарушением газообмена. Вначале при рентгенографии легких выявляются мелкие и средние очаги, тонкостенные единичные кисты, расположенные в верхних и средних отделах, а базальные отделы легких интактны. По мере прогрессирования нарастают пневмофиброз, кистозная перестройка с распространением на все сегменты легких. При прорыве крупных булл возникает СП, который может стать причиной летального исхода. Табачный дым относится к главным провоцирующим факторам развития легочного гистиоцитоза, что было продемонстрировано во многих работах [14].
В литературе описаны разные варианты течения данной патологии. Представлены примеры, характеризующееся медленным развитием легочных симптомов (заболевание выявлено при проведении плановой флюорографии), у молодой женщины – курильщицы в анамнезе, с невысокой степенью активности заболевания в дебюте, хорошим ответом на проводимую терапию преднизолоном и относительно благоприятным жизненным прогнозом. В другом примере продемонстрировано течение заболевания с летальным исходом у молодого человека, которое неуклонно прогрессировало вопреки проводимой базисной терапии преднизолоном (в течение 3 лет в дозе 15 мг/сут) и сопровождалось эпизодами СП, последний из которых стал причиной смерти пациента [15].
Представляем клиническое наблюдение пациента с буллезной эмфиземой, осложненной СП и смертью пациента. При патоморфологическом исследовании в качестве основного заболевания был установлен синдром Вильямса–Кэмпбелла, а также множественные внешние и клинические признаки, указывающие на наследственную патологию соединительной ткани (дисплазию соединительной ткани), которые не были описаны и диагностированы при жизни пациента.
Из анамнеза больного, 1955 г. р., известно, что в течение длительного времени его беспокоила одышка, связанная с физической нагрузкой, по поводу которой пациент не обращался к врачам. В июне 2024 г. в возрасте 69 лет на фоне усиления одышки, уменьшения толерантности к физической нагрузке больной обратился к участковому терапевту. Выполнены общеклинические исследования. При флюорографии выявлено очаговое образование верхней доли правого легкого, по поводу которого пациент направлен к онкологу с диагнозом «Образование верхней доли правого легкого». При обследовании в июле 2024 г. проведены ультразвуковые исследования (УЗИ). Абдоминальное УЗИ выявило признаки диффузных изменений в поджелудочной железе. При УЗИ лимфоузлов: подчелюстные и шейные лимфоузлы с небольшим утолщением коркового слоя, не увеличены, что соответствует реактивным изменениям в подчелюстных и шейных лимфоузлах. При УЗИ над- и подключичных лимфоузлов изменений не выявлено. Дуплексное сканирование вен нижних конечностей: признаки клапанной венозной недостаточности в притоках большой подкожной вены правой голени. Фиброгастродуоденоскопия (ФГДС): атрофический гастрит, отсутствие перистальтики, застойное содержимое. Повторное ФГДС через 1,5 мес: атрофический гастрит. Фибробронхоскопия: атрофический эндобронхит. Функция внешнего дыхания: генерализованная обструкция дыхательных путей тяжелой степени на фоне выраженного снижения жизненной емкости легких. Мультиспиральная компьютерная томография головного мозга с внутривенным контрастированием: структурных изменений головного мозга, костей лицевого скелета и костей свода черепа не выявлено. Эхокардиография (ЭхоКГ): диффузные склерогенные изменения сердца, нерезко выраженная недостаточность митрального клапана, недостаточность трикуспидального клапана. Признаки легочной гипертензии. Нарушение ритма. Электрокардиография: ритм синусовый с частотой сердечных сокращений 75–93 в мин. Вертикальное положение электрической оси сердца. Увеличение правого желудочка. Выраженные изменения в миокарде. Рентгенография органов грудной клетки: легкое расправлено, свободные газ и жидкость в плевральной полости не определяются. Над диафрагмой паракардиально воздушная полость 45×47 мм с тонкими стенками. Выраженные адгезивные изменения в плевральных синусах. Средостение не смещено.
На основании проведенных исследований было решено провести диагностическую торакоскопию справа с атипической резекцией верхней доли легкого справа.
 В прижизненном патолого-анатомическом исследовании образца легочной ткани, взятой при операции, описана морфологическая картина, наиболее характерная для организующейся неспецифической пневмонии с исходом в интерстициальный фиброз. Достоверных признаков опухолевого роста в объеме исследуемого материала не выявлено.
В прижизненном патолого-анатомическом исследовании образца легочной ткани, взятой при операции, описана морфологическая картина, наиболее характерная для организующейся неспецифической пневмонии с исходом в интерстициальный фиброз. Достоверных признаков опухолевого роста в объеме исследуемого материала не выявлено.
По результатам госпитализации выставлен клинический диагноз. Основное заболевание: D14.3 Образование верхней доли правого легкого. Состояние после оперативного лечения (резекция участка на верхней доле правого легкого от 13.08.2024). Сопутствующие заболевания: артериальная гипертензия II ст. риск 4; пароксизмальная форма фибрилляции предсердий; хроническая сердечная недостаточность IIА; хронический бронхит, ДН I.
Пациент выписан с улучшением под наблюдение терапевта по месту жительства.
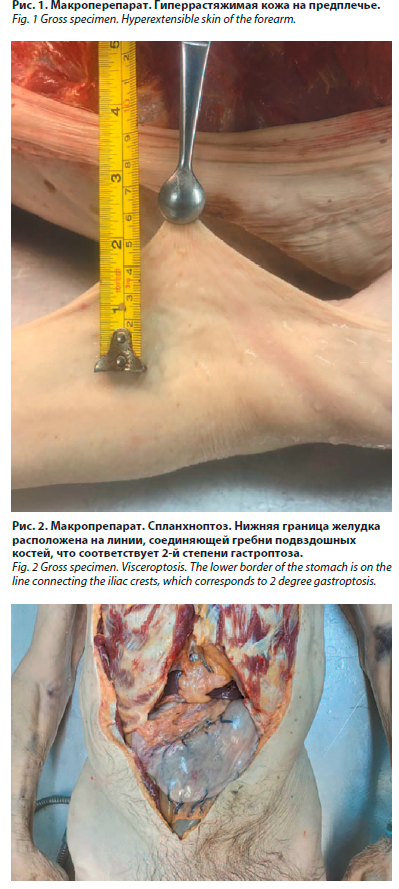
Через 5 дней после выписки пациент скончался на дому. Проведено патолого-анатомическое вскрытие. При наружном осмотре трупа отмечены признаки астенической конституции и долихостеномелии при длине тела в 192 см. Обращало внимание пониженное питание и плохо развитые атрофичные мышцы различных групп, узкая, вытянутой формы килевидная грудная клетка, с острым реберным углом и запавшими надключичными ямками, кожа на всех участках тонкая, бледная, с пониженным тургором и повышенной растяжимостью: кожная складка на предплечье при оттягивании достигала 7 см (рис. 1). На коже грудной клетки справа в V межреберье имелся свежий послеоперационный рубец длиной 20 см, заживший первичным натяжением. При осмотре ног выделялась извитая расширенная венозная сеть на стопах и голенях.
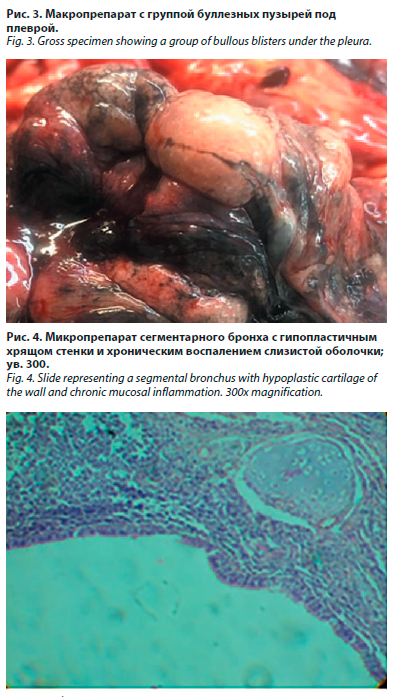
При внутреннем исследовании тела обращало внимание пониженное количество подкожно-жировой клетчатки и жира в депо. В брюшной полости наблюдалось смещение вниз (опущение) внутренних органов (спланхноптоз) (рис. 2). Почки были расположены ниже подреберий, в малом тазу. Желудок пуст, растянут, смещен вниз, нижняя граница его расположена ниже гребешковой линии, что соответствовало 2-й степени гастроптоза. Сигмовидная кишка была заметно увеличена по длине, стенка растянута, просвет переполнен содержимым. При вскрытии левой грудной полости из нее под давлением выделился воздух (водная проба на пневмоторакс положительная).
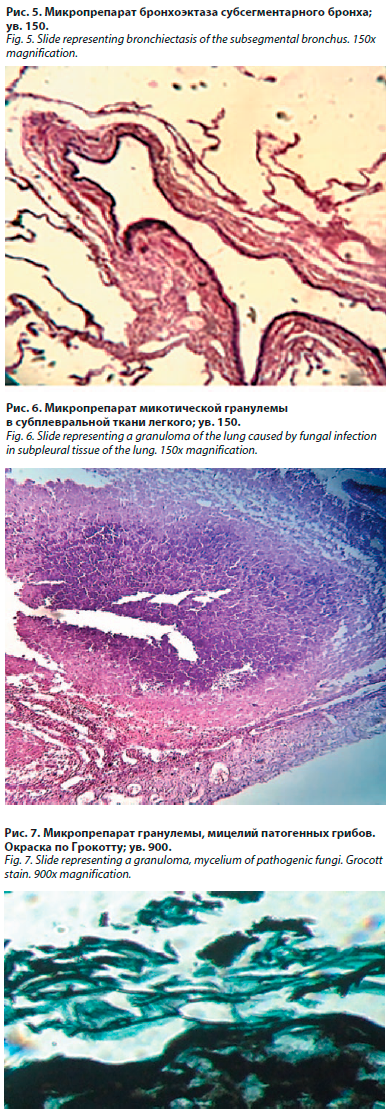
 Левое легкое находилось в спавшемся состоянии, поджато к корню, органы средостения немного смещены влево. Листки плевры и перикарда однородные, тонкие, серого цвета. Справа, в зоне бывшей операции, по ходу послеоперационного рубца висцеральный и париетальный плевральные листки были спаяны между собою рыхлыми спайками. Слизистые оболочки верхних дыхательных путей, главных и долевых бронхов тускловатые, бледно-серые. На поверхности верхних долей обоих легких расположены множественные тонкостенные буллы размерами от 0,5 до 3 см (рис. 3). Ткань правого легкого повышенной воздушности преимущественно в субплевральных отделах, она крепитирует при рассечении. Верхняя доля его частично резецирована, в оставшейся ткани, в субплевральных отделах 3-го сегмента расположен очаг размерами 2,5×2,5 см белесоватого цвета, с нечеткими границами, плотной консистенции, ткань которого на разрезе в центральной части имеет участок распада диаметром до 1,5 см, напоминающий казеозные массы. Левое легкое частично спавшееся, ткань нижней доли плотная, темно-красного цвета, кусочки ткани легкого тонут в водном растворе формалина, верхняя доля слабо воздушна. Над поверхностью среза в обоих легких выступают бронхи, с эктазированными просветами неправильной формы, заполненные сероватой мокротой, легочные сосуды торчат над поверхностью среза в виде перьев, с поверхности среза стекает темная жидкая кровь и мутная жидкость. Бифуркационные лимфатические узлы размерами по 1,5 см, однородные, темно-серого цвета. Сердце имело вытянутую форму, размер 12–10–8 см и массу 450 г. Полости сердца, особенно правого предсердия и желудочка расширены, заполнены жидкой кровью, толщина стенки правого желудочка составила 0,6 см, его стенка имела многочисленные ветвистые трабекулы, идущие в разных направлениях, с глубокими межтрабекулярными пространствами (гипертрабекулярность). Миокард на разрезе выглядел дряблым, светло-коричневым. Фиброзное кольцо трикуспидального клапана было немного расширено, а клапанный эндокард выглядел отечным. Интима аорты имела немногочисленные атероматозные бляшки, участки изъязвления и кальциноза стенки в брюшном отделе. При макроскопическом исследовании в мозговом веществе обоих почек были видны мелкие кистозные полости до 0,5 см.
Левое легкое находилось в спавшемся состоянии, поджато к корню, органы средостения немного смещены влево. Листки плевры и перикарда однородные, тонкие, серого цвета. Справа, в зоне бывшей операции, по ходу послеоперационного рубца висцеральный и париетальный плевральные листки были спаяны между собою рыхлыми спайками. Слизистые оболочки верхних дыхательных путей, главных и долевых бронхов тускловатые, бледно-серые. На поверхности верхних долей обоих легких расположены множественные тонкостенные буллы размерами от 0,5 до 3 см (рис. 3). Ткань правого легкого повышенной воздушности преимущественно в субплевральных отделах, она крепитирует при рассечении. Верхняя доля его частично резецирована, в оставшейся ткани, в субплевральных отделах 3-го сегмента расположен очаг размерами 2,5×2,5 см белесоватого цвета, с нечеткими границами, плотной консистенции, ткань которого на разрезе в центральной части имеет участок распада диаметром до 1,5 см, напоминающий казеозные массы. Левое легкое частично спавшееся, ткань нижней доли плотная, темно-красного цвета, кусочки ткани легкого тонут в водном растворе формалина, верхняя доля слабо воздушна. Над поверхностью среза в обоих легких выступают бронхи, с эктазированными просветами неправильной формы, заполненные сероватой мокротой, легочные сосуды торчат над поверхностью среза в виде перьев, с поверхности среза стекает темная жидкая кровь и мутная жидкость. Бифуркационные лимфатические узлы размерами по 1,5 см, однородные, темно-серого цвета. Сердце имело вытянутую форму, размер 12–10–8 см и массу 450 г. Полости сердца, особенно правого предсердия и желудочка расширены, заполнены жидкой кровью, толщина стенки правого желудочка составила 0,6 см, его стенка имела многочисленные ветвистые трабекулы, идущие в разных направлениях, с глубокими межтрабекулярными пространствами (гипертрабекулярность). Миокард на разрезе выглядел дряблым, светло-коричневым. Фиброзное кольцо трикуспидального клапана было немного расширено, а клапанный эндокард выглядел отечным. Интима аорты имела немногочисленные атероматозные бляшки, участки изъязвления и кальциноза стенки в брюшном отделе. При макроскопическом исследовании в мозговом веществе обоих почек были видны мелкие кистозные полости до 0,5 см.
 При гистологическом исследовании препаратов легочной ткани левого легкого имелись признаки ателектаза. Было установлено, что стенки сегментарных и субсегментарных бронхов обоих легких истончены, деформированы, в них наблюдается гипоплазия, либо отсутствие хрящевых элементов, фракционное расположение и уменьшение мышечных волокон, формирующиеся бронхоэктазы (рис. 4).
При гистологическом исследовании препаратов легочной ткани левого легкого имелись признаки ателектаза. Было установлено, что стенки сегментарных и субсегментарных бронхов обоих легких истончены, деформированы, в них наблюдается гипоплазия, либо отсутствие хрящевых элементов, фракционное расположение и уменьшение мышечных волокон, формирующиеся бронхоэктазы (рис. 4).
Легочная ткань субплевральных отделов эмфизематозна, резко расширены просветы респираторных бронхиол и альвеол, были сформированы небольшие кистозные полости/буллы, выстланные кубическим, либо уплощенным эпителием, межальвеолярные перегородки истончены, местами склерозированы, по ходу перибронхиальной стромы имелось отложение частиц угольной пыли (рис. 5).
В препарате из 3-го сегмента правого легкого обнаружена структура инфекционной гранулемы (рис. 6).
В некротических массах из ее центральной части при окраске по Грокотту выявлены споры и мицелий плесневых грибов, наиболее сходных с аспергиллами. Вокруг зоны некроза располагался вал из эпителиоидных клеток, редкие многоядерные гигантские клетки и лимфоциты (при этом окраска по Циль–Нильсену не выявила кислотоустойчивой флоры), зона воспалительной грануляционной ткани формировала по периферии фиброзную капсулу (рис. 7).
При микроскопическом исследовании гистопрепаратов почек был обнаружен очаговый гломерулосклероз и структурные признаки медуллярных кист.
Основным заболеванием в патолого-анатомическом диагнозе фигурирует врожденный порок формирования легких Q33.0 в виде гипоплазии хрящей в стенках сегментарных и субсегментарных бронхов, формированием многочисленных бронхоэтазов, микрокист и субплевральных булл (синдром Вильямса–Кэмпбелла). Порок легочной ткани сочетался с хроническим катарально-склерозирующим воспалением слизистых оболочек бронхов, перибронхиальным пневмофиброзом и образованием микотической гранулемы 3-го сегмента верхней доли правого легкого. Заболевание осложнилось разрывом одной из булл левого легкого, напряженным пневмотораксом, ателектазом и коллапсом левого легкого.
В разделе сопутствующих заболеваний патологоанатомом выделены такие состояния, как «избыточная трабекулярность правого предсердия и желудочка», спланхноптоз (гастро-, нефроптоз); поликистоз пирамид почек (медуллярная губчатая почка); долихосигма; варикозное расширение вен ног.
Возникает закономерный вопрос, возможно ли было при жизни заподозрить наследственную патологию соединительной ткани, выявив и объединив типичные клинические признаки дисплазии соединительной ткани: килевидную деформацию грудной клетки, гиперэластичную кожу, буллезную эмфизему легких, СП, гастроптоз 2-й степени, нефроптоз, долихосигму, варикозное расширение вен ног при УЗИ, диспластические изменения в сердце при ЭхоКГ. Насколько вероятно избежать неправильно поставленного диагноза у данного пациента при знании и учете фенотипических и клинических диспластических проявлений – вопрос остается открытым.
Судить о наличии генетически детерминированной патологии соединительной ткани у пациентов с первичным СП позволяют их фенотипические особенности и направление пациентов на генетическое исследование. В направлении на морфологическое исследование фрагмента легочной ткани в прижизненной диагностике важным аспектом является указание на марфаноидный фенотип, которое, возможно сориентировало бы врача-патоморфолога на выявление наследственной патологии соединительной ткани еще при жизни пациента.
В данном случае дефект хрящей бронхов 5–6-го порядка (синдром Вильямса–Кемпбелла) был ассоциирован с марфаноподобным фенотипом, который, на наш взгляд, отражает общий системный процесс наследственной патологии соединительной ткани.
По литературным описаниям, пациенты с марфаноподобным фенотипом отличаются не только высоким ростом и худощавостью с долихостеномелией. У большинства из них имеются другие признаки дисплазии соединительной ткани: различные виды деформации грудной клетки и позвоночника, плоскостопие, варикозное расширение вен, миопия, гипермобильность суставов, пролапсы сердечных клапанов, повышенная растяжимость кожи, буллезная эмфизема, которые позволяют не только заподозрить наследственную патологию соединительной ткани, но и диагностировать ее, а также разработать для пациента индивидуальною программу реабилитации и лечения [16, 17].
Особенностью данного наблюдения является посмертная диагностика микотической гранулемы (воспалительная псевдоопухоль), которая клинически имитировала периферическую опухоль легкого, а по сути отражала дефект местного иммунитета у пациентов диспластического фенотипа.
Своевременная диагностика наследственно детерминированной патологии соединительной ткани позволит вовремя профилактировать осложнения и скоропостижную гибель данной группы пациентов от осложнения буллезной эмфиземы – спонтанного пневмоторакса.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сергей Иванович Викторов – врач-патологоанатом высшей категории, зав. централизованным патолого-анатомическим отделением, БУЗ Омской области «Городская больница №3».
ORCHID: 0009-0005-9767-3109
Sergey I. Viktorov – Pathologist of the highest category, Head of the centralized pathology department, City Hospital No 3. ORCHID: 0009-0005-9767-3109
Дарья Сергеевна Иванова – канд. мед. наук, доц., доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: darja.ordinator@mail.ru; ORCHID: 0000-0002-4145-7969
Daria S. Ivanova – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: darja.ordinator@mail.ru; ORCHID: 0000-0002-4145-7969
Динара Барамбаевна Уралбаева – ассистент каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ; врач-пульмонолог отд-ния аллергологии-иммунологии, БУЗ Омской области «Городская поликлиника №12». ORCHID: 0000-0002-2881-2524
Dinara B. Uralbaeva – Аssistant, Omsk State Medical University; Pulmonologist, City Polyclinic No 12. ORCHID: 0000-0002-2881-2524
Инна Анатольевна Викторова – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ, гл. внештатный специалист по терапии и общей врачебной практике (семейной медицине) Минздрава Омской области. ORCHID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. ORCHID: 0000-0001-8728-2722
Поступила в редакцию: 17.03.2025
Поступила после рецензирования: 26.03.2025
Принята к публикации: 10.04.2025
Received: 17.03.2025
Revised: 26.03.2025
Accepted: 10.04.2025
Bullous emphysema: causes, diagnosis, complications. Clinical and pathological study of the patient with bullous emphysema and fatal spontaneous pneumothorax
Sergey I. Viktorov1, Daria S. Ivanova2, Dinara B. Uralbaeva2,3, Inna A. Viktorova21 City Hospital No 3, Omsk, Russia;
2 Omsk State Medical University, Omsk, Russia;
3 City Polyclinic No 12, Omsk, Russia
darja.ordinator@mail.ru
Abstract
The clinical and pathological study of the patient having bullous emphysema complicated with spontaneous pneumothorax, the causes of which were not diagnosed antemortem, is reported. Phenotypic signs of connective tissue dysplasia, Williams–Campbell syndrome, and granuloma of the lung caused by fungal infection were diagnosed postmortem. The analysis of literature in terms of this clinical case emphasizes the need for detection of phenotypic and clinical signs of connective tissue dysplasia in patients with bullous emphysema, antemortem verification of hereditary connective tissue disorders with the timely referral of patients to genetic testing, development of individual rehabilitation and treatment program, which will make it possible to prevent premature deaths among this category of patients.
Keywords: bullous emphysema, spontaneous pneumothorax, connective tissue dysplasia, Williams–Campbell syndrome.
For citation: Viktorov S.I., Ivanova D.S., Uralbaeva D.B., Viktorova I.A. Bullous emphysema: causes, diagnosis, complications. Clinical and pathological study of the patient with bullous emphysema and fatal spontaneous pneumothorax. Clinical review for general practice. 2025; 6 (6): 67–74 (In Russ.). DOI: 10.47407/kr2025.6.6.00632
Буллезная эмфизема – состояние, при котором образуются субплевральные воздушные полости (буллы и/или блебы), обычно расположенные в области верхушек легких. Эмфизему легких с множеством крупных булл также называют «буллезная болезнь легких», подчеркивая, что такая эмфизема считается «хирургическим» заболеванием, лечение которого, как и его осложнений (напряженная гигантская булла, пневмоторакс, гемопневмоторакс), нуждающихся в неотложной хирургической помощи, относится в основном к компетенции хирургов. Буллезная эмфизема является наиболее частой причиной спонтанного пневмоторакса [1].
Спонтанный пневмоторакс (СП) – состояние, которое характеризуется скоплением воздуха в плевральной полости при возникновении ее патологического сообщения с воздухоносными путями и не связано с травмой или лечебным воздействием [1].
Первичный СП возникает преимущественно у пациентов молодого возраста (до 30 лет), у мужчин – в 8–10 раз чаще, чем у женщин. Факторами риска являются также семейный анамнез первичного СП, курение табака и астенический тип конституции [1].
Причиной буллезной эмфиземы легких в первую очередь является дефицит фермента α1-антитрипсина, который может быть первичным (генетическим, имеющим аутосомно-рецессивный характер наследования) или вторичным – при выраженном воспалительном процессе. При недостатке α1-антитрипсина продолжительность воздействия «избыточных» агрессивных ферментов на легочную ткань увеличивается с 20 до
80 мс, что приводит к неизбежной деструкции эластических волокон легочной стромы и бронхиальной стенки, протеолитическому разрушению эластических волокон, истончению и разрыву альвеолярных перегородок с формированием эмфиземы [2].
Изучение генетических маркеров и признаков наследственных нарушений соединительной ткани при буллезной эмфиземе показывает ее тесное родство с наследственно детерминированными системными заболеваниями соединительной ткани, такими как синдром Элерса–Данло, синдром Марфана, синдром Берта–Хогга–Дюбе, синдром Вильямса–Кэмпбелла, гистиоцитоз Х, имеющими различную этиологию, но сходные патогенетические факторы, которые приводят к деградации эластических структур соединительной ткани, в том числе и в органах дыхания [3].
Судить о наличии генетически детерминированной патологии соединительной ткани у пациентов с первичным СП также позволяют их фенотипические особенности. Данные пациенты отличаются не только высоким ростом и худощавостью (признаки марфаноидности) – у большинства из них имеются различные виды деформации грудной клетки и позвоночника, плоскостопие, варикозное расширение вен, миопия, гипермобильность суставов, пролапс митрального клапана сердца [4].
При синдроме Элерса–Данло СП описан при двух типах: сосудистом и мышечно-контрактурном.
Диагноз «синдром Элерса–Данло, сосудистый тип» ставится на основании клинических признаков, неинвазивной визуализации и выявления мутации в гене COL3A1, коллаген III типа, α1 – цепь; реже COL1A1, коллаген I типа, α1 – цепь [5].
Большие критерии:
1. Наследственный анамнез, отягощенный по сосудистому типу с зарегистрированными изменениями гена COL3A1.
2. Разрыв аорты в молодом возрасте.
3. Спонтанная перфорация сигмовидной кишки в отсутствие дивертикулов или другой патологии.
4. Спонтанный разрыв матки/промежности.
5. Формирование каротидно-кавернозного соустья в отсутствие травмы.
Малые критерии:
1. Синяки, не связанные с травмой и/или в необычных местах, таких как щеки и спина.
2. Тонкая, полупрозрачная кожа с видимым венозным рисунком.
3. Характерный внешний вид лица – изменение размеров и формы лица (дисморфия). Лицо из-за недостатка подкожно-жирового слоя выглядит истощенным с выступающими скулами и впалыми щеками, глаза – запавшими или выпуклыми, часто с темной пигментацией и тонкими телеангиэктазиями на веках. Нос тонкий, как и губы, особенно верхняя, края которой часто не определяются. Могут быть слегка оттопыренные уши. На коже лица и рук отмечаются признаки раннего старения, что позволило при описании использовать термин «акрогерия». Синдром может также проявляться без характерных черт акрогерии, что, по мнению ряда исследователей, затрудняет клиническую диагностику [5].
4. СП.
5. Акрогерия (атрофия кожи на пальцах стоп и кистей).
6. Эквиноварусная деформация стоп.
7. Врожденный вывих бедра.
8. Гипермобильность мелких суставов.
9. Разрыв сухожилий и мышц.
10. Кератоконус.
11. Рецессия, хрупкость десен.
12. Раннее возникновение варикозной болезни.
Наличие семейной истории заболевания, разрывов или расслоений артерий, спонтанной перфорации сигмовидной кишки или СП в присутствии других малых признаков должны стать поводом для молекулярно-генетического исследования [5].
Диагноз «синдром Элерса–Данло» сосудистого типа основывается на типичных клинических проявлениях, развитии характерных тяжелых осложнений и наследственной отягощенности. Заболевание может быть заподозрено при наличии тонкой ранимой кожи, гипермобильности суставов в сочетании с продольным плоскостопием. Обнаружение мутации в гене COL3A1 обеспечивает точность диагностики синдрома Элерса–Данло [6].
С 1997 г. диагностика синдрома Элерса–Данло велась по большим и малым Вильфраншским диагностическим критериям [7]. В настоящее время для постановки диагноза пользуются Международным консорциумом 2017 г., где критерии диагностики синдрома Элерса–Данло ревизированы и обновлены [5].
Мышечно-контрактурный тип синдрома Элерса–Данло включает пневмоторакс как малый диагностический критерий. Заболевание имеет аутосомно-рецессивное наследование, OMIM 615539. Для диагностики используют совокупность больших и малых критериев [5].
Большие критерии:
1. Врожденные множественные контрактуры, приводяще-сгибательная и/или эквиноварусная деформация стоп.
2. Характерные черепно-лицевые особенности, проявляющиеся при рождении или в раннем возрасте (большой родничок, гипертелоризм, короткие и косые морщины век, голубые склеры, короткий нос с гипоплазией столбика, низко расположенные и перекрученные уши, высокое небо, удлиненный фильтр носа, тонкая верхняя губа, маленький рот, незначительный сдвиг верхней челюсти кзади (микроретрогнатия).
3. Характерные кожные изменения: гиперэластичность кожи, легкая травмируемость, хрупкость, атрофические рубцы, морщинистые ладони.
Малые критерии:
1. Периодические/хронические вывихи.
2. Деформации грудной клетки (плоская, воронкообразная).
3. Деформации позвоночника (сколиоз, кифосколиоз).
4. Характерные пальцы (конусовидные, тонкие, цилиндрические).
5. Прогрессирующие деформации стоп (плоские, вальгусные, полые).
6. Большие подкожные гематомы.
7. Хронический запор.
8. Дивертикулы толстой кишки.
9. Пневмоторакс/гемопневмоторакс.
10. Нефролитиаз/цистолитиаз.
11. Гидронефроз.
12. Крипторхизм.
13. Косоглазие.
14. Нарушения рефракции (близорукость, астигматизм).
15. Глаукома/повышенное внутриглазное давление.
Для постановки диагноза необходимо: при рождении и в периоде раннего детства – сочетание первого и второго больших критериев; в подростковом периоде – сочетание первого и третьего больших критериев [5].
Синдром Марфана – аутосомно-доминантное наследственное нарушение соединительной ткани (мутация гена фибриллина-1 – FBN1). Пересмотренные в 2010 г. Гентские критерии характеризуются клинической ориентированностью. Вместо множества признаков, встречающихся при синдроме Марфана, выделена триада симптомов, обладающая наибольшей специфичностью: 1) дилатация/расслоение аорты, 2) эктопия (подвывих) хрусталика, 3) скелетные аномалии. Наиболее значимые скелетные и клинические признаки оценены в баллах, подсчет которых позволяет оценить наличие системного вовлечения соединительной ткани [8].
Балльная оценка системного вовлечения соединительной ткани при синдроме Марфана [8]:
1. Признак запястья и большого пальца (3 балла).
2. Признак запястья или большого пальца (1 балл).
3. Воронкообразная или асимметричная деформация грудной клетки (1 балл).
4. Килевидная деформация грудной клетки (2 балла).
5. Вальгусная деформация стопы (2 балла).
6. Плоскостопие (1 балл).
7. СП (2 балла).
8. Эктазия твердой мозговой оболочки (2 балла).
9. Протрузия тазобедренного сустава (2 балла).
10. Отношение верх/низ ≤0,86 и размах рук/рост ≥1,05 без выраженного сколиоза (1 балл).
11. Сколиоз или кифоз (1 балл).
12. Неполное (170°) разгибание локтя (1 балл).
13. Три из пяти лицевых признаков: долихоцефалия, энофтальм, скошенные вниз глазные щели, гипоплазия скуловых костей, ретрогнатия (1 балл).
14. Миопия (1 балл).
15. Стрии (1 балл).
16. Пролапс митрального клапана (1 балл).
Синдром Берта–Хогга–Дюбе также известный как синдром Хорнштейна–Кникенберга, вызывается гетерозиготной мутацией в гене FLCN (607273) на хромосоме 17p11. Также известна нозологическая форма под названием первичный СП 173600 – это аллельное заболевание, которое может представлять собой более легкую форму синдрома Берта–Хогга–Дюбе [9].
Синдром Берта–Хогга–Дюбе – это редкий аутосомно-доминантный наследственный генодерматоз, характеризующийся множественными бессимптомными куполообразными папулами на коже головы, шеи, груди, спины и рук. Эти кожные проявления патологически характеризуются как фиброфолликуломы или гамартомы волосяных фолликулов. Синдром Берта–Хогга–Дюбе ассоциируется с наследственными опухолями почек, особенно гибридными онкоцитарными опухолями почек и хромофобной почечно-клеточной карциномой, а также с пневмотораксом и/или множественными кистами легких [10].
Синдром Вильямса–Кэмпбелла характеризуется генерализованным дефектом бронхиальных хрящей. Этот порок впервые был описан H. Williams и P. Campbell в 1960 г. у 5 пациентов с необычными генерализованными бронхоэктазами, которые расширялись на вдохе и спадались на выдохе. Предполагается аутосомно-рецессивное наследование порока, однако патологический ген не выявлен. При синдроме Вильямса–Кэмпбелла имеет место отсутствие или недоразвитие хрящевых колец бронхов на уровне от 2-й до 6–8-й генераций. В большинстве случаев дефект имеет распространенный двусторонний характер, хотя описаны и односторонние поражения. Доказательством врожденного происхождения синдрома считают наличие однотипного хрящевого дефекта проксимальных бронхов, отсутствие повреждений других элементов бронхиальной стенки, что наблюдается при обычном воспалительном процессе, несоответствие больших анатомических изменений, выявляемых при бронхографии, степени бронхопульмональной инфекции. В зонах дефектов бронхиальные стенки лишены хрящевой опоры, поэтому легко расширяются на вдохе и коллабируют на выдохе, вследствие чего формируются характерные «баллонирующие» бронхоэктазы. При этом поражаются преимущественно нижние доли легких [11].
Легочный гистиоцитоз X — системное заболевание, характеризующееся образованием в тканях гранулем из клеток Лангерганса (дендритные клетки — один из вариантов клеток мононуклеарного ряда) [12]. Распространенность гистиоцитоза Х у мужчин – 0,27 на 100 тыс. населения, у женщин заболевание встречается в 2–4 раза реже. Гистиоцитоз Х – заболевание преимущественно пациентов молодого возраста, пик заболеваемости приходится на возраст 20–40 лет [13].
Основные патогенетические звенья включают накопление клеток Лангерганса с перестройкой бронхиального дерева и нарушением газообмена. Вначале при рентгенографии легких выявляются мелкие и средние очаги, тонкостенные единичные кисты, расположенные в верхних и средних отделах, а базальные отделы легких интактны. По мере прогрессирования нарастают пневмофиброз, кистозная перестройка с распространением на все сегменты легких. При прорыве крупных булл возникает СП, который может стать причиной летального исхода. Табачный дым относится к главным провоцирующим факторам развития легочного гистиоцитоза, что было продемонстрировано во многих работах [14].
В литературе описаны разные варианты течения данной патологии. Представлены примеры, характеризующееся медленным развитием легочных симптомов (заболевание выявлено при проведении плановой флюорографии), у молодой женщины – курильщицы в анамнезе, с невысокой степенью активности заболевания в дебюте, хорошим ответом на проводимую терапию преднизолоном и относительно благоприятным жизненным прогнозом. В другом примере продемонстрировано течение заболевания с летальным исходом у молодого человека, которое неуклонно прогрессировало вопреки проводимой базисной терапии преднизолоном (в течение 3 лет в дозе 15 мг/сут) и сопровождалось эпизодами СП, последний из которых стал причиной смерти пациента [15].
Представляем клиническое наблюдение пациента с буллезной эмфиземой, осложненной СП и смертью пациента. При патоморфологическом исследовании в качестве основного заболевания был установлен синдром Вильямса–Кэмпбелла, а также множественные внешние и клинические признаки, указывающие на наследственную патологию соединительной ткани (дисплазию соединительной ткани), которые не были описаны и диагностированы при жизни пациента.
Из анамнеза больного, 1955 г. р., известно, что в течение длительного времени его беспокоила одышка, связанная с физической нагрузкой, по поводу которой пациент не обращался к врачам. В июне 2024 г. в возрасте 69 лет на фоне усиления одышки, уменьшения толерантности к физической нагрузке больной обратился к участковому терапевту. Выполнены общеклинические исследования. При флюорографии выявлено очаговое образование верхней доли правого легкого, по поводу которого пациент направлен к онкологу с диагнозом «Образование верхней доли правого легкого». При обследовании в июле 2024 г. проведены ультразвуковые исследования (УЗИ). Абдоминальное УЗИ выявило признаки диффузных изменений в поджелудочной железе. При УЗИ лимфоузлов: подчелюстные и шейные лимфоузлы с небольшим утолщением коркового слоя, не увеличены, что соответствует реактивным изменениям в подчелюстных и шейных лимфоузлах. При УЗИ над- и подключичных лимфоузлов изменений не выявлено. Дуплексное сканирование вен нижних конечностей: признаки клапанной венозной недостаточности в притоках большой подкожной вены правой голени. Фиброгастродуоденоскопия (ФГДС): атрофический гастрит, отсутствие перистальтики, застойное содержимое. Повторное ФГДС через 1,5 мес: атрофический гастрит. Фибробронхоскопия: атрофический эндобронхит. Функция внешнего дыхания: генерализованная обструкция дыхательных путей тяжелой степени на фоне выраженного снижения жизненной емкости легких. Мультиспиральная компьютерная томография головного мозга с внутривенным контрастированием: структурных изменений головного мозга, костей лицевого скелета и костей свода черепа не выявлено. Эхокардиография (ЭхоКГ): диффузные склерогенные изменения сердца, нерезко выраженная недостаточность митрального клапана, недостаточность трикуспидального клапана. Признаки легочной гипертензии. Нарушение ритма. Электрокардиография: ритм синусовый с частотой сердечных сокращений 75–93 в мин. Вертикальное положение электрической оси сердца. Увеличение правого желудочка. Выраженные изменения в миокарде. Рентгенография органов грудной клетки: легкое расправлено, свободные газ и жидкость в плевральной полости не определяются. Над диафрагмой паракардиально воздушная полость 45×47 мм с тонкими стенками. Выраженные адгезивные изменения в плевральных синусах. Средостение не смещено.
На основании проведенных исследований было решено провести диагностическую торакоскопию справа с атипической резекцией верхней доли легкого справа.
 В прижизненном патолого-анатомическом исследовании образца легочной ткани, взятой при операции, описана морфологическая картина, наиболее характерная для организующейся неспецифической пневмонии с исходом в интерстициальный фиброз. Достоверных признаков опухолевого роста в объеме исследуемого материала не выявлено.
В прижизненном патолого-анатомическом исследовании образца легочной ткани, взятой при операции, описана морфологическая картина, наиболее характерная для организующейся неспецифической пневмонии с исходом в интерстициальный фиброз. Достоверных признаков опухолевого роста в объеме исследуемого материала не выявлено.По результатам госпитализации выставлен клинический диагноз. Основное заболевание: D14.3 Образование верхней доли правого легкого. Состояние после оперативного лечения (резекция участка на верхней доле правого легкого от 13.08.2024). Сопутствующие заболевания: артериальная гипертензия II ст. риск 4; пароксизмальная форма фибрилляции предсердий; хроническая сердечная недостаточность IIА; хронический бронхит, ДН I.
Пациент выписан с улучшением под наблюдение терапевта по месту жительства.
Через 5 дней после выписки пациент скончался на дому. Проведено патолого-анатомическое вскрытие. При наружном осмотре трупа отмечены признаки астенической конституции и долихостеномелии при длине тела в 192 см. Обращало внимание пониженное питание и плохо развитые атрофичные мышцы различных групп, узкая, вытянутой формы килевидная грудная клетка, с острым реберным углом и запавшими надключичными ямками, кожа на всех участках тонкая, бледная, с пониженным тургором и повышенной растяжимостью: кожная складка на предплечье при оттягивании достигала 7 см (рис. 1). На коже грудной клетки справа в V межреберье имелся свежий послеоперационный рубец длиной 20 см, заживший первичным натяжением. При осмотре ног выделялась извитая расширенная венозная сеть на стопах и голенях.
При внутреннем исследовании тела обращало внимание пониженное количество подкожно-жировой клетчатки и жира в депо. В брюшной полости наблюдалось смещение вниз (опущение) внутренних органов (спланхноптоз) (рис. 2). Почки были расположены ниже подреберий, в малом тазу. Желудок пуст, растянут, смещен вниз, нижняя граница его расположена ниже гребешковой линии, что соответствовало 2-й степени гастроптоза. Сигмовидная кишка была заметно увеличена по длине, стенка растянута, просвет переполнен содержимым. При вскрытии левой грудной полости из нее под давлением выделился воздух (водная проба на пневмоторакс положительная).
 Левое легкое находилось в спавшемся состоянии, поджато к корню, органы средостения немного смещены влево. Листки плевры и перикарда однородные, тонкие, серого цвета. Справа, в зоне бывшей операции, по ходу послеоперационного рубца висцеральный и париетальный плевральные листки были спаяны между собою рыхлыми спайками. Слизистые оболочки верхних дыхательных путей, главных и долевых бронхов тускловатые, бледно-серые. На поверхности верхних долей обоих легких расположены множественные тонкостенные буллы размерами от 0,5 до 3 см (рис. 3). Ткань правого легкого повышенной воздушности преимущественно в субплевральных отделах, она крепитирует при рассечении. Верхняя доля его частично резецирована, в оставшейся ткани, в субплевральных отделах 3-го сегмента расположен очаг размерами 2,5×2,5 см белесоватого цвета, с нечеткими границами, плотной консистенции, ткань которого на разрезе в центральной части имеет участок распада диаметром до 1,5 см, напоминающий казеозные массы. Левое легкое частично спавшееся, ткань нижней доли плотная, темно-красного цвета, кусочки ткани легкого тонут в водном растворе формалина, верхняя доля слабо воздушна. Над поверхностью среза в обоих легких выступают бронхи, с эктазированными просветами неправильной формы, заполненные сероватой мокротой, легочные сосуды торчат над поверхностью среза в виде перьев, с поверхности среза стекает темная жидкая кровь и мутная жидкость. Бифуркационные лимфатические узлы размерами по 1,5 см, однородные, темно-серого цвета. Сердце имело вытянутую форму, размер 12–10–8 см и массу 450 г. Полости сердца, особенно правого предсердия и желудочка расширены, заполнены жидкой кровью, толщина стенки правого желудочка составила 0,6 см, его стенка имела многочисленные ветвистые трабекулы, идущие в разных направлениях, с глубокими межтрабекулярными пространствами (гипертрабекулярность). Миокард на разрезе выглядел дряблым, светло-коричневым. Фиброзное кольцо трикуспидального клапана было немного расширено, а клапанный эндокард выглядел отечным. Интима аорты имела немногочисленные атероматозные бляшки, участки изъязвления и кальциноза стенки в брюшном отделе. При макроскопическом исследовании в мозговом веществе обоих почек были видны мелкие кистозные полости до 0,5 см.
Левое легкое находилось в спавшемся состоянии, поджато к корню, органы средостения немного смещены влево. Листки плевры и перикарда однородные, тонкие, серого цвета. Справа, в зоне бывшей операции, по ходу послеоперационного рубца висцеральный и париетальный плевральные листки были спаяны между собою рыхлыми спайками. Слизистые оболочки верхних дыхательных путей, главных и долевых бронхов тускловатые, бледно-серые. На поверхности верхних долей обоих легких расположены множественные тонкостенные буллы размерами от 0,5 до 3 см (рис. 3). Ткань правого легкого повышенной воздушности преимущественно в субплевральных отделах, она крепитирует при рассечении. Верхняя доля его частично резецирована, в оставшейся ткани, в субплевральных отделах 3-го сегмента расположен очаг размерами 2,5×2,5 см белесоватого цвета, с нечеткими границами, плотной консистенции, ткань которого на разрезе в центральной части имеет участок распада диаметром до 1,5 см, напоминающий казеозные массы. Левое легкое частично спавшееся, ткань нижней доли плотная, темно-красного цвета, кусочки ткани легкого тонут в водном растворе формалина, верхняя доля слабо воздушна. Над поверхностью среза в обоих легких выступают бронхи, с эктазированными просветами неправильной формы, заполненные сероватой мокротой, легочные сосуды торчат над поверхностью среза в виде перьев, с поверхности среза стекает темная жидкая кровь и мутная жидкость. Бифуркационные лимфатические узлы размерами по 1,5 см, однородные, темно-серого цвета. Сердце имело вытянутую форму, размер 12–10–8 см и массу 450 г. Полости сердца, особенно правого предсердия и желудочка расширены, заполнены жидкой кровью, толщина стенки правого желудочка составила 0,6 см, его стенка имела многочисленные ветвистые трабекулы, идущие в разных направлениях, с глубокими межтрабекулярными пространствами (гипертрабекулярность). Миокард на разрезе выглядел дряблым, светло-коричневым. Фиброзное кольцо трикуспидального клапана было немного расширено, а клапанный эндокард выглядел отечным. Интима аорты имела немногочисленные атероматозные бляшки, участки изъязвления и кальциноза стенки в брюшном отделе. При макроскопическом исследовании в мозговом веществе обоих почек были видны мелкие кистозные полости до 0,5 см.  При гистологическом исследовании препаратов легочной ткани левого легкого имелись признаки ателектаза. Было установлено, что стенки сегментарных и субсегментарных бронхов обоих легких истончены, деформированы, в них наблюдается гипоплазия, либо отсутствие хрящевых элементов, фракционное расположение и уменьшение мышечных волокон, формирующиеся бронхоэктазы (рис. 4).
При гистологическом исследовании препаратов легочной ткани левого легкого имелись признаки ателектаза. Было установлено, что стенки сегментарных и субсегментарных бронхов обоих легких истончены, деформированы, в них наблюдается гипоплазия, либо отсутствие хрящевых элементов, фракционное расположение и уменьшение мышечных волокон, формирующиеся бронхоэктазы (рис. 4). Легочная ткань субплевральных отделов эмфизематозна, резко расширены просветы респираторных бронхиол и альвеол, были сформированы небольшие кистозные полости/буллы, выстланные кубическим, либо уплощенным эпителием, межальвеолярные перегородки истончены, местами склерозированы, по ходу перибронхиальной стромы имелось отложение частиц угольной пыли (рис. 5).
В препарате из 3-го сегмента правого легкого обнаружена структура инфекционной гранулемы (рис. 6).
В некротических массах из ее центральной части при окраске по Грокотту выявлены споры и мицелий плесневых грибов, наиболее сходных с аспергиллами. Вокруг зоны некроза располагался вал из эпителиоидных клеток, редкие многоядерные гигантские клетки и лимфоциты (при этом окраска по Циль–Нильсену не выявила кислотоустойчивой флоры), зона воспалительной грануляционной ткани формировала по периферии фиброзную капсулу (рис. 7).
При микроскопическом исследовании гистопрепаратов почек был обнаружен очаговый гломерулосклероз и структурные признаки медуллярных кист.
Основным заболеванием в патолого-анатомическом диагнозе фигурирует врожденный порок формирования легких Q33.0 в виде гипоплазии хрящей в стенках сегментарных и субсегментарных бронхов, формированием многочисленных бронхоэтазов, микрокист и субплевральных булл (синдром Вильямса–Кэмпбелла). Порок легочной ткани сочетался с хроническим катарально-склерозирующим воспалением слизистых оболочек бронхов, перибронхиальным пневмофиброзом и образованием микотической гранулемы 3-го сегмента верхней доли правого легкого. Заболевание осложнилось разрывом одной из булл левого легкого, напряженным пневмотораксом, ателектазом и коллапсом левого легкого.
В разделе сопутствующих заболеваний патологоанатомом выделены такие состояния, как «избыточная трабекулярность правого предсердия и желудочка», спланхноптоз (гастро-, нефроптоз); поликистоз пирамид почек (медуллярная губчатая почка); долихосигма; варикозное расширение вен ног.
Обсуждение
В представленном клиническом наблюдении выявлено несоответствие заключительного клинического и патолого-анатомического диагнозов, связанное с затруднением прижизненной диагностики наследственно детерминированных системных заболеваний соединительной ткани, таких как синдром Элерса–Данло, синдром Марфана, cиндром Берта–Хогга–Дюбе, синдром Вильямса–Кэмпбелла, гистиоцитоз Х, зачастую проявляющихся буллезной эмфиземой и СП. Фенотипические признаки дисплазии соединительной ткани (высокий рост – 192 см, долихостеномелия, килевидная деформация грудной клетки, гиперрастяжимая кожа, буллезная эмфизема, спланхноптоз), легко выявляемые при осмотре, не были описаны в медицинской документации и, следовательно, не учитывались при установлении диагноза.Возникает закономерный вопрос, возможно ли было при жизни заподозрить наследственную патологию соединительной ткани, выявив и объединив типичные клинические признаки дисплазии соединительной ткани: килевидную деформацию грудной клетки, гиперэластичную кожу, буллезную эмфизему легких, СП, гастроптоз 2-й степени, нефроптоз, долихосигму, варикозное расширение вен ног при УЗИ, диспластические изменения в сердце при ЭхоКГ. Насколько вероятно избежать неправильно поставленного диагноза у данного пациента при знании и учете фенотипических и клинических диспластических проявлений – вопрос остается открытым.
Судить о наличии генетически детерминированной патологии соединительной ткани у пациентов с первичным СП позволяют их фенотипические особенности и направление пациентов на генетическое исследование. В направлении на морфологическое исследование фрагмента легочной ткани в прижизненной диагностике важным аспектом является указание на марфаноидный фенотип, которое, возможно сориентировало бы врача-патоморфолога на выявление наследственной патологии соединительной ткани еще при жизни пациента.
В данном случае дефект хрящей бронхов 5–6-го порядка (синдром Вильямса–Кемпбелла) был ассоциирован с марфаноподобным фенотипом, который, на наш взгляд, отражает общий системный процесс наследственной патологии соединительной ткани.
По литературным описаниям, пациенты с марфаноподобным фенотипом отличаются не только высоким ростом и худощавостью с долихостеномелией. У большинства из них имеются другие признаки дисплазии соединительной ткани: различные виды деформации грудной клетки и позвоночника, плоскостопие, варикозное расширение вен, миопия, гипермобильность суставов, пролапсы сердечных клапанов, повышенная растяжимость кожи, буллезная эмфизема, которые позволяют не только заподозрить наследственную патологию соединительной ткани, но и диагностировать ее, а также разработать для пациента индивидуальною программу реабилитации и лечения [16, 17].
Особенностью данного наблюдения является посмертная диагностика микотической гранулемы (воспалительная псевдоопухоль), которая клинически имитировала периферическую опухоль легкого, а по сути отражала дефект местного иммунитета у пациентов диспластического фенотипа.
Своевременная диагностика наследственно детерминированной патологии соединительной ткани позволит вовремя профилактировать осложнения и скоропостижную гибель данной группы пациентов от осложнения буллезной эмфиземы – спонтанного пневмоторакса.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сергей Иванович Викторов – врач-патологоанатом высшей категории, зав. централизованным патолого-анатомическим отделением, БУЗ Омской области «Городская больница №3».
ORCHID: 0009-0005-9767-3109
Sergey I. Viktorov – Pathologist of the highest category, Head of the centralized pathology department, City Hospital No 3. ORCHID: 0009-0005-9767-3109
Дарья Сергеевна Иванова – канд. мед. наук, доц., доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: darja.ordinator@mail.ru; ORCHID: 0000-0002-4145-7969
Daria S. Ivanova – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: darja.ordinator@mail.ru; ORCHID: 0000-0002-4145-7969
Динара Барамбаевна Уралбаева – ассистент каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ; врач-пульмонолог отд-ния аллергологии-иммунологии, БУЗ Омской области «Городская поликлиника №12». ORCHID: 0000-0002-2881-2524
Dinara B. Uralbaeva – Аssistant, Omsk State Medical University; Pulmonologist, City Polyclinic No 12. ORCHID: 0000-0002-2881-2524
Инна Анатольевна Викторова – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ, гл. внештатный специалист по терапии и общей врачебной практике (семейной медицине) Минздрава Омской области. ORCHID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. ORCHID: 0000-0001-8728-2722
Поступила в редакцию: 17.03.2025
Поступила после рецензирования: 26.03.2025
Принята к публикации: 10.04.2025
Received: 17.03.2025
Revised: 26.03.2025
Accepted: 10.04.2025
Список исп. литературыСкрыть список1. Авдеев С.Н. Пневмоторакс. Consillium Medicum. 2005;7(10):874-82.
Avdeev S.N. Pnevmotoraks. Consilium Medicum. 2005;7(10):874-82 (in Russian).
2. Буйкин С.В., Пузырев В.П. Альфа-1-антитрипсиновая недостаточность. Перспективы скрининга. Сообщение 1. Бюл. СО РАМН. 2004;1:92-7.
Buykin SV, Puzyrev VP. Alpha-1-antitrypsin insufficiency. Prospects of screening. Message 1. Bulletin Sibirskogo Otdelenia Rossiyskoy Akademii Meditsinskykh Nauk. 2004,1:92-7 (in Russian).
3. Champion P, Ryan F. A case of congenital cutis laxa (generalized elastolysis). Can Respir J 2005;12(3):151e2.
4. Вершинина М.В., Гринберг Л.М., Нечаева Г.И. и др. Спонтанный пневмоторакс и дисплазия соединительной ткани: фенотипические особенности пациентов. Пульмонология. 2011;(6):43-7.
Vershinina M.V., Grinberg L.M., Nechaeva G.I. et al. Spontaneous pheumothorax and dysplasia of the connecting tissue: phenotype characteristics. Pulmonologiya. 2011;(6):43-7 (in Russian).
5. Арсентьев В.Г., Кадурина Т.И., Аббакумова Л.Н. Новые принципы диагностики и классификации синдрома Элерса – Данло. Педиатр. 2018;9(1):118-25.
Arsentev V.G., Kadurina T.I., Abbakumova L.N. New principles of diagnosis and classification of the Ehlers-Danlos syndrome. Pediatrician (St. Petersburg). 2018;9(1):118-25 (in Russian).
6. Rebelo M, Ramos L, Lima J et al. Ehlers-Danlos syndrome Type IV in association with a (c.970G>A) mutation in the COL3A1 gene. Acta Med Port 2011;24:1079-86.
7. Филатова А.С., Гринберг Л.М. Спонтанный пневмоторакс – этиопатогенез, патоморфология (обзор литературы). Уральский медицинский журнал. 2008;13(58):82-9.
Filatova A.S., Grinberg L.M. Spontaneous pneumothorax:etiology, pathogenesis, histopathology (review). Ural'skiy meditsinskiy zhurnal. 2008;13(58):82-9 (in Russian).
8. Лунева Е.Б., Парфенова Н.Н., Коршунова А.Л., Земцовский Э.В. Новые подходы к диагностике синдрома Марфана. Российский семейный врач. 2012;3:14-9.
Luneva E.B., Parfenova N.N., Korshunova A.L., Zemtsovsky E.V. New aproaches to marfan syndrome diagnostics. Rossiyskiy Semeyniy Vrach. 2012;3:14-9 (in Russian).
9. Kunogi M, Kurihara M, Ikegami TS et al. Clinical and genetic spectrum of Birt-Hogg-Dube syndrome patients in whom pneumothorax and/or multiple lung cysts are the presenting feature. J Med Genet 2010;47:281-7.
10. Vincent A, Farley M, Chan E et al. Birt-Hogg-Dube syndrome: a review of the literature and the differential diagnosis of firm facial papules. J Am Acad Dermatol 2003;49:698-705.
11. Shankar G, Kothari P, Sarda D et al. Pneumonectomy in a child with congenital bronchiectasis: A case report and review of literature. Annals of Thoracic Medicine 2006;1:2:81-3.
12. Попова Е.Н., Коган Е.А., Корнев Б.М. и др. Интерстициальные болезни легких. Практическое руководство. Под ред. Н.А. Мухина М.: Литтерра, 2007.
Popova E.N., Kogan E.A., Kornev B.M. et al. Interstitial lung diseases. A practical guide. Ed. by N.A. Mukhina. Moscow: Litterra, 2007 (in Russian).
13. Фесенко О.В.. Гистиоцитох Х легких. Терапевтический архив. 2007;79(3):70.6.
Fesenko О.V. Pulmonary X histiocytosis. Terapevticheskiy arkhiv. 2007;79(3):70-6 (in Russian).
14. Амосов В.В. Компьютерная томография в оценке перестройки легочной ткани у больного с гистиоцитозом Х. Медицинская визуализация. 2014;(3):27-31.
Amosov VV. Computed tomography in the evaluation of the lesion of the lung tissue in patients with histiocytosis X. Medical Visualization. 2014;(3):27-31 (in Russian).
15. Пономарева Е.Ю., Ребров А.П., Архангельская Е.Е. и др. Гистиоцитоз Х: клинические наблюдения. Клиницист. 2012;(1):77-80.
Ponomareva E.Y., Rebrov A.P., Archangelskaja E.E. et al. Histiocytosis X: clinical observations. Klinitsist. 2012;(1):77-80 (in Russian).
16. Говорова С.Е., Вершинина М.В., Нечаева Г.И. Эффективность программы реабилитации у пациентов с буллезной эмфиземой и спонтанным пневмотораксом в центре дисплазии соединительной ткани. Омский научный вестник. 2011;1(104):110-3.
Govorova S.E., Vershinina M.V., Nechaeva G.I. Effectiveness of the rehabilitation program in patients with bullous emphysema and spontaneous pneumothorax in the center of connective tissue dysplasia. Omskiy nauchnyy vestnik. 2011;1(104):110-13 (in Russian).
17. Вершинина М.В., Говорова С.Е., Нечаева Г.И., Ратынская И.А. Лечение пациентов с буллезной эмфиземой на фоне дисплазии соединительной ткани в первичном звене здравоохранения. Лечащий врач. 2011;(9):14-6.
Vershinina M.V., Govorova S.E., Nechaeva G.I., Ratynskaya I.A. Treatment of patients with bullous emphysema on the background of connective tissue dysplasia in primary healthcare. Lechaschi Vrach. 2011;(9):14-6 (in Russian).