Клинический разбор в общей медицине №6 2025
Клинический разбор в общей медицине №6 2025
Факторы риска развития резистентной артериальной гипертензии
Номера страниц в выпуске:75-79
Аннотация
Резистентная артериальная гипертензия (АГ) продолжает оставаться серьезной медико-социальной проблемой во всем мире. Цель исследования – выявление факторов риска развития резистентной АГ. Были обследованы 50 пациентов с истинно резистентной АГ
(основная группа) и 45 пациентов с контролируемой АГ (группа сравнения). Изучали адренореактивность эритроцитарных мембран
(β-АРМЭ), уровни оксида азота (NO), эндотелина-1 (ЕТ-1), высокочувствительного С-реактивного белка (вч-СРБ), интерлейкина
(ИЛ)-6, ИЛ-17, фактора некроза опухоли (ФНО)-α в плазме крови. Установлены статистически значимые различия между группой резистентной АГ и контролируемой АГ по показателям β-АРМЭ (р=0,002), NO (р=0,028), ЕТ-1 (p=0,006), ФНО-α (р<0,001), ИЛ-6 (р=0,002). Определены следующие предикторы развития резистентной АГ: показатель β-АРМЭ ≥52,3 усл. ед., содержание в крови SOD≤9,7 ЕД/мл, NO≤16,7 ммоль/л, ЕТ-1≥11,5 пг/мл, ФНО-α≥4,2 пг/мл. Определение риска развития резистентной АГ является важным и необходимым для разработки эффективных терапевтических стратегий, обеспечения контроля артериального давления и улучшения прогноза у данной категории пациентов.
Ключевые слова: резистентная артериальная гипертензия, адренореактивность эритроцитарных мембран, оксид азота, эндотелин-1, высокочувствительный С-реактивный белок, интерлейкин-6, интерлейкин-17, фактор некроза опухоли α.
Для цитирования: Гуменюк Л.Н., Звегинцев Р.Р., Бобрик Ю.В., Черноротов В.А. Факторы риска развития резистентной артериальной гипертензии. Клинический разбор в общей медицине. 2025; 6 (6): 75–79. DOI: 10.47407/kr2025.6.6.00633
Резистентная артериальная гипертензия (АГ) продолжает оставаться серьезной медико-социальной проблемой во всем мире. Цель исследования – выявление факторов риска развития резистентной АГ. Были обследованы 50 пациентов с истинно резистентной АГ
(основная группа) и 45 пациентов с контролируемой АГ (группа сравнения). Изучали адренореактивность эритроцитарных мембран
(β-АРМЭ), уровни оксида азота (NO), эндотелина-1 (ЕТ-1), высокочувствительного С-реактивного белка (вч-СРБ), интерлейкина
(ИЛ)-6, ИЛ-17, фактора некроза опухоли (ФНО)-α в плазме крови. Установлены статистически значимые различия между группой резистентной АГ и контролируемой АГ по показателям β-АРМЭ (р=0,002), NO (р=0,028), ЕТ-1 (p=0,006), ФНО-α (р<0,001), ИЛ-6 (р=0,002). Определены следующие предикторы развития резистентной АГ: показатель β-АРМЭ ≥52,3 усл. ед., содержание в крови SOD≤9,7 ЕД/мл, NO≤16,7 ммоль/л, ЕТ-1≥11,5 пг/мл, ФНО-α≥4,2 пг/мл. Определение риска развития резистентной АГ является важным и необходимым для разработки эффективных терапевтических стратегий, обеспечения контроля артериального давления и улучшения прогноза у данной категории пациентов.
Ключевые слова: резистентная артериальная гипертензия, адренореактивность эритроцитарных мембран, оксид азота, эндотелин-1, высокочувствительный С-реактивный белок, интерлейкин-6, интерлейкин-17, фактор некроза опухоли α.
Для цитирования: Гуменюк Л.Н., Звегинцев Р.Р., Бобрик Ю.В., Черноротов В.А. Факторы риска развития резистентной артериальной гипертензии. Клинический разбор в общей медицине. 2025; 6 (6): 75–79. DOI: 10.47407/kr2025.6.6.00633
Original Article
Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University, Simferopol, Russia
lesya_gymenyuk@mail.ru
Abstract
Resistant arterial hypertension (AH) continues to be a serious medical and social problem throughout the world. The aim of the study was to identify risk factors for the development of resistant AH. A total of 50 patients with truly resistant AH (main group) and 45 patients with controlled AH (comparison group) were examined. We studied β-ARME, NO, ET-1, hs-CRP, IL-6, IL-17, and TNF-α levels in blood plasma. Statistically significant differences were found between the resistant hypertension group and the controlled hypertension group in terms of β-ARME (p=0.002), NO (p=0.028), ET-1 (p=0.006), TNF-α (p<0.001), and IL-6 (p=0.002). The following predictors of resistant hypertension development were identified: β-ARME ≥52.3 conventional units, SOD blood content ≤9.7 U/ml, NO ≤16.7 mmol/l, ET-1≥11.5 pg/ml, TNF-α≥4.2 pg/ml. Determining the risk of developing resistant hypertension is important and necessary for developing effective therapeutic strategies, ensuring blood pressure control and improving the prognosis in this category of patients.
Keywords: resistant arterial hypertension, β-ARBs, NO, ET-1, hs-CRP, IL-6, IL-17, TNF-α.
For citation: Gumenyuk L.N., Zvegintsev R.R., Bobrik Yu.V., Chernorotov V.A. Risk factors for the development of resistant arterial hypertension. Clinical review for general practice. 2025; 6 (6): 75–79 (In Russ.). DOI: 10.47407/kr2025.6.6.00633
Патогенез развития резистентной АГ является сложным, до конца не изученным и включает множество факторов. В настоящее время такими ключевыми факторами признаны избыточная активация симпатоадреналовой системы (САС), реализуемая преимущественно через β-адренорецепторы [5], а также эндотелиальная дисфункция (ЭД) [6], в развитии которой особое значение имеют оксид азота (II) (NO) [7] и эндотелин-1
(ET-1) [8]. Тем не менее исследования, посвященные изучению изменений этих биомаркеров ЭД у пациентов с резистентной АГ, остаются ограниченными и демонстрируют противоречивые результаты [9, 10]. Так, в исследовании N.W. Rajapakse и соавт. [9] у пациентов с резистентной АГ выявлено снижение плазменных уровней NO, сопряженное с показателями АД. Напротив, результаты недавно опубликованного исследования
H.N. Ranasinghe и соавт. [10] показали, что у пациентов с резистентной АГ плазменные уровни NO были значительно выше не только по сравнению с группой здорового контроля, но и по сравнению с пациентами с контролируемой АГ и положительно коррелировали со значениями АД. Кроме того, важно отметить, что предыдущие исследования оценивали уровни ЕТ-1 преимущественно у пациентов с нелеченой или контролируемой АГ, а исследования с участием пациентов с резистентной АГ практически отсутствуют. Несмотря на это, в ряде клинических проектов продемонстрирована эффективность 48-недельной терапии двойным антагонистом рецепторов ЕТ-1 – апроцитентаном – в снижении уровня АГ у пациентов с резистентной АГ [11, 12]. Однако выявленные изменения не были напрямую сопоставлены с уровнями ЕТ-1. Ввиду этого актуальным направлением современных биомедицинских исследований является определение предикторов развития резистентной АГ.
Цель исследования – выявление факторов риска развития резистентной АГ.
с истинно резистентной АГ (основная группа) [женщины – 27 и мужчины – 23, средний возраст 42,5 (39,7; 44,5) года] и 45 пациентов с контролируемой АГ (группа сравнения) [женщины – 25 и мужчины – 20, средний возраст 40,3 (37,4; 43,1) года]. Характеристика пациентов с резистентной АГ и контролируемой АГ отображена в табл.1.
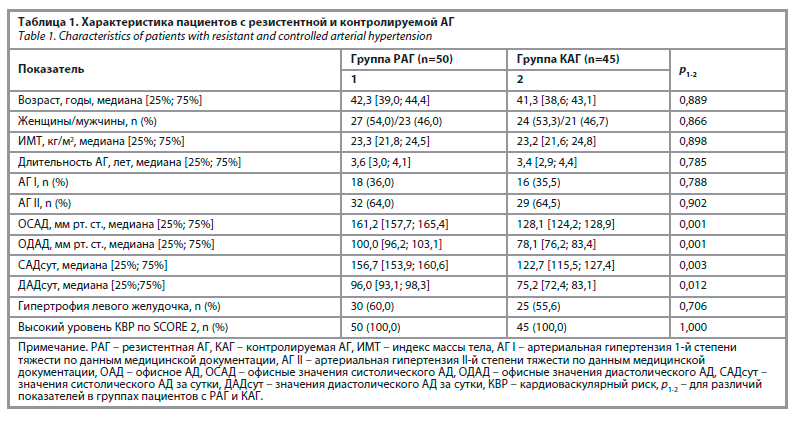
Критериями включения пациентов с резистентной АГ в исследование являлись: возраст от 18 до 45 лет; индекс массы тела в пределах 18,5–24,9 кг/м²; верифицированная истинная резистентная АГ (согласно актуальным национальным рекомендациям [13]), АГ I или II степени тяжести.
Критерии невключения: индекс массы тела <18,5 и >25 кг/м²; вторичные и псевдорезистентные формы АГ, АГ III степени тяжести, клинически выраженные формы ишемической болезни сердца, перенесенный инфаркт миокарда и/или инсульт, хроническая сердечная недостаточность II–IV функциональных классов, нарушения ритма и проводимости сердца, снижение скорости клубочковой фильтрации менее 45 мл/мин/1,73 м², сахарный диабет 1 и 2-го типов, аутоиммунные и онкологические заболевания, а также другая соматическая патология, приводящая к декомпенсации любой системы организма. Также не включались пациенты с синдромом обструктивного апноэ сна, хроническими вирусными инфекциями в течение 6 мес, предшествующих включению в исследование, психическими расстройствами и инсомнией в анамнезе, а также женщины в период беременности и лактации.
Критерии включения в группу сравнения: возраст от 18 до 45 лет; индекс массы тела в пределах 18,5–24,9 кг/м²; I, II степень тяжести АГ.
Критерии невключения были идентичны группе пациентов с резистентной АГ.
У всех пациентов с резистентной и контролируемой АГ произведен забор венозной крови (утром, в интервале с 7:00 до 9:00, натощак после 8–12 ч голодания) для оценки β-адренореактивности эритроцитарных мембран (β-АРМЭ), уровней NO, эндотелина-1 (ЕТ-1), высокочувствительного С-реактивного белка (вч-СРБ), интерлейкина (ИЛ)-6, ИЛ-17 и фактора некроза опухоли (ФНО)-α. Показатель β-АРМЭ определяли в эритроцитах с использованием экспресс-метода, основанного на ингибировании их осмолярной резистентности в присутствии β-адреноблокатора [14], с применением тест-наборов β-АРМЭ-АГАТ («Агат-Мед», Россия). Уровни в плазме крови NO и ET-1 определяли методом иммуноферментного анализа с использованием тест-наборов «ELISA Kit» (FineTest, КНР). Уровень в плазме крови вч-СРБ измеряли посредством метода высокочувствительной иммунонефелометрии с использованием тест-наборов «Dade Behring» (Германия), уровни ИЛ-6, ИЛ-17 и ФНО-α – с помощью твердофазного иммуноферментного метода с использованием тестовых систем «ЗАО Вектор-Бест» (Россия).
Для статистической обработки полученных данных использовался программный пакет Statistica 8.0 (StatSoft Inc., США). Количественные показатели представлены в виде медианы (Ме) с интерквартильным размахом [25-й и 75-й перцентили (%)], качественные – в виде долей и абсолютных значений. Сравнительный анализ количественных данных между группами проводился с использованием U-критерия Манна–Уитни, качественных – с помощью χ2-критерия. Для выявления предикативных факторов формирования резистентной АГ применяли множественный логистический регрессионный анализ. Для анализа отношения шансов (ОШ) и расчета границ 95% доверительного интервала (ДИ) использовалась онлайн-платформа StatTech. Уровень статистической значимости определяли при р<0,05.
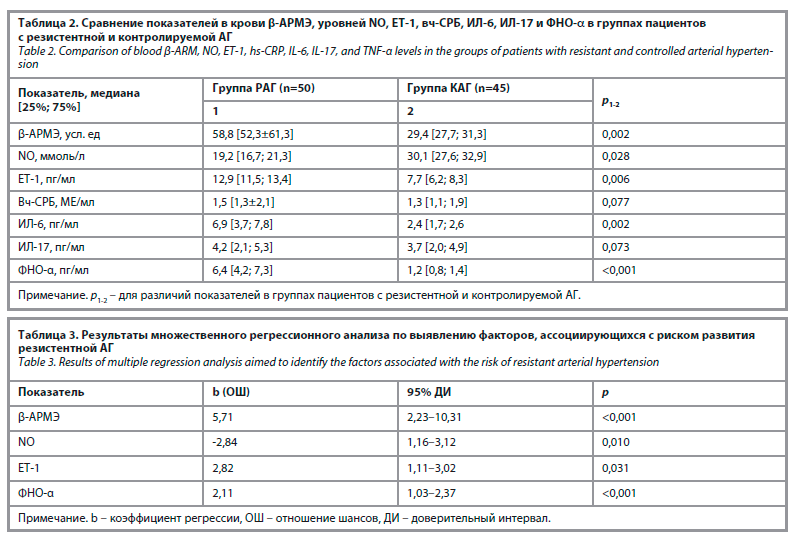
Как видно, в группе пациентов с резистентной АГ по сравнению с группой пациентов с контролируемой АГ уровень β-АРМ был выше в 2,0 раза (р=0,002), ЕТ-1 – в 1,7 раза (р=0,006), ФНО-α – в 5,3 раза (р<0,001), ИЛ-6 – в 2,9 раза (р=0,002) и уровень NO был ниже в 1,6 раза (р=0,028). При этом в группах пациентов с резистентной и контролируемой АГ значения вч-СРБ и ИЛ-17 были сопоставимы (р=0,077 и р=0,073 соответственно).
Выполнен множественный логистический регрессионный анализ по определению факторов, ассоци-ирующихся с развитием резистентной АГ (табл. 3).
β-АРМЭ, ЕТ-1, ФНО-α, ИЛ-6 и более низкими значениями NO. Важно отметить, что эти данные получены у пациентов, длительно (более 6 мес) получавших актуальную медикаментозную АГТ при высоком уровне приверженности терапии и соблюдении рекомендаций по модификации образа жизни. С одной стороны, эти факты указывают на более злокачественное течение заболевания у пациентов с резистентной АГ по сравнению с контролируемой АГ, а с другой – свидетельствуют о недостаточной эффективности стандартного алгоритма АГТ в данной группе пациентов.
В рамках нашего исследования, на основании множественного логистического регрессионного анализа, из исходного набора показателей, различающихся между группами резистентной и контролируемой АГ, было установлено 4 независимых ассоциаций с развитием резистентной АГ (в порядке убывания их значимости): показатель β-АРМЭ ≥52,3 усл. ед., психологический стресс при PSM-25 ≥115,3 балла, содержание в крови SOD ≤9,7 ЕД/мл, NO ≤16,7 ммоль/л, ЕТ-1 ≥11,5 пг/мл, ФНО-α ≥4,2 пг/мл, инсомния при ISI ≥16,2 балла.
Доказано, что высокий показатель β-АРМЭ отражает избыточную системную активацию САС [14, 15]. В свете этого мы можем говорить, что наиболее сильным предиктором развития резистентной АГ по нашим результатам является избыточная активация САС. Она увеличивает риск развития резистентной АГ в 5,7 раза. Механизмы, лежащие в основе развития резистентной АГ при стойкой избыточной активации САС, в сущности, объясняются четырьмя группами эффектов, которые, тесно взаимодействуя между собой, создают порочный круг [5]: нейрогуморальные эффекты, в первую очередь за счет активации ренин-ангиотензин-альдостероновой системы; гемодинамические эффекты – в виде аугментации частоты сердечных сокращений и повышения общего периферического сопротивления; сосудистые эффекты с прогрессированием сосудистого ремоделирования сосудистой стенки, ЭД, а также повышением артериальной жесткости; почечные эффекты – чрезмерная секреция норадреналина симпатическими нервными окончаниями, локализованными в почках, повышает активность натрий-хлор-контранспортера в клетках дистальных почечных канальцев и ведет к ингибированию прессорного натрийуреза. Полученные нами данные относительно прогностической роли избыточной активности САС в развитии резистентной АГ были ожидаемы, поскольку в метаанализе, выполненном G. Grassi и соавт. [16] (58 экспериментальных исследований и рандомизированных контролируемых исследований – РКП) и системном обзоре C. Tsioufis и соавт. [17] (88 РКП) также подтверждена роль симпатоадреналового овердрайва в поддержании и прогрессии АГ, вплоть до развития резистентной АГ и поражения органов-мишеней, главным образом сердца и почек. Сопоставимые данные были представлены и в некоторых проектах, выполненных коллективами отечественных ученых. Так, Р.И. Стрюк и И.Г. Длусская [14] показали, что у пациентов с резистентной АГ имеет место прогрессирующее возрастание активности САС не только относительно здоровых лиц, но и результатов, полученных в группе пациентов с контролируемой АГ. И.В. Зюбанова и соавт. [15] продемонстрировали, что ослабление активности САС на ранних сроках после симпатической денервации почечных артерий (ДПА) ассоциировалось со снижением уровней систолического и диастолического АД через 24 нед после хирургического вмешательства, тогда как отсутствие изменений активности САС не приводило к снижению высоких уровней АД. Аналогичные результаты представлены и в исследовании Т.Ю. Ребровой и соавт. [18]: выразительность антигипертензивного эффекта симпатической ДПА была сопряжена со степенью ослабления активности САС. Оценка состояния САС в отечественных работах проводилась также по изменению значения β-АРМ, но у пациентов с длительностью АГ >20 лет, среди которых 70% имели избыточную массу тела.
Кроме того, по нашим данным, низкий уровень NO также оказался значимым фактором, ассоциированным с почти трехкратным увеличением риска развития резистентной АГ. NO представляет собой медиатор эндотелий-зависимой вазодилатации и, по определению, ингибирует выработку вазоконстрикторов (главным образом ангиотензина II и ЕТ-1), адгезию лейкоцитов и агрегацию тромбоцитов, инфильтрацию и пролиферацию гладкомышечных клеток сосудов, поддерживает тонус сосудов и неадгезивность их внутренней поверхности, регулирует воспалительные и противовоспалительные реакции, предотвращает окислительную модификацию липопротеинов низкой плотности [19], что определяет поддержание сосудистого гомеостаза, тогда как дефицит NO вызывает ЭД. В противоположность нашим результатам, в исследовании H.N. Ranasinghe и соавт. [10] высокий уровень NO был связан с резистентностью к АГТ. Объяснением такого контрастирования могут быть различные причины, в частности, отличия в характеристиках изучаемых выборок: исследование коллег характеризовалось высокой гетерогенностью пациентов (по возрасту, индексу массы тела, тяжести и длительности АГ, наличию сопутствующих состояний – сахарный диабет, ожирение, хроническая болезнь почек, статусу курения), что могло привести к определенному смещению полученных результатов. Мы в нашем исследовании эти смещающие факторы устранили. В частности, как мы указывали ранее, наши пациенты были не старше 45 лет с нормальным индексом массы тела (в пределах 18,5–24,9 кг/м²), без коморбидных сердечно-сосудистых заболеваний и других соматических заболеваний, не курили.
Так же, как и в исследовании K. Kostov и соавт. [20], нами выявлена ассоциация высокого уровня ЕТ-1 с развитием резистентной АГ. При этом имеет смысл подчеркнуть, что в вышеупомянутых исследованиях влияние уровней ЕТ-1 на повышение риска развития резистентности к АГТ было продемонстрировано для пациентов пожилого возраста, отягощенным анамнезом по сердечно-сосудистым заболеваниям, а также избыточной массой тела, т.е. относящихся к группе, имеющих традиционные факторы риска резистентной АГ, однако полученные нами результаты продемонстрировали его роль и у пациентов молодого и среднего возраста без традиционных факторов риска резистентной АГ. Созвучность наших данных с результатами ранее проведенных работ свидетельствует об универсальности роли ЕТ-1 в формировании резистентности к медикаментозной АГТ как у пациентов, имеющих факторы риска резистентной АГ, так и без них. Основные механизмы влияния ЕТ-1 на развитие резистентности эксперты объясняют следующими процессами: активацией ангиотензина II и контрактильных реакций сосудов на другие вазоконстрикторы (серотонин и норадреналин), ослаблением натрийуреза [21]; инициацией высвобождения вторичных вазоактивных медиаторов, цитокиновых молекул и факторов роста [22]; прогрессированием нарушения функции эндотелия и ремоделирования резистентных артерий, включая утолщение и потерю эластичности сосудистой стенки; интенсификацией констрикции артерий почечных клубочков с изменением секреции альдостерона, вазопрессина, адреномедулина; усугублением и поддержанием избыточной активности САС [23]. Считаем важным отметить, что в нашем исследовании NO и ET-1 продемонстрировали практически равную значимость в развитии резистентной АГ с показателями ОШ 2,84 и 2,82 соответственно. Эти данные согласуются с известным фактом, что именно симультанное нарушение баланса в системе NO–ET-1 ведет к существенной аугментации вазоконстрикции и усилению пролиферативной активности ET-1, тем самым обеспечивая стойкое повышение АД и резистентность к медикаментозной АГТ [24].
Кроме того, в нашем исследовании высокий уровень ФНО-α (≥4,2 пг/мл) был выявлен как фактор, ассоци-ированный с 2,11-кратным увеличением риска развития резистентной АГ. Актуальность выявленной связи является неоспоримой, поскольку описана впервые и ранее не указывалась. Современные данные свидетельствуют о том, что ФНО-α, кроме выраженного провоспалительного действия, может индуцировать транскрипцию ренина в клетках юкстагломерулярного аппарата почек, а также наращивать чувствительность рецепторов к ангиотензину II, что, в свою очередь, вызывает избыточную активацию САС и повышение АД [25]. Помимо этого, ФНО-α играет важную роль в запуске нейровоспаления, что приводит к повышению тонуса САС на уровне головного мозга и также сопровождается повышением АД [26]. К тому же активизация центров симпатоадреналовой активности центров в головном мозге может происходить как за счет непосредственного диффундирования ФНО-α из системного кровотока через гематоэнцефалический барьер, так и вследствие усиленной локальной продукции этого цитокина клетками микроглии [27]. Нами также установлена статистически значимая прямая взаимосвязь между уровнем ФНО-α и показателем β-АРМЭ. В отличие от N.R. Barbaro и соавт. [27], мы не обнаружили связи ИЛ-6 с риском развития резистентной АГ. Возможно, это несоответствие связано с существенным отличием включенного в исследование коллег контингента пациентов от нашего (1359 пациентов с хронической болезнью почек, 876 курили). Влияние этих факторов может быть существенным, по данным ряда исследований, хроническая болезнь почек и курение тесно связаны с концентрацией ИЛ-6 [28, 29].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Гуменюк Леся Николаевна – д-р мед. наук, проф., Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Е-mail: lesya_gymenyuk@mail.ru
Lesya N. Gumenyuk – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: lesya_gymenyuk@mail.ru
Звегинцев Роман Романович – преподаватель, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им.
В.И. Вернадского». Е-mail: romamuse97@gmail.com
Roman R. Zvegintsev – Lecturer, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: romamuse97@gmail.com
Бобрик Юрий Валерьевич – д-р мед. наук, проф. каф. лечебной физкультуры и спортивной медицины и физиотерапии с курсом физического воспитания, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского».
Е-mail: yura.bobrik@mail.ru
Yuri V. Bobrik – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University Е-mail: yura.bobrik@mail.ru
Черноротов Владимир Алексеевич – д-р мед. наук, проф., Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Е-mail: chernorotov.csmu@mail.ru
Vladimir A. Chernorotov – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: chernorotov.csmu@mail.ru
Поступила в редакцию: 10.03.2025
Поступила после рецензирования: 15.03.2025
Принята к публикации: 20.03.2025
Received: 10.03.2025
Revised: 15.03.2025
Accepted: 20.03.2025
Risk factors for the development of resistant arterial hypertension
Lesya N. Gumenyuk, Roman R. Zvegintsev, Yuri V. Bobrik, Vladimir A. ChernorotovGeorgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University, Simferopol, Russia
lesya_gymenyuk@mail.ru
Abstract
Resistant arterial hypertension (AH) continues to be a serious medical and social problem throughout the world. The aim of the study was to identify risk factors for the development of resistant AH. A total of 50 patients with truly resistant AH (main group) and 45 patients with controlled AH (comparison group) were examined. We studied β-ARME, NO, ET-1, hs-CRP, IL-6, IL-17, and TNF-α levels in blood plasma. Statistically significant differences were found between the resistant hypertension group and the controlled hypertension group in terms of β-ARME (p=0.002), NO (p=0.028), ET-1 (p=0.006), TNF-α (p<0.001), and IL-6 (p=0.002). The following predictors of resistant hypertension development were identified: β-ARME ≥52.3 conventional units, SOD blood content ≤9.7 U/ml, NO ≤16.7 mmol/l, ET-1≥11.5 pg/ml, TNF-α≥4.2 pg/ml. Determining the risk of developing resistant hypertension is important and necessary for developing effective therapeutic strategies, ensuring blood pressure control and improving the prognosis in this category of patients.
Keywords: resistant arterial hypertension, β-ARBs, NO, ET-1, hs-CRP, IL-6, IL-17, TNF-α.
For citation: Gumenyuk L.N., Zvegintsev R.R., Bobrik Yu.V., Chernorotov V.A. Risk factors for the development of resistant arterial hypertension. Clinical review for general practice. 2025; 6 (6): 75–79 (In Russ.). DOI: 10.47407/kr2025.6.6.00633
Введение
Резистентная артериальная гипертензия (АГ) – клинический фенотип, при котором соответствующие меры по модификации образа жизни и лекарственная терапия оптимальными или максимально допустимыми дозами трех препаратов различных классов, включая диуретик, не приводит к достижению показателей артериального давления (АД) <140/90 мм рт. ст., несмотря на засвидетельствованную приверженность к терапии [1]. В общей популяции пациентов с артериальной гипертензией резистентная АГ имеет место в 14,7% случаев [2], ассоциируется с существенным увеличением риска сердечно-сосудистых осложнений, ухудшением прогноза, снижением качества жизни [3, 4] и продолжает оставаться серьезной медико-социальной проблемой во всем мире.Патогенез развития резистентной АГ является сложным, до конца не изученным и включает множество факторов. В настоящее время такими ключевыми факторами признаны избыточная активация симпатоадреналовой системы (САС), реализуемая преимущественно через β-адренорецепторы [5], а также эндотелиальная дисфункция (ЭД) [6], в развитии которой особое значение имеют оксид азота (II) (NO) [7] и эндотелин-1
(ET-1) [8]. Тем не менее исследования, посвященные изучению изменений этих биомаркеров ЭД у пациентов с резистентной АГ, остаются ограниченными и демонстрируют противоречивые результаты [9, 10]. Так, в исследовании N.W. Rajapakse и соавт. [9] у пациентов с резистентной АГ выявлено снижение плазменных уровней NO, сопряженное с показателями АД. Напротив, результаты недавно опубликованного исследования
H.N. Ranasinghe и соавт. [10] показали, что у пациентов с резистентной АГ плазменные уровни NO были значительно выше не только по сравнению с группой здорового контроля, но и по сравнению с пациентами с контролируемой АГ и положительно коррелировали со значениями АД. Кроме того, важно отметить, что предыдущие исследования оценивали уровни ЕТ-1 преимущественно у пациентов с нелеченой или контролируемой АГ, а исследования с участием пациентов с резистентной АГ практически отсутствуют. Несмотря на это, в ряде клинических проектов продемонстрирована эффективность 48-недельной терапии двойным антагонистом рецепторов ЕТ-1 – апроцитентаном – в снижении уровня АГ у пациентов с резистентной АГ [11, 12]. Однако выявленные изменения не были напрямую сопоставлены с уровнями ЕТ-1. Ввиду этого актуальным направлением современных биомедицинских исследований является определение предикторов развития резистентной АГ.
Цель исследования – выявление факторов риска развития резистентной АГ.
Материалы и методы
На базе ГБУЗ РК «Симферопольская городская клиническая больница №7» г. Симферополь в период с 2022 по 2024 г. проведено обследование 50 пациентовс истинно резистентной АГ (основная группа) [женщины – 27 и мужчины – 23, средний возраст 42,5 (39,7; 44,5) года] и 45 пациентов с контролируемой АГ (группа сравнения) [женщины – 25 и мужчины – 20, средний возраст 40,3 (37,4; 43,1) года]. Характеристика пациентов с резистентной АГ и контролируемой АГ отображена в табл.1.

Критериями включения пациентов с резистентной АГ в исследование являлись: возраст от 18 до 45 лет; индекс массы тела в пределах 18,5–24,9 кг/м²; верифицированная истинная резистентная АГ (согласно актуальным национальным рекомендациям [13]), АГ I или II степени тяжести.
Критерии невключения: индекс массы тела <18,5 и >25 кг/м²; вторичные и псевдорезистентные формы АГ, АГ III степени тяжести, клинически выраженные формы ишемической болезни сердца, перенесенный инфаркт миокарда и/или инсульт, хроническая сердечная недостаточность II–IV функциональных классов, нарушения ритма и проводимости сердца, снижение скорости клубочковой фильтрации менее 45 мл/мин/1,73 м², сахарный диабет 1 и 2-го типов, аутоиммунные и онкологические заболевания, а также другая соматическая патология, приводящая к декомпенсации любой системы организма. Также не включались пациенты с синдромом обструктивного апноэ сна, хроническими вирусными инфекциями в течение 6 мес, предшествующих включению в исследование, психическими расстройствами и инсомнией в анамнезе, а также женщины в период беременности и лактации.
Критерии включения в группу сравнения: возраст от 18 до 45 лет; индекс массы тела в пределах 18,5–24,9 кг/м²; I, II степень тяжести АГ.
Критерии невключения были идентичны группе пациентов с резистентной АГ.
У всех пациентов с резистентной и контролируемой АГ произведен забор венозной крови (утром, в интервале с 7:00 до 9:00, натощак после 8–12 ч голодания) для оценки β-адренореактивности эритроцитарных мембран (β-АРМЭ), уровней NO, эндотелина-1 (ЕТ-1), высокочувствительного С-реактивного белка (вч-СРБ), интерлейкина (ИЛ)-6, ИЛ-17 и фактора некроза опухоли (ФНО)-α. Показатель β-АРМЭ определяли в эритроцитах с использованием экспресс-метода, основанного на ингибировании их осмолярной резистентности в присутствии β-адреноблокатора [14], с применением тест-наборов β-АРМЭ-АГАТ («Агат-Мед», Россия). Уровни в плазме крови NO и ET-1 определяли методом иммуноферментного анализа с использованием тест-наборов «ELISA Kit» (FineTest, КНР). Уровень в плазме крови вч-СРБ измеряли посредством метода высокочувствительной иммунонефелометрии с использованием тест-наборов «Dade Behring» (Германия), уровни ИЛ-6, ИЛ-17 и ФНО-α – с помощью твердофазного иммуноферментного метода с использованием тестовых систем «ЗАО Вектор-Бест» (Россия).
Для статистической обработки полученных данных использовался программный пакет Statistica 8.0 (StatSoft Inc., США). Количественные показатели представлены в виде медианы (Ме) с интерквартильным размахом [25-й и 75-й перцентили (%)], качественные – в виде долей и абсолютных значений. Сравнительный анализ количественных данных между группами проводился с использованием U-критерия Манна–Уитни, качественных – с помощью χ2-критерия. Для выявления предикативных факторов формирования резистентной АГ применяли множественный логистический регрессионный анализ. Для анализа отношения шансов (ОШ) и расчета границ 95% доверительного интервала (ДИ) использовалась онлайн-платформа StatTech. Уровень статистической значимости определяли при р<0,05.
Результаты
Результаты сравнения групп пациентов с резистентной и контролируемой АГ по уровням изучаемых биохимических маркеров активности САС, ЭД и системного воспаления, которые теоретически могли повлиять на формирование резистентности к антигипертензивной терапии (АГТ) представлены в табл. 2.
Как видно, в группе пациентов с резистентной АГ по сравнению с группой пациентов с контролируемой АГ уровень β-АРМ был выше в 2,0 раза (р=0,002), ЕТ-1 – в 1,7 раза (р=0,006), ФНО-α – в 5,3 раза (р<0,001), ИЛ-6 – в 2,9 раза (р=0,002) и уровень NO был ниже в 1,6 раза (р=0,028). При этом в группах пациентов с резистентной и контролируемой АГ значения вч-СРБ и ИЛ-17 были сопоставимы (р=0,077 и р=0,073 соответственно).
Выполнен множественный логистический регрессионный анализ по определению факторов, ассоци-ирующихся с развитием резистентной АГ (табл. 3).
Обсуждение
В ходе простого сравнения (однофакторный анализ) групп пациентов с резистентной и контролируемой АГ было установлено, что пациенты с резистентной АГ, помимо закономерно более тяжелого клинического состояния (выражающегося в более высоких уровнях офисного и среднесуточного АД), статистически значимо отличались более высокими показателямиβ-АРМЭ, ЕТ-1, ФНО-α, ИЛ-6 и более низкими значениями NO. Важно отметить, что эти данные получены у пациентов, длительно (более 6 мес) получавших актуальную медикаментозную АГТ при высоком уровне приверженности терапии и соблюдении рекомендаций по модификации образа жизни. С одной стороны, эти факты указывают на более злокачественное течение заболевания у пациентов с резистентной АГ по сравнению с контролируемой АГ, а с другой – свидетельствуют о недостаточной эффективности стандартного алгоритма АГТ в данной группе пациентов.
В рамках нашего исследования, на основании множественного логистического регрессионного анализа, из исходного набора показателей, различающихся между группами резистентной и контролируемой АГ, было установлено 4 независимых ассоциаций с развитием резистентной АГ (в порядке убывания их значимости): показатель β-АРМЭ ≥52,3 усл. ед., психологический стресс при PSM-25 ≥115,3 балла, содержание в крови SOD ≤9,7 ЕД/мл, NO ≤16,7 ммоль/л, ЕТ-1 ≥11,5 пг/мл, ФНО-α ≥4,2 пг/мл, инсомния при ISI ≥16,2 балла.
Доказано, что высокий показатель β-АРМЭ отражает избыточную системную активацию САС [14, 15]. В свете этого мы можем говорить, что наиболее сильным предиктором развития резистентной АГ по нашим результатам является избыточная активация САС. Она увеличивает риск развития резистентной АГ в 5,7 раза. Механизмы, лежащие в основе развития резистентной АГ при стойкой избыточной активации САС, в сущности, объясняются четырьмя группами эффектов, которые, тесно взаимодействуя между собой, создают порочный круг [5]: нейрогуморальные эффекты, в первую очередь за счет активации ренин-ангиотензин-альдостероновой системы; гемодинамические эффекты – в виде аугментации частоты сердечных сокращений и повышения общего периферического сопротивления; сосудистые эффекты с прогрессированием сосудистого ремоделирования сосудистой стенки, ЭД, а также повышением артериальной жесткости; почечные эффекты – чрезмерная секреция норадреналина симпатическими нервными окончаниями, локализованными в почках, повышает активность натрий-хлор-контранспортера в клетках дистальных почечных канальцев и ведет к ингибированию прессорного натрийуреза. Полученные нами данные относительно прогностической роли избыточной активности САС в развитии резистентной АГ были ожидаемы, поскольку в метаанализе, выполненном G. Grassi и соавт. [16] (58 экспериментальных исследований и рандомизированных контролируемых исследований – РКП) и системном обзоре C. Tsioufis и соавт. [17] (88 РКП) также подтверждена роль симпатоадреналового овердрайва в поддержании и прогрессии АГ, вплоть до развития резистентной АГ и поражения органов-мишеней, главным образом сердца и почек. Сопоставимые данные были представлены и в некоторых проектах, выполненных коллективами отечественных ученых. Так, Р.И. Стрюк и И.Г. Длусская [14] показали, что у пациентов с резистентной АГ имеет место прогрессирующее возрастание активности САС не только относительно здоровых лиц, но и результатов, полученных в группе пациентов с контролируемой АГ. И.В. Зюбанова и соавт. [15] продемонстрировали, что ослабление активности САС на ранних сроках после симпатической денервации почечных артерий (ДПА) ассоциировалось со снижением уровней систолического и диастолического АД через 24 нед после хирургического вмешательства, тогда как отсутствие изменений активности САС не приводило к снижению высоких уровней АД. Аналогичные результаты представлены и в исследовании Т.Ю. Ребровой и соавт. [18]: выразительность антигипертензивного эффекта симпатической ДПА была сопряжена со степенью ослабления активности САС. Оценка состояния САС в отечественных работах проводилась также по изменению значения β-АРМ, но у пациентов с длительностью АГ >20 лет, среди которых 70% имели избыточную массу тела.
Кроме того, по нашим данным, низкий уровень NO также оказался значимым фактором, ассоциированным с почти трехкратным увеличением риска развития резистентной АГ. NO представляет собой медиатор эндотелий-зависимой вазодилатации и, по определению, ингибирует выработку вазоконстрикторов (главным образом ангиотензина II и ЕТ-1), адгезию лейкоцитов и агрегацию тромбоцитов, инфильтрацию и пролиферацию гладкомышечных клеток сосудов, поддерживает тонус сосудов и неадгезивность их внутренней поверхности, регулирует воспалительные и противовоспалительные реакции, предотвращает окислительную модификацию липопротеинов низкой плотности [19], что определяет поддержание сосудистого гомеостаза, тогда как дефицит NO вызывает ЭД. В противоположность нашим результатам, в исследовании H.N. Ranasinghe и соавт. [10] высокий уровень NO был связан с резистентностью к АГТ. Объяснением такого контрастирования могут быть различные причины, в частности, отличия в характеристиках изучаемых выборок: исследование коллег характеризовалось высокой гетерогенностью пациентов (по возрасту, индексу массы тела, тяжести и длительности АГ, наличию сопутствующих состояний – сахарный диабет, ожирение, хроническая болезнь почек, статусу курения), что могло привести к определенному смещению полученных результатов. Мы в нашем исследовании эти смещающие факторы устранили. В частности, как мы указывали ранее, наши пациенты были не старше 45 лет с нормальным индексом массы тела (в пределах 18,5–24,9 кг/м²), без коморбидных сердечно-сосудистых заболеваний и других соматических заболеваний, не курили.
Так же, как и в исследовании K. Kostov и соавт. [20], нами выявлена ассоциация высокого уровня ЕТ-1 с развитием резистентной АГ. При этом имеет смысл подчеркнуть, что в вышеупомянутых исследованиях влияние уровней ЕТ-1 на повышение риска развития резистентности к АГТ было продемонстрировано для пациентов пожилого возраста, отягощенным анамнезом по сердечно-сосудистым заболеваниям, а также избыточной массой тела, т.е. относящихся к группе, имеющих традиционные факторы риска резистентной АГ, однако полученные нами результаты продемонстрировали его роль и у пациентов молодого и среднего возраста без традиционных факторов риска резистентной АГ. Созвучность наших данных с результатами ранее проведенных работ свидетельствует об универсальности роли ЕТ-1 в формировании резистентности к медикаментозной АГТ как у пациентов, имеющих факторы риска резистентной АГ, так и без них. Основные механизмы влияния ЕТ-1 на развитие резистентности эксперты объясняют следующими процессами: активацией ангиотензина II и контрактильных реакций сосудов на другие вазоконстрикторы (серотонин и норадреналин), ослаблением натрийуреза [21]; инициацией высвобождения вторичных вазоактивных медиаторов, цитокиновых молекул и факторов роста [22]; прогрессированием нарушения функции эндотелия и ремоделирования резистентных артерий, включая утолщение и потерю эластичности сосудистой стенки; интенсификацией констрикции артерий почечных клубочков с изменением секреции альдостерона, вазопрессина, адреномедулина; усугублением и поддержанием избыточной активности САС [23]. Считаем важным отметить, что в нашем исследовании NO и ET-1 продемонстрировали практически равную значимость в развитии резистентной АГ с показателями ОШ 2,84 и 2,82 соответственно. Эти данные согласуются с известным фактом, что именно симультанное нарушение баланса в системе NO–ET-1 ведет к существенной аугментации вазоконстрикции и усилению пролиферативной активности ET-1, тем самым обеспечивая стойкое повышение АД и резистентность к медикаментозной АГТ [24].
Кроме того, в нашем исследовании высокий уровень ФНО-α (≥4,2 пг/мл) был выявлен как фактор, ассоци-ированный с 2,11-кратным увеличением риска развития резистентной АГ. Актуальность выявленной связи является неоспоримой, поскольку описана впервые и ранее не указывалась. Современные данные свидетельствуют о том, что ФНО-α, кроме выраженного провоспалительного действия, может индуцировать транскрипцию ренина в клетках юкстагломерулярного аппарата почек, а также наращивать чувствительность рецепторов к ангиотензину II, что, в свою очередь, вызывает избыточную активацию САС и повышение АД [25]. Помимо этого, ФНО-α играет важную роль в запуске нейровоспаления, что приводит к повышению тонуса САС на уровне головного мозга и также сопровождается повышением АД [26]. К тому же активизация центров симпатоадреналовой активности центров в головном мозге может происходить как за счет непосредственного диффундирования ФНО-α из системного кровотока через гематоэнцефалический барьер, так и вследствие усиленной локальной продукции этого цитокина клетками микроглии [27]. Нами также установлена статистически значимая прямая взаимосвязь между уровнем ФНО-α и показателем β-АРМЭ. В отличие от N.R. Barbaro и соавт. [27], мы не обнаружили связи ИЛ-6 с риском развития резистентной АГ. Возможно, это несоответствие связано с существенным отличием включенного в исследование коллег контингента пациентов от нашего (1359 пациентов с хронической болезнью почек, 876 курили). Влияние этих факторов может быть существенным, по данным ряда исследований, хроническая болезнь почек и курение тесно связаны с концентрацией ИЛ-6 [28, 29].
Заключение
Риск развития резистентной АГ возрастает при повышении уровней β-АРМЭ, ET-1, ФНО-α и снижении содержания NO.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Гуменюк Леся Николаевна – д-р мед. наук, проф., Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Е-mail: lesya_gymenyuk@mail.ru
Lesya N. Gumenyuk – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: lesya_gymenyuk@mail.ru
Звегинцев Роман Романович – преподаватель, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им.
В.И. Вернадского». Е-mail: romamuse97@gmail.com
Roman R. Zvegintsev – Lecturer, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: romamuse97@gmail.com
Бобрик Юрий Валерьевич – д-р мед. наук, проф. каф. лечебной физкультуры и спортивной медицины и физиотерапии с курсом физического воспитания, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского».
Е-mail: yura.bobrik@mail.ru
Yuri V. Bobrik – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University Е-mail: yura.bobrik@mail.ru
Черноротов Владимир Алексеевич – д-р мед. наук, проф., Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Е-mail: chernorotov.csmu@mail.ru
Vladimir A. Chernorotov – Dr. Sci. (Med.), Prof., Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. Е-mail: chernorotov.csmu@mail.ru
Поступила в редакцию: 10.03.2025
Поступила после рецензирования: 15.03.2025
Принята к публикации: 20.03.2025
Received: 10.03.2025
Revised: 15.03.2025
Accepted: 20.03.2025
Список исп. литературыСкрыть списокСписок литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/