Клинический разбор в общей медицине №6 2025
Julia I. Naimann, Anna I. Olkhovskaya, Darya A. Tyurina, Ivan V. Kuznetsov
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
kaplunovavy@mail.ru
Abstract
Bland–White–Garland syndrome (BWGS) is a relatively rare inborn pathology. The defect is detected in about 1 out of 300 000 a live newborns, which is 0.24–0.46% of all alive newborns. Anomalies in the arising of the coronary arteries may occur more often, causing coronary pathology, including myocardial infarction, and heart failure and sudden cardiac death. At the same time, the world literature describes sporadic cases of BWGS in the elderly. There are four variants of this pathology: anomalous origin of left coronary artery (LCA), right coronary artery (RCA), both coronary arteries or the accessory pulmonary artery. The most common variant is abnormal origin of the LCA – 90%, which, as a rule, branches from the left or posterior sinus of the pulmonary trunk. Abnormal origin of the RCA or both coronary arteries from the pulmonary trunk is less common, in only 10% of cases. With the infantile version of BWGS, counting for 10% of observations, there was an almost 100% mortality rate in children under one year of age. Other types of BWGS can have masks of coronary heart diseases – angina pectoris, myocardial infarction, post myocardial cardiosclerosis, dilated cardiomyopathy, mitral valve prolapse or insufficiency. These patients are characterized by sudden cardiac death, considering a variety of arrhythmias which they may have. The article describes the case of a 60-year-old patient with abnormal anomalous origin of the RCA from the pulmonary trunk, having a mask of coronary artery disease, equivalent to angina pectoris.
Key words: coronary arteries, coronary bed anomalies, Bland–White–Garland syndrome, clinical masks.
For citation: Kaplunova V.Yu., Koblikov V.V., Kondrashin S.A. Kochekaeva S.A., Naimann Yu.I., Olkhovskaya A.I., Tyurina D.A., Kuznetsov I.V. Anomalies of the coronary arteries. Bland–White–Garland syndrome. A clinical case. Clinical review for general practice. 2025; 6 (6): 80–85 (In Russ.). DOI: 10.47407/kr2025.6.6.00634
В 1973 г. F. Gerbode и D. Radtliff впервые продемонстрировали данный порок при выполнении ангиографии [4–7]. В 1976 г. и в 1982 г. появились описания 11 и 23 случаев данной патологии [1, 8]. Наибольший интерес представляет аномальное отхождение ЛКА, так как аномалии отхождения правой и добавочной коронарных артерий (КА), как правило, не сопровождаются ранними и выраженными клиническими проявлениями. Дети с аномальными отхождениями ЛКА нежизнеспособны, формируют инфантильный тип СБУГ [9, 10]. Синдром проходит в своем развитии три основных патофизиологических фазы [3, 10]. Первая фаза характеризуется адекватным кровенаполнением ЛКА за счет высокого кровенаполнения в легочном стволе; вторая фаза – критическая, обусловлена падением давления в легочном стволе и развитием сети анастомозов между ПКА и ветвями ЛКА; третья фаза соответствует стадии сформированных анастомозов. На этом, последнем этапе, создается единая сеть коронарного кровообращения с различными уровнями давления. Так, в ПКА систолическое давление равно давлению в аорте и в несколько раз превышает систолическое давление в ЛКА. Поступающая через анастомозы кровь из ПКА ретроградно идет в ЛКА и затем в ЛА. Таким образом, СБУГ приобретает черты врожденного артериовенозного свища со сбросом крови слева направо. Клинические проявления связаны с фазой снижения давления в ЛА, причем их выраженность зависит от адекватности развивающихся анастомозов, типов кровоснабжения сердца и снижения давления. После рождения ребенка с СБУГ развивается хроническая гипоксия миокарда, связанная с поступлением венозной, мало насыщенной кислородом крови. Дальнейшее развитие заболевания включает формирование очагов некроза, дистрофии миокарда, снижение сократительной способности сердца, дилатацию камер и развитие систолической сердечной недостаточности [8, 10–12, 14–16].
Отмечается крайне низкая распространенность данной аномалии у взрослых, так как большинство детей, имеющих СБУГ с аномалией отхождения ЛКА, умирают в раннем возрасте. Кроме того, СБУГ имеет маски других заболеваний, таких как миокардит, постмиокардитический кардиосклероз, дилатационная кардиомиопатия, пролапс и/или недостаточность митрального клапана, инфаркт миокарда. При этом большое значение имеют методы диагностики, которые позволяют выполнить точную диагностику данной врожденной патологии, к которым относятся коронароангиография и мультиспиральная компьютерная томография, а также магнитно-резонансная томография с гадолинием [3, 11, 12]. Большое значение в диагностике и оценке состояния имеют также эхокардиографическое исследование, рентгенодиагностика, холтеровское мониторирование и стресс-тесты в зависимости от варианта течения и клинических проявлений СБУГ, что позволяет провести более точную диагностику заболевания [10, 13–16].
Как правило, ПКА отходит от передней поверхности легочного ствола, идет, как в нормальном сердце, располагаясь в правой предсердно-желудочковой борозде, отдавая ветви правому желудочку. Артерия тонкостенна, извита и похожа на вену. Однако при гистологическом исследовании, стенка имеет артериальное строение. Нарушения гемодинамики при аномальном отхождении коронарных артерий от ЛА определяются недостаточным снабжением миокарда кровью и зависят от степени развития коллатералей между системами ПКА и ЛКА.
У многих больных и новорожденных коллатерали развиты слабо, что формирует инфантильный тип порока. Во внутриутробном периоде давление и насыщение кислородом крови в аорте и легочном стволе одинаковое. После рождения давление в ЛА падает и через 7–10 дней достигает обычных нормальных цифр для взрослого (25–30 мм рт. ст.). В результате уже через 2 нед после рождения ребенка миокард, снабжаемый одной коронарной артерией, получает венозную кровь под низким давлением в бассейн аномально отходящей от легочного ствола артерии. Наступает резкое ухудшение состояния новорожденного, обусловленное плохим кровоснабжением зоны миокарда. Развивается тяжелая ишемия зоны миокарда, снабжаемой данной артерией. Это первая фаза нарушения гемодинамики. Как показал N. Talner [1, 10], на этом этапе кровь еще может поступать из легочного ствола в коронарную артерию. При инфантильном типе порока у новорожденного ишемия возникает на 7–8 нед после рождения [10].
Существовали разнообразные операции по хирургической коррекции данного порока. Первоначально коррекция заключалась в перевязке аномально отходящей артерии. Впервые подобную операцию выполнил D. Sabiston в 1960 г. В нашей стране данную операцию выполнил В.И. Бураковский в 1974 г. В дальнейшем были разработаны методики коррекции данного порока, создающие более адекватное кровоснабжение миокарда: транслокация устья коронарной артерии в аорту. Существует прямая и непрямая методика данных вмешательств. Прямая методика заключается во вшивании устья аномальной коронарной артерии в аорту, которая впервые была выполнена R. Grace с соавторами в 1977 г. Техника «drap-door», предложенная T. Katsumata и соавторами в 1999 г., позволяет увеличить длину транслоцируемой артерии. Непрямая методика: выполнение аортокоронарного шунтирования с использованием аутовены или протеза, примененная D. Gooley в 1996 г., а в нашей стране И.И. Бураковским в 1974 г.; с использованием подключичной артерии, выполненное Meyer в 1968 г. и Алекси-Месхишвили в 1985 г.; формирование внутрилегочного тоннеля, предложенное J. Takenchi и соавт. в 1974 г. Таким образом, хирургическое лечение данного порока и в настоящее время является единственным эффективным методом лечения [9, 17–21]. Степень дооперационного поражения миокарда значительно влияет на послеоперационный прогноз [22, 23].
Из анамнеза жизни известно: родилась в 1964 г., ДНР. Росла и развивалась соответственно полу и возрасту. Имеет среднее образование, работала до 50 лет медицинской сестрой. На данный момент не курит в течение 8 лет (ранее курила 2–3 года по 8 сигарет в день). Алкоголь не употребляет более 10 лет. Употребление наркотиков отрицает. Имеет ряд хронических заболеваний: язвенная болезнь желудка и луковицы 12-перстной кишки (кровотечение из язв в 2000 и 2021 г.), мочекаменная болезнь (МКБ), было проведено закрытие Боталлова протока и тонзилэктомия в 8 лет. Аллергический анамнез не отягощен. Отец умер в 71 год от аритмии, мать умерла в 79 лет из-за непроходимости кишечника. Менструации с 12 лет, регулярные, безболезненные. Беременности – 10. Роды – 3. Аборты – 7. Гинекологические заболевания – фибромиома, операций не проводилось. Поступила в состоянии средней степени тяжести, в ясном сознании, ориентировалась в пространстве, времени и собственной личности. Рост составляет 170 см, масса тела – 100 кг, индекс массы тела – 34,1 кг/м2 (ожирение 1-й степени). Температура тела – 36 °С. Кожные покровы бледно-розовые, отмечаются пастозность и отеки голеней, сосудистые сеточки на бедрах. Дыхание везикулярное, хрипы отсутствуют, частота дыхательных движений – 16 в мин, SpO2 – 99%. Тоны сердца приглушены; шумов нет, частота сердечных сокращений (ЧСС) – 65 уд/мин, АД – 115/75 мм рт. ст. Живот при пальпации мягкий, безболезненный, мочеиспускание свободное, безболезненное.
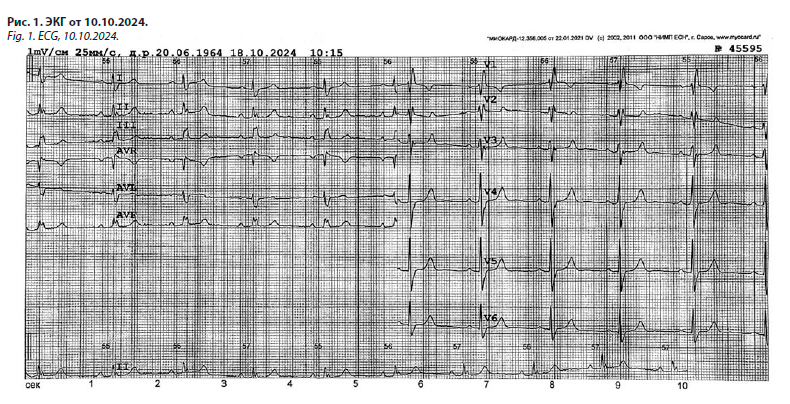
ЭКГ от 10.10.2024: синусовый ритм, ЧСС – 68 в мин. Полная блокада правой ножки пучка Гиса. Нарушение процессов реполяризации по передне-септальной стенке в виде двухфазных Т зубцов (рис. 1).
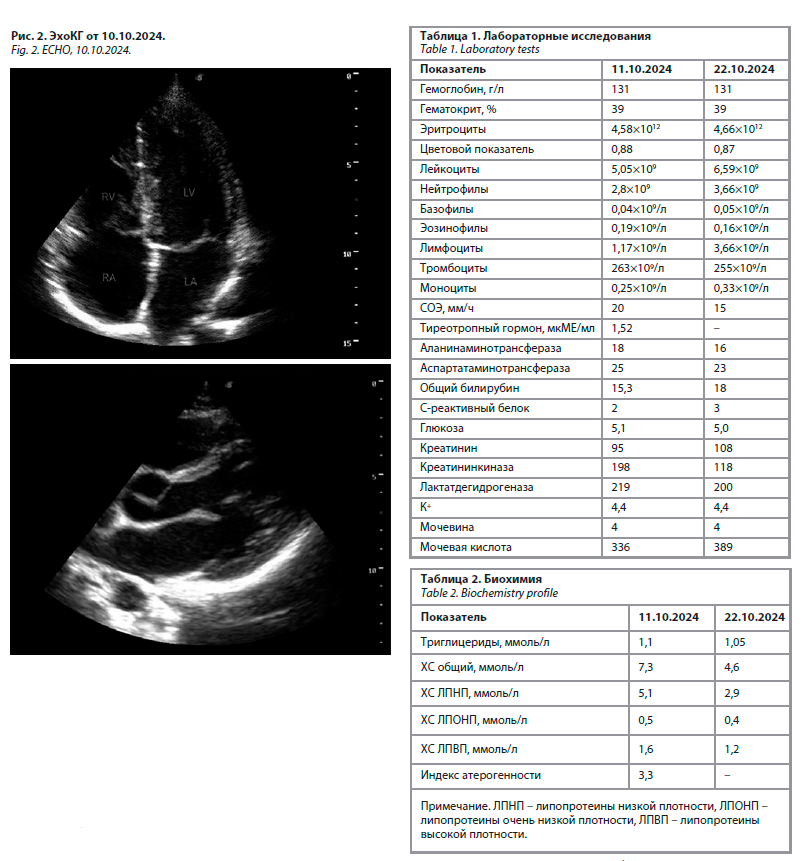
Заключение ЭхоКГ: полости сердца не расширены; аортальная регургитация до 1-й степени; локальная и глобальная сократимость левого желудочка не нарушены; диастолической дисфункции нет; фракция выброса левого желудочка 68% (рис. 2).
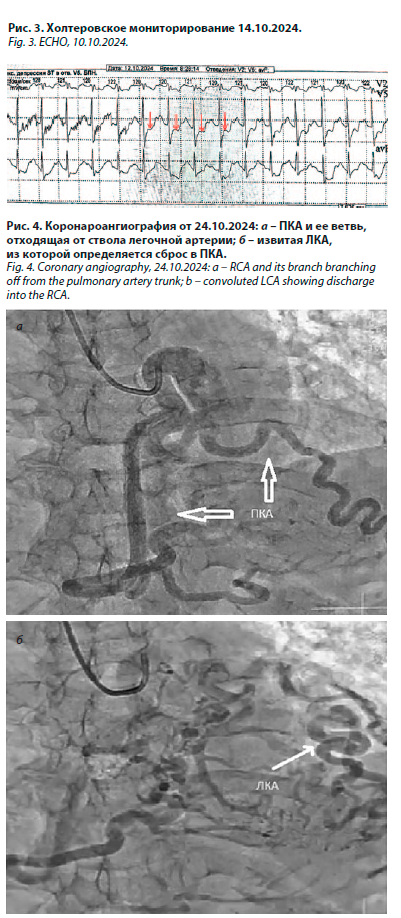 Проведено холтеровское мониторирование 14.10.2024 (рис. 3). Заключение: основной ритм – синусовый; всего выявлено 62 желудочковых экстрасистол; пауз ритма от 2 с нет. Замедление AV проводимости. PQ до 0,23 с. На фоне синусовой тахикардии при ЧСС свыше 102 в мин зарегистрированы 9 эпизодов депрессии сегмента ST по V5 отв. до 2,1 мм длительностью от 1 до 7 мин 45 с. В период депрессии сегмента ST появляются жалобы на одышку.
Проведено холтеровское мониторирование 14.10.2024 (рис. 3). Заключение: основной ритм – синусовый; всего выявлено 62 желудочковых экстрасистол; пауз ритма от 2 с нет. Замедление AV проводимости. PQ до 0,23 с. На фоне синусовой тахикардии при ЧСС свыше 102 в мин зарегистрированы 9 эпизодов депрессии сегмента ST по V5 отв. до 2,1 мм длительностью от 1 до 7 мин 45 с. В период депрессии сегмента ST появляются жалобы на одышку.
Результаты мониторирования от 14.10.2024: систолическое АД (САД) ср. дн. – 113 мм рт. ст., диастолическое АД (ДАД) ср. дн. – 75 мм рт. ст., САД ср. н. – 104 мм рт. ст., ДАД ср. н. – 73 мм рт. ст. Вариабельность АД по САД и ДАД в норме. ЧСС ср. дн. – 82 в мин, ЧСС ср. н. – 63 в мин.
По данным лабораторного исследования выявлены: дислипидемия 2-го типа, снижение скорости клубочковой фильтрации, соответствующая хронической болезни почек 3А стадии (табл. 1, 2).
NT-pro BN – 199 пг/мл, СКФ 48 мл/мин – ХБП С3а.
Коронароангиография (лучевой доступ) от 24.10.2024 (рис. 4). Заключение: тип кровоснабжения левый; выраженное расширение коронарных артерий; при контрастировании ЛКА заполняются передняя межжелудочковая артерия, огибающая артерия, далее по коллатералям контрастируют ПКА и ее ветви. Гемодинамически значимых стенозов не выявлено.
Развернутый клинический диагноз. Основное заболевание: синдром Бланда–Уайта–Гарланда. Эквиваленты стенокардии II–III функционального класса. Закрытие Боталлова протока в 1972 г. Нарушение проводимости сердца: полная блокада правой ножки пучка Гиса, преходящая AV-блокада 1-й степени. Сопутствующие: дислипидемия, атеросклероз аорты, ожирение 1-й степени, МКБ в анамнезе, кисты левой почки, хроническая болезнь почек С3А, язвенная болезнь желудка и 12-перстной кишки, вне обострения, хронический геморрой, остеохондроз шейно-грудного отдела позвоночника.
Пациентка направлена на консультацию в ФГБУ «Федеральный научный центр трансплантологии искусственных органов им. акад. В.И. Шумакова» для решения вопроса о проведении хирургической коррекции коронарного кровотока. В плановом порядке назначена консультация гастроэнтеролога, учитывая анамнез и предстоящее хирургическое вмешательство.
Проводится медикаментозная терапия: бисопролол (Конкор) – 2,5 мг утром под контролем ЧСС, ацетилсалициловая кислота (Тромбо АСС) – 100 мг вечером после ужина, омепразол 20 мг вечером, аторвастатин 40 мг вечером под контролем липидного спектра. Контроль уровня печеночных ферментов (аланинаминотрансфераза, аспартатаминотрансфераза, креатинфосфокиназа) через 1,3 мес, далее 1 раз вгод при достижении целевых значений общего ХС и ЛПНП (целевые значения общего ХС – менее 4,0 ммоль/л, ЛПНП – менее 2,6 ммоль/л).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Каплунова Вера Юрьевна – д-р мед. наук, проф. каф. госпитальной терапии №1 Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: kaplunovavy@mail.ru. SPIN-код: 5326-7363; ORCID: 0000-0002-5864-0938
Vera Yu. Kaplunova – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: kaplunovavy@mail.ru. SPIN code: 5326-7363; ORCID: 0000-0002-5864-0938
Кобликов Василий Владимирович – ассистент каф. лучевой диагностики и лучевой терапии Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). SPIN-код: 5221-0523; ORCID: 0000-0002-9661-8686.
Vasily V. Koblikov – Assistant, Sechenov First Moscow State Medical University (Sechenov University). SPIN code: 5221-0523; ORCID: 0000-0002-9661-8686
Кондрашин Сергей Алексеевич – д-р мед. наук, проф. каф. лучевой диагностики и лучевой терапии Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им.
И.М. Сеченова» (Сеченовский Университет). ORCID: 0000-0002-3492-9446
Sergey A. Kondrashin – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0002-3492-9446
Кочекаева Светлана Александровна – врач-кардиолог отд-ния кардиологии №1 Института клинической медицины (ИКМ) им.
Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0007-2716-2383
Svetlana A. Kochekaeva – Cardiologist, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0007-2716-2383
Найманн Юлия Игоревна – канд. мед. наук, зав. отд-нием кардиологии №1 Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0000-0003-4099-1033
Julia I. Naimann – Cand. Sci. (Med.), Head of the Cardiology Department No. 1., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0003-4099-1033
Ольховская Анна Игоревна – студентка 4-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0007-4037-409Х
Anna I. Olkhovskaya – 4th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0007-4037-409Х
Тюрина Дарья Александровна – студентка 6-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0006-9295-1891
Darya A. Tyurina – 6th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0006-9295-1891
Кузнецов Иван Вадимович – студент 5-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0005-9785-5949
Ivan V. Kuznetsov – 5th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-00059785-5949
Поступила в редакцию: 14.04.2025
Поступила после рецензирования: 17.04.2025
Принята к публикации: 22.05.2025
Received: 14.04.2025
Revised: 17.04.2025
Accepted: 22.05.2025
Клинический разбор в общей медицине №6 2025
Аномалии коронарных артерий. Синдром Бланда–Уайта–Гарланда. Клинический случай
Номера страниц в выпуске:80-85
Аннотация
Синдром Бланда–Уайта–Гарланда (СБУГ) относительно редкая врожденная патология. Порок выявляют примерно у 1 из 300 тыс. живых новорожденных, что составляет 0,24–0,46% всех живых новорожденных. Аномалии отхождения коронарных артерий могут встречаться чаще, являясь причиной коронарной патологии, в том числе инфаркта миокарда, сердечной недостаточности и внезапной сердечной смерти. При этом в мировой литературе описаны единичные случаи наблюдений СБУГ в пожилом возрасте. Различают четыре варианта этой аномалии: отхождения левой, правой, обеих коронарных артерий или добавочной от легочной артерии. Наиболее часто встречается аномальное отхождение левой коронарной артерии – 90%, которая, как правило, отходит от левого или заднего синуса легочного ствола. Реже встречается аномальное отхождение правой коронарной артерии или обеих коронарных артерий от легочной артерии, всего 10% случаев. При инфантильном варианте СБУГ, составляющем 10% наблюдений, отмечена практически стопроцентная смертность у детей до года. При остальных вариантах СБУГ возможны маски ишемической болезни сердца – стенокардии, инфаркта миокарда, постмиокардитического кардиосклероза, дилатационной кардиомиопатии, пролапса/недостаточности митрального клапана. Для этих пациентов характерна внезапная сердечная смерть, учитывая разнообразные аритмии. В статье описан случай пациентки П., 60 лет, с аномальным отхождением правой коронарной артерии от легочного ствола, имеющей маску ишемической болезни сердца, эквивалентной стенокардии.
Ключевые слова: коронарные артерии, аномалии коронарного русла, синдром Бланда–Уайта–Гарланда, клинические маски.
Для цитирования: Каплунова В.Ю., Кобликов В.В., Кондрашин С.А., Кочекаева С.А., Найманн Ю.И., Ольховская А.И., Тюрина Д.А., Кузнецов И.В. Аномалии коронарных артерий. Синдром Бланда–Уайта–Гарланда. Клинический разбор в общей медицине. 2025; 6 (6): 80–85. DOI: 10.47407/kr2025.6.6.00634
Синдром Бланда–Уайта–Гарланда (СБУГ) относительно редкая врожденная патология. Порок выявляют примерно у 1 из 300 тыс. живых новорожденных, что составляет 0,24–0,46% всех живых новорожденных. Аномалии отхождения коронарных артерий могут встречаться чаще, являясь причиной коронарной патологии, в том числе инфаркта миокарда, сердечной недостаточности и внезапной сердечной смерти. При этом в мировой литературе описаны единичные случаи наблюдений СБУГ в пожилом возрасте. Различают четыре варианта этой аномалии: отхождения левой, правой, обеих коронарных артерий или добавочной от легочной артерии. Наиболее часто встречается аномальное отхождение левой коронарной артерии – 90%, которая, как правило, отходит от левого или заднего синуса легочного ствола. Реже встречается аномальное отхождение правой коронарной артерии или обеих коронарных артерий от легочной артерии, всего 10% случаев. При инфантильном варианте СБУГ, составляющем 10% наблюдений, отмечена практически стопроцентная смертность у детей до года. При остальных вариантах СБУГ возможны маски ишемической болезни сердца – стенокардии, инфаркта миокарда, постмиокардитического кардиосклероза, дилатационной кардиомиопатии, пролапса/недостаточности митрального клапана. Для этих пациентов характерна внезапная сердечная смерть, учитывая разнообразные аритмии. В статье описан случай пациентки П., 60 лет, с аномальным отхождением правой коронарной артерии от легочного ствола, имеющей маску ишемической болезни сердца, эквивалентной стенокардии.
Ключевые слова: коронарные артерии, аномалии коронарного русла, синдром Бланда–Уайта–Гарланда, клинические маски.
Для цитирования: Каплунова В.Ю., Кобликов В.В., Кондрашин С.А., Кочекаева С.А., Найманн Ю.И., Ольховская А.И., Тюрина Д.А., Кузнецов И.В. Аномалии коронарных артерий. Синдром Бланда–Уайта–Гарланда. Клинический разбор в общей медицине. 2025; 6 (6): 80–85. DOI: 10.47407/kr2025.6.6.00634
Anomalies of the coronary arteries. Bland–White–Garland syndrome. A clinical case
Vera Yu. Kaplunova, Vasily V. Koblikov, Sergey A. Kondrashin, Svetlana A. Kochekaeva,Julia I. Naimann, Anna I. Olkhovskaya, Darya A. Tyurina, Ivan V. Kuznetsov
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
kaplunovavy@mail.ru
Abstract
Bland–White–Garland syndrome (BWGS) is a relatively rare inborn pathology. The defect is detected in about 1 out of 300 000 a live newborns, which is 0.24–0.46% of all alive newborns. Anomalies in the arising of the coronary arteries may occur more often, causing coronary pathology, including myocardial infarction, and heart failure and sudden cardiac death. At the same time, the world literature describes sporadic cases of BWGS in the elderly. There are four variants of this pathology: anomalous origin of left coronary artery (LCA), right coronary artery (RCA), both coronary arteries or the accessory pulmonary artery. The most common variant is abnormal origin of the LCA – 90%, which, as a rule, branches from the left or posterior sinus of the pulmonary trunk. Abnormal origin of the RCA or both coronary arteries from the pulmonary trunk is less common, in only 10% of cases. With the infantile version of BWGS, counting for 10% of observations, there was an almost 100% mortality rate in children under one year of age. Other types of BWGS can have masks of coronary heart diseases – angina pectoris, myocardial infarction, post myocardial cardiosclerosis, dilated cardiomyopathy, mitral valve prolapse or insufficiency. These patients are characterized by sudden cardiac death, considering a variety of arrhythmias which they may have. The article describes the case of a 60-year-old patient with abnormal anomalous origin of the RCA from the pulmonary trunk, having a mask of coronary artery disease, equivalent to angina pectoris.
Key words: coronary arteries, coronary bed anomalies, Bland–White–Garland syndrome, clinical masks.
For citation: Kaplunova V.Yu., Koblikov V.V., Kondrashin S.A. Kochekaeva S.A., Naimann Yu.I., Olkhovskaya A.I., Tyurina D.A., Kuznetsov I.V. Anomalies of the coronary arteries. Bland–White–Garland syndrome. A clinical case. Clinical review for general practice. 2025; 6 (6): 80–85 (In Russ.). DOI: 10.47407/kr2025.6.6.00634
Введение
Синдром Бланда–Уайта–Гарланда (СБУГ) – относительно редкая врожденная патология. Порок выявляют примерно у 1 из 300 тыс. живых новорожденных, что составляет 0,24–0,46% всех живых новорожденных. Некоторые авторы считают, что аномалии отхождения коронарных артерий встречаются чаще, являясь причиной коронарной патологии, инфаркта миокарда, сердечной недостаточности и внезапной сердечной смерти детей первого года жизни. В мировой литературе описаны единичные случаи наблюдений СБУГ в пожилом возрасте. Эмбриогенез аномального отхождения левой коронарной артерии (ЛКА) от легочной артерии (ЛА) пока не ясен. Различают четыре варианта этой аномалии: отхождения левой, правой, обеих коронарных артерии или добавочной от ЛА. Наиболее часто встречается аномальное отхождение ЛКА, которая, как правило, отходит от левого или заднего синуса легочного ствола. Реже встречается отхождение правой коронарной артерии (ПКА) или обеих коронарных артерий, всего 10%. Описаны единичные случаи изолированного отхождения стволов двух артерий от аорты. Данные о пороке впервые были описаны в 1886 г. J. Brooks как случайная находка при вскрытии у двух взрослых, не имеющих заболеваний сердца [1, 2]. В 1911 г. особенности анатомии венечных сосудов при данной патологии исследовал А.И. Абрикосов. В 1933 г. американские кардиологи Е. Бланд (Edward Franklin Bland), П. Уайт (Paul Dudley White) и Й. Гарланд (Joseph Garland) подробно описали клинические и электрокардиографические признаки данной патологии [1–4]. Последующие описания порока были только как случайные находки.В 1973 г. F. Gerbode и D. Radtliff впервые продемонстрировали данный порок при выполнении ангиографии [4–7]. В 1976 г. и в 1982 г. появились описания 11 и 23 случаев данной патологии [1, 8]. Наибольший интерес представляет аномальное отхождение ЛКА, так как аномалии отхождения правой и добавочной коронарных артерий (КА), как правило, не сопровождаются ранними и выраженными клиническими проявлениями. Дети с аномальными отхождениями ЛКА нежизнеспособны, формируют инфантильный тип СБУГ [9, 10]. Синдром проходит в своем развитии три основных патофизиологических фазы [3, 10]. Первая фаза характеризуется адекватным кровенаполнением ЛКА за счет высокого кровенаполнения в легочном стволе; вторая фаза – критическая, обусловлена падением давления в легочном стволе и развитием сети анастомозов между ПКА и ветвями ЛКА; третья фаза соответствует стадии сформированных анастомозов. На этом, последнем этапе, создается единая сеть коронарного кровообращения с различными уровнями давления. Так, в ПКА систолическое давление равно давлению в аорте и в несколько раз превышает систолическое давление в ЛКА. Поступающая через анастомозы кровь из ПКА ретроградно идет в ЛКА и затем в ЛА. Таким образом, СБУГ приобретает черты врожденного артериовенозного свища со сбросом крови слева направо. Клинические проявления связаны с фазой снижения давления в ЛА, причем их выраженность зависит от адекватности развивающихся анастомозов, типов кровоснабжения сердца и снижения давления. После рождения ребенка с СБУГ развивается хроническая гипоксия миокарда, связанная с поступлением венозной, мало насыщенной кислородом крови. Дальнейшее развитие заболевания включает формирование очагов некроза, дистрофии миокарда, снижение сократительной способности сердца, дилатацию камер и развитие систолической сердечной недостаточности [8, 10–12, 14–16].
Отмечается крайне низкая распространенность данной аномалии у взрослых, так как большинство детей, имеющих СБУГ с аномалией отхождения ЛКА, умирают в раннем возрасте. Кроме того, СБУГ имеет маски других заболеваний, таких как миокардит, постмиокардитический кардиосклероз, дилатационная кардиомиопатия, пролапс и/или недостаточность митрального клапана, инфаркт миокарда. При этом большое значение имеют методы диагностики, которые позволяют выполнить точную диагностику данной врожденной патологии, к которым относятся коронароангиография и мультиспиральная компьютерная томография, а также магнитно-резонансная томография с гадолинием [3, 11, 12]. Большое значение в диагностике и оценке состояния имеют также эхокардиографическое исследование, рентгенодиагностика, холтеровское мониторирование и стресс-тесты в зависимости от варианта течения и клинических проявлений СБУГ, что позволяет провести более точную диагностику заболевания [10, 13–16].
Как правило, ПКА отходит от передней поверхности легочного ствола, идет, как в нормальном сердце, располагаясь в правой предсердно-желудочковой борозде, отдавая ветви правому желудочку. Артерия тонкостенна, извита и похожа на вену. Однако при гистологическом исследовании, стенка имеет артериальное строение. Нарушения гемодинамики при аномальном отхождении коронарных артерий от ЛА определяются недостаточным снабжением миокарда кровью и зависят от степени развития коллатералей между системами ПКА и ЛКА.
У многих больных и новорожденных коллатерали развиты слабо, что формирует инфантильный тип порока. Во внутриутробном периоде давление и насыщение кислородом крови в аорте и легочном стволе одинаковое. После рождения давление в ЛА падает и через 7–10 дней достигает обычных нормальных цифр для взрослого (25–30 мм рт. ст.). В результате уже через 2 нед после рождения ребенка миокард, снабжаемый одной коронарной артерией, получает венозную кровь под низким давлением в бассейн аномально отходящей от легочного ствола артерии. Наступает резкое ухудшение состояния новорожденного, обусловленное плохим кровоснабжением зоны миокарда. Развивается тяжелая ишемия зоны миокарда, снабжаемой данной артерией. Это первая фаза нарушения гемодинамики. Как показал N. Talner [1, 10], на этом этапе кровь еще может поступать из легочного ствола в коронарную артерию. При инфантильном типе порока у новорожденного ишемия возникает на 7–8 нед после рождения [10].
Существовали разнообразные операции по хирургической коррекции данного порока. Первоначально коррекция заключалась в перевязке аномально отходящей артерии. Впервые подобную операцию выполнил D. Sabiston в 1960 г. В нашей стране данную операцию выполнил В.И. Бураковский в 1974 г. В дальнейшем были разработаны методики коррекции данного порока, создающие более адекватное кровоснабжение миокарда: транслокация устья коронарной артерии в аорту. Существует прямая и непрямая методика данных вмешательств. Прямая методика заключается во вшивании устья аномальной коронарной артерии в аорту, которая впервые была выполнена R. Grace с соавторами в 1977 г. Техника «drap-door», предложенная T. Katsumata и соавторами в 1999 г., позволяет увеличить длину транслоцируемой артерии. Непрямая методика: выполнение аортокоронарного шунтирования с использованием аутовены или протеза, примененная D. Gooley в 1996 г., а в нашей стране И.И. Бураковским в 1974 г.; с использованием подключичной артерии, выполненное Meyer в 1968 г. и Алекси-Месхишвили в 1985 г.; формирование внутрилегочного тоннеля, предложенное J. Takenchi и соавт. в 1974 г. Таким образом, хирургическое лечение данного порока и в настоящее время является единственным эффективным методом лечения [9, 17–21]. Степень дооперационного поражения миокарда значительно влияет на послеоперационный прогноз [22, 23].
Клиническое наблюдение
Больная П., 60 лет, госпитализирована в отделение кардиологии с жалобами на одышку при средних физических нагрузках – подъем на 2-й этаж, редкое неритмичное сердцебиение, подъемы артериального давления (АД) до 150/90 мм рт. ст., общую слабость, умеренные отеки голеней и стоп во второй половине дня. Из анамнеза заболевания известно, что в 8-летнем возрасте проведено оперативное вмешательство – закрытие Боталлова протока. Сохранялось удовлетворительное самочувствие. В 18 лет (1982 г.) первая беременность и роды, затем еще две беременности и роды без осложнений. Дети здоровы. В 52 года (2022 г.) – COVID, после чего появляются вышеперечисленные жалобы, пациентка обращается к врачам. В анализах крови – дислипидемия 2-го типа. На догоспитальном этапе назначена терапия: перинева 2 мг, верошпирон 25 мг, розувастатин 10 мг, кардиомагнил 75 мг, с нестойким эффектом. Сохранялись одышка при средних физических нагрузках и слабость. На электрокардиографии (ЭКГ) полная блокада правой ножки пучка Гиса. Для дальнейшего обследования была направлена в отделение кардиологии №1.Из анамнеза жизни известно: родилась в 1964 г., ДНР. Росла и развивалась соответственно полу и возрасту. Имеет среднее образование, работала до 50 лет медицинской сестрой. На данный момент не курит в течение 8 лет (ранее курила 2–3 года по 8 сигарет в день). Алкоголь не употребляет более 10 лет. Употребление наркотиков отрицает. Имеет ряд хронических заболеваний: язвенная болезнь желудка и луковицы 12-перстной кишки (кровотечение из язв в 2000 и 2021 г.), мочекаменная болезнь (МКБ), было проведено закрытие Боталлова протока и тонзилэктомия в 8 лет. Аллергический анамнез не отягощен. Отец умер в 71 год от аритмии, мать умерла в 79 лет из-за непроходимости кишечника. Менструации с 12 лет, регулярные, безболезненные. Беременности – 10. Роды – 3. Аборты – 7. Гинекологические заболевания – фибромиома, операций не проводилось. Поступила в состоянии средней степени тяжести, в ясном сознании, ориентировалась в пространстве, времени и собственной личности. Рост составляет 170 см, масса тела – 100 кг, индекс массы тела – 34,1 кг/м2 (ожирение 1-й степени). Температура тела – 36 °С. Кожные покровы бледно-розовые, отмечаются пастозность и отеки голеней, сосудистые сеточки на бедрах. Дыхание везикулярное, хрипы отсутствуют, частота дыхательных движений – 16 в мин, SpO2 – 99%. Тоны сердца приглушены; шумов нет, частота сердечных сокращений (ЧСС) – 65 уд/мин, АД – 115/75 мм рт. ст. Живот при пальпации мягкий, безболезненный, мочеиспускание свободное, безболезненное.
ЭКГ от 10.10.2024: синусовый ритм, ЧСС – 68 в мин. Полная блокада правой ножки пучка Гиса. Нарушение процессов реполяризации по передне-септальной стенке в виде двухфазных Т зубцов (рис. 1).

Заключение ЭхоКГ: полости сердца не расширены; аортальная регургитация до 1-й степени; локальная и глобальная сократимость левого желудочка не нарушены; диастолической дисфункции нет; фракция выброса левого желудочка 68% (рис. 2).

 Проведено холтеровское мониторирование 14.10.2024 (рис. 3). Заключение: основной ритм – синусовый; всего выявлено 62 желудочковых экстрасистол; пауз ритма от 2 с нет. Замедление AV проводимости. PQ до 0,23 с. На фоне синусовой тахикардии при ЧСС свыше 102 в мин зарегистрированы 9 эпизодов депрессии сегмента ST по V5 отв. до 2,1 мм длительностью от 1 до 7 мин 45 с. В период депрессии сегмента ST появляются жалобы на одышку.
Проведено холтеровское мониторирование 14.10.2024 (рис. 3). Заключение: основной ритм – синусовый; всего выявлено 62 желудочковых экстрасистол; пауз ритма от 2 с нет. Замедление AV проводимости. PQ до 0,23 с. На фоне синусовой тахикардии при ЧСС свыше 102 в мин зарегистрированы 9 эпизодов депрессии сегмента ST по V5 отв. до 2,1 мм длительностью от 1 до 7 мин 45 с. В период депрессии сегмента ST появляются жалобы на одышку. Результаты мониторирования от 14.10.2024: систолическое АД (САД) ср. дн. – 113 мм рт. ст., диастолическое АД (ДАД) ср. дн. – 75 мм рт. ст., САД ср. н. – 104 мм рт. ст., ДАД ср. н. – 73 мм рт. ст. Вариабельность АД по САД и ДАД в норме. ЧСС ср. дн. – 82 в мин, ЧСС ср. н. – 63 в мин.
По данным лабораторного исследования выявлены: дислипидемия 2-го типа, снижение скорости клубочковой фильтрации, соответствующая хронической болезни почек 3А стадии (табл. 1, 2).
NT-pro BN – 199 пг/мл, СКФ 48 мл/мин – ХБП С3а.
Коронароангиография (лучевой доступ) от 24.10.2024 (рис. 4). Заключение: тип кровоснабжения левый; выраженное расширение коронарных артерий; при контрастировании ЛКА заполняются передняя межжелудочковая артерия, огибающая артерия, далее по коллатералям контрастируют ПКА и ее ветви. Гемодинамически значимых стенозов не выявлено.
Развернутый клинический диагноз. Основное заболевание: синдром Бланда–Уайта–Гарланда. Эквиваленты стенокардии II–III функционального класса. Закрытие Боталлова протока в 1972 г. Нарушение проводимости сердца: полная блокада правой ножки пучка Гиса, преходящая AV-блокада 1-й степени. Сопутствующие: дислипидемия, атеросклероз аорты, ожирение 1-й степени, МКБ в анамнезе, кисты левой почки, хроническая болезнь почек С3А, язвенная болезнь желудка и 12-перстной кишки, вне обострения, хронический геморрой, остеохондроз шейно-грудного отдела позвоночника.
Пациентка направлена на консультацию в ФГБУ «Федеральный научный центр трансплантологии искусственных органов им. акад. В.И. Шумакова» для решения вопроса о проведении хирургической коррекции коронарного кровотока. В плановом порядке назначена консультация гастроэнтеролога, учитывая анамнез и предстоящее хирургическое вмешательство.
Проводится медикаментозная терапия: бисопролол (Конкор) – 2,5 мг утром под контролем ЧСС, ацетилсалициловая кислота (Тромбо АСС) – 100 мг вечером после ужина, омепразол 20 мг вечером, аторвастатин 40 мг вечером под контролем липидного спектра. Контроль уровня печеночных ферментов (аланинаминотрансфераза, аспартатаминотрансфераза, креатинфосфокиназа) через 1,3 мес, далее 1 раз вгод при достижении целевых значений общего ХС и ЛПНП (целевые значения общего ХС – менее 4,0 ммоль/л, ЛПНП – менее 2,6 ммоль/л).
Заключение
Представленное нами клиническое наблюдение свидетельствует о трудностях диагностики СБУГ и более благоприятном течении СБУГ при аномалии отхождения ПКА, о наличии масок заболевания (в данном случае маска – ишемическая болезнь сердца, эквивалент стенокардии), а также о необходимости проведения хирургической коррекции коронарного кровотока, как единственной адекватной методике лечения СБУГ.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Каплунова Вера Юрьевна – д-р мед. наук, проф. каф. госпитальной терапии №1 Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: kaplunovavy@mail.ru. SPIN-код: 5326-7363; ORCID: 0000-0002-5864-0938
Vera Yu. Kaplunova – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: kaplunovavy@mail.ru. SPIN code: 5326-7363; ORCID: 0000-0002-5864-0938
Кобликов Василий Владимирович – ассистент каф. лучевой диагностики и лучевой терапии Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). SPIN-код: 5221-0523; ORCID: 0000-0002-9661-8686.
Vasily V. Koblikov – Assistant, Sechenov First Moscow State Medical University (Sechenov University). SPIN code: 5221-0523; ORCID: 0000-0002-9661-8686
Кондрашин Сергей Алексеевич – д-р мед. наук, проф. каф. лучевой диагностики и лучевой терапии Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им.
И.М. Сеченова» (Сеченовский Университет). ORCID: 0000-0002-3492-9446
Sergey A. Kondrashin – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0002-3492-9446
Кочекаева Светлана Александровна – врач-кардиолог отд-ния кардиологии №1 Института клинической медицины (ИКМ) им.
Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0007-2716-2383
Svetlana A. Kochekaeva – Cardiologist, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0007-2716-2383
Найманн Юлия Игоревна – канд. мед. наук, зав. отд-нием кардиологии №1 Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0000-0003-4099-1033
Julia I. Naimann – Cand. Sci. (Med.), Head of the Cardiology Department No. 1., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0003-4099-1033
Ольховская Анна Игоревна – студентка 4-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0007-4037-409Х
Anna I. Olkhovskaya – 4th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0007-4037-409Х
Тюрина Дарья Александровна – студентка 6-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0006-9295-1891
Darya A. Tyurina – 6th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-0006-9295-1891
Кузнецов Иван Вадимович – студент 5-го курса, лечебного факультета Института клинической медицины (ИКМ) им. Н.В. Склифосовского, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). ORCID: 0009-0005-9785-5949
Ivan V. Kuznetsov – 5th year student, Sechenov First Moscow State Medical University (Sechenov University).
ORCID: 0009-00059785-5949
Поступила в редакцию: 14.04.2025
Поступила после рецензирования: 17.04.2025
Принята к публикации: 22.05.2025
Received: 14.04.2025
Revised: 17.04.2025
Accepted: 22.05.2025
Список исп. литературыСкрыть список1. Ishihata T, Takeda H, Katohno E et al. An adult case of Bland–White–Garland syndrome with collaterals from the bronchial artery. Heart Vessels 1994;9:218-22.
2. Brijesh P, Kottayil M, Karunakaran J et al. Anomalous Origin of Left Coronary Artery From Pulmonary Artery in Older Children and Adults: Direct Aortic Implantation. Ann Thorac Surg 2011;91:549-53.
3. Cowles RA, Berdon WE. Bland–White–Garland syndrome of anomalous left coronary artery arising from the pulmonary artery (ALCAPA). A historical review. Pediatr Radiol 2007;37:890-95.
4. Bland EF, White PD, Garland J. Congenital anomalies of the coronary arteries: report of an unusual case associated with cardiac hypertrophy. American Heart Journal 1933;8(6):787-801.
5. Maeder M, Paul R, Ammann P, Rickli H. Bland–White–Garland Syndrome in a 39-Year-Old Mother. Ann Thorac Surg 2004;78:1451-3.
6. Yau JM, Singh R, Halpern EJ et al. Anomalous origin of the leftcoronary artery from the pulmonary artery in adults: a comprehensivereview of 151 adult cases and a new diagnosis in a 53-year-old woman. Clin Cardiol 2011;34:204-10.
7. Bagur R, Michaud N, Bergeron S et al. Adult Bland-White-Garland Syndrome Presenting as Cardiomyopathy Characterized by Subendocardial Fibrosis. J Am Coll Cardiol 2010;56:15. DOI: 10.1016/j.jacc. 2009.09.085
8. Isomatsu Y, Imai Y, Shin’oka Т et al. Surgical intervention for anomalous origin of the left coronary artery from the pulmonary artery: The Tokyo experience. J Thorac Cardiovasc Surg 2001;121:792-7.
9 Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн.: Сердечно-сосудистая хирургия. Под ред. В.И. Бураковского, Л.А. Бокерия. М.: Медицина, 1989.
Burakovsky V.A., Bukharin V.A., Podzolkov V.P. and others. Congenital heart defects. In: Cardiovascular Surgery. Ed. V.I. Burakovsky, L.A. Bokeria. Moscow: Medicine, 1989 (in Russian).
10. Mazurak M, Kusa J. The radiologist’s tragedy, or Bland-White-Garland syndrome (BWGS). On the 80(th) anniversary of the first clinical description of ALCAPA (anomalous left coronary artery from the pulmonary artery). Kardiochir Torakochirurgia Pol 2014;11:225-9. DOI: 10.5114/kitp.2014.43857
11. Mittal Kartik, Dey Amit K, Gadewar Rohit et al. Rare case of truncus arteriosus with anomalous origin of the right coronary artery from the pulmonary artery (ARCAPA) and unilateral left pulmonary artery agenesis. Japanese Journal of Radiology 2015;33(4):220-4. DOI: 10.1007/s11604-015-0404-7
12. Prandi FR, Zaidi AN, LaRocca G et al. Sudden Cardiac Arrest in an Adult with Anomalous Origin of the Left Coronary Artery from the Pulmonary Artery (ALCAPA): Case Report. Int J Environ Res Public Health 2022;19(3):1554. DOI: 10.3390/ijerph19031554
13. Иваницкий А.В. Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985;(8):55-7.
Ivanitsky A.V. The role of X-ray examination in the diagnosis of heart defects in children. Pediatrics. 1985;(8):55-7 (in Russian).
14. Алексеева Ю.М. и др. Редкий случай синдрома Бланда–Уайта–Гарланда у взрослой пациентки. Кардиология. 2012;(11):4-14.
Alekseeva Yu.M. et al. A rare case of Bland–White–Garland syndrome in an adult patient. Cardiology. 2012;(11):4-14 (in Russian).
15. Eidem BW, Cetta F, O’Leary PW. Echocardiography in Pediatric and Adult Congenital Heart Disease, 3rd ed.; Wolters Kluwer: Alphen am Rhein, The Netherlands, 2021; pp. 514–530.
16. Li RJ, Yang Y, Li ZA et al. Right coronary artery arising from the main pulmonary artery: evaluation with 2-dimensional transthoracic echocardiography and multislice computed tomography. Tex Heart Inst J 2010;37(3):376-7. PMID: 20548830; PMCID: PMC2879209.
17. Махалин М.В. Хирургическое лечение дисфункции митрального клапана при синдроме Бланда–Уайта–Гарланда в раннем детском возрасте: Автореф. дис. … канд. мед. наук. М., 2007.
Makhalin M.V. Surgical treatment of mitral valve dysfunction in Bland–White–Garland syndrome in early childhood: Abstract of the dissertation ... Cand. Sci. (Med.). Moscow, 2007 (in Russian).
18. Бокерия JI.A., Беришвили И.И., Вахромеева М.Н. и др. Аномальное отхождение левой коронарной артерии от правой легочной артерии. Грудная и сердечно-сосудистая хирургия. 1997;(4):65.
Bokeria JI.A., Berishvili I.I., Vakhromeeva M.N. et al. Abnormal divergence of the left coronary artery from the right pulmonary artery. Thoracic and cardiovascular surgery. 1997;(4):65 (in Russian).
19. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983.
Amosov N.M., Bendet Ya.A. Therapeutic aspects of cardiac surgery. Kiev: Zdorovye Publ., 1983 (in Russian).
20. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. М.: Медицина, 1987.
Belokon N.A., Kuberger M.B. Diseases of the heart and blood vessels in children. A guide for doctors. In 2 volumes. Moscow: Medicine, 1987 (in Russian).
21. Takeuchi S, Imamura H, Katsumoto K et al. New surgical method for repair of left coronary artery from pulmonary artery. J Thorac Cardiovasc Surg 1979;78:7-11.
22. Hu R, Zhang W, Yu X et al. Midterm Surgical Outcomes for ALCAPA Repair in Infants and Children. Thorac Cardiovasc Surg 2021;70:2–9. DOI: 10.1055/s-0041-1725978
23. Mishra A. Surgical management of anomalous origin of coronary artery from pulmonary artery. Indian J Thorac Cardiovasc Surg 2021;37:131-43. DOI: 10.1007/s12055-021-01147-8
16 июля 2025
Количество просмотров: 207