Клинический разбор в общей медицине №7 2025
Клинический разбор в общей медицине №7 2025
Субксифоидальная торакоскопическая тимэктомия у пациента с расположением левой плечеголовной вены в толще кистозно измененной вилочковой железы: клиническое наблюдение и обзор литературы
Номера страниц в выпуске:6-12
Аннотация
Опухоли вилочковой железы – редкие новообразования, развивающиеся из клеток и тканей тимуса. Киста вилочковой железы является самым частым доброкачественным образованием переднего средостения, в то время как тимома считается наиболее распространенной злокачественной опухолью всего средостения. Немаловажной проблемой в хирургии переднего средостения является необходимость исключения злокачественного процесса в сложной многокамерной кисте либо в гиперплазированном тимусе. Нередко данные изменения могут возникать на фоне аутоиммунных заболеваний. Сами тимомы в 1/2 случаев ассоциированы с патогномоничными аутоиммунными синдромами (миастения, синдром Гуда, красноклеточная аплазия). В настоящей работе описан клинический случай сложной многокамерной кисты вилочковой железы. Уникальностью данного случая является интрапаренхиматозное (футлярное) расположение левой плечеголовной вены. Данных в пользу миастении и злокачественного процесса не получено. Ввиду больших размеров образования и его высокого расположения хирургическая операция была выполнена из субксифоидального доступа. Послеоперационный период протекал без осложнений.
Ключевые слова: образование переднего средостения, киста тимуса, субксифоидальный доступ, торакоскопическая тимэктомия, левая плечеголовная вена.
Для цитирования: Салимов З.М., Рябов А.Б., Афонин Г.В., Скоропад В.Ю., Агабабян Т.А., Куприянова Е.И., Якушева А.С., Петров В.А., Иванов С.А., Каприн А.Д. Субксифоидальная торакоскопическая тимэктомия у пациента с расположением левой плечеголовной вены в толще кистозно измененной вилочковой железы: клиническое наблюдение и обзор литературы. Клинический разбор в общей медицине. 2025; 6 (7): 6–12. DOI: 10.47407/kr2025.6.7.00638
Опухоли вилочковой железы – редкие новообразования, развивающиеся из клеток и тканей тимуса. Киста вилочковой железы является самым частым доброкачественным образованием переднего средостения, в то время как тимома считается наиболее распространенной злокачественной опухолью всего средостения. Немаловажной проблемой в хирургии переднего средостения является необходимость исключения злокачественного процесса в сложной многокамерной кисте либо в гиперплазированном тимусе. Нередко данные изменения могут возникать на фоне аутоиммунных заболеваний. Сами тимомы в 1/2 случаев ассоциированы с патогномоничными аутоиммунными синдромами (миастения, синдром Гуда, красноклеточная аплазия). В настоящей работе описан клинический случай сложной многокамерной кисты вилочковой железы. Уникальностью данного случая является интрапаренхиматозное (футлярное) расположение левой плечеголовной вены. Данных в пользу миастении и злокачественного процесса не получено. Ввиду больших размеров образования и его высокого расположения хирургическая операция была выполнена из субксифоидального доступа. Послеоперационный период протекал без осложнений.
Ключевые слова: образование переднего средостения, киста тимуса, субксифоидальный доступ, торакоскопическая тимэктомия, левая плечеголовная вена.
Для цитирования: Салимов З.М., Рябов А.Б., Афонин Г.В., Скоропад В.Ю., Агабабян Т.А., Куприянова Е.И., Якушева А.С., Петров В.А., Иванов С.А., Каприн А.Д. Субксифоидальная торакоскопическая тимэктомия у пациента с расположением левой плечеголовной вены в толще кистозно измененной вилочковой железы: клиническое наблюдение и обзор литературы. Клинический разбор в общей медицине. 2025; 6 (7): 6–12. DOI: 10.47407/kr2025.6.7.00638
Review and Clinical Case
Tatev A. Аgababyan1, Ekaterina I. Kupriyanova1, Anastasiya S. Yakusheva1, Vladimir A. Petrov1,5, Sergey А. Ivanov1,3, Andrey D. Kaprin2–4
1 Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology, Obninsk, Russia;
2 National Medical Research Centre of Radiology, Obninsk, Russia;
3 Patrice Lumumba Peoples' Friendship University of Russia (RUDN University), Moscow, Russia;
4 Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology, Moscow, Russia
5 Obninsk Institute for Nuclear Power Engineering – branch of National Research Nuclear University MEPhI, Obninsk, Russia
Zavir_Salimov@mail.ru
Abstract
Thymic neoplasms are rare in prevalence among the general population. The most common benign formation of the anterior mediastinum is thymus cyst, while thymoma is the most common malignant tumor of the mediastinum. An important problem in mediastinal surgery is the need to exclude a malignant process in a complex thymic cyst or in a hyperplastic thymus, because autoimmune processes in the body are accompanied by changes in the thymus gland. In half of the cases, thymomas can be associated with pathognomonic autoimmune syndromes (myasthenia gravis, Hood syndrome, red cell aplasia). We present a clinical case of a complex multicameral thymic cyst with the unique location of the left brachiocephalic vein in the thickness of the thymus parenchyma. No data has been obtained for the presence of a malignant process or myasthenia. Due to the large size of the tumor and the high location of the main part of the neoplasm, the surgical operation was performed from a subxyphoid approach. No data have been obtained for postoperative complications, including relaxation of the diaphragm.
Keywords: anterior mediastinal neoplasm, thymic cyst, subxiphoid approach, thoracoscopic thymectomy, left brachiocephalic vein.
For citation: Salimov Z.M., Riabov A.B., Afonin G.V., Skoropad V.Yu., Аgababyan T.A., Kupriyanova E.I., Yakusheva A.S., Petrov V.A., Ivanov S.А., Kaprin A.D. Subxyphoid thoracoscopic thymectomy in a patient with the location of the left brachiocephalic vein in the thickness of a cystically altered thymus gland: clinical observation and literature review. Clinical review for general practice. 2025; 6 (7): 6–12 (In Russ.). DOI: 10.47407/kr2025.6.7.00638
Bилочковая железа наряду с красным костным мозгом является главным органом иммунной системы. Основополагающая роль тимуса в иммунном ответе обусловлена созреванием и селекцией Т-лимфоцитов в паренхиме железы, после чего «обученные» Т-лимфоциты током крови распределяются по организму. Максимума развития вилочковая железа достигает к пубертату, далее в течение всей жизни происходят постепенная инволюция и замещение органа жировой тканью [1]. Однако при ряде иммунопатологических состояний организма вследствие уникальной особенности функционирования вилочковой железы в структуре тимуса выявляют различные органические изменения (гиперплазия, кистозная трансформация) [2, 3]. Более того, нередко первичные изменения в паренхиме железы (гиперплазия, опухолевая трансформация) могут запускать патогномоничные аутоиммунные синдромы (миастения, синдром Гуда, красноклеточная аплазия) [4–6].
Тимэктомия является ведущим методом лечения пациентов с различными образованиями вилочковой железы, а также больных с серопозитивной генерализованной миастенией [7].
Сама вилочковая железа локализована в преваскулярной зоне, т. е. полностью располагается над перикардом и магистральными сосудами (аорта, верхняя полая вена, левая плечеголовная вена – ЛПВ) [8]. Ключевой момент в хирургии переднего средостения – контроль над ЛПВ. В большинстве случаев (свыше 90%) тимус расположен полностью над ЛПВ. Однако иногда правая или левая доля либо обе доли расположены под плечеголовной веной [9]. Данный момент следует учитывать при хирургической операции у пациентов с тимомой и тем более c генерализованной миастенией, так как данной категории пациентов показано полное удаление всей железы с клетчаткой переднего средостения для максимальной редукции эктопических очагов тимуса [10].
 Пациент C., 54 года, житель Орловской области, обратился в МРНЦ им. А.Ф. Цыба в ноябре 2023 г. с жалобами на хронический кашель в течение года.
Пациент C., 54 года, житель Орловской области, обратился в МРНЦ им. А.Ф. Цыба в ноябре 2023 г. с жалобами на хронический кашель в течение года.
Из анамнеза: в ноябре 2022 г. пациент перенес правостороннюю пневмонию, обследовался и лечился по месту жительства, выполнялась компьютерная томография (КТ) органов грудной клетки (ОГК), при которой было выявлено образование переднего средостения кистозного характера. Пациент был оставлен под динамическое наблюдение.
В связи с сохранением кашля в октябре 2023 г. была выполнена контрольная КТ ОГК, с результатами которой пациент обратился на прием к онкологу в поликлинике МРНЦ им. А.Ф. Цыба.
Анамнез курения отсутствует. Факторы вредности на работе отрицает. Наследственный анамнез по аутоиммунным заболеваниям не отягощен.
Уровень антител к ацетилхолиновому рецептору 0,23 (норма менее 0,45 нмоль/л).
Антитела к скелетным мышцам 1:20 (норма 1:20).
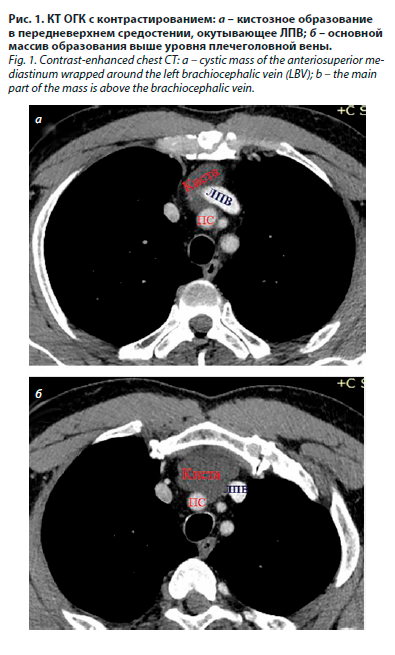
По данным КТ ОГК от 30.10.2023 в верхней половине переднего средостения, прилегая к грудино-подъязычной мышце с обеих сторон, окутывая по передней полуокружности плечеголовной ствол (ПС) и плотно прилегая к передней поверхности ЛПВ, определяется образование пониженной плотности, неправильной формы, местами с нечеткими контурами, однородной плотностью (15–17 ед.), не накапливающее контрастный препарат. Размеры образования 49×38×48 мм. Верхний полюс образования расположен на 15 мм ниже яремной вырезки (на уровне бифуркации артериального ПС); нижний полюс – на уровне ЛПВ (рис. 1).
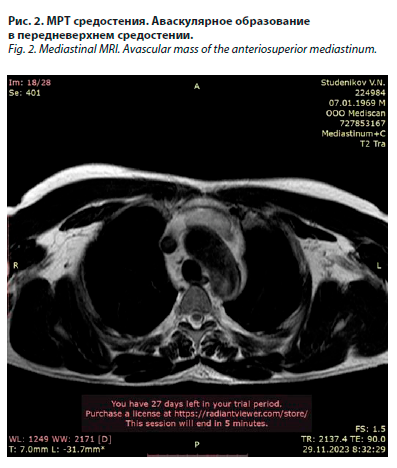 Для уточнения характера опухоли 29.11.2023 была выполнена магнитно-резонансная томография (МРТ) средостения с внутривенным контрастированием. По данным МРТ визуализируемое на КТ образование также аваскулярное, гиперинтенсивное на Т2-взвешенных изображениях, гипоинтенсивное на Т1-взвешенных изображениях, размерами 50×20×68 мм (рис. 2).
Для уточнения характера опухоли 29.11.2023 была выполнена магнитно-резонансная томография (МРТ) средостения с внутривенным контрастированием. По данным МРТ визуализируемое на КТ образование также аваскулярное, гиперинтенсивное на Т2-взвешенных изображениях, гипоинтенсивное на Т1-взвешенных изображениях, размерами 50×20×68 мм (рис. 2).
На основании данных комплексного обследования были выставлены показания для проведения торакоскопической тимэктомии.
Операция из субксифоидального доступа выполнена для достижения верхнего полюса и работы в зоне выше ЛПВ. Преимущество последнего также в адекватной визуализации обоих диафрагмальных нервов, в возможности удаления препарата больших размеров во избежание проведения торакотомии.
18.01.2024 выполнено хирургическое вмешательство: под эндотрахеальным наркозом в эпигастральной области на 1,5 см ниже мечевидного отростка произведен горизонтальный дугообразный поперечный разрез кожи (4 см). Рассечены подкожная клетчатка, апоневроз, выделен мечевидный отросток. Установлен монопорт. Вскрыта правая плевральная полость. При ревизии спаечного процесса свободной жидкости в плевральной полости не выявлено; отмечается избыточное количество жировой клетчатки в области переднего средостения. Начиная с диафрагмы выделена клетчатка переднего средостения между обоими диафрагмальными нервами, при этом вскрыта левая плевральная полость. Выше ЛПВ определяется кистозное образование 50×45 мм. Также выявлено нахождение ЛПВ в толще кистозно измененной вилочковой железы (рис. 3).
Для облегчения манипуляций и повышения маневренности в связи со сложным анатомическим случаем установлены дополнительно два порта (5 мм) в правом подреберье. Операция выполнена en bloc с выделением окружающей жировой клетчатки и денудацией ЛПВ (рис. 4).
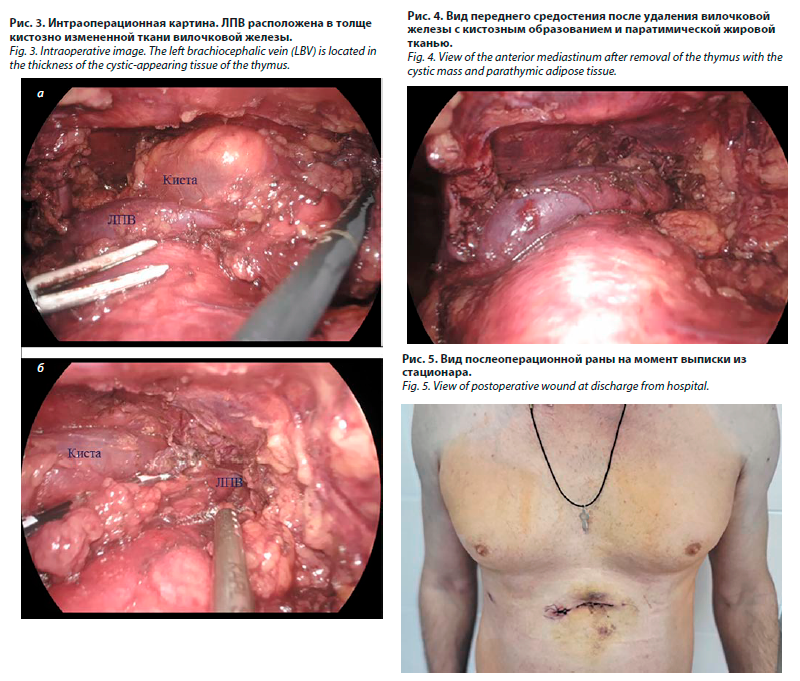
Пересечена вена Кейнеса. Препарат удален в резиновом контейнере. Дренирование обеих плевральных полостей (один дренаж) через эпигастральную область. Послойное ушивание ран.
Дренаж удален на следующий день после операции. Пациент выписан на 3-и сутки в удовлетворительном состоянии. На рис. 5 – вид послеоперационной раны на 3-и сутки после операции.
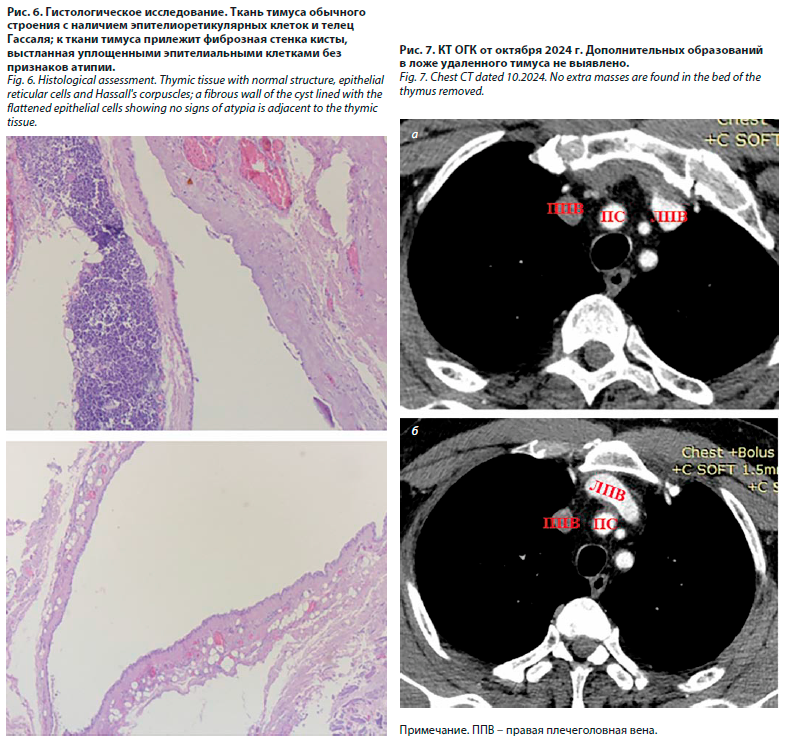
При гистологическом исследовании была выявлена киста вилочковой железы без признаков атипии (рис. 6).
В октябре 2024 г. пациент выполнил контрольную КТ ОГК, согласно которой данных в пользу наличия остаточной ткани вилочковой железы в ложе удаленного тимуса не получено (рис. 7).
Значимым моментом в лечении заболеваний вилочковой железы являются патогномоничные аутоиммунные синдромы, ассоциированные с органическими изменениями вилочковой железы [21]. Чаще всего данные состояния сопутствуют тимоме, и к таким синдромам относят гипогаммаглобулинемию, красноклеточную аплазию, миастению. У каждого второго больного с тимомой переднего средостения диагностируют наличие ассоциированного аутоиммунного синдрома. Наиболее часто имеет место миастенический синдром (25–40%) [22, 23]. Однако принципиально дифференцировать миастению и миастенический синдром при тимоме. Генерализованная миастения является самостоятельным аутоиммунным заболеванием, проявляющимся мышечной слабостью и повышенной мышечной утомляемостью. Ее патогенез обусловлен поражением различных компонентов постсинаптической мембраны нейромышечного синапса аутоагрессивными антителами, которые в 70–90% случаев образуются в тимусе [24]. При гистологическом исследовании операционного материала чаще выявляют атрофию либо гиперплазию тимуса, реже кисту вилочковой железы; тимома встречается в 10–15% случаев. Тимэктомия у больных миастенией показана при серопозитивной форме (наличие антител к ацетилхолиновому рецептору), а также при наличии тимомы (почти всегда серопозитивны) [25]. В связи с вероятностью наличия латентной формы миастении у пациентов с тимомой перед планируемым хирургическим вмешательством они должны быть обследованы на наличие антител к ацетилхолиновому рецептору и скелетным мышцам.
В целом любое образование переднего средостения до 5–6 см (исключение – гиперплазия тимуса без миастении) с отсутствием признаков вовлечения окружающих структур является показанием для торакоскопического удаления с лечебно-диагностической целью [7].
Как было отмечено выше, ключевым моментом в хирургии переднего средостения является контроль над ЛПВ; игнорирование данного момента может привести к повреждению последней и профузному кровотечению. При проведении тимэктомии взаимосвязь тимуса и ЛПВ становится особенно актуальной. Во-первых, дренирование вен тимуса происходит в ЛПВ. Во-вторых, тимус расположен над передней полуокружностью описанной магистральной вены, нередко интимно прилегая к последней. В 5–10% случаев часть железы либо вся железа расположена под ЛПВ, что усложняет проведение тимэктомии и требует максимального выделения последней [9]. При наличии тимомы у таких больных во избежание нарушения целостности капсулы опухоли хирургическую операцию следует выполнять из стернотомного доступа с возможной сосудистой пластикой магистральных вен.
Стандартным вариантом доступа при торакоскопической тимэктомии является монолатеральный доступ. Чаще предпочитают правосторонний доступ, так как правая плевральная полость больше по объему, большинство хирургов праворукие, удобнее выделять верхнюю полую вену и ЛПВ. К левостороннему доступу прибегают при тяготении опухоли влево [7, 26]. В последние годы активно применяют субксифоидальный доступ, преимущества которого обусловлены отсутствием травмы межреберного нерва (снижение выраженности болевого синдрома), лучшим контролем за обоими диафрагмальными нервами и областью выше ЛПВ (безопасность операции), а также возможностью эвакуировать препарат больших размеров, не прибегая к торакотомии [27–29]. Еще субксифоидальный доступ может быть применен после предшествующих операций, в том числе открытых, у пациентов с рефрактерной миастенией и рецидивной тимомой для удаления резидуальных эктопических очагов [28, 30].
В настоящей работе описан клинический случай сложной многокамерной кисты вилочковой железы без миастении. Данных в пользу наличия злокачественного процесса не получено (нормальные показатели антител к ацетилхолиновому рецептору, скелетным мышцам; отсутствие признаков тимомы при МРТ средостения). Ввиду больших размеров опухоли (49×38×48 мм), высокого расположения основной части образования (выше ЛПВ) хирургическая операция выполнена из субксифоидального доступа. Дополнительно были установлены два порта (5 мм) в правом подреберье с целью повышения маневренности при выделении ЛПВ. Послеоперационный период протекал без осложнений. Болевой синдром регрессировал полностью через неделю после операции. При контрольной КТ ОГК данных в пользу наличия остаточной ткани тимуса, релаксации куполов диафрагмы не получено; ЛПВ проходима на всем протяжении, без перегибов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Салимов Завир Муслимович – врач-онколог отд-ния лучевого и хирургического лечения заболеваний торакальной области МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии».
E-mail: Zavir_Salimov@mail.ru; ORCID: 0000-0002-3488-425X
Zavir M. Salimov – oncologist, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: Zavir_Salimov@mail.ru; ORCID: 0000-0002-3488-425X
Рябов Андрей Борисович – д-р мед. наук, зав. отд. торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: ryabovdoc@mail.ru; ORCID: 0000-0002-1037-2364; SPIN-код: 9810-5315
Andrey B. Riabov – Dr. Sci. (Med.), head of the department, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology. E-mail: ryabovdoc@mail.ru; ORCID: 0000-0002-1037-2364; SPIN code: 9810-5315
Афонин Григорий Владиславович – канд. мед. наук, ст. науч. сотр., и. о. зав. отд-нием лучевого и хирургического лечения заболеваний торакальной области МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: Dr.G.Afonin@mail.ru; ORCID: 0000-0002-7128-2397; SPIN-код: 9039-6110
Grigoriy V. Afonin – Cand. Sci. (Med.), head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: Dr.G.Afonin@mail.ru; ORCID: 0000-0002-7128-2397; SPIN code: 9039-6110
Скоропад Виталий Юрьевич – д-р мед. наук, проф., зав. отд. торакоабдоминальной онкологии МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Vitaliy Yu. Skoropad – Dr. Sci. (Med.), Professor, head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: tatevik.05@mail.ru; ORCID: 0000-0002-9971-3451; SPIN-код: 5752-3393
Tatev A. Аgababyan – Cand. Sci. (Med.), head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: tatevik.05@mail.ru; ORCID: 0000-0002-9971-3451; SPIN code: 5752-3393
Куприянова Екатерина Ивановна – врач патологоанатомического отд-ния МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: kupriyanova1306@gmail.com; ORCID: 0000-0001-5856-9759; SPIN-код: 3557-2386
Ekaterina I. Kupriyanova – doctor, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: kupriyanova1306@gmail.com; ORCID: 0000-0001-5856-9759
Якушева Анастасия Сергеевна – науч. сотр. отд-ния ультразвуковой диагностики и малоинвазивных технологий МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: nastmed10@yandex.ru; ORCID: 0000-0002-4369-0246
Anastasiya S. Yakusheva – Research Officer, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: nastmed10@yandex.ru; ORCID: 0000-0002-4369-0246
Петров Владимир Александрович – д-р мед. наук, проф., зав. научно-образовательным отд. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: vapetrov1959@mail.ru;
ORCID: 0000-0002-8580-933X; SPIN-код: 1833-0060
Vladimir A. Petrov – Dr. Sci. (Med.), Full Prof., head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X; SPIN code: 1833-0060
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, дир. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии», проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института ФГАОУ ВО РУДН, главный внештатный специалист-онколог ЦФО Минздрава России. E-mail: ivanov.obninsk@mail.ru; ORCID: 0000-0001-7689-6032
Sergey А. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology, Professor, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: ivanov.obninsk@mail.ru; ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, проф., ген. дир. ФГБУ «НМИЦ радиологии», дир. МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института ФГАОУ ВО РУДН, главный внештатный онколог (ПФО, ЦФО, СКФО) Минздрава России. E-mail: kaprin@mail.ru; ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Full Prof., Director General, National Medical Research Centre of Radiology, Director, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology, head of the department, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: kaprin@mail.ru; ORCID: 0000-0001-8784-8415
Поступила в редакцию: 20.12.2024
Поступила после рецензирования: 15.01.2025
Принята к публикации: 30.01.2025
Received: 20.12.2024
Revised: 15.01.2025
Accepted: 30.01.2025
Subxyphoid thoracoscopic thymectomy in a patient with the location of the left brachiocephalic vein in the thickness of a cystically altered thymus gland: clinical observation and literature review
Zavir M. Salimov1, Andrey B. Riabov2–4, Grigoriy V. Afonin1, Vitaliy Yu. Skoropad1,Tatev A. Аgababyan1, Ekaterina I. Kupriyanova1, Anastasiya S. Yakusheva1, Vladimir A. Petrov1,5, Sergey А. Ivanov1,3, Andrey D. Kaprin2–4
1 Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology, Obninsk, Russia;
2 National Medical Research Centre of Radiology, Obninsk, Russia;
3 Patrice Lumumba Peoples' Friendship University of Russia (RUDN University), Moscow, Russia;
4 Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology, Moscow, Russia
5 Obninsk Institute for Nuclear Power Engineering – branch of National Research Nuclear University MEPhI, Obninsk, Russia
Zavir_Salimov@mail.ru
Abstract
Thymic neoplasms are rare in prevalence among the general population. The most common benign formation of the anterior mediastinum is thymus cyst, while thymoma is the most common malignant tumor of the mediastinum. An important problem in mediastinal surgery is the need to exclude a malignant process in a complex thymic cyst or in a hyperplastic thymus, because autoimmune processes in the body are accompanied by changes in the thymus gland. In half of the cases, thymomas can be associated with pathognomonic autoimmune syndromes (myasthenia gravis, Hood syndrome, red cell aplasia). We present a clinical case of a complex multicameral thymic cyst with the unique location of the left brachiocephalic vein in the thickness of the thymus parenchyma. No data has been obtained for the presence of a malignant process or myasthenia. Due to the large size of the tumor and the high location of the main part of the neoplasm, the surgical operation was performed from a subxyphoid approach. No data have been obtained for postoperative complications, including relaxation of the diaphragm.
Keywords: anterior mediastinal neoplasm, thymic cyst, subxiphoid approach, thoracoscopic thymectomy, left brachiocephalic vein.
For citation: Salimov Z.M., Riabov A.B., Afonin G.V., Skoropad V.Yu., Аgababyan T.A., Kupriyanova E.I., Yakusheva A.S., Petrov V.A., Ivanov S.А., Kaprin A.D. Subxyphoid thoracoscopic thymectomy in a patient with the location of the left brachiocephalic vein in the thickness of a cystically altered thymus gland: clinical observation and literature review. Clinical review for general practice. 2025; 6 (7): 6–12 (In Russ.). DOI: 10.47407/kr2025.6.7.00638
Bилочковая железа наряду с красным костным мозгом является главным органом иммунной системы. Основополагающая роль тимуса в иммунном ответе обусловлена созреванием и селекцией Т-лимфоцитов в паренхиме железы, после чего «обученные» Т-лимфоциты током крови распределяются по организму. Максимума развития вилочковая железа достигает к пубертату, далее в течение всей жизни происходят постепенная инволюция и замещение органа жировой тканью [1]. Однако при ряде иммунопатологических состояний организма вследствие уникальной особенности функционирования вилочковой железы в структуре тимуса выявляют различные органические изменения (гиперплазия, кистозная трансформация) [2, 3]. Более того, нередко первичные изменения в паренхиме железы (гиперплазия, опухолевая трансформация) могут запускать патогномоничные аутоиммунные синдромы (миастения, синдром Гуда, красноклеточная аплазия) [4–6].
Тимэктомия является ведущим методом лечения пациентов с различными образованиями вилочковой железы, а также больных с серопозитивной генерализованной миастенией [7].
Сама вилочковая железа локализована в преваскулярной зоне, т. е. полностью располагается над перикардом и магистральными сосудами (аорта, верхняя полая вена, левая плечеголовная вена – ЛПВ) [8]. Ключевой момент в хирургии переднего средостения – контроль над ЛПВ. В большинстве случаев (свыше 90%) тимус расположен полностью над ЛПВ. Однако иногда правая или левая доля либо обе доли расположены под плечеголовной веной [9]. Данный момент следует учитывать при хирургической операции у пациентов с тимомой и тем более c генерализованной миастенией, так как данной категории пациентов показано полное удаление всей железы с клетчаткой переднего средостения для максимальной редукции эктопических очагов тимуса [10].
Клинический случай
 Пациент C., 54 года, житель Орловской области, обратился в МРНЦ им. А.Ф. Цыба в ноябре 2023 г. с жалобами на хронический кашель в течение года.
Пациент C., 54 года, житель Орловской области, обратился в МРНЦ им. А.Ф. Цыба в ноябре 2023 г. с жалобами на хронический кашель в течение года.Из анамнеза: в ноябре 2022 г. пациент перенес правостороннюю пневмонию, обследовался и лечился по месту жительства, выполнялась компьютерная томография (КТ) органов грудной клетки (ОГК), при которой было выявлено образование переднего средостения кистозного характера. Пациент был оставлен под динамическое наблюдение.
В связи с сохранением кашля в октябре 2023 г. была выполнена контрольная КТ ОГК, с результатами которой пациент обратился на прием к онкологу в поликлинике МРНЦ им. А.Ф. Цыба.
Анамнез курения отсутствует. Факторы вредности на работе отрицает. Наследственный анамнез по аутоиммунным заболеваниям не отягощен.
Уровень антител к ацетилхолиновому рецептору 0,23 (норма менее 0,45 нмоль/л).
Антитела к скелетным мышцам 1:20 (норма 1:20).
По данным КТ ОГК от 30.10.2023 в верхней половине переднего средостения, прилегая к грудино-подъязычной мышце с обеих сторон, окутывая по передней полуокружности плечеголовной ствол (ПС) и плотно прилегая к передней поверхности ЛПВ, определяется образование пониженной плотности, неправильной формы, местами с нечеткими контурами, однородной плотностью (15–17 ед.), не накапливающее контрастный препарат. Размеры образования 49×38×48 мм. Верхний полюс образования расположен на 15 мм ниже яремной вырезки (на уровне бифуркации артериального ПС); нижний полюс – на уровне ЛПВ (рис. 1).
 Для уточнения характера опухоли 29.11.2023 была выполнена магнитно-резонансная томография (МРТ) средостения с внутривенным контрастированием. По данным МРТ визуализируемое на КТ образование также аваскулярное, гиперинтенсивное на Т2-взвешенных изображениях, гипоинтенсивное на Т1-взвешенных изображениях, размерами 50×20×68 мм (рис. 2).
Для уточнения характера опухоли 29.11.2023 была выполнена магнитно-резонансная томография (МРТ) средостения с внутривенным контрастированием. По данным МРТ визуализируемое на КТ образование также аваскулярное, гиперинтенсивное на Т2-взвешенных изображениях, гипоинтенсивное на Т1-взвешенных изображениях, размерами 50×20×68 мм (рис. 2).На основании данных комплексного обследования были выставлены показания для проведения торакоскопической тимэктомии.
Операция из субксифоидального доступа выполнена для достижения верхнего полюса и работы в зоне выше ЛПВ. Преимущество последнего также в адекватной визуализации обоих диафрагмальных нервов, в возможности удаления препарата больших размеров во избежание проведения торакотомии.
18.01.2024 выполнено хирургическое вмешательство: под эндотрахеальным наркозом в эпигастральной области на 1,5 см ниже мечевидного отростка произведен горизонтальный дугообразный поперечный разрез кожи (4 см). Рассечены подкожная клетчатка, апоневроз, выделен мечевидный отросток. Установлен монопорт. Вскрыта правая плевральная полость. При ревизии спаечного процесса свободной жидкости в плевральной полости не выявлено; отмечается избыточное количество жировой клетчатки в области переднего средостения. Начиная с диафрагмы выделена клетчатка переднего средостения между обоими диафрагмальными нервами, при этом вскрыта левая плевральная полость. Выше ЛПВ определяется кистозное образование 50×45 мм. Также выявлено нахождение ЛПВ в толще кистозно измененной вилочковой железы (рис. 3).
Для облегчения манипуляций и повышения маневренности в связи со сложным анатомическим случаем установлены дополнительно два порта (5 мм) в правом подреберье. Операция выполнена en bloc с выделением окружающей жировой клетчатки и денудацией ЛПВ (рис. 4).

Пересечена вена Кейнеса. Препарат удален в резиновом контейнере. Дренирование обеих плевральных полостей (один дренаж) через эпигастральную область. Послойное ушивание ран.
Дренаж удален на следующий день после операции. Пациент выписан на 3-и сутки в удовлетворительном состоянии. На рис. 5 – вид послеоперационной раны на 3-и сутки после операции.
При гистологическом исследовании была выявлена киста вилочковой железы без признаков атипии (рис. 6).
В октябре 2024 г. пациент выполнил контрольную КТ ОГК, согласно которой данных в пользу наличия остаточной ткани вилочковой железы в ложе удаленного тимуса не получено (рис. 7).

Обсуждение
Наличие опухоли средостения является достаточно редкой ситуацией, и различные по характеру образования в данной анатомической локализации выявляют не более чем в 1–1,5% случаев [11–13]. У большей части пациентов опухоли средостения локализованы в переднем отделе. Не менее 60% таких новообразований являются образованиями вилочковой железы. Киста вилочковой железы является самым частым доброкачественным образованием переднего средостения [14, 15] Кисты тимуса могут быть как простыми (истинные), так и сложными (многокамерные). Последние могут быть опасными, так как в утолщенных стенках таких кист может развиваться злокачественный процесс [16, 17]. Сами первичные злокачественные опухоли тимуса нередко имеют кистозно-солидную структуру (нейроэндокринные опухоли, тимомы). «Золотым стандартом» диагностики образований вилочковой железы является КТ ОГК с контрастированием [18]. Однако данный метод не всегда позволяет исключить наличие опухоли в сложных многокамерных кистах с неоднородными стенками. С целью разграничения простой и сложной кист, исключения опухолевого процесса в последней показано проведение МРТ средостения, которая позволяет оценить плотность образования, определить наличие некротического компонента, наличие жировых включений. Также МРТ средостения показана при дифференциальной диагностике истинной и лимфофолликулярной гиперплазии с целью исключения участка злокачественной трансформации на фоне неоднородной структуры гиперплазированного тимуса [19, 20].Значимым моментом в лечении заболеваний вилочковой железы являются патогномоничные аутоиммунные синдромы, ассоциированные с органическими изменениями вилочковой железы [21]. Чаще всего данные состояния сопутствуют тимоме, и к таким синдромам относят гипогаммаглобулинемию, красноклеточную аплазию, миастению. У каждого второго больного с тимомой переднего средостения диагностируют наличие ассоциированного аутоиммунного синдрома. Наиболее часто имеет место миастенический синдром (25–40%) [22, 23]. Однако принципиально дифференцировать миастению и миастенический синдром при тимоме. Генерализованная миастения является самостоятельным аутоиммунным заболеванием, проявляющимся мышечной слабостью и повышенной мышечной утомляемостью. Ее патогенез обусловлен поражением различных компонентов постсинаптической мембраны нейромышечного синапса аутоагрессивными антителами, которые в 70–90% случаев образуются в тимусе [24]. При гистологическом исследовании операционного материала чаще выявляют атрофию либо гиперплазию тимуса, реже кисту вилочковой железы; тимома встречается в 10–15% случаев. Тимэктомия у больных миастенией показана при серопозитивной форме (наличие антител к ацетилхолиновому рецептору), а также при наличии тимомы (почти всегда серопозитивны) [25]. В связи с вероятностью наличия латентной формы миастении у пациентов с тимомой перед планируемым хирургическим вмешательством они должны быть обследованы на наличие антител к ацетилхолиновому рецептору и скелетным мышцам.
В целом любое образование переднего средостения до 5–6 см (исключение – гиперплазия тимуса без миастении) с отсутствием признаков вовлечения окружающих структур является показанием для торакоскопического удаления с лечебно-диагностической целью [7].
Как было отмечено выше, ключевым моментом в хирургии переднего средостения является контроль над ЛПВ; игнорирование данного момента может привести к повреждению последней и профузному кровотечению. При проведении тимэктомии взаимосвязь тимуса и ЛПВ становится особенно актуальной. Во-первых, дренирование вен тимуса происходит в ЛПВ. Во-вторых, тимус расположен над передней полуокружностью описанной магистральной вены, нередко интимно прилегая к последней. В 5–10% случаев часть железы либо вся железа расположена под ЛПВ, что усложняет проведение тимэктомии и требует максимального выделения последней [9]. При наличии тимомы у таких больных во избежание нарушения целостности капсулы опухоли хирургическую операцию следует выполнять из стернотомного доступа с возможной сосудистой пластикой магистральных вен.
Стандартным вариантом доступа при торакоскопической тимэктомии является монолатеральный доступ. Чаще предпочитают правосторонний доступ, так как правая плевральная полость больше по объему, большинство хирургов праворукие, удобнее выделять верхнюю полую вену и ЛПВ. К левостороннему доступу прибегают при тяготении опухоли влево [7, 26]. В последние годы активно применяют субксифоидальный доступ, преимущества которого обусловлены отсутствием травмы межреберного нерва (снижение выраженности болевого синдрома), лучшим контролем за обоими диафрагмальными нервами и областью выше ЛПВ (безопасность операции), а также возможностью эвакуировать препарат больших размеров, не прибегая к торакотомии [27–29]. Еще субксифоидальный доступ может быть применен после предшествующих операций, в том числе открытых, у пациентов с рефрактерной миастенией и рецидивной тимомой для удаления резидуальных эктопических очагов [28, 30].
В настоящей работе описан клинический случай сложной многокамерной кисты вилочковой железы без миастении. Данных в пользу наличия злокачественного процесса не получено (нормальные показатели антител к ацетилхолиновому рецептору, скелетным мышцам; отсутствие признаков тимомы при МРТ средостения). Ввиду больших размеров опухоли (49×38×48 мм), высокого расположения основной части образования (выше ЛПВ) хирургическая операция выполнена из субксифоидального доступа. Дополнительно были установлены два порта (5 мм) в правом подреберье с целью повышения маневренности при выделении ЛПВ. Послеоперационный период протекал без осложнений. Болевой синдром регрессировал полностью через неделю после операции. При контрольной КТ ОГК данных в пользу наличия остаточной ткани тимуса, релаксации куполов диафрагмы не получено; ЛПВ проходима на всем протяжении, без перегибов.
Выводы
При подозрении на тимому и планировании тимэктомии все пациенты должны быть обследованы на наличие антител к ацетилхолиновому рецептору, скелетным мышцам для исключения субклинической формы миастении. Кисты средостения наряду с лимфофолликулярной гиперплазией являются показаниями для проведения МРТ средостения с целью исключения злокачественной трансформации. Показанием для торакоскопической тимэктомии являются образования диаметром до 5–6 см, серопозитивная форма миастении. Применение субксифоидального доступа позволяет выполнить расширенную диссекцию клетчатки переднего средостения с полным контролем обоих диафрагмальных нервов и безопасной работой в области выше ЛПВ (высокое расположение опухоли), а также обеспечивает возможность удалить образование больших размеров, не прибегая к торакотомии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Салимов Завир Муслимович – врач-онколог отд-ния лучевого и хирургического лечения заболеваний торакальной области МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии».
E-mail: Zavir_Salimov@mail.ru; ORCID: 0000-0002-3488-425X
Zavir M. Salimov – oncologist, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: Zavir_Salimov@mail.ru; ORCID: 0000-0002-3488-425X
Рябов Андрей Борисович – д-р мед. наук, зав. отд. торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: ryabovdoc@mail.ru; ORCID: 0000-0002-1037-2364; SPIN-код: 9810-5315
Andrey B. Riabov – Dr. Sci. (Med.), head of the department, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology. E-mail: ryabovdoc@mail.ru; ORCID: 0000-0002-1037-2364; SPIN code: 9810-5315
Афонин Григорий Владиславович – канд. мед. наук, ст. науч. сотр., и. о. зав. отд-нием лучевого и хирургического лечения заболеваний торакальной области МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: Dr.G.Afonin@mail.ru; ORCID: 0000-0002-7128-2397; SPIN-код: 9039-6110
Grigoriy V. Afonin – Cand. Sci. (Med.), head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: Dr.G.Afonin@mail.ru; ORCID: 0000-0002-7128-2397; SPIN code: 9039-6110
Скоропад Виталий Юрьевич – д-р мед. наук, проф., зав. отд. торакоабдоминальной онкологии МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Vitaliy Yu. Skoropad – Dr. Sci. (Med.), Professor, head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: tatevik.05@mail.ru; ORCID: 0000-0002-9971-3451; SPIN-код: 5752-3393
Tatev A. Аgababyan – Cand. Sci. (Med.), head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: tatevik.05@mail.ru; ORCID: 0000-0002-9971-3451; SPIN code: 5752-3393
Куприянова Екатерина Ивановна – врач патологоанатомического отд-ния МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: kupriyanova1306@gmail.com; ORCID: 0000-0001-5856-9759; SPIN-код: 3557-2386
Ekaterina I. Kupriyanova – doctor, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: kupriyanova1306@gmail.com; ORCID: 0000-0001-5856-9759
Якушева Анастасия Сергеевна – науч. сотр. отд-ния ультразвуковой диагностики и малоинвазивных технологий МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: nastmed10@yandex.ru; ORCID: 0000-0002-4369-0246
Anastasiya S. Yakusheva – Research Officer, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: nastmed10@yandex.ru; ORCID: 0000-0002-4369-0246
Петров Владимир Александрович – д-р мед. наук, проф., зав. научно-образовательным отд. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии». E-mail: vapetrov1959@mail.ru;
ORCID: 0000-0002-8580-933X; SPIN-код: 1833-0060
Vladimir A. Petrov – Dr. Sci. (Med.), Full Prof., head of the department, Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology. E-mail: vapetrov1959@mail.ru; ORCID: 0000-0002-8580-933X; SPIN code: 1833-0060
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, дир. МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии», проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института ФГАОУ ВО РУДН, главный внештатный специалист-онколог ЦФО Минздрава России. E-mail: ivanov.obninsk@mail.ru; ORCID: 0000-0001-7689-6032
Sergey А. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Tsyb Medical Radiological Research Center – branch of the National Medical Research Centre of Radiology, Professor, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: ivanov.obninsk@mail.ru; ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, проф., ген. дир. ФГБУ «НМИЦ радиологии», дир. МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко Медицинского института ФГАОУ ВО РУДН, главный внештатный онколог (ПФО, ЦФО, СКФО) Минздрава России. E-mail: kaprin@mail.ru; ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Full Prof., Director General, National Medical Research Centre of Radiology, Director, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Centre of Radiology, head of the department, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: kaprin@mail.ru; ORCID: 0000-0001-8784-8415
Поступила в редакцию: 20.12.2024
Поступила после рецензирования: 15.01.2025
Принята к публикации: 30.01.2025
Received: 20.12.2024
Revised: 15.01.2025
Accepted: 30.01.2025
Список исп. литературыСкрыть список1. Thapa P, Farber DL. The Role of the Thymus in the Immune Response. Thorac Surg Clin 2019;29(2):123-31. DOI: 10.1016/j.thorsurg.2018. 12.001
2. Ohe R, Yang S, Yamashita D, et al. Pathogenesis of follicular thymic hyperplasia associated with rheumatoid arthritis. Pathol Int. 2022;72(4):252-60. DOI: 10.1111/pin.13212
3. Haider U, Richards P, Gianoukakis AG. Thymic Hyperplasia Associated with Graves' Disease: Pathophysiology and Proposed Management Algorithm. Thyroid. 2017;27(8):994-1000. DOI: 10.1089/thy.2017.0086
4. Blum TG, Misch D, Kollmeier J, et al. Autoimmune disorders and paraneoplastic syndromes in thymoma. J Thorac Dis. 2020;12(12):7571-90. DOI: 10.21037/jtd-2019-thym-10
5. Evoli A, Lancaster E. Paraneoplastic disorders in thymoma patients. J Thorac Oncol. 2014;9(Suppl.2):S143-7. DOI: 10.1097/JTO. 0000000000000300
6. Guevara-Hoyer K, Fuentes-Antrás J, Calatayud Gastardi J, Sánchez-Ramón S. Immunodeficiency and thymoma in Good syndrome: Two sides of the same coin. Immunol Lett. 2021;(231):11-7. DOI: 10.1016/j.imlet.2020.12.010
7. Пикин О.В., Рябов А.Б., Мартынова Д.Е., Салимов З.М. Малоинвазивные технологии в хирургии вилочковой железы (обзор литературы). Вестник хирургии им. И.И. Грекова. 2021;180(4):99-105. DOI: 10.24884/0042-4625-2021-180-4-99-105
Pikin O.V., Ryabov A.B., Martynova D.E., Salimov Z.M. Minimally invasive technologies in thymus surgery (literature review). Grekov Bulletin of Surgery. 2021;180(4):99-105. DOI: 10.24884/0042-4625-2021-180-4-99-105 (in Russian).
8. Safieddine N, Keshavjee S. Anatomy of the thymus gland. Thorac Surg Clin. 2011;21(2):191-5,viii. DOI: 10.1016/j.thorsurg.2010.12.011
9. Di Marino V, Argème M, Brunet C, et al. Macroscopic study of the adult thymus. Surg Radiol Anat. 1987;9(1):51-62. DOI: 10.1007/BF02116854
10. Sarkkinen J, Dunkel J, Tuulasvaara A, et al. Ectopic germinal centers in the thymus accurately predict prognosis of myasthenia gravis after thymectomy. Mod Pathol. 2022;35(9):1168-74. DOI: 10.1038/s41379-022-01070-2
11. Yoon SH, Choi SH, Kang CH, Goo JM. Incidental Anterior Mediastinal Nodular Lesions on Chest CT in Asymptomatic Subjects. J Thorac Oncol. 2018;13(3):359-66. DOI: 10.1016/j.jtho.2017.11.124
12. Miyazawa R, Matsusako M, Nozaki T, et al. Incidental mediastinal masses detected at low-dose CT screening: prevalence and radiological characteristics. Jpn J Radiol. 2020;38(12):1150-7. DOI: 10.1007/ s11604-020-01015-2
13. Araki T, Nishino M, Gao W, et al. Anterior Mediastinal Masses in the Framingham Heart Study: Prevalence and CT Image Characteristics. Eur J Radiol Open. 2015;(2):26-31. DOI: 10.1016/j.ejro.2014.12.003
14. Strollo DC, Rosado de Christenson ML, Jett JR. Primary mediastinal tumors. Part 1: tumors of the anterior mediastinum. Chest. 1997;112(2):511-22. DOI: 10.1378/chest.112.2.511
15. Roden AC, Fang W, Shen Y, et al. Distribution of Mediastinal Lesions Across Multi-Institutional, International, Radiology Databases. J Thorac Oncol. 2020;15(4):568-79. DOI: 10.1016/j.jtho.2019.12.108
16. Strange CD, Truong MT, Ahuja J, et al. Imaging evaluation of thymic tumors. Mediastinum. 2023;(7):28. DOI: 10.21037/med-22-58
17. Shahrzad M, Le TS, Silva M, et al. Anterior mediastinal masses. Am J Roentgenol. 2014;203(2):W128-38. DOI: 10.2214/AJR.13.11998
18. Carter BW, Marom EM, Detterbeck FC. Approaching the patient with an anterior mediastinal mass: a guide for clinicians. J Thorac Oncol. 2014;9(Suppl.2):S102-9. DOI: 10.1097/JTO.0000000000000294
19. Tomiyama N, Honda O, Tsubamoto M, et al. Anterior mediastinal tumors: diagnostic accuracy of CT and MRI. Eur J Radiol. 2009;69(2):280-8. DOI: 10.1016/j.ejrad.2007.10.002
20. Ackman JB. MR Imaging of Mediastinal Masses. Magn Reson Imaging Clin N Am. 2015;23(2):141-64. DOI: 10.1016/j.mric.2015.01.002
21. Shelly S, Agmon-Levin N, Altman A, Shoenfeld Y. Thymoma and autoimmunity. Cell Mol Immunol. 2011;8(3):199-202. DOI: 10.1038/cmi.2010.74
22. Zhao J, Bhatnagar V, Ding L, et al. A systematic review of paraneoplastic syndromes associated with thymoma: Treatment modalities, recurrence, and outcomes in resected cases. J Thorac Cardiovasc Surg. 2020;160(1):306-314.e14. DOI: 10.1016/j.jtcvs.2019.11.052
23. Пищик Е.Г., Калинина Н.М., Давыдова Н.И. Синдром Гуда – редкий паранеопластический синдром при тимомах: 5-летнее наблюдение. Вопросы онкологии. 2008;(3):365-7.
Pishchik E.G., Kalinina N.M., Davydova N.I. Good's syndrome - a rare paraneoplastic syndrome in thymomas: 5-year observation. Issues of oncology. 2008;(3):365-7 (in Russian).
24. Gilhus NE. Myasthenia Gravis. N Engl J Med. 2016;375(26):2570-81. DOI: 10.1056/NEJMra1602678
25. Narayanaswami P, Sanders DB, Wolfe G, et al. International Consensus Guidance for Management of Myasthenia Gravis: 2020 Update. Neurology. 2021;96(3):114-22. DOI: 10.1212/WNL.0000000000011124
26. Tamburini N, D'Urbano F, Bagolini F, et al. Unilateral Thoracoscopic Thymectomy for Thymoma: Does Side Matter? A Single Institutional Experience. Thorac Cardiovasc Surg. 2023;71(5):418-24. DOI: 10.1055/s-0041-1731778
27. Li J, Qi G, Liu Y, et al. Meta-analysis of subxiphoid approach versus lateral approach for thoracoscopic Thymectomy. J Cardiothorac Surg. 2020;15(1):89. DOI: 10.1186/s13019-020-01135-w
28. Ambrogi V, Tacconi F, Sellitri F, et al. Subxiphoid completion thymectomy for refractory non-thymomatous myasthenia gravis. J Thorac Dis. 2020;12(5):2388-94. DOI: 10.21037/jtd.2020.03.81
29. Jiang JH, Gao J, Zhang Y, et al. Modified Subxiphoid Thoracoscopic Thymectomy for Locally Invasive Thymoma. Ann Thorac Surg. 2021;112(4):1095-100. DOI: 10.1016/j.athoracsur.2020.10.032
30. Пикин О.В., Рябов А.Б., Щербакова Н.И. и др. Ретимэктомия субксифоидальным доступом у больной с тимомой, ассоциированной с генерализованной формой миастении. Онкология. Журнал им. П.А. Герцена. 2022;11(1):50-4. DOI: 10.17116/onkolog 20221101150
Pikin O.V., Ryabov A.B., Shcherbakova N.I., et al. Rethymectomy by subxiphoidal approach in a patient with thymoma associated with generalized myasthenia. Oncology. Herzen Journal. 2022;11(1):50-4. DOI: 10.17116/onkolog20221101150 (in Russian).
3 сентября 2025
Количество просмотров: 7247