Клинический разбор в общей медицине №7 2025
1 Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University, Simferopol, Russia;
2 Pirogov City Hospital No. 1, Sevastopol, Russia
V-kostenich@mail.ru
Abstract
Drug-induced lung injury (LIPL) is caused by the reaction of lung tissue to various drugs. One of the pharmacological groups capable of leading to drug damage to the lungs include monoclonal antibodies against T-lymphocyte receptors to enhance their cytotoxic function in order to treat unresectable or metastatic melanoma. As a result, the normal regulation of the immune system is disrupted, which can lead to immune-mediated side effects. One of the most dangerous complications of monoclonal antibody therapy is pneumonitis. Due to the variety of clinical and radiological manifestations of the disease described in the literature, it is necessary to consider LIPL as a diagnosis of exclusion, which requires the accumulation of data for effective diagnosis and management of patients. The purpose – to present for the first time a clinical case of lung damage in a patient with metastatic melanoma on the background of the use of a combination of Nurulimab and Prolgolimab. According to the clinical observation data of a 68-year-old woman, the importance of a detailed medical history collection for diagnosis has been demonstrated.
Keywords: drug-induced lung injury, nurulimab, prolgolimab, pneumonitis, metastatic melanoma.
For citation: Chernorotov V.A., Beloglazov V.A., Kuznetsov V.A., Kostenich V.S. Drug-induced interstitial lung injury in a patient with metastatic melanoma using a combination of nurulimab and prolgolimab. Clinical review for general practice. 2025; 6 (7): 13–18 (In Russ.). DOI: 10.47407/kr2025.6.7.00639
Несмотря на то что концепция таргетного воздействия иммунного ответа пациента на опухоль увлекала умы ученых долгое время, лишь недавно она была внедрена в повседневную онкологическую практику [1]. Контрольные точки иммунного ответа – это молекулы, действующие как негативные регуляторы
Т-клеточного иммунного ответа, основной функцией которых является иммунная толерантность, предотвращающая развитие аутоиммунных заболеваний [2, 3]. Рецептор PD-1, а также CTLA-4 и его лиганды PD-L1 и PD-L2 являются одними из представителей иммунологических контрольных точек. PD-L1 обнаруживаются в В-лимфоцитах, дендритных клетках, макрофагах, эндотелиальных, гемопоэтических и эпителиальных клетках, нормальных противоопухолевых лимфоцитах [4]. Кроме того, экспрессия PD-L1, CLTA-4 обнаружена на клетках многих злокачественных опухолей, таких как меланома, почечно-клеточный рак, немелкоклеточный рак легкого, опухоли головы и шеи, опухоли желудочно-кишечного тракта, рак яичников, лимфомы, лейкозы, а у детей – лимфомы и лейкозы. В норме система иммунологических контрольных точек участвует в подавлении аутоиммунных реакций. Однако при развитии онкологических заболеваний опухолевые клетки способны экспрессировать на своей поверхности лиганд PD-L1, который связывается с рецептором PD-1 на Т-лимфоцитах, что подавляет цитотоксическую активность последних [3].
С целью лечения пациентов с нерезектабельной или метастатической меланомой используют фиксированную комбинацию оригинальных моноклональных антител (мАТ) против рецептора CTLA-4 (нурулимаб) и рецептора PD-1 (пролголимаб) в соотношении 1:3. Механизм действия лекарственного препарата заключается в повышении способности иммунной системы самостоятельно бороться с опухолью. Достигается это посредством связывания, введенных в организм пациента мАТ с рецепторами Т-лимфоцитов (PD-1 и CLTA-4) и, как следствие, блокированием их действия. В результате лиганды PD-L1 и PD-L2, расположенные на опухолевых клетках, не способны образовать комплекс со связанными рецепторами PD-1 и CLTA-4. В результате цитотоксическая функция Т-лимфоцитов не подавляется (рис. 1) [5].
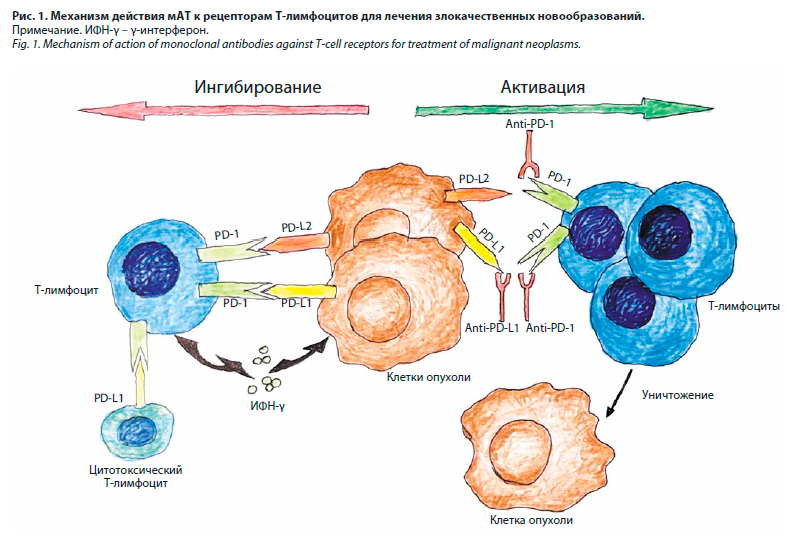
Несмотря на доказанную эффективность и более благоприятный профиль побочных явлений для иммунотерапевтических препаратов в сравнении с классической химиотерапией, данная группа лекарственных средств не лишена недостатков [6]. Поскольку рецепторы PD-1 и CTLA-4 тормозят цитотоксический эффект Т-лимфоцитов и в норме ингибируют иммунную реакцию, при введении мАТ могут нарушаться нормальные процессы регуляции иммунной системы, что приводит к неконтролируемой активации Т-клеток и является основой для иммуноопосредованных побочных эффектов [7]. Одним из наиболее опасных побочных эффектов является пневмонит [8].
Цель – впервые представить клинический случай поражения легких у пациентки с метастатической меланомой на фоне применения комбинации нурулимаб + пролголимаб.
Описанные симптомы отмечает в течение последних 7 дней с постепенным прогрессированием и ухудшением состояния. В день поступления упала, ударилась головой, после чего вызвала скорую помощь.
В анамнезе: обширная меланома кожи правой щеки, IV стадия, метастазы в лимфатические узлы шеи справа, легкие. За 1,5 года до поступления – оперативное лечение по поводу меланомы: широкое иссечение меланомы кожи щечной области справа с регионарными лимфатическими узлами, последующей интерферонотерапией. 10 мес назад выполнена радикальная паротидэктомия с расширенной лимфаденэктомией справа. Пациентка прошла 4 курса химиотерапии дакарбазином. Находится в процессе терапии комбинацией нурулимаб +
пролголимаб. Последнее введение препарата – за 3 нед до поступления.
Аллергологический анамнез не отягощен.
Пациентка постоянно принимает периндоприл 5 мг, бисопролол 2,5 мг.
Курение, употребление алкоголя отрицает. Контакт с животными отрицает. Контакт с плесенью отрицает. После подробного сбора анамнеза других аллергенов в бытовых условиях пациентки не выявлено.
Семейный анамнез по онкопатологии, заболеваниям легких не отягощен.
Объективно: аускультативно дыхание везикулярное, проводится во все отделы, звучная крепитация в среднем и нижнем отделах правого легкого по передней поверхности. Частота дыхательных движений – 20 в минуту. SaO2 при дыхании воздухом – 76%. Пульс – 116 в минуту, ритмичный. Артериальное давление – 110/70 мм рт. ст.
В остальном без клинически значимых изменений.
 В приемном отделении пациентке выполнена компьютерная томография (КТ) головного мозга с внутривенным контрастным усилением. Метастатическое поражение и переломы костей черепа были исключены.
В приемном отделении пациентке выполнена компьютерная томография (КТ) головного мозга с внутривенным контрастным усилением. Метастатическое поражение и переломы костей черепа были исключены.
Результаты лабораторных исследований: клинический анализ крови: лейкоциты 8,2×109/л, нейтрофилы 6,21×109/л, эозинофилы 1,2%, эритроциты 3,8×1012/л, гемоглобин 108 г/л, тромбоциты 133×109/л, СОЭ 24 мм/ч; биохимический анализ крови: С-реактивный белок 490 мг/л, общий белок 42,69 г/л, креатинин 93 мкмоль/л, в остальном без клинически значимых изменений. С учетом эпидемической обстановки выполнена ПЦР для определения РНК SARS-CoV2, вирусов гриппа А и В, результат – не обнаружено.
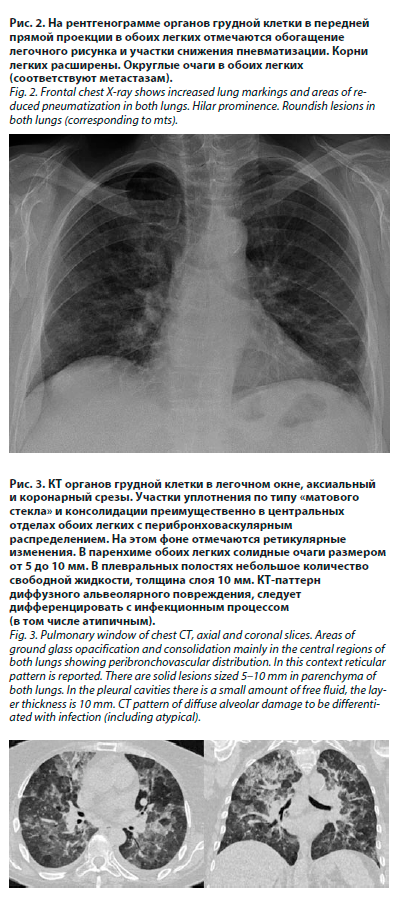
Выполнена рентгенография органов грудной клетки (рис. 2).
Учитывая приведенные данные, установлен диагноз «внебольничная пневмония». Пациентка госпитализирована в терапевтическое отделение. В отделении получала: инсуффляцию кислорода через назальные канюли со скоростью потока 5 л/мин, цефтриаксон 1 г 2 раза в день внутримышечно, профилактические дозы
нефракционированного гепарина для профилактики венозной тромбоэмболиии в связи с высоким риском по шкале Padua.
После 72 ч антибиотикотерапии цефтриаксоном состояние пациентки без положительной динамики. Для уточнения диагноза выполнена КТ органов грудной клетки (рис. 3).
Учитывая изменения на КТ и клинические данные, в частности прием препаратов на основе мАТ – нурулимаба и пролголимаба, был выставлен диагноз: лекарственно-индуцированное поражение легких. Пациентке были назначены: преднизолон 120 мг внутривенно с постепенным снижением дозы до 60 мг/сут в течение 10 дней, левофлоксацин 500 мг 2 раза в день внутривенно.
На фоне проводимого лечения состояние пациентки – с выраженной положительной динамикой: достигнута стойкая нормотермия, уменьшились головокружение и слабость.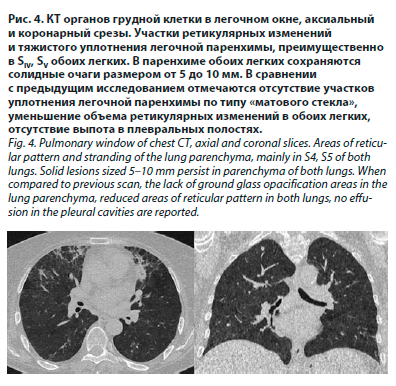 Объективно: при аускультации легких дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. SaO2 при дыхании воздухом 98%. Результаты контрольных лабораторных исследований: лейкоциты 6,2×109/л, эритроциты 3,53×1012/л, гемоглобин 101 г/л, тромбоциты 257×109/л, СОЭ 32 мм/ч; биохимический анализ крови: С-реактивный белок 36 мг/л, общий белок 48 г/л, в остальном без клинически значимых изменений.
Объективно: при аускультации легких дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. SaO2 при дыхании воздухом 98%. Результаты контрольных лабораторных исследований: лейкоциты 6,2×109/л, эритроциты 3,53×1012/л, гемоглобин 101 г/л, тромбоциты 257×109/л, СОЭ 32 мм/ч; биохимический анализ крови: С-реактивный белок 36 мг/л, общий белок 48 г/л, в остальном без клинически значимых изменений.
На 9-е сутки лечения глюкокортикостероидами (ГКС) выполнена контрольная КТ органов грудной клетки (рис. 4).
Через 13 койко-дней лечения пациентка выписана из стационара для продолжения лечения в амбулаторных условиях. Назначены преднизолон 30 мг в день перорально на 1 мес с дальнейшим постепенным снижением дозы, ингибиторы протонного насоса, препараты кальция и витамина D.
Диагностика поражения легких у пациентов на фоне злокачественного новообразования и терапии ИКТИО является сложной проблемой, требующей комплексного подхода и широкого дифференциально-диагностического ряда. Атипичным в клинической картине представленного случая было отсутствие респираторных жалоб. С учетом лихорадки и данных, полученных в ходе объективного исследования, повышения острофазовых показателей крови и уплотнения легочной паренхимы по данным рентгенологической картины установлен диагноз «внебольничная пневмония». Начата этиотропная терапия антибиотиками широкого спектра.
В связи с неэффективностью лечения в течение 72 ч к лечению добавлен второй антибактериальный препарат. Для уточнения диагноза выполнено КТ-исследование органов грудной клетки, по результатам которого выявлен паттерн диффузного альвеолярного поражения. В дифференциально-диагностический ряд вошли следующие диагнозы: пневмония (бактериальная, вирусная, вызванная оппортунистическими агентами: пневмоцистная, грибковая), интерстициальное поражение легких лекарственного генеза (пневмонит), тромбоэмболия легочной артерии, системный васкулит с поражением легких. Тромбоэмболия легочной артерии была маловероятной из-за низкого риска по шкале Wells, наличия лихорадки, КТ-картины, предполагающей иное поражение. Дальнейшее обследование в этом направлении признано нецелесообразным. Системный васкулит решено считать маловероятным по причине отсутствия признаков поражения иных органов и систем, дальнейшее обследование признано нецелесообразным. Пациентка не продуцировала мокроту, а выполнение бронхоальвеолярного лаважа было недоступно, так же как и экспресс-тестов на антигены легионелл и пневмококка. Вирусная пневмония исключена путем ПЦР на РНК SARS-CoV-2, гриппа. Не получено данных об иммунодефиците: нет лейкопении, нейтропении, оппортунистические инфекции не являются характерным осложнением лечения ИКТИО. Принимая во внимание вышесказанное, нельзя достоверно исключить бактериальную пневмонию, пневмонию, вызванную оппортунистическими агентами. В связи с этим терапия антибактериальными препаратами продолжалась. У пациентки имели место: острое развитие поражения легочной паренхимы; в анамнезе прием ИКТИО, для которых характерно развитие пневмонита как нежелательного явления (интервал между применением лекарственного препарата и развитием поражения легких не исключает связь этих событий); КТ-паттерн диффузного альвеолярного повреждения. Опираясь на вышеназванные факты, было решено считать более вероятным диагноз лекарственно-индуцированного заболевания легких. По классификации CTCAE (Common Termonology Criteria for Adverse Events) оно соответствует 3-й степени тяжести иммуноопосредованных нежелательных реакций. Назначены ГКС в высоких дозах внутривенно. Достигнута выраженная положительная динамика в виде регресса лихорадки, дыхательной недостаточности, снижения уровней острофазовых показателей, положительной радиологической картины. Пациентка выписана на амбулаторное лечение, рекомендован пероральный прием ГКС с постепенным снижением дозы.
Первичная заболеваемость пневмонитом в результате применения ИКТИО составляет 1–7% [10]. Иммуноопосредованное поражение легких развивается как во время лечения ИКТИО, так и после отмены препарата, в том числе сообщают и об отдаленных случаях развития пневмонита – через 4–28 мес после отмены [11, 12]. Сообщается также и о рекуррентных (в том числе об отдаленных рекуррентных) случаях [11]. КТ высокого разрешения – метод выбора для диагностики изменений со стороны дыхательной системы. КТ-картина лекарственно-индуцированного поражения легких чаще всего представлена следующими паттернами: диффузным альвеолярным повреждением, организующейся пневмонией, гиперсенситивным пневмонитом, неспецифической интерстициальной пневмонией [13]. Изменения на КТ у пациентки соответствовали КТ-паттерну диффузного альвеолярного повреждения в ранней фазе, характеризующемуся двусторонними уплотнениями легочной паренхимы по типу «матового стекла» и консолидации, выпотом в плевральные полости, возможным симптомом бронхоэктазии (в представленном случае не отмечался). Дифференциально-диагностический ряд должен включать следующие состояния: пневмония (бактериальная, вирусная, туберкулезная, грибковая), прогрессирование и псевдопрогрессирование опухоли, обострение хронической обструктивной болезни легких, лучевое поражение легких, кардиогенный отек легких, тромбоэмболия легочной артерии, системные заболевания соединительной ткани с поражением легких, респираторные симптомы в результате иных иммуноопосредованных нежелательных явлений (миокардит, тиреоидит с плевральным выпотом, миастения). Краеугольным камнем лечения пневмонита, индуцированного ИКТИО, является применение ГКС в дозе 1–2 мг/кг в течение не менее чем 1 мес [14]. Доза определяется тяжестью проявлений пневмонита. При пневмоните I–II стадии по CTCAE сообщают об эффективности меньших доз – 0,5 мг/кг массы тела. Большинство случаев хорошо отвечают на терапию ГКС [15]. Для лечения стероидорезистентных случаев существуют следующие опции: внутривенный иммуноглобулин [15], ингибиторы рецептора интерлейкина-6 [16], антитела к фактору некроза опухоли [17], пульс-терапия ГКС [18], микофенолата мофетил [19], циклофосфамид [15].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без спонсорской поддержки.
Acknowledgements. The study had no sponsorship.
Соответствие нормам этики. Информированное согласие от пациентки получено. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Compliance with ethical standards. The patient submitted the informed consent. The study was conducted in accordance with the principles of the Declaration of Helsinki.
Информация об авторах
Information about the authors
Черноротов Владимир Алексеевич – д-р мед. наук, проф., зав. каф. лучевой диагностики и лучевой терапии, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет
им. В.И. Вернадского». E-mail: chernorotov.csmu@mail.ru; ORCID: 0000-0002-3111-9747
Vladimir A. Chernorotov – Dr. Sci. (Med.), Full Prof., Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: chernorotov.csmu@mail.ru; ORCID: 0000-0002-3111-9747
Белоглазов Владимир Алексеевич – д-р мед. наук, проф., зав. каф. внутренней медицины №2, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Vladimir A. Beloglazov – Dr. Sci. (Med.), Full Prof., Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Кузнецов Вячеслав Александрович – врач-терапевт, ГБУЗ «Городская больница № 1 им. Н.И. Пирогова». E-mail: kuznetsov_v_a@outlook.com; ORCID: 0000-0002-0072-2025
Vyacheslav A. Kuznetsov – therapist, Pirogov City Hospital No. 1. E-mail: kuznetsov_v_a@outlook.com; ORCID: 0000-0002-0072-2025
Костенич Виктор Сергеевич – аспирант, ст. преподаватель каф. лучевой диагностики и лучевой терапии, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: v-kostenich@mail.ru; ORCID: 0000-0001-5733-6953
Victor S. Kostenich – Graduate Student, Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: v-kostenich@mail.ru; ORCID: 0000-0001-5733-6953
Поступила в редакцию: 24.03.2025
Поступила после рецензирования: 07.04.2025
Принята к публикации: 17.04.2025
Received: 24.03.2025
Revised: 07.04.2025
Accepted: 17.04.2025
Клинический разбор в общей медицине №7 2025
Лекарственно-индуцированное интерстициальное поражение легких у пациента с метастатической меланомой при использовании комбинации нурулимаб + пролголимаб
Номера страниц в выпуске:13-18
Аннотация
Лекарственно-индуцированное поражение легких обусловлено реакцией легочной ткани на различные лекарственные средства. Одной из фармакологических групп, способных приводить к лекарственному поражению легких, являются моноклональные антитела против рецепторов Т-лимфоцитов для повышения их цитотоксической функции с целью лечения нерезектабельной или метастатической меланомы. В результате нарушается нормальная регуляция иммунной системы, что может привести к иммуноопосредованным побочным эффектам. Одним из наиболее опасных осложнений терапии моноклональными антителами является пневмонит. В силу разнообразия описываемых в литературе клинических и рентгенологических проявлений заболевания необходимо рассматривать лекарственно-индуцированное поражение легких как диагноз исключения, что требует накопления данных для эффективной диагностики и ведения пациентов. Цель – впервые представить клинический случай поражения легких у пациентки с метастатической меланомой на фоне применения комбинации нурулимаб + пролголимаб. По данным клинического наблюдения женщины 68 лет продемонстрирована значимость детального сбора анамнеза болезни для установления диагноза.
Ключевые слова: лекарственно-индуцированное поражение легких, нурулимаб, пролголимаб, пневмонит, метастатическая меланома.
Для цитирования: Черноротов В.А., Белоглазов В.А., Кузнецов В.А., Костенич В.С. Лекарственно-индуцированное интерстициальное поражение легких у пациента с метастатической меланомой при использовании комбинации нурулимаб + пролголимаб. Клинический разбор в общей медицине. 2025; 6 (7): 13–18. DOI: 10.47407/kr2025.6.7.00639
Лекарственно-индуцированное поражение легких обусловлено реакцией легочной ткани на различные лекарственные средства. Одной из фармакологических групп, способных приводить к лекарственному поражению легких, являются моноклональные антитела против рецепторов Т-лимфоцитов для повышения их цитотоксической функции с целью лечения нерезектабельной или метастатической меланомы. В результате нарушается нормальная регуляция иммунной системы, что может привести к иммуноопосредованным побочным эффектам. Одним из наиболее опасных осложнений терапии моноклональными антителами является пневмонит. В силу разнообразия описываемых в литературе клинических и рентгенологических проявлений заболевания необходимо рассматривать лекарственно-индуцированное поражение легких как диагноз исключения, что требует накопления данных для эффективной диагностики и ведения пациентов. Цель – впервые представить клинический случай поражения легких у пациентки с метастатической меланомой на фоне применения комбинации нурулимаб + пролголимаб. По данным клинического наблюдения женщины 68 лет продемонстрирована значимость детального сбора анамнеза болезни для установления диагноза.
Ключевые слова: лекарственно-индуцированное поражение легких, нурулимаб, пролголимаб, пневмонит, метастатическая меланома.
Для цитирования: Черноротов В.А., Белоглазов В.А., Кузнецов В.А., Костенич В.С. Лекарственно-индуцированное интерстициальное поражение легких у пациента с метастатической меланомой при использовании комбинации нурулимаб + пролголимаб. Клинический разбор в общей медицине. 2025; 6 (7): 13–18. DOI: 10.47407/kr2025.6.7.00639
Drug-induced interstitial lung injury in a patient with metastatic melanoma using a combination of nurulimab and prolgolimab
Vladimir A. Chernorotov1, Vladimir A. Beloglazov1, Vyacheslav A. Kuznetsov2, Victor S. Kostenich11 Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University, Simferopol, Russia;
2 Pirogov City Hospital No. 1, Sevastopol, Russia
V-kostenich@mail.ru
Abstract
Drug-induced lung injury (LIPL) is caused by the reaction of lung tissue to various drugs. One of the pharmacological groups capable of leading to drug damage to the lungs include monoclonal antibodies against T-lymphocyte receptors to enhance their cytotoxic function in order to treat unresectable or metastatic melanoma. As a result, the normal regulation of the immune system is disrupted, which can lead to immune-mediated side effects. One of the most dangerous complications of monoclonal antibody therapy is pneumonitis. Due to the variety of clinical and radiological manifestations of the disease described in the literature, it is necessary to consider LIPL as a diagnosis of exclusion, which requires the accumulation of data for effective diagnosis and management of patients. The purpose – to present for the first time a clinical case of lung damage in a patient with metastatic melanoma on the background of the use of a combination of Nurulimab and Prolgolimab. According to the clinical observation data of a 68-year-old woman, the importance of a detailed medical history collection for diagnosis has been demonstrated.
Keywords: drug-induced lung injury, nurulimab, prolgolimab, pneumonitis, metastatic melanoma.
For citation: Chernorotov V.A., Beloglazov V.A., Kuznetsov V.A., Kostenich V.S. Drug-induced interstitial lung injury in a patient with metastatic melanoma using a combination of nurulimab and prolgolimab. Clinical review for general practice. 2025; 6 (7): 13–18 (In Russ.). DOI: 10.47407/kr2025.6.7.00639
Несмотря на то что концепция таргетного воздействия иммунного ответа пациента на опухоль увлекала умы ученых долгое время, лишь недавно она была внедрена в повседневную онкологическую практику [1]. Контрольные точки иммунного ответа – это молекулы, действующие как негативные регуляторы
Т-клеточного иммунного ответа, основной функцией которых является иммунная толерантность, предотвращающая развитие аутоиммунных заболеваний [2, 3]. Рецептор PD-1, а также CTLA-4 и его лиганды PD-L1 и PD-L2 являются одними из представителей иммунологических контрольных точек. PD-L1 обнаруживаются в В-лимфоцитах, дендритных клетках, макрофагах, эндотелиальных, гемопоэтических и эпителиальных клетках, нормальных противоопухолевых лимфоцитах [4]. Кроме того, экспрессия PD-L1, CLTA-4 обнаружена на клетках многих злокачественных опухолей, таких как меланома, почечно-клеточный рак, немелкоклеточный рак легкого, опухоли головы и шеи, опухоли желудочно-кишечного тракта, рак яичников, лимфомы, лейкозы, а у детей – лимфомы и лейкозы. В норме система иммунологических контрольных точек участвует в подавлении аутоиммунных реакций. Однако при развитии онкологических заболеваний опухолевые клетки способны экспрессировать на своей поверхности лиганд PD-L1, который связывается с рецептором PD-1 на Т-лимфоцитах, что подавляет цитотоксическую активность последних [3].
С целью лечения пациентов с нерезектабельной или метастатической меланомой используют фиксированную комбинацию оригинальных моноклональных антител (мАТ) против рецептора CTLA-4 (нурулимаб) и рецептора PD-1 (пролголимаб) в соотношении 1:3. Механизм действия лекарственного препарата заключается в повышении способности иммунной системы самостоятельно бороться с опухолью. Достигается это посредством связывания, введенных в организм пациента мАТ с рецепторами Т-лимфоцитов (PD-1 и CLTA-4) и, как следствие, блокированием их действия. В результате лиганды PD-L1 и PD-L2, расположенные на опухолевых клетках, не способны образовать комплекс со связанными рецепторами PD-1 и CLTA-4. В результате цитотоксическая функция Т-лимфоцитов не подавляется (рис. 1) [5].

Несмотря на доказанную эффективность и более благоприятный профиль побочных явлений для иммунотерапевтических препаратов в сравнении с классической химиотерапией, данная группа лекарственных средств не лишена недостатков [6]. Поскольку рецепторы PD-1 и CTLA-4 тормозят цитотоксический эффект Т-лимфоцитов и в норме ингибируют иммунную реакцию, при введении мАТ могут нарушаться нормальные процессы регуляции иммунной системы, что приводит к неконтролируемой активации Т-клеток и является основой для иммуноопосредованных побочных эффектов [7]. Одним из наиболее опасных побочных эффектов является пневмонит [8].
Цель – впервые представить клинический случай поражения легких у пациентки с метастатической меланомой на фоне применения комбинации нурулимаб + пролголимаб.
Клинический случай
Женщина 68 лет, пенсионерка, доставлена бригадой скорой медицинской помощи в приемное отделение городской больницы г. Севастополь с жалобами на лихорадку до 39 °С, выраженную слабость, головокружение.Описанные симптомы отмечает в течение последних 7 дней с постепенным прогрессированием и ухудшением состояния. В день поступления упала, ударилась головой, после чего вызвала скорую помощь.
В анамнезе: обширная меланома кожи правой щеки, IV стадия, метастазы в лимфатические узлы шеи справа, легкие. За 1,5 года до поступления – оперативное лечение по поводу меланомы: широкое иссечение меланомы кожи щечной области справа с регионарными лимфатическими узлами, последующей интерферонотерапией. 10 мес назад выполнена радикальная паротидэктомия с расширенной лимфаденэктомией справа. Пациентка прошла 4 курса химиотерапии дакарбазином. Находится в процессе терапии комбинацией нурулимаб +
пролголимаб. Последнее введение препарата – за 3 нед до поступления.
Аллергологический анамнез не отягощен.
Пациентка постоянно принимает периндоприл 5 мг, бисопролол 2,5 мг.
Курение, употребление алкоголя отрицает. Контакт с животными отрицает. Контакт с плесенью отрицает. После подробного сбора анамнеза других аллергенов в бытовых условиях пациентки не выявлено.
Семейный анамнез по онкопатологии, заболеваниям легких не отягощен.
Объективно: аускультативно дыхание везикулярное, проводится во все отделы, звучная крепитация в среднем и нижнем отделах правого легкого по передней поверхности. Частота дыхательных движений – 20 в минуту. SaO2 при дыхании воздухом – 76%. Пульс – 116 в минуту, ритмичный. Артериальное давление – 110/70 мм рт. ст.
В остальном без клинически значимых изменений.
 В приемном отделении пациентке выполнена компьютерная томография (КТ) головного мозга с внутривенным контрастным усилением. Метастатическое поражение и переломы костей черепа были исключены.
В приемном отделении пациентке выполнена компьютерная томография (КТ) головного мозга с внутривенным контрастным усилением. Метастатическое поражение и переломы костей черепа были исключены. Результаты лабораторных исследований: клинический анализ крови: лейкоциты 8,2×109/л, нейтрофилы 6,21×109/л, эозинофилы 1,2%, эритроциты 3,8×1012/л, гемоглобин 108 г/л, тромбоциты 133×109/л, СОЭ 24 мм/ч; биохимический анализ крови: С-реактивный белок 490 мг/л, общий белок 42,69 г/л, креатинин 93 мкмоль/л, в остальном без клинически значимых изменений. С учетом эпидемической обстановки выполнена ПЦР для определения РНК SARS-CoV2, вирусов гриппа А и В, результат – не обнаружено.
Выполнена рентгенография органов грудной клетки (рис. 2).
Учитывая приведенные данные, установлен диагноз «внебольничная пневмония». Пациентка госпитализирована в терапевтическое отделение. В отделении получала: инсуффляцию кислорода через назальные канюли со скоростью потока 5 л/мин, цефтриаксон 1 г 2 раза в день внутримышечно, профилактические дозы
нефракционированного гепарина для профилактики венозной тромбоэмболиии в связи с высоким риском по шкале Padua.
После 72 ч антибиотикотерапии цефтриаксоном состояние пациентки без положительной динамики. Для уточнения диагноза выполнена КТ органов грудной клетки (рис. 3).
Учитывая изменения на КТ и клинические данные, в частности прием препаратов на основе мАТ – нурулимаба и пролголимаба, был выставлен диагноз: лекарственно-индуцированное поражение легких. Пациентке были назначены: преднизолон 120 мг внутривенно с постепенным снижением дозы до 60 мг/сут в течение 10 дней, левофлоксацин 500 мг 2 раза в день внутривенно.
На фоне проводимого лечения состояние пациентки – с выраженной положительной динамикой: достигнута стойкая нормотермия, уменьшились головокружение и слабость.
 Объективно: при аускультации легких дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. SaO2 при дыхании воздухом 98%. Результаты контрольных лабораторных исследований: лейкоциты 6,2×109/л, эритроциты 3,53×1012/л, гемоглобин 101 г/л, тромбоциты 257×109/л, СОЭ 32 мм/ч; биохимический анализ крови: С-реактивный белок 36 мг/л, общий белок 48 г/л, в остальном без клинически значимых изменений.
Объективно: при аускультации легких дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. SaO2 при дыхании воздухом 98%. Результаты контрольных лабораторных исследований: лейкоциты 6,2×109/л, эритроциты 3,53×1012/л, гемоглобин 101 г/л, тромбоциты 257×109/л, СОЭ 32 мм/ч; биохимический анализ крови: С-реактивный белок 36 мг/л, общий белок 48 г/л, в остальном без клинически значимых изменений.На 9-е сутки лечения глюкокортикостероидами (ГКС) выполнена контрольная КТ органов грудной клетки (рис. 4).
Через 13 койко-дней лечения пациентка выписана из стационара для продолжения лечения в амбулаторных условиях. Назначены преднизолон 30 мг в день перорально на 1 мес с дальнейшим постепенным снижением дозы, ингибиторы протонного насоса, препараты кальция и витамина D.
Обсуждение
Первый ингибитор контрольных точек иммунного ответа (ИКТИО) был одобрен для терапии метастатической меланомы в 2011 г. [20]. За прошедшие годы опубликовано множество научных материалов, посвященных эффективности и безопасности данной группы препаратов. В частности, освещены подходы к ведению больных с иммуноопосредованными нежелательными явлениями – «визитной карточкой» ИКТИО. Пролголимаб – первый оригинальный отечественный ингибитор PD-1, зарегистрирован в 2021 г. В конце 2023 г. зарегистрирована фиксированная комбинация мАТ отечественной разработки нурулимаб + пролголимаб. Информация об иммуноопосредованных нежелательных явлениях в результате применения этих препаратов ограничивается исследованием OBERTONE и экстраполирована из данных по применению иных препаратов данной фармакологической группы. OBERTONE – рандомизированное клиническое исследование II фазы, в котором комбинация нурулимаб + пролголимаб сравнивалась с монотерапией пролголимабом для лечения меланомы. Иммуноопосредованные нежелательные реакции зарегистрированы у 24,1% пациентов. Однако в исследовании не указывается частота развития отдельных осложнений, в том числе пневмонита [9]. На момент написания статьи мы не смогли найти публикации об эпидемиологии, ответе на лечение пневмонита в результате применения фиксированной комбинации нурулимаб + пролголимаб.Диагностика поражения легких у пациентов на фоне злокачественного новообразования и терапии ИКТИО является сложной проблемой, требующей комплексного подхода и широкого дифференциально-диагностического ряда. Атипичным в клинической картине представленного случая было отсутствие респираторных жалоб. С учетом лихорадки и данных, полученных в ходе объективного исследования, повышения острофазовых показателей крови и уплотнения легочной паренхимы по данным рентгенологической картины установлен диагноз «внебольничная пневмония». Начата этиотропная терапия антибиотиками широкого спектра.
В связи с неэффективностью лечения в течение 72 ч к лечению добавлен второй антибактериальный препарат. Для уточнения диагноза выполнено КТ-исследование органов грудной клетки, по результатам которого выявлен паттерн диффузного альвеолярного поражения. В дифференциально-диагностический ряд вошли следующие диагнозы: пневмония (бактериальная, вирусная, вызванная оппортунистическими агентами: пневмоцистная, грибковая), интерстициальное поражение легких лекарственного генеза (пневмонит), тромбоэмболия легочной артерии, системный васкулит с поражением легких. Тромбоэмболия легочной артерии была маловероятной из-за низкого риска по шкале Wells, наличия лихорадки, КТ-картины, предполагающей иное поражение. Дальнейшее обследование в этом направлении признано нецелесообразным. Системный васкулит решено считать маловероятным по причине отсутствия признаков поражения иных органов и систем, дальнейшее обследование признано нецелесообразным. Пациентка не продуцировала мокроту, а выполнение бронхоальвеолярного лаважа было недоступно, так же как и экспресс-тестов на антигены легионелл и пневмококка. Вирусная пневмония исключена путем ПЦР на РНК SARS-CoV-2, гриппа. Не получено данных об иммунодефиците: нет лейкопении, нейтропении, оппортунистические инфекции не являются характерным осложнением лечения ИКТИО. Принимая во внимание вышесказанное, нельзя достоверно исключить бактериальную пневмонию, пневмонию, вызванную оппортунистическими агентами. В связи с этим терапия антибактериальными препаратами продолжалась. У пациентки имели место: острое развитие поражения легочной паренхимы; в анамнезе прием ИКТИО, для которых характерно развитие пневмонита как нежелательного явления (интервал между применением лекарственного препарата и развитием поражения легких не исключает связь этих событий); КТ-паттерн диффузного альвеолярного повреждения. Опираясь на вышеназванные факты, было решено считать более вероятным диагноз лекарственно-индуцированного заболевания легких. По классификации CTCAE (Common Termonology Criteria for Adverse Events) оно соответствует 3-й степени тяжести иммуноопосредованных нежелательных реакций. Назначены ГКС в высоких дозах внутривенно. Достигнута выраженная положительная динамика в виде регресса лихорадки, дыхательной недостаточности, снижения уровней острофазовых показателей, положительной радиологической картины. Пациентка выписана на амбулаторное лечение, рекомендован пероральный прием ГКС с постепенным снижением дозы.
Первичная заболеваемость пневмонитом в результате применения ИКТИО составляет 1–7% [10]. Иммуноопосредованное поражение легких развивается как во время лечения ИКТИО, так и после отмены препарата, в том числе сообщают и об отдаленных случаях развития пневмонита – через 4–28 мес после отмены [11, 12]. Сообщается также и о рекуррентных (в том числе об отдаленных рекуррентных) случаях [11]. КТ высокого разрешения – метод выбора для диагностики изменений со стороны дыхательной системы. КТ-картина лекарственно-индуцированного поражения легких чаще всего представлена следующими паттернами: диффузным альвеолярным повреждением, организующейся пневмонией, гиперсенситивным пневмонитом, неспецифической интерстициальной пневмонией [13]. Изменения на КТ у пациентки соответствовали КТ-паттерну диффузного альвеолярного повреждения в ранней фазе, характеризующемуся двусторонними уплотнениями легочной паренхимы по типу «матового стекла» и консолидации, выпотом в плевральные полости, возможным симптомом бронхоэктазии (в представленном случае не отмечался). Дифференциально-диагностический ряд должен включать следующие состояния: пневмония (бактериальная, вирусная, туберкулезная, грибковая), прогрессирование и псевдопрогрессирование опухоли, обострение хронической обструктивной болезни легких, лучевое поражение легких, кардиогенный отек легких, тромбоэмболия легочной артерии, системные заболевания соединительной ткани с поражением легких, респираторные симптомы в результате иных иммуноопосредованных нежелательных явлений (миокардит, тиреоидит с плевральным выпотом, миастения). Краеугольным камнем лечения пневмонита, индуцированного ИКТИО, является применение ГКС в дозе 1–2 мг/кг в течение не менее чем 1 мес [14]. Доза определяется тяжестью проявлений пневмонита. При пневмоните I–II стадии по CTCAE сообщают об эффективности меньших доз – 0,5 мг/кг массы тела. Большинство случаев хорошо отвечают на терапию ГКС [15]. Для лечения стероидорезистентных случаев существуют следующие опции: внутривенный иммуноглобулин [15], ингибиторы рецептора интерлейкина-6 [16], антитела к фактору некроза опухоли [17], пульс-терапия ГКС [18], микофенолата мофетил [19], циклофосфамид [15].
Заключение
Диагностика поражений легких у пациентов со злокачественными заболеваниями, принимающих ИКТИО, в реальной клинической практике является сложной задачей. Эссенциально важно включать пневмонит в дифференциально-диагностический поиск при появлении респираторной симптоматики у пациентов, получающих ИКТИО. Пневмонит является нередким и потенциально летальным иммуноопосредованным нежелательным явлением терапии ИКТИО. Требуются тщательные исследования профиля безопасности фиксированой комбинации нурулимаб + пролголимаб, в том числе в отношении частоты развития и прогноза пневмонита, для определения его соответствия имеющимся данным о применении иных ИКТИО.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без спонсорской поддержки.
Acknowledgements. The study had no sponsorship.
Соответствие нормам этики. Информированное согласие от пациентки получено. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Compliance with ethical standards. The patient submitted the informed consent. The study was conducted in accordance with the principles of the Declaration of Helsinki.
Информация об авторах
Information about the authors
Черноротов Владимир Алексеевич – д-р мед. наук, проф., зав. каф. лучевой диагностики и лучевой терапии, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет
им. В.И. Вернадского». E-mail: chernorotov.csmu@mail.ru; ORCID: 0000-0002-3111-9747
Vladimir A. Chernorotov – Dr. Sci. (Med.), Full Prof., Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: chernorotov.csmu@mail.ru; ORCID: 0000-0002-3111-9747
Белоглазов Владимир Алексеевич – д-р мед. наук, проф., зав. каф. внутренней медицины №2, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Vladimir A. Beloglazov – Dr. Sci. (Med.), Full Prof., Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Кузнецов Вячеслав Александрович – врач-терапевт, ГБУЗ «Городская больница № 1 им. Н.И. Пирогова». E-mail: kuznetsov_v_a@outlook.com; ORCID: 0000-0002-0072-2025
Vyacheslav A. Kuznetsov – therapist, Pirogov City Hospital No. 1. E-mail: kuznetsov_v_a@outlook.com; ORCID: 0000-0002-0072-2025
Костенич Виктор Сергеевич – аспирант, ст. преподаватель каф. лучевой диагностики и лучевой терапии, Ордена Трудового Красного Знамени медицинский институт им. С.И. Георгиевского, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: v-kostenich@mail.ru; ORCID: 0000-0001-5733-6953
Victor S. Kostenich – Graduate Student, Georgievsky Order of the Red Banner Medical Institute, Vernadsky Crimean Federal University. E-mail: v-kostenich@mail.ru; ORCID: 0000-0001-5733-6953
Поступила в редакцию: 24.03.2025
Поступила после рецензирования: 07.04.2025
Принята к публикации: 17.04.2025
Received: 24.03.2025
Revised: 07.04.2025
Accepted: 17.04.2025
Список исп. литературыСкрыть список1. Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature. 2011 Dec 21;480(7378):480-9. DOI: 10.1038/nature10673
2. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013 Jul 25;39(1):1-10. DOI: 10.1016/j.immuni.2013.07.012
3. Callahan MK, Wolchok JD. At the bedside: CTLA-4- and PD-1-blocking antibodies in cancer immunotherapy. J Leukoc Biol. 2013 Jul;94(1):41-53. DOI: 10.1189/jlb.1212631
4. Meng X, Huang Z, Teng F, et al. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy. Cancer Treat Rev. 2015 Dec;41(10):868-76. DOI: 10.1016/j.ctrv.2015.11.001
5. Ключагина Ю.И., Соколова З.А., Барышникова М.А. Роль рецептора PD1 и его лигандов PDL1 и PDL2 в иммунотерапии опухолей. Онкопедиатрия. 2017;4(1):49-55. DOI: 10.15690/onco. v4i1.1684
Klyuchagina Yu.I., Sokolova Z.A., Baryshnikova M.A. Role of PD-1 Receptor and Its Ligands PD-L1 and PD-L2 in Cancer Immunotherapy. Onkopediatria. 2017;4(1):49-55. DOI: 10.15690/onco.v4i1.1684 (in Russian).
6. Guan M, Zhou YP, Sun JL, Chen SC. Adverse events of monoclonal antibodies used for cancer therapy. Biomed Res Int. 2015; 2015:428169. DOI: 10.1155/2015/428169
7. Weber JS, Yang JC, Atkins MB, Disis ML. Toxicities of Immunotherapy for the Practitioner. J Clin Oncol. 2015 Jun 20;33(18):2092-9. DOI: 10.1200/JCO.2014.60.0379
8. Денисова Е.С., Ардзинба М.С., Лактионов КК и др. Клинический случай иммуноопосредованного пневмонита после комбинированного лечения немелкоклеточного рака легкого. Медицинский совет. 2020;(9):248-54. DOI: 10.21518/2079-701X-2020-9-258-264
Denisova ES, Ardzinba MS, Laktionov KK, et al. A case report of immune-related pneumonitis after combined treatment of non small cell lung cancer. Meditsinskiy sovet = Medical Council. 2020;(9):258-64. DOI: 10.21518/2079-701X-2020-9-258-264 (in Russian).
9. Самойленко И.В., Демидов Л.В., Моисеенко Ф.В. и др. Эффективность и безопасность препарата нурулимаб+пролголимаб с продолжением терапии пролголимабом по сравнению с монотерапией пролголимабом в качестве 1-й линии терапии пациентов с нерезектабельной или метастатической меланомой: финальные результаты фазы II клинического исследования OBERTON. Современная онкология. 2023;25(3):313-24. DOI: 10.26442/ 18151434.2023.3.202463
Samoylenko IV, Demidov LV, Moiseenko FV, et al. Efficacy and safety of nurulimab+prolgolimab with continued prolgolimab therapy compared to prolgolimab alone as first-line therapy in patients with unresectable or metastatic melanoma: final results of the phase II OBERTON clinical study. Journal of Modern Oncology. 2023;25(3):313-24. DOI: 10.26442/18151434.2023.3.202463 (in Russian).
10. Su Q, Zhu EC, Wu JB, et al. Risk of Pneumonitis and Pneumonia Associated With Immune Checkpoint Inhibitors for Solid Tumors: A Systematic Review and Meta-Analysis. Front Immunol. 2019 Feb 4;10:108. DOI: 10.3389/fimmu.2019.00108
11. Küçükarda A, Gökmen Ý, Özcan E, et al. Recurrent delayed immune-related pneumonitis after immune-checkpoint inhibitor therapy for advanced osteosarcoma. Immunotherapy. 2022 Apr;14(6):395-99. DOI: 10.2217/imt-2021-0275
12. Kimura H, Sone T, Araya T, et al. Late-onset programmed cell death protein-1 inhibitor-induced pneumonitis after cessation of nivolumab or pembrolizumab in patients with advanced non-small cell lung cancer: A case series. Transl Lung Cancer Res. 2021;10:1576-81. DOI: 10.21037/tlcr-20-582
13. Johkoh T, Lee KS, Nishino M, et al. Chest CT Diagnosis and Clinical Management of Drug-related Pneumonitis in Patients Receiving Molecular Targeting Agents and Immune Checkpoint Inhibitors: A Position Paper from the Fleischner Society. Radiology. 2021 Mar;298(3):550-66. DOI: 10.1148/radiol.2021203427
14. Friedman CF, Proverbs-Singh TA, Postow MA. Treatment of the Immune-Related Adverse Effects of Immune Checkpoint Inhibitors: A Review. JAMA Oncol. 2016 Oct 1;2(10):1346-53. DOI: 10.1001/ jamaoncol.2016.1051
15. Wang H, Guo X, Zhou J, et al. Clinical diagnosis and treatment of immune checkpoint inhibitor-associated pneumonitis. Thorac Cancer. 2020 Jan;11(1):191-7. DOI: 10.1111/1759-7714.13240
16. Stroud CR, Hegde A, Cherry C, et al. Tocilizumab for the management of immune mediated adverse events secondary to PD-1 blockade. J Oncol Pharm Pract. 2019 Apr;25(3):551-7. DOI: 10.1177/107 8155217745144
17. Suresh K, Voong KR, Shankar B, et al. Pneumonitis in Non-Small Cell Lung Cancer Patients Receiving Immune Checkpoint Immunotherapy: Incidence and Risk Factors. J Thorac Oncol. 2018 Dec;13(12):1930-9. DOI: 10.1016/j.jtho.2018.08.2035
18. Lai KC, Hsiao YH, Chen SC. Pulse corticosteroid therapy in the treatment of steroid-refractory immune checkpoint inhibitor-related pneumonitis: Case report and review. Front Immunol. 2022 Aug 31;13:994064. DOI: 10.3389/fimmu.2022.994064
19. Shioiri N, Kikuchi R, Matsumoto I, et al. Effective treatment of steroid-resistant immune checkpoint inhibitor pneumonitis with mycophenolate mofetil. Respirol Case Rep. 2024 Apr 15;12(4):e01356. DOI: 10.1002/rcr2.1356
20. Abbott M, Ustoyev Y. Cancer and the Immune System: The History and Background of Immunotherapy. Semin Oncol Nurs. 2019 Oct;35(5):150923. DOI: 10.1016/j.soncn.2019.08.002