Клинический разбор в общей медицине №7 2025
Sergey V. Yaytsev, Tatyana A. Sokolova
South Ural State Medical University, Chelyabinsk, Russia
top120@yandex.ru
Abstract
Against the background of immune antitumour therapy, the number of documented cases of cardiovascular complications is increasing. These studies emphasise the ability of contrast-enhanced magnetic resonance imaging in vivo to provide detailed information on myocardial damage of different etiologies
Objective. To evaluate cardiac magnetic resonance imaging parameters in cancer patients receiving chekpoint-inhibitor therapy.
Materials and methods. The prospective study included 85 patients (58 men, 27 women), mean age 51.3±8.37 years. The H2FPEF scale, Scale for Assessment of Clinical Status of Patient with Chronic Heart Failure (SACCHF) was evaluated. If new or progression of existing symptoms associated with heart failure occurred, magnetic resonance imaging (MRI) of the heart with contrast enhancement was performed.
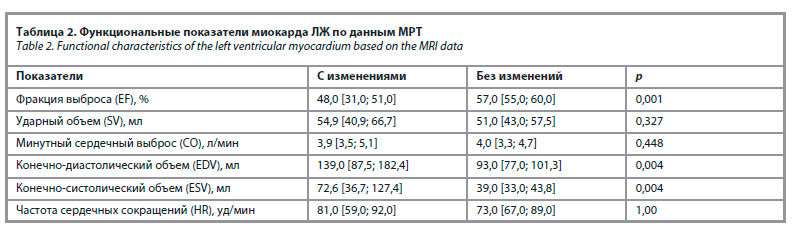
Results. New and/or progression of existing symptoms associated with heart failure was noted in 16 patients over a three-month period. The mean H2FPEF score was 5.0 [4.0; 7.0] and SCOX score was 6.0 [4.0; 7.0]. According to the data of cardiac MRI with contrasting in 18.75% of patients (n=3) fibrosis zones were revealed, and in 1 patient – a combination of edema and fibrosis zones. There was a decrease in the basal thickness of the anterior wall in diastole (p=0.013) and systole (p=0.011) of the left ventricle (LV), of the lateral wall in LV systole (p=0.002), of the posterior wall in LV systole (p=0.007); decrease in the thickness of the middle part of the anterior wall (p=0.03), apical part of the interventricular septum in LV systole (p=0.009); decrease in LV ejection fraction (p=0.001), increase in LV end-diastolic (p=0.004) and end-systolic volumes (p=0.004).
Conclusions. According to the data of contrast-enhanced cardiac MRI in 3 (18.75%) of cancer patients receiving chekpoint-inhibitors, structural and functional changes of the left ventricular myocardium associated with the formation of foci of oedema, foci of fibrosis were revealed. In the group of patients with the presence of oedema and/or fibrosis, a decrease in the basal thickness of the anterior wall in systole and diastole, of the lateral wall in systole, and of the posterior wall in systole of the left ventricle was revealed. There was a decrease in the thickness of the middle section of the anterior wall, apical section of the interventricular septum in systole of the left ventricle. The revealed structural changes were associated with decreased ejection fraction, increased end-diastolic and end-systolic volumes of the left ventricle.
Keywords: chekpoint-inhibitors, malignant neoplasms, cardiac magnetic resonance imaging, cardiovascular toxicity.
For citation: Kharlamova U.V., Vazhenin A.V., Kurchenkova O.V., Fedosova A.A., Yaitsev S.V., Sokolova T.A. Evaluation of cardiac magnetic resonance imaging parameters in cancer patients receiving chekpoint-inhibitor therapy. Clinical review for general practice. 2025; 6 (7): 19–24 (In Russ.). DOI: 10.47407/kr2025.6.7.00640
Заболеваемость злокачественными новообразованиями (ЗНО) и связанная с ними смертность представляют собой серьезную проблему для здравоохранения во всем мире, включая Россию. В последние десятилетия наблюдается устойчивый рост числа новых случаев ЗНО [1].
Внедрение в практику chekpoint-ингибиторов является шагом к формированию инновационной парадигмы лечения больных со ЗНО. Chekpoint-ингибиторы, усиливая эндогенный противоопухолевый иммунитет, позволяют достичь долгосрочного противоопухолевого эффекта, повышения выживаемости и качества жизни пациентов с широким спектром онкологических заболеваний [1, 2]. Однако чрезмерная активация Т-клеточного иммунного ответа приводит к иммуноопосредованным нежелательным реакциям, в том числе кардиотоксичности [3]. Очевидно, что кардиотоксичность chekpoint-ингибиторов требует особой клинической настороженности [4].
По мере накопления онкологами и кардиологами клинического опыта становится очевидным, что первичное представление о кардиоваскулярных осложнениях терапии chekpoint-ингибиторами могло основываться на недооценке частоты развития и спектра возникающих событий [5]. Серологические маркеры, эхокардиографическое исследование не всегда дают исчерпывающую информацию [6]. Данные мировых исследований подчеркивают способность магнитно-резонансной томографии (МРТ) с контрастным усилением в естественных условиях предоставить подробную информацию о поражении миокарда разной этиологии [7].
Цель исследования – провести оценку показателей МРТ сердца у онкологических больных, получающих терапию chekpoint-ингибиторами.
Критерии включения в исследование: пациенты старше 18 лет с верифицированным диагнозом ЗНО, требующим, согласно действующим клиническим рекомендациям, терапии chekpoint-ингибиторами, с общим состоянием пациента по шкале Карновского (ECOG) 0–2, давшие информированное согласие на участие в исследовании.
Критерии отказа от включения: наличие сопутствующей патологии (системные аутоиммунные заболевания; текущая неконтролируемая инфекция; перенесенные оперативные вмешательства в течение последних 2 мес; хроническое легочное сердце; активные заболевания печени; врожденные и приобретенные гемодинамически значимые пороки сердца); применение до включения в исследование лекарственных средств и манипуляций с доказанным кардиотоксическим эффектом; отсутствие адекватной визуализации при проведении эхокардиографического исследования миокарда левого желудочка (ЛЖ); коматозные состояния, делириозные состояния, алкоголизм/наркомания; психические заболевания; отсутствие возможности выполнения регулярных визитов к кардиологу; отказ пациента от обследования.
Исследование одобрено этическим комитетом ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России (протокол № 4 от 10.05.2024).
Все привлекаемые лица включались в исследование после ознакомления с информационной картой (протоколом исследования) и подписания информированного согласия.
Локализация ЗНО: легкие (n=51), меланома (n=14), уротелиальный рак (n=7), опухоли головы и шеи (n=5), рак пищевода (n=2), рак шейки матки (n=6). Все пациенты наблюдались, обследовались, получали противоопухолевую лекарственную терапию chekpoint-ингибиторами: ниволумабом (n=9), пембролизумабом (n=53), атезолизумабом (n=23) – на базе ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» (Челябинск).
Проводилась оценка ранних кардиоваскулярных осложнений лекарственной противоопухолевой терапии. Для клинической оценки использовалась Шкала оценки клинического состояния пациента с хронической сердечной недостаточностью (ШОКС), для оценки вероятности сердечной недостаточности с сохраненной фракцией выброса – шкала H2FPEF [8].
При возникновении новых или прогрессировании имеющихся симптомов, ассоциированных с сердечной недостаточностью, проводилась МРТ сердца с контрастным усилением. МРТ сердца выполнялась на базе ООО «КЛИНИКА ЭКСПЕРТ ЧЕЛЯБИНСК» (Челябинск) на аппарате Philips Intera 1.5 T с использованием неионного линейного парамагнитного контрастного средства на основе гадолиния (Омнискан) из расчета
0,3 мл/кг массы тела. При оценке МРТ рассматривались структурно-функциональные показатели ЛЖ, наличие/отсутствие фиброза, наличие/отсутствие отека миокарда [9].
Статистическая обработка материала проводилась при помощи лицензионного пакета программ IBM SPSS Statistics19.0. При законе распределения признака в выборке, близком к нормальному, количественные значения представлялись в виде среднего арифметического и его среднеквадратичного отклонения (M±σ). При законе распределения признака, отличающемся от нормального, рассчитывались медиана и интерквартильный размах (Ме [25-й; 75-й перцентили]). Для оценки различий между двумя группами в количественных признаках при нормальном распределении и равенстве дисперсий применяли t-критерий Стьюдента, в остальных случаях – непараметрический
U-критерий Манна–Уитни. Для сравнения средних более чем в двух независимых группах применяли критерий Краскелла–Уоллиса. При уровне значимости р<0,05 проводилось попарное сравнение групп с использованием непараметрического теста Манна–Уитни с поправкой Бонферрони. Качественные признаки описаны абсолютными и относительными частотами с оценкой межгрупповых различий с использованием критерия хи-квадрат (χ2) Пирсона, а при ожидаемых частотах менее 5 – с помощью точного двустороннего теста Фишера. Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
По данным МРТ сердца с контрастированием у 3 (18,75%) пациентов выявлены зоны фиброза, причем у одного пациента – сочетание зон отека и фиброза. Группы пациентов с наличием отека и/или фиброза и с отсутствием отека и/или фиброза миокарда ЛЖ достоверно не различались по возрасту (58,67±14,32 и 65,92±5,82 года; р=0,55), полу (в группе с фиброзом и/или отеком – 1 женщина и 2 мужчины; в группе без фиброза и/или отека – 7 мужчин и 6 женщин; р=0,60).
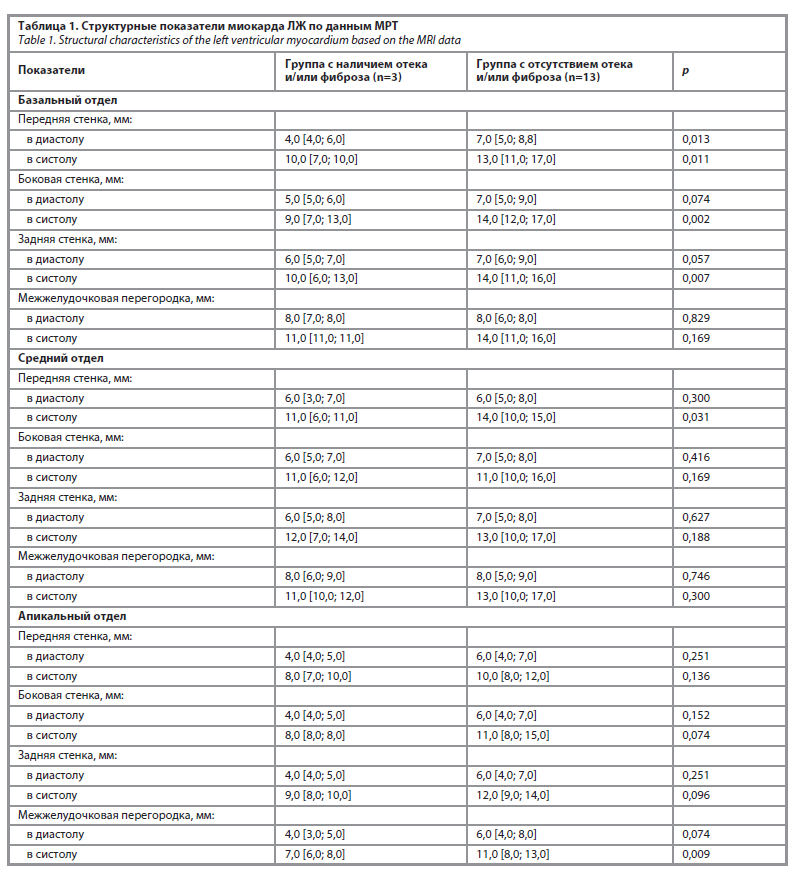
Изучение структурных показателей миокарда ЛЖ (табл. 1) выявило уменьшение толщины базального отдела передней стенки в диастолу и систолу ЛЖ, боковой стенки в систолу ЛЖ, задней стенки в систолу ЛЖ. Отмечено уменьшение толщины среднего отдела передней стенки, апикального отдела межжелудочковой перегородки в систолу ЛЖ.
Выявленные структурные изменения ассоциировались со снижением показателя фракции выброса ЛЖ, увеличением конечно-диастолического и конечно-систолического объемов ЛЖ (табл. 2).
По данным МРТ сердца с контрастированием у 18,75% пациентов, получающих терапию chekpoint-ингибиторами, выявлено наличие отека и/или фиброза миокарда ЛЖ, ассоциирующееся со структурными изменениями миокарда ЛЖ, снижением систолической функции ЛЖ.
Фундаментальным механизмом, лежащим в основе большинства иммуноопосредованных побочных эффектов терапии chekpoint-ингибиторами, является активация иммунного ответа, сопряженная с реализацией противоопухолевого иммунитета [12]. Кардиомиоциты в ответ на повреждение могут начать экспрессию белков PD-1, PD-L1, защищая поврежденные, но функционально сохранные кардиомиоциты от развития аутоиммунной воспалительной реакции [13]. Однако экспрессированные белки PD-1, PD-L1 становятся дополнительной мишенью для chekpoint-ингибиторов, связываются с моноклональными антителами, индуцируют повреждение, воспаление, активацию продукции цитокинов (интерлейкина-8, интерлейкина-6, трансформирующего фактора роста β), структурно-функциональные изменения миокарда, развитие сердечно-сосудистых осложнений [14].
Данные анализа инструментальных показателей состояния миокарда у онкологических больных, получающих иммунотерапию, противоречивы: ряд авторов выявили отрицательную динамику конечно-систолического и конечно-диастолического объемов ЛЖ, фракции выброса ЛЖ, кругового и продольного стрейнов, однако результаты трехмесячного контроля в другой группе пациентов со ЗНО не выявили МРТ-изменений миокарда [15, 16]. Данные имеющихся на сегодняшний день проспективных исследований о частоте развития кардиотоксичности на фоне терапии chekpoint-ингибиторами не могут быть в полной мере сопоставимы из-за различия критериев, определяющих дисфункцию ЛЖ. Кардиотоксичность chekpoint-ингибиторов представляет собой проблему, требующую дальнейших исследований [17, 18].
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда (соглашение № 24-25-20035).
Acknowledgements. The study was financially supported by the Russian Science Foundation (Agreement No. 24-25-20035).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that they have no conflict of interest.
Информация об авторах
Information about the authors
Харламова Ульяна Владимировна – д-р мед. наук, доц., проф. каф. пропедевтики внутренних болезней, врач-кардиолог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Ulyana V. Kharlamova – Dr. Sci. (Med.), Assoc. Prof., Prof., cardiologist, South Ural State Medical University. E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Важенин Андрей Владимирович – академик РАН, заслуженный врач Российской Федерации, д-р мед. наук, проф., зав. каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-7912-9039
Andrei V. Vazhenin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Honored Doctor of the Russian Federation, oncologist, South Ural State Medical University. ORCID: 0000-0002-7912-9039
Курченкова Ольга Валерьевна – ст. лаборант каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-4570-1404
Olga V. Kurchenkova – Senior Lab. Assist., oncologist, South Ural State Medical University. ORCID: 0000-0002-4570-1404
Федосова Алина Андреевна – специалист отд. инновационной работы, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0009-0001-4877-2865
Alina A. Fedosova – innovation specialist, oncologist, South Ural State Medical University. ORCID: 0009-0001-4877-2865
Яйцев Сергей Васильевич – д-р мед. наук, проф., проф. каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0001-5268-3892
Sergey V. Yaytsev – Dr. Sci. (Med.), Full Prof., Prof., oncologist, South Ural State Medical University. ORCID: 0000-0001-5268-3892
Соколова Татьяна Анатольевна – канд. мед. наук, доц. каф. госпитальной терапии ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-0535-492X
Tatyana A. Sokolova – Cand. Sci. (Med.), Assoc. Prof., South Ural State Medical University. ORCID: 0000-0002-0535-492X
Поступила в редакцию: 16.05.2025
Поступила после рецензирования: 19.05.2025
Принята к публикации: 29.05.2025
Received: 16.05.2025
Revised: 19.05.2025
Accepted: 29.05.2025
Клинический разбор в общей медицине №7 2025
Оценка показателей магнитно-резонансной томографии сердца у онкологических больных, получающих терапию chekpoint-ингибиторами
Номера страниц в выпуске:19-24
Аннотация
На фоне иммунной противоопухолевой терапии растет число задокументированных случаев развития сердечно-сосудистых осложнений. Данные исследований подчеркивают способность магнитно-резонансной томографии (МРТ) с контрастным усилением в естественных условиях предоставить подробную информацию о поражении миокарда разной этиологии.
Цель. Провести оценку показателей МРТ сердца у онкологических больных, получающих терапию chekpoint-ингибиторами.
Материалы и методы. В проспективное исследование включено 85 пациентов (58 мужчин, 27 женщин), средний возраст – 51,3±8,37 года. Проводилась оценка с использованием шкалы H2FPEF, Шкалы оценки клинического состояния пациента с хронической сердечной недостаточностью (ШОКС). При возникновении новых или прогрессировании имеющихся симптомов, ассоциированных с сердечной недостаточностью, проводилось МРТ-исследование сердца с контрастным усилением.
Результаты. У 16 пациентов в течение 3 мес отмечено появление новых и/или прогрессирование имеющихся симптомов, ассоциированных с сердечной недостаточностью. Среднее значение по шкале H2FPEF составило 5,0 [4,0; 7,0] балла, по ШОКС – 6,0 [4,0; 7,0] балла. По данным МРТ сердца с контрастированием у 18,75% пациентов (n=3) выявлены зоны фиброза, причем у одного пациента – сочетание зоны отека и фиброза. Выявлено снижение толщины базального отдела передней стенки в диастолу (р=0,013) и систолу (р=0,011) левого желудочка (ЛЖ), боковой стенки в систолу ЛЖ (р=0,002), задней стенки в систолу ЛЖ (р=0,007); уменьшение толщины среднего отдела передней стенки (р=0,03), апикального отдела межжелудочковой перегородки в систолу ЛЖ (р=0,009); снижение показателя фракции выброса ЛЖ (р=0,001); увеличение конечно-диастолического (р=0,004) и конечно-систолического объемов ЛЖ (р=0,004).
Заключение. По данным МРТ сердца с контрастным усилением у 3 (18,75%) онкологических пациентов, получающих chekpoint-ингибиторы, выявлены структурно-функциональные изменения миокарда ЛЖ, ассоциирующиеся с формированием очагов отека, очагов фиброза. В группе пациентов с наличием отека и/или фиброза выявлено уменьшение толщины базального отдела передней стенки в систолу и диастолу, боковой и задней стенки – в систолу ЛЖ. Отмечено уменьшение толщины среднего отдела передней стенки, апикального отдела межжелудочковой перегородки в систолу ЛЖ. Выявленные структурные изменения ассоциировались со снижением показателя фракции выброса, увеличением конечно-диастолического и конечно-систолического объемов ЛЖ.
Ключевые слова: chekpoint-ингибиторы, злокачественные новообразования, магнитно-резонансная томография сердца, кардиоваскулярная токсичность.
Для цитирования: Харламова У.В., Важенин А.В., Курченкова О.В., Федосова А.А., Яйцев С.В., Соколова Т.А. Оценка показателей магнитно-резонансной томографии сердца у онкологических больных, получающих терапию chekpoint-ингибиторами. Клинический разбор в общей медицине. 2025; 6 (7): 19–24. DOI: 10.47407/kr2025.6.7.00640
На фоне иммунной противоопухолевой терапии растет число задокументированных случаев развития сердечно-сосудистых осложнений. Данные исследований подчеркивают способность магнитно-резонансной томографии (МРТ) с контрастным усилением в естественных условиях предоставить подробную информацию о поражении миокарда разной этиологии.
Цель. Провести оценку показателей МРТ сердца у онкологических больных, получающих терапию chekpoint-ингибиторами.
Материалы и методы. В проспективное исследование включено 85 пациентов (58 мужчин, 27 женщин), средний возраст – 51,3±8,37 года. Проводилась оценка с использованием шкалы H2FPEF, Шкалы оценки клинического состояния пациента с хронической сердечной недостаточностью (ШОКС). При возникновении новых или прогрессировании имеющихся симптомов, ассоциированных с сердечной недостаточностью, проводилось МРТ-исследование сердца с контрастным усилением.
Результаты. У 16 пациентов в течение 3 мес отмечено появление новых и/или прогрессирование имеющихся симптомов, ассоциированных с сердечной недостаточностью. Среднее значение по шкале H2FPEF составило 5,0 [4,0; 7,0] балла, по ШОКС – 6,0 [4,0; 7,0] балла. По данным МРТ сердца с контрастированием у 18,75% пациентов (n=3) выявлены зоны фиброза, причем у одного пациента – сочетание зоны отека и фиброза. Выявлено снижение толщины базального отдела передней стенки в диастолу (р=0,013) и систолу (р=0,011) левого желудочка (ЛЖ), боковой стенки в систолу ЛЖ (р=0,002), задней стенки в систолу ЛЖ (р=0,007); уменьшение толщины среднего отдела передней стенки (р=0,03), апикального отдела межжелудочковой перегородки в систолу ЛЖ (р=0,009); снижение показателя фракции выброса ЛЖ (р=0,001); увеличение конечно-диастолического (р=0,004) и конечно-систолического объемов ЛЖ (р=0,004).
Заключение. По данным МРТ сердца с контрастным усилением у 3 (18,75%) онкологических пациентов, получающих chekpoint-ингибиторы, выявлены структурно-функциональные изменения миокарда ЛЖ, ассоциирующиеся с формированием очагов отека, очагов фиброза. В группе пациентов с наличием отека и/или фиброза выявлено уменьшение толщины базального отдела передней стенки в систолу и диастолу, боковой и задней стенки – в систолу ЛЖ. Отмечено уменьшение толщины среднего отдела передней стенки, апикального отдела межжелудочковой перегородки в систолу ЛЖ. Выявленные структурные изменения ассоциировались со снижением показателя фракции выброса, увеличением конечно-диастолического и конечно-систолического объемов ЛЖ.
Ключевые слова: chekpoint-ингибиторы, злокачественные новообразования, магнитно-резонансная томография сердца, кардиоваскулярная токсичность.
Для цитирования: Харламова У.В., Важенин А.В., Курченкова О.В., Федосова А.А., Яйцев С.В., Соколова Т.А. Оценка показателей магнитно-резонансной томографии сердца у онкологических больных, получающих терапию chekpoint-ингибиторами. Клинический разбор в общей медицине. 2025; 6 (7): 19–24. DOI: 10.47407/kr2025.6.7.00640
Evaluation of cardiac magnetic resonance imaging parameters in cancer patients receiving chekpoint-inhibitor therapy
Ulyana V. Kharlamova, Andrei V. Vazhenin, Olga V. Kurchenkova, Alina A. Fedosova,Sergey V. Yaytsev, Tatyana A. Sokolova
South Ural State Medical University, Chelyabinsk, Russia
top120@yandex.ru
Abstract
Against the background of immune antitumour therapy, the number of documented cases of cardiovascular complications is increasing. These studies emphasise the ability of contrast-enhanced magnetic resonance imaging in vivo to provide detailed information on myocardial damage of different etiologies
Objective. To evaluate cardiac magnetic resonance imaging parameters in cancer patients receiving chekpoint-inhibitor therapy.
Materials and methods. The prospective study included 85 patients (58 men, 27 women), mean age 51.3±8.37 years. The H2FPEF scale, Scale for Assessment of Clinical Status of Patient with Chronic Heart Failure (SACCHF) was evaluated. If new or progression of existing symptoms associated with heart failure occurred, magnetic resonance imaging (MRI) of the heart with contrast enhancement was performed.
Results. New and/or progression of existing symptoms associated with heart failure was noted in 16 patients over a three-month period. The mean H2FPEF score was 5.0 [4.0; 7.0] and SCOX score was 6.0 [4.0; 7.0]. According to the data of cardiac MRI with contrasting in 18.75% of patients (n=3) fibrosis zones were revealed, and in 1 patient – a combination of edema and fibrosis zones. There was a decrease in the basal thickness of the anterior wall in diastole (p=0.013) and systole (p=0.011) of the left ventricle (LV), of the lateral wall in LV systole (p=0.002), of the posterior wall in LV systole (p=0.007); decrease in the thickness of the middle part of the anterior wall (p=0.03), apical part of the interventricular septum in LV systole (p=0.009); decrease in LV ejection fraction (p=0.001), increase in LV end-diastolic (p=0.004) and end-systolic volumes (p=0.004).
Conclusions. According to the data of contrast-enhanced cardiac MRI in 3 (18.75%) of cancer patients receiving chekpoint-inhibitors, structural and functional changes of the left ventricular myocardium associated with the formation of foci of oedema, foci of fibrosis were revealed. In the group of patients with the presence of oedema and/or fibrosis, a decrease in the basal thickness of the anterior wall in systole and diastole, of the lateral wall in systole, and of the posterior wall in systole of the left ventricle was revealed. There was a decrease in the thickness of the middle section of the anterior wall, apical section of the interventricular septum in systole of the left ventricle. The revealed structural changes were associated with decreased ejection fraction, increased end-diastolic and end-systolic volumes of the left ventricle.
Keywords: chekpoint-inhibitors, malignant neoplasms, cardiac magnetic resonance imaging, cardiovascular toxicity.
For citation: Kharlamova U.V., Vazhenin A.V., Kurchenkova O.V., Fedosova A.A., Yaitsev S.V., Sokolova T.A. Evaluation of cardiac magnetic resonance imaging parameters in cancer patients receiving chekpoint-inhibitor therapy. Clinical review for general practice. 2025; 6 (7): 19–24 (In Russ.). DOI: 10.47407/kr2025.6.7.00640
Заболеваемость злокачественными новообразованиями (ЗНО) и связанная с ними смертность представляют собой серьезную проблему для здравоохранения во всем мире, включая Россию. В последние десятилетия наблюдается устойчивый рост числа новых случаев ЗНО [1].
Внедрение в практику chekpoint-ингибиторов является шагом к формированию инновационной парадигмы лечения больных со ЗНО. Chekpoint-ингибиторы, усиливая эндогенный противоопухолевый иммунитет, позволяют достичь долгосрочного противоопухолевого эффекта, повышения выживаемости и качества жизни пациентов с широким спектром онкологических заболеваний [1, 2]. Однако чрезмерная активация Т-клеточного иммунного ответа приводит к иммуноопосредованным нежелательным реакциям, в том числе кардиотоксичности [3]. Очевидно, что кардиотоксичность chekpoint-ингибиторов требует особой клинической настороженности [4].
По мере накопления онкологами и кардиологами клинического опыта становится очевидным, что первичное представление о кардиоваскулярных осложнениях терапии chekpoint-ингибиторами могло основываться на недооценке частоты развития и спектра возникающих событий [5]. Серологические маркеры, эхокардиографическое исследование не всегда дают исчерпывающую информацию [6]. Данные мировых исследований подчеркивают способность магнитно-резонансной томографии (МРТ) с контрастным усилением в естественных условиях предоставить подробную информацию о поражении миокарда разной этиологии [7].
Цель исследования – провести оценку показателей МРТ сердца у онкологических больных, получающих терапию chekpoint-ингибиторами.
Материалы и методы
В исследование включено 85 пациентов (58 мужчин, 27 женщин), средний возраст – 51,3±8,37 года. Все пациенты прошли лабораторно-инструментальное обследование в рамках утвержденных стандартов оказания специализированной медицинской помощи.Критерии включения в исследование: пациенты старше 18 лет с верифицированным диагнозом ЗНО, требующим, согласно действующим клиническим рекомендациям, терапии chekpoint-ингибиторами, с общим состоянием пациента по шкале Карновского (ECOG) 0–2, давшие информированное согласие на участие в исследовании.
Критерии отказа от включения: наличие сопутствующей патологии (системные аутоиммунные заболевания; текущая неконтролируемая инфекция; перенесенные оперативные вмешательства в течение последних 2 мес; хроническое легочное сердце; активные заболевания печени; врожденные и приобретенные гемодинамически значимые пороки сердца); применение до включения в исследование лекарственных средств и манипуляций с доказанным кардиотоксическим эффектом; отсутствие адекватной визуализации при проведении эхокардиографического исследования миокарда левого желудочка (ЛЖ); коматозные состояния, делириозные состояния, алкоголизм/наркомания; психические заболевания; отсутствие возможности выполнения регулярных визитов к кардиологу; отказ пациента от обследования.
Исследование одобрено этическим комитетом ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России (протокол № 4 от 10.05.2024).
Все привлекаемые лица включались в исследование после ознакомления с информационной картой (протоколом исследования) и подписания информированного согласия.
Локализация ЗНО: легкие (n=51), меланома (n=14), уротелиальный рак (n=7), опухоли головы и шеи (n=5), рак пищевода (n=2), рак шейки матки (n=6). Все пациенты наблюдались, обследовались, получали противоопухолевую лекарственную терапию chekpoint-ингибиторами: ниволумабом (n=9), пембролизумабом (n=53), атезолизумабом (n=23) – на базе ГАУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» (Челябинск).
Проводилась оценка ранних кардиоваскулярных осложнений лекарственной противоопухолевой терапии. Для клинической оценки использовалась Шкала оценки клинического состояния пациента с хронической сердечной недостаточностью (ШОКС), для оценки вероятности сердечной недостаточности с сохраненной фракцией выброса – шкала H2FPEF [8].
При возникновении новых или прогрессировании имеющихся симптомов, ассоциированных с сердечной недостаточностью, проводилась МРТ сердца с контрастным усилением. МРТ сердца выполнялась на базе ООО «КЛИНИКА ЭКСПЕРТ ЧЕЛЯБИНСК» (Челябинск) на аппарате Philips Intera 1.5 T с использованием неионного линейного парамагнитного контрастного средства на основе гадолиния (Омнискан) из расчета
0,3 мл/кг массы тела. При оценке МРТ рассматривались структурно-функциональные показатели ЛЖ, наличие/отсутствие фиброза, наличие/отсутствие отека миокарда [9].
Статистическая обработка материала проводилась при помощи лицензионного пакета программ IBM SPSS Statistics19.0. При законе распределения признака в выборке, близком к нормальному, количественные значения представлялись в виде среднего арифметического и его среднеквадратичного отклонения (M±σ). При законе распределения признака, отличающемся от нормального, рассчитывались медиана и интерквартильный размах (Ме [25-й; 75-й перцентили]). Для оценки различий между двумя группами в количественных признаках при нормальном распределении и равенстве дисперсий применяли t-критерий Стьюдента, в остальных случаях – непараметрический
U-критерий Манна–Уитни. Для сравнения средних более чем в двух независимых группах применяли критерий Краскелла–Уоллиса. При уровне значимости р<0,05 проводилось попарное сравнение групп с использованием непараметрического теста Манна–Уитни с поправкой Бонферрони. Качественные признаки описаны абсолютными и относительными частотами с оценкой межгрупповых различий с использованием критерия хи-квадрат (χ2) Пирсона, а при ожидаемых частотах менее 5 – с помощью точного двустороннего теста Фишера. Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
Результаты
У 16 пациентов в течение 3 мес отмечено появление новых и/или прогрессирование имеющихся симптомов, ассоциированных с сердечной недостаточностью. Среднее значение по шкале H2FPEF составило 5,0 [4,0; 7,0] балла, по ШОКС – 6,0 [4,0; 7,0] балла.По данным МРТ сердца с контрастированием у 3 (18,75%) пациентов выявлены зоны фиброза, причем у одного пациента – сочетание зон отека и фиброза. Группы пациентов с наличием отека и/или фиброза и с отсутствием отека и/или фиброза миокарда ЛЖ достоверно не различались по возрасту (58,67±14,32 и 65,92±5,82 года; р=0,55), полу (в группе с фиброзом и/или отеком – 1 женщина и 2 мужчины; в группе без фиброза и/или отека – 7 мужчин и 6 женщин; р=0,60).

Изучение структурных показателей миокарда ЛЖ (табл. 1) выявило уменьшение толщины базального отдела передней стенки в диастолу и систолу ЛЖ, боковой стенки в систолу ЛЖ, задней стенки в систолу ЛЖ. Отмечено уменьшение толщины среднего отдела передней стенки, апикального отдела межжелудочковой перегородки в систолу ЛЖ.
Выявленные структурные изменения ассоциировались со снижением показателя фракции выброса ЛЖ, увеличением конечно-диастолического и конечно-систолического объемов ЛЖ (табл. 2).

Обсуждение
С каждым годом на фоне иммунной противоопухолевой терапии растет число задокументированных случаев развития сердечно-сосудистых осложнений, которые становятся серьезной проблемой и ассоциированы с высоким процентом летальности у данной категории больных. Кардиоваскулярные события, от бессимптомных лабораторных и инструментальных отклонений до развития жизнеугрожающего молниеносно протекающего миокардита с тяжелой сердечной недостаточностью, обычно возникают на ранней стадии лечения (≤90 дней терапии), но могут наблюдаться и после 1 года терапии chekpoint-ингибиторами [10], в связи с чем ранняя диагностика и своевременная терапия осложнений служат важными критериями успешного проведения противоопухолевой терапии. МРТ-исследование, включающее комплексную оценку структуры миокарда, наличие отека миокарда, участков некроза и/или фиброза, рядом исследователей рассматривается как неинвазивная альтернатива эндомиокардиальной биопсии миокарда [11].По данным МРТ сердца с контрастированием у 18,75% пациентов, получающих терапию chekpoint-ингибиторами, выявлено наличие отека и/или фиброза миокарда ЛЖ, ассоциирующееся со структурными изменениями миокарда ЛЖ, снижением систолической функции ЛЖ.
Фундаментальным механизмом, лежащим в основе большинства иммуноопосредованных побочных эффектов терапии chekpoint-ингибиторами, является активация иммунного ответа, сопряженная с реализацией противоопухолевого иммунитета [12]. Кардиомиоциты в ответ на повреждение могут начать экспрессию белков PD-1, PD-L1, защищая поврежденные, но функционально сохранные кардиомиоциты от развития аутоиммунной воспалительной реакции [13]. Однако экспрессированные белки PD-1, PD-L1 становятся дополнительной мишенью для chekpoint-ингибиторов, связываются с моноклональными антителами, индуцируют повреждение, воспаление, активацию продукции цитокинов (интерлейкина-8, интерлейкина-6, трансформирующего фактора роста β), структурно-функциональные изменения миокарда, развитие сердечно-сосудистых осложнений [14].
Данные анализа инструментальных показателей состояния миокарда у онкологических больных, получающих иммунотерапию, противоречивы: ряд авторов выявили отрицательную динамику конечно-систолического и конечно-диастолического объемов ЛЖ, фракции выброса ЛЖ, кругового и продольного стрейнов, однако результаты трехмесячного контроля в другой группе пациентов со ЗНО не выявили МРТ-изменений миокарда [15, 16]. Данные имеющихся на сегодняшний день проспективных исследований о частоте развития кардиотоксичности на фоне терапии chekpoint-ингибиторами не могут быть в полной мере сопоставимы из-за различия критериев, определяющих дисфункцию ЛЖ. Кардиотоксичность chekpoint-ингибиторов представляет собой проблему, требующую дальнейших исследований [17, 18].
Заключение
По данным МРТ сердца с контрастным усилением у 3 (18,75%) пациентов со ЗНО, получающих терапию chekpoint-ингибиторами, выявлены структурно-функциональные изменения миокарда ЛЖ, ассоциирующиеся с формированием очагов отека, очагов фиброза. В группе пациентов с наличием отека и/или фиброза выявлено уменьшение толщины базального отдела передней стенки в систолу и диастолу, боковой стенки в систолу, задней стенки в систолу ЛЖ. Отмечено уменьшение толщины среднего отдела передней стенки, апикального отдела межжелудочковой перегородки в систолу ЛЖ. Выявленные структурные изменения ассоциировались со снижением показателя фракции выброса, увеличением конечно-диастолического и конечно-систолического объемов ЛЖ.Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда (соглашение № 24-25-20035).
Acknowledgements. The study was financially supported by the Russian Science Foundation (Agreement No. 24-25-20035).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that they have no conflict of interest.
Информация об авторах
Information about the authors
Харламова Ульяна Владимировна – д-р мед. наук, доц., проф. каф. пропедевтики внутренних болезней, врач-кардиолог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Ulyana V. Kharlamova – Dr. Sci. (Med.), Assoc. Prof., Prof., cardiologist, South Ural State Medical University. E-mail: top120@yandex.ru; ORCID: 0000-0003-2421-5797
Важенин Андрей Владимирович – академик РАН, заслуженный врач Российской Федерации, д-р мед. наук, проф., зав. каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-7912-9039
Andrei V. Vazhenin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Honored Doctor of the Russian Federation, oncologist, South Ural State Medical University. ORCID: 0000-0002-7912-9039
Курченкова Ольга Валерьевна – ст. лаборант каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-4570-1404
Olga V. Kurchenkova – Senior Lab. Assist., oncologist, South Ural State Medical University. ORCID: 0000-0002-4570-1404
Федосова Алина Андреевна – специалист отд. инновационной работы, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0009-0001-4877-2865
Alina A. Fedosova – innovation specialist, oncologist, South Ural State Medical University. ORCID: 0009-0001-4877-2865
Яйцев Сергей Васильевич – д-р мед. наук, проф., проф. каф. онкологии, лучевой диагностики и лучевой терапии, врач-онколог, ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0001-5268-3892
Sergey V. Yaytsev – Dr. Sci. (Med.), Full Prof., Prof., oncologist, South Ural State Medical University. ORCID: 0000-0001-5268-3892
Соколова Татьяна Анатольевна – канд. мед. наук, доц. каф. госпитальной терапии ФГБОУ ВО «Южно-Уральский государственный медицинский университет». ORCID: 0000-0002-0535-492X
Tatyana A. Sokolova – Cand. Sci. (Med.), Assoc. Prof., South Ural State Medical University. ORCID: 0000-0002-0535-492X
Поступила в редакцию: 16.05.2025
Поступила после рецензирования: 19.05.2025
Принята к публикации: 29.05.2025
Received: 16.05.2025
Revised: 19.05.2025
Accepted: 29.05.2025
Список исп. литературыСкрыть список1. Каприн А.Д Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена. Филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2024. 276 с.
Kaprin A.D. Malignant neoplasms in Russia in 2023 (morbidity and mortality). Moscow: P.A. Herzen Moscow Oncology Research Institute. Branch of the National Medical Research Center of Radiology of the Ministry of Health of the Russian Federation; 2024. 276 p. (in Russian).
2. Akinleye A, Rasool Z. Immune checkpoint inhibitors of PD-L1 as cancer therapeutics. J Hematol Oncol. 2019;12(1):92.
3. Грибкова И.В. Ингибиторы иммунных контрольных точек при опухолевых заболеваниях системы крови у детей. Онкогематология. 2023;18(2):25-34. DOI: 10.17650/1818-8346-2023-18-2-25-34
Gribkova I.V. Immune checkpoint inhibitors in pediatric hematologic malignancies. Onkogematologiya = Oncohematology. 2023;18(2):25-34. DOI: 10.17650/1818-8346-2023-18-2-25-34 (in Russian).
4. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43:4229-361. DOI: 10.1093/eurheartj/ehac244
5. Шубникова Е.В., Букатина Т.М., Вельц Н.Ю. и др. Ингибиторы контрольных точек иммунного ответа: новые риски нового класса противоопухолевых средств. Безопасность и риск фармакотерапии. 2020;8(1):9-22. DOI: 10.30895/2312-7821-2020-8-1-9-22
Shubnikova E.V., Bukatina T.M., Velts N.Yu., et al. Immune Response Checkpoint Inhibitors: New Risks of a New Class of Antitumor Agents. Safety and Risk of Pharmacotherapy. 2020;8(1):9-22. DOI: 10.30895/2312-7821-2020-8-1-9-22 (in Russian).
6. Васюк Ю.А., Несветов В.В., Школьник Е.Л. и др. Возможности современных эхокардиографических технологий в ранней диагностике кардиотоксического действия химиотерапевтических препаратов антрациклинового ряда у онкологических больных. Кардиология. 2017;57(S4):31-7. DOI: 10.18087/cardio.2417
Vasyuk Yu.A., Nesvetov V.V., Shkolnik E.L., et al. Possibilities of modern echocardiographic technologies in the early diagnosis of the cardiotoxic effect of chemotherapy drugs anthracycline series in cancer patients. Kardiologiia. 2017;57(4S):31-7. DOI: 10.18087/cardio.2417 (in Russian).
7. Мершина Е.А., Синицын В.Е., Ларина О.М. Магнитно-резонансная томография сердца в диагностике гипертрофической кардиомиопатии и стратификации риска внезапной сердечной смерти. Клиническая и экспериментальная хирургия. Журнал им. акад.
Б.В. Петровского. 2019;7(3):70-8. DOI: 10.24411/2308-1198-2019-13008
Mershina E.A., Sinitsyn V.E., Larina O.M. Cardiac magnetic resonance in diagnosis of hypertrophic cardiomyopathy and sudden cardiac death risk stratification. Clin Experiment Surg. Petrovsky J. 2019;7(3):70-8. DOI: 10.24411/2308-1198-2019-13008 (in Russian).
8. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2024;29(11): 251-349. DOI: 10.15829/1560-4071-2020-4083
2020 Clinical practice guidelines for Chronic heart failure. Russian Journal of Cardiology. 2020;25(11):4083. DOI: 10.15829/1560-4071-2020-4083 (in Russian).
9. Уэстбрук К., Рот К., Тэлбот Дж. Магнитно-резонансная томография: практическое руководство. М.: Лаборатория знаний, 2022. 451 с.
Westbrook K., Roth K., Talbot J. Magnetic resonance imaging: a practical guide. Moscow: Knowledge Laboratory, 2022. 451 p. (in Russian).
10. Кушнарева Е.А., Моисеева О.М. Миокардиты, ассоциированные с терапией ингибиторами контрольных точек: систематический анализ клинических случаев. Российский кардиологический журнал. 2020;25(11):3910. DOI: 10.15829/29/1560-4071-2020-3910
Kushnareva E.A., Moiseeva O.M. Immune checkpoint inhibitor myocarditis: a systematic case study. Russian Journal of Cardiology. 2020;25(11):3910. DOI: 10.15829/29/1560-4071-2020-3910 (in Russian).
11. Friedrich MG, Sechtem U, Schulz-Menger J, et al. Cardiovascular magnetic resonance in myocarditis: a JACC white paper. J Am Coll Cardiol. 2009;53(17):1475-87.
12. Johnson DB, Nebhan CA, Moslehi JJ, et al. Immune-checkpoint inhibitors: long-term implications of toxicity. Nature Reviews Clin Oncol. 2022;19(4):254-67.
13. Pirozzi F, Poto R, Aran L, et al. Cardiovascular Toxicity of Immune Checkpoint Inhibitors: Clinical Risk Factors. Curr Oncol Rep. 2021;23(2):4-11.
14. Wang M, Zhai X, Li J, et al. The Role of Cytokines in Predicting the Response and Adverse Events Related to Immune Checkpoint Inhibitors. Front Immunol. 2021;12:1-12.
15. Xu A, Yuan M, Zhan X, et al. Early detection of immune checkpoint inhibitor-related subclinical cardiotoxicity: A pilot study by using speckle tracking imaging and three-dimensional echocardiography. Front Cardiovasc Med. 2022;9:1087287.
16. Liu J, Cao Y, Zhu K, et al. Early evaluation of subclinical cardiotoxicity in patients with lung cancer receiving immune checkpoint inhibitors by cardiovascular magnetic resonance: a prospective observational study. Quant Imaging Med Surg. 2022;12(10):4771-85. DOI: 10.21037/qims-22-41
17. Хидирова Л.Д., Лацвиева А.Е., Ведерин А.А. Механизмы кардиотоксичности противоопухолевой терапии ингибиторами иммунных контрольных точек: современные достижения. Рациональная Фармакотерапия в Кардиологии. 2024;20(2):265-74. DOI: 10.20996/1819-6446-2024-3022. EDN JNMVKN
Khidirova L.D., Latsvieva A.E., Vederin A.A. Cardiotoxicity mechanisms of antitumor therapy with immune checkpoint inhibitors: new achievements. Rational Pharmacotherapy in Cardiology. 2024;20(2):265-74. DOI: 10.20996/1819-6446-2024-3022. EDN
JNMVKN (in Russian).
18. Баллюзек М.Ф., Кузин С.О., Хайманова Д.Г., Шолохов ГВ. Характеристика сердечно-сосудистых нежелательных явлений на фоне терапии ингибиторами иммунных контрольных точек. Результат работы междисциплинарной команды. Вопросы онкологии. 2024;70(3):541-9. DOI: 10.37469/0507-3758-2024-70-3-541-549
Ballyuzek M.F., Kuzin S.O., Khaimanova D.G., Sholokhov G.V. The Characteristics of Cardiovascular Adverse Events in Therapy with Immune Checkpoint Inhibitors: The Result of Work of the Multi-Disciplinary Team. Voprosy onkologii. 2024;70(3):541-9. DOI: 10.37469/0507-3758-2024-70-3-541-549 (in Russian).
3 сентября 2025
Количество просмотров: 361