Клинический разбор в общей медицине №7 2025
Клинический разбор в общей медицине №7 2025
Нейроэндокринные опухоли желудка и инфекция Н. pylori: особенности ведения пациентов на примере клинического случая
Номера страниц в выпуске:76-80
Аннотация
В статье представлен клинический случай пациентки 36 лет с высокодифференцированной нейроэндокринной опухолью (НЭО) желудка (NET G2, Ki-67 – 7%), развившейся на фоне аутоиммунного гастрита и персистирующей инфекции Helicobacter pylori (H. pylori). Несмотря на то что при гистологическом исследовании H. pylori не обнаружено, инфекция была подтверждена определением антигена H. pylori в кале методом иммуноферментного анализа, что подтверждает необходимость комплексной диагностики возбудителя у такой категории пациентов. Клиническое наблюдение демонстрирует взаимосвязь между аутоиммунным гастритом, инфекцией H. pylori и развитием НЭО, а также подтверждает эффективность мультидисциплинарного подхода в лечении подобных клинических ситуаций.
Ключевые слова: нейроэндокринная опухоль желудка, аутоиммунный гастрит, Helicobacter pylori, гипергастринемия, октреотид, эрадикационная терапия.
Для цитирования: Козлова М.Д., Ковригин И.И., Дехнич Н.Н. Нейроэндокринные опухоли желудка и инфекция Н. pylori: особенности ведения пациентов на примере клинического случая. Клинический разбор в общей медицине. 2025; 6 (7): 76–80. DOI: 10.47407/ kr2025.6.7.00647
В статье представлен клинический случай пациентки 36 лет с высокодифференцированной нейроэндокринной опухолью (НЭО) желудка (NET G2, Ki-67 – 7%), развившейся на фоне аутоиммунного гастрита и персистирующей инфекции Helicobacter pylori (H. pylori). Несмотря на то что при гистологическом исследовании H. pylori не обнаружено, инфекция была подтверждена определением антигена H. pylori в кале методом иммуноферментного анализа, что подтверждает необходимость комплексной диагностики возбудителя у такой категории пациентов. Клиническое наблюдение демонстрирует взаимосвязь между аутоиммунным гастритом, инфекцией H. pylori и развитием НЭО, а также подтверждает эффективность мультидисциплинарного подхода в лечении подобных клинических ситуаций.
Ключевые слова: нейроэндокринная опухоль желудка, аутоиммунный гастрит, Helicobacter pylori, гипергастринемия, октреотид, эрадикационная терапия.
Для цитирования: Козлова М.Д., Ковригин И.И., Дехнич Н.Н. Нейроэндокринные опухоли желудка и инфекция Н. pylori: особенности ведения пациентов на примере клинического случая. Клинический разбор в общей медицине. 2025; 6 (7): 76–80. DOI: 10.47407/ kr2025.6.7.00647
Clinical Case
1 Smolensk State Medical University, Smolensk, Russia
2 Clinical Hospital №1, Smolensk, Russia
ritulya.kozlova.96@mail.ru
Abstract
In this clinical case, we present an observation of a 36-year-old patient with a highly differentiated neuroendocrine tumor (NEO) of the stomach (NET G2, Ki-67.7%), which developed against the background of autoimmune gastritis and persistent infection with Helicobacter pylori (H. pylori). Despite the absence of detection of H. pylori during histological examination, the infection was confirmed by the determination of the
H. pylori antigen in feces by enzyme immunoassay (ELISA), which confirms the need for a comprehensive diagnosis of the pathogen in this category of patients. The clinical case demonstrates the relationship between autoimmune gastritis, H. pylori infection and the development of NEO, and also confirms the effectiveness of a multidisciplinary approach in the treatment of such clinical situations.
Keywords: neuroendocrine tumor of the stomach, autoimmune gastritis, Helicobacter pylori, hypergastrinemia, octreotide, eradication therapy.
For citation: Kozlova M.D., Kovrigin I.I., Dekhnich N.N. Neuroendocrine tumors of the stomach and H. pylori infection: features of patient monitoring on the example of a clinical case. Clinical review for general practice. 2025; 6 (7): 76–80 (In Russ.). DOI: 10.47407/kr2025.6.7.00647
В Российской Федерации до настоящего времени отсутствуют систематизированные статистические данные о распространенности НЭО. Данный факт существенно осложняет анализ эффективности различных методов лечения и разработку унифицированных диагностических протоколов. Согласно информации из реестра SEER (Surveillance, Epidemiology, and End Results), в Соединенных Штатах показатель заболеваемости НЭО на начало 2004 г. достигал 5,25 случая на 100 тыс. населения. Исследователи отмечают устойчивую тенденцию к росту заболеваемости нейроэндокринными новообразованиями всех локализаций на протяжении последних трех десятилетий. Экстраполируя эти данные на российскую популяцию, можно предположить, что ежегодное число новых случаев НЭО в нашей стране должно составлять приблизительно 7350 [3, 4].
Особый интерес исследователей вызывает установленная связь между развитием НЭО и хронической инфекцией H. pylori, которой, по данным Всемирной организации здравоохранения, инфицировано около половины населения земного шара [5]. Широкая распространенность H. pylori и его доказанная роль в патогенезе хронического гастрита, атрофических изменений слизистой оболочки и предраковых состояний желудка делают изучение его влияния на развитие НЭО чрезвычайно актуальным [6]. Патогенетический механизм предполагает, что длительная персистенция инфекции H. pylori приводит к гипохлоргидрии, что в свою очередь вызывает компенсаторную гипергастринемию [7]. Повышенный уровень гастрина стимулирует пролиферацию ECL-клеток, создавая основу для возможной неопластической трансформации [8].
Клиническая значимость проблемы усугубляется диагностическими сложностями. Большинство НЭО на ранних стадиях протекают бессимптомно и обнаруживаются случайно при эндоскопическом исследовании [9]. При этом дифференциальная диагностика между доброкачественными и потенциально злокачественными формами требует комплексного подхода, включая гистологические и иммуногистохимические исследования, а также оценку пролиферативной активности опухолевых клеток [10].
Современные исследования показывают, что эрадикация H. pylori может приводить к регрессу некоторых типов НЭО [11], однако механизмы этого процесса остаются недостаточно изученными. Кроме того, сохраняются вопросы относительно роли различных штаммов микроорганизмов, значения сопутствующих факторов (таких как аутоиммунный гастрит или длительный прием ингибиторов протонной помпы), а также оптимальных стратегий динамического наблюдения за пациентами после лечения [12].
Цель данного описания клинического случая – показать важность комплексного подхода к ведению пациентов с выявленными НЭО желудка.
Пациентка Е., 36 лет, в апреле 2024 г. обратилась к гастроэнтерологу с жалобами на дискомфорт в эпигастрии, жжение языка и привкус кислого во рту.
Анамнез заболевания. Считает себя больной с 2024 г., когда появились дискомфорт в эпигастрии и жжение языка. Ранее никакой клинической симптоматики со стороны желудочно-кишечного тракта не предъявляла, гастроскопия не проводилась. Обратилась в поликлинику по месту жительства с указанными жалобами и была направлена участковым терапевтом на эзофагогастродуоденоскопию (ЭГДС). При ЭГДС, выполненной 11.02.2024, была выявлена слабая диффузная эритема слизистой оболочки тела и антрального отдела желудка. В средней трети тела желудка по малой кривизне обнаруживалось эпителиальное образование диаметром 0,6 см на фоне гиперемированной слизистой оболочки с сохраненным ямочным рисунком. Образование было удалено в ходе исследования. Было выдано заключение врача-эндоскописта: «Эритематозная гастропатия. Полип желудка». Однако гистологическое исследование удаленного образования выявило полиповидный фрагмент слизистой оболочки желудка с очагом высокодифференцированной НЭО. После получения гистологического заключения пациентка была проконсультирована онкологом в специализированном онкологическом центре, где были проведены дополнительные исследования. Лабораторное обследование показало значительное повышение уровня гастрина – до 1761 мкЕд/мл (норма 13–115 мкЕд/мл), хромогранина А – до 288 мкг/л (норма <100 мкг/л) и серотонина – до 249 нг/мл (норма 20–206 нг/мл). Выявлен высокий титр антител к париетальным клеткам желудка (1:2560 при норме <1:40), что в совокупности с другими данными позволило предположить наличие у больной аутоиммунного гастрита.
В марте 2024 г. пациентка была направлена в Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина для пересмотра биопсийного материала и определения дальнейшей тактики ведения. При повторном морфологическом исследовании подтвержден диагноз НЭО желудка Grade 2 (NET G2) с индексом пролиферации Ki-67 – 7%. Повторная эндоскопия, выполненная в конце марта 2024 г., выявила новое образование в теле желудка диаметром 0,6–0,7 см, которое также было удалено с последующим гистологическим исследованием. Дополнительно были взяты биоптаты из пяти стандартных точек для оценки степени атрофии по системе OLGA. Морфологическое исследование подтвердило наличие НЭО Grade 2 с тем же индексом пролиферации. Оценка атрофических изменений показала выраженную атрофию в теле и углу желудка (66–100% желез) и слабую атрофию в антральном отделе, что соответствует III стадии по системе
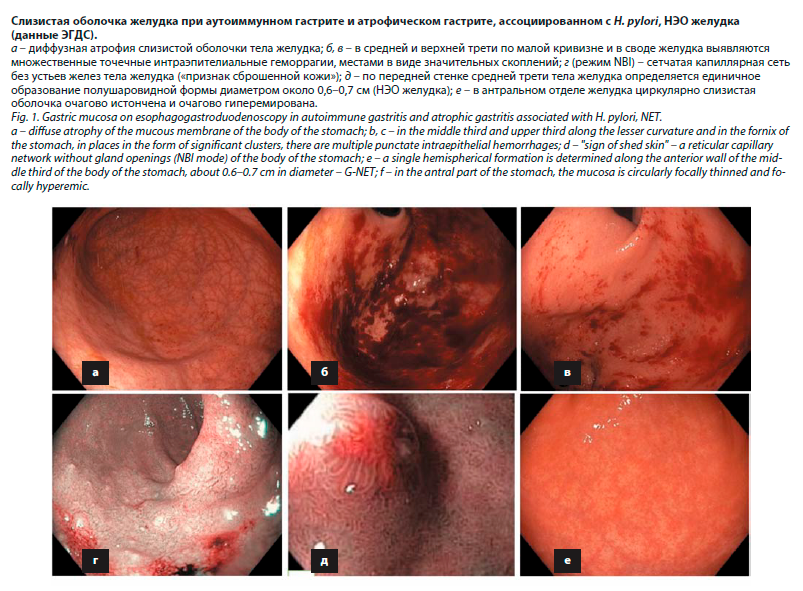
OLGA. H. pylori в исследуемом материале обнаружен не был (см. рисунок).
Полученные данные свидетельствуют о наличии у пациентки НЭО желудка Grade 2, развившихся на фоне аутоиммунного гастрита с выраженными атрофическими изменениями слизистой оболочки желудка. В связи с этим было начато лечение пролонгированным аналогом соматостатина – Октреотидом-депо в дозе 30 мг внутримышечно 1 раз в 4 нед. Контрольное обследование через 3 мес показало выраженную положительную динамику: уровень гастрина снизился с 1761 до 76 мкЕд/мл (норма 13–115 мкЕд/мл), уровень хромо-гранина А нормализовался до 17 мкг/л (исходное значение – 288 мкг/л), содержание серотонина стабилизировалось на уровне 65 нг/мл (исходное значение – 249 нг/мл). Повторная ЭГДС подтвердила отсутствие рецидива и новых опухолевых очагов. Однако сохраняющийся дискомфорт в эпигастрии заставил пациентку обратиться к гастроэнтерологу.
Анамнез жизни. Пациентка имеет высшее образование. Самозанятая, профессиональных вредностей не имеет. Не курит. Алкоголем не злоупотребляет. Травм и операций не было. Наличие хронических заболеваний у себя отрицает. Аллергологический анамнез не отягощен. Наследственный анамнез – у матери были обнаружены полипы в желудке.
Данные объективного обследования. Состояние удовлетворительное. Рост 164 см, масса тела 71 кг, индекс массы тела 26 кг/м2. Видимые слизистые оболочки обычной окраски, костно-мышечная система без особенностей. Кожа чистая, бледно-розовая. Над легкими дыхание везикулярное, хрипов нет. Тоны сердца ритмичны, частота сердечных сокращений – 70 ударов в минуту. Артериальное давление – 110/70 мм рт. ст. Язык влажный, чистый. Обе половины живота симметрично участвуют в акте дыхания. Живот мягкий, при пальпации болезненности не отмечается. Симптомов раздражения брюшины нет. При аускультации живота перистальтика выслушивается. При пальпации нижний край печени определяется у края реберной дуги. Перкуторные размеры печени по Курлову: 10×9×8 см. Селезенка перкуторно не увеличена. Стул регулярный, оформленный, один раз в сутки, без видимых патологических примесей. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание свободное. При пальцевом ректальном исследовании прямой кишки – без особенностей, на перчатке следы кала.
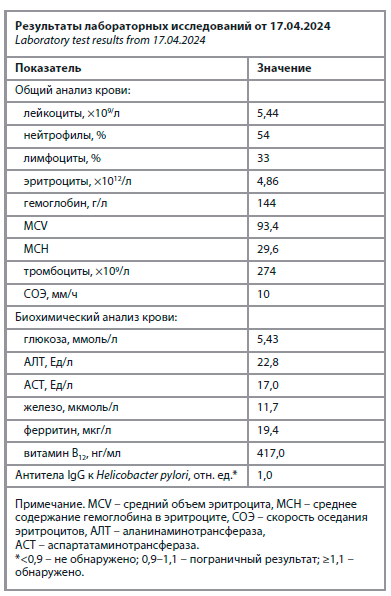
Дополнительные методы исследования. Для обследования были рекомендованы: общий анализ крови, биохимический анализ крови (сывороточное железо, ферритин, витамин B12, глюкоза, АЛТ, АСТ), анализ крови на IgG к инфекции H. pylori (см. таблицу).
Так как анализ крови на антитела к инфекции H. pylori показал пограничный результат (1,0 отн. ед.), был назначен анализ кала на антиген H. pylori методом иммуноферментного анализа, который оказался положительным (18,05 AU/ml).
Лечение и тактика ведения пациентки. Пациентке рекомендована общепринятая диета при гастритах, обеспечивающая отсутствие механического раздражения слизистой оболочки желудка, но способствующая стимуляции его секреторной активности. Целесообразно принимать меньшее количество пищи, равномерно распределенное в течение дня, включать в рацион пищу, богатую злаками, овощами и фруктами, и исключить употребление продуктов с высоким содержанием белка.
Для купирования симптомов диспепсии и эрадикации инфекции H. pylori был назначен 14-дневный курс антихеликобактерной терапии первой линии с использованием стандартной тройной схемы, усиленной препаратом висмута: эзомепразол 20 мг 2 раза в день, кларитромицин 500 мг 2 раза в день, амоксициллин 1000 мг 2 раза в день и висмута трикалия дицитрат 240 мг 2 раза в день. Пациентка прошла эрадикационную терапию в полном объеме. Нежелательных лекарственных реакций в период лечения отмечено не было.
Оценка успешности эрадикации H. pylori была проведена через 8 нед после окончания курса антихеликобактерной терапии. Анализ кала на антиген H. pylori был отрицательный, что подтвердило успешность эрадикации инфекции H. pylori. После проведенного эрадикационного лечения инфекции H. pylori пациентка отмечала улучшение самочувствия в виде исчезновения диспептических жалоб на дискомфорт в эпигастрии.
 Полученные результаты свидетельствуют об эффективности выбранной тактики лечения, сочетающей гормональную терапию аналогами соматостатина с антихеликобактерной терапией. Нормализация биохимических маркеров НЭО (гастрина, хромогранина А, серотонина) в сочетании с отсутствием новых очагов по данным эндоскопического исследования позволяют говорить о достижении стойкой клинической ремиссии НЭО желудка. Данное наблюдение подчеркивает важность комплексного подхода к ведению пациентов с НЭО желудка, включающего как специфическую противоопухолевую терапию, так и лечение H. pylori-ассоциированного гастрита.
Полученные результаты свидетельствуют об эффективности выбранной тактики лечения, сочетающей гормональную терапию аналогами соматостатина с антихеликобактерной терапией. Нормализация биохимических маркеров НЭО (гастрина, хромогранина А, серотонина) в сочетании с отсутствием новых очагов по данным эндоскопического исследования позволяют говорить о достижении стойкой клинической ремиссии НЭО желудка. Данное наблюдение подчеркивает важность комплексного подхода к ведению пациентов с НЭО желудка, включающего как специфическую противоопухолевую терапию, так и лечение H. pylori-ассоциированного гастрита.
Пациентке даны рекомендации по необходимому динамическому мониторингу ряда исследований для исключения возможного прогрессирования аутоиммунного атрофического гастрита и его осложнений:
1) общий клинический анализ крови и биохимический анализ крови (включая железо, ферритин, витамин B12) – 1 раз в 6 мес;
2) исследование серологических биомаркеров ГастроПанель® – 1 раз в год;
3) контроль исходно измененных уровней хромогранина А, гастрина и серотонина – 1 раз в 3 мес;
4) ЭГДС – 1 раз в 6 мес;
5) мультиспиральная компьютерная томография органов грудной клетки и органов брюшной полости с внутривенным усилением – 1 раз в год.
H. pylori.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Козлова Маргарита Дмитриевна – ассистент каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет», ОГБУЗ «Клиническая больница №1».
E-mail: ritulya.kozlova.96@mail.ru; ORCID: 0009-0001-7146-5302
Мargarita D. Kozlova – Аssistant, Smolensk State Medical University, Clinical Hospital №1. E-mail: ritulya.kozlova.96@mail.ru; ORCID: 0009-0001-7146-5302
Ковригин Илья Игоревич – ординатор каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет». E-mail: buztup@mail.ru; ORCID: 0009-0003-0333-2174
Ilya I. Kovrigin – Resident, Smolensk State Medical University.
E-mail: buztup@mail.ru; ORCID: 0009-0003-0333-2174
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения ФГБОУ ВО «Смоленский государственный медицинский университет», ОГБУЗ «Клиническая больница №1». E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – Dr. Sci. (Med.), Prof., Smolensk State Medical University, Clinical Hospital №1. E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Поступила в редакцию: 03.06.2025
Поступила после рецензирования: 17.06.2025
Принята к публикации: 26.06.2025
Received: 03.06.2025
Revised: 17.06.2025
Accepted: 26.06.2025
Neuroendocrine tumors of the stomach and H. pylori infection: features of patient monitoring on the example of a clinical case
Margarita D. Kozlova1,2, Ilya I. Kovrigin1, Natalya N. Dekhnich1,21 Smolensk State Medical University, Smolensk, Russia
2 Clinical Hospital №1, Smolensk, Russia
ritulya.kozlova.96@mail.ru
Abstract
In this clinical case, we present an observation of a 36-year-old patient with a highly differentiated neuroendocrine tumor (NEO) of the stomach (NET G2, Ki-67.7%), which developed against the background of autoimmune gastritis and persistent infection with Helicobacter pylori (H. pylori). Despite the absence of detection of H. pylori during histological examination, the infection was confirmed by the determination of the
H. pylori antigen in feces by enzyme immunoassay (ELISA), which confirms the need for a comprehensive diagnosis of the pathogen in this category of patients. The clinical case demonstrates the relationship between autoimmune gastritis, H. pylori infection and the development of NEO, and also confirms the effectiveness of a multidisciplinary approach in the treatment of such clinical situations.
Keywords: neuroendocrine tumor of the stomach, autoimmune gastritis, Helicobacter pylori, hypergastrinemia, octreotide, eradication therapy.
For citation: Kozlova M.D., Kovrigin I.I., Dekhnich N.N. Neuroendocrine tumors of the stomach and H. pylori infection: features of patient monitoring on the example of a clinical case. Clinical review for general practice. 2025; 6 (7): 76–80 (In Russ.). DOI: 10.47407/kr2025.6.7.00647
Введение
Нейроэндокринные опухоли (НЭО) желудка, несмотря на свою относительную редкость, представляют значимую клиническую проблему в современной гастроэнтерологии и онкологии [1]. Эти новообразования, происходящие из энтерохромаффиноподобных клеток слизистой оболочки желудка, отличаются разнообразием клинического течения – от медленно прогрессирующих форм до агрессивных злокачественных вариантов [2].В Российской Федерации до настоящего времени отсутствуют систематизированные статистические данные о распространенности НЭО. Данный факт существенно осложняет анализ эффективности различных методов лечения и разработку унифицированных диагностических протоколов. Согласно информации из реестра SEER (Surveillance, Epidemiology, and End Results), в Соединенных Штатах показатель заболеваемости НЭО на начало 2004 г. достигал 5,25 случая на 100 тыс. населения. Исследователи отмечают устойчивую тенденцию к росту заболеваемости нейроэндокринными новообразованиями всех локализаций на протяжении последних трех десятилетий. Экстраполируя эти данные на российскую популяцию, можно предположить, что ежегодное число новых случаев НЭО в нашей стране должно составлять приблизительно 7350 [3, 4].
Особый интерес исследователей вызывает установленная связь между развитием НЭО и хронической инфекцией H. pylori, которой, по данным Всемирной организации здравоохранения, инфицировано около половины населения земного шара [5]. Широкая распространенность H. pylori и его доказанная роль в патогенезе хронического гастрита, атрофических изменений слизистой оболочки и предраковых состояний желудка делают изучение его влияния на развитие НЭО чрезвычайно актуальным [6]. Патогенетический механизм предполагает, что длительная персистенция инфекции H. pylori приводит к гипохлоргидрии, что в свою очередь вызывает компенсаторную гипергастринемию [7]. Повышенный уровень гастрина стимулирует пролиферацию ECL-клеток, создавая основу для возможной неопластической трансформации [8].
Клиническая значимость проблемы усугубляется диагностическими сложностями. Большинство НЭО на ранних стадиях протекают бессимптомно и обнаруживаются случайно при эндоскопическом исследовании [9]. При этом дифференциальная диагностика между доброкачественными и потенциально злокачественными формами требует комплексного подхода, включая гистологические и иммуногистохимические исследования, а также оценку пролиферативной активности опухолевых клеток [10].
Современные исследования показывают, что эрадикация H. pylori может приводить к регрессу некоторых типов НЭО [11], однако механизмы этого процесса остаются недостаточно изученными. Кроме того, сохраняются вопросы относительно роли различных штаммов микроорганизмов, значения сопутствующих факторов (таких как аутоиммунный гастрит или длительный прием ингибиторов протонной помпы), а также оптимальных стратегий динамического наблюдения за пациентами после лечения [12].
Цель данного описания клинического случая – показать важность комплексного подхода к ведению пациентов с выявленными НЭО желудка.
Клинический случай

Пациентка Е., 36 лет, в апреле 2024 г. обратилась к гастроэнтерологу с жалобами на дискомфорт в эпигастрии, жжение языка и привкус кислого во рту.
Анамнез заболевания. Считает себя больной с 2024 г., когда появились дискомфорт в эпигастрии и жжение языка. Ранее никакой клинической симптоматики со стороны желудочно-кишечного тракта не предъявляла, гастроскопия не проводилась. Обратилась в поликлинику по месту жительства с указанными жалобами и была направлена участковым терапевтом на эзофагогастродуоденоскопию (ЭГДС). При ЭГДС, выполненной 11.02.2024, была выявлена слабая диффузная эритема слизистой оболочки тела и антрального отдела желудка. В средней трети тела желудка по малой кривизне обнаруживалось эпителиальное образование диаметром 0,6 см на фоне гиперемированной слизистой оболочки с сохраненным ямочным рисунком. Образование было удалено в ходе исследования. Было выдано заключение врача-эндоскописта: «Эритематозная гастропатия. Полип желудка». Однако гистологическое исследование удаленного образования выявило полиповидный фрагмент слизистой оболочки желудка с очагом высокодифференцированной НЭО. После получения гистологического заключения пациентка была проконсультирована онкологом в специализированном онкологическом центре, где были проведены дополнительные исследования. Лабораторное обследование показало значительное повышение уровня гастрина – до 1761 мкЕд/мл (норма 13–115 мкЕд/мл), хромогранина А – до 288 мкг/л (норма <100 мкг/л) и серотонина – до 249 нг/мл (норма 20–206 нг/мл). Выявлен высокий титр антител к париетальным клеткам желудка (1:2560 при норме <1:40), что в совокупности с другими данными позволило предположить наличие у больной аутоиммунного гастрита.
В марте 2024 г. пациентка была направлена в Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина для пересмотра биопсийного материала и определения дальнейшей тактики ведения. При повторном морфологическом исследовании подтвержден диагноз НЭО желудка Grade 2 (NET G2) с индексом пролиферации Ki-67 – 7%. Повторная эндоскопия, выполненная в конце марта 2024 г., выявила новое образование в теле желудка диаметром 0,6–0,7 см, которое также было удалено с последующим гистологическим исследованием. Дополнительно были взяты биоптаты из пяти стандартных точек для оценки степени атрофии по системе OLGA. Морфологическое исследование подтвердило наличие НЭО Grade 2 с тем же индексом пролиферации. Оценка атрофических изменений показала выраженную атрофию в теле и углу желудка (66–100% желез) и слабую атрофию в антральном отделе, что соответствует III стадии по системе
OLGA. H. pylori в исследуемом материале обнаружен не был (см. рисунок).
Полученные данные свидетельствуют о наличии у пациентки НЭО желудка Grade 2, развившихся на фоне аутоиммунного гастрита с выраженными атрофическими изменениями слизистой оболочки желудка. В связи с этим было начато лечение пролонгированным аналогом соматостатина – Октреотидом-депо в дозе 30 мг внутримышечно 1 раз в 4 нед. Контрольное обследование через 3 мес показало выраженную положительную динамику: уровень гастрина снизился с 1761 до 76 мкЕд/мл (норма 13–115 мкЕд/мл), уровень хромо-гранина А нормализовался до 17 мкг/л (исходное значение – 288 мкг/л), содержание серотонина стабилизировалось на уровне 65 нг/мл (исходное значение – 249 нг/мл). Повторная ЭГДС подтвердила отсутствие рецидива и новых опухолевых очагов. Однако сохраняющийся дискомфорт в эпигастрии заставил пациентку обратиться к гастроэнтерологу.
Анамнез жизни. Пациентка имеет высшее образование. Самозанятая, профессиональных вредностей не имеет. Не курит. Алкоголем не злоупотребляет. Травм и операций не было. Наличие хронических заболеваний у себя отрицает. Аллергологический анамнез не отягощен. Наследственный анамнез – у матери были обнаружены полипы в желудке.
Данные объективного обследования. Состояние удовлетворительное. Рост 164 см, масса тела 71 кг, индекс массы тела 26 кг/м2. Видимые слизистые оболочки обычной окраски, костно-мышечная система без особенностей. Кожа чистая, бледно-розовая. Над легкими дыхание везикулярное, хрипов нет. Тоны сердца ритмичны, частота сердечных сокращений – 70 ударов в минуту. Артериальное давление – 110/70 мм рт. ст. Язык влажный, чистый. Обе половины живота симметрично участвуют в акте дыхания. Живот мягкий, при пальпации болезненности не отмечается. Симптомов раздражения брюшины нет. При аускультации живота перистальтика выслушивается. При пальпации нижний край печени определяется у края реберной дуги. Перкуторные размеры печени по Курлову: 10×9×8 см. Селезенка перкуторно не увеличена. Стул регулярный, оформленный, один раз в сутки, без видимых патологических примесей. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание свободное. При пальцевом ректальном исследовании прямой кишки – без особенностей, на перчатке следы кала.
Дополнительные методы исследования. Для обследования были рекомендованы: общий анализ крови, биохимический анализ крови (сывороточное железо, ферритин, витамин B12, глюкоза, АЛТ, АСТ), анализ крови на IgG к инфекции H. pylori (см. таблицу).
Так как анализ крови на антитела к инфекции H. pylori показал пограничный результат (1,0 отн. ед.), был назначен анализ кала на антиген H. pylori методом иммуноферментного анализа, который оказался положительным (18,05 AU/ml).
Лечение и тактика ведения пациентки. Пациентке рекомендована общепринятая диета при гастритах, обеспечивающая отсутствие механического раздражения слизистой оболочки желудка, но способствующая стимуляции его секреторной активности. Целесообразно принимать меньшее количество пищи, равномерно распределенное в течение дня, включать в рацион пищу, богатую злаками, овощами и фруктами, и исключить употребление продуктов с высоким содержанием белка.
Для купирования симптомов диспепсии и эрадикации инфекции H. pylori был назначен 14-дневный курс антихеликобактерной терапии первой линии с использованием стандартной тройной схемы, усиленной препаратом висмута: эзомепразол 20 мг 2 раза в день, кларитромицин 500 мг 2 раза в день, амоксициллин 1000 мг 2 раза в день и висмута трикалия дицитрат 240 мг 2 раза в день. Пациентка прошла эрадикационную терапию в полном объеме. Нежелательных лекарственных реакций в период лечения отмечено не было.
Оценка успешности эрадикации H. pylori была проведена через 8 нед после окончания курса антихеликобактерной терапии. Анализ кала на антиген H. pylori был отрицательный, что подтвердило успешность эрадикации инфекции H. pylori. После проведенного эрадикационного лечения инфекции H. pylori пациентка отмечала улучшение самочувствия в виде исчезновения диспептических жалоб на дискомфорт в эпигастрии.
 Полученные результаты свидетельствуют об эффективности выбранной тактики лечения, сочетающей гормональную терапию аналогами соматостатина с антихеликобактерной терапией. Нормализация биохимических маркеров НЭО (гастрина, хромогранина А, серотонина) в сочетании с отсутствием новых очагов по данным эндоскопического исследования позволяют говорить о достижении стойкой клинической ремиссии НЭО желудка. Данное наблюдение подчеркивает важность комплексного подхода к ведению пациентов с НЭО желудка, включающего как специфическую противоопухолевую терапию, так и лечение H. pylori-ассоциированного гастрита.
Полученные результаты свидетельствуют об эффективности выбранной тактики лечения, сочетающей гормональную терапию аналогами соматостатина с антихеликобактерной терапией. Нормализация биохимических маркеров НЭО (гастрина, хромогранина А, серотонина) в сочетании с отсутствием новых очагов по данным эндоскопического исследования позволяют говорить о достижении стойкой клинической ремиссии НЭО желудка. Данное наблюдение подчеркивает важность комплексного подхода к ведению пациентов с НЭО желудка, включающего как специфическую противоопухолевую терапию, так и лечение H. pylori-ассоциированного гастрита.Пациентке даны рекомендации по необходимому динамическому мониторингу ряда исследований для исключения возможного прогрессирования аутоиммунного атрофического гастрита и его осложнений:
1) общий клинический анализ крови и биохимический анализ крови (включая железо, ферритин, витамин B12) – 1 раз в 6 мес;
2) исследование серологических биомаркеров ГастроПанель® – 1 раз в год;
3) контроль исходно измененных уровней хромогранина А, гастрина и серотонина – 1 раз в 3 мес;
4) ЭГДС – 1 раз в 6 мес;
5) мультиспиральная компьютерная томография органов грудной клетки и органов брюшной полости с внутривенным усилением – 1 раз в год.
Заключение
Хотя точный механизм влияния H. pylori на развитие аутоиммунного гастрита остается не до конца изученным, современные исследования свидетельствуют о синергетическом эффекте между аутоиммунным процессом и бактериальной инфекцией, существенно повышающем риск малигнизации. В связи с этим обязательному скринингу на инфекцию H. pylori подлежат все пациенты с подтвержденным аутоиммунным гастритом. При выявлении инфекции показано проведение антихеликобактерной терапии с последующим обязательным мониторингом эффективности эрадикацииH. pylori.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Козлова Маргарита Дмитриевна – ассистент каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет», ОГБУЗ «Клиническая больница №1».
E-mail: ritulya.kozlova.96@mail.ru; ORCID: 0009-0001-7146-5302
Мargarita D. Kozlova – Аssistant, Smolensk State Medical University, Clinical Hospital №1. E-mail: ritulya.kozlova.96@mail.ru; ORCID: 0009-0001-7146-5302
Ковригин Илья Игоревич – ординатор каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет». E-mail: buztup@mail.ru; ORCID: 0009-0003-0333-2174
Ilya I. Kovrigin – Resident, Smolensk State Medical University.
E-mail: buztup@mail.ru; ORCID: 0009-0003-0333-2174
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения ФГБОУ ВО «Смоленский государственный медицинский университет», ОГБУЗ «Клиническая больница №1». E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – Dr. Sci. (Med.), Prof., Smolensk State Medical University, Clinical Hospital №1. E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Поступила в редакцию: 03.06.2025
Поступила после рецензирования: 17.06.2025
Принята к публикации: 26.06.2025
Received: 03.06.2025
Revised: 17.06.2025
Accepted: 26.06.2025
Список исп. литературыСкрыть список1. Modlin IM, Lye KD, Kidd MA. 5-decade analysis of 13,715 carcinoid tumors. Cancer. 2003;97:934-59.
2. Burkitt MD, Pritchard DM. Review article: Pathogenesis and management of gastric carcinoid tumours. Aliment Pharmacol Ther. 2006 Nov 1;24(9):1305-20. DOI: 10.1111/j.1365-2036.2006.03130.x
3. Yao JC, Hassan M, Phan A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35825 cases in the United States. J Clin Oncol. 2008;26:3063-72.
4. Артамонова ЕВ, Бельцевич ДГ, Гелиашвили ТМ и др. Нейроэндокринные опухоли. Клинические рекомендации. М., 2020.
Artamonova EV, Beltsevich DG, Geliashvili TM, et al. Neuroendocrine tumors. Clinical guidelines. Moscow, 2020 (in Russian).
5. Hooi JKY, Lai WY, Ng WK, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153(2):420-9.
6. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. Cancer Res. 1992;52(24):6735-40.
7. Delle Fave G, O’Toole D, Sundin A, et al. ENETS Consensus Guidelines Update for Gastroduodenal Neuroendocrine Neoplasms. Neuroendocrinology. 2016;103:119-24.
8. Jianu CS, Fossmark R, Viset T, et al. Gastric carcinoids after long-term use of a proton pump inhibitor. Aliment Pharmacol Ther. 2012;36(7):644-9.
9. Scherübl H, Cadiot G, Jensen RT, et al. Neuroendocrine tumors of the stomach (gastric carcinoids) are on the rise: small tumors, small problems? Endoscopy. 2010;42(08):664-71.
10. Rindi G, Klöppel G, Couvelard A, et al. TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Archiv. 2007;451(4):757-62.
11. Borch K, Ahrén B, Ahlman H, et al. Gastric carcinoids: biologic behavior and prognosis after differentiated treatment in relation to type. Ann Surg. 2005;242(1):64-73.
12. Massironi S, Sciola V, Spampatti MP, et al. Gastric carcinoids: between underestimation and overtreatment. World J Gastroenterol. 2009;15(18):2177-83.