Клинический разбор в общей медицине №7 2025
Клинический разбор в общей медицине №7 2025
Маркеры эффективности нутриционной поддержки у пациентов хирургического профиля (обзор литературы)
Номера страниц в выпуске:81-86
Аннотация
В обзорной статье подробно раскрыты возможности оценки нутриционного статуса у пациентов хирургического профиля. Оценка нутриционного статуса должна проводиться комплексно для определения показаний и эффективности нутриционной поддержки (НП): начиная со скрининга, который учитывает клинические данные, с использованием шкал и индексов, включающих маркеры крови, антропометрию, заканчивая инструментальными методами, функциональными пробами, – что позволяет понять степень риска, вид нарушений питания и их обратимость, прогнозировать ответ на НП, возможные осложнения и последствия операции. В периоперационном периоде особенно важно своевременное выявление скрытого белково-энергетического дефицита, правильное обеспечение потребностей в основных компонентах питания и жидкости для предотвращения осложнений, связанных с нутриционной недостаточностью. Алгоритм применения методик при проведении оценки эффективности НП на разных этапах периоперационного периода является непростой задачей, и необходимо отметить, что тактика НП в периоперационном периоде не имеет единого подхода среди международных медицинских сообществ. В статье подробно обсуждаются скрининги, позволяющие выявить нутриционные риски развития осложнений и выбрать тактику наблюдения или лечения пациента; шкалы, определяющие тяжесть нутриционной недостаточности; индексы и шкалы, включающие дополнительные маркеры крови и позволяющие оценить тяжесть нутриционной недостаточности. Внедрение в дополнение к общепринятым стандартным показателям новых маркеров нутриционной недостаточности, таких как преальбумин, иризин, трансферрин, ретинол-связывающий белок, не имеющих рутинного применения, будет способствовать корректной оценке степени тяжести и эффективности терапии у пациентов хирургического профиля. Таким образом, следует учитывать факторы, влияющие на интерпретацию полученных результатов, и использовать наиболее чувствительные маркеры в различных клинических ситуациях, это позволит оптимизировать подход в лечении пациента, добиться достойных результатов.
Ключевые слова: нутриционный статус, саркопения, скрининг нутриционного риска, Индекс нутриционного риска, Универсальный скрининг недостаточности питания, Неапольская прогностическая шкала, маркеры нутриционной недостаточности, ретинол-связывающий белок, периоперационная нутриционная поддержка.
Для цитирования: Кузьмина Т.Н., Рубанова Д.В., Смирнова О.А., Сергеева А.В., Тимощенко А.В., Винницкая Е.В. Маркеры эффективности нутриционной поддержки у пациентов хирургического профиля (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (7): 81–86. DOI: 10.47407/kr2025.6.7.00648
В обзорной статье подробно раскрыты возможности оценки нутриционного статуса у пациентов хирургического профиля. Оценка нутриционного статуса должна проводиться комплексно для определения показаний и эффективности нутриционной поддержки (НП): начиная со скрининга, который учитывает клинические данные, с использованием шкал и индексов, включающих маркеры крови, антропометрию, заканчивая инструментальными методами, функциональными пробами, – что позволяет понять степень риска, вид нарушений питания и их обратимость, прогнозировать ответ на НП, возможные осложнения и последствия операции. В периоперационном периоде особенно важно своевременное выявление скрытого белково-энергетического дефицита, правильное обеспечение потребностей в основных компонентах питания и жидкости для предотвращения осложнений, связанных с нутриционной недостаточностью. Алгоритм применения методик при проведении оценки эффективности НП на разных этапах периоперационного периода является непростой задачей, и необходимо отметить, что тактика НП в периоперационном периоде не имеет единого подхода среди международных медицинских сообществ. В статье подробно обсуждаются скрининги, позволяющие выявить нутриционные риски развития осложнений и выбрать тактику наблюдения или лечения пациента; шкалы, определяющие тяжесть нутриционной недостаточности; индексы и шкалы, включающие дополнительные маркеры крови и позволяющие оценить тяжесть нутриционной недостаточности. Внедрение в дополнение к общепринятым стандартным показателям новых маркеров нутриционной недостаточности, таких как преальбумин, иризин, трансферрин, ретинол-связывающий белок, не имеющих рутинного применения, будет способствовать корректной оценке степени тяжести и эффективности терапии у пациентов хирургического профиля. Таким образом, следует учитывать факторы, влияющие на интерпретацию полученных результатов, и использовать наиболее чувствительные маркеры в различных клинических ситуациях, это позволит оптимизировать подход в лечении пациента, добиться достойных результатов.
Ключевые слова: нутриционный статус, саркопения, скрининг нутриционного риска, Индекс нутриционного риска, Универсальный скрининг недостаточности питания, Неапольская прогностическая шкала, маркеры нутриционной недостаточности, ретинол-связывающий белок, периоперационная нутриционная поддержка.
Для цитирования: Кузьмина Т.Н., Рубанова Д.В., Смирнова О.А., Сергеева А.В., Тимощенко А.В., Винницкая Е.В. Маркеры эффективности нутриционной поддержки у пациентов хирургического профиля (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (7): 81–86. DOI: 10.47407/kr2025.6.7.00648
Review
Anastasia V. Timoshchenko, Elena V. Vinnitskaya
Loginov Moscow Clinical Scientific and Practical Center, Moscow, Russia
dr.smirnovaoa@gmail.com
Abstract
The review article details the possibilities of assessing nutritional status in surgical patients. Nutritional status assessment should be carried out comprehensively to determine the indications and effectiveness of nutritional support: starting with screening, which takes into account clinical data, using scales and indices including blood markers, anthropometry, instrumental techniques, functional tests, which allows you to understand the degree of risk, the type of nutritional disorders and its reversibility, predict the response to nutritional support, possible complications and consequences of surgery. In the perioperative period, timely detection of latent protein and energy deficiency, proper provision of basic nutrition and fluid requirements, is especially important to prevent complications associated with nutritional deficiencies. The algorithm of applying the techniques in assessing the effectiveness of nutritional support at different stages of the perioperative period is not an easy task, and it should be noted that the tactics of nutritional support in the perioperative period among the international medical communities does not have a single approach. The article discusses in detail the screenings that identify the nutritional risks of complications and choose the tactics of monitoring or treating the patient; scales that determine the severity of nutritional deficiencies; indexes and scales that include additional blood markers and assess the severity of nutritional deficiencies. The possibility of introducing new markers of nutritional deficiency, such as prealbumin, irisin, transferrin, retinol-binding protein, which have no routine use, except for generally accepted standard indicators, will contribute to the correct assessment of the severity and effectiveness of therapy in surgical patients. Thus, it is necessary to take into account and use the most sensitive markers in various clinical situations, this will optimize the approach to patient treatment and achieve decent results.
Keywords: nutritional status, sarcopenia, Nutritional Risk Screening NRS-2002, Nutritional Risk Index to Buzby, Malnutrition Universal Screening Tool, Naples Prognostic Score, markers of nutritional deficiency, retinol binding protein, рerioperative nutritional support.
For citation: Kuzmina T.N., Rubanova D.V., Smirnova O.A., Sergeeva A.V., Timoshchenko A.V., Vinnitskaya E.V. Markers of the effectiveness of nutritional support in surgical patients (literature review). Clinical review for general practice. 2025; 6 (7): 81–86 (In Russ.). DOI: 10.47407/kr2025.6.7.00648
Нутриционный статус является интегральным показателем, отражающим как физиологические, так и патологические процессы в организме человека, которые в определенной степени способны компенсироваться за счет различных депо, интенсификации белкового обмена в печени, гормональной регуляции.
В зависимости от причин воздействия на нутриционный статус и его фенотипических проявлений («простое» голодание, саркопения, кахексия, раковая кахексия) будет формироваться необратимость или возможность обратимости данных состояний.
Хирургическая стресс-реакция, как правило, запускает катаболизм в обменных процессах, поэтому нутриционная поддержка (НП) должна являться неотъемлемой составляющей в лечении пациентов хирургического профиля, особенно с проявлениями признаков печеночной дисфункции.
В периоперационном периоде особенно важно своевременное выявление скрытого белково-энергетического дефицита, правильное обеспечение потребностей в основных компонентах питания и жидкости для предотвращения осложнений, связанных с нутриционной недостаточностью. Распространенность рисков нутриционной недостаточности колеблется, в зависимости от метода их определения, в пределах 48–52% [1–3]. Пациент может по-разному реагировать на НП из-за неоднородной доступности и усвоения питательных веществ. Также наличие сопутствующей патологии, генетические и эпигенетические факторы, дисфункция печени и почек, восприимчивость к заболеваниям и их прогрессирование являются препятствием для осуществления контроля эффективности НП.
Алгоритм применения различных методик при проведении оценки эффективности НП на разных этапах периоперационного периода является непростой задачей, что мы и хотели обсудить в данной статье.
Необходимо отметить, что тактика НП в периоперационном периоде не имеет единого подхода среди международных медицинских сообществ.
Российское общество клинических онкологов (Russian Society of Clinical Oncology, RUSSCO) рекомендует использовать скрининг нутриционного риска (Nutritional Risk Screening, NRS-2002), введенный в Единую медицинскую информационно-аналитическую систему города Москвы (ЕМИАС) в виде «статуса питания», для назначения НП при высоком риске в течение 10–14 дней, с использованием иммунопитания в послеоперационном периоде при поражении верхних отделов желудочно-кишечного тракта (ЖКТ) [4].
Европейская ассоциация парентерального и энтерального питания (European Society for Clinical Nutrition and Metabolism, ESPEN) нацеливает на проведение превентивной НП независимо от исходного нутриционного статуса [5, 6].
Американское общество парентерального и энтерального питания (American Society for Parenteral and Enteral Nutrition, ASPEN) считает целесообразным назначать иммунопитание пациентам с недостаточностью питания при онкопатологии ЖКТ, головы и шеи за 5–7 дней до операции [7], а отдельным категориям – продлевать курс нутриционной коррекции до 7–14 дней [8].
Американское общество клинической онкологии (American Society of Clinical Oncology, ASCO 2020) использует критерии нутриционной недостаточности GLIM (Global Leadership Initiative on Malnutrition), которые не предусматривают использования каких-либо биохимических или других лабораторных маркеров при оценке степени нутриционной недостаточности для назначения НП [9].
Повсеместное использование скринингов нутриционной недостаточности помогает выявить риски ее развития и определить показания к началу НП.
А. Скрининги, позволяющие выявить нутриционные риски развития осложнений и выбрать тактику наблюдения/лечения пациента:
1. Европейское сообщество по медицинской онкологии (The European Society for Medical Oncology, ESMO) в 2008 г. предложило скрининг для пациентов, который учитывает величину снижения массы тела и наличие аппетита для определения показаний к НП [10].
2. Универсальный скрининг недостаточности питания (мальнутриции) (Malnutrition Universal Screening Tool, MUST) включает параметры роста, массы тела, индекса массы тела (ИМТ), непреднамеренное снижение массы тела, наличие острого заболевания и/или вероятность отсутствия приема пищи более 5 дней, с последующим определением рисков развития нутриционной недостаточности и дальнейшей тактики ведения пациента [11].
3. Ноттингемский скрининг-опросник для определения нутриционной коррекции (2006) включает аналогичные данные, но в нем детально оценивается тяжесть заболевания [12].
4. Скрининг нутриционного риска (Nutritional Risk Screening 2002, NRS-2002) также учитывает эти же параметры, но более детально производится учет потери массы тела, объема потребляемой пищи. Основное заболевание градируется в зависимости от тяжести, учитывается возраст пациента старше 70 лет [13].
5. Мини-оценка питания (Mini Nutritional Assessment, MNA) – наиболее распространенный скрининговый и диагностический инструмент, определяющий состояние, которое способствует развитию недостаточности питания, иммобилизацию и депрессию [14].
Б. Шкалы, определяющие тяжесть нутриционной недостаточности:
1. Субъективная общая оценка (Subjective Global Assessment) отражает степени тяжести нутриционной недостаточности после анализа ряда показателей (процент потери массы тела, объем употребляемого пищевого рациона от необходимого, наличие диспепсии, функциональная активность, стадия течения основного заболевания, состояния подкожного жира и мышечной массы, наличие отечно-асцитического синдрома) [15].
2. Шкала, предложенная Глобальной инициативной группой по борьбе с недоеданием (Global Leadership Initiative on Malnutrition, GLIM), анализирует фенотипические и этиологические факторы, приведшие к нарушению питания, снижение мышечной массы, подтвержденное инструментальными данными, по итогу диагностирует степень нутриционной недостаточности (1-й степени – умеренная, 2-й степени – тяжелая) [16].
В. Индексы и шкалы, включающие дополнительные маркеры крови и позволяющие оценить тяжесть нутриционной недостаточности:
1. Шкала контроля нутриционного статуса (Controlling Nutritional Status score, CONUT): сывороточный альбумин, абсолютное число лимфоцитов, общий холестерин. По совокупности баллов выставляется степень тяжести нутриционной недостаточности (легкая степень нарушений, средняя степень нарушений, тяжелая степень нарушений) [17, 18].
2. Индекс нутриционного риска (Nutritional Risk Index, NRI) to Buzby (1988) и Гериатрический индекс нутриционного риска (Geriatric Nutritional Risk Index, GNRI) различаются величиной коэффициента и отражают тяжесть нарушения питания по совокупности уровня сывороточного альбумина, отношения актуальной массы тела к обычной массе тела (стабильной величине за последние 6 мес):
NRI = [1,519 × альбумин (г/л)] + [41,7 × (масса тела / идеальная масса тела)],GNRI = [1,489 × альбумин (г/л)] + [41,7 × (масса тела / идеальная масса тела)].
 Интерпретация результатов: >100 – нет нарушений питания (no malnutrition); 97,5–100 – легкое нарушение питания (mild malnutrition); 83,5–97,5 – умеренное нарушение питания (moderate malnutrition); <83,5 – тяжелое нарушение питания (severe malnutrition) [19]. Низкие показатели NRI и GNRI указывают на серьезное недоедание.
Интерпретация результатов: >100 – нет нарушений питания (no malnutrition); 97,5–100 – легкое нарушение питания (mild malnutrition); 83,5–97,5 – умеренное нарушение питания (moderate malnutrition); <83,5 – тяжелое нарушение питания (severe malnutrition) [19]. Низкие показатели NRI и GNRI указывают на серьезное недоедание.
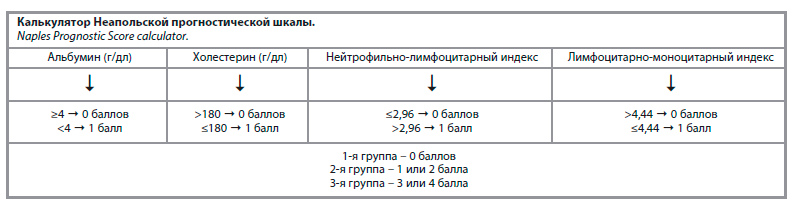
3. Неапольская прогностическая шкала (Naples Prognostic Score, Based on Nutritional and Inflammatory Status – Naples Prognostic Score, NPS) включает следующие показатели: альбумин сыворотки крови, общий холестерин, соотношение нейтрофилов/лимфоцитов и лимфоцитов/моноцитов. По совокупности баллов выявляется степень корреляции с постоперационными осложнениями у больных колоректальным раком (см. рисунок) [20].
4. Прогностический индекс гипотрофии (ПИГ) (Хорошилов И.Е., 1998):
ПИГ (%) = 140 – 1,5 [альбумин сыворотки крови (г/л)] – 1 [окружность средней трети плеча (см)] – 0,5 [КЖСТ (мм)] – 20 (абс. число лимфоцитов крови 109/л).
Значения ПИГ: 0–20% – эйтрофия; 20–30% – гипотрофия легкой степени; 30–50% – среднетяжелая степень гипотрофии; >50% – тяжелая степень гипотрофии [21].
5. Шкала соотношений гемоглобина, альбумина, лимфоцитов, тромбоцитов (Hemoglobin, Albumin, Lymphocyte, Platelets score, HALP) является прогностическим индексом выживаемости у пациентов онкологического профиля [22].
Общепринятым традиционным маркером белкового дефицита является альбумин. Применение данного маркера у пациентов с высоким риском неблагоприятного клинического исхода при неудовлетворительном эффекте НП выполняет прогностическую функцию, при положительном эффекте НП – имеет предиктивное значение, способное обеспечить дифференцированный подход к тактике лечения [23]. Однако при проведении заместительной альбуминотерапии невозможно полностью полагаться на него, так как значение будет соответствовать референсным показателям, снижая показатели рисков.
Большинство скринингов и шкал учитывают клинические признаки нутриционной недостаточности, уровень сывороточного альбумина, холестерина, отдельных клеточных элементов крови, которые при нарушении гидробаланса и печеночной дисфункции могут быть искажены и неверно интерпретированы. Поэтому полностью полагаться на результаты скрининга в определенной степени затруднительно.
Возможность внедрения новых маркеров нутриционной недостаточности, не имеющих рутинного применения, кроме общепринятых стандартных показателей, будет способствовать корректной оценке степени тяжести и эффективности терапии у пациентов хирургического профиля.
Преальбумин – более чувствительный маркер, но период его синтеза составляет 48 ч, а изменения водной нагрузки, которые могут происходить достаточно активно в ближайшем периоперационном периоде, будут влиять на трактовку полученного результата [24].
Период полужизни свободного ретинол-связывающего белка (retinol binding protein) составляет менее 3 ч, а ретинол-связывающего белка в связанном с транстиретином виде – около 12 ч, что позволяет использовать его как маркер, отражающий состояние питания пациента в течение последних 2 дней [25, 26].
Трансферрин имеет период жизни 8 дней, что может быть оптимальным для контроля проведения НП. Однако его уровень может изменяться из-за заболевания печени, продвинутой стадии хронической болезни почек [27], изменения уровня железа [28], сердечно-сосудистых операций [29].
Применение оценки комплекса маркеров (например, гемоглобин, иммуноглобулины G, M, A, лейкоциты, С-реактивный белок, интерлейкин-6) способно отразить эффективность ранней НП у больных раком желудка [30].
Одним из новых показателей состояния питания является ширина распределения эритроцитов (red blood cell distribution width, RDW) – маркер реакции на диетотерапию [31].
В 2022 г. произошла смена парадигмы периоперационного питания, связанного с весомым влиянием саркопении на прогноз у онкологических больных, хирургические осложнения и активность воспаления как причины анаболической резистентности [32].
Так, у пациентов с саркопенией после резекционных вмешательств на печени достоверно чаще отмечались длительное пребывание в стационаре, повторная госпитализация, осложнения [33].
Использование быстрого опросника саркопении (Sarcopenia Fast, SARC-F) и опросника оценки качества жизни при саркопении (Sarcopenia Quality of Life questionnaire, SarQoL) будет нацеливать на более точную диагностику и дополнительное проведение контроля маркеров крови.
В связи с этим перспективным биомаркером состояния питания и наличия саркопении у пациентов с раком ЖКТ является оценка уровня карнитина в сыворотке [34].
Высокий уровень нейтрофилов и лимфоцитов (NLR) – независимый показатель потери мышечной массы [35].
Изучение D3-креатина – D3-креатинина мочи методом масс-спектрометрии изотопного соотношения или жидкостной хроматографии / тандемной масс-спектрометрии позволяет оценить влияние НП на саркопению [36], однако данная методика требует высокотехнологичного оборудования.
Иризин (миокин) – маркер работы мышечной ткани, позволяющий оценить влияние НП [37].
Антропометрические показатели у пациентов хирургического профиля в большинстве случаев под влиянием НП изменяются. Важно изучить состав тела, особенно состояние мышечной массы, до и после НП.
Подсчет площади отдельных мышц (поясничная мышца в зонах LIII, ТXII) при проведении компьютерной томографии происходит автоматически, с помощью специальной программы, что целесообразно выносить в заключение в виде подтверждения или исключения дефицита мышечной ткани.
При данном методе исследования саркопению определяют как уменьшение скелетно-мышечного индекса (skeletal muscle index, SMI) <53,00 см2/м2 для мужчин с ИМТ ≥25 кг/м2, <43,00 см2/м2 для мужчин с ИМТ <25 кг/м2 и <41,00 см2/м2 для женщин [38].
Повторное контрольное исследование после проведения НП сопряжено с повышением лучевой нагрузки и в большинстве случаев нецелесообразно.
Инструментальная методика, оценивающая композиционный состав тела с помощью биоимпедансного анализа, определяет фазовый угол (ФУ), по уровню значения которого можно диагностировать саркопению: ФУ 4,05° у мужчин (чувствительность – 82%, специфичность – 52,2%); ФУ 3,55° у женщин (чувствительность – 71,4%, специфичность – 65,8%). Для пожилых пациентов рекомендовано значение ≤4,55° (чувствительность – 70%, специфичность – 65,9%) [39].
Определение индекса массы скелетных мышц (ИМСМ) рассчитывается по формуле:
ИМСМ = безжировая масса × 0,566,соответственно показателями саркопении являются значения <7,0 кг/м2 для мужчин и <5,7 кг/м2 для женщин [38].
Использование для контроля эффективности НП биоимпедансного анализа состава тела рационально, так как не связано с лучевой нагрузкой и просто в исполнении.
В отношении контроля динамики мышечной силы применение функциональных тестов с целью диагностики саркопении (снижение мышечной силы), оцениваемой при помощи кистевого динамометра, может иметь ряд ограничений, таких как артрозы, артриты мелких суставов кистей, лучезапястных суставов, последствия травмы верхних конечностей, влияющие на трактовку результатов данной функциональной пробы, что исключает ее рутинное применение.
При отсутствии указанных ситуаций в качестве отражения снижения мышечной силы как ключевого критерия саркопении следует рассматривать показатели кистевой динамометрии: для мужчин – снижение мышечной силы менее 26 кг, для женщин – менее 16 кг [40].
В отдельных случаях целесообразно использовать тест с оценкой скорости ходьбы по прямой дорожке; снижение физической работоспособности можно зафиксировать при уменьшении скорости ходьбы менее 0,8 м/с (норма – 10 м/с) [38], но это вступает в противоречие с новым алгоритмом диагностики саркопении FACS: «Найти (Find) – Оценить (Assess) – Подтвердить (Confirm) – Тяжесть (Severity)», согласно которому в первую очередь оценивается мышечная сила, далее оценивают массу скелетных мышц и, если наблюдается ее уменьшение, подтверждают саркопению (Европейская рабочая группа по саркопении пожилых – European Working Group on Sarcopenia for Older People, EWGSOP2).
Таким образом, пересмотренный алгоритм подчеркивает достаточность наличия снижения мышечной силы и массы для установления диагноза саркопении, тогда как предыдущий алгоритм требовал для постановки диагноза определения всех показателей.
На наш взгляд, оценка нутриционного статуса должна проводиться комплексно для определения показаний и эффективности НП: начиная со скрининга, который учитывает клинические данные, с использованием шкал и индексов, включающих маркеры крови, антропометрию, заканчивая инструментальными методиками, функциональными пробами, что позволяет понять степень риска, вид нарушений питания и его обратимость, прогнозировать ответ на НП, возможные осложнения и последствия операции.
Следует учитывать факторы, влияющие на интерпретацию полученных результатов, и использовать наиболее чувствительные маркеры при различных клинических ситуациях, это позволит оптимизировать подход в лечении пациента, добиться достойных результатов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Кузьмина Татьяна Николаевна – д-р мед. наук, зав. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова».
E-mail: KuzminaTN1@zdrav.mos.ru; ORCID: 0000-0003-2800-6503; eLIBRARY.RU SPIN: 3276-7602
Tatiana N. Kuzmina – Dr. Sci. (Med.), Loginov Moscow Clinical Scientific and Practical Center. E-mail: KuzminaTN1@zdrav.mos.ru; ORCID: 0000-0003-2800-6503; eLIBRARY.RU SPIN: 3276-7602
Рубанова Дарья Владимировна – врач анестезиолог-реаниматолог, мл. науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ
им. А.С. Логинова». E-mail: feria2008@mail.ru; ORCID: 0009-0003-2219-8919
Darya V. Rubanova – anesthesiologist-resuscitator, Res. Assist., Loginov Moscow Clinical Scientific and Practical Center. E-mail:
feria2008@mail.ru; ORCID: 0009-0003-2219-8919
Смирнова Ольга Андреевна – канд. мед. наук, науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова». E-mail: dr.smirnovaoa@gmail.com; ORCID: 0000-0002-0088-4075;
eLIBRARY.RU SPIN: 3354-3232
Olga A. Smirnova – Cand. Sci. (Med.), Res. Officer, Loginov Moscow Clinical Scientific and Practical Center. E-mail: dr.smirnovaoa@gmail.com; ORCID: 0000-0002-0088-4075;
eLIBRARY.RU SPIN: 3354-3232
Сергеева Алёна Викторовна – мл. науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова». E-mail: SergeevaAV13@zdrav.mos.ru; ORCID: 0009-0005-1761-5372;
eLIBRARY.RU SPIN: 8899-2406
Alyona V. Sergeeva – Res. Assist., Loginov Moscow Clinical Scientific and Practical Center. E-mail: SergeevaAV13@zdrav.mos.ru;
ORCID: 0009-0005-1761-5372; eLIBRARY.RU SPIN: 8899-2406
Тимощенко Анастасия Викторовна – врач-гастроэнтеролог, аспирант отд-ния заболеваний печени ГБУЗ «МКНЦ им.
А.С. Логинова»
Anastasia V. Timoshchenko – gastroenterologist, Graduate Student, Loginov Moscow Clinical Scientific and Practical Center
Винницкая Елена Владимировна – д-р мед. наук, зав. отд. гепатологии ГБУЗ «МКНЦ им. А.С. Логинова». ORCID: 0000-0002-0344-8375; eLIBRARY.RU SPIN: 6796-7670
Elena V. Vinnitskaya – Dr. Sci. (Med.), Loginov Moscow Clinical Scientific and Practical Center. ORCID: 0000-0002-0344-8375;
eLIBRARY.RU SPIN: 6796-7670
Поступила в редакцию: 17.06.2025
Поступила после рецензирования: 27.06.2025
Принята к публикации: 03.07.2025
Received: 17.06.2025
Revised: 27.06.2025
Accepted: 03.07.2025
Markers of the effectiveness of nutritional support in surgical patients (literature review)
Tatiana N. Kuzmina, Darya V. Rubanova, Olga A. Smirnova, Alyona V. Sergeeva,Anastasia V. Timoshchenko, Elena V. Vinnitskaya
Loginov Moscow Clinical Scientific and Practical Center, Moscow, Russia
dr.smirnovaoa@gmail.com
Abstract
The review article details the possibilities of assessing nutritional status in surgical patients. Nutritional status assessment should be carried out comprehensively to determine the indications and effectiveness of nutritional support: starting with screening, which takes into account clinical data, using scales and indices including blood markers, anthropometry, instrumental techniques, functional tests, which allows you to understand the degree of risk, the type of nutritional disorders and its reversibility, predict the response to nutritional support, possible complications and consequences of surgery. In the perioperative period, timely detection of latent protein and energy deficiency, proper provision of basic nutrition and fluid requirements, is especially important to prevent complications associated with nutritional deficiencies. The algorithm of applying the techniques in assessing the effectiveness of nutritional support at different stages of the perioperative period is not an easy task, and it should be noted that the tactics of nutritional support in the perioperative period among the international medical communities does not have a single approach. The article discusses in detail the screenings that identify the nutritional risks of complications and choose the tactics of monitoring or treating the patient; scales that determine the severity of nutritional deficiencies; indexes and scales that include additional blood markers and assess the severity of nutritional deficiencies. The possibility of introducing new markers of nutritional deficiency, such as prealbumin, irisin, transferrin, retinol-binding protein, which have no routine use, except for generally accepted standard indicators, will contribute to the correct assessment of the severity and effectiveness of therapy in surgical patients. Thus, it is necessary to take into account and use the most sensitive markers in various clinical situations, this will optimize the approach to patient treatment and achieve decent results.
Keywords: nutritional status, sarcopenia, Nutritional Risk Screening NRS-2002, Nutritional Risk Index to Buzby, Malnutrition Universal Screening Tool, Naples Prognostic Score, markers of nutritional deficiency, retinol binding protein, рerioperative nutritional support.
For citation: Kuzmina T.N., Rubanova D.V., Smirnova O.A., Sergeeva A.V., Timoshchenko A.V., Vinnitskaya E.V. Markers of the effectiveness of nutritional support in surgical patients (literature review). Clinical review for general practice. 2025; 6 (7): 81–86 (In Russ.). DOI: 10.47407/kr2025.6.7.00648
Нутриционный статус является интегральным показателем, отражающим как физиологические, так и патологические процессы в организме человека, которые в определенной степени способны компенсироваться за счет различных депо, интенсификации белкового обмена в печени, гормональной регуляции.
В зависимости от причин воздействия на нутриционный статус и его фенотипических проявлений («простое» голодание, саркопения, кахексия, раковая кахексия) будет формироваться необратимость или возможность обратимости данных состояний.
Хирургическая стресс-реакция, как правило, запускает катаболизм в обменных процессах, поэтому нутриционная поддержка (НП) должна являться неотъемлемой составляющей в лечении пациентов хирургического профиля, особенно с проявлениями признаков печеночной дисфункции.
В периоперационном периоде особенно важно своевременное выявление скрытого белково-энергетического дефицита, правильное обеспечение потребностей в основных компонентах питания и жидкости для предотвращения осложнений, связанных с нутриционной недостаточностью. Распространенность рисков нутриционной недостаточности колеблется, в зависимости от метода их определения, в пределах 48–52% [1–3]. Пациент может по-разному реагировать на НП из-за неоднородной доступности и усвоения питательных веществ. Также наличие сопутствующей патологии, генетические и эпигенетические факторы, дисфункция печени и почек, восприимчивость к заболеваниям и их прогрессирование являются препятствием для осуществления контроля эффективности НП.
Алгоритм применения различных методик при проведении оценки эффективности НП на разных этапах периоперационного периода является непростой задачей, что мы и хотели обсудить в данной статье.
Необходимо отметить, что тактика НП в периоперационном периоде не имеет единого подхода среди международных медицинских сообществ.
Российское общество клинических онкологов (Russian Society of Clinical Oncology, RUSSCO) рекомендует использовать скрининг нутриционного риска (Nutritional Risk Screening, NRS-2002), введенный в Единую медицинскую информационно-аналитическую систему города Москвы (ЕМИАС) в виде «статуса питания», для назначения НП при высоком риске в течение 10–14 дней, с использованием иммунопитания в послеоперационном периоде при поражении верхних отделов желудочно-кишечного тракта (ЖКТ) [4].
Европейская ассоциация парентерального и энтерального питания (European Society for Clinical Nutrition and Metabolism, ESPEN) нацеливает на проведение превентивной НП независимо от исходного нутриционного статуса [5, 6].
Американское общество парентерального и энтерального питания (American Society for Parenteral and Enteral Nutrition, ASPEN) считает целесообразным назначать иммунопитание пациентам с недостаточностью питания при онкопатологии ЖКТ, головы и шеи за 5–7 дней до операции [7], а отдельным категориям – продлевать курс нутриционной коррекции до 7–14 дней [8].
Американское общество клинической онкологии (American Society of Clinical Oncology, ASCO 2020) использует критерии нутриционной недостаточности GLIM (Global Leadership Initiative on Malnutrition), которые не предусматривают использования каких-либо биохимических или других лабораторных маркеров при оценке степени нутриционной недостаточности для назначения НП [9].
Повсеместное использование скринингов нутриционной недостаточности помогает выявить риски ее развития и определить показания к началу НП.
А. Скрининги, позволяющие выявить нутриционные риски развития осложнений и выбрать тактику наблюдения/лечения пациента:
1. Европейское сообщество по медицинской онкологии (The European Society for Medical Oncology, ESMO) в 2008 г. предложило скрининг для пациентов, который учитывает величину снижения массы тела и наличие аппетита для определения показаний к НП [10].
2. Универсальный скрининг недостаточности питания (мальнутриции) (Malnutrition Universal Screening Tool, MUST) включает параметры роста, массы тела, индекса массы тела (ИМТ), непреднамеренное снижение массы тела, наличие острого заболевания и/или вероятность отсутствия приема пищи более 5 дней, с последующим определением рисков развития нутриционной недостаточности и дальнейшей тактики ведения пациента [11].
3. Ноттингемский скрининг-опросник для определения нутриционной коррекции (2006) включает аналогичные данные, но в нем детально оценивается тяжесть заболевания [12].
4. Скрининг нутриционного риска (Nutritional Risk Screening 2002, NRS-2002) также учитывает эти же параметры, но более детально производится учет потери массы тела, объема потребляемой пищи. Основное заболевание градируется в зависимости от тяжести, учитывается возраст пациента старше 70 лет [13].
5. Мини-оценка питания (Mini Nutritional Assessment, MNA) – наиболее распространенный скрининговый и диагностический инструмент, определяющий состояние, которое способствует развитию недостаточности питания, иммобилизацию и депрессию [14].
Б. Шкалы, определяющие тяжесть нутриционной недостаточности:
1. Субъективная общая оценка (Subjective Global Assessment) отражает степени тяжести нутриционной недостаточности после анализа ряда показателей (процент потери массы тела, объем употребляемого пищевого рациона от необходимого, наличие диспепсии, функциональная активность, стадия течения основного заболевания, состояния подкожного жира и мышечной массы, наличие отечно-асцитического синдрома) [15].
2. Шкала, предложенная Глобальной инициативной группой по борьбе с недоеданием (Global Leadership Initiative on Malnutrition, GLIM), анализирует фенотипические и этиологические факторы, приведшие к нарушению питания, снижение мышечной массы, подтвержденное инструментальными данными, по итогу диагностирует степень нутриционной недостаточности (1-й степени – умеренная, 2-й степени – тяжелая) [16].
В. Индексы и шкалы, включающие дополнительные маркеры крови и позволяющие оценить тяжесть нутриционной недостаточности:
1. Шкала контроля нутриционного статуса (Controlling Nutritional Status score, CONUT): сывороточный альбумин, абсолютное число лимфоцитов, общий холестерин. По совокупности баллов выставляется степень тяжести нутриционной недостаточности (легкая степень нарушений, средняя степень нарушений, тяжелая степень нарушений) [17, 18].
2. Индекс нутриционного риска (Nutritional Risk Index, NRI) to Buzby (1988) и Гериатрический индекс нутриционного риска (Geriatric Nutritional Risk Index, GNRI) различаются величиной коэффициента и отражают тяжесть нарушения питания по совокупности уровня сывороточного альбумина, отношения актуальной массы тела к обычной массе тела (стабильной величине за последние 6 мес):
NRI = [1,519 × альбумин (г/л)] + [41,7 × (масса тела / идеальная масса тела)],GNRI = [1,489 × альбумин (г/л)] + [41,7 × (масса тела / идеальная масса тела)].
 Интерпретация результатов: >100 – нет нарушений питания (no malnutrition); 97,5–100 – легкое нарушение питания (mild malnutrition); 83,5–97,5 – умеренное нарушение питания (moderate malnutrition); <83,5 – тяжелое нарушение питания (severe malnutrition) [19]. Низкие показатели NRI и GNRI указывают на серьезное недоедание.
Интерпретация результатов: >100 – нет нарушений питания (no malnutrition); 97,5–100 – легкое нарушение питания (mild malnutrition); 83,5–97,5 – умеренное нарушение питания (moderate malnutrition); <83,5 – тяжелое нарушение питания (severe malnutrition) [19]. Низкие показатели NRI и GNRI указывают на серьезное недоедание.3. Неапольская прогностическая шкала (Naples Prognostic Score, Based on Nutritional and Inflammatory Status – Naples Prognostic Score, NPS) включает следующие показатели: альбумин сыворотки крови, общий холестерин, соотношение нейтрофилов/лимфоцитов и лимфоцитов/моноцитов. По совокупности баллов выявляется степень корреляции с постоперационными осложнениями у больных колоректальным раком (см. рисунок) [20].
4. Прогностический индекс гипотрофии (ПИГ) (Хорошилов И.Е., 1998):
ПИГ (%) = 140 – 1,5 [альбумин сыворотки крови (г/л)] – 1 [окружность средней трети плеча (см)] – 0,5 [КЖСТ (мм)] – 20 (абс. число лимфоцитов крови 109/л).
Значения ПИГ: 0–20% – эйтрофия; 20–30% – гипотрофия легкой степени; 30–50% – среднетяжелая степень гипотрофии; >50% – тяжелая степень гипотрофии [21].
5. Шкала соотношений гемоглобина, альбумина, лимфоцитов, тромбоцитов (Hemoglobin, Albumin, Lymphocyte, Platelets score, HALP) является прогностическим индексом выживаемости у пациентов онкологического профиля [22].
Общепринятым традиционным маркером белкового дефицита является альбумин. Применение данного маркера у пациентов с высоким риском неблагоприятного клинического исхода при неудовлетворительном эффекте НП выполняет прогностическую функцию, при положительном эффекте НП – имеет предиктивное значение, способное обеспечить дифференцированный подход к тактике лечения [23]. Однако при проведении заместительной альбуминотерапии невозможно полностью полагаться на него, так как значение будет соответствовать референсным показателям, снижая показатели рисков.
Большинство скринингов и шкал учитывают клинические признаки нутриционной недостаточности, уровень сывороточного альбумина, холестерина, отдельных клеточных элементов крови, которые при нарушении гидробаланса и печеночной дисфункции могут быть искажены и неверно интерпретированы. Поэтому полностью полагаться на результаты скрининга в определенной степени затруднительно.
Возможность внедрения новых маркеров нутриционной недостаточности, не имеющих рутинного применения, кроме общепринятых стандартных показателей, будет способствовать корректной оценке степени тяжести и эффективности терапии у пациентов хирургического профиля.
Преальбумин – более чувствительный маркер, но период его синтеза составляет 48 ч, а изменения водной нагрузки, которые могут происходить достаточно активно в ближайшем периоперационном периоде, будут влиять на трактовку полученного результата [24].
Период полужизни свободного ретинол-связывающего белка (retinol binding protein) составляет менее 3 ч, а ретинол-связывающего белка в связанном с транстиретином виде – около 12 ч, что позволяет использовать его как маркер, отражающий состояние питания пациента в течение последних 2 дней [25, 26].
Трансферрин имеет период жизни 8 дней, что может быть оптимальным для контроля проведения НП. Однако его уровень может изменяться из-за заболевания печени, продвинутой стадии хронической болезни почек [27], изменения уровня железа [28], сердечно-сосудистых операций [29].
Применение оценки комплекса маркеров (например, гемоглобин, иммуноглобулины G, M, A, лейкоциты, С-реактивный белок, интерлейкин-6) способно отразить эффективность ранней НП у больных раком желудка [30].
Одним из новых показателей состояния питания является ширина распределения эритроцитов (red blood cell distribution width, RDW) – маркер реакции на диетотерапию [31].
В 2022 г. произошла смена парадигмы периоперационного питания, связанного с весомым влиянием саркопении на прогноз у онкологических больных, хирургические осложнения и активность воспаления как причины анаболической резистентности [32].
Так, у пациентов с саркопенией после резекционных вмешательств на печени достоверно чаще отмечались длительное пребывание в стационаре, повторная госпитализация, осложнения [33].
Использование быстрого опросника саркопении (Sarcopenia Fast, SARC-F) и опросника оценки качества жизни при саркопении (Sarcopenia Quality of Life questionnaire, SarQoL) будет нацеливать на более точную диагностику и дополнительное проведение контроля маркеров крови.
В связи с этим перспективным биомаркером состояния питания и наличия саркопении у пациентов с раком ЖКТ является оценка уровня карнитина в сыворотке [34].
Высокий уровень нейтрофилов и лимфоцитов (NLR) – независимый показатель потери мышечной массы [35].
Изучение D3-креатина – D3-креатинина мочи методом масс-спектрометрии изотопного соотношения или жидкостной хроматографии / тандемной масс-спектрометрии позволяет оценить влияние НП на саркопению [36], однако данная методика требует высокотехнологичного оборудования.
Иризин (миокин) – маркер работы мышечной ткани, позволяющий оценить влияние НП [37].
Антропометрические показатели у пациентов хирургического профиля в большинстве случаев под влиянием НП изменяются. Важно изучить состав тела, особенно состояние мышечной массы, до и после НП.
Подсчет площади отдельных мышц (поясничная мышца в зонах LIII, ТXII) при проведении компьютерной томографии происходит автоматически, с помощью специальной программы, что целесообразно выносить в заключение в виде подтверждения или исключения дефицита мышечной ткани.
При данном методе исследования саркопению определяют как уменьшение скелетно-мышечного индекса (skeletal muscle index, SMI) <53,00 см2/м2 для мужчин с ИМТ ≥25 кг/м2, <43,00 см2/м2 для мужчин с ИМТ <25 кг/м2 и <41,00 см2/м2 для женщин [38].
Повторное контрольное исследование после проведения НП сопряжено с повышением лучевой нагрузки и в большинстве случаев нецелесообразно.
Инструментальная методика, оценивающая композиционный состав тела с помощью биоимпедансного анализа, определяет фазовый угол (ФУ), по уровню значения которого можно диагностировать саркопению: ФУ 4,05° у мужчин (чувствительность – 82%, специфичность – 52,2%); ФУ 3,55° у женщин (чувствительность – 71,4%, специфичность – 65,8%). Для пожилых пациентов рекомендовано значение ≤4,55° (чувствительность – 70%, специфичность – 65,9%) [39].
Определение индекса массы скелетных мышц (ИМСМ) рассчитывается по формуле:
ИМСМ = безжировая масса × 0,566,соответственно показателями саркопении являются значения <7,0 кг/м2 для мужчин и <5,7 кг/м2 для женщин [38].
Использование для контроля эффективности НП биоимпедансного анализа состава тела рационально, так как не связано с лучевой нагрузкой и просто в исполнении.
В отношении контроля динамики мышечной силы применение функциональных тестов с целью диагностики саркопении (снижение мышечной силы), оцениваемой при помощи кистевого динамометра, может иметь ряд ограничений, таких как артрозы, артриты мелких суставов кистей, лучезапястных суставов, последствия травмы верхних конечностей, влияющие на трактовку результатов данной функциональной пробы, что исключает ее рутинное применение.
При отсутствии указанных ситуаций в качестве отражения снижения мышечной силы как ключевого критерия саркопении следует рассматривать показатели кистевой динамометрии: для мужчин – снижение мышечной силы менее 26 кг, для женщин – менее 16 кг [40].
В отдельных случаях целесообразно использовать тест с оценкой скорости ходьбы по прямой дорожке; снижение физической работоспособности можно зафиксировать при уменьшении скорости ходьбы менее 0,8 м/с (норма – 10 м/с) [38], но это вступает в противоречие с новым алгоритмом диагностики саркопении FACS: «Найти (Find) – Оценить (Assess) – Подтвердить (Confirm) – Тяжесть (Severity)», согласно которому в первую очередь оценивается мышечная сила, далее оценивают массу скелетных мышц и, если наблюдается ее уменьшение, подтверждают саркопению (Европейская рабочая группа по саркопении пожилых – European Working Group on Sarcopenia for Older People, EWGSOP2).
Таким образом, пересмотренный алгоритм подчеркивает достаточность наличия снижения мышечной силы и массы для установления диагноза саркопении, тогда как предыдущий алгоритм требовал для постановки диагноза определения всех показателей.
На наш взгляд, оценка нутриционного статуса должна проводиться комплексно для определения показаний и эффективности НП: начиная со скрининга, который учитывает клинические данные, с использованием шкал и индексов, включающих маркеры крови, антропометрию, заканчивая инструментальными методиками, функциональными пробами, что позволяет понять степень риска, вид нарушений питания и его обратимость, прогнозировать ответ на НП, возможные осложнения и последствия операции.
Следует учитывать факторы, влияющие на интерпретацию полученных результатов, и использовать наиболее чувствительные маркеры при различных клинических ситуациях, это позволит оптимизировать подход в лечении пациента, добиться достойных результатов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Кузьмина Татьяна Николаевна – д-р мед. наук, зав. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова».
E-mail: KuzminaTN1@zdrav.mos.ru; ORCID: 0000-0003-2800-6503; eLIBRARY.RU SPIN: 3276-7602
Tatiana N. Kuzmina – Dr. Sci. (Med.), Loginov Moscow Clinical Scientific and Practical Center. E-mail: KuzminaTN1@zdrav.mos.ru; ORCID: 0000-0003-2800-6503; eLIBRARY.RU SPIN: 3276-7602
Рубанова Дарья Владимировна – врач анестезиолог-реаниматолог, мл. науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ
им. А.С. Логинова». E-mail: feria2008@mail.ru; ORCID: 0009-0003-2219-8919
Darya V. Rubanova – anesthesiologist-resuscitator, Res. Assist., Loginov Moscow Clinical Scientific and Practical Center. E-mail:
feria2008@mail.ru; ORCID: 0009-0003-2219-8919
Смирнова Ольга Андреевна – канд. мед. наук, науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова». E-mail: dr.smirnovaoa@gmail.com; ORCID: 0000-0002-0088-4075;
eLIBRARY.RU SPIN: 3354-3232
Olga A. Smirnova – Cand. Sci. (Med.), Res. Officer, Loginov Moscow Clinical Scientific and Practical Center. E-mail: dr.smirnovaoa@gmail.com; ORCID: 0000-0002-0088-4075;
eLIBRARY.RU SPIN: 3354-3232
Сергеева Алёна Викторовна – мл. науч. сотр. лаб. нутрицевтики ГБУЗ «МКНЦ им. А.С. Логинова». E-mail: SergeevaAV13@zdrav.mos.ru; ORCID: 0009-0005-1761-5372;
eLIBRARY.RU SPIN: 8899-2406
Alyona V. Sergeeva – Res. Assist., Loginov Moscow Clinical Scientific and Practical Center. E-mail: SergeevaAV13@zdrav.mos.ru;
ORCID: 0009-0005-1761-5372; eLIBRARY.RU SPIN: 8899-2406
Тимощенко Анастасия Викторовна – врач-гастроэнтеролог, аспирант отд-ния заболеваний печени ГБУЗ «МКНЦ им.
А.С. Логинова»
Anastasia V. Timoshchenko – gastroenterologist, Graduate Student, Loginov Moscow Clinical Scientific and Practical Center
Винницкая Елена Владимировна – д-р мед. наук, зав. отд. гепатологии ГБУЗ «МКНЦ им. А.С. Логинова». ORCID: 0000-0002-0344-8375; eLIBRARY.RU SPIN: 6796-7670
Elena V. Vinnitskaya – Dr. Sci. (Med.), Loginov Moscow Clinical Scientific and Practical Center. ORCID: 0000-0002-0344-8375;
eLIBRARY.RU SPIN: 6796-7670
Поступила в редакцию: 17.06.2025
Поступила после рецензирования: 27.06.2025
Принята к публикации: 03.07.2025
Received: 17.06.2025
Revised: 27.06.2025
Accepted: 03.07.2025
Список исп. литературыСкрыть список1. Bozzetti F, Mariani L, Lo Vullo S, et al. The nutritional risk in oncology:
A study of 1453 cancer outpatients. Support. Care Cancer. 2012;20:
1919-28.
2. Marshall KM, Loeliger J, Nolte L, et al. Prevalence of malnutrition and impact on clinical outcomes in cancer services: A comparison of two time points. Clin Nutr. 2019 Apr;38(2):644-51. DOI: 10.1016/j.clnu. 2018.04.007
3. Hébuterne X, Lemarié E, Michallet M, et al. Prevalence of Malnutrition and Current Use of Nutrition Support in Patients with Cancer. J Parenter Enter Nutr. 2014;38:196-204.
4. Злокачественные опухоли [спецвыпуск журнала]: Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Под ред. В.М. Моисеенко. М.: Общероссийская общественная организация «Российское общество клинической онкологии», 2022. 288 с. URL:
https://www.malignanttumors.org/jour/issue/view/62
Malignant Tumors [special issue of the journal]: Practical recommendations of the Russian Society of Clinical Oncology. Drug treatment of malignant tumors. Ed. V.M. Moiseenko. Moscow: All-Russian public organization “Russian Society of Clinical Oncology”, 2022. 288 p.
URL: https://www.malignanttumors.org/jour/issue/view/62 (in Russian).
5. Arends J, Bachmann P, Baracos V, et al. ESPEN Guidelines on Nutrition in Cancer Patients. Clin Nutr. 2017;36:11-48.
6. Braga M. Perioperative immunonutrition and gut function. Curr Opin Clin Nutr Metab Care. 2012 Sep;15(5):485-8. DOI: 10.1097/MCO. 0b013e3283567d8f
7. Moore FA. Effects of immune-enhancing diets on infectious morbidity and multiple organ failure. JPEN J Parenter Enteral Nutr. 2001 Mar-Apr;25(2 Suppl):S36-42; discussion S42-3. DOI: 10.1177/ 014860710102500209
8. August DA, Huhmann MB; American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. clinical guidelines: nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation. JPEN J Parenter Enteral Nutr. 2009 Sep-Oct;33(5):472-500. DOI: 10.1177/0148607109341804
9. Barazzoni R, Jensen GL, Correia MITD, et al. Guidance for assessment of the muscle mass phenotypic criterion for the Global Leadership Initiative on Malnutrition (GLIM) diagnosis of malnutrition. Clin Nutr. 2022 Jun;41(6):1425-33. DOI: 10.1016/j.clnu.2022.02.001. Epub 2022 Apr 19.
10. Лейдерман И.Н., Грицан А.И., Заболотских И.Б. и др. Периоперационная нутритивная поддержка. Методические рекомендации Федерации анестезиологов и реаниматологов. Вестник интенсивной терапии им. А.И. Салтанова. 2021;(4):7-20. DOI: 10.21320/1818-474X-2021-4-7-20
Leiderman I.N., Gritsan A.I., Zabolotskikh I.B., et al. Perioperative nutritional support. Clinical practice recommendations of the national “Federation of Anesthesiologists and Reanimatologists”. Annals of Critical Care. 2022;(4):7-20. DOI: 10.21320/1818-474X-2021-4-7-20 (in Russian).
11. Cortes R, Yañez AM, Capitán-Moyano L, et al. Evaluation of different screening tools for detection of malnutrition in hospitalised patients.
J Clin Nurs. 2024 Dec;33(12):4759-71. DOI: 10.1111/jocn.17170. Epub 2024 Apr 17.
12. Cortés-Aguilar R, Malih N, Abbate M, et al. Validity of nutrition screening tools for risk of malnutrition among hospitalized adult patients: A systematic review and meta-analysis. Clin Nutr. 2024 May;43(5):1094-116. DOI: 10.1016/j.clnu.2024.03.008. Epub 2024 Mar 15.
13. Sahli L, Hagenbuch N, Ballmer PE, et al. NRS-2002 components, nutritional score and severity of disease score, and their association with hospital length of stay and mortality. Swiss Med Wkly. 2021 Jul 14;151:w20517. DOI: 10.4414/smw.2021.20517
14. Torbahn G, Strauss T, Sieber CC, et al. Nutritional status according to the mini nutritional assessment (MNA) as potential prognostic factor for health and treatment outcomes in patients with cancer – a systematic review. BMC Cancer. 2020 Jun 26;20(1):594. DOI: 10.1186/s12885-020-07052-4
15. Susetyowati S, Sholikhati AS, Cahyaningrum DK, et al. Comparison of Tools for Nutritional Assessment and Screening of Hospitalized Patients: A study on Surgical Patients. Medeni Med J. 2023 Mar 28;38(1):70-7. DOI: 10.4274/MMJ.galenos.2023.64554
16. Rothenberg E, Tsagari A, Erickson N, et al. Global Leadership Initiative on Malnutrition (GLIM) for the diagnosis of malnutrition - a framework for consistent dietetic practice. Clin Nutr ESPEN. 2024 Apr;60:261-5. DOI: 10.1016/j.clnesp.2024.02.009. Epub 2024 Feb 17.
17. Ma X, Zou W, Sun Y. Prognostic Value of Pretreatment Controlling Nutritional Status Score for Patients With Pancreatic Cancer: A Meta-Analysis. Front Oncol. 2022 Jan 20;11:770894. DOI: 10.3389/fonc.2021.770894
18. Бастриков О.Ю., Харламова У.В., Захарова А.И. и др. Оценка нутритивного статуса у пациентов с симптомами сердечной недостаточности. Acta Biomedica Scientifica. 2020;5(4):14-20. DOI: 10.29413/ABS.2020-5.4.2
Bastrikov O.Yu., Kharlamova U.V., Zakharova A.I., et al. Assessment of Nutritive Status in Patients with Symptoms of Heart Failure. Acta Biomedica Scientifica. 2020;5(4):14-20. DOI: 10.29413/ABS.2020-5.4.2 (in Russian).
19. Poulia KA, Yannakoulia M, Karageorgou D, et al. Evaluation of the efficacy of six nutritional screening tools to predict malnutrition in the elderly. Clin Nutr. 2012 Jun;31(3):378-85. DOI: 10.1016/j.clnu.2011.11. 017. Epub 2011 Dec 17.
20. Galizia G, Lieto E, Auricchio A, et al. Naples Prognostic Score, Based on Nutritional and Inflammatory Status, is an Independent Predictor of Long-term Outcome in Patients Undergoing Surgery for Colorectal Cancer. Dis Colon Rectum. 2017 Dec;60(12):1273-84. DOI: 10.1097/DCR.0000000000000961
21. Ветчинникова О.Н., Пичугина И.С. Белково-энергетическая недостаточность у больных на перитонеальном диализе: факторы риска развития и диагностика. Клиническая нефрология. 2015;(1):55-63.
Vetchinnikova O.N., Pichugina I.S. Protein-energy malnutrition in peritoneal dialysis patients: risk factors and diagnosis. Clinical Nephrology. 2015;(1):55-63 (in Russian).
22. Feng JF, Wang L, Yang X. The preoperative hemoglobin, albumin, lymphocyte and platelet (HALP) score is a useful predictor in patients with resectable esophageal squamous cell carcinoma. Bosn J Basic Med Sci. 2021 Dec 1;21(6):773-81. DOI: 10.17305/bjbms.2021.5666
23. Stoppe C, Wendt S, Mehta NM, et al. Crit Care. 2020 Aug 12;24(1):499. DOI: 10.1186/s13054-020-03208-7
24. Pardo E, Jabaudon M, Godet T, et al. Dynamic assessment of prealbumin for nutrition support effectiveness in critically ill patients. Clin
Nutr. 2024 Jun;43(6):1343-52. DOI: 10.1016/j.clnu.2024.04.015. Epub 2024 Apr 15.
25. Pisprasert V, Shantavasinkul PC, Rattanachaiwong S, et al. Moderately high-protein enteral formula improved retinol-binding protein in tube-fed patients: A multicentre open study. Nutr Health. 2017 Sep;23(3):203-9. DOI: 10.1177/0260106017729959
26. Linden MA, Freitas RGBON, Teles LOS, et al. Transthyretin and Nutritional Status in Critically Ill Adults on Parenteral Nutrition: A Prospective Cohort Study. Nutrients. 2024 Jul 27;16(15):2448. DOI: 10.3390/nu16152448
27. Bañuls C, de Marañon AM, Veses S, et al. Malnutrition impairs mitochondrial function and leukocyte activation. Nutr J. 2019;18(1):1-9. DOI: 10.1186/s12937-019-0514-7
28. Addo OY, Yu EX, Williams AM, et al. Evaluation of Hemoglobin Cutoff Levels to Define Anemia Among Healthy Individuals. JAMA Netw Open. 2021;4(8):е2119123. DOI: 10.1001/jamanetworkopen.2021.19123
29. Yasuda M, Tachi T, Fukuta M. Nutritional factors affecting length of hospital stay in patients undergoing cardiovascular surgery. Pharmazia. 2019;74(12):760-2. DOI: 10.1691/ph.2019.9650
30. Wang Z, Peng W, Zhang J, et al. Effect of Early Enteral Nutrition under the ERAS Model on Gastrointestinal and Immune Function Recovery in Patients Undergoing Gastric Tumor Surgery. Ann Ital Chir. 2024;95(6):1147-54. DOI: 10.62713/aic.3738
31. Haenggi E, Kaegi-Braun N, Wunderle C, et al. Red blood cell distribution width (RDW) – A new nutritional biomarker to assess nutritional risk and response to nutritional therapy? Clin Nutr. 2024 Feb;43(2):575-85. DOI: 10.1016/j.clnu.2024.01.001
32. Bozzetti F. Evolving concepts on perioperative nutrition of sarcopenic cancer patients. Eur J Surg Oncol. 2024 May;50(5):106748. DOI: 10.1016/j.ejso.2022.10.008
33. Berardi G, Antonelli G, Colasanti M, et al. Association of Sarcopenia and Body Composition With Short-term Outcomes After Liver Resection for Malignant Tumors. JAMA Surg. 2020 Nov;155(11):e203336.
34. Takagi A, Hawke P, Tokuda S, et al. Serum carnitine as a biomarker of sarcopenia and nutritional status in preoperative gastrointestinal cancer patients. J Cachexia Sarcopenia Muscle. 2022 Feb;13(1):287-95. DOI: 10.1002/jcsm.12906
35. Shen XD, Wang X, Zheng ZJ, et al. The differential effects of sarcopenia and cachexia on overall survival for pancreatic ductal adenocarcinoma patients following pancreatectomy: a retrospective study based on a large population. Cancer Med. 2023;12:10438-48. DOI: 10.1002/cam4.5779
36. Tosato M, Marzetti E, Cesari M, et al. Measurement of muscle mass in sarcopenia: from imaging to biochemical markers. Aging Clin Exp Res. 2017 Feb;29(1):19-27. DOI: 10.1007/s40520-016-0717-0
37. Planella-Farrugia C, Comas F, Sabater-Masdeu M, et al. Circulating Irisin and Myostatin as Markers of Muscle Strength and Physical Condition in Elderly Subjects. Front Physiol. 2019 Jul 10;10:871. DOI: 10.3389/fphys.2019.00871
38. Cho MR, Lee S, Song SK. A Review of Sarcopenia Pathophysiology, Diagnosis, Treatment and Future Direction. J Korean Med Sci. 2022 May 9;37(18):e146. DOI: 10.3346/jkms.2022.37.e146
39. Di Vincenzo O, Marra M, Di Gregorio A, et al. Bioelectrical impedance analysis (BIA) -derived phase angle in sarcopenia: A systematic review. Clin Nutr. 2021 May;40(5):3052-61. DOI: 10.1016/j.clnu.2020.10.048
40. Revoredo S, Del Fabbro E. Hepatocellular carcinoma and sarcopenia: a narrative review. Ann Palliat Med. 2023 Nov;12(6):1295-309.