Клинический разбор в общей медицине №7 2025
Magdalina G. Budagyan1
1 Patrice Lumumba Peoples’ Friendship University of Russia (RUDN University), Moscow, Russia;
2 Avtsyn Research Institute of Human Morphology, Petrovsky National Research Centre of Surgery, Moscow, Russia
omekan@mail.ru
Abstract
Objective. To expand understanding of the pathogenesis of vaginal atrophy.
Materials and methods. The prospective study included 51 postmenopausal women with a diagnosis of N95.2 Postmenopausal atrophic vaginitis and 30 postmenopausal women with unverified atrophic vaginitis. The inclusion criteria for the study were: postmenopausal women with a verified and unverified diagnosis of N95.2, informed consent of the patient for the study. In accordance with the stated goal, the women were divided into 2 groups: 1) postmenopausal women with atrophic vaginitis (n=51); 2) postmenopausal women without atrophic vaginitis (control group n=30). The following parameters were assessed: age, duration of menopause, severity of atrophic vaginitis, as well as changes in the connective tissue and muscular compartments of the vagina using the assessment of vaginal wall remodeling markers (vimentin, desmin) by immunohistochemical analysis.
Results. The results of the study demonstrate that in atrophic vaginitis, significant changes are observed in the connective tissue and muscle compartment of the epithelial layer of the vaginal wall. This is evidenced by the defective expression of vaginal wall remodeling markers, such as vimentin, desmin, in the compared groups. A significantly low expression of all indicators is observed compared to the control group: vimentin by 1.68; desmin by 2.28 times.
Conclusion. In atrophic vaginitis, significant changes in vaginal wall remodeling markers are observed. In the study, a decrease in the levels of vimentin, desmin is observed compared to the control group.
Keywords: vulvovaginal atrophy, genitourinary syndrome of menopause, pathogenesis of vaginal atrophy.
For citation: Orazov M.O., Radzinsky V.E., Mikhaleva L.M., Khamoshina M.B., Budagyan M.G. Pathogenetic factors of vaginal atrophy. Clinical review for general practice. 2025; 6 (7): 102–107 (In Russ.). DOI: 10.47407/kr2025.6.7.00651
По данным Организации Объединенных Наций (2022), в 2021 г. среди женского населения планеты доля лиц старше 50 лет составила 26%, что на 22% превышало показатель десятилетней давности [1].
В 2023 г. средняя продолжительность жизни женщин в России составила 77,8 года, а численность россиянок пери- и постменопаузального возраста уже превышает 21 млн [2]. Учитывая средний возраст менопаузы, получается, что более трети своей жизни женщина проводит в климактерии.
Поэтому на сегодняшний день одной из приоритетных задач медицины является сохранение здоровья женщин всех возрастов, улучшение качества жизни и увеличение периода активного долголетия.
По мере угасания функции яичников развивается состояние тотального эстрогендефицита, к которому особенно чувствителен урогенитальный тракт. Симптомокомплекс, ассоциированный со снижением уровня эстрогенов и других половых стероидов, включающий изменения наружных половых органов, промежности, влагалища, уретры и мочевого пузыря, носит название генитоуринарного менопаузального синдрома (ГУМС) [3]. Термин предложен в 2012 г. Североамериканским сообществом по менопаузе (North American Menopause Society, NAMS) и Международным обществом по изучению женского сексуального здоровья (International Society for the Study of Women’s Sexual Health, ISS-WSH) и официально утвержден в 2014 г. Общая распространенность ГУМС у женщин в пери- и постменопаузе варьирует от 13 до 87% [4].
Вульвовагинальная атрофия (ВВА) служит наиболее характерным проявлением ГУМС и имеет свой код по Международной классификации болезней 10-го пересмотра (МКБ-10) – N95.2, поэтому отечественные клиницисты чаще используют в своей практике именно этот термин.
Так, по наблюдениям, распространенность ВВА у женщин в перименопаузе достигает 48%, а у женщин в постменопаузе – 53,8–90% [5]. Наиболее частые проявления ВВА – сухость во влагалище (27–55%), раздражение/жжение/зуд (18%), диспареуния (33–41%) [6, 7].
Учитывая деликатность темы, многие женщины стесняются обсуждать интимные жалобы с врачами, поскольку считают это естественным процессом старения. С другой стороны, сами специалисты в области женского здоровья недостаточно активно выявляют симптомы ВВА при осмотре. Так, по данным группы исследователей, симптомы ВВА/ГУМС обсуждали с врачом только 56% опрошенных, но лишь 40% из них использовали местное лечение (в основном безрецептурные препараты) [8, 9]. По данным опроса Women's EMPOWER, 62% врачей выявляют симптомы ВВА/ГУМС у женщин
в постменопаузе, но сами женщины инициировали беседу лишь в 7–10% случаев [10]. К сожалению, все эти факторы приводят к тому, что данная проблема до сих пор находится в «серой зоне» закрытых тем.
С учетом того что проблема с возрастом необратимо прогрессирует, в отличие от вазомоторных проявлений климактерия, перед врачами остро стоит вопрос тщательной диагностики и назначения своевременного и продолжительного лечения, поскольку симптомы ВВА обратимы [11, 12]. Помимо пациенток с физиологической менопаузой, особого внимания заслуживают женщины с преждевременной яичниковой недостаточностью; после радикальных гинекологических операций; проходящие курсы химио- и гормонотерапии. При этом помимо стремительного снижения уровня эстрогенов происходит резкое истощение приспособительных резервов и, соответственно, течение ВВА ускоренное и крайне выраженное [13, 14].
В патогенезе развития ВВА в первую очередь имеет значение дефицит эстрогенов. Эффекты эстрогенов в отношении тканей влагалища хорошо известны, среди них: синтез коллагена и эластина, гиалуроновой кислоты, вагинальный кровоток, лубрикация (за счет синтеза мукополисахаридов и гиалуроновой кислоты), созревание эпителиальных клеток, контроль уровня вагинального рН и т. д. [15]. Уже за год до наступления менопаузы наблюдается постепенное снижение уровня самого мощного эстрогена в крови – эстрадиола. В постменопаузе эстрогены образуются преимущественно за счет усиленной периферической ароматизации андрогенов, в частности андростендиона, и преобладающим эстрогеном становится менее активный – эстрон. Помимо снижения уровня эстрогенов с возрастом, другим патогенетически важным моментом является гормон-рецепторное воздействие. Величина насыщенности организма женщин эстрогенами контролируется ферментативными системами в клетках тканей-мишеней. Этим можно объяснить тот факт, что степень выраженности проявлений индивидуальна.
Поскольку эстрогеновые рецепторы обнаружены во всех слоях влагалища, понятно, что влагалище является органом-мишенью действия эстрогенов. Последние опосредуют свои эффекты через геномное и негеномное влияние на ядерные и мембранные рецепторы – ER-а и -b. ER-a обнаружены во влагалищном эпителии, стромальных и гладкомышечных клетках, в то время как ER-b – в эпителиальных клетках и гладкомышечных клетках сосудов влагалища [16]. Данные о том, как меняется их соотношение у женщин в пери- и постменопаузе, противоречивы. Согласно работе G.D. Chen и соавт., ER-b не обнаруживаются при исследовании биоптатов влагалища у женщин в постменопаузе, хотя еще в пременопаузе экспрессия мРНК ER-b выявлена [17].
Для того чтобы лучше понимать, чем обусловлены те или иные эстрогензависимые проявления ВВА, стоит вспомнить о гистологическом строении влагалища. Стенка влагалища состоит из трех оболочек: слизистой, мышечной и адвентициальной. В свою очередь слизистая оболочка представляет собой многослойный плоский эпителий, в котором выделяют базальный, парабазальный, промежуточный и поверхностные слои. Чем выше эстрогеновая насыщенность организма, тем выраженнее промежуточные и поверхностные слои, которые богаты гликогеном, и наоборот. Клинически дефицит эстрогенов в данном случае будет проявляться истончением слизистой оболочки, сухостью, травматизацией, сглаживанием слизистой оболочки влагалища и потерей складчатости. Лабораторно это подтверждается при кольпоцитологическом исследовании, где отражается соотношение парабазальных, промежуточных и поверхностных клеток – индекс созревания. При атрофическом типе мазка соотношение близко к 100/0/0, т. е. преобладают клетки глубоких слоев слизистой оболочки влагалища. С учетом исчезновения поверхностных клеток, богатых гликогеном, которые необходимы для поддержания нормоценоза, происходит исчезновение лактобактерий, сдвиг влагалищного pH в щелочную сторону, развивается дисбиоз. Согласно современным представлениям, защитную функцию исчезнувших из биотопа влагалища лактобактерий у женщин постменопаузального возраста берут на себя лимфоидные клетки, представляющие собой натуральные киллеры (CD56, CD20), клетки супрессорно-цитотоксического ряда (СD 8) и др.
Собственная пластинка слизистой оболочки представлена рыхлой волокнистой соединительной тканью с большим количеством эластических волокон [18]. За счет активации фибробластов под действием эстрогенов происходит синтез коллагена. Фибробласты играют важную роль в реэпителизации, синтезе коллагеновых волокон, ремоделировании ткани и высвобождении таких эндогенных факторов роста, как FGF, PDGF, TGF-β и VEGF [19].
На фоне снижения уровня эстрогенов активность фибробластов падает, снижается регенеративный потенциал внеклеточного матрикса, наблюдаются количественные и качественные изменения эластических волокон с преобладанием коллагена III типа (грубого) над коллагеном I типа (нежного) [20]. Немаловажную роль играет дезорганизация базальной мембраны, которая находится между соединительнотканными структурами и эпителиальным пластом. Основной причиной этого состояния является снижение содержания коллагена IV типа. Помимо этого на фоне уменьшения количества фибробластов происходит снижение уровня виментина, который является белком промежуточных филаментов, участвующим в поддержании цитоскелета.
Другими белками промежуточных филаментов являются десмин и α-SMA. Десмин входит в состав промежуточных филаментов цитоскелета клеток мышечных тканей. Их роль в контексте атрофического вагинита изучена пока недостаточно, однако в литературе описаны редкие случаи так называемого «вагинального стромального склероза» у женщин в постменопаузе с диспареунией и другими клиническими проявлениями атрофии. При иммуногистохимическом исследовании в стромальных клетках не выявлено экспрессии десмина, α-SMA, CD34 [21].
В последнее время наряду с доказанной ролью дефицита эстрогенов в развитии атрофических явлений изучается вклад андрогенов. Андрогеновые рецепторы обнаружены во всех слоях влагалища, однако плотность их распределения увеличивается по направлению к коже наружных половых губ, в отличие от эстрогеновых рецепторов, плотность которых больше в верхних отделах влагалища [22, 23]. И если ранее влагалище рассматривалось исключительно как пассивный орган, то в настоящее время активно изучается его роль как эндокринного органа. В 1988 г. F. Labrie предложен термин «интракринология» – раздел эндокринологии, в котором рассматриваются пути и механизмы образования андрогенов и эстрогенов из дегидроэпиандростерона (ДГЭА) внутри клеток периферических тканей [24]. Это значит, что эстрогены и андрогены, синтезируемые из ДГЭА, оказывают свой эффект внутриклеточно и не попадают в системный кровоток.
По данным DrugBank, основные эффекты ДГЭА оказывает, связываясь с ядерным рецептором β (ERβ). Вторыми по значимости выступают андрогеновые рецепторы, однако связывающее сродство для них в 2–3 раза ниже, чем для ERβ. В слизистой оболочке влагалища андрогеновые рецепторы обнаружены во всех слоях: эпителии, собственной пластинке и мышечном слое [25]. Есть исследования, в которых установлено, что с возрастом плотность андрогеновых рецепторов в слизистой оболочке влагалища уменьшается, а в стромальной ткани – не меняется. M. Baldassarre и соавт. установили отрицательную связь между возрастом пациенток и экспрессией андрогеновых рецепторов в слизистой оболочке влагалища, а также увеличением содержания последних в слизистой оболочке и строме влагалища при лечении тестостероном [26].
Цель исследования – расширить представления о патогенезе атрофического вагинита.
Пациенткам 1-й группы проводилось определение индекса вагинального здоровья по 5-балльной шкале G. Bachmann, в которой оцениваются следующие показатели: pH, увлажненность, эластичность, характеристика эпителия. Каждый параметр оценивается в баллах от 1 до 5, где 1 балл соответствует высшей степени атрофии, 2, 3, 4 – выраженной, умеренной, незначительной атрофии, а 5 баллов – нормальному состоянию. Суммарное значение 25 баллов соответствует нормальному состоянию эпителия влагалища, 20 баллов – незначительной атрофии, 15 баллов – умеренной атрофии, а менее 15 баллов – значительным атрофическим изменениям слизистой оболочки влагалища [27].
У женщин обеих групп проводился забор биоптатов задней стенки влагалища панчем диаметром 3 мм.
У женщин из контрольной группы биопсия влагалища проводилась во время реконструктивно-пластических операций на тазовом дне. У пациенток обеих групп взято информированное добровольное согласие. Далее проводилось иммуногистохимическое исследование биоптатов влагалища, взятых панчем диаметром 3 мм. Исследование проводилось с использованием антител к виментину и десмину. Гистологический подсчет осуществлялся по формуле:
HS= ∑ (Pi×i),где Pi – процент клеток, окрашенных для каждой интенсивности (от 0 до 100%), i – интенсивность окрашивания со значениями: 0 – отсутствие окрашивания, 1 – слабое окрашивание (светло-коричневое), 2 – умеренное окрашивание (коричневое) 3 – сильное окрашивание (темно-коричневое).
Полученные показатели сравнивали с результатами контрольной группы.
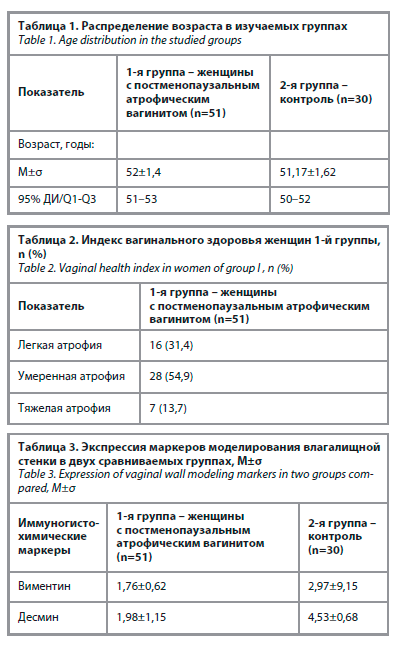 Средний возраст пациенток 1-й и 2-й групп составил 52±1,4 и 51,17±1,62 года соответственно (табл. 1).
Средний возраст пациенток 1-й и 2-й групп составил 52±1,4 и 51,17±1,62 года соответственно (табл. 1).
Для пациенток 1-й группы рассчитан индекс вагинального здоровья (табл. 2). У 31,4% была верифицирована легкая степень атрофии, у 54,9% – умеренная степень атрофии, у 13,7% – тяжелая степень атрофии.
При исследовании биоптатов влагалища методом иммуногистохимии (табл. 3) в 1-й группе у пациенток с
атрофическим вагинитом показатели были следующие: виментин – 1,76±0,62; десмин – 1,98±1,15. Во 2-й (контрольной) группе выявлены следующие показатели: виментин – 2,97±0,18; десмин – 4,53±0,68.
Как видно из табл. 3, у женщин с атрофическим вагинитом в постменопаузе наблюдалась существенно более низкая экспрессия всех показателей по сравнению с группой контроля: виментина – в 1,68 раза, десмина – в 2,28 раза.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Финансирование. Работа выполнена в рамках гранта № 030146-0-000 на базе подразделения: «Кафедра акушерства и гинекологии с курсом перинатологии, Медицинский институт РУДН».
Financing. This work was carried out within the framework of a grant № 030146-0-000, People’s Friendship University of Russia (RUDN University).
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-1767-5536
Mekan R. Orazov – Dr. Sci. (Med.), Full. Prof., Prof., Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-1767-5536
Радзинский Виктор Евсеевич – академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru; ORCID: 0000-0003-4956-0466
Viktor E. Radzinsky – Acad. RAS, Dr. Sci. (Med.), Full Prof., Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Михалева Людмила Михайловна – чл.-корр. РАН, д-р мед. наук, проф., директор НИИМЧ им. академика А.П. Авцына ФГБНУ «РНЦХ им. акад. Б.В. Петровского». ORCID: 0000-0003-2052-914X
Liudmila M. Mikhaleva – Dr. Sci. (Med.), Prof., Corr. Memb. RAS, Dir. of Avtsyn Research Institute of Human Morphology, Petrovsky National Research Centre of Surgery. ORCID: 0000-0003-2052-914X
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН.
E-mail: khamoshina@mail.ru; ORCID: 0000-00033-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Full. Prof., Prof., Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia (RUDN University). E-mail: khamoshina@mail.ru; ORCID: 0000-00033-1940-4534
Будагян Магдалина Грачиковна – аспирант каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. Е-mail: magdalina93@mail.ru
Magdalina G. Budagyan – Postgraduate Student, Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: magdalina93@mail.ru
Поступила в редакцию: 25.06.2025
Поступила после рецензирования: 14.07.2025
Принята к публикации: 17.07.2025
Received: 25.06.2025
Revised: 14.07.2025
Accepted: 17.07.2025
Клинический разбор в общей медицине №7 2025
Патогенетические детерминанты атрофического вагинита
Номера страниц в выпуске:97-102
Аннотация
Цель исследования. Расширить представления о патогенезе атрофического вагинита.
Материалы и методы. В проведенное проспективное исследование были включены 51 женщина в постменопаузе с диагнозом N95.2 Постменопаузальный атрофический вагинит и 30 женщин в постменопаузе с неверифицированным атрофическим вагинитом. Критерии включения в исследование: женщины в постменопаузе с верифицированным и неверифицированным диагнозом N95.2, наличие регулярной половой жизни не менее 1 раза в неделю, информированное согласие пациенток на исследование. В соответствии с поставленной целью женщины были разделены на две группы: 1) женщины в постменопаузе с атрофическим вагинитом (n=51); 2) женщины в постменопаузе без атрофического вагинита (контрольная группа; n=30). Оценивались следующие показатели: возраст, длительность менопаузы, тяжесть течения атрофического вагинита, а также изменения в соединительнотканном и мышечном компартментах влагалища с помощью оценки маркеров ремоделирования стенки влагалища (виментин, десмин) методом иммуногистохимического анализа.
Результаты. Результаты проведенного исследования демонстрируют, что при атрофическом вагините наблюдаются значимые изменения в соединительнотканном и мышечном компартменте эпителиального пласта стенки влагалища. Об этом свидетельствует дефектная экспрессия маркеров ремоделирования стенки влагалища, таких как виментин и десмин, в сравниваемых группах. Наблюдается достоверно низкая экспрессия всех показателей по сравнению с группой контроля: виментина – в 1,68, десмина – в 2,28 раза.
Заключение. При атрофическом вагините наблюдаются значимые изменения маркеров ремоделирования стенки влагалища. В проведенном исследовании наблюдается снижение уровней виментина и десмина в сравнении с контрольной группой.
Ключевые слова: генитоуринарный менопаузальный синдром, атрофический вагинит, патогенез атрофического вагинита.
Для цитирования: Оразов М.Р., Радзинский В.Е., Михалёва Л.М., Хамошина М.Б., Будагян М.Г. Патогенетические детерминанты
атрофического вагинита. Клинический разбор в общей медицине. 2025; 6 (7): 97–102. DOI: 10.47407/kr2025.6.7.00651
Цель исследования. Расширить представления о патогенезе атрофического вагинита.
Материалы и методы. В проведенное проспективное исследование были включены 51 женщина в постменопаузе с диагнозом N95.2 Постменопаузальный атрофический вагинит и 30 женщин в постменопаузе с неверифицированным атрофическим вагинитом. Критерии включения в исследование: женщины в постменопаузе с верифицированным и неверифицированным диагнозом N95.2, наличие регулярной половой жизни не менее 1 раза в неделю, информированное согласие пациенток на исследование. В соответствии с поставленной целью женщины были разделены на две группы: 1) женщины в постменопаузе с атрофическим вагинитом (n=51); 2) женщины в постменопаузе без атрофического вагинита (контрольная группа; n=30). Оценивались следующие показатели: возраст, длительность менопаузы, тяжесть течения атрофического вагинита, а также изменения в соединительнотканном и мышечном компартментах влагалища с помощью оценки маркеров ремоделирования стенки влагалища (виментин, десмин) методом иммуногистохимического анализа.
Результаты. Результаты проведенного исследования демонстрируют, что при атрофическом вагините наблюдаются значимые изменения в соединительнотканном и мышечном компартменте эпителиального пласта стенки влагалища. Об этом свидетельствует дефектная экспрессия маркеров ремоделирования стенки влагалища, таких как виментин и десмин, в сравниваемых группах. Наблюдается достоверно низкая экспрессия всех показателей по сравнению с группой контроля: виментина – в 1,68, десмина – в 2,28 раза.
Заключение. При атрофическом вагините наблюдаются значимые изменения маркеров ремоделирования стенки влагалища. В проведенном исследовании наблюдается снижение уровней виментина и десмина в сравнении с контрольной группой.
Ключевые слова: генитоуринарный менопаузальный синдром, атрофический вагинит, патогенез атрофического вагинита.
Для цитирования: Оразов М.Р., Радзинский В.Е., Михалёва Л.М., Хамошина М.Б., Будагян М.Г. Патогенетические детерминанты
атрофического вагинита. Клинический разбор в общей медицине. 2025; 6 (7): 97–102. DOI: 10.47407/kr2025.6.7.00651
Pathogenetic factors of vaginal atrophy
Mekan R. Orazov1, Viktor E. Radzinsky1, Liudmila M. Mikhaleva2, Marina B. Khamoshina1,Magdalina G. Budagyan1
1 Patrice Lumumba Peoples’ Friendship University of Russia (RUDN University), Moscow, Russia;
2 Avtsyn Research Institute of Human Morphology, Petrovsky National Research Centre of Surgery, Moscow, Russia
omekan@mail.ru
Abstract
Objective. To expand understanding of the pathogenesis of vaginal atrophy.
Materials and methods. The prospective study included 51 postmenopausal women with a diagnosis of N95.2 Postmenopausal atrophic vaginitis and 30 postmenopausal women with unverified atrophic vaginitis. The inclusion criteria for the study were: postmenopausal women with a verified and unverified diagnosis of N95.2, informed consent of the patient for the study. In accordance with the stated goal, the women were divided into 2 groups: 1) postmenopausal women with atrophic vaginitis (n=51); 2) postmenopausal women without atrophic vaginitis (control group n=30). The following parameters were assessed: age, duration of menopause, severity of atrophic vaginitis, as well as changes in the connective tissue and muscular compartments of the vagina using the assessment of vaginal wall remodeling markers (vimentin, desmin) by immunohistochemical analysis.
Results. The results of the study demonstrate that in atrophic vaginitis, significant changes are observed in the connective tissue and muscle compartment of the epithelial layer of the vaginal wall. This is evidenced by the defective expression of vaginal wall remodeling markers, such as vimentin, desmin, in the compared groups. A significantly low expression of all indicators is observed compared to the control group: vimentin by 1.68; desmin by 2.28 times.
Conclusion. In atrophic vaginitis, significant changes in vaginal wall remodeling markers are observed. In the study, a decrease in the levels of vimentin, desmin is observed compared to the control group.
Keywords: vulvovaginal atrophy, genitourinary syndrome of menopause, pathogenesis of vaginal atrophy.
For citation: Orazov M.O., Radzinsky V.E., Mikhaleva L.M., Khamoshina M.B., Budagyan M.G. Pathogenetic factors of vaginal atrophy. Clinical review for general practice. 2025; 6 (7): 102–107 (In Russ.). DOI: 10.47407/kr2025.6.7.00651
По данным Организации Объединенных Наций (2022), в 2021 г. среди женского населения планеты доля лиц старше 50 лет составила 26%, что на 22% превышало показатель десятилетней давности [1].
В 2023 г. средняя продолжительность жизни женщин в России составила 77,8 года, а численность россиянок пери- и постменопаузального возраста уже превышает 21 млн [2]. Учитывая средний возраст менопаузы, получается, что более трети своей жизни женщина проводит в климактерии.
Поэтому на сегодняшний день одной из приоритетных задач медицины является сохранение здоровья женщин всех возрастов, улучшение качества жизни и увеличение периода активного долголетия.
По мере угасания функции яичников развивается состояние тотального эстрогендефицита, к которому особенно чувствителен урогенитальный тракт. Симптомокомплекс, ассоциированный со снижением уровня эстрогенов и других половых стероидов, включающий изменения наружных половых органов, промежности, влагалища, уретры и мочевого пузыря, носит название генитоуринарного менопаузального синдрома (ГУМС) [3]. Термин предложен в 2012 г. Североамериканским сообществом по менопаузе (North American Menopause Society, NAMS) и Международным обществом по изучению женского сексуального здоровья (International Society for the Study of Women’s Sexual Health, ISS-WSH) и официально утвержден в 2014 г. Общая распространенность ГУМС у женщин в пери- и постменопаузе варьирует от 13 до 87% [4].
Вульвовагинальная атрофия (ВВА) служит наиболее характерным проявлением ГУМС и имеет свой код по Международной классификации болезней 10-го пересмотра (МКБ-10) – N95.2, поэтому отечественные клиницисты чаще используют в своей практике именно этот термин.
Так, по наблюдениям, распространенность ВВА у женщин в перименопаузе достигает 48%, а у женщин в постменопаузе – 53,8–90% [5]. Наиболее частые проявления ВВА – сухость во влагалище (27–55%), раздражение/жжение/зуд (18%), диспареуния (33–41%) [6, 7].
Учитывая деликатность темы, многие женщины стесняются обсуждать интимные жалобы с врачами, поскольку считают это естественным процессом старения. С другой стороны, сами специалисты в области женского здоровья недостаточно активно выявляют симптомы ВВА при осмотре. Так, по данным группы исследователей, симптомы ВВА/ГУМС обсуждали с врачом только 56% опрошенных, но лишь 40% из них использовали местное лечение (в основном безрецептурные препараты) [8, 9]. По данным опроса Women's EMPOWER, 62% врачей выявляют симптомы ВВА/ГУМС у женщин
в постменопаузе, но сами женщины инициировали беседу лишь в 7–10% случаев [10]. К сожалению, все эти факторы приводят к тому, что данная проблема до сих пор находится в «серой зоне» закрытых тем.
С учетом того что проблема с возрастом необратимо прогрессирует, в отличие от вазомоторных проявлений климактерия, перед врачами остро стоит вопрос тщательной диагностики и назначения своевременного и продолжительного лечения, поскольку симптомы ВВА обратимы [11, 12]. Помимо пациенток с физиологической менопаузой, особого внимания заслуживают женщины с преждевременной яичниковой недостаточностью; после радикальных гинекологических операций; проходящие курсы химио- и гормонотерапии. При этом помимо стремительного снижения уровня эстрогенов происходит резкое истощение приспособительных резервов и, соответственно, течение ВВА ускоренное и крайне выраженное [13, 14].
В патогенезе развития ВВА в первую очередь имеет значение дефицит эстрогенов. Эффекты эстрогенов в отношении тканей влагалища хорошо известны, среди них: синтез коллагена и эластина, гиалуроновой кислоты, вагинальный кровоток, лубрикация (за счет синтеза мукополисахаридов и гиалуроновой кислоты), созревание эпителиальных клеток, контроль уровня вагинального рН и т. д. [15]. Уже за год до наступления менопаузы наблюдается постепенное снижение уровня самого мощного эстрогена в крови – эстрадиола. В постменопаузе эстрогены образуются преимущественно за счет усиленной периферической ароматизации андрогенов, в частности андростендиона, и преобладающим эстрогеном становится менее активный – эстрон. Помимо снижения уровня эстрогенов с возрастом, другим патогенетически важным моментом является гормон-рецепторное воздействие. Величина насыщенности организма женщин эстрогенами контролируется ферментативными системами в клетках тканей-мишеней. Этим можно объяснить тот факт, что степень выраженности проявлений индивидуальна.
Поскольку эстрогеновые рецепторы обнаружены во всех слоях влагалища, понятно, что влагалище является органом-мишенью действия эстрогенов. Последние опосредуют свои эффекты через геномное и негеномное влияние на ядерные и мембранные рецепторы – ER-а и -b. ER-a обнаружены во влагалищном эпителии, стромальных и гладкомышечных клетках, в то время как ER-b – в эпителиальных клетках и гладкомышечных клетках сосудов влагалища [16]. Данные о том, как меняется их соотношение у женщин в пери- и постменопаузе, противоречивы. Согласно работе G.D. Chen и соавт., ER-b не обнаруживаются при исследовании биоптатов влагалища у женщин в постменопаузе, хотя еще в пременопаузе экспрессия мРНК ER-b выявлена [17].
Для того чтобы лучше понимать, чем обусловлены те или иные эстрогензависимые проявления ВВА, стоит вспомнить о гистологическом строении влагалища. Стенка влагалища состоит из трех оболочек: слизистой, мышечной и адвентициальной. В свою очередь слизистая оболочка представляет собой многослойный плоский эпителий, в котором выделяют базальный, парабазальный, промежуточный и поверхностные слои. Чем выше эстрогеновая насыщенность организма, тем выраженнее промежуточные и поверхностные слои, которые богаты гликогеном, и наоборот. Клинически дефицит эстрогенов в данном случае будет проявляться истончением слизистой оболочки, сухостью, травматизацией, сглаживанием слизистой оболочки влагалища и потерей складчатости. Лабораторно это подтверждается при кольпоцитологическом исследовании, где отражается соотношение парабазальных, промежуточных и поверхностных клеток – индекс созревания. При атрофическом типе мазка соотношение близко к 100/0/0, т. е. преобладают клетки глубоких слоев слизистой оболочки влагалища. С учетом исчезновения поверхностных клеток, богатых гликогеном, которые необходимы для поддержания нормоценоза, происходит исчезновение лактобактерий, сдвиг влагалищного pH в щелочную сторону, развивается дисбиоз. Согласно современным представлениям, защитную функцию исчезнувших из биотопа влагалища лактобактерий у женщин постменопаузального возраста берут на себя лимфоидные клетки, представляющие собой натуральные киллеры (CD56, CD20), клетки супрессорно-цитотоксического ряда (СD 8) и др.
Собственная пластинка слизистой оболочки представлена рыхлой волокнистой соединительной тканью с большим количеством эластических волокон [18]. За счет активации фибробластов под действием эстрогенов происходит синтез коллагена. Фибробласты играют важную роль в реэпителизации, синтезе коллагеновых волокон, ремоделировании ткани и высвобождении таких эндогенных факторов роста, как FGF, PDGF, TGF-β и VEGF [19].
На фоне снижения уровня эстрогенов активность фибробластов падает, снижается регенеративный потенциал внеклеточного матрикса, наблюдаются количественные и качественные изменения эластических волокон с преобладанием коллагена III типа (грубого) над коллагеном I типа (нежного) [20]. Немаловажную роль играет дезорганизация базальной мембраны, которая находится между соединительнотканными структурами и эпителиальным пластом. Основной причиной этого состояния является снижение содержания коллагена IV типа. Помимо этого на фоне уменьшения количества фибробластов происходит снижение уровня виментина, который является белком промежуточных филаментов, участвующим в поддержании цитоскелета.
Другими белками промежуточных филаментов являются десмин и α-SMA. Десмин входит в состав промежуточных филаментов цитоскелета клеток мышечных тканей. Их роль в контексте атрофического вагинита изучена пока недостаточно, однако в литературе описаны редкие случаи так называемого «вагинального стромального склероза» у женщин в постменопаузе с диспареунией и другими клиническими проявлениями атрофии. При иммуногистохимическом исследовании в стромальных клетках не выявлено экспрессии десмина, α-SMA, CD34 [21].
В последнее время наряду с доказанной ролью дефицита эстрогенов в развитии атрофических явлений изучается вклад андрогенов. Андрогеновые рецепторы обнаружены во всех слоях влагалища, однако плотность их распределения увеличивается по направлению к коже наружных половых губ, в отличие от эстрогеновых рецепторов, плотность которых больше в верхних отделах влагалища [22, 23]. И если ранее влагалище рассматривалось исключительно как пассивный орган, то в настоящее время активно изучается его роль как эндокринного органа. В 1988 г. F. Labrie предложен термин «интракринология» – раздел эндокринологии, в котором рассматриваются пути и механизмы образования андрогенов и эстрогенов из дегидроэпиандростерона (ДГЭА) внутри клеток периферических тканей [24]. Это значит, что эстрогены и андрогены, синтезируемые из ДГЭА, оказывают свой эффект внутриклеточно и не попадают в системный кровоток.
По данным DrugBank, основные эффекты ДГЭА оказывает, связываясь с ядерным рецептором β (ERβ). Вторыми по значимости выступают андрогеновые рецепторы, однако связывающее сродство для них в 2–3 раза ниже, чем для ERβ. В слизистой оболочке влагалища андрогеновые рецепторы обнаружены во всех слоях: эпителии, собственной пластинке и мышечном слое [25]. Есть исследования, в которых установлено, что с возрастом плотность андрогеновых рецепторов в слизистой оболочке влагалища уменьшается, а в стромальной ткани – не меняется. M. Baldassarre и соавт. установили отрицательную связь между возрастом пациенток и экспрессией андрогеновых рецепторов в слизистой оболочке влагалища, а также увеличением содержания последних в слизистой оболочке и строме влагалища при лечении тестостероном [26].
Цель исследования – расширить представления о патогенезе атрофического вагинита.
Материалы и методы
В исследовании приняли участие женщины в ранней постменопаузе (стадия старения по шкале STRAW-10 +1a, b; n=81). Из них в 1-ю группу (n=51) включены женщины с верифицированным диагнозом N95.2 Постменопаузальный атрофический вагинит, во 2-ю (контрольная группа; n=30) – женщины в постменопаузе без верифицированного диагноза N95.2.Пациенткам 1-й группы проводилось определение индекса вагинального здоровья по 5-балльной шкале G. Bachmann, в которой оцениваются следующие показатели: pH, увлажненность, эластичность, характеристика эпителия. Каждый параметр оценивается в баллах от 1 до 5, где 1 балл соответствует высшей степени атрофии, 2, 3, 4 – выраженной, умеренной, незначительной атрофии, а 5 баллов – нормальному состоянию. Суммарное значение 25 баллов соответствует нормальному состоянию эпителия влагалища, 20 баллов – незначительной атрофии, 15 баллов – умеренной атрофии, а менее 15 баллов – значительным атрофическим изменениям слизистой оболочки влагалища [27].
У женщин обеих групп проводился забор биоптатов задней стенки влагалища панчем диаметром 3 мм.
У женщин из контрольной группы биопсия влагалища проводилась во время реконструктивно-пластических операций на тазовом дне. У пациенток обеих групп взято информированное добровольное согласие. Далее проводилось иммуногистохимическое исследование биоптатов влагалища, взятых панчем диаметром 3 мм. Исследование проводилось с использованием антител к виментину и десмину. Гистологический подсчет осуществлялся по формуле:
HS= ∑ (Pi×i),где Pi – процент клеток, окрашенных для каждой интенсивности (от 0 до 100%), i – интенсивность окрашивания со значениями: 0 – отсутствие окрашивания, 1 – слабое окрашивание (светло-коричневое), 2 – умеренное окрашивание (коричневое) 3 – сильное окрашивание (темно-коричневое).
Полученные показатели сравнивали с результатами контрольной группы.
Результаты
 Средний возраст пациенток 1-й и 2-й групп составил 52±1,4 и 51,17±1,62 года соответственно (табл. 1).
Средний возраст пациенток 1-й и 2-й групп составил 52±1,4 и 51,17±1,62 года соответственно (табл. 1).Для пациенток 1-й группы рассчитан индекс вагинального здоровья (табл. 2). У 31,4% была верифицирована легкая степень атрофии, у 54,9% – умеренная степень атрофии, у 13,7% – тяжелая степень атрофии.
При исследовании биоптатов влагалища методом иммуногистохимии (табл. 3) в 1-й группе у пациенток с
атрофическим вагинитом показатели были следующие: виментин – 1,76±0,62; десмин – 1,98±1,15. Во 2-й (контрольной) группе выявлены следующие показатели: виментин – 2,97±0,18; десмин – 4,53±0,68.
Как видно из табл. 3, у женщин с атрофическим вагинитом в постменопаузе наблюдалась существенно более низкая экспрессия всех показателей по сравнению с группой контроля: виментина – в 1,68 раза, десмина – в 2,28 раза.
Обсуждение
С учетом темпа прироста лиц старшей возрастной группы, обусловленного увеличением продолжительности жизни, остро стоит вопрос улучшения качества жизни женщины в климактерии. Урогенитальный тракт особенно чувствителен к дефициту эстрогенов, его эффекты в отношении тканей влагалища хорошо известны, среди них: синтез коллагена и эластина, гиалуроновой кислоты, вагинальный кровоток, лубрикация (за счет синтеза мукополисахаридов и гиалуроновой кислоты), созревание эпителиальных клеток, контроль уровня вагинального рН. Поскольку эстрогеновые рецепторы расположены во всех слоях влагалищной стенки, то изменения будут затрагивать все ее структуры. На фоне снижения уровня эстрогенов наблюдается снижение активности фибробластов, которое в свою очередь инициирует снижение уровней различных белков, участвующих в поддержании цитоскелета, таких как виментин и десмин. Это белки промежуточных филаментов, основной функцией которых является поддержание механической прочности клетки и обеспечение межклеточной адгезии. В проведенном исследовании при иммуногистохимическом изучении биоптатов влагалищной стенки у женщин в постменопаузе с атрофическим вагинитом выявлена дефектная экспрессия данных маркеров по сравнению с контрольной группой, что позволяет предположить дополнительные патогенетические механизмы формирования атрофического вагинита.Заключение
При атрофическом вагините наблюдаются значимые изменения маркеров ремоделирования стенки влагалища. В проведенном исследовании наблюдается снижение уровней виментина и десмина в сравнении с группой контроля.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Финансирование. Работа выполнена в рамках гранта № 030146-0-000 на базе подразделения: «Кафедра акушерства и гинекологии с курсом перинатологии, Медицинский институт РУДН».
Financing. This work was carried out within the framework of a grant № 030146-0-000, People’s Friendship University of Russia (RUDN University).
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-1767-5536
Mekan R. Orazov – Dr. Sci. (Med.), Full. Prof., Prof., Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-1767-5536
Радзинский Виктор Евсеевич – академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru; ORCID: 0000-0003-4956-0466
Viktor E. Radzinsky – Acad. RAS, Dr. Sci. (Med.), Full Prof., Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Михалева Людмила Михайловна – чл.-корр. РАН, д-р мед. наук, проф., директор НИИМЧ им. академика А.П. Авцына ФГБНУ «РНЦХ им. акад. Б.В. Петровского». ORCID: 0000-0003-2052-914X
Liudmila M. Mikhaleva – Dr. Sci. (Med.), Prof., Corr. Memb. RAS, Dir. of Avtsyn Research Institute of Human Morphology, Petrovsky National Research Centre of Surgery. ORCID: 0000-0003-2052-914X
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН.
E-mail: khamoshina@mail.ru; ORCID: 0000-00033-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Full. Prof., Prof., Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia (RUDN University). E-mail: khamoshina@mail.ru; ORCID: 0000-00033-1940-4534
Будагян Магдалина Грачиковна – аспирант каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. Е-mail: magdalina93@mail.ru
Magdalina G. Budagyan – Postgraduate Student, Medical Institute, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: magdalina93@mail.ru
Поступила в редакцию: 25.06.2025
Поступила после рецензирования: 14.07.2025
Принята к публикации: 17.07.2025
Received: 25.06.2025
Revised: 14.07.2025
Accepted: 17.07.2025
Список исп. литературыСкрыть список1. United Nations Department of Economic and Social Affairs. World Economic Situation and Prospects. New York: United Nations; 2021. 172 p.
2. Росстат. Средняя продолжительность жизни женщин в РФ в 2024 г. URL: https://rshbins-life.ru/news/blog/srednyaya-prodolzhitelnost-zhizni-zhenshchin-v-rossii/?sphrase_id=128797
Rosstat. Average life expectancy of women in the Russian Federation in 2024. URL: https://rshbins-life.ru/news/blog/srednyaya-prodolzhitelnost-zhizni-zhenshchin-v-rossii/?sphrase_id=128797 (in Russian).
3. Клинические рекомендации: Менопауза и климактерическое состояние у женщины, 2024.
Clinical guidelines: Menopause and climacteric state in women, 2024 (in Russian).
4. Luo C, Yue F, Mei L, et al. Efficacy of Fractional CO2 Laser Versus Intravaginal Estrogen for Controlling the Genitourinary Syndrome of Menopause (GSM) Especially Sexual Dysfunctions – A Systematic Review and Meta-Analysis. Clin Exp Obstet Gynecol. 2024;51(2):40. DOI: 10.31083/j.ceog5102040
5. González-Arboleda AA, Arias-Castillo L, García-Perdomo HA. Urologic perspective of genitourinary syndrome of menopause. Int J Urol Nurs. 2024;18(1):e12388.
6. Portman DJ, Gass ML; Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women's Sexual Health and The North American Menopause Society. Climacteric. 2014 Oct;17(5):557-63. DOI: 10.3109/13697137.2014.946279
7. Бахтияров К.Р., Чилова Р.А., Сардарова Ш.Ш. Диагностика и современные методы лечения вульвовагинальной атрофии у женщин в постменопаузе. Лечащий врач. 2021;12(24):17-21. DOI: 10.51793/OS.2021.24.12.002
Bahtiyarov K.R., Chilova R.A., Sardarova Sh.Sh. Vulvovaginal atrophy in postmenopausal women: diagnosis and modern-day treatments. Lechaschi vrach. 2021;12(24):17-21. DOI: 10.51793/OS.2021.24.12.002 (in Russian).
8. Kingsberg SA, Wysocki S, Magnus L, Krychman ML. Vulvar and vaginal atrophy in postmenopausal women: findings from the REVIVE (REal Women's VIews of Treatment Options for Menopausal Vaginal ChangEs) survey. J Sex Med. 2013;10(7):1790-9. DOI: 10.1111/jsm.12190
9. Phillips NA, Bachmann GA. Genitourinary syndrome of menopause: Common problem, effective treatments. Cleve Clin J Med. 2018;85(5):390-8. DOI: 10.3949/ccjm.85a.15081
10. Nappi RE, Palacios S, Panay N, et al. Vulvar and vaginal atrophy in four European countries: evidence from the European REVIVE Survey. Climacteric. 2016;19(2):188-97. DOI: 10.3109/13697137.2015.1107039. Epub 2015 Nov 19. Erratum in: Climacteric. 2016 Apr;19(2):i.
11. Nappi RE, Biglia N, Cagnacci A,, et al. Diagnosis and management of symptoms associated with vulvovaginal atrophy: expert opinion on be- half of the Italian VVA study group. Gynecol Endocrinol. 2016;32:602-6. DOI: 10.1080/09513590.2016.1183627
12. Прилепская В.Н. Генитоуринарный менопаузальный синдром: возможности эстриола. Гинекология. 2018;20(1):5-8. DOI: 10.26442/2079-5696_20.1.5-8
Prilepskaya V.N. Genitourinary menopausal syndrome: the potential of estriol. Gynecology. 2018;20(1):5-8. DOI: 10.26442/2079-5696_20.1.5-8 (in Russian).
13. Кедрова А.Г. Профилактика атрофии влагалища после лечения опухолей органов женской репродуктивной системы. Опухоли женской репродуктивной системы. 2019;15(4):73-8. DOI: 10.17650/1994-4098-2019-15-4-73-78
Kedrova A.G. Prevention of vaginal atrophy after treatment for tumors of the female reproductive system. Tumors of Female Reproductive System. 2019;15(4):73-8. DOI: 10.17650/1994-4098-2019-15-4-73-78 (in Russian).
14. Ампилогова Д.М., Солопова А.Г., Блинов Д.В. и др. Вульвовагинальная атрофия: проблемы лечения и реабилитации. Гинекология. 2022;24(4):240-5. DOI: 10.26442/20795696. 2022.4.201792
Ampilogova D.M., Solopova A.G., Blinov D.V., et al. Vulvovaginal atrophy: issues of treatment and rehabilitation: A review. Gynecology. 2022;24(4):240-5. DOI: 10.26442/20795696.2022.4.201792 (in Russian).
15. Оразов М.Р., Силантьева Е.С., Радзинский В.Е. и др. Факторы риска развития и механизмы патогенеза генитоуринарного менопаузального синдрома. Российский вестник акушера-гинеколога. 2023;23(4):44-9. DOI: 10.17116/rosakush20232304144
Orazov M.R., Silant’yeva E.S., Radzinskii V.E., et al. Risk factors and pathogenetic mechanisms of genitourinary menopausal syndrome. Russian Bulletin of Obstetrician-Gynecologist. 2023;23(4):44-9. DOI: 10.17116/rosakush20232304144 (in Russian).
16. Fu X, Rezapour M, Wu X, et al. Expression of estrogen receptor-alpha and -beta in anterior vaginal walls of genuine stress incontinent women. Int Urogynecol J Pelvic Floor Dysfunct. 2003 Oct;14(4):276-81; discussion 281. DOI: 10.1007/s00192-003-1042-7
17. Chen GD, Oliver RH, Leung BS, et al. Estrogen receptor alpha and beta expression in the vaginal walls and uterosacral ligaments of premenopausal and postmenopausal women. Fertil Steril. 1999 Jun;71(6):1099-102. DOI: 10.1016/s0015-0282(99)00113-2
18. Шурыгина О.В., Ямщиков Н.В., Кулакова О.В. и др. Гистологическое исследование тканевых компонентов cтенки влагалища человека. Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. 2014;1(13):8-12.
Shurygina O.V., Yamshchikov N.V., Kulakova O.V., et al. Histological study of tissue components of the human vaginal wall. Bulletin of the Reaviz Medical Institute: rehabilitation, doctor and health. 2014;1(13):8-12 (in Russian).
19. Vincent F. Mechanisms of cutaneous wound repair. In: Freedberg IM, Eisen AZ, Wolff K, et al. (eds). Fitzpatrick’s dermatology in general medicine. 6th ed. New York: McGraw Hill; 2003. P. 236-46.
20. Оразов М.Р., Демяшкин Г.А., Токтар Л.Р. Ремоделирующая лазерная терапия влагалища при генитоуринарном менопаузальном синдроме. Хирургическая практика. 2018;(1):22-37. DOI: 10.17238/issn2223-2427.2018.1.22-37
Orazov M.R., Demyashkin G.A., Toktar L.R. Remodeling laser therapy of the vagina in genitourinary menopausal syndrome. Surgical Practice. 2018;(1):22-37. DOI: 10.17238/issn2223-2427.2018.1.22-37 (in Russian).
21. Fadare O. Vaginal stromal sclerosis: a distinctive stromal change associated with vaginal atrophy. Int J Gynecol Pathol. 2011 May;30(3):295-300. DOI: 10.1097/PGP.0b013e3182005356
22. Palacios S. Expression of androgen receptors in the structures of vulvovaginal tissue. Menopause. 2020 Nov;27(11):1336-42. DOI: 10.1097/GME.0000000000001587
23. Hodgins MB, Spike RC, Mackie RM, MacLean AB. An immunohistochemical study of androgen, oestrogen and progesterone receptors in the vulva and vagina. Br J Obstet Gynaecol. 1998 Feb;105(2):216-22. DOI: 10.1111/j.1471-0528.1998.tb10056.x
24. Labrie F, et al. Breast. In: Genazzani AR, Petralgia F, Artini PG (eds). Advances in Gynecological Endocrinology. Boca Raton: Parthenon Publishing Group; 2004. P. 246.
25. Palacios S. Expression of androgen receptors in the structures of vulvovaginal tissue. Menopause. 2020 Nov;27(11):1336-42. DOI: 10.1097/GME.0000000000001587
26. Baldassarre M, Perrone A, Giannone F, et al. Androgen receptor expression in the human vagina under different physiological and treatment conditions. Int J Impot Res. 2013;25:7-11. DOI: 10.1038/ijir.2012.25
27. Bachmann GA, Notelovitz M, Kelly SJ, et al. Long-term non-hormonal treatment of vaginal dryness. Clin Pract Sexuality. 1992;8:3-8.
3 сентября 2025
Количество просмотров: 234