Клинический разбор в общей медицине №8 2025
1 Clinic of Professor Kinzersky, Chelyabinsk, Russia;
2 Alexander Vein Headache Clinic, Moscow, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
dr.timohovich@kinzerskiy.clinicc
Abstract
Background. Migraine is a common disease that affects about 1 billion people worldwide. Factors affecting the limbic system play a major role in the migraine chronification. Dysfunction of the limbic system underlies many non-painful symptoms of migraine. Also there is an association between severe migraine and depression. Conditions such as misophonia and trypophobia are clinical markers indicating the development of limbic sensitization that accompanied chronic migraine.
Aim. The impact of limbic sensitization on the efficacy of fremanezumab therapy and depression in migraine patients.
Methods. A total of 80 patients with the established diagnosis of migraine and depression took part in the study. Fremanezumab 225 mg was administered monthly for 6 months. Сlinical interviewing and filling of Hamilton Depression Rating Scale, Central Sensitization Inventory, Trypophobia Questionnaire, and Misophonia Questionnaire were performed every month.
Results. A significant decrease in the headache frequency, depression, central sensitization, misophonia and trypophobia is observed with the steady increase of effect by month 3 of therapy and the effect persistence by month 6 of therapy is reported in patients with chronic migraine and depression. A significant decrease in the depression scores based on the Hamilton depression rating Scale is observed at 2, 3, and 6 months of treatment compared with baseline. There was a correlation between baseline misophonia and trypophobia scores and headache frequency, depression scores, and central sensitization scores. High baseline levels of misophonia and trypophobia were negative predictors of treatment efficacy.
Conclusion. Limbic system-mediated symptoms and comorbidities contribute to migraine chronification and affect patient quality of life, treatment satisfaction, and behavioral patterns. Screening for comorbidities is recommended for all patients with migraine.
Keywords: migraine, monoclonal antibodies, chronic migraine, depression, fremanezumab, CGRP, misophonia, trypophobia.
For citation: Timokhovich A.Yu., Berdnikova A.V., Latysheva N.V. The impact of limbic sensitization on the efficacy of fremanezumab therapy in migraine patients. Clinical review for general practice. 2025; 6 (8): 32–39 (In Russ.). DOI: 10.47407/kr2025.6.8.00655
Известно, что большую роль в хронификации мигрени играют факторы, влияющие на лимбическую систему: чрезмерное использование анальгетиков, употребление кофеина, плохая гигиена сна, ожирение, неадекватное лечение острых приступов мигрени, отсутствие физических упражнений, женский пол, аллодиния, травмы головы, низкий социально-экономический статус, депрессия, тревожность, стрессовые жизненные события, посттравматический стресс и сопутствующие болевые расстройства [5, 6].
Лимбическая система передает и интегрирует множественные сигналы как от тела, так и от окружающей среды, фильтрует или производит генерацию эмоциональных, гомеостатических и когнитивных реакций [4]. К ее функциям относятся регуляция голода и жажды, сексуальное удовлетворение, реакция на боль, удовольствие и сенсорную информацию, в особенности от обонятельной системы [8]. Эта система также отвечает за контроль агрессивного или жестокого поведения, эмоций, таких как гнев и страх, и функций вегетативной нервной системы, которые включают регуляцию частоты пульса, артериального давления, дыхания и возбуждения [8]. Поскольку лимбическая система функционирует как «система сигнализации» мозга, она также может быть первой группой нейронов, которые распознают начало мозговой активности, связанной с мигренью [5].
Соматосенсорные нейронные сети, ответственные за возникновение боли во время приступов мигрени, проходят в основном через заднюю часть мозга, включая тригеминоцервикальный комплекс в стволе мозга, таламус и соматосенсорную кору [9]. В то же время сети, ответственные за лимбические особенности, в особенности эмоциональный компонент, расположены в средней (гипоталамус и передняя поясная кора), медиальной височной (миндалевидное тело и гиппокамп) и передней (префронтальная кора) частях мозга [4]. Отмечается, что у пациентов с мигренью и депрессией значительно увеличивается объем миндалевидного тела, и нейроны, экспрессирующие кальцитонин-ген-родственный пептид (CGRP) в парабрахиальном ядре, имеют решающее значение для передачи болевых сигналов в центральное ядро миндалины, что может видоизменять аффективные мотивационные аспекты боли [10]. В ряде исследований показано, что изменения объема миндалевидного тела коррелируют с частотой ГБ, но, в свою очередь, также могут быть связаны с выраженностью и длительностью симптомов депрессии [11, 12].
Клиническими маркерами, свидетельствующими о развитии лимбической сенситизации, являются такие состояния, как мизофония и трипофобия [13]. Под мизофонией подразумевается нетерпимость к звукам, таким как прием пищи рядом сидящего человека, зевота, глубокое дыхание, хруст пальцев, храп, кашель, шмыгание носом, т.е. звуки, не вызывающие негативной реакции при спокойном состоянии человека [14]. После воздействия триггера может развиться повышенная симпатическая активация (мышечное напряжение, увеличение частоты сердечных сокращений и изменение дермографизма), возможно появление чувства гнева, отвращения и беспокойства [15]. Такая ответная реакция может перейти в поведенческую или вербальную агрессию, а также в крайнее избегающее поведение стимула и, как наученный механизм реагирования, опосредованный через миндалину, гиппокамп и связь с префронтальной корой, сформировать по аналогии избегание боли при мигрени и страх приступа [16]. Есть данные о большой роли генетических факторов в развитии мизофонии [15].
У пациентов с мигренью и депрессией в сочетании с высокими показателями мизофонии в ответ на ГБ часто возникают чувство беспомощности, страха, усиление восприятия боли и катастрофизация приступов. Для таких пациентов характерен негативизм, особое внимание к деталям, в особенности связанным с негативным опытом, категоричность суждений, низкая комплаентность, стратегии избегания, плохое купирование приступов ГБ и злоупотребление анальгетиками. Механизмы развития более тяжелого течения мигрени у пациентов с мизофонией могут быть генетически обусловлены особенностями анатомического строения головного мозга при мизофонии (большее участие островковой зоны и передней поясной извилины и миндалевидного тела) и реализацией механизмов развития приступов не только через CGRP [17].
Трипофобия – это состояние, при котором у человека возникает сильное отвращение или страх при виде скопления мелких отверстий или углублений [18]. Данные литературы свидетельствует, что подобный страх может быть связан с эволюционными механизмами, направленными на избегание потенциальной опасности [19]. Симптомы трипофобии, как правило, можно разделить на три области, ассоциированные с сенсорными (например, ощущения «зуд», «ползание кожи»), когнитивными (например, «отвращение, отвращение или отвращение», «нелегкие») и вегетативными проявлениями (например, «тошнота, позывы на рвоту», «затрудненное дыхание») [19]. У пациентов с трипофобией при предъявлении провоцирующих стимулов отмечалось искажение когнитивной обработки стимулов с большим акцентом на эмоциональную их окраску, и, соответственно, такие люди отличаются большей чувствительностью к внешнему стрессу, более уязвимы и могут пытаться избегать трипофобных изображений и, таким образом, избежать сопутствующего дискомфорта [20].
Несмотря на успехи в разработке таргетной терапии мигрени, которой стали препараты анти-CGRP-моноклональных антител, эффект от лечения часто остается неполным. Это говорит о том, что механизмы, лежащие в основе мигрени, являются многофакторными как у разных пациентов, так и у каждого отдельно взятого пациента. Учитывая текущее состояние терапии мигрени и частое наличие коморбидных психических расстройств, требуется более целостный подход к лечению, нацеленный не только на купирование болевого синдрома, но и на иные механизмы, которые приводят к неболевым симптомам мигрени и сопутствующим заболеваниям, включая лимбическую сенситизацию.
Цель – изучение влияния лимбической сенситизации на течение мигрени и депрессии и эффективность таргетной терапии мигрени.
Критерии включения:
• диагноз эпизодической мигрени или хронической мигрени в соответствии с критериями Международной классификации головной боли 3-го пересмотра [21];
• частота ГБ ≥8 дней в месяц;
• диагноз текущего депрессивного эпизода в соответствии с критериями Международной классификации болезней 10-го пересмотра [22];
• возраст от 18 до 65 лет;
• подписание информированного добровольного согласия на участие в исследовании.
Критерии исключения:
• наличие тяжелых соматических и неврологических заболеваний, хронических заболеваний в стадии декомпенсации;
• наличие тяжелых психических заболеваний;
• беременность или планирование ее на период, совпадающий с проведением исследования;
• прием психоактивных веществ (в том числе антидепрессантов, транквилизаторов и антипсихотиков).
Всем пациентам исходно проводились неврологическое обследование, сбор демографических и клинических характеристик и обучение заполнению дневника ГБ. На исходном визите и далее ежемесячно в течение 6 мес проводилось анкетирование с использованием шкалы депрессии Гамильтона [23], опросника центральной сенситизации (ЦС) [24], опросника трипофобии [25] и опросника мизофонии [26]. Пациентам проводилось подкожное введение фреманезумаба в дозировке 225 мг ежемесячно в течение 6 мес.
Статистический анализ проводился в программе
Microsoft Excel 2016 и на онлайн-ресурсах Statistics Kingdom и SocStatistic. Для обозначения статистически значимых различий между показателями (p<0,05) использовался символ «*».
 В исследовании приняли участие 80 пациентов, преимущественно женского пола (n=72, 90%). Средний возраст составил 39,9±10,8 года. Медиана частоты ГБ составила 25 дней в месяц, медиана частоты мигрени – 12,5 дня в месяц. Исходный уровень депрессии по шкале депрессии Гамильтона составил 19,5 [15; 24] балла, что соответствует выраженной степени депрессии. Исходный уровень ЦС по опроснику ЦС составил 40 [30; 50], что соответствует клинически значимому уровню. Клинико-демографические данные пациентов и исходные показатели опросников депрессии, ЦС, мизофонии и трипофобии представлены в табл. 1.
В исследовании приняли участие 80 пациентов, преимущественно женского пола (n=72, 90%). Средний возраст составил 39,9±10,8 года. Медиана частоты ГБ составила 25 дней в месяц, медиана частоты мигрени – 12,5 дня в месяц. Исходный уровень депрессии по шкале депрессии Гамильтона составил 19,5 [15; 24] балла, что соответствует выраженной степени депрессии. Исходный уровень ЦС по опроснику ЦС составил 40 [30; 50], что соответствует клинически значимому уровню. Клинико-демографические данные пациентов и исходные показатели опросников депрессии, ЦС, мизофонии и трипофобии представлены в табл. 1.
Динамика частоты ГБ
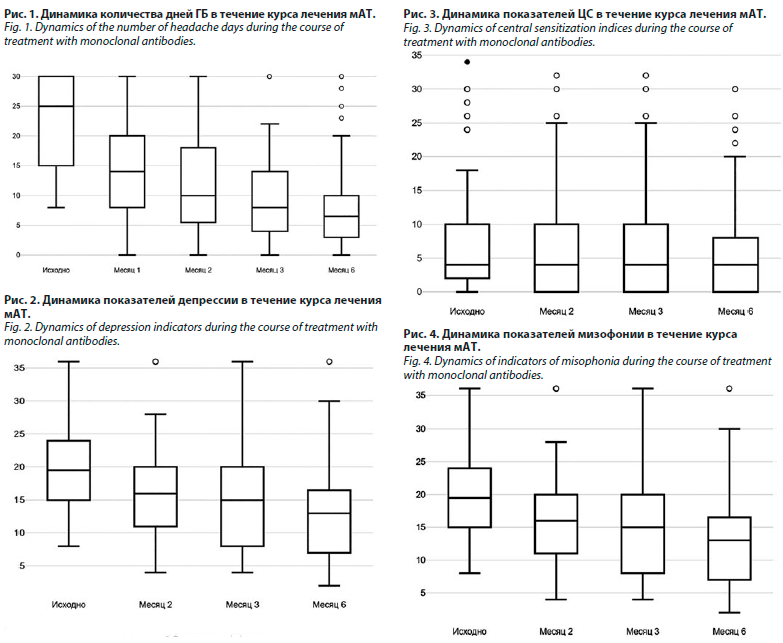
Исходное число дней ГБ в месяц составляло 25 [15; 30]. Через 1 мес лечения количество дней ГБ снизилось до 14 [8; 20], p<0,00001*. Через 2 мес лечения количество дней ГБ составило 10 [5,3; 18], по сравнению с исходным уровнем p<0,00001*. К 3-му месяцу лечения количество дней ГБ достигло 8 [4; 14], p<0,00001*, а к 6-му месяцу – 6,5 [3; 10], p<0,00001*. Таким образом, отмечается статистически значимое снижение количества дней ГБ на фоне лечения моноклональными антителами (мАТ) на 1, 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Данные представлены на рис. 1.
Динамика показателей депрессии
Показатели депрессии снизились ко 2-му месяцу лечения с 19,5 [15; 24] балла до 16 [11; 20], p<0,00001*, к 3-му – до 15 [8; 20], p<0,00001*, а к 6-му – до 13
[7; 16,8], p<0,00001*. Таким образом, отмечается статистически значимое снижение показателей уровня депрессии на фоне лечения мАТ на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Динамика показателей депрессии представлена на рис. 2.
Динамика показателей ЦС
Исходный уровень ЦС составил 40 [30; 50] баллов и ко 2-му месяцу лечения снизился до 30 [22; 42], p<0,00001*, что является показателем ниже порогового для определения ЦС как клинически значимой (40 баллов). Через 3 мес лечения уровень ЦС составил 28 [20; 40], p<0,00001*, через 6 мес лечения – 24 [16; 38] по сравнению с исходным уровнем; p<0,00001*. Таким образом, отмечается статистически значимое снижение уровня ЦС на фоне лечения мАТ на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Данные представлены на рис. 3.
Динамика показателей мизофонии и трипофобии
 Отмечалось статистически значимое снижение уровня мизофонии по сравнению с исходным уровнем: 4 [0; 10], p<0,00001* через 2 мес лечения; 4 [0; 10], p<0,00001* через 3 мес лечения; 4 [0; 8], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 4.
Отмечалось статистически значимое снижение уровня мизофонии по сравнению с исходным уровнем: 4 [0; 10], p<0,00001* через 2 мес лечения; 4 [0; 10], p<0,00001* через 3 мес лечения; 4 [0; 8], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 4.
Отмечалось статистически значимое снижение уровня трипофобии по сравнению с исходным уровнем: 19 [17; 22], p=0,0004* через 2 мес лечения; 19 [17; 20,8], p=0,0001* через 3 мес лечения; 19 [17; 20], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 5.
ГБ уредилась менее чем на 30% у 12 (15%) пациентов, соответственно, урежение ГБ ≥30% отмечалось у 68 (85%) человек. Урежение ГБ ≥50% отмечалось у 51 (63,8%) пациента.
Показатели депрессии значимо снизились как у респондеров (урежение ГБ ≥50%), так и у нон-респондеров (урежение ГБ <50%). При этом как на исходном уровне, так и через 3 мес лечения показатели депрессии были значимо выше у группы нон-респондеров по сравнению с группой респондеров. Данные представлены в табл. 2.
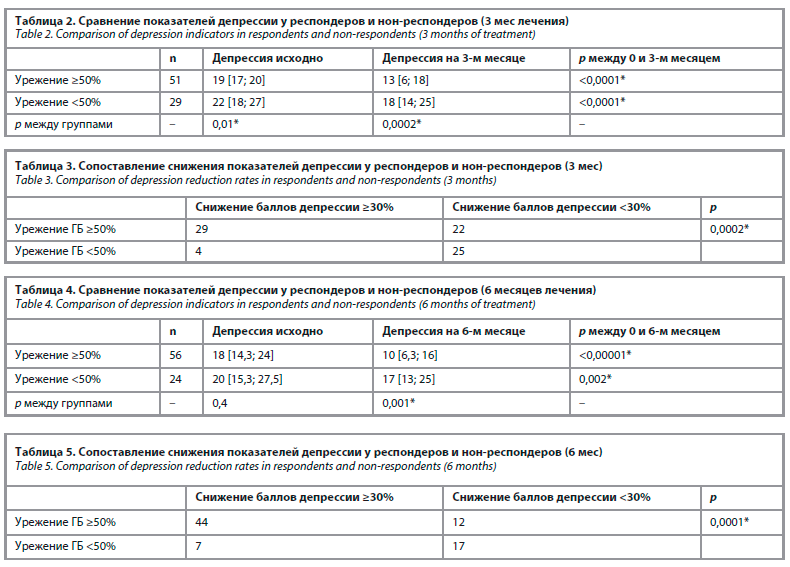
При оценке снижения баллов депрессии в процентном соотношении (≥30% и <30%) отмечалось статистически значимое преобладание пациентов со снижением показателей депрессии ≥30% в группе респондеров (табл. 3).
Шесть месяцев лечения
ГБ уредилась менее чем на 30% у 8 (10%) пациентов, соответственно, урежение ГБ ≥30% отмечалось у 72 (90%) человек. Урежение ГБ ≥50% отмечалось у 56 (70%).
Показатели депрессии значимо снизились как у респондеров (урежение ГБ ≥50%), так и у нон-респондеров (урежение ГБ <50%). На исходном уровне показатели депрессии между группами не имели статистически значимой разницы, через 6 мес лечения показатели депрессии были значимо выше у группы нон-респондеров по сравнению с группой респондеров. Данные представлены в табл. 4.
При оценке снижения баллов депрессии в процентном соотношении отмечалось статистически значимое преобладание пациентов со снижением показателей депрессии ≥30% в группе респондеров (табл. 5).
• через 1 мес лечения отмечалась статистически незначимая слабая положительная корреляция, rs=0,09, p=0,41;
• через 3 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,2, p=0,048*, что означает меньшее снижение частоты ГБ у пациентов с более высоким исходным уровнем мизофонии;
• через 6 мес лечения отмечалась статистически незначимая слабая отрицательная корреляция, rs=-0,02, p=0,07.
При оценке корреляции между исходным уровнем трипофобии и снижением частоты ГБ были получены следующие результаты:
• через 1 мес лечения отмечалась статистически незначимая слабая отрицательная корреляция, rs=-0,02, p=0,88;
• через 3 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,26, p=0,017*, что означает меньшее снижение частоты ГБ у пациентов с более высоким уровнем трипофобии;
• через 6 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,26, p=0,02*, что означает меньшее снижение частоты ГБ у пациентов с более высоким уровнем трипофобии.
При оценке взаимосвязи между исходным количеством дней ГБ и мизофонией отмечалась статистически значимая умеренная положительная корреляция (rs=0,48, pp<0,0001*), а при оценке взаимосвязи с трипофобией – статистически значимая слабая положительная корреляция (rs=0,25, p=0,02*), что означает соответствие более высоких показателей мизофонии и трипофобии более высокой частоте ГБ.
Отмечались статистически значимая умеренная положительная корреляция (rs=0,48, p<0,0001*) между исходным уровнем депрессии и исходным уровнем мизофонии и статистически значимая умеренная положительная корреляция (rs=0,43, p<0,0001*) между исходным уровнем депрессии и исходным уровнем трипофобии.
Отмечалась статистически значимая умеренная положительная корреляция (rs=0,43, p<0,0001*) между исходным уровнем ЦС и исходным уровнем мизофонии и статистически значимая умеренная положительная корреляция (rs=0,38, p=0,0005*) между исходным уровнем ЦС и исходным уровнем трипофобии.
Мизофония и трипофобия как предикторы ответа на терапию
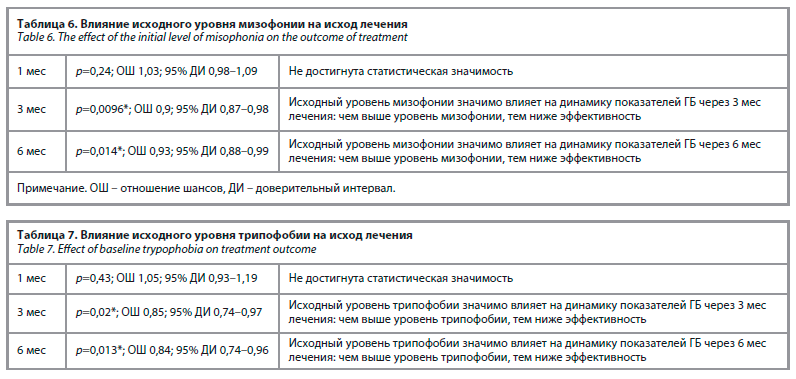
В качестве параметра, определяющего эффективность лечения, было принято снижение количества дней ГБ ≥50%. Данные о влиянии исходного уровня мизофонии и трипофобии на исход лечения представлены в табл. 6, 7.
В связи с этим представляется интересным изучение возможных механизмов подобного эффекта, так как механизмы депрессии реализуются не за счет системы CGRP, а за счет иных путей, в том числе посредством вовлечения нейротрансмиттерных систем лимбической системы [30].
В нашем исследовании в первую очередь была продемонстрирована эффективность фреманезумаба в лечении мигрени за 6 мес терапии и оценены группы респондеров и нон-респондеров, что позволило дополнительно проанализировать взаимосвязь эффективности лечения мигрени и снижения показателей депрессии. Кроме этого, было отмечено значимое снижение показателей депрессии в течение курса лечения.
При этом представляет интерес тот факт, что как через 3, так и через 6 мес лечения в обеих группах (респондеры и нон-респондеры) отмечалось статистические значимое улучшение депрессии. При этом показатели депрессии в группе нон-респондеров оказались значимо выше по сравнению с показателями в группе респондеров на фоне лечения, т.е. снижались несколько медленнее, чем у пациентов, показавших хороший ответ на терапию фреманезумабом. По аналогии с делением пациентов на респондеров и нон-респондеров в зависимости от процентного снижения частоты ГБ нами было проведено разделение пациентов на две группы в зависимости от процентного снижения показателей депрессии – группа со снижением <30% и группа со снижением ≥30%. Анализ полученных данных показал, что в группе нон-респондеров по ГБ как через 3, так и через 6 мес отмечалось значимое преобладание пациентов, снижение депрессии у которых составило <30%. Кроме того, выявлены пациенты (4 пациента через 3 мес терапии и 7 пациентов через 6 мес терапии), у которых отмечено снижение уровня депрессии при отсутствии урежения ГБ. Таким образом, ответ на терапию фреманезумабом может зависеть в том числе от выраженности снижения уровня депрессии у пациентов.
В нашем исследовании было показано, что более высокие исходные показатели мизофонии и трипофобии ассоциированы с более частыми приступами мигрени и более выраженной степенью депрессии. При этом на фоне лечения фреманезумабом показано, что более высокие показатели мизофонии и трипофобии влияют на худший исход лечения к 3 и 6-му месяцу терапии, что позволяет сделать вывод о влиянии лимбической сенситизации на течение мигрени. Генерализованная гиперчувствительность к аверсивным стимулам, свидетельствующая о развитии лимбической сенситизации, может быть как врожденной особенностью пациентов с мигренью, так и следствием изменений, произошедших за время развития мигрени в течение жизни пациента [31].
Стоит акцентировать внимание на том, что мигрень – это заболевание, имеющее как болевые, так и неболевые проявления, а также коморбидные заболевания, и в основе как мигрени, так и сопутствующих состояний лежит тесное переплетение различных механизмов, оказывающих друг на друга влияние. Известно, что одним из ключевых белков, играющих роль в развитии нейрогенного воспаления и непосредственно боли, является CGRP, ставший таргетной молекулой для лечения препаратами мАТ [32]. Вместе с этим большую роль в развитии неболевых проявлений играет лимбическая система, что в особенности выражено при хронизации мигрени [4]. В свою очередь, известно, что в основе хронизации мигрени лежит развитие ЦС, которая нарушает регуляцию нейронов лимбической системы, при этом степень выраженности ЦС коррелирует с выраженностью симптомов депрессии при мигрени [33].
Из литературы известно взаимодействие между CGRP-ергическими путями и серотонинергическими структурами лимбической системы [34], и результаты исследования Y. Yang и соавт. [35] продемонстрировали возможность того, что система CGRP играет роль в опосредовании поведения, контролируемого лимбической системой, по крайней мере частично, через прямое воздействие на серотонинергические нейроны ядра шва.
С момента выхода препаратов анти-CGRP-мАТ проводились множественные исследования по оценке возможных предикторов ответа на терапию и неоднократно была показана зависимость более низкого эффективного лечения от более высокого исходного уровня депрессии у пациентов с мигренью [36]. Однако изучение состояний, ассоциированных с лимбической сенситизацией при мигрени, как потенциальных предикторов положительного или отрицательного ответа на терапию ранее не проводились. Нами впервые была проведена оценка мизофонии и трипофобии методом логистической регрессии как прогностических показателей при лечении мигрени препаратами анти-CGRP-мАТ. Полученные результаты показали, что исходный уровень как мизофонии, так и трипофобии является негативным прогностическим фактором – чем выше были исходные показатели выраженности данных состояний, тем ниже была эффективность терапии как к 3, так и к 6-му месяцу лечения. Полученные результаты представляют большой научный интерес, так как наличие лимбической сенситизации и ее маркеров, таких как мизофония и трипофобия, у пациентов с мигренью является известным фактом, однако крупных исследований по изучению корреляции данных состояний с мигренью не проводилось [37, 13], а появление таргетной терапии мигрени ставит новые задачи по исследованию не только болевых, но и неболевых проявлений мигрени, а также их потенциальной связи с эффективностью лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Тимохович Анна Юрьевна – врач-невролог, клиника проф. Кинзерского. E-mail: dr.timohovich@kinzerskiy.clinic; ORCID: 0009-0005-2076-7668
Anna Yu. Timokhovich – neurologist, Сlinic of Professor Kinzersky. E-mail: dr.timohovich@kinzerskiy.clinic; ORCID: 0009-0005-2076-7668
Бердникова Анна Владимировна – канд. мед. наук, ассистент каф. нервных болезней Института профессионального образования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), Клиника головной боли и вегетативных расстройств им. акад. Александра Вейна. E-mail: asimcin@mail.ru; ORCID: 0000-0002- 4447-2152
Anna V. Berdnikova – Cand. Sci. (Med.), Аssistant, Sechenov First Moscow State Medical University (Sechenov University), Alexander Vein Headache Clinic. E-mail: asimcin@mail.ru; ORCID: 0000-0002-4447-2152
Латышева Нина Владимировна – д-р мед. наук, доц., проф. каф. нервных болезней Института профессионального образования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), Клиника головной боли и вегетативных расстройств им. акад. Александра Вейна. E-mail: ninalat@gmail.com; ORCID: 0000-0001-9600-5540
Nina V. Latysheva – Dr. Sci. (Med.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University), Alexander Vein Headache Clinic. E-mail: ninalat@gmail.com; ORCID: 0000-0001-9600-5540
Поступила в редакцию: 12.08.2025
Поступила после рецензирования: 18.08.2025
Принята к публикации: 21.08.2025
Received: 12.08.2025
Revised: 18.08.2025
Accepted: 21.08.2025
Клинический разбор в общей медицине №8 2025
Влияние лимбической сенситизации на эффективность терапии фреманезумабом у пациентов с мигренью
Номера страниц в выпуске:32-39
Аннотация
Введение. Мигрень – это широко распространенное заболевание, которым страдают около 1 млрд человек в мире. Известно, что большую роль в хронификации мигрени играют факторы, влияющие на лимбическую систему, и дисфункция лимбической системы лежит в основе многих неболевых проявлений мигрени. Также имеет место ассоциация тяжелого течения мигрени и проявлений депрессии. Клиническими маркерами, свидетельствующими о развитии лимбической сенситизации, сопутствующей хронической мигрени, являются такие состояния, как мизофония и трипофобия.
Цель. Изучение влияния лимбической сенситизации на течение мигрени и депрессии и эффективность таргетной терапии мигрени.
Материалы и методы. В исследовании приняли участие 80 пациентов с установленными диагнозами мигрени и депрессивного расстройства. Пациентам проводилось подкожное введение фреманезумаба в дозировке 225 мг ежемесячно в течение 6 мес. На исходном визите и далее ежемесячно проводились клиническое интервью и анкетирование с использованием шкалы депрессии Гамильтона, опросника центральной сенситизации, опросника трипофобии и опросника мизофонии.
Результаты. Отмечалось значимое снижение количества дней головной боли, показателей депрессии, центральной сенситизации, мизофонии и трипофобии на фоне лечения фреманезумабом на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Отмечалась корреляция между исходными показателями мизофонии и трипофобии и частотой головной боли, показателями депрессии и центральной сенситизации. Исходные высокие уровни мизофонии и трипофобии явились негативными предикторами эффективности терапии.
Заключение. Симптомы и сопутствующие заболевания, опосредованные лимбической системой, способствуют хронизации мигрени и влияют на качество жизни пациента и удовлетворенность лечением, а также определяют поведенческие паттерны пациентов. Рекомендуется проводить скрининг на наличие сопутствующих факторов у всех пациентов с мигренью.
Ключевые слова: мигрень, моноклональные антитела, хроническая мигрень, депрессия, фреманезумаб, CGRP, мизофония, трипофобия.
Для цитирования: Тимохович А.Ю., Бердникова А.В., Латышева Н.В. Влияние лимбической сенситизации на эффективность терапии фреманезумабом у пациентов с мигренью. Клинический разбор в общей медицине. 2025; 6 (8): 32–39. DOI: 10.47407/kr2025.6.8.00655
Введение. Мигрень – это широко распространенное заболевание, которым страдают около 1 млрд человек в мире. Известно, что большую роль в хронификации мигрени играют факторы, влияющие на лимбическую систему, и дисфункция лимбической системы лежит в основе многих неболевых проявлений мигрени. Также имеет место ассоциация тяжелого течения мигрени и проявлений депрессии. Клиническими маркерами, свидетельствующими о развитии лимбической сенситизации, сопутствующей хронической мигрени, являются такие состояния, как мизофония и трипофобия.
Цель. Изучение влияния лимбической сенситизации на течение мигрени и депрессии и эффективность таргетной терапии мигрени.
Материалы и методы. В исследовании приняли участие 80 пациентов с установленными диагнозами мигрени и депрессивного расстройства. Пациентам проводилось подкожное введение фреманезумаба в дозировке 225 мг ежемесячно в течение 6 мес. На исходном визите и далее ежемесячно проводились клиническое интервью и анкетирование с использованием шкалы депрессии Гамильтона, опросника центральной сенситизации, опросника трипофобии и опросника мизофонии.
Результаты. Отмечалось значимое снижение количества дней головной боли, показателей депрессии, центральной сенситизации, мизофонии и трипофобии на фоне лечения фреманезумабом на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Отмечалась корреляция между исходными показателями мизофонии и трипофобии и частотой головной боли, показателями депрессии и центральной сенситизации. Исходные высокие уровни мизофонии и трипофобии явились негативными предикторами эффективности терапии.
Заключение. Симптомы и сопутствующие заболевания, опосредованные лимбической системой, способствуют хронизации мигрени и влияют на качество жизни пациента и удовлетворенность лечением, а также определяют поведенческие паттерны пациентов. Рекомендуется проводить скрининг на наличие сопутствующих факторов у всех пациентов с мигренью.
Ключевые слова: мигрень, моноклональные антитела, хроническая мигрень, депрессия, фреманезумаб, CGRP, мизофония, трипофобия.
Для цитирования: Тимохович А.Ю., Бердникова А.В., Латышева Н.В. Влияние лимбической сенситизации на эффективность терапии фреманезумабом у пациентов с мигренью. Клинический разбор в общей медицине. 2025; 6 (8): 32–39. DOI: 10.47407/kr2025.6.8.00655
The impact of limbic sensitization on the efficacy of fremanezumab therapy in migraine patients
Anna Yu. Timokhovich1, Anna V. Berdnikova2,3, Nina V. Latysheva2,31 Clinic of Professor Kinzersky, Chelyabinsk, Russia;
2 Alexander Vein Headache Clinic, Moscow, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
dr.timohovich@kinzerskiy.clinicc
Abstract
Background. Migraine is a common disease that affects about 1 billion people worldwide. Factors affecting the limbic system play a major role in the migraine chronification. Dysfunction of the limbic system underlies many non-painful symptoms of migraine. Also there is an association between severe migraine and depression. Conditions such as misophonia and trypophobia are clinical markers indicating the development of limbic sensitization that accompanied chronic migraine.
Aim. The impact of limbic sensitization on the efficacy of fremanezumab therapy and depression in migraine patients.
Methods. A total of 80 patients with the established diagnosis of migraine and depression took part in the study. Fremanezumab 225 mg was administered monthly for 6 months. Сlinical interviewing and filling of Hamilton Depression Rating Scale, Central Sensitization Inventory, Trypophobia Questionnaire, and Misophonia Questionnaire were performed every month.
Results. A significant decrease in the headache frequency, depression, central sensitization, misophonia and trypophobia is observed with the steady increase of effect by month 3 of therapy and the effect persistence by month 6 of therapy is reported in patients with chronic migraine and depression. A significant decrease in the depression scores based on the Hamilton depression rating Scale is observed at 2, 3, and 6 months of treatment compared with baseline. There was a correlation between baseline misophonia and trypophobia scores and headache frequency, depression scores, and central sensitization scores. High baseline levels of misophonia and trypophobia were negative predictors of treatment efficacy.
Conclusion. Limbic system-mediated symptoms and comorbidities contribute to migraine chronification and affect patient quality of life, treatment satisfaction, and behavioral patterns. Screening for comorbidities is recommended for all patients with migraine.
Keywords: migraine, monoclonal antibodies, chronic migraine, depression, fremanezumab, CGRP, misophonia, trypophobia.
For citation: Timokhovich A.Yu., Berdnikova A.V., Latysheva N.V. The impact of limbic sensitization on the efficacy of fremanezumab therapy in migraine patients. Clinical review for general practice. 2025; 6 (8): 32–39 (In Russ.). DOI: 10.47407/kr2025.6.8.00655
Введение
Мигрень является широко распространенным заболеванием, которым страдают около 1 млрд человек в мире [1]. Дебютируя в молодом возрасте, она значимо влияет на социальную жизнь, активность и работоспособность [2]. Помимо боли, при мигрени могут наблюдаться сопутствующие симптомы (зевота, усталость, фотофобия, фонофобия, тошнота, рвота, потливость, нарушения сна, когнитивная дисфункция, поведенческие нарушения, желудочно-кишечная дисфункция, повышенная чувствительность к боли), которые увеличивают бремя заболевания, снижают качество жизни и ухудшают течение мигрени [3]. Многие из этих неболевых симптомов возникают из-за дисфункции лимбической системы и проявляются на каждой фазе приступа мигрени, включая продромальную, иктальную и постдромальную фазы, а также в межиктальный период [4]. Дисфункция лимбической системы тесно связана с катастрофизацией и хронификацией мигрени и часто приводит к лекарственно-индуцированной головной боли (ГБ) [5].Известно, что большую роль в хронификации мигрени играют факторы, влияющие на лимбическую систему: чрезмерное использование анальгетиков, употребление кофеина, плохая гигиена сна, ожирение, неадекватное лечение острых приступов мигрени, отсутствие физических упражнений, женский пол, аллодиния, травмы головы, низкий социально-экономический статус, депрессия, тревожность, стрессовые жизненные события, посттравматический стресс и сопутствующие болевые расстройства [5, 6].
Лимбическая система передает и интегрирует множественные сигналы как от тела, так и от окружающей среды, фильтрует или производит генерацию эмоциональных, гомеостатических и когнитивных реакций [4]. К ее функциям относятся регуляция голода и жажды, сексуальное удовлетворение, реакция на боль, удовольствие и сенсорную информацию, в особенности от обонятельной системы [8]. Эта система также отвечает за контроль агрессивного или жестокого поведения, эмоций, таких как гнев и страх, и функций вегетативной нервной системы, которые включают регуляцию частоты пульса, артериального давления, дыхания и возбуждения [8]. Поскольку лимбическая система функционирует как «система сигнализации» мозга, она также может быть первой группой нейронов, которые распознают начало мозговой активности, связанной с мигренью [5].
Соматосенсорные нейронные сети, ответственные за возникновение боли во время приступов мигрени, проходят в основном через заднюю часть мозга, включая тригеминоцервикальный комплекс в стволе мозга, таламус и соматосенсорную кору [9]. В то же время сети, ответственные за лимбические особенности, в особенности эмоциональный компонент, расположены в средней (гипоталамус и передняя поясная кора), медиальной височной (миндалевидное тело и гиппокамп) и передней (префронтальная кора) частях мозга [4]. Отмечается, что у пациентов с мигренью и депрессией значительно увеличивается объем миндалевидного тела, и нейроны, экспрессирующие кальцитонин-ген-родственный пептид (CGRP) в парабрахиальном ядре, имеют решающее значение для передачи болевых сигналов в центральное ядро миндалины, что может видоизменять аффективные мотивационные аспекты боли [10]. В ряде исследований показано, что изменения объема миндалевидного тела коррелируют с частотой ГБ, но, в свою очередь, также могут быть связаны с выраженностью и длительностью симптомов депрессии [11, 12].
Клиническими маркерами, свидетельствующими о развитии лимбической сенситизации, являются такие состояния, как мизофония и трипофобия [13]. Под мизофонией подразумевается нетерпимость к звукам, таким как прием пищи рядом сидящего человека, зевота, глубокое дыхание, хруст пальцев, храп, кашель, шмыгание носом, т.е. звуки, не вызывающие негативной реакции при спокойном состоянии человека [14]. После воздействия триггера может развиться повышенная симпатическая активация (мышечное напряжение, увеличение частоты сердечных сокращений и изменение дермографизма), возможно появление чувства гнева, отвращения и беспокойства [15]. Такая ответная реакция может перейти в поведенческую или вербальную агрессию, а также в крайнее избегающее поведение стимула и, как наученный механизм реагирования, опосредованный через миндалину, гиппокамп и связь с префронтальной корой, сформировать по аналогии избегание боли при мигрени и страх приступа [16]. Есть данные о большой роли генетических факторов в развитии мизофонии [15].
У пациентов с мигренью и депрессией в сочетании с высокими показателями мизофонии в ответ на ГБ часто возникают чувство беспомощности, страха, усиление восприятия боли и катастрофизация приступов. Для таких пациентов характерен негативизм, особое внимание к деталям, в особенности связанным с негативным опытом, категоричность суждений, низкая комплаентность, стратегии избегания, плохое купирование приступов ГБ и злоупотребление анальгетиками. Механизмы развития более тяжелого течения мигрени у пациентов с мизофонией могут быть генетически обусловлены особенностями анатомического строения головного мозга при мизофонии (большее участие островковой зоны и передней поясной извилины и миндалевидного тела) и реализацией механизмов развития приступов не только через CGRP [17].
Трипофобия – это состояние, при котором у человека возникает сильное отвращение или страх при виде скопления мелких отверстий или углублений [18]. Данные литературы свидетельствует, что подобный страх может быть связан с эволюционными механизмами, направленными на избегание потенциальной опасности [19]. Симптомы трипофобии, как правило, можно разделить на три области, ассоциированные с сенсорными (например, ощущения «зуд», «ползание кожи»), когнитивными (например, «отвращение, отвращение или отвращение», «нелегкие») и вегетативными проявлениями (например, «тошнота, позывы на рвоту», «затрудненное дыхание») [19]. У пациентов с трипофобией при предъявлении провоцирующих стимулов отмечалось искажение когнитивной обработки стимулов с большим акцентом на эмоциональную их окраску, и, соответственно, такие люди отличаются большей чувствительностью к внешнему стрессу, более уязвимы и могут пытаться избегать трипофобных изображений и, таким образом, избежать сопутствующего дискомфорта [20].
Несмотря на успехи в разработке таргетной терапии мигрени, которой стали препараты анти-CGRP-моноклональных антител, эффект от лечения часто остается неполным. Это говорит о том, что механизмы, лежащие в основе мигрени, являются многофакторными как у разных пациентов, так и у каждого отдельно взятого пациента. Учитывая текущее состояние терапии мигрени и частое наличие коморбидных психических расстройств, требуется более целостный подход к лечению, нацеленный не только на купирование болевого синдрома, но и на иные механизмы, которые приводят к неболевым симптомам мигрени и сопутствующим заболеваниям, включая лимбическую сенситизацию.
Цель – изучение влияния лимбической сенситизации на течение мигрени и депрессии и эффективность таргетной терапии мигрени.
Материалы и методы
В исследовании приняли участие 80 пациентов с установленными диагнозами мигрени и депрессивного расстройства.Критерии включения:
• диагноз эпизодической мигрени или хронической мигрени в соответствии с критериями Международной классификации головной боли 3-го пересмотра [21];
• частота ГБ ≥8 дней в месяц;
• диагноз текущего депрессивного эпизода в соответствии с критериями Международной классификации болезней 10-го пересмотра [22];
• возраст от 18 до 65 лет;
• подписание информированного добровольного согласия на участие в исследовании.
Критерии исключения:
• наличие тяжелых соматических и неврологических заболеваний, хронических заболеваний в стадии декомпенсации;
• наличие тяжелых психических заболеваний;
• беременность или планирование ее на период, совпадающий с проведением исследования;
• прием психоактивных веществ (в том числе антидепрессантов, транквилизаторов и антипсихотиков).
Всем пациентам исходно проводились неврологическое обследование, сбор демографических и клинических характеристик и обучение заполнению дневника ГБ. На исходном визите и далее ежемесячно в течение 6 мес проводилось анкетирование с использованием шкалы депрессии Гамильтона [23], опросника центральной сенситизации (ЦС) [24], опросника трипофобии [25] и опросника мизофонии [26]. Пациентам проводилось подкожное введение фреманезумаба в дозировке 225 мг ежемесячно в течение 6 мес.
Статистический анализ проводился в программе
Microsoft Excel 2016 и на онлайн-ресурсах Statistics Kingdom и SocStatistic. Для обозначения статистически значимых различий между показателями (p<0,05) использовался символ «*».
Результаты
 В исследовании приняли участие 80 пациентов, преимущественно женского пола (n=72, 90%). Средний возраст составил 39,9±10,8 года. Медиана частоты ГБ составила 25 дней в месяц, медиана частоты мигрени – 12,5 дня в месяц. Исходный уровень депрессии по шкале депрессии Гамильтона составил 19,5 [15; 24] балла, что соответствует выраженной степени депрессии. Исходный уровень ЦС по опроснику ЦС составил 40 [30; 50], что соответствует клинически значимому уровню. Клинико-демографические данные пациентов и исходные показатели опросников депрессии, ЦС, мизофонии и трипофобии представлены в табл. 1.
В исследовании приняли участие 80 пациентов, преимущественно женского пола (n=72, 90%). Средний возраст составил 39,9±10,8 года. Медиана частоты ГБ составила 25 дней в месяц, медиана частоты мигрени – 12,5 дня в месяц. Исходный уровень депрессии по шкале депрессии Гамильтона составил 19,5 [15; 24] балла, что соответствует выраженной степени депрессии. Исходный уровень ЦС по опроснику ЦС составил 40 [30; 50], что соответствует клинически значимому уровню. Клинико-демографические данные пациентов и исходные показатели опросников депрессии, ЦС, мизофонии и трипофобии представлены в табл. 1.Динамика частоты ГБ
Исходное число дней ГБ в месяц составляло 25 [15; 30]. Через 1 мес лечения количество дней ГБ снизилось до 14 [8; 20], p<0,00001*. Через 2 мес лечения количество дней ГБ составило 10 [5,3; 18], по сравнению с исходным уровнем p<0,00001*. К 3-му месяцу лечения количество дней ГБ достигло 8 [4; 14], p<0,00001*, а к 6-му месяцу – 6,5 [3; 10], p<0,00001*. Таким образом, отмечается статистически значимое снижение количества дней ГБ на фоне лечения моноклональными антителами (мАТ) на 1, 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Данные представлены на рис. 1.
Динамика показателей депрессии
Показатели депрессии снизились ко 2-му месяцу лечения с 19,5 [15; 24] балла до 16 [11; 20], p<0,00001*, к 3-му – до 15 [8; 20], p<0,00001*, а к 6-му – до 13
[7; 16,8], p<0,00001*. Таким образом, отмечается статистически значимое снижение показателей уровня депрессии на фоне лечения мАТ на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Динамика показателей депрессии представлена на рис. 2.

Динамика показателей ЦС
Исходный уровень ЦС составил 40 [30; 50] баллов и ко 2-му месяцу лечения снизился до 30 [22; 42], p<0,00001*, что является показателем ниже порогового для определения ЦС как клинически значимой (40 баллов). Через 3 мес лечения уровень ЦС составил 28 [20; 40], p<0,00001*, через 6 мес лечения – 24 [16; 38] по сравнению с исходным уровнем; p<0,00001*. Таким образом, отмечается статистически значимое снижение уровня ЦС на фоне лечения мАТ на 2, 3 и 6-м месяцах лечения по сравнению с исходным уровнем. Данные представлены на рис. 3.
Динамика показателей мизофонии и трипофобии
 Отмечалось статистически значимое снижение уровня мизофонии по сравнению с исходным уровнем: 4 [0; 10], p<0,00001* через 2 мес лечения; 4 [0; 10], p<0,00001* через 3 мес лечения; 4 [0; 8], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 4.
Отмечалось статистически значимое снижение уровня мизофонии по сравнению с исходным уровнем: 4 [0; 10], p<0,00001* через 2 мес лечения; 4 [0; 10], p<0,00001* через 3 мес лечения; 4 [0; 8], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 4.Отмечалось статистически значимое снижение уровня трипофобии по сравнению с исходным уровнем: 19 [17; 22], p=0,0004* через 2 мес лечения; 19 [17; 20,8], p=0,0001* через 3 мес лечения; 19 [17; 20], p<0,00001* через 6 мес лечения. Динамика показателей представлена на рис. 5.
Респондеры и нон-респондеры
Три месяца леченияГБ уредилась менее чем на 30% у 12 (15%) пациентов, соответственно, урежение ГБ ≥30% отмечалось у 68 (85%) человек. Урежение ГБ ≥50% отмечалось у 51 (63,8%) пациента.
Показатели депрессии значимо снизились как у респондеров (урежение ГБ ≥50%), так и у нон-респондеров (урежение ГБ <50%). При этом как на исходном уровне, так и через 3 мес лечения показатели депрессии были значимо выше у группы нон-респондеров по сравнению с группой респондеров. Данные представлены в табл. 2.

При оценке снижения баллов депрессии в процентном соотношении (≥30% и <30%) отмечалось статистически значимое преобладание пациентов со снижением показателей депрессии ≥30% в группе респондеров (табл. 3).
Шесть месяцев лечения
ГБ уредилась менее чем на 30% у 8 (10%) пациентов, соответственно, урежение ГБ ≥30% отмечалось у 72 (90%) человек. Урежение ГБ ≥50% отмечалось у 56 (70%).
Показатели депрессии значимо снизились как у респондеров (урежение ГБ ≥50%), так и у нон-респондеров (урежение ГБ <50%). На исходном уровне показатели депрессии между группами не имели статистически значимой разницы, через 6 мес лечения показатели депрессии были значимо выше у группы нон-респондеров по сравнению с группой респондеров. Данные представлены в табл. 4.
При оценке снижения баллов депрессии в процентном соотношении отмечалось статистически значимое преобладание пациентов со снижением показателей депрессии ≥30% в группе респондеров (табл. 5).
Корреляционные связи
При оценке корреляции между исходным уровнем мизофонии и снижением частоты ГБ были получены следующие результаты:• через 1 мес лечения отмечалась статистически незначимая слабая положительная корреляция, rs=0,09, p=0,41;
• через 3 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,2, p=0,048*, что означает меньшее снижение частоты ГБ у пациентов с более высоким исходным уровнем мизофонии;
• через 6 мес лечения отмечалась статистически незначимая слабая отрицательная корреляция, rs=-0,02, p=0,07.
При оценке корреляции между исходным уровнем трипофобии и снижением частоты ГБ были получены следующие результаты:
• через 1 мес лечения отмечалась статистически незначимая слабая отрицательная корреляция, rs=-0,02, p=0,88;
• через 3 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,26, p=0,017*, что означает меньшее снижение частоты ГБ у пациентов с более высоким уровнем трипофобии;
• через 6 мес лечения отмечалась статистически значимая слабая отрицательная корреляция, rs=-0,26, p=0,02*, что означает меньшее снижение частоты ГБ у пациентов с более высоким уровнем трипофобии.
При оценке взаимосвязи между исходным количеством дней ГБ и мизофонией отмечалась статистически значимая умеренная положительная корреляция (rs=0,48, pp<0,0001*), а при оценке взаимосвязи с трипофобией – статистически значимая слабая положительная корреляция (rs=0,25, p=0,02*), что означает соответствие более высоких показателей мизофонии и трипофобии более высокой частоте ГБ.
Отмечались статистически значимая умеренная положительная корреляция (rs=0,48, p<0,0001*) между исходным уровнем депрессии и исходным уровнем мизофонии и статистически значимая умеренная положительная корреляция (rs=0,43, p<0,0001*) между исходным уровнем депрессии и исходным уровнем трипофобии.
Отмечалась статистически значимая умеренная положительная корреляция (rs=0,43, p<0,0001*) между исходным уровнем ЦС и исходным уровнем мизофонии и статистически значимая умеренная положительная корреляция (rs=0,38, p=0,0005*) между исходным уровнем ЦС и исходным уровнем трипофобии.
Мизофония и трипофобия как предикторы ответа на терапию
В качестве параметра, определяющего эффективность лечения, было принято снижение количества дней ГБ ≥50%. Данные о влиянии исходного уровня мизофонии и трипофобии на исход лечения представлены в табл. 6, 7.

Обсуждение
Известно, что течение мигрени ухудшается при наличии сопутствующей депрессии [27]. Кроме этого, в ряде исследований было показано, что мАТ к СGRP показали свою эффективность по снижению депрессии вне зависимости от снижения количества дней с ГБ [28, 29].В связи с этим представляется интересным изучение возможных механизмов подобного эффекта, так как механизмы депрессии реализуются не за счет системы CGRP, а за счет иных путей, в том числе посредством вовлечения нейротрансмиттерных систем лимбической системы [30].
В нашем исследовании в первую очередь была продемонстрирована эффективность фреманезумаба в лечении мигрени за 6 мес терапии и оценены группы респондеров и нон-респондеров, что позволило дополнительно проанализировать взаимосвязь эффективности лечения мигрени и снижения показателей депрессии. Кроме этого, было отмечено значимое снижение показателей депрессии в течение курса лечения.
При этом представляет интерес тот факт, что как через 3, так и через 6 мес лечения в обеих группах (респондеры и нон-респондеры) отмечалось статистические значимое улучшение депрессии. При этом показатели депрессии в группе нон-респондеров оказались значимо выше по сравнению с показателями в группе респондеров на фоне лечения, т.е. снижались несколько медленнее, чем у пациентов, показавших хороший ответ на терапию фреманезумабом. По аналогии с делением пациентов на респондеров и нон-респондеров в зависимости от процентного снижения частоты ГБ нами было проведено разделение пациентов на две группы в зависимости от процентного снижения показателей депрессии – группа со снижением <30% и группа со снижением ≥30%. Анализ полученных данных показал, что в группе нон-респондеров по ГБ как через 3, так и через 6 мес отмечалось значимое преобладание пациентов, снижение депрессии у которых составило <30%. Кроме того, выявлены пациенты (4 пациента через 3 мес терапии и 7 пациентов через 6 мес терапии), у которых отмечено снижение уровня депрессии при отсутствии урежения ГБ. Таким образом, ответ на терапию фреманезумабом может зависеть в том числе от выраженности снижения уровня депрессии у пациентов.
В нашем исследовании было показано, что более высокие исходные показатели мизофонии и трипофобии ассоциированы с более частыми приступами мигрени и более выраженной степенью депрессии. При этом на фоне лечения фреманезумабом показано, что более высокие показатели мизофонии и трипофобии влияют на худший исход лечения к 3 и 6-му месяцу терапии, что позволяет сделать вывод о влиянии лимбической сенситизации на течение мигрени. Генерализованная гиперчувствительность к аверсивным стимулам, свидетельствующая о развитии лимбической сенситизации, может быть как врожденной особенностью пациентов с мигренью, так и следствием изменений, произошедших за время развития мигрени в течение жизни пациента [31].
Стоит акцентировать внимание на том, что мигрень – это заболевание, имеющее как болевые, так и неболевые проявления, а также коморбидные заболевания, и в основе как мигрени, так и сопутствующих состояний лежит тесное переплетение различных механизмов, оказывающих друг на друга влияние. Известно, что одним из ключевых белков, играющих роль в развитии нейрогенного воспаления и непосредственно боли, является CGRP, ставший таргетной молекулой для лечения препаратами мАТ [32]. Вместе с этим большую роль в развитии неболевых проявлений играет лимбическая система, что в особенности выражено при хронизации мигрени [4]. В свою очередь, известно, что в основе хронизации мигрени лежит развитие ЦС, которая нарушает регуляцию нейронов лимбической системы, при этом степень выраженности ЦС коррелирует с выраженностью симптомов депрессии при мигрени [33].
Из литературы известно взаимодействие между CGRP-ергическими путями и серотонинергическими структурами лимбической системы [34], и результаты исследования Y. Yang и соавт. [35] продемонстрировали возможность того, что система CGRP играет роль в опосредовании поведения, контролируемого лимбической системой, по крайней мере частично, через прямое воздействие на серотонинергические нейроны ядра шва.
С момента выхода препаратов анти-CGRP-мАТ проводились множественные исследования по оценке возможных предикторов ответа на терапию и неоднократно была показана зависимость более низкого эффективного лечения от более высокого исходного уровня депрессии у пациентов с мигренью [36]. Однако изучение состояний, ассоциированных с лимбической сенситизацией при мигрени, как потенциальных предикторов положительного или отрицательного ответа на терапию ранее не проводились. Нами впервые была проведена оценка мизофонии и трипофобии методом логистической регрессии как прогностических показателей при лечении мигрени препаратами анти-CGRP-мАТ. Полученные результаты показали, что исходный уровень как мизофонии, так и трипофобии является негативным прогностическим фактором – чем выше были исходные показатели выраженности данных состояний, тем ниже была эффективность терапии как к 3, так и к 6-му месяцу лечения. Полученные результаты представляют большой научный интерес, так как наличие лимбической сенситизации и ее маркеров, таких как мизофония и трипофобия, у пациентов с мигренью является известным фактом, однако крупных исследований по изучению корреляции данных состояний с мигренью не проводилось [37, 13], а появление таргетной терапии мигрени ставит новые задачи по исследованию не только болевых, но и неболевых проявлений мигрени, а также их потенциальной связи с эффективностью лечения.
Выводы
Лимбическая система пациентов с мигренью, по-видимому, постоянно задействована в ходе заболевания, даже когда классическая тригеминальная система находится в состоянии покоя. Симптомы и сопутствующие заболевания, опосредованные лимбической системой, способствуют хронизации мигрени и влияют на качество жизни пациента и удовлетворенность лечением, а также определяют поведенческие паттерны пациентов. Рекомендуется проводить скрининг на наличие сопутствующих факторов у всех пациентов с мигренью, особенно в рефрактерных случаях, и учитывать эти факторы при диагностическом и терапевтическом планировании. Выявление индивидуальных патофизиологических механизмов, лежащих в основе сопутствующих симптомов или состояний, позволит индивидуализировать и соответствующим образом скорректировать лечение пациентов. Отмечена худшая эффективность лечения в группе пациентов с хронической мигренью и депрессией при наличии мизофонии. Внимание следует уделять выявлению специфических фобий, как предиктора развития стратегий избегания при лечении мигрени. Вероятно, стоит изначально начинать терапию у таких пациентов с использованием препаратов, влияющих на серотонинергическую систему, или комбинированной терапии с использованием психотерапевтических методик. Также необходимо уделять больше внимания психообразованию, обучению пациентов и, возможно, более частому применению приемов формирования позитивного подкрепления и коррекции избегающего поведения у пациентов с мигренью.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Тимохович Анна Юрьевна – врач-невролог, клиника проф. Кинзерского. E-mail: dr.timohovich@kinzerskiy.clinic; ORCID: 0009-0005-2076-7668
Anna Yu. Timokhovich – neurologist, Сlinic of Professor Kinzersky. E-mail: dr.timohovich@kinzerskiy.clinic; ORCID: 0009-0005-2076-7668
Бердникова Анна Владимировна – канд. мед. наук, ассистент каф. нервных болезней Института профессионального образования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), Клиника головной боли и вегетативных расстройств им. акад. Александра Вейна. E-mail: asimcin@mail.ru; ORCID: 0000-0002- 4447-2152
Anna V. Berdnikova – Cand. Sci. (Med.), Аssistant, Sechenov First Moscow State Medical University (Sechenov University), Alexander Vein Headache Clinic. E-mail: asimcin@mail.ru; ORCID: 0000-0002-4447-2152
Латышева Нина Владимировна – д-р мед. наук, доц., проф. каф. нервных болезней Института профессионального образования ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), Клиника головной боли и вегетативных расстройств им. акад. Александра Вейна. E-mail: ninalat@gmail.com; ORCID: 0000-0001-9600-5540
Nina V. Latysheva – Dr. Sci. (Med.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University), Alexander Vein Headache Clinic. E-mail: ninalat@gmail.com; ORCID: 0000-0001-9600-5540
Поступила в редакцию: 12.08.2025
Поступила после рецензирования: 18.08.2025
Принята к публикации: 21.08.2025
Received: 12.08.2025
Revised: 18.08.2025
Accepted: 21.08.2025
Список исп. литературыСкрыть список1. Ashina M. Migraine. N Engl J Med 2020;383(19):1866-76.
2. Buse DC, Fanning KM, Reed ML et al. Life With Migraine: Effects on Relationships, Career, and Finances From the Chronic Migraine Epidemiology and Outcomes (CaMEO) Study. Headache 2019;59(8):1286-99.
3. Martelletti P, Schwedt TJ, Lanteri-Minet M et al. My Migraine Voice survey: a global study of disease burden among individuals with migraine for whom preventive treatments have failed. J Headache Pain 2018;19(1):115.
4. Chung C-S, Schwedt TJ. The under-recognized but essential role of the limbic system in the migraine brain: a narrative review. Precis Future Med 2018;6(1):2-8.
5. Schwedt TJ, Alam A, Reed ML et al. Factors associated with acute medication overuse in people with migraine: results from the 2017 migraine in America symptoms and treatment (MAST) study. J Headache Pain 2018;19(1):38.
6. Bigal ME, Lipton RB. What predicts the change from episodic to chronic migraine? Curr Opin Neurol 2009;22(3):269-76.
7. O'Carroll CP. Migraine and the limbic system: closing the circle. Psychopharmacol Bull 2007;40(4):12-23.
8. Maizels M, Aurora S, Heinricher M. Beyond neurovascular: migraine as a dysfunctional neurolimbic pain network. Headache 2012;52(10) :1553-65.
9. Dodick DW. Migraine. Lancet 2018;391(10127):1315-30.
10. Chou TM, Lee ZF, Wang SJ et al. CGRP-dependent sensitization of PKC-δ positive neurons in central amygdala mediates chronic migraine. J Headache Pain 2022;23(1):157.
11. Liu HY, Chou KH, Lee PL et al. Hippocampus and amygdala volume in relation to migraine frequency and prognosis. Cephalalgia 2017;37(14):1329-36.
12. Zavorotnyy M, Zöllner R, Schulte-Güstenberg LR et al. Low left amygdala volume is associated with a longer duration of unipolar depression. J Neural Transm (Vienna) 2018;125(2):229-38.
13. Eross E. Potential Clinical Evidence for Limbic System Sensitization in Migraine. Neurology 2020;94(15_suppl).
14. Vitoratou S, Uglik-Marucha N, Hayes C et al. Item Response Theory Investigation of Misophonia Auditory Triggers. Audiol Res 2021;11(4):567-81.
15. Ferrer-Torres A, Giménez-Llort L. Misophonia: A Systematic Review of Current and Future Trends in This Emerging Clinical Field. Int J Environ Res Public Health 2022;19(11):6790.
16. Andermane N, Bauer M, Simner J, Ward J. A symptom network model of misophonia: From heightened sensory sensitivity to clinical comorbidity. J Clin Psychol 2023;79(10):2364-87.
17. Siepsiak M, Dragan W. Misophonia – a review of research results and theoretical concepts. ]Mizofonia – przegląd badań i głównych koncepcji teoretycznych[. Psychiatr Pol 2019;53(2):447-58.
18. Cole GG, Wilkins AJ. Fear of holes. Psychol Sci 2013;24(10):1980-5.
19. Imaizumi S, Furuno M, Hibino H, Koyama S. Trypophobia is predicted by disgust sensitivity, empathic traits, and visual discomfort. Springerplus 2016;5(1):1449.
20. Wabnegger A, Schwab, D, Schienle A. The hole story: an event-related potential study with trypophobic stimuli. Motiv Emot 2019;43:985-92.
21. Headache classification committee of the International Headache Society (IHS) The International classification of Headache disorders, 3rd edition. Cephalalgia 2018;38(1):1-211.
22. Международная классификация болезней 10-го пересмотра. Режим доступа: https://mkb-10.com/
International Classification of Diseases, 10th revision. Access mode: https://mkb-10.com/ (in Russian).
23. Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry 1960;23(1):56-62.
24. Mayer TG, Neblett R, Cohen H et al. The development and psychometric validation of the central sensitization inventory. Pain Pract 2012;12(4):276-85.
25. Le AT, Cole GG, Wilkins AJ. Assessment of trypophobia and an analysis of its visual precipitation. Q J Exp Psychol (Hove) 2015;68(11):2304-22.
26. Dozier TH. Counter conditioning treatment for misophonia. Clin Case Stud 2015;14(5):374-87.
27. Buse DC, Silberstein SD, Manack AN et al. Psychiatric comorbidities of episodic and chronic migraine. J Neurol 2013;260(8):1960-9.
28. De Vries Lentsch S, van der Arend BWH, de Boer I et al. Depression and treatment with anti-calcitonin gene related peptide (CGRP) (ligand or receptor) antibodies for migraine. Eur J Neurol 2024;31(2):e16106.
29. Torres-Ferrús M, Gallardo VJ, Alpuente A et al. Improvement of migraine depressive symptoms is not related to headache frequency: exploring the impact of anti-CGRP therapies. Cephalalgia 2024;44(2):3331024231222923.
30. Lemke H, Probst S, Warneke A et al. The Course of Disease in Major Depressive Disorder Is Associated With Altered Activity of the Limbic System During Negative Emotion Processing. Biol Psychiatry Cogn Neurosci Neuroimaging 2022;7(3):323-32.
31. Wilcox SL, Veggeberg R, Lemme J et al. Increased Functional Activation of Limbic Brain Regions during Negative Emotional Processing in Migraine. Front Hum Neurosci 2016;(10):366.
32. Dodick DW. A Phase-by-Phase Review of Migraine Pathophysiology. Headache 2018;58(Suppl.1):4-16.
33. Suzuki K, Haruyama Y, Kobashi G et al. Central Sensitization in Neurological, Psychiatric, and Pain Disorders: A Multicenter Case-Controlled Study. Pain Res Manag 2021;(2021):6656917.
34. Zhang RH, Zhang XB, Lu YB et al. Calcitonin gene-related peptide and brain-derived serotonin are related to bone loss in ovariectomized rats. Brain Res Bull 2021;(176):85-92.
35. Yang YT, Romero-Leguizamón CR, Sheykhzade M et al. Calcitonin gene-related peptide (CGRP) exerts membrane, cellular and synaptic actions on serotonergic dorsal raphe neurons ex vivo: Functional implications for a role in dorsal raphe-controlled functions. Neuropharmacology 2025;(273):110457.
36. Hong JB, Lange KS, Overeem LH et al. A Scoping Review and Meta-Analysis of Anti-CGRP Monoclonal Antibodies: Predicting Response. Pharmaceuticals (Basel) 2023;16(7):934.
37. Sahin A, Cakir S, Aydinlar EI et al. Assessing Misophonia as a Potential Comorbidity in Migraine Patients Compared to Controls: A Cross-sectional Study. Front Neurol 2025;(16):1545520.
22 сентября 2025
Количество просмотров: 224