Клинический разбор в общей медицине №9 2025
Клинический разбор в общей медицине №9 2025
Коморбидные маски эндометриоза
Номера страниц в выпуске:6-11
Аннотация
Эндометриоз по-прежнему остается одной из наиболее интересных и вместе с тем недостаточно изученных гинекологических нозологий во всем мире. Данные современных эпидемиологических исследований демонстрируют, что динамика заболеваемости эндометриозом скоро приобретет пандемийный характер и будет затрагивать до 1 млрд женщин репродуктивного возраста на планете. Одна из главных проблем эндометриоза на современном этапе – длительная диагностика, причиной которой является недооценка атипичных и коморбидных состояний, ассоциированных с эндометриозом. В этой связи важно рассмотреть современные доказанные нозологические ассоциации эндометриоза с другими коморбидностями и атипичными алгологическими симптомами, а также отметить современные стратегии эффективной и патогенетически оправданной терапии заболевания.
Ключевые слова: эндометриоз, атипичные симптомы, коморбидность, патогенетическая терапия, диеногест.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Коморбидные маски эндометриоза. Клинический разбор в общей медицине. 2025; 6 (9): 6–11. DOI: 10.47407/kr2025.6.9.00667
Эндометриоз по-прежнему остается одной из наиболее интересных и вместе с тем недостаточно изученных гинекологических нозологий во всем мире. Данные современных эпидемиологических исследований демонстрируют, что динамика заболеваемости эндометриозом скоро приобретет пандемийный характер и будет затрагивать до 1 млрд женщин репродуктивного возраста на планете. Одна из главных проблем эндометриоза на современном этапе – длительная диагностика, причиной которой является недооценка атипичных и коморбидных состояний, ассоциированных с эндометриозом. В этой связи важно рассмотреть современные доказанные нозологические ассоциации эндометриоза с другими коморбидностями и атипичными алгологическими симптомами, а также отметить современные стратегии эффективной и патогенетически оправданной терапии заболевания.
Ключевые слова: эндометриоз, атипичные симптомы, коморбидность, патогенетическая терапия, диеногест.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Коморбидные маски эндометриоза. Клинический разбор в общей медицине. 2025; 6 (9): 6–11. DOI: 10.47407/kr2025.6.9.00667
Review
Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Endometriosis still remains one of the most interesting but poorly understood disease entities in the world. The current epidemiological research data demonstrate that the endometriosis incidence rate will soon become somewhat of a pandemic and will affect up to 1 billion of fertile age women on the globe. At the same time, one of the main problems of endometriosis at present is underestimation of the endometriosis-associated atypical conditions and comorbidities. In this regard, it is important to consider modern, proven nosological associations of endometriosis with other comorbidities and atypical algological symptoms, as well as to note modern strategies for the effective and pathogenetically substantiated disease therapy.
Keywords: endometriosis, atypical symptoms, comorbidity, pathogenetic therapy, dienogest.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Comorbid masks of endometriosis. Clinical review for general practice. 2025; 6 (9): 6–11 (In Russ.). DOI: 10.47407/kr2025.6.9.00667
 Выбор женщин в пользу карьеры и самореализации привел к «сдвигу» возраста рождения первого ребенка и увеличению периода избыточного воздействия эстрогенов. Все это способствует парадоксальному росту заболеваемости эндометриозом, который в настоящее время затрагивает около 10% или 190 млн женщин репродуктивного возраста по всему миру [3]. Однако и эти «классические» данные являются заниженными: согласно имеющимся прогнозам в ближайшее время число женщин репродуктивного возраста с эндометриозом превысит 1 млрд, что составит около 12,5% от всего населения планеты [4–6]! Вместе с тем наиболее типичными проявлениями эндометриоза являются хроническая тазовая боль и бесплодие: у данных групп пациенток эндометриоз верифицируется в 80 и 47% случаев соответственно [7, 8]. Однако проблемой в проблеме остается длительный период диагностики эндометриоза, который, по данным последних исследований, в настоящее время достигает 11 лет [9, 10]. Несмотря на тысячи исследований, десятки международных гайдлайнов и активную просветительскую работу, эндометриоз по-прежнему сохраняет грани латентности и скрытости. Важно отметить, что наиболее часто эндометриоз «зарождается» в подростковом возрасте, однако в связи со стигматизацией проблем, связанных с репродуктивной системой, и принятие девушками дисменореи как вариант нормы эндометриоз долгое время остается недиагностированным [11]. Весьма интересные данные были получены в ходе исследования P. Giglio
Выбор женщин в пользу карьеры и самореализации привел к «сдвигу» возраста рождения первого ребенка и увеличению периода избыточного воздействия эстрогенов. Все это способствует парадоксальному росту заболеваемости эндометриозом, который в настоящее время затрагивает около 10% или 190 млн женщин репродуктивного возраста по всему миру [3]. Однако и эти «классические» данные являются заниженными: согласно имеющимся прогнозам в ближайшее время число женщин репродуктивного возраста с эндометриозом превысит 1 млрд, что составит около 12,5% от всего населения планеты [4–6]! Вместе с тем наиболее типичными проявлениями эндометриоза являются хроническая тазовая боль и бесплодие: у данных групп пациенток эндометриоз верифицируется в 80 и 47% случаев соответственно [7, 8]. Однако проблемой в проблеме остается длительный период диагностики эндометриоза, который, по данным последних исследований, в настоящее время достигает 11 лет [9, 10]. Несмотря на тысячи исследований, десятки международных гайдлайнов и активную просветительскую работу, эндометриоз по-прежнему сохраняет грани латентности и скрытости. Важно отметить, что наиболее часто эндометриоз «зарождается» в подростковом возрасте, однако в связи со стигматизацией проблем, связанных с репродуктивной системой, и принятие девушками дисменореи как вариант нормы эндометриоз долгое время остается недиагностированным [11]. Весьма интересные данные были получены в ходе исследования P. Giglio
Ayers и соавт. (2024), включавшего более 6 тыс. женщин и продемонстрировавшего, что средний возраст диагностирования заболевания составил 39 лет, в то время как в более молодой когорте пациенток заболевание верифицировалось значительно реже (p<0,0005) [12]. Подобные расхождения эпидемиологических данных обусловлены одной из главных проблем эндометриоза на современном этапе – длительным временем диагностики заболевания. При этом, согласно другим имеющимся данным, задержка диагностирования эндометриоза может достигать и 13 лет [13]. Исходя из этого, важно отметить данные, полученные в ходе систематического обзора S. Lukac и соавт. (2024), определяющие причины столь длительного периода диагностики заболевания [13]:
– обращение за помощью к непрофильным специалистам;
– использование анальгетиков без верификации причин дисменореи;
– принятие дисменореи как нормы;
– стигматизация менструального цикла в семье;
– неверно выставленный диагноз;
– недостаточная осведомленность врачей других специальностей об эндометриозе;
– атипичная клиническая симптоматика.
Вместе с тем наиболее интересной причиной длительного диагностирования является атипичная клиническая симптоматика, которую многие клиницисты могут не учитывать. В этой связи необходимо рассмотреть современные атипичные проявления эндометриоза и отметить его коморбидные ассоциации, суммация которых позволит заподозрить и вовремя выставить правильный диагноз.
Коморбидные маски эндометриоза: как их распознать?
Безусловно, основой клинической картины эндометриоза являются алгологические симптомы: «4Д» (дисменорея, дисхезия, дизурия, диспареуния) и хроническая тазовая боль. При этом в настоящее время доказано, что частота и, самое главное, тяжесть основных алгологических симптомов у пациенток с верифицированным эндометриозом в 2 раза выше, чем у женщин в общей популяции (88,9% против 48,7%; р<0,0001) [14]. Однако результаты последних научных работ демонстрируют высокую частоту развития генерализованного эндометриоз-ассоциированного алгологического синдрома. Так, по данным исследования P. Thiel и соавт. (2024), были доказаны прочные взаимосвязи между эндометриозом, классической «пятеркой» тазовой боли, а также рядом атипичных алгологических симптомов, включая боль [15]:
– за грудиной;
– в нижних конечностях, верхней части спины, груди, внутренней поверхности бедер;
– уретре, паховой области и крестце;
– бедре, ягодицах, пояснице, вульве или промежности;
– подлопаточной области;
– эпигастрии;
– правом подреберье.
Вместе с тем в настоящее время в мировой научной библиотеке опубликован ряд данных, доказывающих наличие прямых и косвенных ассоциаций эндометриоза не только с атипичными алгологическими симптомами, но и с рядом нозологий. Исходя из этого, клиницисту принципиально важно верно оценивать персонифицированные риски у каждой конкретной пациентки. В этой связи мы представляем «сводку» доказанных коморбидных ассоциаций эндометриоза на основе результатов последних научных данных, к которым относятся [16]:
– артериальная гипертония;
– дислипидемия;
– ишемическая болезнь сердца;
– цереброваскулярные заболевания;
– гипотиреоз;
– фибромиалгия;
– синдром хронической усталости;
– аутоиммунные заболевания;
– аллергия;
– бронхиальная астма.
Особая роль среди коморбидностей эндометриоза, безусловно, отводится сердечно-сосудистым заболеваниям. Так, по данным исследования J.M. Smyk и соавт. (2024), было доказано, что эндометриоз ассоциирован с развитием генерализованной эндотелиальной дисфункции (p=0,027), накоплением продуктов гликации в коже, отражающих повышение артериальной жесткости (p=0,013), а также снижением индекса реактивной гиперемии (p=0,037) [17]. При этом данные нарушения подтвердили свою клиническую значимость в исследовании M.A. Pabon и соавт. (2024), по результатам которого было выявлено, что эндометриоз приводит к развитию генерализованного хронического воспаления и оксидативного стресса, провоцирующих эндотелиальную дисфункцию, которые, в свою очередь, ассоциированы с повышением риска реализации аритмии (относительный риск – ОР 1,21, 95% доверительный интервал – ДИ 1,17–1,25) и сердечной недостаточности (ОР 1,11, 95%ДИ 1,05–1,18) [18].
Закономерным результатом всех отмеченных алгологических и коморбидных «масок» эндометриоза является мультимодальное снижение качества жизни у всех пациенток по данным ряда последних научных исследований, представленных ниже.
По данным исследования E.B. Arslan и соавт. (2024), включавшего 420 женщин с верифицированным эндометриозом, выявлено, что у данной когорты пациенток баллы в доменах, связанных с болью и физической активностью по шкале оценки качества жизни SF-36, оказались значимо ниже (p<0,05) [19].
Согласно результатам исследования F.P. Silva и соавт. (2024), включавшего 229 женщин с эндометриозом, разделенных на 4 группы (1-я группа – без бесплодия и без боли; 2-я группа – с болью без бесплодия; 3-я группа – с бесплодием без боли; 4-я группа – с бесплодием и болью), доказано, что у пациенток с эндометриоз-ассоциированной тазовой болью отмечались более высокие показатели тревоги и депрессии, а также значительное общее снижение качества жизни (p<0,001). Кроме того, было выявлено, что у всех пациенток отмечалось выраженное снижение качества сексуальной жизни без значимых различий между группами (p=0,671) [20].
По данным перекрестного исследования L. Van Niekerk и соавт. (2024), включавшего 210 пациенток с предшествующим хирургическим лечением эндометриоза, выявлены низкие показатели качества жизни по шкале HRQoL особенно у женщин с болевым синдромом тяжелой степени, а также снижение качества сексуальной жизни по шкале FSFI по всем доменам (желание, возбуждение, лубрикация, оргазмическая функция, удовлетворенность, боль) [21].
Таким образом, в настоящее время доказано, что эндометриоз проявляется не только классическими симптомами, такими как тазовая боль и бесплодие, но и другими атипичными алгологическими симптомами и коморбидными заболеваниями, учет которых в ходе клинического менеджмента позволит повысить точность диагностики и сократить период диагностического поиска с целью своевременного назначения патогенетической терапии.
Достижения патогенетической терапии эндометриоза
Важно отметить, что в настоящее время основными методами лечения эндометриоза являются медикаментозный и хирургический, каждый из которых обладает своими преимуществами и «слабыми местами». Согласно данным отечественных рекомендаций (2024) и международного гайдлайна ESHRE (2022), отмеченные методы лечения эндометриоза не должны противопоставляться, а решение клинициста должно быть строго персонифицированным [22, 23]. Однако необходимо помнить, что хирургическое лечение без его сочетания с фармакологической поддержкой не является состоятельным, а после операции обязательно должна следовать превентивная противорецидивная фармакотерапия. Вместе с тем современные рекомендации включают следующий перечень фармакологических средств для лечения эндометриоза [22–24]:
– нестероидные противовоспалительные препараты: в качестве симптоматического лечения эндометриоз-ассоциированной тазовой боли. Данные препараты используются до трех месяцев в связи с высоким риском ульцерогенеза;
– гестагены;
– агонисты гонадотропин-рилизинг-гормона (аГнРГ): являются препаратами с доказанным патогенетически оправданным эффектом в лечении эндометриоза, однако они обладают низким профилем безопасности за счет развития выраженной гипоэстрогении и впоследствии – лекарственной менопаузы. В этой связи их использование более 6 мес должно обязательно сопровождаться назначением add-back-терапии. Еще один недостаток данной группы препаратов – наличие короткого периода стимуляции гипофиза, во время которой может провоцироваться рост гетеротопий и снижаться эффективность лечения;
– антагонисты гонадотропин-рилизинг-гормона (антГнРГ): главным преимуществом данных препаратов является отсутствие фазы стимуляции гипофиза, а также более благоприятный профиль безопасности;
– даназол: является представителем группы антигонадотропинов и производным 17α-этинилэстрадиола. За счет блокады выброса лютеинизирующего гормона и стероидогенеза в яичниках его использование ассоциировано с повышением концентрации тестостерона и развитием симптомов гиперандрогении, из-за чего данный препарат относится к 3-й линии лекарственной терапии эндометриоза после гестагенов и аГнРГ.
Несмотря на широкий спектр лекарственных препаратов для лечения эндометриоза, группой, обладающей наиболее благоприятным профилем безопасности и патогенетическим механизмом действия, безусловно, являются прогестагены. При этом единственным прогестином, обладающим широким спектром таргетных патогенетически оправданных свойств именно в терапии эндометриоза является диеногест (Зафрилла). Согласно имеющимся данным, доказанными эффектами диеногеста в патогенетической терапии эндометриоза являются [25]:
1) снижение выживаемости клеток гетеротопических очагов через 48 ч после обработки клеточных культур диеногестом (p<0,005);
2) снижение соотношения фосфорилированной и дефосфорилированной протеинкиназы B (pAKT/AKT), демонстрирующее снижение пролиферативной активности клеток гетеротопических очагов эндометрия (p<0,005);
3) снижение экспрессии сосудистого эндотелиального фактора роста (p<0,005);
4) антагонистический эффект с фактором некроза опухолей за счет снижения выживаемости клеток (p<0,005);
5) антагонистический эффект с интерлейкином-1β за счет снижения выживаемости клеток (p<0,005);
6) снижение объема гетеротопий (с 53,70 до 21,46 мм3, p<0,005).
Таким образом, важно резюмировать, что диеногест, в отличие от других гестагенов, реализует ряд патогенетически оправданных эффектов, включая антипролиферативный, антиангиогенный и противовоспалительный.
В этой связи важно отметить, что данные уникальные свойства диеногеста (Зафрилла) наилучшим образом зарекомендовали его в качестве золотого стандарта патогенетической терапии эндометриоза, что подтверждается данными ряда клинических исследований, согласно результатам которых в настоящее время доказано, что:
– диеногест обладает наибольшим боль-редуцирующим эффектом в сравнении с другими гестагенами и аГнРГ, включая дисменорею, хроническую тазовую боль, диспареунию и дисхезию (p<0,00001) [26–31];
– диеногест значимо снижает объем менструальной кровопотери (p<0,05) [26, 31];
– диеногест значимо снижает размер эндометриоидных гетеротопий [30];
– диеногест снижает объем эндометриоидных кист яичников на 55% [32];
– диеногест способствует значимому снижению частоты постоперационных рецидивов эндометриоза (p<0,0001) [28].
Исходя из всего вышесказанного, важно отметить, что в настоящее время диеногест (Зафрилла) является уникальным терапевтическим инструментом с рядом доказанных и выгодных патогенетически оправданных свойств, а также наилучшим профилем безопасности среди всех вариантов фармакотерапии эндометриоза.
В настоящее время в арсенале современного клинициста имеется множество вариантов фармакотерапии, однако наиболее благоприятным как с точки зрения патогенетической эффективности, так и благоприятного профиля безопасности являются гестагены, наиболее «выигрышным» из которых является диеногест (Зафрилла). Согласно имеющимся научным данным, доказано, что диеногест обладает наибольшим количеством патогенетически оправданных и таргетных свойств в отношении фармакотерапии эндометриоза, которые позволят не только эффективно редуцировать гетеротопии, но и предотвратить развитие рецидивов в дальнейшем.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Поступила в редакцию: 21.08.2025
Поступила после рецензирования: 02.09.2025
Принята к публикации: 04.09.2025
Received: 21.08.2025
Revised: 02.09.2025
Accepted: 04.09.2025
Comorbid masks of endometriosis
Mekan R. Orazov, Viktor E. Radzinsky, Evgeny D. DolgovPatrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Endometriosis still remains one of the most interesting but poorly understood disease entities in the world. The current epidemiological research data demonstrate that the endometriosis incidence rate will soon become somewhat of a pandemic and will affect up to 1 billion of fertile age women on the globe. At the same time, one of the main problems of endometriosis at present is underestimation of the endometriosis-associated atypical conditions and comorbidities. In this regard, it is important to consider modern, proven nosological associations of endometriosis with other comorbidities and atypical algological symptoms, as well as to note modern strategies for the effective and pathogenetically substantiated disease therapy.
Keywords: endometriosis, atypical symptoms, comorbidity, pathogenetic therapy, dienogest.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Comorbid masks of endometriosis. Clinical review for general practice. 2025; 6 (9): 6–11 (In Russ.). DOI: 10.47407/kr2025.6.9.00667
Эндометриоз на современном этапе
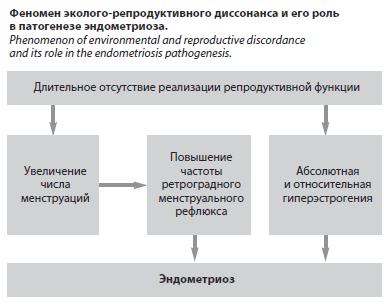
По-прежнему одной из наиболее актуальных и интересных нозологий в современной гинекологии остается эндометриоз. Несмотря на тысячи публикаций, рассматривающих современные стратегии диагностики и лечения данного заболевания, мы научились лишь держать его под контролем, но не излечивать до конца, и в этой связи эндометриоз остается одной из немногих неизлечимых болезней гинекологии XXI в. Учитывая патогенетические особенности данного заболевания, в частности ретроградный менструальный рефлюкс, лежащий в его основе, становится очевидно, что эндометриоз появился одновременно с зарождением первой женщины на Земле. Однако первые упоминания в мировой научной литературе о нем датируются лишь 1739 г., когда Crell описал «опухоль, прикрепляющуюся к дну матки снаружи». Уже в 1756 г. Артур Дафф описал клинико-морфологические характеристики заболевания, похожего на эндометриоз, в свой диссертации «К вопросу о воспалении матки». В дальнейшем изучению эндометриоза свою «научную» жизнь посвятил знаменитый Карл Рокитанский, предположительно описавший эндометриоз более чем в 50 работах. Однако наиболее знаковой фигурой в истории эндометриоза оказался Джон Сэмпсон, описавший в 1920 г. «маточные железы» за пределами полости матки, а затем в 1921 г., описавший геморрагические кисты яичников, содержащие ткань, идентичную по морфофункциональным характеристикам эндометрию. Апогеем научной деятельности Сэмпсона послужила первая сформулированная теория патогенеза заболевания, подразумевающая рефлюкс менструальной крови с фрагментами эндометрия через маточные трубы, способствующий «оседанию» и развитию фрагментов эндометрия на брюшине, яичниках и внутренних органах [1, 2]. Исходя из этого, важно отметить, что эндометриоз как нозологическая форма сопровождает эволюцию человечества с момента появления первой женщины, однако нынешняя распространенность заболевания даже близко несопоставима с эпидемиологическими показателями столетней давности, что также обусловлено эволюционными изменениями биосоциальных паттернов населения планеты, к которым прежде всего относится феномен эколого-репродуктивного диссонанса (см. рисунок). Выбор женщин в пользу карьеры и самореализации привел к «сдвигу» возраста рождения первого ребенка и увеличению периода избыточного воздействия эстрогенов. Все это способствует парадоксальному росту заболеваемости эндометриозом, который в настоящее время затрагивает около 10% или 190 млн женщин репродуктивного возраста по всему миру [3]. Однако и эти «классические» данные являются заниженными: согласно имеющимся прогнозам в ближайшее время число женщин репродуктивного возраста с эндометриозом превысит 1 млрд, что составит около 12,5% от всего населения планеты [4–6]! Вместе с тем наиболее типичными проявлениями эндометриоза являются хроническая тазовая боль и бесплодие: у данных групп пациенток эндометриоз верифицируется в 80 и 47% случаев соответственно [7, 8]. Однако проблемой в проблеме остается длительный период диагностики эндометриоза, который, по данным последних исследований, в настоящее время достигает 11 лет [9, 10]. Несмотря на тысячи исследований, десятки международных гайдлайнов и активную просветительскую работу, эндометриоз по-прежнему сохраняет грани латентности и скрытости. Важно отметить, что наиболее часто эндометриоз «зарождается» в подростковом возрасте, однако в связи со стигматизацией проблем, связанных с репродуктивной системой, и принятие девушками дисменореи как вариант нормы эндометриоз долгое время остается недиагностированным [11]. Весьма интересные данные были получены в ходе исследования P. Giglio
Выбор женщин в пользу карьеры и самореализации привел к «сдвигу» возраста рождения первого ребенка и увеличению периода избыточного воздействия эстрогенов. Все это способствует парадоксальному росту заболеваемости эндометриозом, который в настоящее время затрагивает около 10% или 190 млн женщин репродуктивного возраста по всему миру [3]. Однако и эти «классические» данные являются заниженными: согласно имеющимся прогнозам в ближайшее время число женщин репродуктивного возраста с эндометриозом превысит 1 млрд, что составит около 12,5% от всего населения планеты [4–6]! Вместе с тем наиболее типичными проявлениями эндометриоза являются хроническая тазовая боль и бесплодие: у данных групп пациенток эндометриоз верифицируется в 80 и 47% случаев соответственно [7, 8]. Однако проблемой в проблеме остается длительный период диагностики эндометриоза, который, по данным последних исследований, в настоящее время достигает 11 лет [9, 10]. Несмотря на тысячи исследований, десятки международных гайдлайнов и активную просветительскую работу, эндометриоз по-прежнему сохраняет грани латентности и скрытости. Важно отметить, что наиболее часто эндометриоз «зарождается» в подростковом возрасте, однако в связи со стигматизацией проблем, связанных с репродуктивной системой, и принятие девушками дисменореи как вариант нормы эндометриоз долгое время остается недиагностированным [11]. Весьма интересные данные были получены в ходе исследования P. Giglio Ayers и соавт. (2024), включавшего более 6 тыс. женщин и продемонстрировавшего, что средний возраст диагностирования заболевания составил 39 лет, в то время как в более молодой когорте пациенток заболевание верифицировалось значительно реже (p<0,0005) [12]. Подобные расхождения эпидемиологических данных обусловлены одной из главных проблем эндометриоза на современном этапе – длительным временем диагностики заболевания. При этом, согласно другим имеющимся данным, задержка диагностирования эндометриоза может достигать и 13 лет [13]. Исходя из этого, важно отметить данные, полученные в ходе систематического обзора S. Lukac и соавт. (2024), определяющие причины столь длительного периода диагностики заболевания [13]:
– обращение за помощью к непрофильным специалистам;
– использование анальгетиков без верификации причин дисменореи;
– принятие дисменореи как нормы;
– стигматизация менструального цикла в семье;
– неверно выставленный диагноз;
– недостаточная осведомленность врачей других специальностей об эндометриозе;
– атипичная клиническая симптоматика.
Вместе с тем наиболее интересной причиной длительного диагностирования является атипичная клиническая симптоматика, которую многие клиницисты могут не учитывать. В этой связи необходимо рассмотреть современные атипичные проявления эндометриоза и отметить его коморбидные ассоциации, суммация которых позволит заподозрить и вовремя выставить правильный диагноз.
Коморбидные маски эндометриоза: как их распознать?
Безусловно, основой клинической картины эндометриоза являются алгологические симптомы: «4Д» (дисменорея, дисхезия, дизурия, диспареуния) и хроническая тазовая боль. При этом в настоящее время доказано, что частота и, самое главное, тяжесть основных алгологических симптомов у пациенток с верифицированным эндометриозом в 2 раза выше, чем у женщин в общей популяции (88,9% против 48,7%; р<0,0001) [14]. Однако результаты последних научных работ демонстрируют высокую частоту развития генерализованного эндометриоз-ассоциированного алгологического синдрома. Так, по данным исследования P. Thiel и соавт. (2024), были доказаны прочные взаимосвязи между эндометриозом, классической «пятеркой» тазовой боли, а также рядом атипичных алгологических симптомов, включая боль [15]:
– за грудиной;
– в нижних конечностях, верхней части спины, груди, внутренней поверхности бедер;
– уретре, паховой области и крестце;
– бедре, ягодицах, пояснице, вульве или промежности;
– подлопаточной области;
– эпигастрии;
– правом подреберье.
Вместе с тем в настоящее время в мировой научной библиотеке опубликован ряд данных, доказывающих наличие прямых и косвенных ассоциаций эндометриоза не только с атипичными алгологическими симптомами, но и с рядом нозологий. Исходя из этого, клиницисту принципиально важно верно оценивать персонифицированные риски у каждой конкретной пациентки. В этой связи мы представляем «сводку» доказанных коморбидных ассоциаций эндометриоза на основе результатов последних научных данных, к которым относятся [16]:
– артериальная гипертония;
– дислипидемия;
– ишемическая болезнь сердца;
– цереброваскулярные заболевания;
– гипотиреоз;
– фибромиалгия;
– синдром хронической усталости;
– аутоиммунные заболевания;
– аллергия;
– бронхиальная астма.
Особая роль среди коморбидностей эндометриоза, безусловно, отводится сердечно-сосудистым заболеваниям. Так, по данным исследования J.M. Smyk и соавт. (2024), было доказано, что эндометриоз ассоциирован с развитием генерализованной эндотелиальной дисфункции (p=0,027), накоплением продуктов гликации в коже, отражающих повышение артериальной жесткости (p=0,013), а также снижением индекса реактивной гиперемии (p=0,037) [17]. При этом данные нарушения подтвердили свою клиническую значимость в исследовании M.A. Pabon и соавт. (2024), по результатам которого было выявлено, что эндометриоз приводит к развитию генерализованного хронического воспаления и оксидативного стресса, провоцирующих эндотелиальную дисфункцию, которые, в свою очередь, ассоциированы с повышением риска реализации аритмии (относительный риск – ОР 1,21, 95% доверительный интервал – ДИ 1,17–1,25) и сердечной недостаточности (ОР 1,11, 95%ДИ 1,05–1,18) [18].
Закономерным результатом всех отмеченных алгологических и коморбидных «масок» эндометриоза является мультимодальное снижение качества жизни у всех пациенток по данным ряда последних научных исследований, представленных ниже.
По данным исследования E.B. Arslan и соавт. (2024), включавшего 420 женщин с верифицированным эндометриозом, выявлено, что у данной когорты пациенток баллы в доменах, связанных с болью и физической активностью по шкале оценки качества жизни SF-36, оказались значимо ниже (p<0,05) [19].
Согласно результатам исследования F.P. Silva и соавт. (2024), включавшего 229 женщин с эндометриозом, разделенных на 4 группы (1-я группа – без бесплодия и без боли; 2-я группа – с болью без бесплодия; 3-я группа – с бесплодием без боли; 4-я группа – с бесплодием и болью), доказано, что у пациенток с эндометриоз-ассоциированной тазовой болью отмечались более высокие показатели тревоги и депрессии, а также значительное общее снижение качества жизни (p<0,001). Кроме того, было выявлено, что у всех пациенток отмечалось выраженное снижение качества сексуальной жизни без значимых различий между группами (p=0,671) [20].
По данным перекрестного исследования L. Van Niekerk и соавт. (2024), включавшего 210 пациенток с предшествующим хирургическим лечением эндометриоза, выявлены низкие показатели качества жизни по шкале HRQoL особенно у женщин с болевым синдромом тяжелой степени, а также снижение качества сексуальной жизни по шкале FSFI по всем доменам (желание, возбуждение, лубрикация, оргазмическая функция, удовлетворенность, боль) [21].
Таким образом, в настоящее время доказано, что эндометриоз проявляется не только классическими симптомами, такими как тазовая боль и бесплодие, но и другими атипичными алгологическими симптомами и коморбидными заболеваниями, учет которых в ходе клинического менеджмента позволит повысить точность диагностики и сократить период диагностического поиска с целью своевременного назначения патогенетической терапии.
Достижения патогенетической терапии эндометриоза
Важно отметить, что в настоящее время основными методами лечения эндометриоза являются медикаментозный и хирургический, каждый из которых обладает своими преимуществами и «слабыми местами». Согласно данным отечественных рекомендаций (2024) и международного гайдлайна ESHRE (2022), отмеченные методы лечения эндометриоза не должны противопоставляться, а решение клинициста должно быть строго персонифицированным [22, 23]. Однако необходимо помнить, что хирургическое лечение без его сочетания с фармакологической поддержкой не является состоятельным, а после операции обязательно должна следовать превентивная противорецидивная фармакотерапия. Вместе с тем современные рекомендации включают следующий перечень фармакологических средств для лечения эндометриоза [22–24]:
– нестероидные противовоспалительные препараты: в качестве симптоматического лечения эндометриоз-ассоциированной тазовой боли. Данные препараты используются до трех месяцев в связи с высоким риском ульцерогенеза;
– гестагены;
– агонисты гонадотропин-рилизинг-гормона (аГнРГ): являются препаратами с доказанным патогенетически оправданным эффектом в лечении эндометриоза, однако они обладают низким профилем безопасности за счет развития выраженной гипоэстрогении и впоследствии – лекарственной менопаузы. В этой связи их использование более 6 мес должно обязательно сопровождаться назначением add-back-терапии. Еще один недостаток данной группы препаратов – наличие короткого периода стимуляции гипофиза, во время которой может провоцироваться рост гетеротопий и снижаться эффективность лечения;
– антагонисты гонадотропин-рилизинг-гормона (антГнРГ): главным преимуществом данных препаратов является отсутствие фазы стимуляции гипофиза, а также более благоприятный профиль безопасности;
– даназол: является представителем группы антигонадотропинов и производным 17α-этинилэстрадиола. За счет блокады выброса лютеинизирующего гормона и стероидогенеза в яичниках его использование ассоциировано с повышением концентрации тестостерона и развитием симптомов гиперандрогении, из-за чего данный препарат относится к 3-й линии лекарственной терапии эндометриоза после гестагенов и аГнРГ.
Несмотря на широкий спектр лекарственных препаратов для лечения эндометриоза, группой, обладающей наиболее благоприятным профилем безопасности и патогенетическим механизмом действия, безусловно, являются прогестагены. При этом единственным прогестином, обладающим широким спектром таргетных патогенетически оправданных свойств именно в терапии эндометриоза является диеногест (Зафрилла). Согласно имеющимся данным, доказанными эффектами диеногеста в патогенетической терапии эндометриоза являются [25]:
1) снижение выживаемости клеток гетеротопических очагов через 48 ч после обработки клеточных культур диеногестом (p<0,005);
2) снижение соотношения фосфорилированной и дефосфорилированной протеинкиназы B (pAKT/AKT), демонстрирующее снижение пролиферативной активности клеток гетеротопических очагов эндометрия (p<0,005);
3) снижение экспрессии сосудистого эндотелиального фактора роста (p<0,005);
4) антагонистический эффект с фактором некроза опухолей за счет снижения выживаемости клеток (p<0,005);
5) антагонистический эффект с интерлейкином-1β за счет снижения выживаемости клеток (p<0,005);
6) снижение объема гетеротопий (с 53,70 до 21,46 мм3, p<0,005).
Таким образом, важно резюмировать, что диеногест, в отличие от других гестагенов, реализует ряд патогенетически оправданных эффектов, включая антипролиферативный, антиангиогенный и противовоспалительный.
В этой связи важно отметить, что данные уникальные свойства диеногеста (Зафрилла) наилучшим образом зарекомендовали его в качестве золотого стандарта патогенетической терапии эндометриоза, что подтверждается данными ряда клинических исследований, согласно результатам которых в настоящее время доказано, что:
– диеногест обладает наибольшим боль-редуцирующим эффектом в сравнении с другими гестагенами и аГнРГ, включая дисменорею, хроническую тазовую боль, диспареунию и дисхезию (p<0,00001) [26–31];
– диеногест значимо снижает объем менструальной кровопотери (p<0,05) [26, 31];
– диеногест значимо снижает размер эндометриоидных гетеротопий [30];
– диеногест снижает объем эндометриоидных кист яичников на 55% [32];
– диеногест способствует значимому снижению частоты постоперационных рецидивов эндометриоза (p<0,0001) [28].
Исходя из всего вышесказанного, важно отметить, что в настоящее время диеногест (Зафрилла) является уникальным терапевтическим инструментом с рядом доказанных и выгодных патогенетически оправданных свойств, а также наилучшим профилем безопасности среди всех вариантов фармакотерапии эндометриоза.
Заключение
Таким образом, необходимо резюмировать, что эндометриоз в настоящее время представляет собой одну из самых многогранных и вместе с тем «неизведанных» нозологий современной гинекологии. Долгое время полагалось, что эндометриоз ассоциирован лишь с развитием различных фенотипов тазовой боли и бесплодия, однако в настоящее время появляется все больше доказательных данных, свидетельствующих о наличии ряда других атипичных проявлений эндометриоза. Важно отметить, что основной проблемой клинического менеджмента эндометриоза на современном этапе является затянутая диагностика, одной из главных причин которой является недооценка общего коморбидного фона и тех самых атипичных проявлений заболевания. В настоящее время доказано, что эндометриоз, в связи с развитием общего воспалительного фона и оксидативного стресса, ассоциирован с рядом полисистемных нозологий, а также за счет централизации своего алгологического компонента – с генерализованным алгологическим синдромом. В этой связи важно отметить, что учет рассмотренных в рамках данной статьи атипичных проявлений эндометриоза позволит с более высокой вероятностью правильно выставить диагноз и своевременно начать эффективную патогенетическую терапию.В настоящее время в арсенале современного клинициста имеется множество вариантов фармакотерапии, однако наиболее благоприятным как с точки зрения патогенетической эффективности, так и благоприятного профиля безопасности являются гестагены, наиболее «выигрышным» из которых является диеногест (Зафрилла). Согласно имеющимся научным данным, доказано, что диеногест обладает наибольшим количеством патогенетически оправданных и таргетных свойств в отношении фармакотерапии эндометриоза, которые позволят не только эффективно редуцировать гетеротопии, но и предотвратить развитие рецидивов в дальнейшем.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Поступила в редакцию: 21.08.2025
Поступила после рецензирования: 02.09.2025
Принята к публикации: 04.09.2025
Received: 21.08.2025
Revised: 02.09.2025
Accepted: 04.09.2025
Список исп. литературыСкрыть список1. Brosens I. Endometriosis rediscovered? Human Reproduction 2004;19(7):1679-80.
2. Benagiano G, Brosens I, Lippi D. The history of endometriosis. Gynecologic and obstetric investigation 2014;78(1):1-9.
3. Zondervan KT, Becker CM, Missmer SA. Endometriosis. N Engl J Med 2020;382:1244-56. DOI: 10.1056/nejmra1810764
4. Huang JQ, Lathi RB, Lemyre M et al. Coexistence of endometriosis in women with symptomatic leiomyomas. Fertil. Steril 2010;94:720-3.
5. Nezhat C, Li A, Abed S et al. Strong Association between Endometriosis and Symptomatic Leiomyomas. JSLS 2016;20:e2016.00053.
6. Nezhat C, Nezhat F, Nezhat C. Endometriosis: Ancient Disease, Ancient Treatments. Fertil Steril 2012;98:S1–S62.
7. Carter J.E. Combined hysteroscopic and laparoscopic findings in patients with chronic pelvic pain. J Am Assoc Gynecol Laparoscopists 1994;2:43-7.
8. Meuleman C, Vandenabeele B, Fieuws S et al. High prevalence of endometriosis in infertile women with normal ovulation and normospermic partners. Fertil Steril 2009;92:68-74.
9. Fryer J, Mason-Jones AJ, Woodward A. Understanding diagnostic delay for endometriosis: a scoping review. medRxiv 2024;p.:2024-01. DOI: 10.1101/2024.01.08.24300988
10. Sims OT, Gupta J, Missmer SA, Aninye IO. Stigma and Endometriosis: A Brief Overview and Recommendations to Improve Psychosocial Well-Being and Diagnostic Delay. Int J Environ Res Public Health 2021;18:8210.
11. Shim JY, Laufer MR, DiVasta AD. Treatment of adolescent endometriosis before, during, and after use of gonadotropin-releasing hormone agonists: a retrospective cohort study. J Pediat Adolescent Gynecol 2023;36(5):472-5.
12. Giglio Ayers P, Ezike O, Foley CE, Brown BP. Demographic Correlates of Endometriosis Diagnosis Among United States Women Aged 15–50. J Minimally Invasive Gynecol 2024;31(7):607-12. DOI: 10.1016/j.jmig. 2024.04.020
13. Lukac S, Hancke K, Janni W et al. Three-dimensional model for improvement of endometriosis care (3D-E). Int J Gynecol Obstetrics 2024;165(2):416-23.
14. Warzecha D, Wielgoset M, Salloum D et al. Epidemiology, management and diagnostic workup for endometriosis related pelvic pain. 2023. DOI: 10.21203/rs.3.rs-3508411/v1
15. Thiel P et al. Entrapped by pain: The diagnosis and management of endometriosis affecting somatic nerves. Best Pract Res Clin Obstet Gynaecol 2024;95:102502. DOI: 10.1016/j.bpobgyn.2024.102502
16. Nezhat C et al. The prevalence of endometriosis in patients with unexplained infertility. J Clin Med 2024;13(2):444.
17. Smyk JM, Danielecka Z, Kotowska M et al. Cardiovascular risks and endothelial dysfunction in reproductive-age women with endometriosis. Scientific Reports 2024;14(1):24127.
18. Pabon MA, Wang X, Rexrode KM. Beyond reproductive health: the cardiovascular risks of endometriosis. Eur Heart J 2024;45(44): 4744-46. DOI: 10.1093/eurheartj/ehae674
19. Kigloo HN, Itani R, Montreuil T et al. Endometriosis, chronic pain, anxiety, and depression: A retrospective study among 12 million women. J Affective Disorders 2024;346:260-5.
20. Arslan EB, Kocaˆz S, Kýzýlýrmak A. The effect of endometriosis on anxiety and the Quality of Life in women. Health Care Women Int 2024;45(5):550-61.
21. Silva FP, Yela DA, de Barros Meneguetti M et al. Assessment of quality of life, psychological aspects, and sexual function of women with endometriosis according to pain and infertility: a cross sectional study. Arch Gynecol Obstet 2024;309(6):2741-9. DOI: 10.1007/s00404-024-07464-8
22. Endometriosis. ESHRE guideline, 2022. URL: https://www.eshre.eu/ Guidelines-and-Legal/Guidelines/Endometriosis-guideline
23. Эндометриоз. Клинические рекомендации Минздрава России. М., 2024.
Endometriosis. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2024 (in Russian).
24. Hirata T, Koga K, Osuga Y. Extra-pelvic endometriosis: a review. Reprod Med Biol 2020;19(4):323-33.
25. Kim HJ, Kim SH, Oh YS et al. Dienogest May Reduce Estradiol-and Inflammatory Cytokine-Induced Cell Viability and Proliferation and Inhibit the Pathogenesis of Endometriosis: A Cell Culture-and Mouse Model-Based Study. Biomedicines 2022;10(11):2992.
26. Yang S, Liu Y, Wen J et al. Clinical efficacy of Dienogest versus Levonorgestrel-releasing intrauterine system for Adenomyosis. Evid-Based Complement Altern Med 2022;(3):1-6. DOI: 10.1155/2022/1995472
27. Lin SC, Wang XY, Fu XL et al. Systematic review and Meta-analysis of efficacy and safety of dienogest in treatment of endometriosis. World J Meta-Anal 2021;9(4):377-388. DOI: 10.13105/wjma.v9.i4.377
28. Muzii L, Di Tucci C, Galati G et al. The efficacy of dienogest in reducing disease and pain recurrence after endometriosis surgery: a systematic review and meta-analysis. Reprod Sci 2023;30(11):3135-43.
29. Vahid-Dastjerdi M, Hosseini R, Rodi H et al. Comparison of the effectiveness of Dienogest with medroxyprogesterone acetate in the treatment of pelvic pain and recurrence of endometriosis after laparoscopic surgery. Arch Gynecol Obstet 2023;308(1):149-55.
30. Wu H, Liu JJ, Ye ST et al. Efficacy and safety of dienogest in the treatment of deep infiltrating endometriosis: A meta-analysis. Eur J Obstet Gynecol Reprod Biol 2024;297:40-9.
31. Ali MK, Hussein RS, Abdallah KS, Mohamed AA. The use of dienogest in treatment of symptomatic adenomyosis: a systematic review and meta-analysis. J Gynecol Obstetr Hum Reprod 2024;53(7):102795. DOI: 10.1016/j.jogoh.2024.102795
32. Thiel PS, Donders F, Kobylianskii A et al. The Effect of Hormonal Treatment on Ovarian Endometriomas: A Systematic Review and Meta-Analysis. J Minim Invasive Gynecol 2024;31(4):273-9. DOI: 10.1016/j.jmig.2024.01.002
20 октября 2025
Количество просмотров: 224

