Клинический разбор в общей медицине №9 2025
Karina M. Syrko
Kuban State Medical University, Krasnodar, Russia
ktrnkzhvnkv@gmail.com
Abstract
Background. The relevance of the problem is associated with the lack of a unified strategy for managing patients with repeated implantation failures during assisted reproductive technology procedures due to chronic endometritis. Currently, anamnestic-visual (the presence of a female factor of infertility, a change in the thickness of the endometrium during sonography and a relatively specific hysteroscopic picture of chronic inflammation of the inner layer of the uterus) and immunohistochemical (the main one is the detection of plasma cells in the endometrial epithelium) markers of this pathology are mainly used, while their accuracy is still the subject of many discussions and does not allow methods for eliminating infertility. The article is devoted to a review analysis of diagnostic procedures and approaches to the treatment of chronic endometritis in women with repeated implantation failures within the framework of reproductive medicine in general and reproductive immunology.
Objectives. Critical analysis of the main diagnostic methods for assessing the receptivity of the endometrium in chronic endometritis.
Methods. An analysis of data from Russian- and English-language scientific literature devoted to studies to assess methods for diagnosing chronic endometritis in women with reproductive disorders.
Results. More than 80 studies were analyzed in this publication. The main methods of diagnosis of chronic endometritis both in retrospective and in the modern aspect are evaluated.
Conclusion. Now, in reproductive medicine, there are no highly specific methods for diagnosing chronic endometritis, which, on the one hand, necessitates an integrated approach to assessing the implantation properties of the endometrium, and, on the other hand, stimulates a more in-depth study of new aspects of the pathogenesis of this pathology and the search for more accurate diagnostic markers.
Keywords: infertility, chronic endometritis, repeated implantation failures, reproductive immunology, diagnostics, plasma cells.
For citation: Borovikov I.O., Papoyan L.A., Revenko D.V., Golubchenko K.E., Ilyina D.V., Syrko K.M. Chronic endometritis – diagnosing difficulties (review). Clinical review for general practice. 2025; 6 (9): 12–18(In Russ.). DOI: 10.47407/kr2025.6.09.00p4533
2) недостаточная изученность их функций, которые меняются в зависимости от фазы менструального цикла – это затрудняет понимание их роли в имплантации эмбриона и наступлении беременности; 3) ошибочное предположение, лежащее в основе одной из фундаментальных гипотез репродуктивной иммунологии – «парадокса Медавара», – гипотеза предполагает иммунологическое отторжение и толерантность к полуаллогенным трансплантатным эмбрионам [4].
В настоящее время многие аспекты репродуктивной иммунологии активно применяются в практике ведения пациенток, страдающих от привычных потерь беременности и неудачных попыток экстракорпорального оплодотворения. Особенно показательным в этом плане является диагностика и лечение хронического эндометрита (ХЭ). Используя термин «chronic endometritis», в базе данных PubMed 2022 г. можно найти в общей сложности 71 совпадение, тогда как в 2012 г. их было 11, что свидетельствует о возрастающем интересе к данной патологии. А в большинстве европейских стран диагностика и терапия ХЭ уже включена в действующие клинические рекомендации по привычному невынашиванию беременности. В случае наличия привычных выкидышей для исключения ХЭ у пациентки производится биопсия эндометрия с иммуногистохимической оценкой биоптата и типированием плазматических клеток (ПК) – CD138+ (синдекан-1), оценкой количества трансмембранного протеогликана гепарана сульфата I типа [5]. Кроме того, в данные клинические рекомендации включены схемы возможной антибиотикотерапии, которые могут быть применены для профилактики прерывания беременности в случае диагностики ХЭ [5, 6]. В Российской Федерации интерес к проблеме ХЭ также не вызывает сомнений – в поисковой базе библиотеки ELibrary.ru найдено 82 научных статьи с его упоминанием (2013–2023 гг.), а в клинических рекомендациях Российского общества акушеров-гинекологов (РОАГ) 2021 г. («Привычный выкидыш») одной из причин привычного невынашивания назван ХЭ, но при этом «не рекомендовано рутинно направлять пациентку на проведение биопсии эндометрия» [7].
Одной из ключевых проблем современной репродуктивной медицины, вызывающей множество споров, является неоднозначность существующих диагностических критериев ХЭ. В этом обзоре авторы постараются обобщить основные подходы к диагностике ХЭ и выделить ключевые иммунопатогенетические аспекты, которые следует учитывать как в процессе постановки диагноза, так и в лечении таких пациенток.
История проблемы или трудный путь к определению и диагностике хронического эндометрита
Эндометрит представляет собой воспалительный процесс, поражающий слизистую оболочку матки. Как правило, основные причины этого заболевания – бактериальные или, реже, вирусные инфекции – в основном предотвращаются благодаря двум важным факторам: 1) менструации – эндометрий отделяется во время менструации, что снижает риск возникновения инфекции; 2) структуре репродуктивного тракта – женский репродуктивный тракт можно условно разделить на две области, каждая из которых обладает своим уникальным набором иммунных клеток: верхний отдел – эта область включает эндоцервикс, матку и фаллопиевы трубы, где наблюдается низкая концентрация микроорганизмов; нижний отдел – микробиом этой области (влагалище и эктоцервикс) характеризуется высокой микробиологической нагрузкой [8, 9]. Эпителиальные клетки шейки матки обеспечивают два барьера: физический – он состоит из слизи и эпителиальных пластов, которые служат преградой для инфекций; иммунологический – этот барьер формируется из клеток, выполняющих иммунорегуляторные функции, что также способствует защите от инфекций [9, 10]. Теоретически, воспаление может возникнуть только тогда, когда эти естественные барьеры нарушены, в первую очередь это относится к событиям, связанным с абортом или родоразрешением [11, 12]. В отличие от острого эндометрита, его хроническая форма в основном протекает бессимптомно, поэтому и оставалась в значительной степени неопределенной до начала XX в. В 1911 г. британские акушеры-гинекологи Archibald Donald и W. Fletcher Shaw заявили: «Во всей области гинекологии нет случаев, столь распространенных, как те, которые обычно называются “хроническим эндометритом”. Этот термин обычно используется для обозначения класса случаев, которые клинически хорошо известны, но трудно поддаются определению. То, что вся предметная область все еще находится в состоянии замешательства, очевидно для всех, чей долг состоит в том, чтобы попытаться дать четкий отчет о малой гинекологии студентам-медикам» [13]. Эта ситуация изменилась благодаря новаторской для того времени работе чешского и австрийского гинекологов – Фрица Хитшмана (Fritz Hitschmann) и Людвига Адлера (Ludwig Adler) [14]. Они полностью пересмотрели диагностический термин «хронический эндометрит», включая его многочисленные классификации, и отвергли термин endometritis glandularis, который был ранее придуман патологоанатомом Карлом Руге (Carl Ruge) [15]. Данные исследователи впервые осознали, что основополагающие принципы некоторых специфических гистологических наблюдений носят не патологический, а физиологический характер. Более того, они первыми признали важную роль ПК в воспалительных процессах эндометрия и постулировали их наличие в качестве уникального критерия диагностики пациенток с ХЭ: «Мы склонны делать обнаружение плазматических клеток диагностическим критерием для хронического эндометрита» [14].
До недавнего времени это было единственным надежным диагностическим критерием ХЭ. Во многом это связано с отсутствием специфических симптомов, которые могут указывать на наличие ХЭ. В некоторых случаях эта патология может проявляться аномальным маточным кровотечением или неясным дискомфортом в области таза, однако у большинства женщин она протекает бессимптомно. В начале нового тысячелетия, после длительного периода пренебрежения как диагностическими, так и патогенетическими аспектами ХЭ, интерес к эндометриальным причинам бесплодия значительно возрос. Это нашло отражение в широком спектре предлагаемых тестов, направленных на оценку рецептивности эндометрия. Однако и этот все возрастающий бум интереса создает ряд проблем. Существует много теорий, постулирующих, что ХЭ может негативно повлиять на женскую фертильность и течение беременности. Данные теории охватывают: измененную децидуализацию эндометрия [16]; изменения в профиле экспрессии генов эндометрия (таких как инсулиноподобный фактор роста-1, В-клеточная лимфома 2, Bcl-2-ассоциированный X и др.) [17]; различный состав иммунных или иммуномодулирующих клеток, таких как В-клетки, натуральные клетки-киллеры (NK-клетки), регуляторные Т-клетки (Treg) или субпопуляции Т-helper клеток Th1/Th2, Th17 [18–20], дисрегуляция цитокинов, измененная аутофагия [21] и различная микробиота женского репродуктивного тракта [22]; нарушение васкуляризации или маточная дисперистальтика [23]. Следует отметить, что все эти проблемы действительно могут влиять на женскую фертильность, но не могут рассматриваться отдельно. Так, липополисахариды микроорганизмов способны регулировать экспрессию цитокинов, которые, в свою очередь, ответственны за лейкоцитарную инфильтрацию, а LpS-зависимая активация Toll-подобных рецепторов может препятствовать имплантации эмбриона, что, по-видимому, связано с измененной экспрессией молекул адгезии в клетках эндометрия человека [18, 24, 25]. Тем не менее полностью достоверные и надежные исследования, которые могли бы обосновать эти утверждения, по-прежнему отсутствуют, не в последнюю очередь из-за того, что анализ транскриптома эндометрия и диагностика иммунных клеток далеко не просты, и при интерпретации результатов необходимо проявлять осторожность.
Кроме того, даже гистологический диагноз ХЭ не всегда отличается достоверностью, в связи с высокой вариацией параметров, и во многом зависит от опыта патологоанатома и различных методов окрашивания препаратов [23, 26]. Для канонического маркера ХЭ – ПК (CD138+) рекомендуется иммуноокрашивание как гарант их надежного обнаружения. Но при этом, инфекционная патология влагалища и особенно шейки матки могут фальсифицировать результаты, поскольку цервикальные ПК способны экспрессировать синдекан-1 [27, 28]. Однако наиболее серьезным ограничением диагностики ХЭ является отсутствие консенсуса в отношении количества ПК, необходимых для правильной интерпретации диагноза [23, 29]. В недавнем обзоре W. Huang и соавт. (2020) подробно рассмотрели этот вопрос и дали критическую оценку большинству принятых в настоящее время диагностических критериев:
в 12 исследованиях, включенных в этот метаанализ (одно исследование «случай-контроль», 5 ретроспективных и 6 проспективных исследований), было применено 6 различных диагностических критериев для ХЭ, что побудило авторов призвать к выработке единых диагностических критериев данной патологии [30].
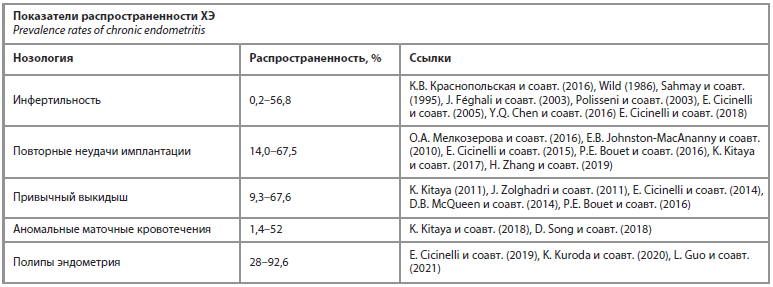
Еще одной дискутабельной проблемой является статистика распространенности ХЭ, которая сильно различается не только между различными субпопуляциями, но и в пределах одних и тех же субпопуляций бесплодных пациентов (см. таблицу).
Хотя в настоящее время нет достоверных данных, большинство патоморфологов ставят диагноз на основании единственного критерия – наличия ПК в эндометрии [26]. Однако до сих пор не проведено надежных исследований, которые бы изучали возникновение эндометриальных ПК у фертильных женщин в разные фазы менструального цикла. При этом не учитывается, что ПК могут обнаруживаться и в эндометрии здоровых женщин, способных к деторождению [30]. Недавно было опубликовано проспективное многоцентровое исследование (2022), в котором приняли участие 80 молодых женщин, страдающих от бесплодия. Исследование показало, что более чем у половины пациенток были обнаружены ПК в количестве ≥1. Однако количество обнаруженных ПК не помогло предсказать успешную беременность в будущем [24]. Хотя другие исследования пришли к противоположным выводам, факт остается фактом: общие данные по этому вопросу все еще ограничены и разрознены [31–33].
Из-за отсутствия стандартизированных гистологических критериев гистероскопия все чаще предлагается в качестве важного подспорья для диагностики ХЭ, демонстрируя высокую точность для широкого спектра патологии матки, включая доброкачественные состояния, такие как миомы, полипы, гиперплазия эндометрия, а также рак эндометрия [24]. Гистероскопия, выполняемая в пролиферативной фазе менструального цикла, также может позволить идентифицировать признаки воспаления эндометрия [34–36]. Классическая гистероскопическая находка ХЭ чаще всего включает в себя эндометриальный «клубничный рисунок» с участками гиперемии с белыми участками в центре. Однако, исходя из нашего клинического опыта и согласно литературе, можно предположить, что такая картина на самом деле визуализируется достаточно редко [37, 38]. Многие клиницисты и исследователи отождествляют проявления ХЭ с пролиферативными изменениями слизистой оболочки (<1 мм) – микрополипами и стромальным отеком, однако большинство данных изменений эндометрия, по-видимому, имеют низкую диагностическую точность при нашем заболевании [39–42]. Хотя до сих пор не существует консенсуса в отношении гистероскопических критериев ХЭ, можно предположить, что исключить данную патологию можно, когда по крайней мере один из трех вышеперечисленных критериев ХЭ не подтвержден [40, 43, 44]. При этом, по мнению большинства авторов, гистероскопия, выполняемая опытным клиницистом, в сочетании с гистологической оценкой должна рассматриваться как наиболее специфичный критерий для диагностики ХЭ [45, 46].
Проанализировав сложности в диагностике ХЭ, еще хуже обстоят дела в методах его лечения. Особенно серьезной проблемой в этой части является отсутствие ясности в патогенезе ХЭ условно-патогенной микрофлоры как триггера аутоиммунного процесса с нарушением рецептивности эндометрия. Конечно, в первую очередь диагностика ХЭ должна в обязательном порядке включать оценку восходящей микрофлоры урогенитального тракта, что на самом деле часто не делается, так как считается довольно сложной и дорогостоящей процедурой, включающей отбор проб потенциальных патогенов из матки с низкой массой микробиоты через вагинальную микробиоту с высокой массой, что предполагает риск контаминации образцов. Еще одним моментом, представляющим большую сложность в интерпретации результатов бактериологического исследования, являются трудности в культивировании некоторых бактериальных штаммов, при этом инновационное и широко рекламируемое в настоящее время обнаружение определенных последовательностей 16S рРНК в слизистой оболочке эндометрия не дифференцирует живые бактерии или (мертвые) бактериальные фрагменты. Это может привести к неправильной постановке диагноза, хотя нельзя исключать, что даже неактивные бактериальные фрагменты все еще могут способствовать физиологическому взаимодействию с клетками-хозяевами и тем самым влиять на женскую фертильность [8].
В клинической практике терапия ХЭ часто приводит к применению антибиотиков широкого спектра действия без положительного результата теста на наличие соответствующих патогенов, при этом конечной точкой успешной терапии является уже не нивелирование (все еще не доказанного) патогена, а отсутствие ПК [47–49]. Такой подход к лечению ХЭ вызывает обоснованные сомнения как в отношении потенциальных побочных эффектов антибактериальной терапии, так и в необходимости ее применения, тем более, что наблюдается явное несоответствие в схемах применения различных типов антибиотиков, дозировках и продолжительности терапии [29, 50]. Кроме того, до сих пор не было проведено надежных рандомизированных исследований, которые бы продемонстрировали какие-либо преимущества в результате применения антибиотиков в лечении ХЭ, а тот факт, что даже антибиотики широкого спектра действия (например, доксициклин или амоксициллин) часто не способствуют уменьшению количества эндометриальных ПК, подрывает теорию ХЭ, индуцированного бактериями. И тут приходится признать, что тканевая воспалительная реакция предполагает не только микробную этиологию, но предполагается, что так называемое «асептическое» или «аутоиммунное» воспаление может принимать участие в патофизиологических состояниях, связанных с репродукцией, таких как эндометриоз, имплантация эмбриона, преждевременные роды, плацентарная недостаточность и преэклампсия [51]. Однако вышеперечисленные аспекты обычно не принимаются во внимание в лечении ХЭ и даже наоборот, чтобы подвергать сомнению текущие догмы, касающиеся его патогенеза, активно внедряются новые модифицированные комбинированные режимы антибактериальной терапии, которые часто используются в случае длительной персистенции ПК. К этому добавляется тот факт, что в последнее время существует много пиара вокруг важности микробиома матки для репродуктивного здоровья. Независимо от вопроса, оправдано это или нет, мы должны честно спросить себя, приносим ли мы больше вреда, чем пользы, применяя такие подходы к терапии.
Вспомогательные репродуктивные технологии – аспекты диагностики (гипердиагностики)
Без сомнения, существует множество доказательств того, что пациентки подвергаются гипердиагностике, что обусловлено двумя основными причинами: широким спектром патологии со сходной клинической картиной и чрезмерным количеством диагностических критериев. Хотя все еще существуют трудности даже в определении термина «гипердиагностика» и проведении четких границ между необходимым спектром исследований для постановки правильного диагноза и их избыточностью, нет никаких сомнений в том, что гипердиагностика является серьезной проблемой в здравоохранении [52–55]. Гипердиагностика может быть результатом: 1) все более чувствительных тестов; 2) случайных результатов или 3) чрезмерно расширенных определений диагностических критериев [56]. И эта проблема также актуальна в области репродуктивной медицины. Широкое применение предимплантационного генетического тестирования на анеуплоидии (PGT-A) с платформами секвенирования следующего поколения (NGS) с высоким разрешением полностью соответствует вышеупомянутым критериям – данные исследования позволили опровергнуть догму о том, что человеческие эмбрионы являются либо однородными эуплоидами, либо анеуплоидами. Было продемонстрировано, что немалая часть человеческих эмбрионов может быть классифицирована как хромосомные мозаики, имеющие смесь как аномальных, так и нормальных клеток. Заданные пороги для эуплоидных (т.е. <20% анеуплоидных клеток), анеуплоидных и мозаичных эмбрионов были установлены без биологических, но технических критериев (определяемых количеством трофэктодермных биопсийных клеток), что привело либо к браковке огромного количества эмбрионов с нормальным потенциалом беременности, либо к переносу «мозаичных» эмбрионов, что приводит к высокому уровню психологического стресса у пациентов после их переноса [57, 58]. Однако преимплантационное тестирование является ярким, но не единственным примером гипердиагностики в репродуктивной медицине.
Перечисленные пункты (все более чувствительные тесты, случайные результаты или чрезмерно расширенные определения диагностических критериев) также применяются к текущим критериям для диагностики ХЭ. Во-первых, иммуногистохимия CD138+ повышает чувствительность детекции ПК, во-вторых, если вы что-то ищете, вы что-то найдете – скрининг может выявить «случайные результаты» у лиц, проходящих тестирование по другим причинам. Хорошо известно, что имплантационные неудачи и привычные выкидыши считаются одними из самых сложных и спорных вопросов в репродуктивной медицине, с малоизученной до сих пор этиологией и, соответственно, патогенезом. Обнаружение эндометриальных ПК может быть случайной находкой и не обязательно быть связанной с перечисленными состояниями. И, в-третьих, чрезмерно расширенные определения диагностических критериев могут также применяться для предоставления достаточных доказательств диагностики ХЭ при обнаружении только одной или нескольких ПК.
Репродуктивная иммунология – пересмотр концепций
Помимо хромосомной нестабильности во время раннего эмбриогенеза, некоторых маточных факторов и неадекватных процессов эндометриально-эмбриональной синхронизации, иммунные девиации также предполагаются как ответственные за нарушение имплантационных свойств эндометрия и потерю эмбрионов. Причины этого очевидны – инфильтрация иммунокомпетентными клетками является основой клеточного компонента децидуальной оболочки, а специфические иммунные клетки незаменимы для достижения и поддержания беременности [59, 60]. Поэтому нет сомнений в том, что функциональная чувствительная иммунная система имеет решающее значение для установления успешной беременности.
Репродуктивная иммунология уже привлекала внимание в 1950-е годы прошлого, спровоцированная определением иммунологического парадокса беременности и постулированием концепции полуаллотрансплантата известным биологом Питером Медаваром (Peter Medawar), и его исследования по-прежнему представляют основу для многих аспектов современной иммунологии и трансплантационной медицины. Однако, что касается концепции полуаллотрансплантата, P. Medawar, вероятно, ошибался – предположение о том, что неудачи имплантации, выкидыш и преждевременные роды происходят в результате недостаточной иммуносупрессии матери, приводящей к отторжению эмбриона, было воспринято с энтузиазмом. Были проведены параллели между трансплантационной и репродуктивной иммунологией, и как фатальное последствие область трансплантационной медицины по-прежнему служит планом для многих репродуктивных аспектов, которые не могут быть исследованы in vivo. Тем не менее иммуномодулирующая терапия, такая как иммуноглобулины, интралипидная инфузия, применение гранулоцитарного колониестимулирующего фактора, мононуклеарных клеток периферической крови, подкожное введение ингибиторов фактора некроза опухоли-α, ингибирующего фактора лейкемии, глюкокортикоидов противовоспалительного действия и даже иммунодепрессантов, предлагается пациентам с повторными неудачами имплантации и привычным выкидышем на более или менее регулярной основе, при этом, согласно последним исследованиям, доказательств их эффективности не хватает и они не рекомендуются в клинической практике [61, 62]. В данном контексте не менее важно учитывать недавние выводы о том, что с эволюционной точки зрения имплантация эмбриона может быть результатом воспалительного процесса предков, а провоспалительный процесс является первым шагом и играет ключевую роль в беременности вида млекопитающих [63, 64]. Это, как следствие, не только влечет за собой риск терапевтической неэффективности из-за неправильной теории, но также может поставить под угрозу здоровье пациентов и желаемый результат экстракорпорального оплодотворения.
При этом, несмотря на вышеперечисленные несостыковки суждений, все больше расширяется спектр диагностических иммунологических тестов, которые предлагаются инфертильным пациенткам перед проведением вспомогательных репродуктивных технологий – и это не только тестирование плазмоцитов, но и других лимфоидных клеток, таких как Tregs, Т-клетки или естественные клетки-киллеры эпителия матки (uNK).
В частности, последние вызвали наибольшие дискуссии, учитывая тот факт, что NK-клетки составляют 50–90% лейкоцитов в децидуа и были предложены в качестве медиаторов клеточной цитотоксичности, и, соответственно, повышенный уровень uNK может рассматриваться как оказывающий отрицательное влияние на имплантацию и поддержание беременности. Однако в связи с этим возникает ряд вопросов: во-первых, вариации в количестве uNK в разных репродуктивных фазах огромные – их количество резко возрастает от пролиферативной до поздней секреторной фазы менструального цикла; кроме того, развитие этих клеток очень динамично во время беременности, показывая фенотипические различия, отраженные в чередовании экспрессии генов (например, экспрессия иммуноглобулиноподобных рецепторов клеток-киллеров (KIR) снижается с 6-й по 12-ю недели беременности, в то время как экспрессия NKG2D и NKp80 увеличивается во втором триместре) [59]. Однако наиболее важной проблемой является тот факт, что клеточная линия NK состоит из относительно гетерогенной и разнообразной популяции CD56+/CD3+, а эндометрий почти исключительно содержит CD56brightCD16 NK-клетки, при этом данная популяция NK не только демонстрирует более высокую по сравнению с периферическими NK-клетками экспрессию CD56 (CD56dim), но и активирует экспрессию CD9, CD49α и иммуносупрессивной молекулы PP14 [65]. Маточные NK-клетки также демонстрируют значительные различия в структуре экспрессии по сравнению с их периферическими аналогами: обнаружено по крайней мере 278 генов с более чем трехкратным изменением их экспрессии по сравнению с периферическими NK [66]. Кроме того, хотя NK-клетки и могут приобретать цитотоксическую способность при инфицировании децидуа, предполагается, что они скорее обладают иммуномодулирующими свойствами вместо цитотоксических эффекторных реакций, при этом современные результаты исследований, сделанные уже в начале этого тысячелетия, часто игнорируются [67]. Между тем эти исследования дают более четкую картину того, как uNK способствуют фундаментальным физиологическим процессам беременности в децидуа, участвуя в процессах установления и поддержания беременности, они не только способствуют инвазии экстравиллозного трофобласта (EVT) через прямое взаимодействие с его клетками, но и регулируют глубину инвазии [67, 68]. Также uNK способны к секреции матриксных металлопротеиназ, тем самым внося вклад в децидуа-ассоциированное ремоделирование сосудов и несколько ангиогенных факторов, включая фактор роста эндотелия сосудов, плацентарный фактор роста, и косвенно модифицируют спиральные артерии через их взаимодействие с EVT [67, 68].
В свою очередь, антигены основного комплекса гистосовместимости трофобласта класса I могут модулировать активность uNK-клеток. Это также справедливо для взаимодействия различных иммунных клеток. Например, NK-клетки играют важную роль в регуляции клеток Th17, в то время как клетки Th17, в свою очередь, индуцируют активацию uNK-клеток [69]. Сосредоточение внимания только на одной популяции иммунных клеток в таких сложных взаимодействующих путях несет в себе опасность искажения их истинной природы. По крайней мере, можно с достаточной вероятностью предположить, что uNK не представляют собой однородную и клеточную популяцию, при этом не только динамика экспрессии генов во время вынашивания плода подчеркивает эту картину – недавнее исследование на основе секвенирования одноклеточной РНК указывает на существование различных субпопуляций клеток uNK [70]. Хотя наше понимание развития и функции NK-клеток значительно продвинулось в последние годы, мы должны признать тот факт, что только начинаем понимать их огромную пластичность и их разнообразные функции – проблема исследования uNK in vivo препятствует поиску новых данных. Например, до сих пор неясно, привлекают ли локально секретируемые хемокины/цитокины NK-клетки к эндометрию, где они подвергаются местной дифференцировке, или же uNKs возникают из их предшественников в эндометрии [67].
Имеет ли смысл количественно оценивать такую динамичную клеточную популяцию с высокой пластичностью, которая до сих пор имеет неизвестное происхождение и развитие в основном с неизвестными функциями? Применительно к ситуации с ХЭ и ПК не следует предполагать, что разнообразность их взаимодействий менее сложна по сравнению с NK-клетками. ПК представляют собой дифференцированные антиген-активированные В-лимфоциты, которые могут выделять большое количество различных антител и, таким образом, являются неотъемлемой и эффективной частью гуморального иммунитета. Тем не менее в настоящее время признано, что они также являются важными производителями цитокинов, участвующих в процессах, независимых от секреции антител, таких как регуляция кроветворения, гомеостаз кишечника и др. [71, 72]. Тем не менее следует признать, что, вероятно, большинство функций ПК, независимых от антителообразования, еще предстоит выяснить и, кроме того, различные функции ПК могут также отражаться в огромной гетерогенности их субпопуляций [73].
Эндометриальные плазматические клетки – открытые вопросы
И в данном плане самый важный вопрос – представляет ли наличие эндометриальных ПК патологическую ситуацию. Хотя крупномасштабные исследования все еще отсутствуют, есть намеки на то, что данный вид
иммунокомпетентных клеток может присутствовать и при физиологических ситуациях [24, 30, 74]. Следует также помнить, что многие слои слизистой оболочки эндометрия охватывают в основном IgA-продуцирующие ПК, при этом данные антитела (IgA) не ограничиваются воспалительными функциями, но могут также обладать противовоспалительными свойствами. Найдены признаки того, что ПК, способные высвобождать IgA, не только сдерживают патогены, но и защищают комменсальную микробиоту [60, 75]. В настоящий момент, когда нет полных данных о свойствах ПК, предположение, что их низкое количество в эндометрии обладает защитными свойствами для микробиоты матки, преждевременно. Однако приведенные в этом обзоре данные должны способствовать уточнению взаимоотношений иммунокомпетентных клеток в столь уникальной среде, как эндометрий, при физиологических состояниях и на фоне ХЭ, повторных неудачах имплантации и привычных выкидышах, что необходимо для более широкого понимания такой относительно новой области медицины, как репродуктивная иммунология.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Боровиков Игорь Олегович – д-р мед. наук, доцент, проф. каф. акушерства, гинекологии и перинатологии №1, ФГБОУ ВО «Кубанский государственный медицинский университет».
ORCID: 0000-0001-8576-1359
Igor O. Borovikov – Dr. Sci. (Med.), Assoc. Prof., Kuban State Medical University. ORCID: 0000-0001-8576-1359
Папоян Лидия Андреевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: ktrnkzhvnkv@gmail.com; ORCID: 0009-0009-6220-7767
Lidiya A. Papoyan – Student, Kuban State Medical University.
E-mail: ktrnkzhvnkv@gmail.com; ORCID: 0009-0009-6220-7767
Ревенко Дарья Васильевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: daria.revenko@mail.ru; ORCID: 0009-0001-5809-6397
Daria V. Revenko – Student, Kuban State Medical University.
E-mail: daria.revenko@mail.ru; ORCID: 0009-0001-5809-6397
Голубченко Кирилл Эдуардович – студент 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: kgolubchenko@yandex.ru; ORCID: 0009-0006-5617-7683
Kirill E. Golubchenko – Student, Kuban State Medical University.
E-mail: kgolubchenko@yandex.ru; ORCID: 0009-0006-5617-7683
Ильина Дарья Витальевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: dariailyina7@gmail.com; ORCID: 0009-0009-7637-9508
Daria V. Ilyina – Student, Kuban State Medical University. E-mail: dariailyina7@gmail.com; ORCID: 0009-0009-7637-9508
Сырко Карина Михайловна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: syrkok@mail.ru; ORCID: 0009-0008-1645-9146
Karina M. Syrko – Student, Kuban State Medical University.
E-mail: syrkok@mail.ru; ORCID: 0009-0008-1645-9146
Поступила в редакцию: 10.02.2025
Поступила после рецензирования: 12.03.2025
Принята к публикации: 17.04.2025
Received: 10.02.2025
Revised: 12.03.2025
Accepted: 17.04.2025
Клинический разбор в общей медицине №9 2025
Хронический эндометрит – сложности диагностики (обзор литературы)
Номера страниц в выпуске:12-18
Аннотация
Обоснование. Актуальность проблемы связана с отсутствием единой стратегии менеджмента пациенток с повторными неудачами имплантации при проведении процедур вспомогательных репродуктивных технологий, обусловленные хроническим эндометритом. В настоящее время в основном используются анамнестическо-визуальные (наличие женского фактора бесплодия, изменение толщины эндометрия при сонографии и относительно специфическая гистероскопическая картина хронического воспаления внутреннего слоя матки) и иммуногистохимические (основной – детекция плазматических клеток в эпителии эндометрия) маркеры данной патологии, при этом их точность до сих пор является предметом множества дискуссий. Статья посвящена обзорному анализу диагностических процедур и подходов к терапии хронического эндометрита у женщин с повторными неудачами имплантации в рамках репродуктивной медицины в целом и репродуктивной иммунологии в частности.
Цель. Критический анализ основных диагностических методов оценки рецептивности эндометрия при хроническом эндометрите.
Методы. Проведен анализ данных русско- и англоязычной научной литературы, посвященных исследованиям по оценке методов диагностики и лечения хронического эндометрита у женщин с нарушениями репродуктивной функции.
Результаты. Проанализированы более 80 исследований. Дана оценка основным методам диагностики хронического эндометрита как в ретроспективном, так и в современном аспекте.
Заключение. В настоящий момент в репродуктивной медицине не существует высокоспецифичных методов диагностики хронического эндометрита, что, с одной стороны, обусловливает необходимость комплексного подхода к оценке имплантационных свойств эндометрия, а, с другой стороны, стимулирует более углубленное исследование новых аспектов патогенеза данной патологии и поиск более точных маркеров диагностики.
Ключевые слова: инфертильность, хронический эндометрит, повторные неудачи имплантации, репродуктивная иммунология, диагностика, плазматические клетки.
Для цитирования: Боровиков И.О., Папоян Л.А., Ревенко Д.В., Голубченко К.Э., Ильина Д.В., Сырко К.М. Хронический эндометрит – сложности диагностики (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (9): 12–18. DOI: 10.47407/kr2025.6.09.00p4533
Обоснование. Актуальность проблемы связана с отсутствием единой стратегии менеджмента пациенток с повторными неудачами имплантации при проведении процедур вспомогательных репродуктивных технологий, обусловленные хроническим эндометритом. В настоящее время в основном используются анамнестическо-визуальные (наличие женского фактора бесплодия, изменение толщины эндометрия при сонографии и относительно специфическая гистероскопическая картина хронического воспаления внутреннего слоя матки) и иммуногистохимические (основной – детекция плазматических клеток в эпителии эндометрия) маркеры данной патологии, при этом их точность до сих пор является предметом множества дискуссий. Статья посвящена обзорному анализу диагностических процедур и подходов к терапии хронического эндометрита у женщин с повторными неудачами имплантации в рамках репродуктивной медицины в целом и репродуктивной иммунологии в частности.
Цель. Критический анализ основных диагностических методов оценки рецептивности эндометрия при хроническом эндометрите.
Методы. Проведен анализ данных русско- и англоязычной научной литературы, посвященных исследованиям по оценке методов диагностики и лечения хронического эндометрита у женщин с нарушениями репродуктивной функции.
Результаты. Проанализированы более 80 исследований. Дана оценка основным методам диагностики хронического эндометрита как в ретроспективном, так и в современном аспекте.
Заключение. В настоящий момент в репродуктивной медицине не существует высокоспецифичных методов диагностики хронического эндометрита, что, с одной стороны, обусловливает необходимость комплексного подхода к оценке имплантационных свойств эндометрия, а, с другой стороны, стимулирует более углубленное исследование новых аспектов патогенеза данной патологии и поиск более точных маркеров диагностики.
Ключевые слова: инфертильность, хронический эндометрит, повторные неудачи имплантации, репродуктивная иммунология, диагностика, плазматические клетки.
Для цитирования: Боровиков И.О., Папоян Л.А., Ревенко Д.В., Голубченко К.Э., Ильина Д.В., Сырко К.М. Хронический эндометрит – сложности диагностики (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (9): 12–18. DOI: 10.47407/kr2025.6.09.00p4533
Chronic endometritis – diagnosing difficulties (review)
Igor O. Borovikov, Lidiya A. Papoyan, Daria V. Revenko, Kirill E. Golubchenko, Daria V. Ilyina,Karina M. Syrko
Kuban State Medical University, Krasnodar, Russia
ktrnkzhvnkv@gmail.com
Abstract
Background. The relevance of the problem is associated with the lack of a unified strategy for managing patients with repeated implantation failures during assisted reproductive technology procedures due to chronic endometritis. Currently, anamnestic-visual (the presence of a female factor of infertility, a change in the thickness of the endometrium during sonography and a relatively specific hysteroscopic picture of chronic inflammation of the inner layer of the uterus) and immunohistochemical (the main one is the detection of plasma cells in the endometrial epithelium) markers of this pathology are mainly used, while their accuracy is still the subject of many discussions and does not allow methods for eliminating infertility. The article is devoted to a review analysis of diagnostic procedures and approaches to the treatment of chronic endometritis in women with repeated implantation failures within the framework of reproductive medicine in general and reproductive immunology.
Objectives. Critical analysis of the main diagnostic methods for assessing the receptivity of the endometrium in chronic endometritis.
Methods. An analysis of data from Russian- and English-language scientific literature devoted to studies to assess methods for diagnosing chronic endometritis in women with reproductive disorders.
Results. More than 80 studies were analyzed in this publication. The main methods of diagnosis of chronic endometritis both in retrospective and in the modern aspect are evaluated.
Conclusion. Now, in reproductive medicine, there are no highly specific methods for diagnosing chronic endometritis, which, on the one hand, necessitates an integrated approach to assessing the implantation properties of the endometrium, and, on the other hand, stimulates a more in-depth study of new aspects of the pathogenesis of this pathology and the search for more accurate diagnostic markers.
Keywords: infertility, chronic endometritis, repeated implantation failures, reproductive immunology, diagnostics, plasma cells.
For citation: Borovikov I.O., Papoyan L.A., Revenko D.V., Golubchenko K.E., Ilyina D.V., Syrko K.M. Chronic endometritis – diagnosing difficulties (review). Clinical review for general practice. 2025; 6 (9): 12–18(In Russ.). DOI: 10.47407/kr2025.6.09.00p4533
Введение
В последние годы репродуктивная иммунология стремительно развивается, превращаясь в отдельную область науки. Она занимается изучением патологий в репродуктивной системе, таких как повторные неудачи имплантации (Recurrent Implantation Failure – RIF) и привычное невынашивание. Эти проблемы связаны с аномальной экспрессией иммунных факторов, что подтверждается увеличением числа диагностических тестов, позволяющих выявлять изменения во внутреннем слое матки (эндометрии) путем количественной оценки различных типов иммунных клеток [1, 2]. Разнообразие иммунных маркеров и сложность их точной интерпретации приводят к широкому спектру вмешательств в иммунитет пациенток, особенно при длительном бесплодии и многократных неудачах вспомогательных репродуктивных технологий [1–3]. Однако, как правило, не учитывается несколько важных факторов: 1) пластичность и изменчивость большинства иммунокомпетентных клеток в женской репродуктивной системе;2) недостаточная изученность их функций, которые меняются в зависимости от фазы менструального цикла – это затрудняет понимание их роли в имплантации эмбриона и наступлении беременности; 3) ошибочное предположение, лежащее в основе одной из фундаментальных гипотез репродуктивной иммунологии – «парадокса Медавара», – гипотеза предполагает иммунологическое отторжение и толерантность к полуаллогенным трансплантатным эмбрионам [4].
В настоящее время многие аспекты репродуктивной иммунологии активно применяются в практике ведения пациенток, страдающих от привычных потерь беременности и неудачных попыток экстракорпорального оплодотворения. Особенно показательным в этом плане является диагностика и лечение хронического эндометрита (ХЭ). Используя термин «chronic endometritis», в базе данных PubMed 2022 г. можно найти в общей сложности 71 совпадение, тогда как в 2012 г. их было 11, что свидетельствует о возрастающем интересе к данной патологии. А в большинстве европейских стран диагностика и терапия ХЭ уже включена в действующие клинические рекомендации по привычному невынашиванию беременности. В случае наличия привычных выкидышей для исключения ХЭ у пациентки производится биопсия эндометрия с иммуногистохимической оценкой биоптата и типированием плазматических клеток (ПК) – CD138+ (синдекан-1), оценкой количества трансмембранного протеогликана гепарана сульфата I типа [5]. Кроме того, в данные клинические рекомендации включены схемы возможной антибиотикотерапии, которые могут быть применены для профилактики прерывания беременности в случае диагностики ХЭ [5, 6]. В Российской Федерации интерес к проблеме ХЭ также не вызывает сомнений – в поисковой базе библиотеки ELibrary.ru найдено 82 научных статьи с его упоминанием (2013–2023 гг.), а в клинических рекомендациях Российского общества акушеров-гинекологов (РОАГ) 2021 г. («Привычный выкидыш») одной из причин привычного невынашивания назван ХЭ, но при этом «не рекомендовано рутинно направлять пациентку на проведение биопсии эндометрия» [7].
Одной из ключевых проблем современной репродуктивной медицины, вызывающей множество споров, является неоднозначность существующих диагностических критериев ХЭ. В этом обзоре авторы постараются обобщить основные подходы к диагностике ХЭ и выделить ключевые иммунопатогенетические аспекты, которые следует учитывать как в процессе постановки диагноза, так и в лечении таких пациенток.
История проблемы или трудный путь к определению и диагностике хронического эндометрита
Эндометрит представляет собой воспалительный процесс, поражающий слизистую оболочку матки. Как правило, основные причины этого заболевания – бактериальные или, реже, вирусные инфекции – в основном предотвращаются благодаря двум важным факторам: 1) менструации – эндометрий отделяется во время менструации, что снижает риск возникновения инфекции; 2) структуре репродуктивного тракта – женский репродуктивный тракт можно условно разделить на две области, каждая из которых обладает своим уникальным набором иммунных клеток: верхний отдел – эта область включает эндоцервикс, матку и фаллопиевы трубы, где наблюдается низкая концентрация микроорганизмов; нижний отдел – микробиом этой области (влагалище и эктоцервикс) характеризуется высокой микробиологической нагрузкой [8, 9]. Эпителиальные клетки шейки матки обеспечивают два барьера: физический – он состоит из слизи и эпителиальных пластов, которые служат преградой для инфекций; иммунологический – этот барьер формируется из клеток, выполняющих иммунорегуляторные функции, что также способствует защите от инфекций [9, 10]. Теоретически, воспаление может возникнуть только тогда, когда эти естественные барьеры нарушены, в первую очередь это относится к событиям, связанным с абортом или родоразрешением [11, 12]. В отличие от острого эндометрита, его хроническая форма в основном протекает бессимптомно, поэтому и оставалась в значительной степени неопределенной до начала XX в. В 1911 г. британские акушеры-гинекологи Archibald Donald и W. Fletcher Shaw заявили: «Во всей области гинекологии нет случаев, столь распространенных, как те, которые обычно называются “хроническим эндометритом”. Этот термин обычно используется для обозначения класса случаев, которые клинически хорошо известны, но трудно поддаются определению. То, что вся предметная область все еще находится в состоянии замешательства, очевидно для всех, чей долг состоит в том, чтобы попытаться дать четкий отчет о малой гинекологии студентам-медикам» [13]. Эта ситуация изменилась благодаря новаторской для того времени работе чешского и австрийского гинекологов – Фрица Хитшмана (Fritz Hitschmann) и Людвига Адлера (Ludwig Adler) [14]. Они полностью пересмотрели диагностический термин «хронический эндометрит», включая его многочисленные классификации, и отвергли термин endometritis glandularis, который был ранее придуман патологоанатомом Карлом Руге (Carl Ruge) [15]. Данные исследователи впервые осознали, что основополагающие принципы некоторых специфических гистологических наблюдений носят не патологический, а физиологический характер. Более того, они первыми признали важную роль ПК в воспалительных процессах эндометрия и постулировали их наличие в качестве уникального критерия диагностики пациенток с ХЭ: «Мы склонны делать обнаружение плазматических клеток диагностическим критерием для хронического эндометрита» [14].

До недавнего времени это было единственным надежным диагностическим критерием ХЭ. Во многом это связано с отсутствием специфических симптомов, которые могут указывать на наличие ХЭ. В некоторых случаях эта патология может проявляться аномальным маточным кровотечением или неясным дискомфортом в области таза, однако у большинства женщин она протекает бессимптомно. В начале нового тысячелетия, после длительного периода пренебрежения как диагностическими, так и патогенетическими аспектами ХЭ, интерес к эндометриальным причинам бесплодия значительно возрос. Это нашло отражение в широком спектре предлагаемых тестов, направленных на оценку рецептивности эндометрия. Однако и этот все возрастающий бум интереса создает ряд проблем. Существует много теорий, постулирующих, что ХЭ может негативно повлиять на женскую фертильность и течение беременности. Данные теории охватывают: измененную децидуализацию эндометрия [16]; изменения в профиле экспрессии генов эндометрия (таких как инсулиноподобный фактор роста-1, В-клеточная лимфома 2, Bcl-2-ассоциированный X и др.) [17]; различный состав иммунных или иммуномодулирующих клеток, таких как В-клетки, натуральные клетки-киллеры (NK-клетки), регуляторные Т-клетки (Treg) или субпопуляции Т-helper клеток Th1/Th2, Th17 [18–20], дисрегуляция цитокинов, измененная аутофагия [21] и различная микробиота женского репродуктивного тракта [22]; нарушение васкуляризации или маточная дисперистальтика [23]. Следует отметить, что все эти проблемы действительно могут влиять на женскую фертильность, но не могут рассматриваться отдельно. Так, липополисахариды микроорганизмов способны регулировать экспрессию цитокинов, которые, в свою очередь, ответственны за лейкоцитарную инфильтрацию, а LpS-зависимая активация Toll-подобных рецепторов может препятствовать имплантации эмбриона, что, по-видимому, связано с измененной экспрессией молекул адгезии в клетках эндометрия человека [18, 24, 25]. Тем не менее полностью достоверные и надежные исследования, которые могли бы обосновать эти утверждения, по-прежнему отсутствуют, не в последнюю очередь из-за того, что анализ транскриптома эндометрия и диагностика иммунных клеток далеко не просты, и при интерпретации результатов необходимо проявлять осторожность.
Кроме того, даже гистологический диагноз ХЭ не всегда отличается достоверностью, в связи с высокой вариацией параметров, и во многом зависит от опыта патологоанатома и различных методов окрашивания препаратов [23, 26]. Для канонического маркера ХЭ – ПК (CD138+) рекомендуется иммуноокрашивание как гарант их надежного обнаружения. Но при этом, инфекционная патология влагалища и особенно шейки матки могут фальсифицировать результаты, поскольку цервикальные ПК способны экспрессировать синдекан-1 [27, 28]. Однако наиболее серьезным ограничением диагностики ХЭ является отсутствие консенсуса в отношении количества ПК, необходимых для правильной интерпретации диагноза [23, 29]. В недавнем обзоре W. Huang и соавт. (2020) подробно рассмотрели этот вопрос и дали критическую оценку большинству принятых в настоящее время диагностических критериев:
в 12 исследованиях, включенных в этот метаанализ (одно исследование «случай-контроль», 5 ретроспективных и 6 проспективных исследований), было применено 6 различных диагностических критериев для ХЭ, что побудило авторов призвать к выработке единых диагностических критериев данной патологии [30].
Еще одной дискутабельной проблемой является статистика распространенности ХЭ, которая сильно различается не только между различными субпопуляциями, но и в пределах одних и тех же субпопуляций бесплодных пациентов (см. таблицу).
Хотя в настоящее время нет достоверных данных, большинство патоморфологов ставят диагноз на основании единственного критерия – наличия ПК в эндометрии [26]. Однако до сих пор не проведено надежных исследований, которые бы изучали возникновение эндометриальных ПК у фертильных женщин в разные фазы менструального цикла. При этом не учитывается, что ПК могут обнаруживаться и в эндометрии здоровых женщин, способных к деторождению [30]. Недавно было опубликовано проспективное многоцентровое исследование (2022), в котором приняли участие 80 молодых женщин, страдающих от бесплодия. Исследование показало, что более чем у половины пациенток были обнаружены ПК в количестве ≥1. Однако количество обнаруженных ПК не помогло предсказать успешную беременность в будущем [24]. Хотя другие исследования пришли к противоположным выводам, факт остается фактом: общие данные по этому вопросу все еще ограничены и разрознены [31–33].
Из-за отсутствия стандартизированных гистологических критериев гистероскопия все чаще предлагается в качестве важного подспорья для диагностики ХЭ, демонстрируя высокую точность для широкого спектра патологии матки, включая доброкачественные состояния, такие как миомы, полипы, гиперплазия эндометрия, а также рак эндометрия [24]. Гистероскопия, выполняемая в пролиферативной фазе менструального цикла, также может позволить идентифицировать признаки воспаления эндометрия [34–36]. Классическая гистероскопическая находка ХЭ чаще всего включает в себя эндометриальный «клубничный рисунок» с участками гиперемии с белыми участками в центре. Однако, исходя из нашего клинического опыта и согласно литературе, можно предположить, что такая картина на самом деле визуализируется достаточно редко [37, 38]. Многие клиницисты и исследователи отождествляют проявления ХЭ с пролиферативными изменениями слизистой оболочки (<1 мм) – микрополипами и стромальным отеком, однако большинство данных изменений эндометрия, по-видимому, имеют низкую диагностическую точность при нашем заболевании [39–42]. Хотя до сих пор не существует консенсуса в отношении гистероскопических критериев ХЭ, можно предположить, что исключить данную патологию можно, когда по крайней мере один из трех вышеперечисленных критериев ХЭ не подтвержден [40, 43, 44]. При этом, по мнению большинства авторов, гистероскопия, выполняемая опытным клиницистом, в сочетании с гистологической оценкой должна рассматриваться как наиболее специфичный критерий для диагностики ХЭ [45, 46].
Проанализировав сложности в диагностике ХЭ, еще хуже обстоят дела в методах его лечения. Особенно серьезной проблемой в этой части является отсутствие ясности в патогенезе ХЭ условно-патогенной микрофлоры как триггера аутоиммунного процесса с нарушением рецептивности эндометрия. Конечно, в первую очередь диагностика ХЭ должна в обязательном порядке включать оценку восходящей микрофлоры урогенитального тракта, что на самом деле часто не делается, так как считается довольно сложной и дорогостоящей процедурой, включающей отбор проб потенциальных патогенов из матки с низкой массой микробиоты через вагинальную микробиоту с высокой массой, что предполагает риск контаминации образцов. Еще одним моментом, представляющим большую сложность в интерпретации результатов бактериологического исследования, являются трудности в культивировании некоторых бактериальных штаммов, при этом инновационное и широко рекламируемое в настоящее время обнаружение определенных последовательностей 16S рРНК в слизистой оболочке эндометрия не дифференцирует живые бактерии или (мертвые) бактериальные фрагменты. Это может привести к неправильной постановке диагноза, хотя нельзя исключать, что даже неактивные бактериальные фрагменты все еще могут способствовать физиологическому взаимодействию с клетками-хозяевами и тем самым влиять на женскую фертильность [8].
В клинической практике терапия ХЭ часто приводит к применению антибиотиков широкого спектра действия без положительного результата теста на наличие соответствующих патогенов, при этом конечной точкой успешной терапии является уже не нивелирование (все еще не доказанного) патогена, а отсутствие ПК [47–49]. Такой подход к лечению ХЭ вызывает обоснованные сомнения как в отношении потенциальных побочных эффектов антибактериальной терапии, так и в необходимости ее применения, тем более, что наблюдается явное несоответствие в схемах применения различных типов антибиотиков, дозировках и продолжительности терапии [29, 50]. Кроме того, до сих пор не было проведено надежных рандомизированных исследований, которые бы продемонстрировали какие-либо преимущества в результате применения антибиотиков в лечении ХЭ, а тот факт, что даже антибиотики широкого спектра действия (например, доксициклин или амоксициллин) часто не способствуют уменьшению количества эндометриальных ПК, подрывает теорию ХЭ, индуцированного бактериями. И тут приходится признать, что тканевая воспалительная реакция предполагает не только микробную этиологию, но предполагается, что так называемое «асептическое» или «аутоиммунное» воспаление может принимать участие в патофизиологических состояниях, связанных с репродукцией, таких как эндометриоз, имплантация эмбриона, преждевременные роды, плацентарная недостаточность и преэклампсия [51]. Однако вышеперечисленные аспекты обычно не принимаются во внимание в лечении ХЭ и даже наоборот, чтобы подвергать сомнению текущие догмы, касающиеся его патогенеза, активно внедряются новые модифицированные комбинированные режимы антибактериальной терапии, которые часто используются в случае длительной персистенции ПК. К этому добавляется тот факт, что в последнее время существует много пиара вокруг важности микробиома матки для репродуктивного здоровья. Независимо от вопроса, оправдано это или нет, мы должны честно спросить себя, приносим ли мы больше вреда, чем пользы, применяя такие подходы к терапии.
Вспомогательные репродуктивные технологии – аспекты диагностики (гипердиагностики)
Без сомнения, существует множество доказательств того, что пациентки подвергаются гипердиагностике, что обусловлено двумя основными причинами: широким спектром патологии со сходной клинической картиной и чрезмерным количеством диагностических критериев. Хотя все еще существуют трудности даже в определении термина «гипердиагностика» и проведении четких границ между необходимым спектром исследований для постановки правильного диагноза и их избыточностью, нет никаких сомнений в том, что гипердиагностика является серьезной проблемой в здравоохранении [52–55]. Гипердиагностика может быть результатом: 1) все более чувствительных тестов; 2) случайных результатов или 3) чрезмерно расширенных определений диагностических критериев [56]. И эта проблема также актуальна в области репродуктивной медицины. Широкое применение предимплантационного генетического тестирования на анеуплоидии (PGT-A) с платформами секвенирования следующего поколения (NGS) с высоким разрешением полностью соответствует вышеупомянутым критериям – данные исследования позволили опровергнуть догму о том, что человеческие эмбрионы являются либо однородными эуплоидами, либо анеуплоидами. Было продемонстрировано, что немалая часть человеческих эмбрионов может быть классифицирована как хромосомные мозаики, имеющие смесь как аномальных, так и нормальных клеток. Заданные пороги для эуплоидных (т.е. <20% анеуплоидных клеток), анеуплоидных и мозаичных эмбрионов были установлены без биологических, но технических критериев (определяемых количеством трофэктодермных биопсийных клеток), что привело либо к браковке огромного количества эмбрионов с нормальным потенциалом беременности, либо к переносу «мозаичных» эмбрионов, что приводит к высокому уровню психологического стресса у пациентов после их переноса [57, 58]. Однако преимплантационное тестирование является ярким, но не единственным примером гипердиагностики в репродуктивной медицине.
Перечисленные пункты (все более чувствительные тесты, случайные результаты или чрезмерно расширенные определения диагностических критериев) также применяются к текущим критериям для диагностики ХЭ. Во-первых, иммуногистохимия CD138+ повышает чувствительность детекции ПК, во-вторых, если вы что-то ищете, вы что-то найдете – скрининг может выявить «случайные результаты» у лиц, проходящих тестирование по другим причинам. Хорошо известно, что имплантационные неудачи и привычные выкидыши считаются одними из самых сложных и спорных вопросов в репродуктивной медицине, с малоизученной до сих пор этиологией и, соответственно, патогенезом. Обнаружение эндометриальных ПК может быть случайной находкой и не обязательно быть связанной с перечисленными состояниями. И, в-третьих, чрезмерно расширенные определения диагностических критериев могут также применяться для предоставления достаточных доказательств диагностики ХЭ при обнаружении только одной или нескольких ПК.
Репродуктивная иммунология – пересмотр концепций
Помимо хромосомной нестабильности во время раннего эмбриогенеза, некоторых маточных факторов и неадекватных процессов эндометриально-эмбриональной синхронизации, иммунные девиации также предполагаются как ответственные за нарушение имплантационных свойств эндометрия и потерю эмбрионов. Причины этого очевидны – инфильтрация иммунокомпетентными клетками является основой клеточного компонента децидуальной оболочки, а специфические иммунные клетки незаменимы для достижения и поддержания беременности [59, 60]. Поэтому нет сомнений в том, что функциональная чувствительная иммунная система имеет решающее значение для установления успешной беременности.
Репродуктивная иммунология уже привлекала внимание в 1950-е годы прошлого, спровоцированная определением иммунологического парадокса беременности и постулированием концепции полуаллотрансплантата известным биологом Питером Медаваром (Peter Medawar), и его исследования по-прежнему представляют основу для многих аспектов современной иммунологии и трансплантационной медицины. Однако, что касается концепции полуаллотрансплантата, P. Medawar, вероятно, ошибался – предположение о том, что неудачи имплантации, выкидыш и преждевременные роды происходят в результате недостаточной иммуносупрессии матери, приводящей к отторжению эмбриона, было воспринято с энтузиазмом. Были проведены параллели между трансплантационной и репродуктивной иммунологией, и как фатальное последствие область трансплантационной медицины по-прежнему служит планом для многих репродуктивных аспектов, которые не могут быть исследованы in vivo. Тем не менее иммуномодулирующая терапия, такая как иммуноглобулины, интралипидная инфузия, применение гранулоцитарного колониестимулирующего фактора, мононуклеарных клеток периферической крови, подкожное введение ингибиторов фактора некроза опухоли-α, ингибирующего фактора лейкемии, глюкокортикоидов противовоспалительного действия и даже иммунодепрессантов, предлагается пациентам с повторными неудачами имплантации и привычным выкидышем на более или менее регулярной основе, при этом, согласно последним исследованиям, доказательств их эффективности не хватает и они не рекомендуются в клинической практике [61, 62]. В данном контексте не менее важно учитывать недавние выводы о том, что с эволюционной точки зрения имплантация эмбриона может быть результатом воспалительного процесса предков, а провоспалительный процесс является первым шагом и играет ключевую роль в беременности вида млекопитающих [63, 64]. Это, как следствие, не только влечет за собой риск терапевтической неэффективности из-за неправильной теории, но также может поставить под угрозу здоровье пациентов и желаемый результат экстракорпорального оплодотворения.
При этом, несмотря на вышеперечисленные несостыковки суждений, все больше расширяется спектр диагностических иммунологических тестов, которые предлагаются инфертильным пациенткам перед проведением вспомогательных репродуктивных технологий – и это не только тестирование плазмоцитов, но и других лимфоидных клеток, таких как Tregs, Т-клетки или естественные клетки-киллеры эпителия матки (uNK).
В частности, последние вызвали наибольшие дискуссии, учитывая тот факт, что NK-клетки составляют 50–90% лейкоцитов в децидуа и были предложены в качестве медиаторов клеточной цитотоксичности, и, соответственно, повышенный уровень uNK может рассматриваться как оказывающий отрицательное влияние на имплантацию и поддержание беременности. Однако в связи с этим возникает ряд вопросов: во-первых, вариации в количестве uNK в разных репродуктивных фазах огромные – их количество резко возрастает от пролиферативной до поздней секреторной фазы менструального цикла; кроме того, развитие этих клеток очень динамично во время беременности, показывая фенотипические различия, отраженные в чередовании экспрессии генов (например, экспрессия иммуноглобулиноподобных рецепторов клеток-киллеров (KIR) снижается с 6-й по 12-ю недели беременности, в то время как экспрессия NKG2D и NKp80 увеличивается во втором триместре) [59]. Однако наиболее важной проблемой является тот факт, что клеточная линия NK состоит из относительно гетерогенной и разнообразной популяции CD56+/CD3+, а эндометрий почти исключительно содержит CD56brightCD16 NK-клетки, при этом данная популяция NK не только демонстрирует более высокую по сравнению с периферическими NK-клетками экспрессию CD56 (CD56dim), но и активирует экспрессию CD9, CD49α и иммуносупрессивной молекулы PP14 [65]. Маточные NK-клетки также демонстрируют значительные различия в структуре экспрессии по сравнению с их периферическими аналогами: обнаружено по крайней мере 278 генов с более чем трехкратным изменением их экспрессии по сравнению с периферическими NK [66]. Кроме того, хотя NK-клетки и могут приобретать цитотоксическую способность при инфицировании децидуа, предполагается, что они скорее обладают иммуномодулирующими свойствами вместо цитотоксических эффекторных реакций, при этом современные результаты исследований, сделанные уже в начале этого тысячелетия, часто игнорируются [67]. Между тем эти исследования дают более четкую картину того, как uNK способствуют фундаментальным физиологическим процессам беременности в децидуа, участвуя в процессах установления и поддержания беременности, они не только способствуют инвазии экстравиллозного трофобласта (EVT) через прямое взаимодействие с его клетками, но и регулируют глубину инвазии [67, 68]. Также uNK способны к секреции матриксных металлопротеиназ, тем самым внося вклад в децидуа-ассоциированное ремоделирование сосудов и несколько ангиогенных факторов, включая фактор роста эндотелия сосудов, плацентарный фактор роста, и косвенно модифицируют спиральные артерии через их взаимодействие с EVT [67, 68].
В свою очередь, антигены основного комплекса гистосовместимости трофобласта класса I могут модулировать активность uNK-клеток. Это также справедливо для взаимодействия различных иммунных клеток. Например, NK-клетки играют важную роль в регуляции клеток Th17, в то время как клетки Th17, в свою очередь, индуцируют активацию uNK-клеток [69]. Сосредоточение внимания только на одной популяции иммунных клеток в таких сложных взаимодействующих путях несет в себе опасность искажения их истинной природы. По крайней мере, можно с достаточной вероятностью предположить, что uNK не представляют собой однородную и клеточную популяцию, при этом не только динамика экспрессии генов во время вынашивания плода подчеркивает эту картину – недавнее исследование на основе секвенирования одноклеточной РНК указывает на существование различных субпопуляций клеток uNK [70]. Хотя наше понимание развития и функции NK-клеток значительно продвинулось в последние годы, мы должны признать тот факт, что только начинаем понимать их огромную пластичность и их разнообразные функции – проблема исследования uNK in vivo препятствует поиску новых данных. Например, до сих пор неясно, привлекают ли локально секретируемые хемокины/цитокины NK-клетки к эндометрию, где они подвергаются местной дифференцировке, или же uNKs возникают из их предшественников в эндометрии [67].
Имеет ли смысл количественно оценивать такую динамичную клеточную популяцию с высокой пластичностью, которая до сих пор имеет неизвестное происхождение и развитие в основном с неизвестными функциями? Применительно к ситуации с ХЭ и ПК не следует предполагать, что разнообразность их взаимодействий менее сложна по сравнению с NK-клетками. ПК представляют собой дифференцированные антиген-активированные В-лимфоциты, которые могут выделять большое количество различных антител и, таким образом, являются неотъемлемой и эффективной частью гуморального иммунитета. Тем не менее в настоящее время признано, что они также являются важными производителями цитокинов, участвующих в процессах, независимых от секреции антител, таких как регуляция кроветворения, гомеостаз кишечника и др. [71, 72]. Тем не менее следует признать, что, вероятно, большинство функций ПК, независимых от антителообразования, еще предстоит выяснить и, кроме того, различные функции ПК могут также отражаться в огромной гетерогенности их субпопуляций [73].
Эндометриальные плазматические клетки – открытые вопросы
И в данном плане самый важный вопрос – представляет ли наличие эндометриальных ПК патологическую ситуацию. Хотя крупномасштабные исследования все еще отсутствуют, есть намеки на то, что данный вид
иммунокомпетентных клеток может присутствовать и при физиологических ситуациях [24, 30, 74]. Следует также помнить, что многие слои слизистой оболочки эндометрия охватывают в основном IgA-продуцирующие ПК, при этом данные антитела (IgA) не ограничиваются воспалительными функциями, но могут также обладать противовоспалительными свойствами. Найдены признаки того, что ПК, способные высвобождать IgA, не только сдерживают патогены, но и защищают комменсальную микробиоту [60, 75]. В настоящий момент, когда нет полных данных о свойствах ПК, предположение, что их низкое количество в эндометрии обладает защитными свойствами для микробиоты матки, преждевременно. Однако приведенные в этом обзоре данные должны способствовать уточнению взаимоотношений иммунокомпетентных клеток в столь уникальной среде, как эндометрий, при физиологических состояниях и на фоне ХЭ, повторных неудачах имплантации и привычных выкидышах, что необходимо для более широкого понимания такой относительно новой области медицины, как репродуктивная иммунология.
Заключение
Спустя более 100 лет после внедрения критериев Хитшмана–Адлера (Hitschmann–Adler) для ХЭ научное и клиническое сообщества созрели для необходимости пересмотра самого определения данной патологии [76, 77]. Будущие критерии ХЭ не должны основываться на единственном признаке – детекции ПК, а должны включать гистероскопические и морфологические результаты [26, 76–79]. Дополнительные иммунологические тесты и методы лечения, принимаемые с учетом изменений в них, в настоящее время не находят своей доказательной базы и не должны предлагаться пациентам, по крайней мере до тех пор, пока мы не сможем понять основы репродуктивной иммунологии и исключить риск причинения вреда нашим больным [38, 80, 81]. Хотя с точки зрения оценки локального иммунного статуса вполне разумно, что сложность многих аспектов, касающихся репродуктивной иммунологии, разделена на такие результаты, как количество uNK-клеток, соотношение Th1/Th2 и наличие ПК, хотя и данное разделение не может отразить весь комплекс физиологических процессов, происходящих в организме женщины и в целом не удовлетворяет требованиям современной репродуктивной медицины [38, 81].Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Боровиков Игорь Олегович – д-р мед. наук, доцент, проф. каф. акушерства, гинекологии и перинатологии №1, ФГБОУ ВО «Кубанский государственный медицинский университет».
ORCID: 0000-0001-8576-1359
Igor O. Borovikov – Dr. Sci. (Med.), Assoc. Prof., Kuban State Medical University. ORCID: 0000-0001-8576-1359
Папоян Лидия Андреевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: ktrnkzhvnkv@gmail.com; ORCID: 0009-0009-6220-7767
Lidiya A. Papoyan – Student, Kuban State Medical University.
E-mail: ktrnkzhvnkv@gmail.com; ORCID: 0009-0009-6220-7767
Ревенко Дарья Васильевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: daria.revenko@mail.ru; ORCID: 0009-0001-5809-6397
Daria V. Revenko – Student, Kuban State Medical University.
E-mail: daria.revenko@mail.ru; ORCID: 0009-0001-5809-6397
Голубченко Кирилл Эдуардович – студент 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: kgolubchenko@yandex.ru; ORCID: 0009-0006-5617-7683
Kirill E. Golubchenko – Student, Kuban State Medical University.
E-mail: kgolubchenko@yandex.ru; ORCID: 0009-0006-5617-7683
Ильина Дарья Витальевна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: dariailyina7@gmail.com; ORCID: 0009-0009-7637-9508
Daria V. Ilyina – Student, Kuban State Medical University. E-mail: dariailyina7@gmail.com; ORCID: 0009-0009-7637-9508
Сырко Карина Михайловна – студентка 6-го курса лечебного факультета, ФГБОУ ВО «Кубанский государственный медицинский университет». E-mail: syrkok@mail.ru; ORCID: 0009-0008-1645-9146
Karina M. Syrko – Student, Kuban State Medical University.
E-mail: syrkok@mail.ru; ORCID: 0009-0008-1645-9146
Поступила в редакцию: 10.02.2025
Поступила после рецензирования: 12.03.2025
Принята к публикации: 17.04.2025
Received: 10.02.2025
Revised: 12.03.2025
Accepted: 17.04.2025
Список исп. литературыСкрыть список1. Demirdag E, Guler I, Cevher Akdulum MF et al. Subsequent IVF outcomes following antibiotic therapy for chronic endometritis in patients with recurrent implantation failure. J Obstet Gynaecol Res 2022;47(12):4350-6. DOI: 10.1111/jog.15037
2. Murtinger M, Wirleitner B, Spitzer D et al. Diagnosing chronic endometritis: when simplification fails to clarify. Hum Reprod Open 2022;7(3):hoac023. DOI: 10.1093/hropen/hoac023
3. Darici E, Blockeel C, Mackens S. Should we stop screening for chronic endometritis? Reprod Biomed Online 2022;16:S1472-6483(22)00493-X. DOI: 10.1016/j.rbmo.2022.07.008
4. Giaimo S. Medawar and Hamilton on the selective forces in the evolution of ageing. Hist Philos Life Sci 2021;43(4):124. DOI: 10.1007/s40656-021-00476-6
5. Hennessy M, Dennehy R, Meaney S et al. Clinical practice guidelines for recurrent miscarriage in high-income countries: a systematic review. Reprod Biomed Online 2021;42:1146-71. DOI: 10.1016/j.rbmo. 2021.02.014
6. Toth B, Würfel W, Bohlmann M et al. Recurrent Miscarriage: Diagnostic and Therapeutic Procedures. Guideline of the DGGG, OEGGG and SGGG (S2k-Level, AWMF Registry Number 015/050). Geburtshilfe Frauenheilkd 2018;78:364-81. DOI: 10.1055/a-0586-4568
7. Привычный выкидыш (МКБ-10: O26.2, N96). Клинические рекомендации Российского общества акушеров-гинекологов (РОАГ). Год утверждения (частота пересмотра): 2021. URL: https://roag-portal.ru/recommendations_obstetrics
Habitual miscarriage (ICD-10: O26.2, N96). Clinical recommendations of the Russian Society of Obstetricians and Gynecologists (ROAG). Year of approval (frequency of revision): 2021. URL: https://roag-portal.ru/recommendations_obstetrics (in Russian).
8. Benner M, Ferwerda G, Joosten I, van der Molen RG. How uterine microbiota might be responsible for a receptive, fertile endometrium. Hum Reprod Update 2018;24:393-415. DOI: 10.1093/humupd/ dmy012
9. Barrios De Tomasi J, Opata MM, Mowa CN. Immunity in the Cervix: Interphase between Immune and Cervical Epithelial Cells. J Immunol Res 2019;7693183. DOI: 10.1155/2019/7693183
10. Shen M, O'Donnell E, Leon G et al. The role of endometrial B cells in normal endometrium and benign female reproductive pathologies: a systematic review. Hum Reprod Open 2021;1:hoab043. DOI: 10.1093/hropen/hoab043
11. Мелкозерова О.А., Башмакова Н.В., Есарева А.В. Проблемы коммуникации эмбриона и эндометрия: маркеры нарушений и механизмы влияния. Российский вестник акушера-гинеколога. 2016;16(5):29-36. DOI: 10.17116/rosakush201616529-36
Melkozerova O.A., Bashmakova N.V., Kesareva A.V. Problems of communication between the embryo and endometrium: markers of disorders and mechanisms of influence. Russian Bulletin of the obstetrician-gynecologist. 2016;16(5):29-36. DOI: 10.17116/rosakush201616529-36 (in Russian).
12. de Ziegler D. Chronic endometritis and embryo implantation: the great illusion. Fertil Steril 2022;118(4):637-8. DOI: 10.1016/j.fertnstert. 2022.08.017
13. Donald A, Shaw WF. The symptoms and treatment of chronic endometritis, with special reference to the results of curetting. Proc R Soc Med 1911;4:37-52
14. Hitschmann F, Adler L. Die Lehre von der Endometritits.
Z Geburtshilfe Gynäkol 1907;60:63-86.
15. Ruge C. Zur Aetiologie und Anatomie der Endometritits. Z Geburtshilfe Gynäkol 1880;5:317-23.
16. Wu D, Kimura F, Zheng L et al. Chronic endometritis modifies decidualization in human endometrial stromal cells. Reprod Biol Endocrinol 2017;15:16. DOI: 10.1186/s12958-017-0233-x
17. Di Pietro C, Cicinelli E, Guglielmino MR et al. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis. Am J Reprod Immunol 2013;69:509-17. DOI: 10.1111/aji.12076
18. Buzzaccarini G, Vitagliano A, Andrisani A et al. Chronic endometritis and altered embryo implantation: a unified pathophysiological theory from a literature systematic review. J Assist Reprod Genet 2020;37:2897-911. DOI: 10.1007/s10815-020-01955-8
19. Chen P, Chen P, Guo Y et al. Interaction between chronic endometritis caused endometrial microbiota disorder and endometrial immune environment change in recurrent implantation failure. Front Immunol 2021;12:748447. DOI: 10.3389/fimmu.2021.748447
20. Kitazawa J, Kimura F, Nakamura A et al. Alteration in endometrial helper T-cell subgroups in chronic endometritis. Am J Reprod Immunol 2021;85:e13372. DOI: 10.1111/aji.13372
21. Wang WJ, Zhang H, Chen ZQ et al. Endometrial TGF-β, IL-10, IL-17 and autophagy are dysregulated in women with recurrent implantation failure with chronic endometritis. Reprod Biol Endocrinol 2019;17:2. DOI: 10.1186/s12958-018-0444-9
22. Tanaka SE, Sakuraba Y, Kitaya K, Ishikawa T. Differential vaginal microbiota profiling in lactic-acid-producing bacteria between infertile women with and without chronic endometritis. Diagnostics (Basel) 2022;12:878. DOI: 10.3390/diagnostics12040878
23. Mount S, Mead P, Cooper K. Chlamydia trachomatis in the endometrium: can surgical pathologists identify plasma cells? Adv Anat Pathol 2001;8:327-9. DOI: 10.1097/00125480-200111000-00002
24. Herlihy NS, Klimczak AM, Titus S et al. The role of endometrial staining for CD138 as a marker of chronic endometritis in predicting live birth. J Assist Reprod Genet 2022;39(2):473-9. DOI: 10.1007/s10815-021-02374-z
25. Jain M, Samokhodskaya L, Mladova E, Panina O. Mucosal biomarkers for endometrial receptivity: A promising yet underexplored aspect of reproductive medicine. Syst Biol Reprod Med 2022;68(1):13-24. DOI: 10.1080/19396368.2021.1985186
26. Margulies SL, Dhingra I, Flores V et al. The diagnostic criteria for chronic endometritis: a survey of pathologists. Int J Gynecol Pathol 2021;40:556-62. DOI: 10.1097/PGP.0000000000000737
27. Groth JV. Chronic endometritis and the plasma cell, fact versus fiction. Fertil Steril 2018;109:788. DOI: 10.1016/j.fertnstert.2018.02.116
28. Яковчук Е.К., Сулима А.Н., Рыбалка А.Н. и др. Хронический эндометрит: современное состояние проблемы, основные аспекты патогенеза, влияние на репродуктивную функцию. Российский вестник акушера-гинеколога. 2016;16(5):37-41. DOI: 10.17116/ rosakush201616537-41
Yakovchuk E.K., Sulima A.N., Rybalka A.N. et al. Chronic endometritis: current state of the problem, main aspects of pathogenesis, impact on reproductive function. Russian Bulletin of the obstetrician-gynecologist. 2016;16(5):37-41. DOI: 10.17116/rosakush201616537-41 (in Russian).
29. Huang W, Liu B, He Y et al. Variation of diagnostic criteria in women with chronic endometritis and its effect on reproductive outcomes: a systematic review and meta-analysis. J Reprod Immunol 2020;140:103146. DOI: 10.1016/j.jri.2020.103146
30. Achilles SL, Amortegui AJ, Wiesenfeld HC. Endometrial plasma cells: do they indicate subclinical pelvic inflammatory disease? Sex Transm Dis 2005;32:185-8. DOI: 10.1097/01.olq.0000154491.47682.bf
31. McQueen DB, Bernardi LA, Stephenson MD. Chronic endometritis in women with recurrent early pregnancy loss and/or fetal demise. Fertil Steril 2014;101:1026-30. DOI: 10.1016/j.fertnstert.2013.12.031
32. Li Y, Xu S, Yu S et al. Diagnosis of chronic endometritis: how many CD138+ cells/HPF in endometrial stroma affect pregnancy outcome of infertile women? Am J Reprod Immunol 2021;85:e13369. DOI: 10.1111/aji.13369
33. Gkrozou F, Dimakopoulos G, Vrekoussis T et al. Hysteroscopy in women with abnormal uterine bleeding: a meta-analysis on four major endometrial pathologies. Arch Gynecol Obstet 2015; 291:1347-54. DOI: 10.1007/s00404-014-3585-x
34. Cicinelli E, Bettocchi S, de Ziegler D et al. Chronic endometritis, a common disease hidden behind endometrial polyps in premenopausal women: first evidence from a case-control study. J Minim Invasive Gynecol 2019;26:1346-50. DOI: 10.1016/j.jmig.2019.01.012
35. Guo L, Gu F, Tan J et al. Multiple endometrial polyps is associated with higher risk of chronic endometritis in reproductive-aged women. J Obstet Gynaecol Res 2021;47:389-96. DOI: 10.1111/jog.14541
36. Kuroda K, Horikawa T, Moriyama A et al. Impact of chronic endometritis on endometrial receptivity analysis results and pregnancy outcomes. Immun Inflamm Dis 2020;8:650-8. DOI: 10.1002/iid3.354
34. Оразов М.Р., Михалева Л.М., Семенов П.А. Хронический эндометрит: патогенез, диагностика, лечение и его связь с бесплодием. Клиническая и экспериментальная морфология. 2020;9(2):16-25. DOI: 10.31088/CEM2020.9.2.16-25
Orazov M.R., Mikhaleva L.M., Semenov P.A. Chronic endometritis: pathogenesis, diagnosis, treatment and its relation to infertility. Clinical and experimental morphology. 2020;9(2):16-25. DOI: 10.31088/CEM2020.9.2.16-25 (in Russian).
38. Краснопольская К.В., Назаренко Т.А., Ершова И.Ю. Современные подходы к оценке рецептивности эндометрия (обзор литературы). Проблемы репродукции. 2016;22(5):61-9. DOI: 10.17116/repro201622561-69
Krasnopolskaya K.V., Nazarenko T.A., Yershova I.Y. Modern approaches to assessing endometrial receptivity (literature review). Problems of reproduction. 2016;22(5):61-9. DOI: 10.17116/repro 201622561-69 (in Russian).
39. Tsonis O, Gkrozou F, Dimitriou E, Paschopoulos M. Hysteroscopic detection of chronic endometritis: Evaluating proposed hysteroscopic features suggestive of chronic endometritis. J Gynecol Obstet Hum Reprod 2021;50:102182. DOI: 10.1016/j.jogoh.2021.102182
40. Zolghadri J, Momtahan M, Aminian K et al. The value of hysteroscopy in diagnosis of chronic endometritis in patients with unexplained recurrent spontaneous abortion. Eur J Obstet Gynecol Reprod Biol 2011;155:217-20. DOI: 10.1016/j.ejogrb.2010.12.010
41. Wang S, Li F, Zhang W et al. Investigation of the Relationship between Chronic Endometritis Manifestations under Hysteroscope and CD138 Expression. Appl Bionics Biomech 2022;8323017. DOI: 10.1155/2022/ 8323017
42. Féghali J, Bakar J, Mayenga JM et al. Systematic hysteroscopy prior to in vitro fertilization. Gynecol Obstet Fertil 2003;31:127-31. DOI: 10.1016/s1297-9589(03)00007-9
43. Cicinelli E, Resta L, Nicoletti R et al. Detection of chronic endometritis at fluid hysteroscopy. J Minim Invasive Gynecol 2005;12:514-8. DOI: 10.1016/j.jmig.2005.07.394
44. Cicinelli E, Matteo M, Tinelli R et al. Prevalence of chronic endometritis in repeated unexplained implantation failure and the IVF success rate after antibiotic therapy. Hum Reprod 2015;30:323-30. DOI: 10.1093/humrep/deu292
45. Puente E, Alonso L, Laganà AS et al. Chronic endometritis: old problem, novel insights and future challenges. Int J Fertil Steril 2020;13:250-6. DOI: 10.22074/ijfs.2020.5779
46. La Marca A, Gaia G, Mignini Renzini M et al. Hysteroscopic findings in chronic endometritis. Minerva Obstet Gynecol 2021;73:790-805. DOI: 10.23736/S2724-606X.21.04970-8
47. Cicinelli E, Matteo M, Trojano G et al. Chronic endometritis in patients with unexplained infertility: Prevalence and effects of antibiotic treatment on spontaneous conception. Am J Reprod Immunol 2018;79:e12782. DOI: 10.1111/aji.12783
48. Zhang Y, Xu H, Liu Y et al. Confirmation of chronic endometritis in repeated implantation failure and success outcome in IVF-ET after intrauterine delivery of the combined administration of antibiotic and dexamethasone. Am J Reprod Immunol 2019;82:e13177. DOI: 10.1111/aji.13177
49. Kitaya K, Matsubayashi H, Takaya Y et al. Live birth rate following oral antibiotic treatment for chronic endometritis in infertile women with repeated implantation failure. Am J Reprod Immunol 2017;78:e12719. DOI: 10.1111/aji.12722
50. Sfakianoudis K., Simopoulou M., Nikas Y et al. Efficient treatment of chronic endometritis through a novel approach of intrauterine antibiotic infusion: a case series. BMC Women’s Health. 2018; 18: 197. DOI: 10.1186/s12905-018-0688-8
51. Negishi Y, Shima Y, Takeshita T, Morita R. Harmful and beneficial effects of inflammatory response on reproduction: sterile and pathogen-associated inflammation. Immunol Med 2021;44:98-115. DOI: 10.1080/25785826.2020.1809951
52. Kale MS, Korenstein D. Overdiagnosis in primary care: framing the problem and finding solutions. BMJ 2018;362:k2820. DOI: 10.1136/bmj.k2820
53. Rothberg MB, Class J, Bishop TF et al. The cost of defensive medicine on 3 hospital medicine services. JAMA Intern Med 2014;174:1867-8. DOI: 10.1001/jamainternmed.2014.4649
54. Johnston-MacAnanny EB, Hartnett J, Engmann LL et al. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization. Fertil Steril 2010;93:437-41. DOI: 10.1016/j.fertnstert.2008.12.131
55. McQueen DB, Perfetto CO, Hazard F.K et al. Pregnancy outcomes in women with chronic endometritis and recurrent pregnancy loss. Fertil Steril 2015;104:927-31. DOI: 10.1016/j.fertnstert.2015.06.044
56. Moynihan R, Doust J, Henry D. Preventing overdiagnosis: how to stop harming the healthy. BMJ 2012;344:e3502. DOI: 10.1001/10.1136/bmj.e3502
57. Murtinger M, Wirleitner B, Schuff M. Scoring of mosaic embryos after preimplantation genetic testing: a rollercoaster ride between fear, hope and embryo wastage. Reprod Biomed Online 2018;37:120-1. DOI: 10.1016/j.rbmo.2018.04.046
58. Gleicher N, Kushnir VA, Barad DH. How PGS/PGT-A laboratories succeeded in losing all credibility. Reprod Biomed Online 2018;37:242-5. DOI: 10.1016/j.rbmo.2018.06.019
59. Bulmer JN, Lash GE. Uterine natural killer cells: time for a re-appraisal? F1000Research 2019;8:999. DOI: 10.1016/10.12688/f1000research.19132.1
60. Bemark M, Angeletti D. Know your enemy or find your friend? – Induction of IgA at mucosal surfaces. Immunol Rev 2021;303:83-102. DOI: 0.1111/imr.13014
61. Nakagawa K, Kwak-Kim J, Ota K et al. Immunosuppression with tacrolimus improved reproductive outcome of women with repeated implantation failure and elevated peripheral blood TH1/TH2 cell ratios. Am J Reprod Immunol 2015;73:353-61. DOI: 10.1111/aji.12338
62. Mascarenhas M, Jeve Y, Polanski L et al. Management of recurrent implantation failure: British Fertility Society policy and practice guideline. Hum Fertil (Camb) 2021;5:1-25. DOI: 10.1080/14647273. 2021.1905886
63. Chavan AR, Griffith OW, Wagner GP. The inflammation paradox in the evolution of mammalian pregnancy: turning a foe into a friend. Curr Opin Genet Dev 2017;47:24-32. DOI: 10.1016/j.gde.2017.08.004
64. Moffett A, Shreeve N. Local immune recognition of trophoblast in early human pregnancy: controversies and questions. Nat Rev Immunol 2022;3:1-14. DOI: 10.1038/s41577-022-00777-2
65. Cooper MA, Fehniger TA, Turner SC et al. Human natural killer cells: a unique innate immunoregulatory role for the CD56(bright) subset. Blood 2001;97:3146-51. DOI: 10.1182/blood.v97.10.3146
66. Koopman LA, Kopcow HD, Rybalov B et al. Human decidual natural killer cells are a unique NK cell subset with immunomodulatory potential. J Exp Med 2003;198:1201-12. DOI: 10.1084/jem.20030305
67. Gaynor LM, Colucci F. Uterine natural killer cells: functional distinctions and influence on pregnancy in humans and mice. Front Immunol 2017;8:467. DOI: 10.3389/fimmu.2017.00467
68. Kanter JR, Mani S, Gordon SM, Mainigi M. Uterine natural killer cell biology and role in early pregnancy establishment and outcomes. F S Rev 2021;2(4):265-86. DOI: 10.1016/j.xfnr.2021.06.002
69. Pan D, Liu Q, Du L, Yang Y, Jiang G. Polarization disorder of decidual NK cells in unexplained recurrent spontaneous abortion revealed by single-cell transcriptome analysis. Reprod Biol Endocrinol 2022;20(1):108. DOI: 10.1186/s12958-022-00980-9
70. Vento-Tormo R, Efremova M, Botting R.A et al. Single-cell reconstruction of the early maternal-fetal interface in humans. Nature 2018;563:347-53. DOI: 10.1038/s41586-018-0698-6
71. Pioli PD. Plasma cells, the next generation: beyond antibody secretion. Front Immunol 2019;10:2768. DOI: 10.3389/fimmu.2019.02768
72. Shalapour S, Font-Burgada J, Di Caro G et al. Immunosuppressive plasma cells impede T-cell-dependent immunogenic chemotherapy. Nature 2015;521:94-98. DOI: 10.1038/nature14395
73. Delaloy C, Schuh W, Jäck H.M et al. Single-cell resolution of plasma cell fate programming in health and disease. Eur J Immunol 2022;52:10-23. DOI: 10.1002/eji.202149216
74. Chen YQ, Fang RL, Luo YN, Luo CQ. Analysis of the diagnostic value of CD138 for chronic endometritis, the risk factors for the pathogenesis of chronic endometritis and the effect of chronic endometritis on pregnancy: a cohort study. BMC Womens Health 2016;16:60. DOI: 10.1186/s12905-016-0341-3
75. Monteiro RC. Immunoglobulin A as an anti-inflammatory agent. Clin Exp Immunol 2014;178(1):108-10. DOI: 10.1111/cei.12531
76. Kitaya K, Takeuchi T, Mizuta S et al. Endometritis: new time, new concepts. Fertil Steril 2018;110:344-50. DOI: 10.1016/j.fertnstert. 2018.04.012
77. Song D, Feng X, Zhang Q et al. Prevalence and confounders of chronic endometritis in premenopausal women with abnormal bleeding or reproductive failure. Reprod Biomed Online 2018;36:78-83. DOI: 10.1016/j.rbmo.2017.09.008
78. Bouet PE, El Hachem H, Monceau E et al. Chronic endometritis in women with recurrent pregnancy loss and recurrent implantation failure: prevalence and role of office hysteroscopy and immunohistochemistry in diagnosis. Fertil Steril 2016;105:106-10. DOI: 10.1016/j.fertnstert.2015.09.025
79. Mitter VR, Meier S, Rau TT et al. Treatment following hysteroscopy and endometrial diagnostic biopsy increases the chance for live birth in women with chronic endometritis. Am J Reprod Immunol 2021;86(5):e13482. DOI: 0.1111/aji.13482
80. Singh N, Sethi A. Endometritis – Diagnosis, Treatment and its impact on fertility – A Scoping Review. JBRA Assist Reprod 2022;26(3):538-546. DOI: 10.5935/1518-0557.20220015
81. Gkrozou F, Tsonis O, Dimitriou E, Paschopoulos M. In women with chronic or subclinical endometritis is hysteroscopy suitable for setting the diagnosis? A systematic review. J Obstet Gynaecol Res 2020;46(9):1639-50. DOI: 10.1111/jog.14360
20 октября 2025
Количество просмотров: 270

