Клинический разбор в общей медицине №9 2025
Nodira Kh. Ruzieva3, Holidazhon S. Ikramova1
1 Urgench branch of the Tashkent Medical Academy, Urgench, Republic of Uzbekistan;
2 Tashkent Medical Academy, Tashkent, Republic of Uzbekistan;
3 Tashkent Pediatric Institute, Tashkent, Republic of Uzbekistan
gmatrizayeva@gmail.com
Abstract
Hyperprolactinemia, a condition characterized by elevated prolactin levels, is associated with various organic and functional factors, including pituitary adenomas, stress, hypothyroidism, and polycystic ovary syndrome (PCOS). This study investigates the impact of hyperprolactinemia on mineral metabolism and reproductive function in women, focusing on those with hypothyroidism and PCOS.
Aim. To study the effect of hyperprolactinemia on mineral metabolism in women with hyperprolactinemia syndrome and optimize the restoration of their reproductive function.
Materials and methods. A total of 134 women of reproductive age were included in the study, divided into two main groups: women with hypothyroidism and hyperprolactinemia (n=52) and women with PCOS and hyperprolactinemia (n=42). A control group of 40 healthy women was also included. The study was conducted in two stages: the first stage involved selecting women based on their underlying conditions and dividing them into subgroups based on treatment protocols (pathogenetic therapy with or without mineral complexes and vitamin D). The second stage focused on monitoring hormonal, biochemical, and obstetric outcomes in women who became pregnant after treatment.
Results. Key findings revealed that women with hyperprolactinemia, particularly those with PCOS, exhibited significant hormonal imbalances, including elevated LH levels, insulin resistance, and reduced bone mineral density. The addition of mineral complexes and vitamin D to standard treatment significantly improved pregnancy rates and reduced obstetric complications such as miscarriage, gestational hypertension, and preeclampsia. Women receiving combined treatment had higher pregnancy rates and fewer complications compared to those receiving only standard therapy. The study concludes that hyperprolactinemia significantly affects mineral metabolism and reproductive health, leading to complications such as osteopenia, hormonal dysregulation, and adverse pregnancy outcomes. The average calcium levels, which are key indicators of mineral metabolism, showed a significant difference between the groups. In women with hypothyroidism and hyperprolactinemia, the calcium level was 1.8±0.01, which was significantly lower than the normal range. In women with PCOS and hyperprolactinemia, this level was found at the lowest threshold of the normal range, which we attributed to the relative hyperestrogenism and androgenism in these women.
Conclusion. The inclusion of mineral supplements and vitamin D in the treatment regimen not only enhances reproductive function but also mitigates the risk of obstetric complications, highlighting the importance of a comprehensive approach to managing hyperprolactinemia in women with hypothyroidism and PCOS.
Keywords: hyperprolactinemia, mineral metabolism, osteopenia, pregnancy.
For citation: Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. Mineral metabolism and reproductive dysfunction in hyperprolactinemia. Clinical review for general practice. 2025; 6 (9): 26–36 (In Russ.). DOI: 10.47407/kr2025.6.9.00669
Патогенез гиперпролактинемического гипогонадизма. Патогенетические механизмы развития гиперпролактинемического гипогонадизма также являются многофакторными. К ним относятся: снижение или полное отсутствие тормозящего влияния дофамина на секрецию пролактина; усиление стимулирующего действия тиролиберина; нарушения секреции эстрогенов и андрогенов; гиперплазия лактотропных клеток гипофиза, обусловленная усиленным синтезом пролактина под воздействием мелатонина, серотонина, катехоламинов и простагландинов [3, 4].
Работы как отечественных, так и зарубежных авторов подтверждают наличие сложных биохимических процессов, происходящих в нейроэндокринной системе у пациенток с гиперпролактинемией [5].
Синдром гиперпролактинемии в большинстве случаев приводит к развитию гиперпролактинемического гипогонадизма и остается одной из центральных тем научных исследований уже на протяжении последних 30 лет.
С учетом выраженного влияния гиперпролактинемии на репродуктивную систему, приоритет в клинической и научной практике традиционно отдается изучению нарушений в репродуктивной сфере. Однако при этом остается слабо изученной особенность течения и патофизиология остеопенического синдрома, развивающегося на фоне данной патологии. Во время беременности потребность плода в кальции и фосфоре, необходимых для роста скелета, клеток и тканей, полностью обеспечивается за счет материнского организма [6, 7].
Фетоплацентарный комплекс активно абсорбирует кальций из организма матери. В период беременности в материнском организме происходят значительные изменения в обмене данного макроэлемента, направленные на удовлетворение потребностей плода в кальции [8].
При доношенной беременности происходит ремоделирование минерального гомеостаза в кортикальных отделах скелета женщины, что сопровождается увеличением минеральной плотности костной ткани: в нижних конечностях на +1,8%, в верхних конечностях на +2,8%. В то же время в трабекулярной костной ткани наблюдается снижение минеральной плотности: в области таза на –3,2%, в позвоночнике на –4,5%. В результате общие изменения минеральной плотности костной ткани остаются сбалансированными и практически неизменными [9, 10].
Остеопенический синдром при гиперпролактинемии. Изучение остеопенического синдрома при гиперпролактинемии представляет собой сложную задачу из-за многообразия этиологических факторов, вызывающих патологическую гиперпролактинемию. К ним относятся поражения гипоталамуса, патология гипофиза, наличие системных заболеваний, а также фармакологические влияния. Одним из осложнений гиперпролактинемии является нарушение костно-минерального обмена – остеопения или остеопороз. Этот процесс объясняется как дефицитом половых гормонов (в частности, эстрогенов у женщин), так и прямым действием пролактина на костную ткань. Формирование остеопенического синдрома при гиперпролактинемии имеет множество сложных и до конца не изученных особенностей этиопатогенеза. Надежные данные о снижении минеральной плотности костной ткани в области дистального отдела лучевой кости у женщин с гиперпролактинемией были впервые зафиксированы в 1980 г. [9].
У молодых девушек в возрасте 16–18 лет с гиперпролактинемией наблюдается быстрое снижение минеральной плотности костной ткани, что может быть связано с тем, что костная масса в этом возрасте еще не достигла своего физиологического пика и окончательно не сформирована. Ключевую роль в развитии остеопенического синдрома при гиперпролактинемии играет снижение продукции половых гормонов, прежде всего эстрогенов. Независимо от причины повышения уровня пролактина, он оказывает ингибирующее действие на гипоталамо-гипофизарно-гонадную систему, нарушая циклическую секрецию гонадотропинов и гонадолиберинов, что, в свою очередь, нарушает регуляцию репродуктивной функции и метаболизм костной ткани. Это приводит к снижению частоты и амплитуды секреции лютеинизирующего гормона (ЛГ), подавлению действия гонадотропинов на гонады, а также к снижению продукции половых стероидов – эстрогенов у женщин и андрогенов у мужчин, что, в конечном итоге, приводит к развитию синдрома гипогонадизма. Механизмы влияния половых гормонов на костную ткань обусловлены наличием рецепторов к эстрогенам и андрогенам в остеобластах, что делает костную ткань мишенью для действия этих гормонов [4, 11].
Оценка состояния кальций-регулирующих гормональных систем при гиперпролактинемии представляет собой важный патогенетический аспект, связанный с развитием гипоэстрогенизма на фоне гипогонадизма. Остеокласты обладают рецепторами к эстрогенам, и их ингибирующее действие на резорбцию костной ткани является доказанным. Поэтому снижение уровня эстрогенов в сыворотке крови приводит к активации остеокластов, усилению резорбции костной ткани и, как следствие, – к повышению уровня С-изомера телопептида коллагена I типа (β-CrossLaps или CL) в крови. Кроме того, установлено, что эстрогены снижают чувствительность костной ткани к действию паратиреоидного гормона и одновременно стимулируют синтез активной формы витамина D3 (кальцитриола) в почках, что также влияет на минеральный обмен. Повышение уровня пролактина нарушает функции на различных уровнях гипоталамо-гипофизарно-яичниковой системы. Сочетание гиперпролактинемии с такими эндокринными патологиями, как сахарный диабет, гипотиреоз и гиперандрогения, усиливает деструктивные изменения в фетоплацентарном комплексе и утяжеляет течение гестации. На сегодняшний день вопросы комплексного влияния гиперпролактинемии в сочетании с другими гормональными нарушениями на течение беременности и развитие плода изучены недостаточно [9, 12].
Таким образом, существует необходимость в комплексном исследовании особенностей течения беременности и родов у пациенток с синдромом гиперпролактинемии с позиций современных научных и методологических подходов.
Цель исследования – изучить влияние гиперпролактинемии на минеральный обмен у женщин с синдромом гиперпролактинемии и оптимизировать восстановление их репродуктивной функции.
“Al-Kharizmi” (договор №2, 2023 г.).
В запланированное исследование были включены
134 женщины репродуктивного возраста. Все участницы исследовательских групп являлись жительницами городов и сельской местности Хорезмской области.
Исследование проводилось в два этапа. На первом этапе были отобраны 94 женщины с гиперпролактинемией, ассоциированной с гипотиреозом или СПЯ.
В зависимости от этиологии гиперпролактинемии пациентки были распределены на две основные группы:
– 1-я группа – женщины с гипотиреозом и гиперпролактинемией (n=52);
– 2-я группа – женщины с СПЯ и гиперпролактинемией (n=42).
Контрольную группу составили 40 соматически здоровых женщин с регулярным менструальным циклом и отсутствием эндокринной патологии.
Каждая из двух основных групп была дополнительно разделена на две подгруппы в зависимости от полученного варианта лечения:
– группа 1а – женщины с гипотиреозом и гиперпролактинемией, получавшие патогенетическую терапию в сочетании с минеральными комплексами и холекальциферолом – витамин D (n=30);
– группа 1б – женщины с гипотиреозом и гиперпролактинемией, получавшие только патогенетическую терапию (n=22);
– группа 2а – женщины с СПЯ и гиперпролактинемией, получавшие патогенетическую терапию в сочетании с минеральными комплексами и холекальциферолом (n=22);
– группа 2б – женщины с СПЯ и гиперпролактинемией, получавшие только патогенетическую терапию (n=20).
На втором этапе, после завершения курса лечения, проводилась оценка гормонального, биохимического и инструментального статуса у женщин, у которых наступила беременность. Осуществлялось динамическое наблюдение за течением беременности и послеродовым периодом, включая акушерские исходы и осложнения.
Для динамического наблюдения за пациентками была разработана специальная анкета, включающая следующие параметры: жалобы, анамнез жизни и заболевания, особенности менструального цикла, состояние репродуктивной функции, а также данные объективного обследования – рост, масса тела и индекс массы тела (ИМТ). ИМТ рассчитывался по формуле: ИМТ=масса тела (кг) / рост2 (м2), при этом нормальными считались значения в пределах 18,5–25,0 кг/м2.
В программу клинико-лабораторного обследования вошли: биохимический и гормональный анализ крови, ультразвуковое исследование органов малого таза, определение уровней минералов и витамина D в сыворотке крови, денситометрия костной ткани, а также оценка вида и эффективности проведенного лечения.
Результаты анализа показали: в 1-й группе (женщины с гипотиреозом и гиперпролактинемией) у 22 (42,3%) пациенток были выявлены расстройства пищевого поведения. Во 2-й группе (женщины с СПЯ и гиперпролактинемией) данный показатель выявлен у 26 (61,9%) женщин. Различия между этими двумя группами были статистически значимыми (p<0,05). В контрольной группе только у 15% женщин наблюдались нарушения режима питания, что достоверно отличалось от обеих исследуемых групп (p<0,001).
Стресс оказался одним из ведущих факторов риска:
в 1-й группе стресс отмечался у 32 (61,5%) женщин, во 2-й группе – у 30 (71,4%) женщин, при этом различие между группами 1 и 2 было статистически незначимым (p>0,05). В контрольной группе стресс наблюдался у 8 (20%) женщин, что было достоверно ниже, чем в основных группах (p<0,01).
Гиподинамия была преимущественно характерна для 1-й группы – 22 (42,3%) пациентки, что статистически достоверно отличалось от групп 2 и 3 (p<0,001). Между 2-й и контрольной группой различий по уровню гиподинамии не выявлено (p>0,05). Возрастной состав женщин в исследуемых группах достоверных различий не показал (p>0,05). Преобладающее большинство участниц относились к репродуктивному возрасту – от 23 до 32 лет.
Анализ данных, касающихся особенностей менструального цикла и половой жизни обследованных женщин, показал следующие результаты: при оценке возраста наступления менструации было установлено, что возрастной диапазон 10–13 лет встречался у 72,5% женщин контрольной группы, что статистически достоверно отличалось от показателей 2-й группы (p<0,001) и 1-й группы (p<0,05). Это указывает на физиологичное развитие репродуктивной системы у женщин контрольной группы. Позднее наступление менструации (после 16 лет) наблюдалось только у женщин 2-й группы (с СПЯ), что также имело статистически значимую разницу при сравнении с другими группами (p<0,01). При сравнении длительности менструального цикла достоверных различий между 1-й и 2-й группами не выявлено (p>0,05). Однако в контрольной группе (3-я группа) большинство женщин имели менструации длительностью 3–5 дней, что достоверно отличалось от основных групп (p<0,001); табл. 1.
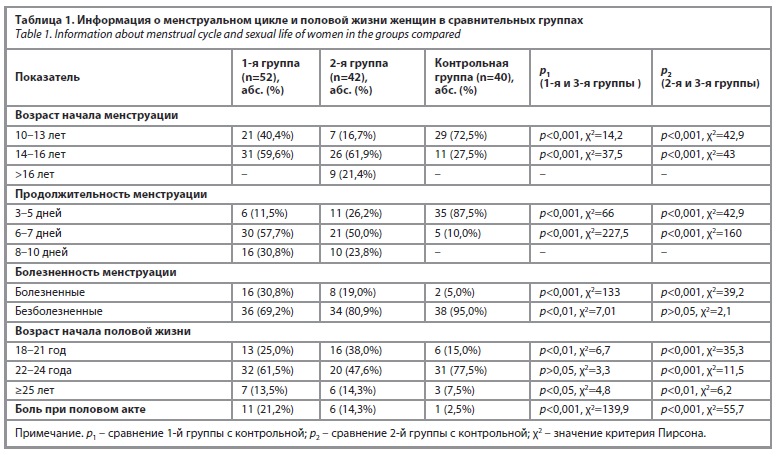
Анализ анамнестических данных показал, что частота гинекологических заболеваний в обеих основных группах была сравнимой. Однако при сопоставлении всех трех групп было установлено, что такие заболевания, как хронический эндометрит, вульвовагинит, эндоцервицит и эктопия шейки матки, чаще встречались у женщин 2-й группы (с СПЯ и гиперпролактинемией). Различия между группами оказались статистически значимыми (p<0,01).
Одной из основных задач нашего исследования было определение взаимосвязи между гиперпролактинемией и метаболическим синдромом у женщин, а также изучение его влияния на минеральный обмен. Результаты показали, что в контрольной группе у 85% женщин отмечалась нормальная масса тела, что статистически достоверно отличалось от показателей в основных группах (p1<0,05; χ2=1,88; p2<0,001; χ2=14,2).
При сравнении повышенного ИМТ наблюдались следующие данные: в 1-й группе – у 14 (26,9%) женщин, во 2-й группе – у 18 (42,9%) женщин, в контрольной группе – у 6 (15,0%) женщин. Эти различия также оказались статистически значимыми при сравнении с контрольной группой: p1<0,001; χ2=10,7, p2<0,001; χ2=24 (табл. 2).
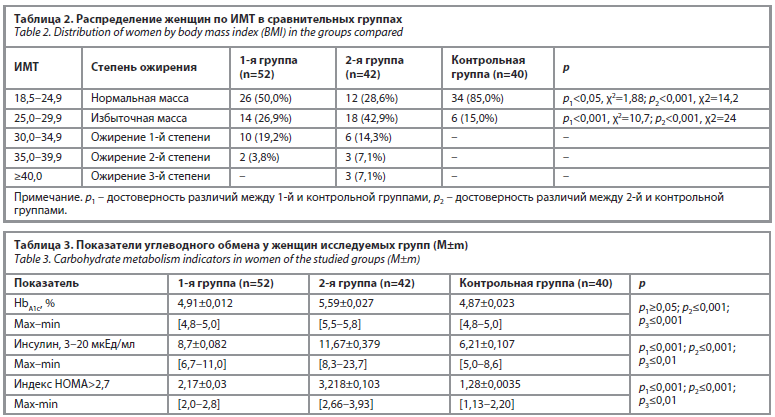
Ожирение разной степени наблюдалось только в основных группах, что подтверждает связь гиперпролактинемии с повышенным риском формирования метаболического синдрома. Это, в свою очередь, может способствовать развитию гинекологических и акушерских осложнений на более поздних этапах.
Цель проведения орального глюкозотолерантного теста (ОГТТ) заключалась в выявлении инсулинорезистентности у женщин исследуемых групп и оценке ее значения в патогенезе бесплодия. Тест применялся как диагностический инструмент, отражающий нарушение углеводного обмена, особенно в условиях гиперпролактинемии в сочетании с другими эндокринными патологиями. Наиболее значимые изменения наблюдались у женщин со СПЯ, что подтверждает прямую связь между инсулинорезистентностью и гиперандрогенией в данной группе. Полученные данные свидетельствуют о высокой распространенности метаболических нарушений у данной категории пациенток и возможной их роли в развитии репродуктивной дисфункции. Исходный уровень глюкозы (натощак) показал, что у большинства женщин 2-й группы (СПЯ) значения превышали норму. Средний уровень глюкозы в группах составил: 2-я группа – 6,24±0,2 ммоль/л; 1-я группа (гипотиреоз) – 5,72±0,2 ммоль/л; контрольная группа – 4,64±0,2 ммоль/л. Различия между группами были статистически значимыми: между 1-й и 2-й группами: p<0,05; между 2-й и контрольной группой: p<0,01.
Через 120 мин после ОГТТ: у женщин с гипотиреозом (1-я группа) – 7,2±0,2 ммоль/л; у женщин с СПЯ (2-я группа) – 7,84±0,2 ммоль/л; у женщин контрольной группы – 6,81±0,2 ммоль/л.
Показатели свидетельствуют о сохранении толерантности к глюкозе у женщин с гиперпролактинемией, однако во 2-й группе уровень остается выше, что может быть связано с инсулинорезистентностью и гиперандрогенией (табл. 3).
HbA1c: статистически значимо повышен у женщин 2-й группы по сравнению с 1-й и контрольной (p<0,01).
Инсулин: уровень наиболее высок в группе с СПЯ (p1-2<0,05, p2-3<0,01). Индекс HOMA превышает норму у женщин 2-й группы → признаки инсулинорезистентности. Индекс Caro у 2-й группы снижен по сравнению с контролем, что также отражает наличие инсулинорезистентности. Индекс HOMA-IR оказался преимущественно повышенным у женщин 2-й группы (с СПЯ). Различия между этой группой и остальными были статистически значимыми (p<0,01), что свидетельствует о более выраженной инсулинорезистентности у пациенток с СПЯ по сравнению с женщинами с гипотиреозом и контрольной группой. Гиперинсулинемия при СПЯ может быть обусловлена наличием инсулинорезистентности, и ее наличие объективно оценивается с помощью индекса HOMA-IR, который отражает функциональное состояние β-клеток поджелудочной железы. Анализ показал, что степень инсулинорезистентности по индексу HOMA-IR у женщин с СПЯ и ожирением была в 2 раза выше, чем у пациенток с СПЯ без ожирения. Это может быть связано с увеличением массы β-клеток у женщин с СПЯ и их гиперфункцией, что приводит к усиленной секреции инсулина – типичному проявлению инсулинорезистентности.
На следующем этапе исследования проводился анализ гормонального профиля пациенток. Для этого женщины сдавали кровь на 2–3-й день менструального цикла, в утренние часы (между 08:00 и 09:00), в состоянии физиологического покоя (до еды, в спокойной обстановке). Полученные результаты гормонального обследования представлены в табл. 4.
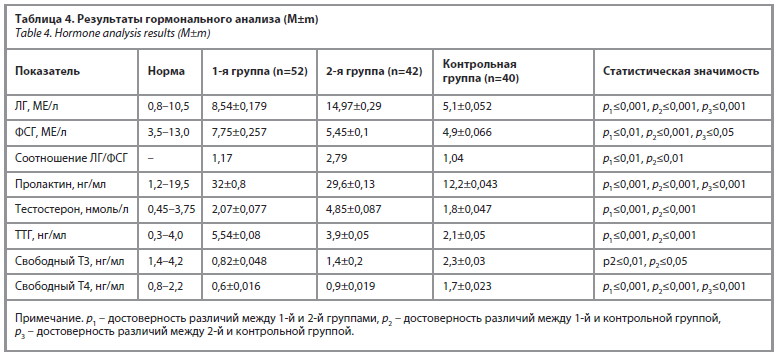
Согласно полученным результатам, у женщин с СПЯ на 3–5-й день менструального цикла уровень ЛГ составил 14,97±0,29 МЕ/л, тогда как в группе пациенток с гиперпролактинемией и гипотиреозом данный показатель был 8,54±0,179 МЕ/л, а в контрольной группе – 5,1±0,052 МЕ/л. Эти различия были статистически достоверными между 1-й и 2-й группами, а также между 2-й и 3-й группами (p<0,01).
Уровень фолликулостимулирующего гормона (ФСГ) не продемонстрировал статистически значимых различий между 2-й и 3-й группами: значения составили 5,45±0,1 МЕ/л и 4,9±0,066 МЕ/л соответственно. У женщин с гипотиреозом (1-я группа) этот показатель был относительно выше – 7,75±0,257 МЕ/л, однако различие со 2-й группой не достигло статистической значимости (p>0,05). Кроме того, соотношение ЛГ/ФСГ составило в среднем 2,7 во 2-й группе и 1,04 в контрольной группе, что свидетельствует о достоверной разнице (p<0,01). Такое нарушение соотношения ЛГ/ФСГ у женщин с СПЯ указывает на более выраженную дисфункцию гипоталамо-гипофизарной системы, характерную для этой патологии.
Особого внимания заслуживает уровень пролактина. У женщин основных исследуемых групп концентрация данного гормона превышала физиологические нормы, однако его показатели были значительно выше в 1-й группе по сравнению со 2-й: 32±0,8 нг/мл против 29,6±0,13 нг/мл. Тем не менее данное различие не достигло статистической значимости (p>0,05). Полученные значения соответствуют вторичной патологической гиперпролактинемии, отличной от гиперпролактинемии, вызванной аденомами гипофиза, при которых уровни пролактина значительно выше. Следует отметить, что в контрольной группе ни у одной женщины не было выявлено повышения уровня пролактина, что также подтверждает достоверность наблюдаемых отличий между контрольной и основными группами. Пролактин также оказывает воздействие на рецепторы волосяных фолликулов, что способствует развитию гирсутизма и повышению уровня эстрогенов. Снижение тормозного влияния дофамина на секрецию пролактина приводит к умеренной гиперпролактинемии, сопровождающейся повышением уровня ЛГ.
У женщин 1-й группы (с гипотиреозом) наблюдались изменения уровня тиреотропного гормона (ТТГ), варьирующие от 5,54 до 7,4 мЕд/л. При сравнении уровней ТТГ между всеми группами значения оставались в пределах референсных норм, однако в группе 2 (женщины с СПЯ и гиперпролактинемией) средний уровень ТТГ находился на верхней границе нормы, что имело статистически значимую разницу по сравнению с другими группами (p<0,05). Этот феномен был интерпретирован как стимулирующее влияние повышенного уровня пролактина на продукцию ТТГ, что объясняется нарушением регуляции гипоталамо-гипофизарной оси при гиперпролактинемии.
Таким образом, у пациенток с метаболическими нарушениями отмечалась высокая степень гиперпролактинемии, сопровождавшаяся изменениями липидного спектра крови и нарушением функционального состояния печени. Особенно выделялись пациентки 2-й группы, у которых было зарегистрировано повышенное соотношение ЛГ/ФСГ, что в большей степени выражалось у женщин с метаболическим синдромом. Согласно нашим данным, прогностически значимым фактором у женщин с СПЯ является повышенный уровень ЛГ, который сопровождается увеличением объема яичников и способствует их полицистической трансформации, указывая на наличие инсулинорезистентности.
Данная комбинация клинических и лабораторных признаков свидетельствует о синергическом эффекте инсулина и ЛГ, в результате которого происходит формирование поликистозных яичников.
С целью исследования минерального обмена у женщин с гиперпролактинемией на первом этапе были проведены сравнительные анализы уровней гормонов, регулирующих обмен витаминов и минералов, между основными группами и контрольной. Эти гормоны оказывают прямое влияние на минеральный обмен, особенно в аспекте фосфорно-кальциевого и магниевого гомеостаза. Нормальные уровни витамина D были выявлены: у 11 (21,2%) женщин в 1-й группе (гипотиреоз + гиперпролактинемия), 6 (14,3%) женщин во второй группе (СПЯ + гиперпролактинемия), 32 (80%) женщин в контрольной группе. Различия с контрольной группой оказались статистически значимыми (p1<0,001; χ2=43,2, p2<0,001; χ2=53,9). Дефицит и недостаточность витамина D значительно чаще встречались у женщин с гиперпролактинемией на фоне гипотиреоза и СПЯ. Несмотря на отсутствие статистически значимых различий между двумя основными группами, по сравнению с контрольной группой выявлены достоверные различия: p1<0,001; χ2=29,3; p2<0,001; χ2=45.
Анализ уровней гормонов, контролирующих минеральный обмен, показал, что повышение уровня паратиреоидного гормона (ПТГ) сопровождалось снижением уровня кальцитонина в крови. Такие изменения были особенно выражены у женщин с гипотиреозом и синдромом гиперпролактинемии. Это свидетельствует о том, что у данной группы женщин минеральный обмен подвергся значительным нарушениям по сравнению с другими исследуемыми группами. Данные представлены в табл. 5, где наглядно отражены различия в концентрациях гормонов, участвующих в регуляции кальциево-фосфорного обмена.
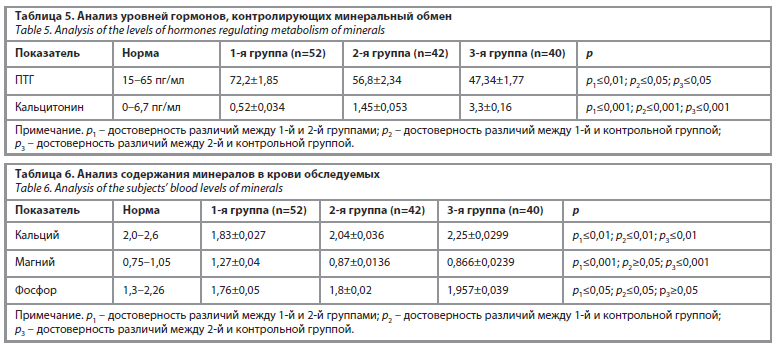
В 1-й группе – у женщин с гиперпролактинемией на фоне гипотиреоза – уровень ПТГ составил 72,2±1,85 пг/мл, что превышало верхнюю границу нормы (15–65 пг/мл). Во 2-й группе – у пациенток с гиперпролактинемией, связанной с СПЯ, данный показатель был 56,8±2,34 пг/мл, а в контрольной группе – 47,34±1,77 пг/мл. Согласно результатам статистического анализа, разница между 1-й группой и контрольной группой была достоверной (p1≤0,01), между 2-й группой и контрольной группой – также статистически значимой (p2≤0,05), а различия между 1-й и 2-й группами имели достоверный характер на уровне p3≤0,05 (см. табл. 5). Повышение уровня ПТГ на фоне гиперпролактинемии может приводить к вымыванию кальция из костной ткани и снижению его концентрации в крови. Особенно выраженно данный процесс проявляется в случаях, ассоциированных с гипотиреозом.
 Количество кальцитонина – гормона, выполняющего антагонистическую роль в кальциевом метаболизме, – в 1-й группе составило 0,52±0,034 пг/мл, во 2-й группе – 1,45±0,053 пг/мл, а в контрольной группе – 3,3±0,16 пг/мл. Различия между показателями имели высокую статистическую значимость: p1≤0,001, p2≤0,001 и p3≤0,001. Снижение уровня кальцитонина наиболее выражено отмечалось у женщин 1-й группы, что указывает на ослабление функции удержания кальция в костной ткани. Вместе с тем у женщин 2-й группы также было зафиксировано достоверное снижение уровня кальцитонина по сравнению с контрольной группой (см. табл. 5).
Количество кальцитонина – гормона, выполняющего антагонистическую роль в кальциевом метаболизме, – в 1-й группе составило 0,52±0,034 пг/мл, во 2-й группе – 1,45±0,053 пг/мл, а в контрольной группе – 3,3±0,16 пг/мл. Различия между показателями имели высокую статистическую значимость: p1≤0,001, p2≤0,001 и p3≤0,001. Снижение уровня кальцитонина наиболее выражено отмечалось у женщин 1-й группы, что указывает на ослабление функции удержания кальция в костной ткани. Вместе с тем у женщин 2-й группы также было зафиксировано достоверное снижение уровня кальцитонина по сравнению с контрольной группой (см. табл. 5).
Анализ уровней ПТГ и кальцитонина у женщин с гиперпролактинемией, особенно в сочетании с гипотиреозом, выявил выраженные нарушения минерального обмена. Эти изменения, в свою очередь, формируют патогенетическую основу для дисбаланса костной ткани, повышения риска остеопении и возникновения осложнений в ходе беременности. Подобные сдвиги наиболее явно проявлялись у пациенток с гиперпролактинемическим синдромом на фоне гипотиреоза, у которых нарушения минерального обмена были более выраженными по сравнению с другими группами. Мы связываем это как с изменением уровня пролактина, так и с изменением концентрации гормонов щитовидной железы, так как щитовидная железа непосредственно участвует в регуляции костного метаболизма, и любые колебания ее гормонов неизбежно отражаются на плотности костной ткани.
С целью оценки состояния минерального гомеостаза у женщин с синдромом гиперпролактинемии был проведен анализ содержания кальция, магния и фосфора в крови (табл. 6). Эти показатели имеют ключевое значение для оценки процессов костеобразования, эндокринной функции, а также для характеристики фетоплацентарной активности во время беременности.
В 1-й группе (гиперпролактинемия, ассоциированная с гипотиреозом) уровень кальция составил 1,83±0,027 ммоль/л, что значительно ниже нормы (2,0–2,6 ммоль/л). Во 2-й группе (гиперпролактинемия, связанная с СПЯ) данный показатель равнялся 2,04±0,036 ммоль/л, тогда как в контрольной группе он составлял 2,25±0,0299 ммоль/л. Различия между всеми группами были статистически значимыми: p1≤0,01, p2≤0,01, p3≤0,01. Эти результаты могут свидетельствовать о нарушениях всасывания или метаболизма кальция на фоне гиперпролактинемии.
В 1-й группе уровень магния составил 1,27±0,04 ммоль/л, что превышает верхнюю границу нормы (референсные значения: 0,75–1,05 ммоль/л). При сравнении с контрольной группой выявлено статистически значимое различие (p1≤0,001). Во 2-й группе содержание магния было 0,87±0,0136 ммоль/л, а в 3-й группе (контроль) – 0,866±0,0239 ммоль/л. Различие между 2-й и 3-й группами оказалось статистически незначимым (p2≥0,05). Повышенный уровень магния в 1-й группе может указывать на электролитные нарушения, связанные с гипотиреозом (см. табл. 6).
Показатели фосфора в 1-й группе составили 1,76±0,05 ммоль/л, во 2-й группе – 1,8±0,02 ммоль/л, а в 3-й группе – 1,957±0,039 ммоль/л, оставаясь в пределах нормы (1,3–2,26 ммоль/л). Однако статистический анализ показал, что различия между 1-й и контрольной группами, а также между 2-й и контрольной группами, были достоверными (p1≤0,05 и p2≤0,05 соответственно). Различие между 2-й и 3-й группами оказалось статистически незначимым (p3≥0,05).
Средний уровень кальция в крови, являющийся одним из ключевых показателей минерального обмена, значительно различался между группами. У женщин с гиперпролактинемией на фоне гипотиреоза он составил 1,8±0,01 ммоль/л, что существенно ниже нормативных значений. У пациенток с гиперпролактинемией, связанной с микроаденомой гипофиза, данный показатель находился на нижней границе нормы, что мы связываем с наличием у этих женщин СПЯ и ановуляторных циклов, сопровождающихся относительным гиперэстрогенизмом и гиперандрогенизмом.
У женщин с гиперпролактинемией, особенно при сочетании с гипотиреозом, было выявлено снижение содержания кальция и фосфора в крови, а также повышение уровня магния. Эти изменения указывают на неблагоприятные сдвиги в метаболизме костной ткани, снижении способности к вынашиванию беременности и нарушении гормонального баланса. Данные показатели имеют важное значение в изучении метаболических нарушений, развивающихся на фоне синдрома гиперпролактинемии, и в разработке методов их коррекции.
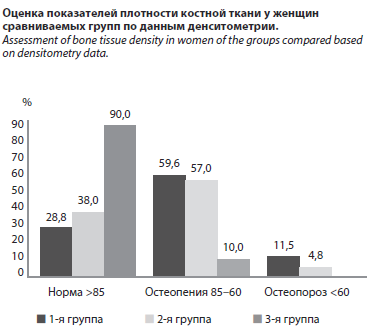
Минеральная плотность костной ткани является объективным показателем кальциевого метаболизма, минерального гомеостаза и процессов остеогенеза в организме. Это состояние тесно связано с гормональным дисбалансом и нарушением кальциевого обмена на фоне гиперпролактинемии, и было оценено методом денситометрии (см. рисунок).
По результатам анализа у женщин контрольной группы нормальная плотность костной ткани (T-показатель ≥ –1 SD) выявлена в 90% случаев, тогда как среди пациенток с гиперпролактинемией данный показатель составил лишь 28,8% в 1-й группе (с гипотиреозом) и 38% во 2-й группе (с СПЯ).
Состояние остеопении, указывающее на снижение плотности костной ткани, было выявлено в 59,6% случаев в 1-й группе и в 57% случаев во 2-й группе. В контрольной группе подобные изменения встречались крайне редко – лишь в 10% случаев (χ2>20, p<0,001). Эти данные свидетельствуют о том, что при гиперпролактинемии, особенно в ее варианте, протекающем на фоне гипотиреоза, остеопенические изменения имеют широкое распространение.
Более тяжелое патологическое состояние – остеопороз – диагностировано у 11,5% женщин 1-й группы и у 4,8% пациенток 2-й группы, тогда как в контрольной группе данный диагноз не был зафиксирован ни в одном случае. Различия между показателями групп имели высокую статистическую значимость (p1<0,001, p2<0,001, p3<0,001).
При гиперпролактинемии, особенно в случаях, сопровождающихся гипотиреозом, наблюдается выраженное снижение минеральной плотности костной ткани. Состояния остеопении и остеопороза значительно чаще регистрировались у женщин с гипотиреозом по сравнению с пациентками, имеющими СПЯ. Эти данные указывают на необходимость обязательного мониторинга состояния костной ткани у больных с гиперпролактинемией как на прегравидарном этапе, так и в гестационном периоде.
Результаты проведенного корреляционного анализа свидетельствуют о следующем: между минеральной плотностью костной ткани (T-score) и уровнем кальция выявлена прямая корреляционная связь средней силы (r=0,90, p<0,001). Это означает, что с повышением содержания кальция в крови вероятность увеличения плотности костной ткани также возрастает. Кроме того, между минеральной плотностью костной ткани и уровнем кальцитонина установлена выраженная прямая корреляция (r=0,96, p<0,001). Таким образом, увеличение концентрации кальцитонина связано с улучшением структуры костной ткани.
Полученные данные подтверждают прогностическую значимость показателей кальция и кальцитонина при оценке костного метаболизма на фоне гиперпролактинемии.
В рамках нашего исследования мы проводили овариальную стимуляцию у всех женщин с СПЯ, при этом продолжали назначение минеральных комплексов и витамина D. У пациенток с гипотиреозом индукторы овуляции не применялись – они получали только минеральные препараты и витамин D. Результаты, касающиеся наступления беременности в ходе наблюдения, представлены в табл. 7.
Согласно данным табл. 7, проведение прегравидарной подготовки у женщин с гиперпролактинемией оказывает значительное влияние на исход беременности.
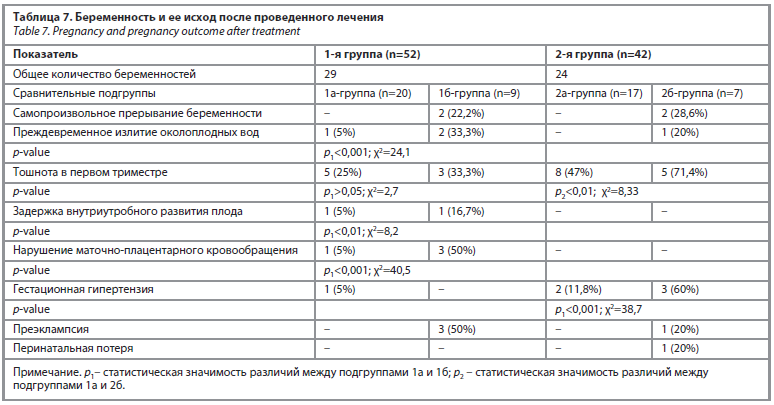
В обеих исследуемых группах – с гипотиреозом и с СПЯ – были выявлены выраженные различия в уровне сохранения беременности между подгруппами, где подготовка проводилась и не проводилась.
В 1-й группе (женщины с гиперпролактинемией на фоне гипотиреоза) среди пациенток, прошедших прегравидарную подготовку (подгруппа 1а, n=30), беременность сохранялась в 66,7% случаев (n=20). В подгруппе без подготовки (1б, n=22) этот показатель составил лишь 40,9% (n=9). Различие оказалось статистически значимым (χ2=16,3; p<0,001).
Во 2-й группе (женщины с гиперпролактинемией, связанной с микроаденомой гипофиза) в подгруппе с проведенной прегравидарной подготовкой (2а, n=22) беременность была сохранена в 77,3% случаев (n=17), тогда как без подготовки (2б, n=20) – только в 35% случаев (n=7). Различие также оказалось высоко статистически значимым (χ2=51,1; p<0,001).
В 1-й группе (женщины с гиперпролактинемией на фоне гипотиреоза) риск самопроизвольного выкидыша в подгруппе с проведенной прегравидарной подготовкой (1а, n=20) составил 50% (n=10), тогда как в подгруппе без подготовки (1б, n=9) он достигал 77,8% (n=7). Различие было статистически значимым (χ2=9,9; p1<0,001). Ретрохориальная гематома встречалась у женщин подгруппы 1а лишь в 1 (5%) случае, тогда как в подгруппе 1б данное осложнение было зарегистрировано у 22,2% (n=2) пациенток (χ2=13,3; p1<0,001). Замершая беременность и полный самопроизвольный выкидыш отмечались только в подгруппе 1б – без прегравидарной подготовки (соответственно 22,2 и 11,1%). Токсикоз беременных в виде рвоты наблюдался у 25% (n=5) женщин подгруппы 1а и у 33,3% (n=3) женщин подгруппы 1б. Данное различие не достигло статистической значимости (χ2=2,7; p1>0,05), однако сохранялась тенденция к более высокой частоте осложнения в подгруппе без подготовки.
Во 2-й группе (женщины с гиперпролактинемией, связанной с СПЯ) риск самопроизвольного выкидыша в подгруппе с прегравидарной подготовкой (2а, n=17) составил 47% (n=8), тогда как в подгруппе без подготовки (2б, n=7) он достигал 71,4% (n=5). Различие было статистически значимым (χ2=8,3; p2<0,01). Ретрохориальная гематома была зафиксирована только у одной пациентки подгруппы 2б (14,3%), тогда как в подгруппе с подготовкой данное осложнение не наблюдалось. Замершая беременность в подгруппе 2а не регистрировалась, тогда как в подгруппе 2б встречалась в 28,6% случаев (n=2). Токсикоз беременных в виде рвоты наблюдался у 47% (n=8) женщин подгруппы 2а и у 71,4% (n=5) женщин подгруппы 2б. Это различие также оказалось статистически значимым (χ2=8,33; p2<0,01). Таким образом, прегравидарная подготовка при наступлении беременности на фоне гиперпролактинемии позволяет значительно снизить частоту гинекологических осложнений. Наибольшая распространенность серьезных осложнений, таких как самопроизвольный выкидыш, ретрохориальная гематома и замершая беременность, отмечалась преимущественно в группах без подготовки. При этом сходная тенденция наблюдалась как у пациенток с гипотиреозом, так и у женщин с микроаденомой гипофиза.
Задержка внутриутробного роста плода наблюдалась в подгруппе 1а в 5% случаев (n=1), тогда как в подгруппе без подготовки – в 16,7% случаев (n=1) (χ2=8,2; p1<0,01). Гестационная гипертензия была зафиксирована только в подгруппе 1а – 5% (n=1) случаев, а в подгруппе 1б не встречалась. Преэклампсия, напротив, регистрировалась исключительно в подгруппе без подготовки (1б) – 50% случаев (n=3). Эти данные указывают на то, что беременность при гиперпролактинемии и гипотиреозе без адекватной подготовки сопровождается высоким риском тяжелых осложнений.
Во 2-й группе гестационная гипертензия отмечалась в подгруппе 2а (с подготовкой) в 11,8% случаев (n=2), тогда как в подгруппе 2б (без подготовки) – в 60% случаев (n=3), что было статистически значимым (χ2=38,7; p<0,001). Преэклампсия встречалась только в подгруппе 2б – 20% случаев (n=1). Перинатальная потеря также была зарегистрирована лишь в подгруппе без подготовки – 20% (n=1).
Таким образом, акушерские осложнения – в частности, преэклампсия, задержка внутриутробного роста плода, гестационная гипертензия и перинатальные потери – значительно чаще встречаются у женщин с гиперпролактинемией без прегравидарной подготовки.
В обеих группах проведение подготовительного этапа достоверно снижало частоту этих осложнений. Полученные данные подтверждают, что при планировании беременности у женщин с гиперпролактинемией крайне важно оценивать акушерские риски и устранять их на этапе подготовки. Комплексная терапевтическая подготовка играет ключевую роль в улучшении репродуктивного здоровья. Наши результаты убедительно показывают, что для достижения успешных репродуктивных исходов у женщин с гиперпролактинемией в прегравидарный период необходимо проводить всестороннюю оценку эндокринных, метаболических и нутритивных факторов и осуществлять целенаправленную подготовку.
В отличие от большинства исследований, сосредоточенных на гиперпролактинемии или СПЯ изолированно, в этой работе рассматривается влияние сочетания этих патологий на репродуктивное здоровье, минеральный обмен и исходы беременности.
Особое внимание уделено дефициту кальция и витамина D, что нередко упускается из виду в других работах, преимущественно ориентированных на гормональные нарушения. Полученные данные свидетельствуют о взаимосвязи между дефицитом данных микроэлементов и ухудшением репродуктивных функций, что подчеркивает необходимость комплексного подхода к лечению женщин с гиперпролактинемией и СПЯ, включающего не только гормональную коррекцию, но и восстановление минерального баланса. Кроме того, настоящее исследование представляет собой эксперимент по оценке эффективности комбинированной терапии, включающей стандартное лечение в сочетании с применением минеральных комплексов и витамина D. Такой подход является новаторским по сравнению с большинством исследований, в которых отдельно рассматриваются гормональная терапия или витаминно-минеральные добавки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело внешнего финансирования или спонсорской поддержки.
Financing. The study had no sponsorship.
Вклад авторов. Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. – формулирование концепции исследования и разработка его дизайна; Балтабаева Г.Ш., Муминова З.А. – сбор клинического и лабораторного материала; Балтабаева Г.Ш., Муминова З.А., Икрамова Х.С. – анализ и интерпретация полученных результатов; Хаитов А.О., Рузиева Н.Х. – обзор литературы и статистическая обработка данных; Матризаева Г.Д., Балтабаева Г.Ш. – написание первоначального варианта рукописи и подготовка ее окончательной редакции;
Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. – критический пересмотр рукописи с внесением существенного интеллектуального вклада. Все авторы одобрили окончательный вариант статьи перед публикацией и несут полную ответственность за все ее разделы, что подразумевает надлежащее изучение и разрешение всех вопросов, связанных с точностью и добросовестностью представленных данных.
Author contributions. Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. – concept statement and stady design; Baltabaeva G.S., Muminova Z.A – data collection; Baltabaeva G.S., Muminova Z.A, Ikramova Kh.S. – analysis and interpretation of the results; Khaitov A.O., Ruzieva N.H. – literature reviev and statistical analysis; Matrizaeva G.D., Baltabaeva G.S. – drafting of the manuscript and preparation of its final version; Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. – critical reviev of the manuscript with introduction of valuable intellectual content. All authors approved the final version of the paper before publication and assume responsibility for all aspects of the work, which implies proper study and resolution of issues related to the accuracy and integrity of any part of the work.
Информация об авторах
Information about the authors
Матризаева Гульнара Джуманиязовна – д-р мед. наук, доц., зав. каф. акушерства, гинекологии и онкологии, Ургенчский филиал Ташкентской медицинской академии. Е-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Gulnara D. Matrizaeva – Dr. Sci. (Med.), Assoc. Prof., Urgench Branch of the Tashkent Medical Academy. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Балтабаева Гулноза Шухрат кизи – ассистент, каф. акушерства и гинекологии, Ташкентская медицинская академия.
E-mail: gulnoza.gynecologist@gmail.com ORCID: 0009-0008-5427-1830
Gulnoza Sh. Baltabayeva – Аssistant, Tashkent Medical Academy. E-mail: gulnoza.gynecologist@gmail.com ORCID: 0009-0008-5427-1830
Муминова Зиёда Абраровна – д-р мед. наук, доц., каф. акушерства и гинекологии, Ташкентская медицинская академия.
E-mail: ziedamuminova@gmail.com; ORCID: 0000-0001-5188-7025
Ziyoda A. Muminova – Dr. Sci. (Med.), Assoc. Prof., Tashkent Medical Academy. E-mail: ziedamuminova@gmail.com; ORCID: 0000-0001-5188-7025
Хаитов Акбар Октамбаевич – канд. мед. наук, Ургенчский филиал Ташкентской медицинской академии. E-mail:
akbarshox033087@gmail.com; ORCID: 0009-0001-3051-565Х
Akbar O. Khaitov – Cand. Sci. (Med.), Urgench Branch of the Tashkent Medical Academy. E-mail: akbarshox033087@gmail.com; ORCID: 0009-0001-3051-565Х
Рузиева Нодира Хакимовна – д-р мед. наук, проф. каф. акушерства и гинекологии, Ташкентский педиатрический медицинский институт. E-mail: nod_ruz@internet.ru; ORCID: 0000-0003-0679
Nodira Kh. Ruzieva – Dr. Sci. (Med.), Prof., Tashkent Pediatric Medical Institute. E-mail: nod_ruz@internet.ru; ORCID: 0000-0003-0679
Икрамова Холидажон Сахибовна – канд. мед. наук, каф. акушерства и гинекологии, онкологии, Ургенчский филиал Ташкентской медицинской академии. E-mail: xolidajonikramova@gmail.com; ORCID: 0009-0007-1896-5205
Holidazhon S. Ikramova – Cand. Sci. (Med.), Urgench Branch of the Tashkent Medical Academy. E-mail: xolidajonikramova@gmail.com; ORCID: 0009-0007-1896-5205
Поступила в редакцию: 19.08.2025
Поступила после рецензирования: 28.08.2025
Принята к публикации: 04.09.2025
Received: 19.08.2025
Revised: 28.08.2025
Accepted: 04.09.2025
Клинический разбор в общей медицине №9 2025
Минеральный обмен и репродуктивные нарушения при гиперпролактинемии
Номера страниц в выпуске:26-36
Аннотация
Гиперпролактинемия – это патологическое состояние, характеризующееся повышенным уровнем пролактина, которое связано с различными органическими и функциональными факторами, включая аденомы гипофиза, стресс, гипотиреоз и синдром поликистозных яичников (СПЯ). В данном исследовании рассматривается влияние гиперпролактинемии на минеральный обмен и репродуктивную функцию у женщин, особенно у пациенток с гипотиреозом и СПЯ.
Цель. Изучить влияние гиперпролактинемии на минеральный обмен у женщин с синдромом гиперпролактинемии и оптимизировать восстановление их репродуктивной функции.
Дизайн. Открытое независимое проспективное исследование.
Материалы и методы. В исследование включены 134 женщины репродуктивного возраста, основная группа была разделена на две группы: 1-я группа – женщины с гипотиреозом и гиперпролактинемией (n=52); 2-я группа – пациентки с СПЯ в сочетании с гиперпролактинемией (n=42). Контрольную группу составили 40 соматически здоровых женщин с регулярным менструальным циклом и отсутствием эндокринной патологии.
Результаты. Основные результаты исследования показали, что у женщин с гиперпролактинемией, выявляются выраженные гормональные нарушения. Среди них – повышенный уровень лютеинизирующего гормона, инсулинорезистентность и снижение минеральной плотности костной ткани. Добавление минеральных комплексов и витамина D (холекальциферола) к стандартной терапии достоверно улучшало репродуктивные исходы: частота наступления беременности увеличивалась, а частота акушерских осложнений, таких как самопроизвольные выкидыши, гестационная артериальная гипертензия и преэклампсия, снижалась. У женщин, получавших комбинированную терапию, беременность наступала значительно чаще, а число осложнений было статистически ниже по сравнению с теми, кто получал только стандартное лечение.
Заключение. Включение минеральных добавок и витамина D в схему лечения способствует не только улучшению репродуктивной функции, но и снижению риска развития акушерских осложнений. Полученные результаты подчеркивают важность комплексного подхода к ведению женщин с гиперпролактинемией, особенно при наличии сопутствующего гипотиреоза и СПЯ. Такой многофакторный терапевтический подход позволяет эффективно воздействовать как на гормональные и метаболические нарушения, так и на улучшение клинических исходов беременности.
Ключевые слова: гиперпролактинемия, минеральный обмен, остеопения, беременность.
Для цитирования: Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. Минеральный обмен и репродуктивные нарушения при гиперпролактинемии. Клинический разбор в общей медицине. 2025; 6 (9): 26–36. DOI: 10.47407/ kr2025.6.9.00669
Гиперпролактинемия – это патологическое состояние, характеризующееся повышенным уровнем пролактина, которое связано с различными органическими и функциональными факторами, включая аденомы гипофиза, стресс, гипотиреоз и синдром поликистозных яичников (СПЯ). В данном исследовании рассматривается влияние гиперпролактинемии на минеральный обмен и репродуктивную функцию у женщин, особенно у пациенток с гипотиреозом и СПЯ.
Цель. Изучить влияние гиперпролактинемии на минеральный обмен у женщин с синдромом гиперпролактинемии и оптимизировать восстановление их репродуктивной функции.
Дизайн. Открытое независимое проспективное исследование.
Материалы и методы. В исследование включены 134 женщины репродуктивного возраста, основная группа была разделена на две группы: 1-я группа – женщины с гипотиреозом и гиперпролактинемией (n=52); 2-я группа – пациентки с СПЯ в сочетании с гиперпролактинемией (n=42). Контрольную группу составили 40 соматически здоровых женщин с регулярным менструальным циклом и отсутствием эндокринной патологии.
Результаты. Основные результаты исследования показали, что у женщин с гиперпролактинемией, выявляются выраженные гормональные нарушения. Среди них – повышенный уровень лютеинизирующего гормона, инсулинорезистентность и снижение минеральной плотности костной ткани. Добавление минеральных комплексов и витамина D (холекальциферола) к стандартной терапии достоверно улучшало репродуктивные исходы: частота наступления беременности увеличивалась, а частота акушерских осложнений, таких как самопроизвольные выкидыши, гестационная артериальная гипертензия и преэклампсия, снижалась. У женщин, получавших комбинированную терапию, беременность наступала значительно чаще, а число осложнений было статистически ниже по сравнению с теми, кто получал только стандартное лечение.
Заключение. Включение минеральных добавок и витамина D в схему лечения способствует не только улучшению репродуктивной функции, но и снижению риска развития акушерских осложнений. Полученные результаты подчеркивают важность комплексного подхода к ведению женщин с гиперпролактинемией, особенно при наличии сопутствующего гипотиреоза и СПЯ. Такой многофакторный терапевтический подход позволяет эффективно воздействовать как на гормональные и метаболические нарушения, так и на улучшение клинических исходов беременности.
Ключевые слова: гиперпролактинемия, минеральный обмен, остеопения, беременность.
Для цитирования: Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. Минеральный обмен и репродуктивные нарушения при гиперпролактинемии. Клинический разбор в общей медицине. 2025; 6 (9): 26–36. DOI: 10.47407/ kr2025.6.9.00669
Mineral metabolism and reproductive dysfunction in hyperprolactinemia
Gulnara D. Matrizaeva1, Gulnoza Sh. Baltabayeva2, Ziyoda A. Muminova2, Akbar O. Khaitov1,Nodira Kh. Ruzieva3, Holidazhon S. Ikramova1
1 Urgench branch of the Tashkent Medical Academy, Urgench, Republic of Uzbekistan;
2 Tashkent Medical Academy, Tashkent, Republic of Uzbekistan;
3 Tashkent Pediatric Institute, Tashkent, Republic of Uzbekistan
gmatrizayeva@gmail.com
Abstract
Hyperprolactinemia, a condition characterized by elevated prolactin levels, is associated with various organic and functional factors, including pituitary adenomas, stress, hypothyroidism, and polycystic ovary syndrome (PCOS). This study investigates the impact of hyperprolactinemia on mineral metabolism and reproductive function in women, focusing on those with hypothyroidism and PCOS.
Aim. To study the effect of hyperprolactinemia on mineral metabolism in women with hyperprolactinemia syndrome and optimize the restoration of their reproductive function.
Materials and methods. A total of 134 women of reproductive age were included in the study, divided into two main groups: women with hypothyroidism and hyperprolactinemia (n=52) and women with PCOS and hyperprolactinemia (n=42). A control group of 40 healthy women was also included. The study was conducted in two stages: the first stage involved selecting women based on their underlying conditions and dividing them into subgroups based on treatment protocols (pathogenetic therapy with or without mineral complexes and vitamin D). The second stage focused on monitoring hormonal, biochemical, and obstetric outcomes in women who became pregnant after treatment.
Results. Key findings revealed that women with hyperprolactinemia, particularly those with PCOS, exhibited significant hormonal imbalances, including elevated LH levels, insulin resistance, and reduced bone mineral density. The addition of mineral complexes and vitamin D to standard treatment significantly improved pregnancy rates and reduced obstetric complications such as miscarriage, gestational hypertension, and preeclampsia. Women receiving combined treatment had higher pregnancy rates and fewer complications compared to those receiving only standard therapy. The study concludes that hyperprolactinemia significantly affects mineral metabolism and reproductive health, leading to complications such as osteopenia, hormonal dysregulation, and adverse pregnancy outcomes. The average calcium levels, which are key indicators of mineral metabolism, showed a significant difference between the groups. In women with hypothyroidism and hyperprolactinemia, the calcium level was 1.8±0.01, which was significantly lower than the normal range. In women with PCOS and hyperprolactinemia, this level was found at the lowest threshold of the normal range, which we attributed to the relative hyperestrogenism and androgenism in these women.
Conclusion. The inclusion of mineral supplements and vitamin D in the treatment regimen not only enhances reproductive function but also mitigates the risk of obstetric complications, highlighting the importance of a comprehensive approach to managing hyperprolactinemia in women with hypothyroidism and PCOS.
Keywords: hyperprolactinemia, mineral metabolism, osteopenia, pregnancy.
For citation: Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. Mineral metabolism and reproductive dysfunction in hyperprolactinemia. Clinical review for general practice. 2025; 6 (9): 26–36 (In Russ.). DOI: 10.47407/kr2025.6.9.00669
Введение
Причины гиперпролактинемии являются многообразными. К ним относятся как органические, так и функциональные факторы. Органические причины включают микро- и макропролактиномы, смешанную соматотропно-пролактиновую аденому гипофиза и другие опухоли гипофизарной области. К числу функциональных факторов относят идиопатическую гиперпролактинемию, психоэмоциональный стресс, нейроинфекции, первичный гипотиреоз, дисгормональные заболевания молочных желез, синдром поликистозных яичников (СПЯ), патологии печени и почек, а также длительное применение некоторых лекарственных препаратов [1, 2].Патогенез гиперпролактинемического гипогонадизма. Патогенетические механизмы развития гиперпролактинемического гипогонадизма также являются многофакторными. К ним относятся: снижение или полное отсутствие тормозящего влияния дофамина на секрецию пролактина; усиление стимулирующего действия тиролиберина; нарушения секреции эстрогенов и андрогенов; гиперплазия лактотропных клеток гипофиза, обусловленная усиленным синтезом пролактина под воздействием мелатонина, серотонина, катехоламинов и простагландинов [3, 4].
Работы как отечественных, так и зарубежных авторов подтверждают наличие сложных биохимических процессов, происходящих в нейроэндокринной системе у пациенток с гиперпролактинемией [5].
Синдром гиперпролактинемии в большинстве случаев приводит к развитию гиперпролактинемического гипогонадизма и остается одной из центральных тем научных исследований уже на протяжении последних 30 лет.
С учетом выраженного влияния гиперпролактинемии на репродуктивную систему, приоритет в клинической и научной практике традиционно отдается изучению нарушений в репродуктивной сфере. Однако при этом остается слабо изученной особенность течения и патофизиология остеопенического синдрома, развивающегося на фоне данной патологии. Во время беременности потребность плода в кальции и фосфоре, необходимых для роста скелета, клеток и тканей, полностью обеспечивается за счет материнского организма [6, 7].
Фетоплацентарный комплекс активно абсорбирует кальций из организма матери. В период беременности в материнском организме происходят значительные изменения в обмене данного макроэлемента, направленные на удовлетворение потребностей плода в кальции [8].
При доношенной беременности происходит ремоделирование минерального гомеостаза в кортикальных отделах скелета женщины, что сопровождается увеличением минеральной плотности костной ткани: в нижних конечностях на +1,8%, в верхних конечностях на +2,8%. В то же время в трабекулярной костной ткани наблюдается снижение минеральной плотности: в области таза на –3,2%, в позвоночнике на –4,5%. В результате общие изменения минеральной плотности костной ткани остаются сбалансированными и практически неизменными [9, 10].
Остеопенический синдром при гиперпролактинемии. Изучение остеопенического синдрома при гиперпролактинемии представляет собой сложную задачу из-за многообразия этиологических факторов, вызывающих патологическую гиперпролактинемию. К ним относятся поражения гипоталамуса, патология гипофиза, наличие системных заболеваний, а также фармакологические влияния. Одним из осложнений гиперпролактинемии является нарушение костно-минерального обмена – остеопения или остеопороз. Этот процесс объясняется как дефицитом половых гормонов (в частности, эстрогенов у женщин), так и прямым действием пролактина на костную ткань. Формирование остеопенического синдрома при гиперпролактинемии имеет множество сложных и до конца не изученных особенностей этиопатогенеза. Надежные данные о снижении минеральной плотности костной ткани в области дистального отдела лучевой кости у женщин с гиперпролактинемией были впервые зафиксированы в 1980 г. [9].
У молодых девушек в возрасте 16–18 лет с гиперпролактинемией наблюдается быстрое снижение минеральной плотности костной ткани, что может быть связано с тем, что костная масса в этом возрасте еще не достигла своего физиологического пика и окончательно не сформирована. Ключевую роль в развитии остеопенического синдрома при гиперпролактинемии играет снижение продукции половых гормонов, прежде всего эстрогенов. Независимо от причины повышения уровня пролактина, он оказывает ингибирующее действие на гипоталамо-гипофизарно-гонадную систему, нарушая циклическую секрецию гонадотропинов и гонадолиберинов, что, в свою очередь, нарушает регуляцию репродуктивной функции и метаболизм костной ткани. Это приводит к снижению частоты и амплитуды секреции лютеинизирующего гормона (ЛГ), подавлению действия гонадотропинов на гонады, а также к снижению продукции половых стероидов – эстрогенов у женщин и андрогенов у мужчин, что, в конечном итоге, приводит к развитию синдрома гипогонадизма. Механизмы влияния половых гормонов на костную ткань обусловлены наличием рецепторов к эстрогенам и андрогенам в остеобластах, что делает костную ткань мишенью для действия этих гормонов [4, 11].
Оценка состояния кальций-регулирующих гормональных систем при гиперпролактинемии представляет собой важный патогенетический аспект, связанный с развитием гипоэстрогенизма на фоне гипогонадизма. Остеокласты обладают рецепторами к эстрогенам, и их ингибирующее действие на резорбцию костной ткани является доказанным. Поэтому снижение уровня эстрогенов в сыворотке крови приводит к активации остеокластов, усилению резорбции костной ткани и, как следствие, – к повышению уровня С-изомера телопептида коллагена I типа (β-CrossLaps или CL) в крови. Кроме того, установлено, что эстрогены снижают чувствительность костной ткани к действию паратиреоидного гормона и одновременно стимулируют синтез активной формы витамина D3 (кальцитриола) в почках, что также влияет на минеральный обмен. Повышение уровня пролактина нарушает функции на различных уровнях гипоталамо-гипофизарно-яичниковой системы. Сочетание гиперпролактинемии с такими эндокринными патологиями, как сахарный диабет, гипотиреоз и гиперандрогения, усиливает деструктивные изменения в фетоплацентарном комплексе и утяжеляет течение гестации. На сегодняшний день вопросы комплексного влияния гиперпролактинемии в сочетании с другими гормональными нарушениями на течение беременности и развитие плода изучены недостаточно [9, 12].
Таким образом, существует необходимость в комплексном исследовании особенностей течения беременности и родов у пациенток с синдромом гиперпролактинемии с позиций современных научных и методологических подходов.
Цель исследования – изучить влияние гиперпролактинемии на минеральный обмен у женщин с синдромом гиперпролактинемии и оптимизировать восстановление их репродуктивной функции.
Материалы и методы
Клинический материал был собран на базе Хорезмского филиала Республиканского специализированного научно-практического медицинского центра охраны материнства и детства, а также в частной клинике “Dilorom Medical”. Клинико-лабораторные исследования проводились в частных медицинских учреждениях “Dilorom Medical” (договор №3, 2023 г.) и“Al-Kharizmi” (договор №2, 2023 г.).
В запланированное исследование были включены
134 женщины репродуктивного возраста. Все участницы исследовательских групп являлись жительницами городов и сельской местности Хорезмской области.
Исследование проводилось в два этапа. На первом этапе были отобраны 94 женщины с гиперпролактинемией, ассоциированной с гипотиреозом или СПЯ.
В зависимости от этиологии гиперпролактинемии пациентки были распределены на две основные группы:
– 1-я группа – женщины с гипотиреозом и гиперпролактинемией (n=52);
– 2-я группа – женщины с СПЯ и гиперпролактинемией (n=42).
Контрольную группу составили 40 соматически здоровых женщин с регулярным менструальным циклом и отсутствием эндокринной патологии.
Каждая из двух основных групп была дополнительно разделена на две подгруппы в зависимости от полученного варианта лечения:
– группа 1а – женщины с гипотиреозом и гиперпролактинемией, получавшие патогенетическую терапию в сочетании с минеральными комплексами и холекальциферолом – витамин D (n=30);
– группа 1б – женщины с гипотиреозом и гиперпролактинемией, получавшие только патогенетическую терапию (n=22);
– группа 2а – женщины с СПЯ и гиперпролактинемией, получавшие патогенетическую терапию в сочетании с минеральными комплексами и холекальциферолом (n=22);
– группа 2б – женщины с СПЯ и гиперпролактинемией, получавшие только патогенетическую терапию (n=20).
На втором этапе, после завершения курса лечения, проводилась оценка гормонального, биохимического и инструментального статуса у женщин, у которых наступила беременность. Осуществлялось динамическое наблюдение за течением беременности и послеродовым периодом, включая акушерские исходы и осложнения.
Для динамического наблюдения за пациентками была разработана специальная анкета, включающая следующие параметры: жалобы, анамнез жизни и заболевания, особенности менструального цикла, состояние репродуктивной функции, а также данные объективного обследования – рост, масса тела и индекс массы тела (ИМТ). ИМТ рассчитывался по формуле: ИМТ=масса тела (кг) / рост2 (м2), при этом нормальными считались значения в пределах 18,5–25,0 кг/м2.
В программу клинико-лабораторного обследования вошли: биохимический и гормональный анализ крови, ультразвуковое исследование органов малого таза, определение уровней минералов и витамина D в сыворотке крови, денситометрия костной ткани, а также оценка вида и эффективности проведенного лечения.
Результаты исследования
Учитывая полиморфизм причин развития гиперпролактинемии при гипотиреозе и СПЯ, нами был проведен анализ социальных факторов риска среди обследованных пациенток.Результаты анализа показали: в 1-й группе (женщины с гипотиреозом и гиперпролактинемией) у 22 (42,3%) пациенток были выявлены расстройства пищевого поведения. Во 2-й группе (женщины с СПЯ и гиперпролактинемией) данный показатель выявлен у 26 (61,9%) женщин. Различия между этими двумя группами были статистически значимыми (p<0,05). В контрольной группе только у 15% женщин наблюдались нарушения режима питания, что достоверно отличалось от обеих исследуемых групп (p<0,001).
Стресс оказался одним из ведущих факторов риска:
в 1-й группе стресс отмечался у 32 (61,5%) женщин, во 2-й группе – у 30 (71,4%) женщин, при этом различие между группами 1 и 2 было статистически незначимым (p>0,05). В контрольной группе стресс наблюдался у 8 (20%) женщин, что было достоверно ниже, чем в основных группах (p<0,01).
Гиподинамия была преимущественно характерна для 1-й группы – 22 (42,3%) пациентки, что статистически достоверно отличалось от групп 2 и 3 (p<0,001). Между 2-й и контрольной группой различий по уровню гиподинамии не выявлено (p>0,05). Возрастной состав женщин в исследуемых группах достоверных различий не показал (p>0,05). Преобладающее большинство участниц относились к репродуктивному возрасту – от 23 до 32 лет.
Анализ данных, касающихся особенностей менструального цикла и половой жизни обследованных женщин, показал следующие результаты: при оценке возраста наступления менструации было установлено, что возрастной диапазон 10–13 лет встречался у 72,5% женщин контрольной группы, что статистически достоверно отличалось от показателей 2-й группы (p<0,001) и 1-й группы (p<0,05). Это указывает на физиологичное развитие репродуктивной системы у женщин контрольной группы. Позднее наступление менструации (после 16 лет) наблюдалось только у женщин 2-й группы (с СПЯ), что также имело статистически значимую разницу при сравнении с другими группами (p<0,01). При сравнении длительности менструального цикла достоверных различий между 1-й и 2-й группами не выявлено (p>0,05). Однако в контрольной группе (3-я группа) большинство женщин имели менструации длительностью 3–5 дней, что достоверно отличалось от основных групп (p<0,001); табл. 1.

Анализ анамнестических данных показал, что частота гинекологических заболеваний в обеих основных группах была сравнимой. Однако при сопоставлении всех трех групп было установлено, что такие заболевания, как хронический эндометрит, вульвовагинит, эндоцервицит и эктопия шейки матки, чаще встречались у женщин 2-й группы (с СПЯ и гиперпролактинемией). Различия между группами оказались статистически значимыми (p<0,01).
Одной из основных задач нашего исследования было определение взаимосвязи между гиперпролактинемией и метаболическим синдромом у женщин, а также изучение его влияния на минеральный обмен. Результаты показали, что в контрольной группе у 85% женщин отмечалась нормальная масса тела, что статистически достоверно отличалось от показателей в основных группах (p1<0,05; χ2=1,88; p2<0,001; χ2=14,2).
При сравнении повышенного ИМТ наблюдались следующие данные: в 1-й группе – у 14 (26,9%) женщин, во 2-й группе – у 18 (42,9%) женщин, в контрольной группе – у 6 (15,0%) женщин. Эти различия также оказались статистически значимыми при сравнении с контрольной группой: p1<0,001; χ2=10,7, p2<0,001; χ2=24 (табл. 2).

Ожирение разной степени наблюдалось только в основных группах, что подтверждает связь гиперпролактинемии с повышенным риском формирования метаболического синдрома. Это, в свою очередь, может способствовать развитию гинекологических и акушерских осложнений на более поздних этапах.
Цель проведения орального глюкозотолерантного теста (ОГТТ) заключалась в выявлении инсулинорезистентности у женщин исследуемых групп и оценке ее значения в патогенезе бесплодия. Тест применялся как диагностический инструмент, отражающий нарушение углеводного обмена, особенно в условиях гиперпролактинемии в сочетании с другими эндокринными патологиями. Наиболее значимые изменения наблюдались у женщин со СПЯ, что подтверждает прямую связь между инсулинорезистентностью и гиперандрогенией в данной группе. Полученные данные свидетельствуют о высокой распространенности метаболических нарушений у данной категории пациенток и возможной их роли в развитии репродуктивной дисфункции. Исходный уровень глюкозы (натощак) показал, что у большинства женщин 2-й группы (СПЯ) значения превышали норму. Средний уровень глюкозы в группах составил: 2-я группа – 6,24±0,2 ммоль/л; 1-я группа (гипотиреоз) – 5,72±0,2 ммоль/л; контрольная группа – 4,64±0,2 ммоль/л. Различия между группами были статистически значимыми: между 1-й и 2-й группами: p<0,05; между 2-й и контрольной группой: p<0,01.
Через 120 мин после ОГТТ: у женщин с гипотиреозом (1-я группа) – 7,2±0,2 ммоль/л; у женщин с СПЯ (2-я группа) – 7,84±0,2 ммоль/л; у женщин контрольной группы – 6,81±0,2 ммоль/л.
Показатели свидетельствуют о сохранении толерантности к глюкозе у женщин с гиперпролактинемией, однако во 2-й группе уровень остается выше, что может быть связано с инсулинорезистентностью и гиперандрогенией (табл. 3).
HbA1c: статистически значимо повышен у женщин 2-й группы по сравнению с 1-й и контрольной (p<0,01).
Инсулин: уровень наиболее высок в группе с СПЯ (p1-2<0,05, p2-3<0,01). Индекс HOMA превышает норму у женщин 2-й группы → признаки инсулинорезистентности. Индекс Caro у 2-й группы снижен по сравнению с контролем, что также отражает наличие инсулинорезистентности. Индекс HOMA-IR оказался преимущественно повышенным у женщин 2-й группы (с СПЯ). Различия между этой группой и остальными были статистически значимыми (p<0,01), что свидетельствует о более выраженной инсулинорезистентности у пациенток с СПЯ по сравнению с женщинами с гипотиреозом и контрольной группой. Гиперинсулинемия при СПЯ может быть обусловлена наличием инсулинорезистентности, и ее наличие объективно оценивается с помощью индекса HOMA-IR, который отражает функциональное состояние β-клеток поджелудочной железы. Анализ показал, что степень инсулинорезистентности по индексу HOMA-IR у женщин с СПЯ и ожирением была в 2 раза выше, чем у пациенток с СПЯ без ожирения. Это может быть связано с увеличением массы β-клеток у женщин с СПЯ и их гиперфункцией, что приводит к усиленной секреции инсулина – типичному проявлению инсулинорезистентности.
На следующем этапе исследования проводился анализ гормонального профиля пациенток. Для этого женщины сдавали кровь на 2–3-й день менструального цикла, в утренние часы (между 08:00 и 09:00), в состоянии физиологического покоя (до еды, в спокойной обстановке). Полученные результаты гормонального обследования представлены в табл. 4.

Согласно полученным результатам, у женщин с СПЯ на 3–5-й день менструального цикла уровень ЛГ составил 14,97±0,29 МЕ/л, тогда как в группе пациенток с гиперпролактинемией и гипотиреозом данный показатель был 8,54±0,179 МЕ/л, а в контрольной группе – 5,1±0,052 МЕ/л. Эти различия были статистически достоверными между 1-й и 2-й группами, а также между 2-й и 3-й группами (p<0,01).
Уровень фолликулостимулирующего гормона (ФСГ) не продемонстрировал статистически значимых различий между 2-й и 3-й группами: значения составили 5,45±0,1 МЕ/л и 4,9±0,066 МЕ/л соответственно. У женщин с гипотиреозом (1-я группа) этот показатель был относительно выше – 7,75±0,257 МЕ/л, однако различие со 2-й группой не достигло статистической значимости (p>0,05). Кроме того, соотношение ЛГ/ФСГ составило в среднем 2,7 во 2-й группе и 1,04 в контрольной группе, что свидетельствует о достоверной разнице (p<0,01). Такое нарушение соотношения ЛГ/ФСГ у женщин с СПЯ указывает на более выраженную дисфункцию гипоталамо-гипофизарной системы, характерную для этой патологии.
Особого внимания заслуживает уровень пролактина. У женщин основных исследуемых групп концентрация данного гормона превышала физиологические нормы, однако его показатели были значительно выше в 1-й группе по сравнению со 2-й: 32±0,8 нг/мл против 29,6±0,13 нг/мл. Тем не менее данное различие не достигло статистической значимости (p>0,05). Полученные значения соответствуют вторичной патологической гиперпролактинемии, отличной от гиперпролактинемии, вызванной аденомами гипофиза, при которых уровни пролактина значительно выше. Следует отметить, что в контрольной группе ни у одной женщины не было выявлено повышения уровня пролактина, что также подтверждает достоверность наблюдаемых отличий между контрольной и основными группами. Пролактин также оказывает воздействие на рецепторы волосяных фолликулов, что способствует развитию гирсутизма и повышению уровня эстрогенов. Снижение тормозного влияния дофамина на секрецию пролактина приводит к умеренной гиперпролактинемии, сопровождающейся повышением уровня ЛГ.
У женщин 1-й группы (с гипотиреозом) наблюдались изменения уровня тиреотропного гормона (ТТГ), варьирующие от 5,54 до 7,4 мЕд/л. При сравнении уровней ТТГ между всеми группами значения оставались в пределах референсных норм, однако в группе 2 (женщины с СПЯ и гиперпролактинемией) средний уровень ТТГ находился на верхней границе нормы, что имело статистически значимую разницу по сравнению с другими группами (p<0,05). Этот феномен был интерпретирован как стимулирующее влияние повышенного уровня пролактина на продукцию ТТГ, что объясняется нарушением регуляции гипоталамо-гипофизарной оси при гиперпролактинемии.
Таким образом, у пациенток с метаболическими нарушениями отмечалась высокая степень гиперпролактинемии, сопровождавшаяся изменениями липидного спектра крови и нарушением функционального состояния печени. Особенно выделялись пациентки 2-й группы, у которых было зарегистрировано повышенное соотношение ЛГ/ФСГ, что в большей степени выражалось у женщин с метаболическим синдромом. Согласно нашим данным, прогностически значимым фактором у женщин с СПЯ является повышенный уровень ЛГ, который сопровождается увеличением объема яичников и способствует их полицистической трансформации, указывая на наличие инсулинорезистентности.
Данная комбинация клинических и лабораторных признаков свидетельствует о синергическом эффекте инсулина и ЛГ, в результате которого происходит формирование поликистозных яичников.
С целью исследования минерального обмена у женщин с гиперпролактинемией на первом этапе были проведены сравнительные анализы уровней гормонов, регулирующих обмен витаминов и минералов, между основными группами и контрольной. Эти гормоны оказывают прямое влияние на минеральный обмен, особенно в аспекте фосфорно-кальциевого и магниевого гомеостаза. Нормальные уровни витамина D были выявлены: у 11 (21,2%) женщин в 1-й группе (гипотиреоз + гиперпролактинемия), 6 (14,3%) женщин во второй группе (СПЯ + гиперпролактинемия), 32 (80%) женщин в контрольной группе. Различия с контрольной группой оказались статистически значимыми (p1<0,001; χ2=43,2, p2<0,001; χ2=53,9). Дефицит и недостаточность витамина D значительно чаще встречались у женщин с гиперпролактинемией на фоне гипотиреоза и СПЯ. Несмотря на отсутствие статистически значимых различий между двумя основными группами, по сравнению с контрольной группой выявлены достоверные различия: p1<0,001; χ2=29,3; p2<0,001; χ2=45.
Анализ уровней гормонов, контролирующих минеральный обмен, показал, что повышение уровня паратиреоидного гормона (ПТГ) сопровождалось снижением уровня кальцитонина в крови. Такие изменения были особенно выражены у женщин с гипотиреозом и синдромом гиперпролактинемии. Это свидетельствует о том, что у данной группы женщин минеральный обмен подвергся значительным нарушениям по сравнению с другими исследуемыми группами. Данные представлены в табл. 5, где наглядно отражены различия в концентрациях гормонов, участвующих в регуляции кальциево-фосфорного обмена.

В 1-й группе – у женщин с гиперпролактинемией на фоне гипотиреоза – уровень ПТГ составил 72,2±1,85 пг/мл, что превышало верхнюю границу нормы (15–65 пг/мл). Во 2-й группе – у пациенток с гиперпролактинемией, связанной с СПЯ, данный показатель был 56,8±2,34 пг/мл, а в контрольной группе – 47,34±1,77 пг/мл. Согласно результатам статистического анализа, разница между 1-й группой и контрольной группой была достоверной (p1≤0,01), между 2-й группой и контрольной группой – также статистически значимой (p2≤0,05), а различия между 1-й и 2-й группами имели достоверный характер на уровне p3≤0,05 (см. табл. 5). Повышение уровня ПТГ на фоне гиперпролактинемии может приводить к вымыванию кальция из костной ткани и снижению его концентрации в крови. Особенно выраженно данный процесс проявляется в случаях, ассоциированных с гипотиреозом.
 Количество кальцитонина – гормона, выполняющего антагонистическую роль в кальциевом метаболизме, – в 1-й группе составило 0,52±0,034 пг/мл, во 2-й группе – 1,45±0,053 пг/мл, а в контрольной группе – 3,3±0,16 пг/мл. Различия между показателями имели высокую статистическую значимость: p1≤0,001, p2≤0,001 и p3≤0,001. Снижение уровня кальцитонина наиболее выражено отмечалось у женщин 1-й группы, что указывает на ослабление функции удержания кальция в костной ткани. Вместе с тем у женщин 2-й группы также было зафиксировано достоверное снижение уровня кальцитонина по сравнению с контрольной группой (см. табл. 5).
Количество кальцитонина – гормона, выполняющего антагонистическую роль в кальциевом метаболизме, – в 1-й группе составило 0,52±0,034 пг/мл, во 2-й группе – 1,45±0,053 пг/мл, а в контрольной группе – 3,3±0,16 пг/мл. Различия между показателями имели высокую статистическую значимость: p1≤0,001, p2≤0,001 и p3≤0,001. Снижение уровня кальцитонина наиболее выражено отмечалось у женщин 1-й группы, что указывает на ослабление функции удержания кальция в костной ткани. Вместе с тем у женщин 2-й группы также было зафиксировано достоверное снижение уровня кальцитонина по сравнению с контрольной группой (см. табл. 5).Анализ уровней ПТГ и кальцитонина у женщин с гиперпролактинемией, особенно в сочетании с гипотиреозом, выявил выраженные нарушения минерального обмена. Эти изменения, в свою очередь, формируют патогенетическую основу для дисбаланса костной ткани, повышения риска остеопении и возникновения осложнений в ходе беременности. Подобные сдвиги наиболее явно проявлялись у пациенток с гиперпролактинемическим синдромом на фоне гипотиреоза, у которых нарушения минерального обмена были более выраженными по сравнению с другими группами. Мы связываем это как с изменением уровня пролактина, так и с изменением концентрации гормонов щитовидной железы, так как щитовидная железа непосредственно участвует в регуляции костного метаболизма, и любые колебания ее гормонов неизбежно отражаются на плотности костной ткани.
С целью оценки состояния минерального гомеостаза у женщин с синдромом гиперпролактинемии был проведен анализ содержания кальция, магния и фосфора в крови (табл. 6). Эти показатели имеют ключевое значение для оценки процессов костеобразования, эндокринной функции, а также для характеристики фетоплацентарной активности во время беременности.
В 1-й группе (гиперпролактинемия, ассоциированная с гипотиреозом) уровень кальция составил 1,83±0,027 ммоль/л, что значительно ниже нормы (2,0–2,6 ммоль/л). Во 2-й группе (гиперпролактинемия, связанная с СПЯ) данный показатель равнялся 2,04±0,036 ммоль/л, тогда как в контрольной группе он составлял 2,25±0,0299 ммоль/л. Различия между всеми группами были статистически значимыми: p1≤0,01, p2≤0,01, p3≤0,01. Эти результаты могут свидетельствовать о нарушениях всасывания или метаболизма кальция на фоне гиперпролактинемии.
В 1-й группе уровень магния составил 1,27±0,04 ммоль/л, что превышает верхнюю границу нормы (референсные значения: 0,75–1,05 ммоль/л). При сравнении с контрольной группой выявлено статистически значимое различие (p1≤0,001). Во 2-й группе содержание магния было 0,87±0,0136 ммоль/л, а в 3-й группе (контроль) – 0,866±0,0239 ммоль/л. Различие между 2-й и 3-й группами оказалось статистически незначимым (p2≥0,05). Повышенный уровень магния в 1-й группе может указывать на электролитные нарушения, связанные с гипотиреозом (см. табл. 6).
Показатели фосфора в 1-й группе составили 1,76±0,05 ммоль/л, во 2-й группе – 1,8±0,02 ммоль/л, а в 3-й группе – 1,957±0,039 ммоль/л, оставаясь в пределах нормы (1,3–2,26 ммоль/л). Однако статистический анализ показал, что различия между 1-й и контрольной группами, а также между 2-й и контрольной группами, были достоверными (p1≤0,05 и p2≤0,05 соответственно). Различие между 2-й и 3-й группами оказалось статистически незначимым (p3≥0,05).
Средний уровень кальция в крови, являющийся одним из ключевых показателей минерального обмена, значительно различался между группами. У женщин с гиперпролактинемией на фоне гипотиреоза он составил 1,8±0,01 ммоль/л, что существенно ниже нормативных значений. У пациенток с гиперпролактинемией, связанной с микроаденомой гипофиза, данный показатель находился на нижней границе нормы, что мы связываем с наличием у этих женщин СПЯ и ановуляторных циклов, сопровождающихся относительным гиперэстрогенизмом и гиперандрогенизмом.
У женщин с гиперпролактинемией, особенно при сочетании с гипотиреозом, было выявлено снижение содержания кальция и фосфора в крови, а также повышение уровня магния. Эти изменения указывают на неблагоприятные сдвиги в метаболизме костной ткани, снижении способности к вынашиванию беременности и нарушении гормонального баланса. Данные показатели имеют важное значение в изучении метаболических нарушений, развивающихся на фоне синдрома гиперпролактинемии, и в разработке методов их коррекции.
Минеральная плотность костной ткани является объективным показателем кальциевого метаболизма, минерального гомеостаза и процессов остеогенеза в организме. Это состояние тесно связано с гормональным дисбалансом и нарушением кальциевого обмена на фоне гиперпролактинемии, и было оценено методом денситометрии (см. рисунок).
По результатам анализа у женщин контрольной группы нормальная плотность костной ткани (T-показатель ≥ –1 SD) выявлена в 90% случаев, тогда как среди пациенток с гиперпролактинемией данный показатель составил лишь 28,8% в 1-й группе (с гипотиреозом) и 38% во 2-й группе (с СПЯ).
Состояние остеопении, указывающее на снижение плотности костной ткани, было выявлено в 59,6% случаев в 1-й группе и в 57% случаев во 2-й группе. В контрольной группе подобные изменения встречались крайне редко – лишь в 10% случаев (χ2>20, p<0,001). Эти данные свидетельствуют о том, что при гиперпролактинемии, особенно в ее варианте, протекающем на фоне гипотиреоза, остеопенические изменения имеют широкое распространение.
Более тяжелое патологическое состояние – остеопороз – диагностировано у 11,5% женщин 1-й группы и у 4,8% пациенток 2-й группы, тогда как в контрольной группе данный диагноз не был зафиксирован ни в одном случае. Различия между показателями групп имели высокую статистическую значимость (p1<0,001, p2<0,001, p3<0,001).
При гиперпролактинемии, особенно в случаях, сопровождающихся гипотиреозом, наблюдается выраженное снижение минеральной плотности костной ткани. Состояния остеопении и остеопороза значительно чаще регистрировались у женщин с гипотиреозом по сравнению с пациентками, имеющими СПЯ. Эти данные указывают на необходимость обязательного мониторинга состояния костной ткани у больных с гиперпролактинемией как на прегравидарном этапе, так и в гестационном периоде.
Результаты проведенного корреляционного анализа свидетельствуют о следующем: между минеральной плотностью костной ткани (T-score) и уровнем кальция выявлена прямая корреляционная связь средней силы (r=0,90, p<0,001). Это означает, что с повышением содержания кальция в крови вероятность увеличения плотности костной ткани также возрастает. Кроме того, между минеральной плотностью костной ткани и уровнем кальцитонина установлена выраженная прямая корреляция (r=0,96, p<0,001). Таким образом, увеличение концентрации кальцитонина связано с улучшением структуры костной ткани.
Полученные данные подтверждают прогностическую значимость показателей кальция и кальцитонина при оценке костного метаболизма на фоне гиперпролактинемии.
В рамках нашего исследования мы проводили овариальную стимуляцию у всех женщин с СПЯ, при этом продолжали назначение минеральных комплексов и витамина D. У пациенток с гипотиреозом индукторы овуляции не применялись – они получали только минеральные препараты и витамин D. Результаты, касающиеся наступления беременности в ходе наблюдения, представлены в табл. 7.
Согласно данным табл. 7, проведение прегравидарной подготовки у женщин с гиперпролактинемией оказывает значительное влияние на исход беременности.

В обеих исследуемых группах – с гипотиреозом и с СПЯ – были выявлены выраженные различия в уровне сохранения беременности между подгруппами, где подготовка проводилась и не проводилась.
В 1-й группе (женщины с гиперпролактинемией на фоне гипотиреоза) среди пациенток, прошедших прегравидарную подготовку (подгруппа 1а, n=30), беременность сохранялась в 66,7% случаев (n=20). В подгруппе без подготовки (1б, n=22) этот показатель составил лишь 40,9% (n=9). Различие оказалось статистически значимым (χ2=16,3; p<0,001).
Во 2-й группе (женщины с гиперпролактинемией, связанной с микроаденомой гипофиза) в подгруппе с проведенной прегравидарной подготовкой (2а, n=22) беременность была сохранена в 77,3% случаев (n=17), тогда как без подготовки (2б, n=20) – только в 35% случаев (n=7). Различие также оказалось высоко статистически значимым (χ2=51,1; p<0,001).
В 1-й группе (женщины с гиперпролактинемией на фоне гипотиреоза) риск самопроизвольного выкидыша в подгруппе с проведенной прегравидарной подготовкой (1а, n=20) составил 50% (n=10), тогда как в подгруппе без подготовки (1б, n=9) он достигал 77,8% (n=7). Различие было статистически значимым (χ2=9,9; p1<0,001). Ретрохориальная гематома встречалась у женщин подгруппы 1а лишь в 1 (5%) случае, тогда как в подгруппе 1б данное осложнение было зарегистрировано у 22,2% (n=2) пациенток (χ2=13,3; p1<0,001). Замершая беременность и полный самопроизвольный выкидыш отмечались только в подгруппе 1б – без прегравидарной подготовки (соответственно 22,2 и 11,1%). Токсикоз беременных в виде рвоты наблюдался у 25% (n=5) женщин подгруппы 1а и у 33,3% (n=3) женщин подгруппы 1б. Данное различие не достигло статистической значимости (χ2=2,7; p1>0,05), однако сохранялась тенденция к более высокой частоте осложнения в подгруппе без подготовки.
Во 2-й группе (женщины с гиперпролактинемией, связанной с СПЯ) риск самопроизвольного выкидыша в подгруппе с прегравидарной подготовкой (2а, n=17) составил 47% (n=8), тогда как в подгруппе без подготовки (2б, n=7) он достигал 71,4% (n=5). Различие было статистически значимым (χ2=8,3; p2<0,01). Ретрохориальная гематома была зафиксирована только у одной пациентки подгруппы 2б (14,3%), тогда как в подгруппе с подготовкой данное осложнение не наблюдалось. Замершая беременность в подгруппе 2а не регистрировалась, тогда как в подгруппе 2б встречалась в 28,6% случаев (n=2). Токсикоз беременных в виде рвоты наблюдался у 47% (n=8) женщин подгруппы 2а и у 71,4% (n=5) женщин подгруппы 2б. Это различие также оказалось статистически значимым (χ2=8,33; p2<0,01). Таким образом, прегравидарная подготовка при наступлении беременности на фоне гиперпролактинемии позволяет значительно снизить частоту гинекологических осложнений. Наибольшая распространенность серьезных осложнений, таких как самопроизвольный выкидыш, ретрохориальная гематома и замершая беременность, отмечалась преимущественно в группах без подготовки. При этом сходная тенденция наблюдалась как у пациенток с гипотиреозом, так и у женщин с микроаденомой гипофиза.
Задержка внутриутробного роста плода наблюдалась в подгруппе 1а в 5% случаев (n=1), тогда как в подгруппе без подготовки – в 16,7% случаев (n=1) (χ2=8,2; p1<0,01). Гестационная гипертензия была зафиксирована только в подгруппе 1а – 5% (n=1) случаев, а в подгруппе 1б не встречалась. Преэклампсия, напротив, регистрировалась исключительно в подгруппе без подготовки (1б) – 50% случаев (n=3). Эти данные указывают на то, что беременность при гиперпролактинемии и гипотиреозе без адекватной подготовки сопровождается высоким риском тяжелых осложнений.
Во 2-й группе гестационная гипертензия отмечалась в подгруппе 2а (с подготовкой) в 11,8% случаев (n=2), тогда как в подгруппе 2б (без подготовки) – в 60% случаев (n=3), что было статистически значимым (χ2=38,7; p<0,001). Преэклампсия встречалась только в подгруппе 2б – 20% случаев (n=1). Перинатальная потеря также была зарегистрирована лишь в подгруппе без подготовки – 20% (n=1).
Таким образом, акушерские осложнения – в частности, преэклампсия, задержка внутриутробного роста плода, гестационная гипертензия и перинатальные потери – значительно чаще встречаются у женщин с гиперпролактинемией без прегравидарной подготовки.
В обеих группах проведение подготовительного этапа достоверно снижало частоту этих осложнений. Полученные данные подтверждают, что при планировании беременности у женщин с гиперпролактинемией крайне важно оценивать акушерские риски и устранять их на этапе подготовки. Комплексная терапевтическая подготовка играет ключевую роль в улучшении репродуктивного здоровья. Наши результаты убедительно показывают, что для достижения успешных репродуктивных исходов у женщин с гиперпролактинемией в прегравидарный период необходимо проводить всестороннюю оценку эндокринных, метаболических и нутритивных факторов и осуществлять целенаправленную подготовку.
Обсуждение
Данное исследование выделяется рядом аспектов, которые отличают его от аналогичных научных работ.В отличие от большинства исследований, сосредоточенных на гиперпролактинемии или СПЯ изолированно, в этой работе рассматривается влияние сочетания этих патологий на репродуктивное здоровье, минеральный обмен и исходы беременности.
Особое внимание уделено дефициту кальция и витамина D, что нередко упускается из виду в других работах, преимущественно ориентированных на гормональные нарушения. Полученные данные свидетельствуют о взаимосвязи между дефицитом данных микроэлементов и ухудшением репродуктивных функций, что подчеркивает необходимость комплексного подхода к лечению женщин с гиперпролактинемией и СПЯ, включающего не только гормональную коррекцию, но и восстановление минерального баланса. Кроме того, настоящее исследование представляет собой эксперимент по оценке эффективности комбинированной терапии, включающей стандартное лечение в сочетании с применением минеральных комплексов и витамина D. Такой подход является новаторским по сравнению с большинством исследований, в которых отдельно рассматриваются гормональная терапия или витаминно-минеральные добавки.
Заключение
Сочетание необходимого количества минеральных веществ и витамина D со стандартным лечением в прегравидарной фазе показало высокую эффективность. Это способствовало не только устранению симптомов заболевания, но и оказало существенное влияние на наступление беременности. Более того, применение комбинированной терапии позволило снизить частоту осложнений в период гестации.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование не имело внешнего финансирования или спонсорской поддержки.
Financing. The study had no sponsorship.
Вклад авторов. Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. – формулирование концепции исследования и разработка его дизайна; Балтабаева Г.Ш., Муминова З.А. – сбор клинического и лабораторного материала; Балтабаева Г.Ш., Муминова З.А., Икрамова Х.С. – анализ и интерпретация полученных результатов; Хаитов А.О., Рузиева Н.Х. – обзор литературы и статистическая обработка данных; Матризаева Г.Д., Балтабаева Г.Ш. – написание первоначального варианта рукописи и подготовка ее окончательной редакции;
Матризаева Г.Д., Балтабаева Г.Ш., Муминова З.А., Хаитов А.О., Рузиева Н.Х., Икрамова Х.С. – критический пересмотр рукописи с внесением существенного интеллектуального вклада. Все авторы одобрили окончательный вариант статьи перед публикацией и несут полную ответственность за все ее разделы, что подразумевает надлежащее изучение и разрешение всех вопросов, связанных с точностью и добросовестностью представленных данных.
Author contributions. Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. – concept statement and stady design; Baltabaeva G.S., Muminova Z.A – data collection; Baltabaeva G.S., Muminova Z.A, Ikramova Kh.S. – analysis and interpretation of the results; Khaitov A.O., Ruzieva N.H. – literature reviev and statistical analysis; Matrizaeva G.D., Baltabaeva G.S. – drafting of the manuscript and preparation of its final version; Matrizaeva G.D., Baltabaeva G.S., Muminova Z.A, Khaitov A.O., Ruzieva N.H., Ikramova Kh.S. – critical reviev of the manuscript with introduction of valuable intellectual content. All authors approved the final version of the paper before publication and assume responsibility for all aspects of the work, which implies proper study and resolution of issues related to the accuracy and integrity of any part of the work.
Информация об авторах
Information about the authors
Матризаева Гульнара Джуманиязовна – д-р мед. наук, доц., зав. каф. акушерства, гинекологии и онкологии, Ургенчский филиал Ташкентской медицинской академии. Е-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Gulnara D. Matrizaeva – Dr. Sci. (Med.), Assoc. Prof., Urgench Branch of the Tashkent Medical Academy. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Балтабаева Гулноза Шухрат кизи – ассистент, каф. акушерства и гинекологии, Ташкентская медицинская академия.
E-mail: gulnoza.gynecologist@gmail.com ORCID: 0009-0008-5427-1830
Gulnoza Sh. Baltabayeva – Аssistant, Tashkent Medical Academy. E-mail: gulnoza.gynecologist@gmail.com ORCID: 0009-0008-5427-1830
Муминова Зиёда Абраровна – д-р мед. наук, доц., каф. акушерства и гинекологии, Ташкентская медицинская академия.
E-mail: ziedamuminova@gmail.com; ORCID: 0000-0001-5188-7025
Ziyoda A. Muminova – Dr. Sci. (Med.), Assoc. Prof., Tashkent Medical Academy. E-mail: ziedamuminova@gmail.com; ORCID: 0000-0001-5188-7025
Хаитов Акбар Октамбаевич – канд. мед. наук, Ургенчский филиал Ташкентской медицинской академии. E-mail:
akbarshox033087@gmail.com; ORCID: 0009-0001-3051-565Х
Akbar O. Khaitov – Cand. Sci. (Med.), Urgench Branch of the Tashkent Medical Academy. E-mail: akbarshox033087@gmail.com; ORCID: 0009-0001-3051-565Х
Рузиева Нодира Хакимовна – д-р мед. наук, проф. каф. акушерства и гинекологии, Ташкентский педиатрический медицинский институт. E-mail: nod_ruz@internet.ru; ORCID: 0000-0003-0679
Nodira Kh. Ruzieva – Dr. Sci. (Med.), Prof., Tashkent Pediatric Medical Institute. E-mail: nod_ruz@internet.ru; ORCID: 0000-0003-0679
Икрамова Холидажон Сахибовна – канд. мед. наук, каф. акушерства и гинекологии, онкологии, Ургенчский филиал Ташкентской медицинской академии. E-mail: xolidajonikramova@gmail.com; ORCID: 0009-0007-1896-5205
Holidazhon S. Ikramova – Cand. Sci. (Med.), Urgench Branch of the Tashkent Medical Academy. E-mail: xolidajonikramova@gmail.com; ORCID: 0009-0007-1896-5205
Поступила в редакцию: 19.08.2025
Поступила после рецензирования: 28.08.2025
Принята к публикации: 04.09.2025
Received: 19.08.2025
Revised: 28.08.2025
Accepted: 04.09.2025
Список исп. литературыСкрыть список1. Biller V, Baum H, Rosenthal D. Progressive trabecular osteopenia in women with hyperprolactinemic amenorrhea. J Clin Endocrinol Metab 1992;75(3):692-7.
2. Bellantoni MF. Osteoporosis prevention and treatment. Am Fam Physician 1996;54(3):986-92.
3. Baltabaeva GSh, Muminova ZA, Khaitov AO. Complications of Hyperprolactenemia During Pregnancy. Am J Med Med Sci 2024;14(6):1647-50.
4. Csermely T, Halvax L, Schmidt E. Lower bone density (osteopenia) in adolescent girls with oligomenorrhea and secondary amenorrhea. Orv Hetil 1997;138(43):2735-41.
5. Lamberts WJ, McLeod RM. Regulation of prolactin secretion at the level of lactotroph. Physiol Rev 1990;70(2):279-308.
6. Гельцер Б.И., Белых О.А., Кочеткова Е.А. Патофизиологические особенности остеопенического синдрома у женщин с гиперандрогенией и гиперпролактинемией (обзор 10 литературных источников). Проблемы репродукции. 2005;(6):63-6.
Geltzer B.I., Belykh O.A., Kochetkova E.A. Pathophysiological features of osteopenic syndrome in women with hyperandrogenism and hyperprolactinemia (review of 10 literary sources). Problems of reproduction. 2005;(6):63-6 (in Russian).
7. Марова Е.И. Нейроэндокринология. Ярославль, 1999.
Marova E.I. Neuroendocrinology. Yaroslavl, 1999 (in Russian).
8. Schlechte J, Dolan K, Sherman B. The natural history of untreated hyperprolactinemia: a prospective analysis. J Clin Endocrinol Metab 1989;68:412-8.
9. Балтабаева Г.Ш., Муминова З.А., Хаитов А.О. Исходы беременности у женщин с синдромом гиперпролактинемии. Узбекский медицинский журнал. 2024;(4):232-7.
Baltabaeva G.Sh., Muminova Z.A., Khaitov A.O. Pregnancy outcomes in women with hyperprolactinemia syndrome. Uzbek Medical Journal. 2024;(4):232-7 (in Russian).
10. Беневоленская Л.И. Остеопороз – актуальная проблема медицины. Остеопороз и остеопатии. 1998;(1):4-7.
Benevolenskaya L.I. Osteoporosis is an urgent medical problem. Osteoporosis and osteopathies. 1998;(1):4-7 (in Russian).
11. Shahbazian HB, Mowla K, Zarei S. Evaluation of bone mineral density in hyperprolactinemic patients treated with dopamine agonists. Scientific Research and Essays 2011;6(29):6033-8.
12. Сметник В.П., Кушлинский Н.Э., Болдырева Н.В. Эффективность заместительной гормональной терапии в лечении и профилактике постменопаузального остеопороза. Остеопороз и остеопатии. 1999;(2):16-9.
Smetnik V.P., Kushlinsky N.E., Boldyreva N.V. The effectiveness of hormone replacement therapy in the treatment and prevention of postmenopausal osteoporosis. Osteoporosis and osteopathies. 1999;(2):16-9 (in Russian).

