Клинический разбор в общей медицине №9 2025
¹ Urgench branch of the Tashkent Medical Academy, Urgench, Republic of Uzbekistan;
² Branch of the Republican Specialized Scientific and Practical Medical Center for Maternal and Child Health of the Khorezm Region, Urgench, Republic of Uzbekistan
doctor_9191@list.ru
Abstract
Anemia is a common disease characterized by a decrease in the level of red blood cells and/or hemoglobin in the blood, which is especially important for women of reproductive age. Based on a study of 97 girls of early reproductive age with anemia in the Khorezm region, diagnostic markers of iron metabolism were assessed. The work used ELISA methods to measure the levels of erythropoietin, soluble transferrin receptor (sTfR) and ferritin, as well as the sTfR / log10Ft index to assess iron status. The results showed a high prevalence of anemia among the subjects, with the detection of functional iron deficiency against the background of a chronic inflammatory process or suppression of erythropoiesis. Most of the girls have iron deficiency, which is confirmed by a decrease in ferritin levels and an increase in the sTfR/log10Ft index. A decrease in erythropoietin production was also noted, indicating a limitation of compensatory mechanisms of hematopoiesis. The importance of a comprehensive approach to the diagnosis of anemia, including the assessment of ferrokinetic markers, lies in a more accurate differentiation of anemia types and the choice of the optimal treatment strategy. This study emphasizes the need for further research to deeply understand the pathogenesis of anemia and develop effective methods of correction in girls of early reproductive age.
Keywords: anemia, iron deficiency, ferritin, soluble transferrin receptor, erythropoietin, reproductive age, Khorezm region.
For citation: Sultanmuratova G.U., Matyakubova S.A. Study of iron metabolism markers in girls of early reproductive age with anemia in Khorezm region. Clinical review for general practice. 2025; 6 (9): 37–41 (In Russ.). DOI: 10.47407/kr2025.6.9.00670
Aнемии – группа заболеваний, характеризующихся уменьшением количества циркулирующих эритроцитов и/или гемоглобина (Hb) в единице объема крови ниже нормального для данного возраста и пола. Наиболее уязвимыми для анемии считаются три группы населения: дети дошкольного возраста (0–5 лет); беременные женщины; женщины репродуктивного возраста (15–49 лет), а также менструирующие девочки подросткового возраста и женщины, в то время как мужская популяция менее подвержена этой патологии. Ключ к пониманию гендерных различий кроется в физиологии женского организма и в современных особенностях репродуктивного поведения, которые заключаются в снижении количества беременностей и в многократном увеличении числа менструаций. От анемии страдают около 30% женщин, 37% беременных женщин и 40% детей в возрасте от полугода до пяти лет, преимущественно из-за дефицита железа. Другие причины включают недостаточность питания, гемоглобинопатии, инфекционные и хронические заболевания, редко – злокачественное новообразование [1, 2]. Наибольшее бремя анемии несут страны с низким уровнем дохода или уровнем дохода ниже среднего, особенно группы населения, проживающие в сельской местности, в более бедных домохозяйствах и не получившие официального образования. Женщины репродуктивного возраста в Узбекистане страдают от сильного скрытого голода. 50% женщин репродуктивного возраста испытывают дефицит железа. Около половины женщин начинают свою беременность с высокой степенью риска рождения ребенка с дефектами нервной трубки. Каждая пятая женщина страдает дефицитом витамина В12. Каждая шестая девочка-подросток (16,5%) в Узбекистане страдает анемией. 75% девочек с анемией страдают железодефицитной анемией. Уровень дефицита железа среди девочек-подростков тревожно высок и составляет около 50%.
Распространенность анемии значительно отличается от региона к региону. Самый высокий уровень анемии отмечается в Ташкентской области и Каракалпакстане, а самые низкие показатели анемии – в Наманганской и Кашкадарьинской областях. Несмотря на усилия мирового медицинского сообщества, частота анемии у женщин разных возрастов остается стабильно высокой. Это вынудило Всемирную организацию здравоохранения (ВОЗ) в 2014 г. признать отсутствие прогресса в решении данной проблемы. Важность снижения и правильного ведения материнской анемии была признана во всем мире, и на международном уровне установлены такие цели, как «Цель устойчивого развития-3» и «Глобальные цели в области питания до 2025 г.», направленные на сокращение анемии у женщин репродуктивного возраста на 50%. ВОЗ характеризует уровень Hb<130,0 г/л у мужчин, Hb<120,0 г/л у женщин, Hb<110,0 г/л у беременных и Hb<100 г/л после родов как анемию. Распространенность анемии является важным показателем здоровья. Углубленное изучение данных анамнеза, особенностей течения беременности, родов и послеродового периода, состояния плода и новорожденного показало, что пациенток с анемиями необходимо относить к группе высокого риска по развитию акушерских и перинатальных осложнений.
Цель исследования – оценить диагностическую значимость маркеров метаболизма железа у девушек раннего репродуктивного возраста с анемией в Хорезмской области.
Индекс массы тела среди обследованных девушек варьировал от 15,6 до 30,1 кг/м2 (среднее значение – 21,58±3,15), при этом девушек с недостаточной массой тела было 14 (14,4%), с избыточным весом – 15 (15,4%) и ожирением – 1 (1,03%). Избыточная масса тела является фактором риска для развития железодефицитной анемии у подростков обоих полов, но девушки подвержены данному риску почти в три раза чаще. Механизм развития анемии у лиц, страдающих избыточной массой тела и ожирением, заключается в повышенной потребности в железе в связи с увеличением массы тела и объема крови [3], что было подтверждено в экспериментальных исследованиях [4]. Кроме того, одним из основных механизмов развития анемии при избыточной массе тела может быть нарушение абсорбции железа в тонком кишечнике. С помощью использования радиоизотопных методов было показано снижение абсорбции железа из железосодержащих лекарственных препаратов с наличием аскорбиновой кислоты или без нее у фертильных женщин и детей с избыточным весом по сравнению с лицами с нормальным весом или его умеренным увеличением [5, 6]. Полученные результаты позволили считать, что одним из механизмов развития анемии при избыточной массе тела является снижение абсорбции железа энтероцитами.
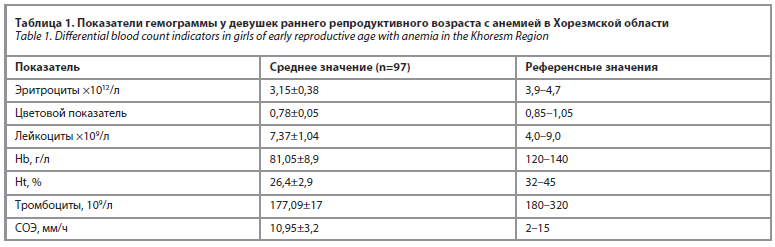
Согласно показателям общего анализа крови всем 97 девушкам диагностированы анемии различной степени тяжести: анемию легкой степени имели 18 (18,6%) девушек, анемию средней степени – 72 (74,2%) и анемию тяжелой степени – 7 (7,2%). Уровень гемоглобина обследуемых колебался от 65 до 108 г/л (среднее значение– 81,05±8,9 г/л), цветовой показатель – от 0,66 до 1 (среднее значение– 0,78±0,05), лейкоциты – от 3,5 до 8,9 (среднее значение – 7,37±1,04), СОЭ – от 5 до 19 мм/ч (среднее значение – 10,95±3,2) (табл. 1). Эти данные подтверждают наличие гипохромной анемии. Важно отметить, что 34% девушек принимали поливитамины и 32% – препараты железа, что может указывать на хроническое течение анемии.
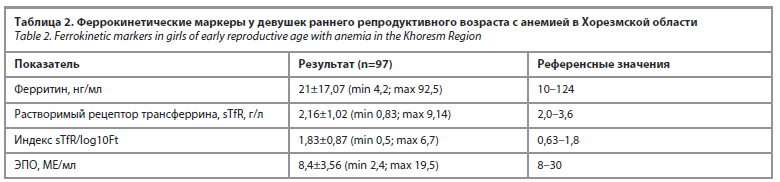
Роль ферритина (Ft) в организме человека крайне разнообразна. Он необходим для нормального функционирования практически всех систем и тканей: поддержки общего иммунитета в активном состоянии, регулирования структуры нервной системы, обеспечения газового обмена и насыщения тканей кислородом, воспроизводства эритроцитов в костном мозге, работы мышечных тканей, образования ферментов и метаболизма холестерина. Контрольные значения концентраций ферритина периферической крови варьируются в зависимости от используемых аналитических методов и исследуемой популяции. Возраст и пол играют важную роль. Контрольные значения уровня Ft у женщин установлены на уровне 10–124 нг/мл. Согласно результатам исследования, концентрация Ft колебалась от 4,2 до 92,5 нг/мл и среднее значение составило 21±17,07 нг/мл. Среди обследованных только 20 (20,6%) девушек раннего репродуктивного возраста имеют дефицит Ft, что свидетельствует об истощении запасов железа. Снижение его уровня – золотой стандарт диагностики широко распространенных железодефицитных состояний.
В настоящее время большое внимание уделяется диагностике абсолютного железодефицита у пациентов с анемией хронического заболевания. Согласно имеющимся данным, в условиях системного воспаления эффективную потребность в железе можно оценить только путем определения sTfR, а расчет sTfR/log Fer позволяет достоверно оценить даже незначительные изменения в статусе феррокинетики [7, 8]. Продукция ферритина, являющегося положительным белком острой фазы, увеличивается в ответ на любой воспалительный стимул, поэтому его диагностическая ценность как показателя, отражающего запасы железа в организме, снижается.
Транспорт железа в клетку происходит благодаря взаимодействию комплекса железо–трансферрин с цитоплазматическим рецептором (TfR), который состоит из двух трансмембранных полипептидных цепей. Молекула трансферрина с двумя атомами железа присоединяется к внешнему, экстрацеллюлярному концу TfR и поглощается клеткой путем эндоцитоза. В образовавшейся везикуле происходит изменение pH, железо окисляется с Fe3+ на Fe2+ и используется для синтеза гемоглобина или сохраняется в депонированной форме. Далее белковая часть трансферрина, освобожденная от железа, вместе с TfR оказывается на поверхности клетки, отделяется апотрансферрин и цикл повторяется [6–9]. При повышенной потребности в железе цикл ускоряется, при этом внешняя часть TfR подвергается расщеплению экстрацеллюлярными протеазами. В результате их воздействия от TfR отделяется фрагмент – пептид с молекулярным весом 95 кДа, он называется растворимым рецептором трансферрина (sTfR), концентрацию его можно определять с помощью иммуноферментного метода. Около 80% TfR находится на плазматической мембране эритропоэтических клеток. TfR выявлен на клетках плаценты, лимфоцитах, на некоторых опухолевых клетках. На поверхности клеток-предшественниц эритроцитов плотность TfR повышается по мере дифференцировки вплоть до ретикулоцитов. На поверхности зрелого эритроцита TfR отсутствует [10–12].
При стимуляции эритропоэтической системы sTfR повышается. При дефиците железа уровни ферритина и sTfR изменяются разнонаправлено: ферритин снижается, sTfR повышается [10, 11, 13]. Уровень sTfR в нашем исследовании колебался от 0,83 до 9,14 г/л, среднее значение sTfR всех обследованных девушек составило 2,16±1,02 г/л. Среди обследованных 40 девушек имели сниженные значения sTfR (возможно из-за подавления костного мозга) и 2 девушки, напротив, – повышенные значения (истинный дефицит железа). sTfR может не быть повышен, если эритропоэз угнетен, поэтому его низкий уровень здесь не исключает дефицита железа.
Согласно источникам, моноисследование маркеров Ft и sTfR обладает низкой информативностью в диагностике железодефицитных состояний [14–16]. Следовательно, для выявления точных запасов железа в организме необходим метод, позволяющий дифференцированно подходить к диагностике анемии воспаления. Для оценки статуса железа мы использовали расчетный показатель – индекс sTfR/log10Ft, изменения которого отражают уровень запасов железа в организме. Так, в наших исследованиях оценка индекса свидетельствовала о том, что среди обследованных 37 девушек раннего репродуктивного возраста имели повышенные значения ферритинового индекса (индекс sTfR/log10Ft – 2,52±0,9), что подтверждает функциональный дефицит железа (при хроническом заболевании организм не может использовать железо, которое есть), в то время как 2 девушки имели сниженные значения этого индекса (индекс sTfR/log10Ft – 0,904±0,02) – перегрузка организма железом (табл. 2).
ЭПО является одним из центральных регуляторов образования эритроцитов в организме человека и животных, первичным медиатором нормальной физиологической реакции на гипоксию. Основная особенность ЭПО – контроль пролиферации и дифференцировки клеток – предшественников эритроидного ряда. Современные методы лабораторной диагностики позволяют с высокой точностью определять уровень ЭПО в сыворотке крови. ЭПО – важный показатель в оценке анемического синдрома. Особенно это важно для дифференциальной диагностики железодефицитной анемии и анемии хронического заболевания. ЭПО вырабатывается почками в ответ на уменьшение тканевой оксигенации. Запасов ЭПО в организме не обнаружено, его референсный уровень в плазме крови 8–30 МЕ/мл во всех возрастных группах. В нашем исследовании уровень эндогенного ЭПО находился в пределах 2,4–19,5 МЕ/мл (в среднем 8,4±3,56 МЕ/мл), при этом у 46% он был ниже нормы, что может свидетельствовать о недостаточной компенсаторной реакции организма на гипоксию. При анемии хронических заболеваний костный мозг подавлен, ЭПО снижен, железо «заперто» в депо, а сниженный ферритин говорит еще и о реальном дефиците железа.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование проведено без финансовой поддержки.
Funding. The study was conducted without funding.
Вклад авторов. С.А. Матьякубова – концепция и дизайн, редактирование текста; Г.У. Султанмуратова – сбор и обработка материала, написание текста, статистическая обработка данных.
Author contribution. S.A. Matyakubova – concept and design, manuscript editing; G.U. Sultanmuratova – data acquisition and processing, manuscript writing, statistical data processing.
Информация об авторах
Information about the authors
Гули Уткировна Султанмуратова – PhD, старший преподаватель каф. акушерства, гинекологии и онкологии, Ургенчский филиал Ташкентской медицинской академии. E-mail:
doctor_9191@list.ru; ORCID: 0000-0001-8457-6178
Guli U. Sultanmuratova – PhD, Senior Lecturer, Department of Obstetrics, Gynecology and Oncology, Urgench Branch of Tashkent Medical Academy. E-mail: doctor_9191@list.ru; ORCID: 0000-0001-8457-6178
Саломат Александровна Матьякубова – DSc, директор филиала государственного учреждения «Республиканский специализированный научно-практический медицинский центр охраны здоровья матери и ребенка Хорезмской области»
Salomat A. Matyakubova – DSc, Director of the State Institution Branch of the Republican Specialized Scientific and Practical Medical Center for Maternal and Child Health of the Khorezm Region
Поступила в редакцию: 19.05.2025
Поступила после рецензирования: 02.06.2025
Принята к публикации: 19.06.2025
Received: 19.05.2025
Revised: 02.06.2025
Accepted: 19.06.2025
Клинический разбор в общей медицине №9 2025
Изучение маркеров метаболизма железа у девушек раннего репродуктивного возраста с анемией в Хорезмской области
Номера страниц в выпуске:37-41
Аннотация
Анемия представляет собой распространенное заболевание, характеризующееся снижением уровня эритроцитов и/или гемоглобина в крови, что особенно актуально для женщин репродуктивного возраста. На основе исследования анемии у 97 девушек раннего репродуктивного возраста в Хорезмской области оценены диагностические маркеры метаболизма железа. В работе использованы методы иммуноферментного анализа для измерения уровней эритропоэтина, растворимого рецептора трансферрина (sTfR) и ферритина, а также индекс sTfR/log10Ft для оценки статуса железа. Результаты показали высокую распространенность анемии с выявлением функционального дефицита железа на фоне хронического воспалительного процесса или угнетения эритропоэза. У большинства девушек наблюдается дефицит железа, что подтверждается снижением уровня ферритина и повышением индекса sTfR/log10Ft. Также отмечено снижение продукции эритропоэтина, что указывает на ограничение компенсаторных механизмов кроветворения. Важность комплексного подхода к диагностике анемий, включая оценку феррокинетических маркеров, заключается в более точной дифференциации типов анемий и выборе оптимальной стратегии лечения. Данное исследование подчеркивает необходимость дальнейших исследований для глубокого понимания патогенеза анемии и разработки эффективных методов коррекции у девушек раннего репродуктивного возраста.
Ключевые слова: анемия, дефицит железа, ферритин, растворимый рецептор трансферрина, эритропоэтин, репродуктивный возраст, Хорезмская область.
Для цитирования: Султанмуратова Г.У., Матьякубова С.А. Изучение маркеров метаболизма железа у девушек раннего репродуктивного возраста с анемией в Хорезмской области. Клинический разбор в общей медицине. 2025; 6 (9): 37–41. DOI: 10.47407/kr2025.6.9.00670
Анемия представляет собой распространенное заболевание, характеризующееся снижением уровня эритроцитов и/или гемоглобина в крови, что особенно актуально для женщин репродуктивного возраста. На основе исследования анемии у 97 девушек раннего репродуктивного возраста в Хорезмской области оценены диагностические маркеры метаболизма железа. В работе использованы методы иммуноферментного анализа для измерения уровней эритропоэтина, растворимого рецептора трансферрина (sTfR) и ферритина, а также индекс sTfR/log10Ft для оценки статуса железа. Результаты показали высокую распространенность анемии с выявлением функционального дефицита железа на фоне хронического воспалительного процесса или угнетения эритропоэза. У большинства девушек наблюдается дефицит железа, что подтверждается снижением уровня ферритина и повышением индекса sTfR/log10Ft. Также отмечено снижение продукции эритропоэтина, что указывает на ограничение компенсаторных механизмов кроветворения. Важность комплексного подхода к диагностике анемий, включая оценку феррокинетических маркеров, заключается в более точной дифференциации типов анемий и выборе оптимальной стратегии лечения. Данное исследование подчеркивает необходимость дальнейших исследований для глубокого понимания патогенеза анемии и разработки эффективных методов коррекции у девушек раннего репродуктивного возраста.
Ключевые слова: анемия, дефицит железа, ферритин, растворимый рецептор трансферрина, эритропоэтин, репродуктивный возраст, Хорезмская область.
Для цитирования: Султанмуратова Г.У., Матьякубова С.А. Изучение маркеров метаболизма железа у девушек раннего репродуктивного возраста с анемией в Хорезмской области. Клинический разбор в общей медицине. 2025; 6 (9): 37–41. DOI: 10.47407/kr2025.6.9.00670
Study of iron metabolism markers in girls of early reproductive age with anemia in Khorezm region
Guli U. Sultanmuratova1, Salomat A. Matyakubova2¹ Urgench branch of the Tashkent Medical Academy, Urgench, Republic of Uzbekistan;
² Branch of the Republican Specialized Scientific and Practical Medical Center for Maternal and Child Health of the Khorezm Region, Urgench, Republic of Uzbekistan
doctor_9191@list.ru
Abstract
Anemia is a common disease characterized by a decrease in the level of red blood cells and/or hemoglobin in the blood, which is especially important for women of reproductive age. Based on a study of 97 girls of early reproductive age with anemia in the Khorezm region, diagnostic markers of iron metabolism were assessed. The work used ELISA methods to measure the levels of erythropoietin, soluble transferrin receptor (sTfR) and ferritin, as well as the sTfR / log10Ft index to assess iron status. The results showed a high prevalence of anemia among the subjects, with the detection of functional iron deficiency against the background of a chronic inflammatory process or suppression of erythropoiesis. Most of the girls have iron deficiency, which is confirmed by a decrease in ferritin levels and an increase in the sTfR/log10Ft index. A decrease in erythropoietin production was also noted, indicating a limitation of compensatory mechanisms of hematopoiesis. The importance of a comprehensive approach to the diagnosis of anemia, including the assessment of ferrokinetic markers, lies in a more accurate differentiation of anemia types and the choice of the optimal treatment strategy. This study emphasizes the need for further research to deeply understand the pathogenesis of anemia and develop effective methods of correction in girls of early reproductive age.
Keywords: anemia, iron deficiency, ferritin, soluble transferrin receptor, erythropoietin, reproductive age, Khorezm region.
For citation: Sultanmuratova G.U., Matyakubova S.A. Study of iron metabolism markers in girls of early reproductive age with anemia in Khorezm region. Clinical review for general practice. 2025; 6 (9): 37–41 (In Russ.). DOI: 10.47407/kr2025.6.9.00670
Aнемии – группа заболеваний, характеризующихся уменьшением количества циркулирующих эритроцитов и/или гемоглобина (Hb) в единице объема крови ниже нормального для данного возраста и пола. Наиболее уязвимыми для анемии считаются три группы населения: дети дошкольного возраста (0–5 лет); беременные женщины; женщины репродуктивного возраста (15–49 лет), а также менструирующие девочки подросткового возраста и женщины, в то время как мужская популяция менее подвержена этой патологии. Ключ к пониманию гендерных различий кроется в физиологии женского организма и в современных особенностях репродуктивного поведения, которые заключаются в снижении количества беременностей и в многократном увеличении числа менструаций. От анемии страдают около 30% женщин, 37% беременных женщин и 40% детей в возрасте от полугода до пяти лет, преимущественно из-за дефицита железа. Другие причины включают недостаточность питания, гемоглобинопатии, инфекционные и хронические заболевания, редко – злокачественное новообразование [1, 2]. Наибольшее бремя анемии несут страны с низким уровнем дохода или уровнем дохода ниже среднего, особенно группы населения, проживающие в сельской местности, в более бедных домохозяйствах и не получившие официального образования. Женщины репродуктивного возраста в Узбекистане страдают от сильного скрытого голода. 50% женщин репродуктивного возраста испытывают дефицит железа. Около половины женщин начинают свою беременность с высокой степенью риска рождения ребенка с дефектами нервной трубки. Каждая пятая женщина страдает дефицитом витамина В12. Каждая шестая девочка-подросток (16,5%) в Узбекистане страдает анемией. 75% девочек с анемией страдают железодефицитной анемией. Уровень дефицита железа среди девочек-подростков тревожно высок и составляет около 50%.
Распространенность анемии значительно отличается от региона к региону. Самый высокий уровень анемии отмечается в Ташкентской области и Каракалпакстане, а самые низкие показатели анемии – в Наманганской и Кашкадарьинской областях. Несмотря на усилия мирового медицинского сообщества, частота анемии у женщин разных возрастов остается стабильно высокой. Это вынудило Всемирную организацию здравоохранения (ВОЗ) в 2014 г. признать отсутствие прогресса в решении данной проблемы. Важность снижения и правильного ведения материнской анемии была признана во всем мире, и на международном уровне установлены такие цели, как «Цель устойчивого развития-3» и «Глобальные цели в области питания до 2025 г.», направленные на сокращение анемии у женщин репродуктивного возраста на 50%. ВОЗ характеризует уровень Hb<130,0 г/л у мужчин, Hb<120,0 г/л у женщин, Hb<110,0 г/л у беременных и Hb<100 г/л после родов как анемию. Распространенность анемии является важным показателем здоровья. Углубленное изучение данных анамнеза, особенностей течения беременности, родов и послеродового периода, состояния плода и новорожденного показало, что пациенток с анемиями необходимо относить к группе высокого риска по развитию акушерских и перинатальных осложнений.
Цель исследования – оценить диагностическую значимость маркеров метаболизма железа у девушек раннего репродуктивного возраста с анемией в Хорезмской области.
Материалы и методы
Обследованы 97 девушек раннего репродуктивного возраста, подавшие заявление в ЗАГС города Ургенч с января по апрель 2024 г. Исследование проводилось в Хорезмском областном филиале Республиканского специализированного научно-практического медицинского центра здоровья матери и ребенка. Все пациентки подписали добровольное медицинское согласие. Критерии включения: девушки раннего репродуктивного возраста, подавшие заявление в ЗАГС города Ургенч с января по апрель 2024 г. (18–25 лет). Всем девушкам проведен развернутый общий анализ крови. Специальные методы исследования включали определение методом иммуноферментного анализа: эритропоэтина (ЭПО), растворимых трансферриновых рецепторов (sTfR), ферритина (Ft). По отношению уровня sTfR к десятичному логарифму Ft вычислялся индекс sTfR/ log10Ft. Повышение значения индекса sTfR/log10Ft>1,8 свидетельствует об истощении запасов железа в депо, а снижение индекса sTfR/log10Ft<0,63 – о перегрузке организма железом, при уровне индекса sTfR/log10Ft в пределах от 0,63–1,8 – о достаточном содержании железа в депо. Статистическая обработка данных проводилась методом вариационной статистики с применением программы Excel-2007, Statistica 6.0 и вычислением t-критерия Стьюдента.Результаты и обсуждение
Возраст обследуемых колебался от 19 до 25 лет (в среднем 21,4±1,4 года). Пациенток, проживающих в сельской местности, было в 2 раза больше – 68 (70%), чем городских жителей – 29 (30%), подавляющее большинство девушек являются студентками – 87 (89,6%).Индекс массы тела среди обследованных девушек варьировал от 15,6 до 30,1 кг/м2 (среднее значение – 21,58±3,15), при этом девушек с недостаточной массой тела было 14 (14,4%), с избыточным весом – 15 (15,4%) и ожирением – 1 (1,03%). Избыточная масса тела является фактором риска для развития железодефицитной анемии у подростков обоих полов, но девушки подвержены данному риску почти в три раза чаще. Механизм развития анемии у лиц, страдающих избыточной массой тела и ожирением, заключается в повышенной потребности в железе в связи с увеличением массы тела и объема крови [3], что было подтверждено в экспериментальных исследованиях [4]. Кроме того, одним из основных механизмов развития анемии при избыточной массе тела может быть нарушение абсорбции железа в тонком кишечнике. С помощью использования радиоизотопных методов было показано снижение абсорбции железа из железосодержащих лекарственных препаратов с наличием аскорбиновой кислоты или без нее у фертильных женщин и детей с избыточным весом по сравнению с лицами с нормальным весом или его умеренным увеличением [5, 6]. Полученные результаты позволили считать, что одним из механизмов развития анемии при избыточной массе тела является снижение абсорбции железа энтероцитами.
Согласно показателям общего анализа крови всем 97 девушкам диагностированы анемии различной степени тяжести: анемию легкой степени имели 18 (18,6%) девушек, анемию средней степени – 72 (74,2%) и анемию тяжелой степени – 7 (7,2%). Уровень гемоглобина обследуемых колебался от 65 до 108 г/л (среднее значение– 81,05±8,9 г/л), цветовой показатель – от 0,66 до 1 (среднее значение– 0,78±0,05), лейкоциты – от 3,5 до 8,9 (среднее значение – 7,37±1,04), СОЭ – от 5 до 19 мм/ч (среднее значение – 10,95±3,2) (табл. 1). Эти данные подтверждают наличие гипохромной анемии. Важно отметить, что 34% девушек принимали поливитамины и 32% – препараты железа, что может указывать на хроническое течение анемии.

Роль ферритина (Ft) в организме человека крайне разнообразна. Он необходим для нормального функционирования практически всех систем и тканей: поддержки общего иммунитета в активном состоянии, регулирования структуры нервной системы, обеспечения газового обмена и насыщения тканей кислородом, воспроизводства эритроцитов в костном мозге, работы мышечных тканей, образования ферментов и метаболизма холестерина. Контрольные значения концентраций ферритина периферической крови варьируются в зависимости от используемых аналитических методов и исследуемой популяции. Возраст и пол играют важную роль. Контрольные значения уровня Ft у женщин установлены на уровне 10–124 нг/мл. Согласно результатам исследования, концентрация Ft колебалась от 4,2 до 92,5 нг/мл и среднее значение составило 21±17,07 нг/мл. Среди обследованных только 20 (20,6%) девушек раннего репродуктивного возраста имеют дефицит Ft, что свидетельствует об истощении запасов железа. Снижение его уровня – золотой стандарт диагностики широко распространенных железодефицитных состояний.
В настоящее время большое внимание уделяется диагностике абсолютного железодефицита у пациентов с анемией хронического заболевания. Согласно имеющимся данным, в условиях системного воспаления эффективную потребность в железе можно оценить только путем определения sTfR, а расчет sTfR/log Fer позволяет достоверно оценить даже незначительные изменения в статусе феррокинетики [7, 8]. Продукция ферритина, являющегося положительным белком острой фазы, увеличивается в ответ на любой воспалительный стимул, поэтому его диагностическая ценность как показателя, отражающего запасы железа в организме, снижается.
Транспорт железа в клетку происходит благодаря взаимодействию комплекса железо–трансферрин с цитоплазматическим рецептором (TfR), который состоит из двух трансмембранных полипептидных цепей. Молекула трансферрина с двумя атомами железа присоединяется к внешнему, экстрацеллюлярному концу TfR и поглощается клеткой путем эндоцитоза. В образовавшейся везикуле происходит изменение pH, железо окисляется с Fe3+ на Fe2+ и используется для синтеза гемоглобина или сохраняется в депонированной форме. Далее белковая часть трансферрина, освобожденная от железа, вместе с TfR оказывается на поверхности клетки, отделяется апотрансферрин и цикл повторяется [6–9]. При повышенной потребности в железе цикл ускоряется, при этом внешняя часть TfR подвергается расщеплению экстрацеллюлярными протеазами. В результате их воздействия от TfR отделяется фрагмент – пептид с молекулярным весом 95 кДа, он называется растворимым рецептором трансферрина (sTfR), концентрацию его можно определять с помощью иммуноферментного метода. Около 80% TfR находится на плазматической мембране эритропоэтических клеток. TfR выявлен на клетках плаценты, лимфоцитах, на некоторых опухолевых клетках. На поверхности клеток-предшественниц эритроцитов плотность TfR повышается по мере дифференцировки вплоть до ретикулоцитов. На поверхности зрелого эритроцита TfR отсутствует [10–12].
При стимуляции эритропоэтической системы sTfR повышается. При дефиците железа уровни ферритина и sTfR изменяются разнонаправлено: ферритин снижается, sTfR повышается [10, 11, 13]. Уровень sTfR в нашем исследовании колебался от 0,83 до 9,14 г/л, среднее значение sTfR всех обследованных девушек составило 2,16±1,02 г/л. Среди обследованных 40 девушек имели сниженные значения sTfR (возможно из-за подавления костного мозга) и 2 девушки, напротив, – повышенные значения (истинный дефицит железа). sTfR может не быть повышен, если эритропоэз угнетен, поэтому его низкий уровень здесь не исключает дефицита железа.
Согласно источникам, моноисследование маркеров Ft и sTfR обладает низкой информативностью в диагностике железодефицитных состояний [14–16]. Следовательно, для выявления точных запасов железа в организме необходим метод, позволяющий дифференцированно подходить к диагностике анемии воспаления. Для оценки статуса железа мы использовали расчетный показатель – индекс sTfR/log10Ft, изменения которого отражают уровень запасов железа в организме. Так, в наших исследованиях оценка индекса свидетельствовала о том, что среди обследованных 37 девушек раннего репродуктивного возраста имели повышенные значения ферритинового индекса (индекс sTfR/log10Ft – 2,52±0,9), что подтверждает функциональный дефицит железа (при хроническом заболевании организм не может использовать железо, которое есть), в то время как 2 девушки имели сниженные значения этого индекса (индекс sTfR/log10Ft – 0,904±0,02) – перегрузка организма железом (табл. 2).

ЭПО является одним из центральных регуляторов образования эритроцитов в организме человека и животных, первичным медиатором нормальной физиологической реакции на гипоксию. Основная особенность ЭПО – контроль пролиферации и дифференцировки клеток – предшественников эритроидного ряда. Современные методы лабораторной диагностики позволяют с высокой точностью определять уровень ЭПО в сыворотке крови. ЭПО – важный показатель в оценке анемического синдрома. Особенно это важно для дифференциальной диагностики железодефицитной анемии и анемии хронического заболевания. ЭПО вырабатывается почками в ответ на уменьшение тканевой оксигенации. Запасов ЭПО в организме не обнаружено, его референсный уровень в плазме крови 8–30 МЕ/мл во всех возрастных группах. В нашем исследовании уровень эндогенного ЭПО находился в пределах 2,4–19,5 МЕ/мл (в среднем 8,4±3,56 МЕ/мл), при этом у 46% он был ниже нормы, что может свидетельствовать о недостаточной компенсаторной реакции организма на гипоксию. При анемии хронических заболеваний костный мозг подавлен, ЭПО снижен, железо «заперто» в депо, а сниженный ферритин говорит еще и о реальном дефиците железа.
Заключение
Результаты исследования демонстрируют высокую распространенность анемий среди девушек раннего репродуктивного возраста в Хорезмской области. Снижение уровней ферритина, растворимого рецептора трансферрина (sTfR) и ЭПО при одновременном повышении ферритинового индекса (sTfR/log10Ft) свидетельствует о комплексном нарушении метаболизма железа у части обследованных девушек. Подобный профиль лабораторных показателей может указывать на функциональный дефицит железа на фоне хронического воспалительного процесса или угнетения эритропоэза. Недостаточная продукция ЭПО, вероятно, ограничивает компенсаторные механизмы кроветворения, что требует дальнейшего изучения причин гипоэритропоэтинемии и ее вклада в патогенез анемии. Использование комплексной оценки феррокинетических маркеров, включая ферритин, sTfR, индекс sTfR/log10Ft и ЭПО, позволяет более точно дифференцировать типы анемий и определять механизмы их развития. Достоверное определение патогенетического типа анемии имеет большую практическую значимость, определяя выбор оптимальной стратегии коррекции анемического синдрома у пациентов.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование проведено без финансовой поддержки.
Funding. The study was conducted without funding.
Вклад авторов. С.А. Матьякубова – концепция и дизайн, редактирование текста; Г.У. Султанмуратова – сбор и обработка материала, написание текста, статистическая обработка данных.
Author contribution. S.A. Matyakubova – concept and design, manuscript editing; G.U. Sultanmuratova – data acquisition and processing, manuscript writing, statistical data processing.
Информация об авторах
Information about the authors
Гули Уткировна Султанмуратова – PhD, старший преподаватель каф. акушерства, гинекологии и онкологии, Ургенчский филиал Ташкентской медицинской академии. E-mail:
doctor_9191@list.ru; ORCID: 0000-0001-8457-6178
Guli U. Sultanmuratova – PhD, Senior Lecturer, Department of Obstetrics, Gynecology and Oncology, Urgench Branch of Tashkent Medical Academy. E-mail: doctor_9191@list.ru; ORCID: 0000-0001-8457-6178
Саломат Александровна Матьякубова – DSc, директор филиала государственного учреждения «Республиканский специализированный научно-практический медицинский центр охраны здоровья матери и ребенка Хорезмской области»
Salomat A. Matyakubova – DSc, Director of the State Institution Branch of the Republican Specialized Scientific and Practical Medical Center for Maternal and Child Health of the Khorezm Region
Поступила в редакцию: 19.05.2025
Поступила после рецензирования: 02.06.2025
Принята к публикации: 19.06.2025
Received: 19.05.2025
Revised: 02.06.2025
Accepted: 19.06.2025
Список исп. литературыСкрыть список1. Lee AI, Okam MM. Anemia in pregnancy. Hematol Oncol Clin North Am 2011;25(2):241-59. DOI: 10.1016/j.hoc.2011.02.001.
2. Roy NBA, Pavord S. The management of anaemia and haematinic deficiencies in pregnancy and post-partum. Transfus Med 2018;28(2):107-16. DOI: 10.1111/tme.12532
3. Oustamanolakis P et al. Soluble transferrin receptor-ferritin index in the evalution of anemia in inflammatory bowel disease a case-control study. Annals of gastroenterology 2011;24:108-14.
4. Bertinato J, Aroche C, Plouffe LJ et al. Diet-induced obese rats have higher iron requirements and are more vulnerable to iron deficiency. Eur J Nutr 2013;53(3):885-9.
5. Zimmermann MB, Zeder С, Muthayya S et al. Adiposity in women and children from transition countries predicts decreased iron absorption, iron deficiency and a reduced response to iron fortification. Int J Obes 2008;32:1098-104.
6. Mujica-Coopmana MF, Britoa A, López de Romañaa D et al. Body mass index, iron absorption and iron status in childbearing age women. Journal of Trace Elements in Medicine and Biology 2015;30:215-9.
7. Weiss G, Schett G. Anaemia in inflammatory rheumatic diseases. Nat Rev Rheumatol 2013;9(4):205-15. DOI:10.1038/nrrheum.2012.183
8. Гринштейн Ю.И., Шабалин В.В., Кусаев В.В. Анемический синдром при ревматоидном артрите: подходы к диагностике и возможности терапии. Терапевтический архив. 2016;88(5):
107-12.
Grinstein Yu.I., Shabalin V.V., Kusaev V.V. Anemic syndrome in rheumatoid arthritis: diagnostic approaches and therapeutic options. Therapeutic Archive. 2016;88(5):107-12 (in Russian).
9. Nemeth E, Tuttle MS, Powelson J et al. Hepcidin regulates cellular iron effux by binding to ferroportin and inducing its intemallzation. Scienc 2004;306:2090-3.
10. Диагностика анемий [Электронный ресурс]. URL: www.biochemmack.ru. Дата доступа: 16.06.2019.
Diagnosis of anemia [Electronic resource]. URL: www.biochemmack.ru. Access date: 16.06.2019 (in Russian).
11. Левина А.А., Казюкова Т.В., Цветаева Н.В. и др. Гепсидин как регулятор гомеостаза железа. Педиатрия. 2008;(1):67-74.
Levina A.A., Kazyukova T.V., Tsvetaeva N.V. et al. Hepcidin as a regulator of iron homeostasis. Pediatrics. 2008;(1):67-74 (in Russian).
12. Тихомиров А.Л., Сарсания С.И., Ночевкин Е.В. Некоторые аспекты диагностики и лечения железодефицитных состояний в практической деятельности на современном этапе. URL: https://medi.ru/ info/3470/. Дата доступа: 15.02.2020. DOI: 10.17116/terarkh 2016885107–112
Tikhomirov A.L., Sarsania S.I., Nochevkin E.V. Some aspects of the diagnosis and treatment of iron deficiency conditions in practice at the present stage. URL: https://medi.ru/info/3470/. Access date: 15.02.2020. DOI: 10.17116/terarkh2016885107–112 (in Russian).
13. Weinstein DA, Roy CN, Fleming MD et al. Inappropriate expression of hepcidin is associated with iron refractory anemia: implications for the anemia of chronic disease. Blood 2002;100:3776-81.
14. Милованова С.Ю. и др. Анемии при острых и хронических заболеваниях печени. Клиническая гепатология. 2006;(2):16-22.
Milovanova S.Yu. et al. Anemia in acute and chronic liver diseases. Clinical hepatology. 2006;(2):16-22 (in Russian).
15. Newman BH. Vasovagal reaction rates and body weight: findings in high- and low-risk populations. Transfusion 2003;43:1084-8.
16. Punnonen K et al. Serum Transferrin Receptor and Its Ratio to Serum Ferritin in the Diagnosis of Iron Deficiency. Blood 1997;89(3):1052-7.