Клинический разбор в общей медицине №9 2025
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia;
3 Scientific Research Institute of Human Morphology named after academician A.P. Avtsyn Petrovsky Russian Scientific Center of Surgery, Moscow, Russia
omekan@mail.ru
Abstract
The relevance of the problem of obesity grows exponentially every year all over the world. Almost a half of the global adult population suffers from overweight or obesity. Today, the fact remains indisputable that obesity provides the basis for realization of a number of somatic polysystemic disease entities, including gynecological and carcinogenic ones. At the same time, the most strong is the correlation between overweight/obesity and proliferative diseases of the endometrium, such as endometrial hyperplasia and endometrial cancer. The prevalence rates of these disease entities continue to grow every year representing a “specular reflection” of global unfavorable changes/trends. The paper is aimed to assess current epidemiological situation for obesity and proliferative diseases of the endometrium, disclose the key pathogenetic links of those, and cover modern management of these disease entities involving the use of unique, innovative, complex solutions, including pharmacological ones.
Keywords: obesity, overweight, endometrial cancer, endometrial hyperplasia, tirzepatide, glucagon-like peptide-1 receptor agonist, glucose-dependent insulinotropic polypeptide.
For citation: Orazov M.R., Radzinsky V.E., Balan V.E., Mikhaleva L.M., Dolgov E.D. Tirzepatide in the practice of obstetrician/gynecologist. Clinical review for general practice. 2025; 6 (9): 68–74 (In Russ.). DOI: 10.47407/kr2025.6.9.00675
Ожирение в XXI в.: тяжелые реалии, лишенные перспектив
Художники выбирали человеческое тело в качестве объекта внимания с доисторических времен. До сих пор не утихают споры вокруг таинственной Венеры Виллендорфской – статуэтки, символизирующей плодородие и защиту от вымирания, возраст которой, по оценкам археологов, составляет более 30 тыс. лет. Статуэтка Венеры Виллендорфской – фигурка (найденная в 1908 г. в
Австрии), высеченная из известняка, изображающая коренастую женщину с большой грудью, свисающим животом, крупными бедрами и ягодицами. Затем в свет вышли великие работы «Брак в Кане», «Портрет Маддалены Дони» и знаменитые «Рубенсовские женщины» – десятки картин, посвященных пышнотелым красавицам. Однако былое понимание эстетики не соответствовало полноценному и правильному пониманию женского здоровья, что и продемонстрировала медицинская наука еще в XIX столетии. Уже начиная с того времени, люди понимали, что есть «болезни богачей» (ожирение, подагра и др.), являющиеся своего рода расплатой за избыточное потребление пищи и разгульный образ жизни. И именно с того момента людям стало понятно, что лишний вес – это не дань эстетике своего времени, это «балласт», символизирующий системное «нездоровье».
А что в рутинных реалиях сегодняшнего дня? Как часто клиницист в течение своего рабочего дня наблюдает соматически здоровых пациенток, пришедших исключительно с целью скринингового обследования, предписанного действующими стандартами акушерско-гинекологической помощи? К сожалению, ответ на этот риторический вопрос очень сложный, поскольку нам все еще трудно осознать, что в течение дня мы можем встретить лишь одну женщину, не имеющую коморбидного фона и перенесенных или имеющихся в данный момент хронических соматических нозологий, либо не встретить ее вовсе. Таковы реалии современного мира, с которыми нам, увы, приходится мириться. Представим ситуацию, в которой на прием к клиницисту приходит пациентка в возрасте 25 лет с целью планового (скринингового) обследования без хронических (в том числе гинекологических) заболеваний и отягощенного анамнеза. Но есть одно большое но – индекс массы тела (ИМТ) этой пациентки составляет 28 кг/м2. И теперь необходимо задаться вопросом: здорова ли она? Безусловно, данная цифра не укладывается в критерии ожирения, а соответствует лишь избыточной массе тела, но легче от этого не становится, поскольку как избыточная масса тела, так и ожирение являются фундаментом реализации ряда полисистемных нозологий.
И несмотря на то, что современное понимание «здоровья» человеческого организма с течением времени неизбежно «размывается» и для многих соответствует лишь отсутствию «видимых» болезней, клиницист обязан быть бдительным и реагировать на выявленные отклонения незамедлительно.
В настоящее время, согласно определению Всемирной организации здравоохранения, ожирение дефинируется как хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющим угрозу здоровью, и являющееся основным фактором риска ряда других хронических заболеваний, включая сахарный диабет 2-го типа (СД 2) и сердечно-сосудистые заболевания [1]. Таким образом, ожирение не является «классической» болезнью, а представляет собой «патогенетический фундамент» для полисистемного нозологического «небоскреба». При этом «проблемой в квадрате» остается поразительная распространенность ожирения в мире, которое, как бы не было удивительно, только растет. Мы наблюдаем парадоксальную вовлеченность мирового медицинского сообщества в решение ряда «пандемийных» проблем, включая ожирение, однако все усилия и огромное количество финансов, вложенных в решение данной проблемы, не привели ни к чему. По последним данным (2025 г.), 43% взрослых людей по всему миру имеют избыточную массу тела и 16% – ожирение [2]. При этом наиболее парадоксальным является «эпидемиологический всплеск» ожирения, который произошел в период с 1990 по 2022 г., в ходе которого его распространенность увеличилась более чем в 2 раза, а среди детей и подростков – в 4 раза [3, 4]! И данная тенденция не смогла не повлиять на общую заболеваемость женщин, в особенности онкологическими нозологиями. Согласно статистическим данным США, только с 2024 по 2025 г. произошло значимое увеличение заболеваемости и смертности женщин от всех онкологических заболеваний в стране: на 16,5 тыс. и 5,3 тыс. случаев. При этом та же динамика отмечается и в случае злокачественных новообразований органов (ЗНО) репродуктивной системы, однако наиболее значимый прирост отмечался у рака эндометрия: +1,3 тыс. случаев и +600 случаев соответственно [5, 6]. В настоящее время доказана прочная ассоциация между избыточной массой тела/ожирением и рисками реализации ряда онкологических заболеваний – от рака эндометрия (наиболее значимо) до множественной миеломы (табл. 1) [7].

Таким образом, важно отметить, что ожирение является одним из главных факторов повышения заболеваемости и смертности от ряда полисистемных нозологий (особенно онкологических). В этой связи необходимо рассмотреть взаимосвязь между избыточной массой тела/ожирением и пролиферативными болезнями эндометрия как c наиболее прочно ассоциированными с ними заболеваниями.
Пролиферативные болезни эндометрия на фоне пандемии ожирения
Относительно недавно (в 2020 г.) в мире произошло значимое и, с одной стороны, революционное событие – знаменитый переход рака эндометрия на 2-е место в структуре заболеваемости и 3-е место в структуре смертности от ЗНО органов репродуктивной системы [8]. Революционность этого события прежде всего связана с долгим «господством» рака шейки матки в данной позиции, однако мировая пандемия ожирения внесла свои коррективы. Результаты недавнего исследования J. Heo и соавт. (2025), включавшего 935 600 женщин, в очередной раз подтвердили значимое влияние ожирения на риск реализации эндометриального рака (повышение риска как минимум в 2 раза!), при этом абдоминальное ожирение независимо от показателя ИМТ также повышает риск, но уже в 2–4 раза [9]. Также важно отметить данные, полученные испанскими коллегами (2025), проанализировавшими 198 710 случаев госпитализации по поводу рака эндометрия. Было доказано, что ровно 1/3 пациенток данной когорты (33,9%) имела верифицированное ожирение и 18% из них – ожирение 3-й степени [10]. В настоящее время не оставляет сомнений негативное влияние каждого «лишнего килограмма» на риск реализации эндометриального рака: согласно имеющимся данным, повышение ИМТ на
5 кг/м2 повышает риск на 54% [11].
В подтверждение отмеченных выше тезисов важно упомянуть результаты недавнего исследования Z. Li и соавт. (2025), доказавших, что наиболее значимыми факторами риска эндометриальной гиперпролиферации являются [12]:
• высокий показатель ИМТ (избыточная масса тела или ожирение) – 1-е место;
• раннее менархе;
• синдром поликистозных яичников;
• СД.
Однако полученные данные не отменяют «классического трио» (триада Бохмана), провоцирующего развитие гиперплазии и рака эндометрия, которое позволяет стратифицировать пациентку в группу риска с «порога медицинского кабинета» (академик В.Е. Радзинский): ожирение, СД и артериальная гипертензия, совместно кратно повышающие риски развития эндометриальной гиперпролиферации. Доказано, что только сочетание ожирения и СД потенцирует риск рака эндометрия на 72% [13]!
Исходя из сказанного, важно отметить, что рак эндометрия на современном этапе является предотвратимой проблемой с тяжелыми последствиями. Именно поэтому основная причина манифестации эндометриального канцера сегодня – это сочетание двух главных факторов: недооценки своего состояния самой женщиной и несвоевременное оказание медицинской помощи клиницистом. В идеалистичной «картине мира» стратификация пациентки в группу риска по раку эндометрия и его профилактика должны проходить еще «на пороге» медицинского кабинета (как только мы визуально определили наличие избыточной массы тела), однако на практике так происходит далеко не всегда. Чаще всего к клиницисту обращается тучная пациентка с жалобами на аномальные маточные кровотечения, и проводимый диагностический поиск приводит нас к очевидно вероятному диагнозу – гиперплазии эндометрия, являющейся переходным «мостом» к эндометриальному раку. Согласно классическому определению, гиперплазия эндометрия – это патологическое состояние, характеризующееся утолщением эндометрия вследствие избыточной клеточной пролиферации и нарушения соотношения между железами и стромой эндометрия, при этом в настоящее время выделяют гиперплазию эндометрия без атипии (с наиболее благоприятным течением, невысоким риском малигнизации и пулом возможностей для консервативного лечения) и атипичную форму заболевания (с высоким риском малигнизации и предпочтительным хирургическим радикальным лечением) [14, 15]. По последним оценкам, распространенность гиперплазии эндометрия с атипией составляет 16,8 случая, а для неатипичной формы заболевания – 121 случай на 100 тыс. женщин [16]. Таким образом, наиболее актуальной с точки зрения распространенности и возможности использования консервативных стратегий является гиперплазия эндометрия без атипии, однако у обеих форм заболевания (наряду с раком эндометрия) отмечаются схожие патогенетические механизмы, ассоциированные с наличием избыточной массой тела и ожирением, к которым относятся:
• хроническое латентное генерализованное воспаление. Доказано, что аномальный иммунный ответ, дисбаланс цитокинов и факторов роста способствуют избыточной пролиферации (в том числе и эндометрия) [17];
• инсулинорезистентность и гиперинсулинемия. Доказано, что данные факторы индуцируют гиперэкспрессию провоспалительных цитокинов и факторов роста (в частности, инсулиноподобного фактора роста) [18, 19];
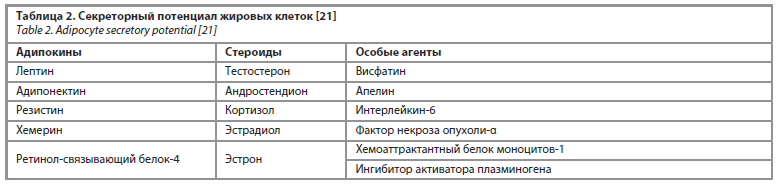
• гормональная дисрегуляция. Доказано, что у пациенток с ожирением адипоциты приобретают секреторно-активный фенотип. В настоящее время известно, что адипоциты секретируют ряд биологически-активных молекул, одними из которых являются эстрогены (табл. 2). Избыточный внегонадный синтез эстрогенов адипоцитами приводит к избыточной и неконтролируемой пролиферации эндометриального компартмента, провоцируя развитие гиперплазии и впоследствии рака эндометрия [20, 21];
• нарушение кишечного микробиома. Доказано, что дисбиоз кишечной микробиоты может приводить к аномальной активности β-глюкуронидазы, деконъюгирующей эстрогены и повышающей их всасывание в крови и системное взаимодействие с ER-рецепторами. Подобные изменения также могут быть причиной системной гиперэстрогении и провоцируют развитие эндометриальной гиперпролиферации [22].
Таким образом, патогенетическая связь между ожирением и гиперплазией эндометрия является мультифакториальной, однако единым и нерушимым остается одно – ожирение остается первопричиной эндометриальной гиперпролиферации у данной когорты пациенток. При этом клиницисту принципиально важно понимать, что гиперплазия эндометрия – это промежуточное состояние (а у пациенток с канцерогенными рисками – премалигнантной), которое необходимо лечить «здесь и сейчас», и кроме лечения самого «морфологического субстрата» (в частности, с использованием гормонотерапии) необходимо купировать первопричину для предотвращения дальнейших рецидивов и нивелирования риска реализации эндометриального рака.
В этой связи терапия эндометриальной гиперплазии у данной группы пациенток должна быть комплексной:
• достижение морфологического регресса гиперплазии эндометрия на фоне гормонотерапии с использованием гестагенов (в случае гиперплазии эндометрия без атипии) или радикальное оперативное лечение (в случае атипичной гиперплазии эндометрия);
• эффективное лечение ожирения и поддержание достигнутого результата с целью долгосрочной поддержки качества жизни женщины и снижения канцерогенных рисков.
Современные терапевтические стратегии лечения гиперплазии эндометрия без атипии, согласно отечественным и международным рекомендациям, подразумевают использование левоноргестрел-высвобождающей внутриматочной системы (ЛНГ-ВМС) в качестве терапии 1-й линии, поскольку данная терапия приводит к морфологическому регрессу гиперплазии эндометрия без атипии у абсолютного большинства женщин [15, 23]. Пациенткам, отказавшимся от использования ЛНГ-ВМС или имеющим противопоказания к ее использованию, должна быть предложена терапия пероральными гестагенами (например, норэтистерона ацетат – единственный гестаген с зарегистрированным показанием к лечению гиперплазии эндометрия), эффективность которой несколько ниже. При этом клиницист обязан оценивать эффективность назначенного лечения в динамике через 6 мес от начала терапии
(в случае отсутствия морфологического регресса может быть назначен повторный курс лечения гестагенами).
В случае атипичной формы гиперплазии эндометрия наиболее предпочтительной является радикальная хирургическая тактика лечения, однако женщинам, желающим реализовать репродуктивную функцию, может быть назначена консервативная терапия после консультации с онкологом. При этом в случае отсутствия позитивной динамики спустя 6 мес от начала терапии также необходимо рассмотреть возможность хирургического лечения.
Параллельно с терапией гиперплазии эндометрия клиницист обязан приступить к эффективному лечению ожирения. Принципиально важно помнить, что комплексное лечение ожирения (в том числе фармакотерапия) не является изолированной прерогативой эндокринолога, поскольку действующие отечественные рекомендации (2024 г.) адресованы клиницистам 11 специальностей, включая акушеров-гинекологов (Приложение А2) [24].
Вместе с тем, согласно данному протоколу, в основе лечения ожирения по-прежнему лежит модификация образа жизни, подразумевающая сбалансированное питание с ограничением калоража (на 500–700 ккал) и адекватной физической активностью (сочетание аэробных нагрузок 150 мин в неделю с анаэробными/силовыми тренировками). В случае неэффективности модификации образа жизни пациентке с ИМТ≥30 кг/м2 или при ИМТ≥27 кг/м2 при наличии факторов риска и/или коморбидных заболеваний будет показана вес-редуцирующая фармакотерапия. Классическим арсеналом фармакотерапии ожирения на сегодняшний день являются хорошо зарекомендовавшие себя орлистат, сибутрамин (в том числе в сочетании с метформином), лираглутид и семаглутид [24]. Однако недавно во всем мире в целом и в Российской Федерации в частности произошла настоящая революция в лекарственной терапии ожирения – в рутинную клиническую практику вошел уникальный препарат под названием тирзепатид (Тирзетта), ключевые особенности которого мы отметили ниже.
Тирзепатид: вчера, сегодня, завтра
Тирзепатид – это инновационный двойной агонист рецепторов глюкагоноподобного пептида-1 (аГПП-1) и глюкозозависимого инсулинотропного полипептида (GIP). Впервые данный препарат был одобрен FDA в США в 2022 г. для лечения СД 2. Биохимическая структура тирзепатида представлена линейной пептидной молекулой, состоящей из 39 аминокислот и «упакованной» в сложную структуру за счет конъюгации с фрагментной жирной кислотой [25, 26]. Данные особенности тирзепатида обусловливают его уникальный фармакокинетический профиль [27–29]:
• обратимое нековалентное связывание с альбуминами крови;
• постепенное достижение максимальной концентрации в крови (через 1–2 сут);
• длительный период полувыведения (116,7 ч).
Столь уникальный фармакокинетический профиль позволяет достичь максимальной комплаентности у пациенток, поскольку режим использования «1 раз в неделю» не вызывает психологического дискомфорта и не формирует негативные установки при использовании фармакотерапии.
Вместе с тем тирзепатид также обладает и уникальным механизмом действия. Еще совсем недавно мир потрясли инновационные решения в терапии СД 2 и ожирения в виде изолированных аГПП-1 (семаглутид и лираглутид), однако уже сегодня появилось еще более уникальное решение, обладающее дополнительной агонистической активностью к рецепторам глюкозозависимого инсулинотропного полипептида в жировой ткани и головном мозге. Двойная агонистическая активность тирзепатида позволяет не только подавлять моторику желудка и снижать аппетит, но и значимо
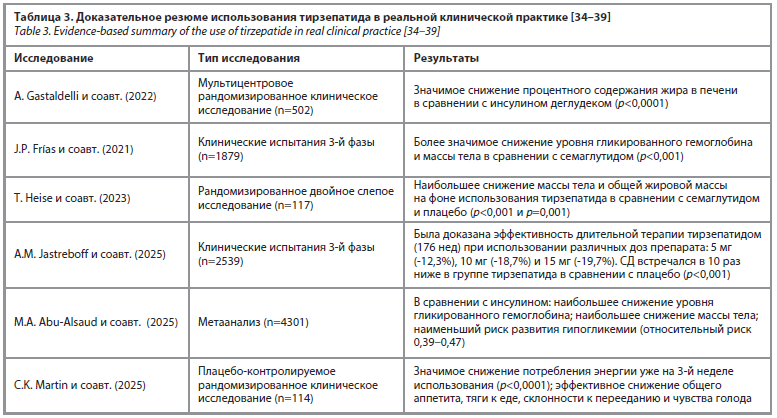
повышать чувствительность тканей к инсулину и стимулировать его секрецию [30, 31]. Исходя из всех отмеченных характеристик тирзепатида, Американская диабетическая ассоциация (ADA) характеризует его как один из наиболее эффективных препаратов для нормализации гликемического профиля и снижения массы тела (эффект более выражен, чем у изолированных аГПП-1 – семаглутида и лираглутида) [32, 33]. В этой связи важно отметить результаты использования тирзепатида в реальной клинической практике в формате «доказательного резюме» (табл. 3).
Таким образом, важно резюмировать, что тирзепатид является эффективной и безопасной терапией ожирения и нарушений углеводного обмена. Данные свойства позволяют использовать тирзепатид у пациенток с эндометриальной гиперплазией на фоне ожирения (в сочетании с основной гестагенотерапией!), что позволит не только предотвратить рецидивы заболевания, но и злокачественную гиперпролиферацию в дальнейшем. В этой связи мы представляем реальный «клинический кейс» использования тирзепатида в комплексной терапии гиперплазии эндометрия у пациентки, обратившейся за помощью к акушеру-гинекологу.
Клинический случай
На прием к акушеру-гинекологу обратилась пациентка 25 лет с жалобами на повторные эпизоды аномальных маточных кровотечений (АМК).
Семейный анамнез: мать страдает СД 2 и ожирением, в 36 лет была проведена гистерэктомия по поводу рака эндометрия.
Анамнез заболевания: 5 лет назад у пациентки отмечался эпизод АМК. В ходе морфологического исследования биоптата эндометрия была верифицирована гиперплазия эндометрия без атипии, по поводу чего был проведен курс гормональной терапии норэтистерона ацетатом (достигнут полный морфологический регресс). Спустя 3 года у пациентки отмечался повторный эпизод АМК, причиной которого стал рецидив гиперплазии эндометрия без атипии, по поводу которого также проводилась гормонотерапия другой группой гестагенов, без морфологического контроля за состоянием эндометрия. За последние 2 года 4-й эпизод АМК.
Страдает ожирением в течение последних 6 лет (несколько лет назад использовала сибутрамин с целью снижения массы тела – без значимого результата).
Исходя из данных анамнеза, основной причиной рецидивирующего течения эндометриальной гиперплазии послужило именно ожирение. Известен постулат о том, что несмотря на более высокую эффективность ЛНГ-ВМС в сравнении с пероральными гестагенами после отмены 6-месячного курса терапии частота рецидивов в обеих группах через 2 года достигает до 40%. Рецидивы значительной эндометриальной гиперплазии чаще возникают у пациенток с ИМТ≥35 кг/м2.
Гинекологический анамнез: менархе в 12 лет, менструальный цикл регулярный, без особенностей.
Объективно: верифицируется абдоминальное ожирение (окружность талии – 94 см). ИМТ=36,2 кг/м2.
Пациентке был назначен план лабораторного и инструментального (сонографическое исследование органов малого таза) обследования.
Особенности лабораторного обследования: отмечается снижение гемоглобина до 101 г/л, снижение уровня ферритина до 10 мкг/л.
Особенности инструментального обследования: по данным эхографии отмечается диффузное утолщение эндометрия до 24 мм, структура эндометрия неоднородна.
По ургентным показаниям пациентка была направлена на гистероскопическое исследование с целью проведения мультифокальной биопсии эндометрия для морфологической оценки образцов эндометрия.
Патоморфологическое заключение: гиперплазия эндометрия без атипии.
После получения результатов патоморфологического исследования нами был сформирован заключительный диагноз.
Основной диагноз: железистая гиперплазия эндометрия без атипии – рецидив (N85.0).
Осложнение основного диагноза: другие уточненные аномальные кровотечения из матки (N93.8).
Сопутствующий диагноз: железодефицитная анемия легкой степени тяжести (D50.0), ожирение 2-й степени (E66.0).
Пациентке была назначена патогенетическая гормональная терапия гиперплазии эндометрия с использованием ЛНГ-ВМС. Параллельно совместно с эндокринологом женщина была проконсультирована по вопросам модификации образа жизни и фармакотерапии с целью коррекции ожирения. Принимая во внимание рецидивирующее течение болезни и высокие канцерогенные риски эндометрия, пациентке был назначен тирзепатид (первый отечественный препарат Тирзетта) по схеме, согласно действующей инструкции к препарату (стартовая доза – 2,5 мг подкожно 1 раз в неделю и постепенное повышение дозы на 2,5 мг каждые 4 нед). Вместе с тем была назначена терапия железодефицитной анемии с использованием протеина сукцинилата железа (III) (Ферлатум фол) по схеме, согласно инструкции к препарату.
Принимая во внимание исходно высокие канцерогенные риски и рецидивирующее течение болезни, было принято решение о необходимости первой контрольной биопсии эндометрия спустя 3 мес на фоне
ЛНГ-ВМС: зафиксирован полный морфологический регресс эндометриальной гиперплазии по данным гистологического исследования. В ходе использования препарата Тирзетта совместно с коррекцией образа жизни у пациентки отмечалось значимое снижение массы тела на 15%, с позитивной динамикой терапия была продолжена в дозе 10 мг с последующей титрацией согласно инструкции. Следует подчеркнуть, что на фоне использования отечественного препарата Тирзетта у пациентки не регистрировались значимые побочные эффекты, что свидетельствует о хорошей переносимости. Через 6 мес была проведена повторная пайпель-биопсия эндометрия – отмечался стойкий морфологический регресс гиперплазии эндометрия. В настоящее время на фоне патогенетически-обоснованной фармакотерапии ожирения пациентка достигла показателя ИМТ 26,4 кг/м2. Мониторинг за состоянием здоровья продолжается и в настоящее время.
Вместе с тем важно понимать, что рак эндометрия – это терминальное «состояние-упущение», связанное прежде всего с неэффективной диспансеризацией женщины и отсутствием стратификации женщин в группу риска по данной нозологии. Однако гиперплазия эндометрия – это промежуточное/премалигнантное состояние (у пациенток с исходно высокими канцерогенными рисками!), в рамках которого клиницист все еще обладает рядом консервативных методов коррекции и профилактики рецидивирования заболевания, способным нивелировать риски эндометриального канцера «здесь и сейчас». Безусловно, в основе лечения гиперплазии эндометрия, в частности неатипичной формы, лежит эффективная и патогенетически-направленная гормонотерапия с использованием гестагенов, но вместе с тем ни в коем случае нельзя забывать о метаболизм-модифицирующей коррекции ожирения.
Эффективная терапия ожирения – это основа предикции возврата гиперплазии эндометрия de novo в ближайшем и рака эндометрия в отдаленном будущем. При этом наиболее инновационным и эффективным фармакологическим методом коррекции ожирения на сегодняшний день является тирзепатид (первый отечественный препарат Тирзетта), обладающий разнонаправленным позитивным эффектом на метаболические показатели. Таким образом, в настоящее время мы обладаем безграничным потенциалом для фармакотерапии ожирения, который немаловажен для повседневной гинекологической практики.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, акад. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Балан Вера Ефимовна – д-р мед. наук, проф. каф. акушерства и гинекологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: balanmed@gmail.com; ORCID: 0000-0002-2364-6838
Vera E. Balan – Dr. Sci. (Med.), Prof.,Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: balanmed@gmail.com; ORCID: 0000-0002-2364-6838
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ
«НИИМЧ им. акад. А.П. Авцына». E-mail: mikhalevalm@yandex.ru; ORСID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Dir. Scientific Research Institute of Human Morphology named after academician A.P. Avtsyn.
E-mail: mikhalevalm@yandex.ru; ORСID: 0000-0003-2052-914X
Долгов Евгений Денисович – клин. ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Поступила в редакцию: 22.08.2025
Поступила после рецензирования: 28.08.2025
Принята к публикации: 04.09.2025
Received: 22.08.2025
Revised: 28.08.2025
Accepted: 04.09.2025
Клинический разбор в общей медицине №9 2025
Тирзепатид в практике акушера-гинеколога
Номера страниц в выпуске:68-74
Аннотация
Актуальность проблемы ожирения во всем мире ежегодно экспоненциально растет. Практически половина взрослого населения планеты страдает избыточной массой тела или ожирением. В настоящее время неоспоримым остается факт того, что ожирение – это фундамент для реализации ряда соматических полисистемных нозологий, в том числе гинекологических и канцерогенных. Наиболее прочной остается взаимосвязь между избыточной массой тела/ожирением и пролиферативными болезнями эндометрия, включая гиперплазию и рак эндометрия. Показатели распространенности данных нозологий с каждым годом продолжают расти, являясь «зеркальным отражением» общемировых неблагоприятных изменений/тенденций. Целью данной статьи является оценка современной эпидемиологической ситуации в отношении ожирения и пролиферативных болезней эндометрия, раскрытие их ключевых патогенетических взаимосвязей и освещение современного менеджмента данных нозологий с использованием уникальных инновационных, комплексных, в том числе и фармакологических решений.
Ключевые слова: ожирение, избыточная масса тела, рак эндометрия, гиперплазия эндометрия, тирзепатид, агонист рецепторов глюкагоноподобного пептида-1, глюкозозависимый инсулинотропный полипептид.
Для цитирования: Оразов М.Р., Радзинский В.Е., Балан В.Е., Михалева Л.М., Долгов Е.Д. Тирзепатид в практике акушера-гинеколога. Клинический разбор в общей медицине. 2025; 6 (9): 68–74. DOI: 10.47407/kr2025.6.9.00675
Актуальность проблемы ожирения во всем мире ежегодно экспоненциально растет. Практически половина взрослого населения планеты страдает избыточной массой тела или ожирением. В настоящее время неоспоримым остается факт того, что ожирение – это фундамент для реализации ряда соматических полисистемных нозологий, в том числе гинекологических и канцерогенных. Наиболее прочной остается взаимосвязь между избыточной массой тела/ожирением и пролиферативными болезнями эндометрия, включая гиперплазию и рак эндометрия. Показатели распространенности данных нозологий с каждым годом продолжают расти, являясь «зеркальным отражением» общемировых неблагоприятных изменений/тенденций. Целью данной статьи является оценка современной эпидемиологической ситуации в отношении ожирения и пролиферативных болезней эндометрия, раскрытие их ключевых патогенетических взаимосвязей и освещение современного менеджмента данных нозологий с использованием уникальных инновационных, комплексных, в том числе и фармакологических решений.
Ключевые слова: ожирение, избыточная масса тела, рак эндометрия, гиперплазия эндометрия, тирзепатид, агонист рецепторов глюкагоноподобного пептида-1, глюкозозависимый инсулинотропный полипептид.
Для цитирования: Оразов М.Р., Радзинский В.Е., Балан В.Е., Михалева Л.М., Долгов Е.Д. Тирзепатид в практике акушера-гинеколога. Клинический разбор в общей медицине. 2025; 6 (9): 68–74. DOI: 10.47407/kr2025.6.9.00675
Tirzepatide in the practice of obstetrician/gynecologist
Mekan R. Orazov1, Viktor E. Radzinsky1, Vera E. Balan2, Lyudmila M. Mikhaleva3, Evgeny D. Dolgov11 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia;
3 Scientific Research Institute of Human Morphology named after academician A.P. Avtsyn Petrovsky Russian Scientific Center of Surgery, Moscow, Russia
omekan@mail.ru
Abstract
The relevance of the problem of obesity grows exponentially every year all over the world. Almost a half of the global adult population suffers from overweight or obesity. Today, the fact remains indisputable that obesity provides the basis for realization of a number of somatic polysystemic disease entities, including gynecological and carcinogenic ones. At the same time, the most strong is the correlation between overweight/obesity and proliferative diseases of the endometrium, such as endometrial hyperplasia and endometrial cancer. The prevalence rates of these disease entities continue to grow every year representing a “specular reflection” of global unfavorable changes/trends. The paper is aimed to assess current epidemiological situation for obesity and proliferative diseases of the endometrium, disclose the key pathogenetic links of those, and cover modern management of these disease entities involving the use of unique, innovative, complex solutions, including pharmacological ones.
Keywords: obesity, overweight, endometrial cancer, endometrial hyperplasia, tirzepatide, glucagon-like peptide-1 receptor agonist, glucose-dependent insulinotropic polypeptide.
For citation: Orazov M.R., Radzinsky V.E., Balan V.E., Mikhaleva L.M., Dolgov E.D. Tirzepatide in the practice of obstetrician/gynecologist. Clinical review for general practice. 2025; 6 (9): 68–74 (In Russ.). DOI: 10.47407/kr2025.6.9.00675
Ожирение в XXI в.: тяжелые реалии, лишенные перспектив
Художники выбирали человеческое тело в качестве объекта внимания с доисторических времен. До сих пор не утихают споры вокруг таинственной Венеры Виллендорфской – статуэтки, символизирующей плодородие и защиту от вымирания, возраст которой, по оценкам археологов, составляет более 30 тыс. лет. Статуэтка Венеры Виллендорфской – фигурка (найденная в 1908 г. в
Австрии), высеченная из известняка, изображающая коренастую женщину с большой грудью, свисающим животом, крупными бедрами и ягодицами. Затем в свет вышли великие работы «Брак в Кане», «Портрет Маддалены Дони» и знаменитые «Рубенсовские женщины» – десятки картин, посвященных пышнотелым красавицам. Однако былое понимание эстетики не соответствовало полноценному и правильному пониманию женского здоровья, что и продемонстрировала медицинская наука еще в XIX столетии. Уже начиная с того времени, люди понимали, что есть «болезни богачей» (ожирение, подагра и др.), являющиеся своего рода расплатой за избыточное потребление пищи и разгульный образ жизни. И именно с того момента людям стало понятно, что лишний вес – это не дань эстетике своего времени, это «балласт», символизирующий системное «нездоровье».
А что в рутинных реалиях сегодняшнего дня? Как часто клиницист в течение своего рабочего дня наблюдает соматически здоровых пациенток, пришедших исключительно с целью скринингового обследования, предписанного действующими стандартами акушерско-гинекологической помощи? К сожалению, ответ на этот риторический вопрос очень сложный, поскольку нам все еще трудно осознать, что в течение дня мы можем встретить лишь одну женщину, не имеющую коморбидного фона и перенесенных или имеющихся в данный момент хронических соматических нозологий, либо не встретить ее вовсе. Таковы реалии современного мира, с которыми нам, увы, приходится мириться. Представим ситуацию, в которой на прием к клиницисту приходит пациентка в возрасте 25 лет с целью планового (скринингового) обследования без хронических (в том числе гинекологических) заболеваний и отягощенного анамнеза. Но есть одно большое но – индекс массы тела (ИМТ) этой пациентки составляет 28 кг/м2. И теперь необходимо задаться вопросом: здорова ли она? Безусловно, данная цифра не укладывается в критерии ожирения, а соответствует лишь избыточной массе тела, но легче от этого не становится, поскольку как избыточная масса тела, так и ожирение являются фундаментом реализации ряда полисистемных нозологий.
И несмотря на то, что современное понимание «здоровья» человеческого организма с течением времени неизбежно «размывается» и для многих соответствует лишь отсутствию «видимых» болезней, клиницист обязан быть бдительным и реагировать на выявленные отклонения незамедлительно.
В настоящее время, согласно определению Всемирной организации здравоохранения, ожирение дефинируется как хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющим угрозу здоровью, и являющееся основным фактором риска ряда других хронических заболеваний, включая сахарный диабет 2-го типа (СД 2) и сердечно-сосудистые заболевания [1]. Таким образом, ожирение не является «классической» болезнью, а представляет собой «патогенетический фундамент» для полисистемного нозологического «небоскреба». При этом «проблемой в квадрате» остается поразительная распространенность ожирения в мире, которое, как бы не было удивительно, только растет. Мы наблюдаем парадоксальную вовлеченность мирового медицинского сообщества в решение ряда «пандемийных» проблем, включая ожирение, однако все усилия и огромное количество финансов, вложенных в решение данной проблемы, не привели ни к чему. По последним данным (2025 г.), 43% взрослых людей по всему миру имеют избыточную массу тела и 16% – ожирение [2]. При этом наиболее парадоксальным является «эпидемиологический всплеск» ожирения, который произошел в период с 1990 по 2022 г., в ходе которого его распространенность увеличилась более чем в 2 раза, а среди детей и подростков – в 4 раза [3, 4]! И данная тенденция не смогла не повлиять на общую заболеваемость женщин, в особенности онкологическими нозологиями. Согласно статистическим данным США, только с 2024 по 2025 г. произошло значимое увеличение заболеваемости и смертности женщин от всех онкологических заболеваний в стране: на 16,5 тыс. и 5,3 тыс. случаев. При этом та же динамика отмечается и в случае злокачественных новообразований органов (ЗНО) репродуктивной системы, однако наиболее значимый прирост отмечался у рака эндометрия: +1,3 тыс. случаев и +600 случаев соответственно [5, 6]. В настоящее время доказана прочная ассоциация между избыточной массой тела/ожирением и рисками реализации ряда онкологических заболеваний – от рака эндометрия (наиболее значимо) до множественной миеломы (табл. 1) [7].

Таким образом, важно отметить, что ожирение является одним из главных факторов повышения заболеваемости и смертности от ряда полисистемных нозологий (особенно онкологических). В этой связи необходимо рассмотреть взаимосвязь между избыточной массой тела/ожирением и пролиферативными болезнями эндометрия как c наиболее прочно ассоциированными с ними заболеваниями.
Пролиферативные болезни эндометрия на фоне пандемии ожирения
Относительно недавно (в 2020 г.) в мире произошло значимое и, с одной стороны, революционное событие – знаменитый переход рака эндометрия на 2-е место в структуре заболеваемости и 3-е место в структуре смертности от ЗНО органов репродуктивной системы [8]. Революционность этого события прежде всего связана с долгим «господством» рака шейки матки в данной позиции, однако мировая пандемия ожирения внесла свои коррективы. Результаты недавнего исследования J. Heo и соавт. (2025), включавшего 935 600 женщин, в очередной раз подтвердили значимое влияние ожирения на риск реализации эндометриального рака (повышение риска как минимум в 2 раза!), при этом абдоминальное ожирение независимо от показателя ИМТ также повышает риск, но уже в 2–4 раза [9]. Также важно отметить данные, полученные испанскими коллегами (2025), проанализировавшими 198 710 случаев госпитализации по поводу рака эндометрия. Было доказано, что ровно 1/3 пациенток данной когорты (33,9%) имела верифицированное ожирение и 18% из них – ожирение 3-й степени [10]. В настоящее время не оставляет сомнений негативное влияние каждого «лишнего килограмма» на риск реализации эндометриального рака: согласно имеющимся данным, повышение ИМТ на
5 кг/м2 повышает риск на 54% [11].
В подтверждение отмеченных выше тезисов важно упомянуть результаты недавнего исследования Z. Li и соавт. (2025), доказавших, что наиболее значимыми факторами риска эндометриальной гиперпролиферации являются [12]:
• высокий показатель ИМТ (избыточная масса тела или ожирение) – 1-е место;
• раннее менархе;
• синдром поликистозных яичников;
• СД.
Однако полученные данные не отменяют «классического трио» (триада Бохмана), провоцирующего развитие гиперплазии и рака эндометрия, которое позволяет стратифицировать пациентку в группу риска с «порога медицинского кабинета» (академик В.Е. Радзинский): ожирение, СД и артериальная гипертензия, совместно кратно повышающие риски развития эндометриальной гиперпролиферации. Доказано, что только сочетание ожирения и СД потенцирует риск рака эндометрия на 72% [13]!
Исходя из сказанного, важно отметить, что рак эндометрия на современном этапе является предотвратимой проблемой с тяжелыми последствиями. Именно поэтому основная причина манифестации эндометриального канцера сегодня – это сочетание двух главных факторов: недооценки своего состояния самой женщиной и несвоевременное оказание медицинской помощи клиницистом. В идеалистичной «картине мира» стратификация пациентки в группу риска по раку эндометрия и его профилактика должны проходить еще «на пороге» медицинского кабинета (как только мы визуально определили наличие избыточной массы тела), однако на практике так происходит далеко не всегда. Чаще всего к клиницисту обращается тучная пациентка с жалобами на аномальные маточные кровотечения, и проводимый диагностический поиск приводит нас к очевидно вероятному диагнозу – гиперплазии эндометрия, являющейся переходным «мостом» к эндометриальному раку. Согласно классическому определению, гиперплазия эндометрия – это патологическое состояние, характеризующееся утолщением эндометрия вследствие избыточной клеточной пролиферации и нарушения соотношения между железами и стромой эндометрия, при этом в настоящее время выделяют гиперплазию эндометрия без атипии (с наиболее благоприятным течением, невысоким риском малигнизации и пулом возможностей для консервативного лечения) и атипичную форму заболевания (с высоким риском малигнизации и предпочтительным хирургическим радикальным лечением) [14, 15]. По последним оценкам, распространенность гиперплазии эндометрия с атипией составляет 16,8 случая, а для неатипичной формы заболевания – 121 случай на 100 тыс. женщин [16]. Таким образом, наиболее актуальной с точки зрения распространенности и возможности использования консервативных стратегий является гиперплазия эндометрия без атипии, однако у обеих форм заболевания (наряду с раком эндометрия) отмечаются схожие патогенетические механизмы, ассоциированные с наличием избыточной массой тела и ожирением, к которым относятся:
• хроническое латентное генерализованное воспаление. Доказано, что аномальный иммунный ответ, дисбаланс цитокинов и факторов роста способствуют избыточной пролиферации (в том числе и эндометрия) [17];
• инсулинорезистентность и гиперинсулинемия. Доказано, что данные факторы индуцируют гиперэкспрессию провоспалительных цитокинов и факторов роста (в частности, инсулиноподобного фактора роста) [18, 19];
• гормональная дисрегуляция. Доказано, что у пациенток с ожирением адипоциты приобретают секреторно-активный фенотип. В настоящее время известно, что адипоциты секретируют ряд биологически-активных молекул, одними из которых являются эстрогены (табл. 2). Избыточный внегонадный синтез эстрогенов адипоцитами приводит к избыточной и неконтролируемой пролиферации эндометриального компартмента, провоцируя развитие гиперплазии и впоследствии рака эндометрия [20, 21];

• нарушение кишечного микробиома. Доказано, что дисбиоз кишечной микробиоты может приводить к аномальной активности β-глюкуронидазы, деконъюгирующей эстрогены и повышающей их всасывание в крови и системное взаимодействие с ER-рецепторами. Подобные изменения также могут быть причиной системной гиперэстрогении и провоцируют развитие эндометриальной гиперпролиферации [22].
Таким образом, патогенетическая связь между ожирением и гиперплазией эндометрия является мультифакториальной, однако единым и нерушимым остается одно – ожирение остается первопричиной эндометриальной гиперпролиферации у данной когорты пациенток. При этом клиницисту принципиально важно понимать, что гиперплазия эндометрия – это промежуточное состояние (а у пациенток с канцерогенными рисками – премалигнантной), которое необходимо лечить «здесь и сейчас», и кроме лечения самого «морфологического субстрата» (в частности, с использованием гормонотерапии) необходимо купировать первопричину для предотвращения дальнейших рецидивов и нивелирования риска реализации эндометриального рака.
В этой связи терапия эндометриальной гиперплазии у данной группы пациенток должна быть комплексной:
• достижение морфологического регресса гиперплазии эндометрия на фоне гормонотерапии с использованием гестагенов (в случае гиперплазии эндометрия без атипии) или радикальное оперативное лечение (в случае атипичной гиперплазии эндометрия);
• эффективное лечение ожирения и поддержание достигнутого результата с целью долгосрочной поддержки качества жизни женщины и снижения канцерогенных рисков.
Современные терапевтические стратегии лечения гиперплазии эндометрия без атипии, согласно отечественным и международным рекомендациям, подразумевают использование левоноргестрел-высвобождающей внутриматочной системы (ЛНГ-ВМС) в качестве терапии 1-й линии, поскольку данная терапия приводит к морфологическому регрессу гиперплазии эндометрия без атипии у абсолютного большинства женщин [15, 23]. Пациенткам, отказавшимся от использования ЛНГ-ВМС или имеющим противопоказания к ее использованию, должна быть предложена терапия пероральными гестагенами (например, норэтистерона ацетат – единственный гестаген с зарегистрированным показанием к лечению гиперплазии эндометрия), эффективность которой несколько ниже. При этом клиницист обязан оценивать эффективность назначенного лечения в динамике через 6 мес от начала терапии
(в случае отсутствия морфологического регресса может быть назначен повторный курс лечения гестагенами).
В случае атипичной формы гиперплазии эндометрия наиболее предпочтительной является радикальная хирургическая тактика лечения, однако женщинам, желающим реализовать репродуктивную функцию, может быть назначена консервативная терапия после консультации с онкологом. При этом в случае отсутствия позитивной динамики спустя 6 мес от начала терапии также необходимо рассмотреть возможность хирургического лечения.
Параллельно с терапией гиперплазии эндометрия клиницист обязан приступить к эффективному лечению ожирения. Принципиально важно помнить, что комплексное лечение ожирения (в том числе фармакотерапия) не является изолированной прерогативой эндокринолога, поскольку действующие отечественные рекомендации (2024 г.) адресованы клиницистам 11 специальностей, включая акушеров-гинекологов (Приложение А2) [24].
Вместе с тем, согласно данному протоколу, в основе лечения ожирения по-прежнему лежит модификация образа жизни, подразумевающая сбалансированное питание с ограничением калоража (на 500–700 ккал) и адекватной физической активностью (сочетание аэробных нагрузок 150 мин в неделю с анаэробными/силовыми тренировками). В случае неэффективности модификации образа жизни пациентке с ИМТ≥30 кг/м2 или при ИМТ≥27 кг/м2 при наличии факторов риска и/или коморбидных заболеваний будет показана вес-редуцирующая фармакотерапия. Классическим арсеналом фармакотерапии ожирения на сегодняшний день являются хорошо зарекомендовавшие себя орлистат, сибутрамин (в том числе в сочетании с метформином), лираглутид и семаглутид [24]. Однако недавно во всем мире в целом и в Российской Федерации в частности произошла настоящая революция в лекарственной терапии ожирения – в рутинную клиническую практику вошел уникальный препарат под названием тирзепатид (Тирзетта), ключевые особенности которого мы отметили ниже.
Тирзепатид: вчера, сегодня, завтра
Тирзепатид – это инновационный двойной агонист рецепторов глюкагоноподобного пептида-1 (аГПП-1) и глюкозозависимого инсулинотропного полипептида (GIP). Впервые данный препарат был одобрен FDA в США в 2022 г. для лечения СД 2. Биохимическая структура тирзепатида представлена линейной пептидной молекулой, состоящей из 39 аминокислот и «упакованной» в сложную структуру за счет конъюгации с фрагментной жирной кислотой [25, 26]. Данные особенности тирзепатида обусловливают его уникальный фармакокинетический профиль [27–29]:
• обратимое нековалентное связывание с альбуминами крови;
• постепенное достижение максимальной концентрации в крови (через 1–2 сут);
• длительный период полувыведения (116,7 ч).
Столь уникальный фармакокинетический профиль позволяет достичь максимальной комплаентности у пациенток, поскольку режим использования «1 раз в неделю» не вызывает психологического дискомфорта и не формирует негативные установки при использовании фармакотерапии.
Вместе с тем тирзепатид также обладает и уникальным механизмом действия. Еще совсем недавно мир потрясли инновационные решения в терапии СД 2 и ожирения в виде изолированных аГПП-1 (семаглутид и лираглутид), однако уже сегодня появилось еще более уникальное решение, обладающее дополнительной агонистической активностью к рецепторам глюкозозависимого инсулинотропного полипептида в жировой ткани и головном мозге. Двойная агонистическая активность тирзепатида позволяет не только подавлять моторику желудка и снижать аппетит, но и значимо
повышать чувствительность тканей к инсулину и стимулировать его секрецию [30, 31]. Исходя из всех отмеченных характеристик тирзепатида, Американская диабетическая ассоциация (ADA) характеризует его как один из наиболее эффективных препаратов для нормализации гликемического профиля и снижения массы тела (эффект более выражен, чем у изолированных аГПП-1 – семаглутида и лираглутида) [32, 33]. В этой связи важно отметить результаты использования тирзепатида в реальной клинической практике в формате «доказательного резюме» (табл. 3).

Таким образом, важно резюмировать, что тирзепатид является эффективной и безопасной терапией ожирения и нарушений углеводного обмена. Данные свойства позволяют использовать тирзепатид у пациенток с эндометриальной гиперплазией на фоне ожирения (в сочетании с основной гестагенотерапией!), что позволит не только предотвратить рецидивы заболевания, но и злокачественную гиперпролиферацию в дальнейшем. В этой связи мы представляем реальный «клинический кейс» использования тирзепатида в комплексной терапии гиперплазии эндометрия у пациентки, обратившейся за помощью к акушеру-гинекологу.
Клинический случай
На прием к акушеру-гинекологу обратилась пациентка 25 лет с жалобами на повторные эпизоды аномальных маточных кровотечений (АМК).
Семейный анамнез: мать страдает СД 2 и ожирением, в 36 лет была проведена гистерэктомия по поводу рака эндометрия.
Анамнез заболевания: 5 лет назад у пациентки отмечался эпизод АМК. В ходе морфологического исследования биоптата эндометрия была верифицирована гиперплазия эндометрия без атипии, по поводу чего был проведен курс гормональной терапии норэтистерона ацетатом (достигнут полный морфологический регресс). Спустя 3 года у пациентки отмечался повторный эпизод АМК, причиной которого стал рецидив гиперплазии эндометрия без атипии, по поводу которого также проводилась гормонотерапия другой группой гестагенов, без морфологического контроля за состоянием эндометрия. За последние 2 года 4-й эпизод АМК.
Страдает ожирением в течение последних 6 лет (несколько лет назад использовала сибутрамин с целью снижения массы тела – без значимого результата).
Исходя из данных анамнеза, основной причиной рецидивирующего течения эндометриальной гиперплазии послужило именно ожирение. Известен постулат о том, что несмотря на более высокую эффективность ЛНГ-ВМС в сравнении с пероральными гестагенами после отмены 6-месячного курса терапии частота рецидивов в обеих группах через 2 года достигает до 40%. Рецидивы значительной эндометриальной гиперплазии чаще возникают у пациенток с ИМТ≥35 кг/м2.
Гинекологический анамнез: менархе в 12 лет, менструальный цикл регулярный, без особенностей.
Объективно: верифицируется абдоминальное ожирение (окружность талии – 94 см). ИМТ=36,2 кг/м2.
Пациентке был назначен план лабораторного и инструментального (сонографическое исследование органов малого таза) обследования.
Особенности лабораторного обследования: отмечается снижение гемоглобина до 101 г/л, снижение уровня ферритина до 10 мкг/л.
Особенности инструментального обследования: по данным эхографии отмечается диффузное утолщение эндометрия до 24 мм, структура эндометрия неоднородна.
По ургентным показаниям пациентка была направлена на гистероскопическое исследование с целью проведения мультифокальной биопсии эндометрия для морфологической оценки образцов эндометрия.
Патоморфологическое заключение: гиперплазия эндометрия без атипии.
После получения результатов патоморфологического исследования нами был сформирован заключительный диагноз.
Основной диагноз: железистая гиперплазия эндометрия без атипии – рецидив (N85.0).
Осложнение основного диагноза: другие уточненные аномальные кровотечения из матки (N93.8).
Сопутствующий диагноз: железодефицитная анемия легкой степени тяжести (D50.0), ожирение 2-й степени (E66.0).
Пациентке была назначена патогенетическая гормональная терапия гиперплазии эндометрия с использованием ЛНГ-ВМС. Параллельно совместно с эндокринологом женщина была проконсультирована по вопросам модификации образа жизни и фармакотерапии с целью коррекции ожирения. Принимая во внимание рецидивирующее течение болезни и высокие канцерогенные риски эндометрия, пациентке был назначен тирзепатид (первый отечественный препарат Тирзетта) по схеме, согласно действующей инструкции к препарату (стартовая доза – 2,5 мг подкожно 1 раз в неделю и постепенное повышение дозы на 2,5 мг каждые 4 нед). Вместе с тем была назначена терапия железодефицитной анемии с использованием протеина сукцинилата железа (III) (Ферлатум фол) по схеме, согласно инструкции к препарату.
Принимая во внимание исходно высокие канцерогенные риски и рецидивирующее течение болезни, было принято решение о необходимости первой контрольной биопсии эндометрия спустя 3 мес на фоне
ЛНГ-ВМС: зафиксирован полный морфологический регресс эндометриальной гиперплазии по данным гистологического исследования. В ходе использования препарата Тирзетта совместно с коррекцией образа жизни у пациентки отмечалось значимое снижение массы тела на 15%, с позитивной динамикой терапия была продолжена в дозе 10 мг с последующей титрацией согласно инструкции. Следует подчеркнуть, что на фоне использования отечественного препарата Тирзетта у пациентки не регистрировались значимые побочные эффекты, что свидетельствует о хорошей переносимости. Через 6 мес была проведена повторная пайпель-биопсия эндометрия – отмечался стойкий морфологический регресс гиперплазии эндометрия. В настоящее время на фоне патогенетически-обоснованной фармакотерапии ожирения пациентка достигла показателя ИМТ 26,4 кг/м2. Мониторинг за состоянием здоровья продолжается и в настоящее время.
Заключение
Исходя из всего сказанного, важно резюмировать, что ожирение по-прежнему остается нерешенной проблемой пандемийного характера. В настоящее время доказано, что как избыточная масса тела, так и ожирение являются базисом для реализации полисистемной соматической заболеваемости, в том числе гинекологической и канцерогенной. Без всякого сомнения, остается доказанным факт, что ожирение наряду с инсулинорезистентностью является ведущей причиной пролиферативных болезней эндометрия, включая гиперплазию и рак эндометрия.Вместе с тем важно понимать, что рак эндометрия – это терминальное «состояние-упущение», связанное прежде всего с неэффективной диспансеризацией женщины и отсутствием стратификации женщин в группу риска по данной нозологии. Однако гиперплазия эндометрия – это промежуточное/премалигнантное состояние (у пациенток с исходно высокими канцерогенными рисками!), в рамках которого клиницист все еще обладает рядом консервативных методов коррекции и профилактики рецидивирования заболевания, способным нивелировать риски эндометриального канцера «здесь и сейчас». Безусловно, в основе лечения гиперплазии эндометрия, в частности неатипичной формы, лежит эффективная и патогенетически-направленная гормонотерапия с использованием гестагенов, но вместе с тем ни в коем случае нельзя забывать о метаболизм-модифицирующей коррекции ожирения.
Эффективная терапия ожирения – это основа предикции возврата гиперплазии эндометрия de novo в ближайшем и рака эндометрия в отдаленном будущем. При этом наиболее инновационным и эффективным фармакологическим методом коррекции ожирения на сегодняшний день является тирзепатид (первый отечественный препарат Тирзетта), обладающий разнонаправленным позитивным эффектом на метаболические показатели. Таким образом, в настоящее время мы обладаем безграничным потенциалом для фармакотерапии ожирения, который немаловажен для повседневной гинекологической практики.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, акад. РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Балан Вера Ефимовна – д-р мед. наук, проф. каф. акушерства и гинекологии, ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского». E-mail: balanmed@gmail.com; ORCID: 0000-0002-2364-6838
Vera E. Balan – Dr. Sci. (Med.), Prof.,Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: balanmed@gmail.com; ORCID: 0000-0002-2364-6838
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., директор ФГБНУ
«НИИМЧ им. акад. А.П. Авцына». E-mail: mikhalevalm@yandex.ru; ORСID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Dir. Scientific Research Institute of Human Morphology named after academician A.P. Avtsyn.
E-mail: mikhalevalm@yandex.ru; ORСID: 0000-0003-2052-914X
Долгов Евгений Денисович – клин. ординатор каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1586dolgde@gmail.com; ORCID: 0000-0001-6709-5209
Поступила в редакцию: 22.08.2025
Поступила после рецензирования: 28.08.2025
Принята к публикации: 04.09.2025
Received: 22.08.2025
Revised: 28.08.2025
Accepted: 04.09.2025
Список исп. литературыСкрыть список1. World Health Organization. Obesity: preventing and managing the global epidemic. Geneva: WHO, 1997.
2. Ueda Yamaguchi N et al. Global Perspectives on Obesity and Being Overweight: A Bibliometric Analysis in Relation to Sustainable Development Goals. International Journal of Environmental Research and Public Health 2025;22(2):146.
3. Phelps NH et al. Worldwide trends in underweight and obesity from 1990 to 2022: a pooled analysis of 3663 population-representative studies with 222 million children, adolescents, and adults. Lancet 2024;403(10431):1027-50.
4. World Health Organization. Obesity and overweight. URL: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.
5. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA: a cancer journal for clinicians 2024;74(1).
6. Siegel RL, Kratzer TB, Giaquinto AN et al. Cancer statistics 2025;75(1).
7. Avgerinos KI, Spyrou N, Mantzoros CS, Dalamaga M. Obesity and cancer risk: Emerging biological mechanisms and perspectives. Metabolism 2019;92:121-35.
8. Liang B et al. Epidemiology, molecular typing, microbiome-immune interactions and treatment strategies of endometrial cancer: a review. Frontiers in Immunology 2025;16:1595638.
9. Heo J, Oh H, Song YS et al. Impact of Changes in Obesity and Abdominal Obesity on Endometrial Cancer Risk in Young Korean Women: A Nationwide Cohort Study. Cancer Epidemiology, Biomarkers & Prevention 2025. DOI: 10.1158/1055-9965.EPI-25-0615
10. Oh Y, Baloch AS, Gupta S. The obesity paradox in endometrial cancer: Epidemiology of obesity among endometrial cancer patients and impact on inpatient hospitalization outcomes. 2025. American Society of Clinical Oncology Annual Meeting; May 30-June 3, 2025; Chicago, IL.
11. Crosbie EJ, Kitson SJ, McAlpine JN et al. Endometrial cancer. Lancet 2022. 399(10333):1412-28.
12. Li Z, Yin J, Liu Y, Zeng F. A risk prediction model for endometrial hyperplasia/endometrial carcinoma in premenopausal women. Scientific Reports 2025;15(1):1019.
13. Li W, Gu Y, Liu S et al. GLP1R inhibits the progression of endometrial carcinoma through activation of cAMP/PKA pathway. J Clin Lab Anal 2022;36(10):e24604.
14. Cree IA, White VA, Indave BI, Lokuhetty D. Revising the WHO classification: female genital tract tumours. Histopathology 2020;76(1):151-6.
15. Гиперплазия эндометрия. Клинические рекомендации Минздрава России. М., 2024.
Endometrial hyperplasia. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2024 (in Russian).
16. Núñez-Troconis J. Endometrial hyperplasia: a narrative review on its pathogenesis, risk factors and diagnosis. Investigación Clínica 2025;66(1):101-15.
17. Tripathi S, Sharma Y, Kumar D. Unveiling the link between chronic inflammation and cancer. Metabolism Open 2025:100347.
18. Szablewski L. Insulin resistance: The increased risk of cancers. Current Oncology 2024;31(2):998–1027.
19. Yang X, Wang JL The role of metabolic syndrome in endometrial cancer: A review. Frontiers in Oncology 2019;9:1-14.
20. American Cancer Society medical and editorial content team. Endometrial cancer risk factors endometrial cancer causes, risk factors, and prevention. 2025, February. URL: cancer.org
21. de Medeiros SF, Rodgers RJ, Norman RJ. Adipocyte and steroidogenic cell cross-talk in polycystic ovary syndrome. Human reproduction update 2021;27(4):771-96.
22. Baker JM, Al-Nakkash L, Herbst-Kralovetz MM. Estrogen–gut microbiome axis: Physiological and clinical implications. Maturitas 2017;103:45-53.
23. Li L, Zhu L. Chinese guidelines on the management of endometrial hyperplasia. Eur J Surg Oncol 2024;50:108391.
24. Ожирение. Клинические рекомендации Минздрава России. М., 2024.
Fatness. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2024. (in Russian).
25. Tirzepatide (Mounjaro) for type 2 diabetes. Med Lett Drugs Ther 2022;64(1654):105-7.
26. Wang L. Designing a dual GLP-I R/GIPR agonist from tirzepatide: Comparing residues between tirzepatide, GLP-I, and GIP. Drug Des Dev Ther 2022;16:1547–60.
27. Furihata K, Mimura H, Urva S et al. A phase 1 multiple-ascending dose study of tirzepatide in Japanese participants with type 2 diabetes. Diabetes Obes Metab 2022;24: 239-246.
28. Coskun T et al. LY3298176, a novel dual GIP and GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus: From discovery to clinical proof of concept. Mol Metab 2018;18: 3-14.
29. Оразов М.Р., Радзинский В.Е., Балан В.Е., Долгов Е.Д. Медикаментозная терапия ожирения в рутинных реалиях: эффективность и безопасность тирзепатида. Клинический разбор в общей медицине. 2025;6(4):92-8.
Orazov M.R., Radzinsky V.E., Balan V.E., Dolgov E.D. Drug therapy of obesity in routine realities: efficacy and safety of tirzepatide. Clinical review for general practice. 2025;6(4):92-8 (in Russian).
30. Samms RJ et al. GIPR agonism mediates weight-independent insulin sensitization by tirzepatide in obese mice. J Clin Invest 2021;131:e146353.
31. Chavda VP, Ajabiya J, Teli D et al. Tirzepatide, a new era of dual-targeted treatment for diabetes and obesity: a mini-review. Molecules 2022;27(13):4315.
32. Gao L, Lee BW, Chawla M et al. Tirzepatide versus insulin glargine as second-line or third-line therapy in type 2 diabetes in the Asia-Pacific region: the SURPASS-AP-Combo trial. Nat Med 2023;29(6):1500-10.
33. Davies MJ, Aroda VR, Collins BS et al. Management of Hyperglycemia in Type 2 Diabetes, 2022. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2022;45(11):2753-86.
34. Gastaldelli A, Cusi K, Landó LF et al. Effect of tirzepatide versus insulin degludec on liver fat content and abdominal adipose tissue in people with type 2 diabetes (SURPASS-3 MRI): a substudy of the randomised, open-label, parallel-group, phase 3 SURPASS-3 trial. The lancet Diabetes & endocrinology 2022;10(6):393-406.
35. Frías JP, Davies MJ, Rosenstock J et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. New England Journal of Medicine 2021;385(6):503-15.
36. Heise T, DeVries JH et al. Tirzepatide reduces appetite, energy intake, and fat mass in people with type 2 diabetes. Diabetes Care 2023;46(5):998-1004.
37. Jastreboff AM, le Roux CW, Stefanski A et al. Tirzepatide for obesity treatment and diabetes prevention. New England Journal of Medicine 2025;392(10):958-71.
38. Abu-Alsaud MA, Ellebedy M, Hammad N et al. Tirzepatide Versus Long-Acting Insulin in Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Journal of Diabetology 2025;16(3):204-13.
39. Martin CK, Carmichael OT, Carnell S et al. Tirzepatide on ingestive behavior in adults with overweight or obesity: a randomized 6-week phase 1 trial. Nat Med 2025. DOI: 10.1038/s41591-025-03774-9


