Клинический разбор в общей медицине №9 2025
Клинический разбор в общей медицине №9 2025
Влияние циркулирующих опухолевых клеток на прогноз у пациенток с поздним раком молочной железы
Номера страниц в выпуске:82-88
Аннотация
Введение. Выявление циркулирующих опухолевых клеток (ЦОК) коррелирует с плохим прогнозом при метастатическом раке молочной железы (МРМЖ), однако данных, доказывающих уровень, фенотипические характеристики, являющиеся предиктором неблагоприятного прогноза, явно недостаточно. Кроме того, высокая стоимость и сложность анализа зарегистрированных в мире тест-систем делает невозможным рутинное проведение исследования и побуждает к поиску иных методик детекции ЦОК и анализа их характеристик для прогноза. Целью настоящего исследования стало изучение влияния ЦОК на течение позднего РМЖ с учетом их уровня и качественного состава с использованием метода проточной цитометрии в соответствии с оригинальной методикой МРНЦ им. А.Ф. Цыба.
Материалы и методы. В исследование включены 21 пациентка с МРМЖ. Средний возраст пациенток составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток было установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (80,9%; n=17) и головного мозга (42,8%; n=9). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%). Всем пациенткам до начала терапии была проведена оценка ЦОК методом многопараметровой проточной цитометрии по оригинальной методике МРНЦ им. А.Ф. Цыба, оценивалось не только количество ЦОК, но и их иммунофенотипические особенности на основании анализа экспрессии антигенов CAM5.2, BerEP4, HLA-DR и CD95. Всем пациенткам было проведено лечение согласно биологическому подтипу опухоли в соответствии с клиническими рекомендациями Минздрава России.
Результаты. ЦОК в периферической крови выявлены у 20 (95,3%) пациенток, количество их варьировало в диапазоне от 1 до 107 клеток. Нами установлено, что пороговым значением, достоверно влияющим на прогноз при распространенном РМЖ, является 8 ЦОК для оценки общей выживаемости (ОВ) и 5 ЦОК для оценки выживаемости без прогрессирования (ВБП) в 7,5 мл крови. Так, 2-летняя ОВ в группе пациенток с 8 и более ЦОК (n=12) составила 50%, в группе с менее чем 8 ЦОК (n=9) – 77,8% (р=0,1); 2-летняя ВБП в группе пациенток с 5 и более ЦОК составила 5,6%, в группе с менее чем 5 ЦОК – 100% (р=0,008). Установлены особенности качественного состава ЦОК, ассоциированные с прогнозом. Прогностически неблагоприятным оказалась группа с иммунофенотипом ЦОК CAM5.2+BerEP4+ по сравнению с группой CAM5.2+BEREP4 – 2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7% (р=0,096); 2-летняя ВБП при фенотипе CAM5.2+BEREP4+ составила 0%, при фенотипе CAM5.2+BEREP4- – 42,9% (р=0,002).
Выводы. ЦОК при МРМЖ выявляются в 95,3% случаев и представляют собой иммунофенотипически гетерогенную по экспрессии пан-эпителиальных маркеров субпопуляцию опухолевых клеток. Количество ЦОК и их качественный состав достоверно связаны с прогнозом МРМЖ.
Ключевые слова: рак молочной железы, циркулирующие опухолевые клетки, поздний рак.
Для цитирования: Абдо И.А.А., Фалалеева Н.А., Гривцова Л.Ю., Галицына А.Б., Пимонова И.С., Белохвостова А.C., Софийчук А.А. Влияние циркулирующих опухолевых клеток на прогноз у пациенток с поздним раком молочной железы. Клинический разбор в общей медицине. 2025; 6 (9): 82–88. DOI: 10.47407/kr2025.6.9.00677
Введение. Выявление циркулирующих опухолевых клеток (ЦОК) коррелирует с плохим прогнозом при метастатическом раке молочной железы (МРМЖ), однако данных, доказывающих уровень, фенотипические характеристики, являющиеся предиктором неблагоприятного прогноза, явно недостаточно. Кроме того, высокая стоимость и сложность анализа зарегистрированных в мире тест-систем делает невозможным рутинное проведение исследования и побуждает к поиску иных методик детекции ЦОК и анализа их характеристик для прогноза. Целью настоящего исследования стало изучение влияния ЦОК на течение позднего РМЖ с учетом их уровня и качественного состава с использованием метода проточной цитометрии в соответствии с оригинальной методикой МРНЦ им. А.Ф. Цыба.
Материалы и методы. В исследование включены 21 пациентка с МРМЖ. Средний возраст пациенток составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток было установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (80,9%; n=17) и головного мозга (42,8%; n=9). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%). Всем пациенткам до начала терапии была проведена оценка ЦОК методом многопараметровой проточной цитометрии по оригинальной методике МРНЦ им. А.Ф. Цыба, оценивалось не только количество ЦОК, но и их иммунофенотипические особенности на основании анализа экспрессии антигенов CAM5.2, BerEP4, HLA-DR и CD95. Всем пациенткам было проведено лечение согласно биологическому подтипу опухоли в соответствии с клиническими рекомендациями Минздрава России.
Результаты. ЦОК в периферической крови выявлены у 20 (95,3%) пациенток, количество их варьировало в диапазоне от 1 до 107 клеток. Нами установлено, что пороговым значением, достоверно влияющим на прогноз при распространенном РМЖ, является 8 ЦОК для оценки общей выживаемости (ОВ) и 5 ЦОК для оценки выживаемости без прогрессирования (ВБП) в 7,5 мл крови. Так, 2-летняя ОВ в группе пациенток с 8 и более ЦОК (n=12) составила 50%, в группе с менее чем 8 ЦОК (n=9) – 77,8% (р=0,1); 2-летняя ВБП в группе пациенток с 5 и более ЦОК составила 5,6%, в группе с менее чем 5 ЦОК – 100% (р=0,008). Установлены особенности качественного состава ЦОК, ассоциированные с прогнозом. Прогностически неблагоприятным оказалась группа с иммунофенотипом ЦОК CAM5.2+BerEP4+ по сравнению с группой CAM5.2+BEREP4 – 2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7% (р=0,096); 2-летняя ВБП при фенотипе CAM5.2+BEREP4+ составила 0%, при фенотипе CAM5.2+BEREP4- – 42,9% (р=0,002).
Выводы. ЦОК при МРМЖ выявляются в 95,3% случаев и представляют собой иммунофенотипически гетерогенную по экспрессии пан-эпителиальных маркеров субпопуляцию опухолевых клеток. Количество ЦОК и их качественный состав достоверно связаны с прогнозом МРМЖ.
Ключевые слова: рак молочной железы, циркулирующие опухолевые клетки, поздний рак.
Для цитирования: Абдо И.А.А., Фалалеева Н.А., Гривцова Л.Ю., Галицына А.Б., Пимонова И.С., Белохвостова А.C., Софийчук А.А. Влияние циркулирующих опухолевых клеток на прогноз у пациенток с поздним раком молочной железы. Клинический разбор в общей медицине. 2025; 6 (9): 82–88. DOI: 10.47407/kr2025.6.9.00677
Original Article
Irina S. Pimonova2, Anna S. Belokhvostova2,3, Aleksandr A. Sofiochuk2
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
3 Obninsk Institute of Atomic Energy – branch National Research Nuclear University MEPhI, Obninsk, Russia
galitsyna.anastaisha@gmail.com
Abstract
Introduction. Detection of circulating tumor cells (CTCs) correlates with a poor prognosis in metastatic breast cancer (MBC), however, there is clearly insufficient data to prove the level and phenotypic characteristics that are predictors of an unfavorable prognosis. In addition, the high cost and complexity of analyzing test systems registered in the world makes it impossible to conduct routine research and encourages the search for other methods for detecting CTCs, analyzing their characteristics and predictive values. The purpose of this study was to study the effect of CTC on the course of MBC, taking into account their level and qualitative composition using the flow cytometry method in accordance with the original methodology of the A.F. Tsyba MRRC.
Materials and methods. The study included 21 patients with MBC. The average age of the patients was 52.7 years. The median follow–up was 21.4 months. The absolute majority of patients had involvement of regional lymph nodes in the tumor process (80.9%), metastatic bone damage was most often noted in 17 (80.9%) patients and brain damage in 9 (42.8%) patients. The most common biological subtype of the tumor was the triple negative subtype (28.7%). Before starting therapy, all patients underwent a CTC assessment using the multiparameter flow cytometry method according to the original method of the Tsyba MRSC. Not only the number of CTCs, but also their immunophenotypic features were evaluated based on the analysis of the expression of CAM5.2, BerEP4, HLA antigens-DR and CD95. All patients were treated according to the biological subtype of the tumor in accordance with the clinical recommendations of the Ministry of Health of the Russian Federation.
Results. CTCs in peripheral blood were detected in 20 patients (95.3%), their number ranged from 1 to 107 cells. We found that the threshold value that significantly affects the prognosis for MBC is 8 CTCs for assessing overall survival (OS) and 5 CTCs for assessing progression-free survival (PFS) in 7.5 ml of blood. Thus, 2-year OS in the group of patients with 8 or more CTC (n=12) was 50%, in the group with less than 8 CTC (n=9) – 77.8% (p=0.1); The 2-year PFS was 5.6% in the group of patients with 5 or more CTC, and 100% in the group with less than 5 CTC (p=0.008). The features of the qualitative composition of the CTC associated with the forecast are established. The group with the CTC immunophenotype CAM5.2+BerEP4+ was prognostically unfavorable compared with the CAM5 group.2+BEREP4 is a 2-year-old OS with the CAM5 phenotype.2+BEREP4+ was 46.2%, with the CAM5 phenotype.2+BEREP4- – 85.7% (p=0.096); 2-year AFD with CAM5 phenotype.2+BEREP4+ was 0%, with the CAM5 phenotype.2+BEREP4- – 42.9% (p=0.002).
Conclusions. CTCs in MBC are detected in 95.3% of cases and represent an immunophenotypically heterogeneous subset of tumor cells in the expression of pan-epithelial markers. The number of CCPs and their qualitative composition are significantly related to the prognosis of MBC.
Keywords: breast cancer, circulating tumor cells, late-stage cancer.
For citation: Abdo I.A.A., Falaleeva N.A., Grivtsova L.Yu., Galitsyna A.B., Pimonova I.S., Belokhvostova A.S., Sofiochuk A.A. The effect of circulating tumor cells on prognosis in patients with advanced breast cancer. Clinical review for general practice. 2025; 6 (9): 82–88 (In Russ.).
DOI: 10.47407/kr2025.6.9.00677
Пациентки с МРМЖ представляют собой крайне неоднородную группу, и прогноз заболевания, а также эффективность лечения существенно варьируются. Традиционно для оценки прогноза и выбора схемы терапии используются такие факторы, как возраст больной на момент диагностики, гормональный статус опухоли, наличие HER2-положительного статуса, локализация метастазов, а также общее состояние пациентки (PS-статус по шкале ECOG) [3]. Сочетания этих факторов позволяют разделить пациенток на подгруппы с различным прогнозом. Однако такая классификация не всегда достаточно точна для предсказания индивидуального ответа на лечение.
Выявление ранних предикторов ответа на терапию позволит избежать назначения неэффективных методов лечения, снизит риск развития токсических побочных эффектов и, следовательно, сократит расходы на лечение. Разработка новых предиктивных моделей, включающих в себя как клинические, так и молекулярно-генетические характеристики опухоли, является актуальной задачей современной онкологии. В настоящее время определение количества циркулирующих опухолевых клеток (ЦОК) в периферической крови приобретает все большее значение.
ЦОК представляют собой клетки злокачественной опухоли, которые диссеминируются из первичного или метастатического очага и циркулируют в кровотоке или лимфатической системе. Эти клетки играют ключевую роль в процессе метастазирования, поскольку они могут проникать в другие органы, где инициируют образование вторичных опухолевых очагов [4]. Многочисленные исследования подтверждают прогностическую ценность обнаружения ЦОК, особенно при МРМЖ [5–7]. Обнаружение и подсчет ЦОК на разных этапах лечения позволяет оценить эффективность терапии, действуя как неинвазивный маркер. Это особенно важно для мониторинга длительного лечения, снижая необходимость частых инвазивных процедур [8, 9].
Механизм проникновения ЦОК в кровеносное русло связан с процессами ангиогенеза и клеточной инвазивности, что позволяет опухолевым клеткам преодолевать барьеры сосудистой стенки [4]. ЦОК являются важным биологическим маркером для оценки стадии заболевания, прогнозирования вероятности метастазирования и мониторинга эффективности терапии. Анализ ЦОК имеет значительный потенциал для разработки методов ранней диагностики.
ЦОК обладают характерными молекулярными и клеточными признаками, такими как экспрессия специфических клеточных маркеров (например, эпителиальных маркеров или маркеров мезенхимальных клеток), которые отличают их от нормальных клеток организма и позволяют их выявление [4]. ЦОК могут быть идентифицированы с использованием высокочувствительных методов, таких как полимеразная цепная реакция, поточная цитометрия, микрочиповые технологии и другие молекулярно-биологические методы [10]. Более того, современные методы позволяют идентифицировать уникальные фенотипические характеристики ЦОК, которые могут отличаться от клеток первичной опухоли [10]. Это имеет критическое значение для понимания механизмов метастазирования и разработки новых целевых терапевтических стратегий. Например, обнаружение специфических клеточных поверхностных маркеров, ассоциированных с высоким риском метастазирования, может быть использовано для целенаправленного уничтожения этих клеток с помощью иммунотерапии [10].
Изучение ЦОК представляет собой динамично развивающуюся область онкологических исследований. На данный момент ведутся активные эксперименты, направленные на улучшение чувствительности и специфичности методов обнаружения ЦОК, а также на интеграцию анализа ЦОК в клиническую практику для более точного прогнозирования и подбора терапии [11]. Будущее онкологической диагностики неразрывно связано с дальнейшим изучением циркулирующих опухолевых клеток.
 В исследование включены 21 пациентка с морфологически/иммуногистохимически верифицированным диагнозом РМЖ. У всех пациенток была установлена распространенная форма заболевания (IV стадия). Средний возраст составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (у 17 пациенток) и головного мозга (у 9 пациенток). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%); табл. 1.
В исследование включены 21 пациентка с морфологически/иммуногистохимически верифицированным диагнозом РМЖ. У всех пациенток была установлена распространенная форма заболевания (IV стадия). Средний возраст составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (у 17 пациенток) и головного мозга (у 9 пациенток). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%); табл. 1.
Всем пациентам перед началом лечения проводилось определение циркулирующих опухолевых клеток методом многопараметровой проточной цитометрии с последующей оценкой их иммунологического фенотипа. Затем пациентки проходили противоопухолевую лекарственную терапию в соответствии с клиническими рекомендациями Минздрава России в зависимости от биологического типа опухоли.
Оценка количества и характеристик циркулирующих опухолевых клеток проводилась методом проточной цитометрии с применением оригинальной методики МРНЦ им. А.Ф. Цыба [12].
Для проведения исследования у пациентки из периферической вены забиралось 8 мл крови, из этой пробирки отбиралась аликвота 0,5 мл для подсчета лейкоцитарной формулы, 7,5 мл периферической крови брали для иммунологического исследования. На первом этапе проводили выделение лейкоцитов из всего объема путем осаждения клеточного осадка центрифугированием при 300 g и дальнейшим лизированием эритроцитов (стандартная манипуляция лизиса эритроцитов с применением готового лизирующего раствора, BD FACS Lysing Solution). Весь полученный клеточный объем делили на две пробы. Первая проба – опытный образец, который инкубировали с моноклональными антителами к исследуемым антигенам, пан-эпителиальным маркерам (CAM5.2 – цитокератины CD326 [EPCAM или BerEP4] – мембранный эпителиальный антиген) и общелейкоцитарному антигену CD45 и нуклеотропному красителю – syto 16, а также антитела для выявления экспрессии на клетках антигена CD133 (маркер, ассоциированный с фенотипом стволовых опухолевых клеток), молекулы HLA-DR (молекула главного комплекса гистосовместимости
II класса) и антигена CD95 – Fas-рецептор (англ. Fasreceptor, FasR), также известный как апоптозный антиген 1 (APO-1 или APT) [13]. В исследовании использовалась комбинация антител к панцитокератинам с CD326 или BerEP4 в зависимости от наличия антител в лаборатории. Вторая проба – контрольный образец, который инкубировался с изотипическими контролями, для оценки неспецифического связывания. Панель антител представлена в табл. 2.
Далее проводилась стандартная реакция иммунофлуоресцентной окраски. Клетки инкубировались с антителами в течение 20 мин в темноте и далее отмывались от не связавшихся антител центрифугированием в течение 5 мин при 300 g дважды (стандартная реакция иммунофлуореcценции). После этого осуществлялся счет клеток на проточном цитометре. Анализу подвергалось 10 000 000–25 000 000 клеток образца в зависимости от уровня лейкоцитов крови у пациентки. По завершении счета на проточном цитометре данные обрабатывались с применением программного обеспечения Kaluza 2.0, позволяющего анализировать нативные файлы проточной цитометрии на обычном персональном компьютере. Преимуществом программного обеспечения Kaluza является возможность анализа большого количества клеток.

Статистическая обработка данных проведена с применением программного пакета SPSS версии 27.0. Для оценки отдаленных результатов лечения расчет производился путем построения кривых по методике Каплана–Майера, отражающих показатели кумулятивной выживаемости к началу определенного временного интервала. Для построения кривой выживаемости без прогрессирования (ВБП) сроки жизни больных рассчитывались от даты начала терапии до прогрессирования, развития рецидива или последней явки больного. Для построения кривой, отражающей общую выживаемость (ОВ), сроки жизни рассчитывались от даты начала лечения до смерти или до даты последней явки больного. Для определения информативности ЦОК использовались следующие операционные характеристики: чувствительность, специфичность, точность. Для вычисления этих показателей применялся ROC-анализ (Receiver Operating Characteristic Analysis). Оценку выживаемости проводили методом Каплана–Майера.
 С целью сравнения кривых выживаемости между исследуемыми группами применялся тест логарифмического рангового критерия (log-rank test). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы и нижнего и верхнего квартилей (Q1–Q3). Для оценки статистической достоверности рассчитанных критериев применялись показатели и таблицы критических значений для приемлемых уровней значимости (р). Для статистики различия были приняты два основных уровня достоверности: достоверный – р<0,050, недостоверный – р>0,050.
С целью сравнения кривых выживаемости между исследуемыми группами применялся тест логарифмического рангового критерия (log-rank test). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы и нижнего и верхнего квартилей (Q1–Q3). Для оценки статистической достоверности рассчитанных критериев применялись показатели и таблицы критических значений для приемлемых уровней значимости (р). Для статистики различия были приняты два основных уровня достоверности: достоверный – р<0,050, недостоверный – р>0,050.
Для оценки дискриминационной способности количества ЦОК при прогнозировании выживаемости пациентов нами был применен метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
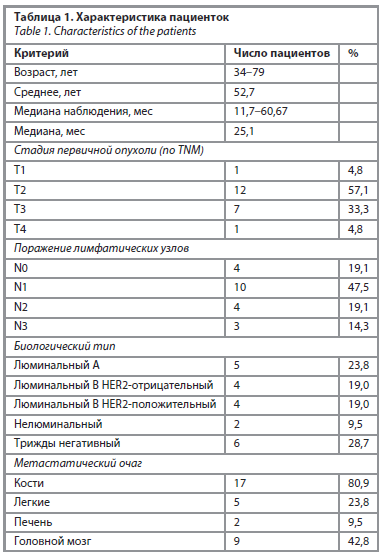
Так, нами было установлено, что ЦОК являются статистически значимым предиктором ОВ [AUC=0,856; 95% доверительный интервал (ДИ) 0,694–1,000, p=0,007]. Пороговое значение ЦОК в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 8 клеток. Смерть прогнозировалась при значении ЦОК выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 76,9% и 75,0% соответственно (рис. 1).
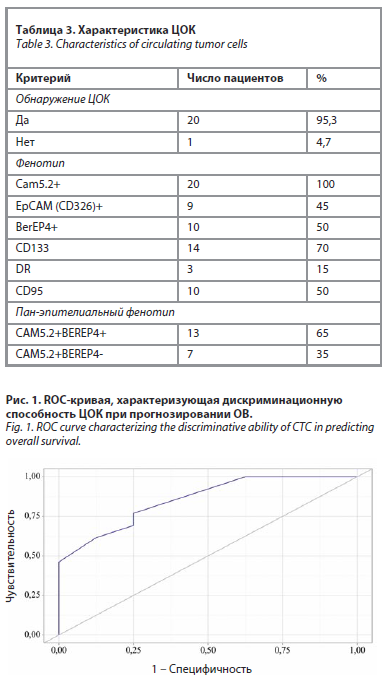
Гипотеза была проверена с помощью методики Каплана–Майера, с помощью которой была получена тенденция к статистической значимости. Так, 2-летняя ОВ в группе пациенток с 8 и более ЦОК (n=12) составила 50%, в группе с менее чем 8 ЦОК (n=9) – 77,8% (р=0,1); рис. 2.
Важно отметить, что при увеличении срока наблюдения в группе пациенток с 8 и более ЦОК отмечается повышение частоты летальных исходов, однако при настоящей медиане наблюдения оценка возможна лишь на 2-летний период. Вероятно, с увеличением времени наблюдения нами будут получены более достоверные различия в ОВ при полученном пороговом значении.
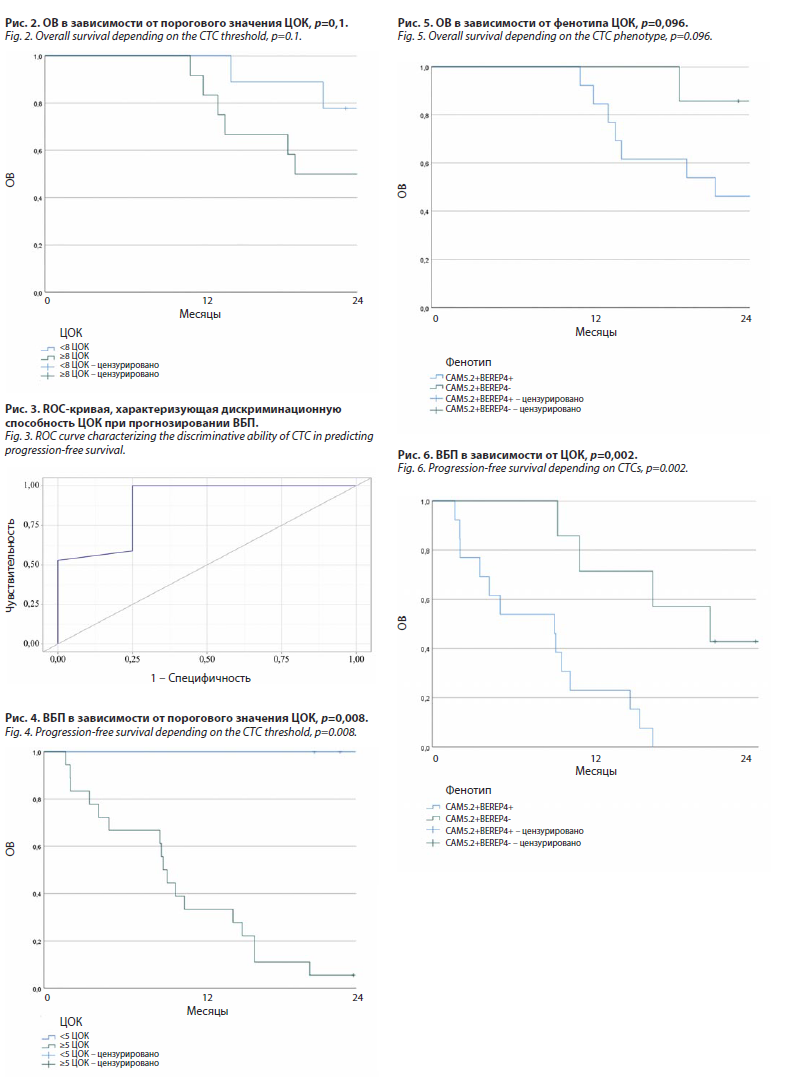
Идентичным образом был проведен анализ влияния ЦОК на риск прогрессирования РМЖ. Так, мы установили, что ЦОК являются статистически значимым предиктором прогрессирования опухоли (AUC=0,890; 95% ДИ 0,741–1,000, p=0,017). Пороговое значение ЦОК в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 5 клеток. Прогрессирование прогнозировалось при значении ЦОК выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 100% и 75% соответственно (рис. 3).
При анализе ВБП в соответствии с выдвинутой гипотезой нами было установлено, что в группе пациентов с 5 и более ЦОК 2-летняя ВБП составила 5,6%, в группе с менее чем 5 ЦОК – 100% (р=0,008); рис. 4.
Мы оценили влияние качественного состава ЦОК (субпопуляций ЦОК отличных по экспрессии пан-эпителиальных маркеров, см. табл. 3) на прогноз заболевания. Так, 2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7% (р=0,096); рис. 5.
При оценке 2-летняя ВБП при фенотипе CAM5.2+ BEREP4+ составила 0%, при фенотипе CAM5.2+ BEREP4- – 42,9% (р=0,002); рис. 6.
Изучение ЦОК в контексте пациентов с диссеминированными формами злокачественных новообразований имеет огромное значение. Во-первых, интеграция данного параметра в системы прогнозирования позволит на начальном этапе выявлять пациенток высокого риска, которым будет требоваться модификация терапии, чтобы не позволить опухоли распространиться за пределы первичного очага, что должно значительно снизить долю пациентов с метастатическими формами злокачественных новообразований, которых в структуре РМЖ в настоящее время около 25% [16]. Во-вторых, изучение фенотипических характеристик ЦОК у пациенток позволит разработать более чувствительные и специфичные варианты терапии, которые будут эффективны в каждом конкретном случае.
В настоящее время анализ ЦОК не входит в стандарты диагностики для пациенток с РМЖ, несмотря на то что многие исследования подтвердили прочную корреляцию между количеством ЦОК и как ОВ, так и ВБП, особенно у пациенток с МРМЖ [17, 18]. Связан данный аспект со сложностью интерпретации полученных данных и относительно высокой стоимостью оборудования.
В рамках нашего исследования было установлено, что пороговым значением ЦОК, достоверно ухудшающим прогноз течения заболевания, является 8 и более клеток относительно ОВ и 5 и более клеток относительно ВБП в 7,5 мл крови больных с МРМЖ. Однако важно отметить, что мировой опыт демонстрирует более низкое пороговое значение количества ЦОК в контексте ОВ. Так, ряд работ определяет 5 и более клеток как максимально достоверное пороговое значение [19–21]. Данные различия могут быть связаны с числом больных в нашем исследовании (21 пациентка), которое могло внести коррективы в полученные результаты.
Кроме того, нами проанализированы уникальные иммунофенотипические характеристики ЦОК: различия в экспрессии цитокератинов 7 и 8, выявляемых антителом CAM 5.2 в цитоплазме клетки, и молекулы клеточной адгезии эпителиальных клеток (EpCam, пан-эпителиальный антиген), выявляемой на мембране клеток посредством антител BerEP4, стандартно применяемых в иммуногистохимической практике при характеристике эпителиальных опухолей [22, 23]. Так, нами были установлены две субпопуляции ЦОК, отличные по экспрессии цитокератинов и пан-эпителиальных антигенов, – CAM5.2+BEREP4+ и CAM5.2+BEREP4-. При этом фенотип CAM5.2+BEREP4+ оказался предиктором неблагоприятного исхода как со стороны ОВ (2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7%, р=0,096), так и со стороны ВБП (2-летняя ВБП при фенотипе CAM5.2+ BEREP4+ составила 0%, при фенотипе CAM5.2+ BEREP4- – 42,9%, р=0,002).
Данные результаты подтверждают гетерогенность ЦОК, что неразрывно связано с исходами терапии и ее адекватностью в каждом конкретном случае. У нашего исследования есть ограничение в виде относительно небольшой выборки, однако результаты работы представляют собой потенциально важные данные, которые требуют дальнейшего изучения и внедрения в клиническую практику.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Соблюдение прав пациентов и правил биоэтики. Все пациенты, включенные в исследование, получали лечение в рамках рутинной практики после подписания информированного согласия на лечение. Персональные данные пациентов не использовались при проведении исследования.
Compliance with patient rights and principles of bioethics. All included patients received therapy in routine clinical practice after obtaining of inform consent for the therapy. Personal patient’s data were not used in the study.
Финансирование. Исследование не имело спонсорской поддержки.
Funding. The work was performed without external funding.
Участие авторов. Все авторы в равной степени участвовали в подготовке публикации: разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Информация об авторах
Information about the authors
Абдо Иман Абдулкадер Абдулхалим – аспирант, каф. онкологии и рентгенорадиологии им. В.П. Харченко, ФГАОУ ВО «РУДН им. Патриса Лумумбы». ORCID: 0009-0002-6631-3862
Iman A.A. Abdo – Graduate Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). ORCID: 0009-0002-6631-3862
Фалалеева Наталья Александровна – д-р мед. наук, проф., зав. отделом лекарственного лечения злокачественных новообразований, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-0023-4216
Natalia A. Falaleeva – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-0023-4216
Гривцова Людмила Юрьевна – д-р биол. наук, канд. мед. наук, зав. отд-нием клинической иммунологии, МРНЦ им.
А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-9103-9688
Luydmila Yu. Grivtsova – Dr. Sci. (Biol.), Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-9103-9688
Галицына Анастасия Борисовна – студентка, Обнинский институт атомной энергетики – ИАТЭ НИЯУ МИФИ. ORCID: 0009-0009-0188-8420
Anastasia B. Galitsyna – Student, Obninsk Institute of Atomic Energy – branch National Research Nuclear University MEPhI. ORCID: 0009-0009-0188-8420
Пимонова Ирина Сергеевна – врач-онколог, отд-ние противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0009-0002-3355-6980
Irina S. Pimonova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0002-3355-6980
Белохвостова Анна Сергеевна – канд. мед. наук, зав. отд-нием противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-4709-1726
Anna S. Belokhvostova – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-4709-1726
Софийчук Александр Александрович – аспирант, врач-онколог, отд-ние противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
ORCID: 0009-0008-0769-1736
Aleksandr A. Sofiochuk – Graduate Student, Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0008-0769-1736
Поступила в редакцию: 19.06.2025
Поступила после рецензирования: 30.06.2025
Принята к публикации: 03.07.2025
Received: 19.06.2025
Revised: 30.06.2025
Accepted: 03.07.2025
The effect of circulating tumor cells on prognosis in patients with advanced breast cancer
Iman A.A. Abdo1, Natalia A. Falaleeva2,3, Luydmila Yu. Grivtsova2, Anastasia B. Galitsyna2,3,Irina S. Pimonova2, Anna S. Belokhvostova2,3, Aleksandr A. Sofiochuk2
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
3 Obninsk Institute of Atomic Energy – branch National Research Nuclear University MEPhI, Obninsk, Russia
galitsyna.anastaisha@gmail.com
Abstract
Introduction. Detection of circulating tumor cells (CTCs) correlates with a poor prognosis in metastatic breast cancer (MBC), however, there is clearly insufficient data to prove the level and phenotypic characteristics that are predictors of an unfavorable prognosis. In addition, the high cost and complexity of analyzing test systems registered in the world makes it impossible to conduct routine research and encourages the search for other methods for detecting CTCs, analyzing their characteristics and predictive values. The purpose of this study was to study the effect of CTC on the course of MBC, taking into account their level and qualitative composition using the flow cytometry method in accordance with the original methodology of the A.F. Tsyba MRRC.
Materials and methods. The study included 21 patients with MBC. The average age of the patients was 52.7 years. The median follow–up was 21.4 months. The absolute majority of patients had involvement of regional lymph nodes in the tumor process (80.9%), metastatic bone damage was most often noted in 17 (80.9%) patients and brain damage in 9 (42.8%) patients. The most common biological subtype of the tumor was the triple negative subtype (28.7%). Before starting therapy, all patients underwent a CTC assessment using the multiparameter flow cytometry method according to the original method of the Tsyba MRSC. Not only the number of CTCs, but also their immunophenotypic features were evaluated based on the analysis of the expression of CAM5.2, BerEP4, HLA antigens-DR and CD95. All patients were treated according to the biological subtype of the tumor in accordance with the clinical recommendations of the Ministry of Health of the Russian Federation.
Results. CTCs in peripheral blood were detected in 20 patients (95.3%), their number ranged from 1 to 107 cells. We found that the threshold value that significantly affects the prognosis for MBC is 8 CTCs for assessing overall survival (OS) and 5 CTCs for assessing progression-free survival (PFS) in 7.5 ml of blood. Thus, 2-year OS in the group of patients with 8 or more CTC (n=12) was 50%, in the group with less than 8 CTC (n=9) – 77.8% (p=0.1); The 2-year PFS was 5.6% in the group of patients with 5 or more CTC, and 100% in the group with less than 5 CTC (p=0.008). The features of the qualitative composition of the CTC associated with the forecast are established. The group with the CTC immunophenotype CAM5.2+BerEP4+ was prognostically unfavorable compared with the CAM5 group.2+BEREP4 is a 2-year-old OS with the CAM5 phenotype.2+BEREP4+ was 46.2%, with the CAM5 phenotype.2+BEREP4- – 85.7% (p=0.096); 2-year AFD with CAM5 phenotype.2+BEREP4+ was 0%, with the CAM5 phenotype.2+BEREP4- – 42.9% (p=0.002).
Conclusions. CTCs in MBC are detected in 95.3% of cases and represent an immunophenotypically heterogeneous subset of tumor cells in the expression of pan-epithelial markers. The number of CCPs and their qualitative composition are significantly related to the prognosis of MBC.
Keywords: breast cancer, circulating tumor cells, late-stage cancer.
For citation: Abdo I.A.A., Falaleeva N.A., Grivtsova L.Yu., Galitsyna A.B., Pimonova I.S., Belokhvostova A.S., Sofiochuk A.A. The effect of circulating tumor cells on prognosis in patients with advanced breast cancer. Clinical review for general practice. 2025; 6 (9): 82–88 (In Russ.).
DOI: 10.47407/kr2025.6.9.00677
Введение
За последние два десятилетия произошел значительный прогресс в лечении метастатического рака молочной железы (МРМЖ) [1]. Средняя продолжительность жизни пациенток значительно увеличилась благодаря появлению новых лекарственных препаратов и более эффективных стратегий лечения [2].Пациентки с МРМЖ представляют собой крайне неоднородную группу, и прогноз заболевания, а также эффективность лечения существенно варьируются. Традиционно для оценки прогноза и выбора схемы терапии используются такие факторы, как возраст больной на момент диагностики, гормональный статус опухоли, наличие HER2-положительного статуса, локализация метастазов, а также общее состояние пациентки (PS-статус по шкале ECOG) [3]. Сочетания этих факторов позволяют разделить пациенток на подгруппы с различным прогнозом. Однако такая классификация не всегда достаточно точна для предсказания индивидуального ответа на лечение.
Выявление ранних предикторов ответа на терапию позволит избежать назначения неэффективных методов лечения, снизит риск развития токсических побочных эффектов и, следовательно, сократит расходы на лечение. Разработка новых предиктивных моделей, включающих в себя как клинические, так и молекулярно-генетические характеристики опухоли, является актуальной задачей современной онкологии. В настоящее время определение количества циркулирующих опухолевых клеток (ЦОК) в периферической крови приобретает все большее значение.
ЦОК представляют собой клетки злокачественной опухоли, которые диссеминируются из первичного или метастатического очага и циркулируют в кровотоке или лимфатической системе. Эти клетки играют ключевую роль в процессе метастазирования, поскольку они могут проникать в другие органы, где инициируют образование вторичных опухолевых очагов [4]. Многочисленные исследования подтверждают прогностическую ценность обнаружения ЦОК, особенно при МРМЖ [5–7]. Обнаружение и подсчет ЦОК на разных этапах лечения позволяет оценить эффективность терапии, действуя как неинвазивный маркер. Это особенно важно для мониторинга длительного лечения, снижая необходимость частых инвазивных процедур [8, 9].
Механизм проникновения ЦОК в кровеносное русло связан с процессами ангиогенеза и клеточной инвазивности, что позволяет опухолевым клеткам преодолевать барьеры сосудистой стенки [4]. ЦОК являются важным биологическим маркером для оценки стадии заболевания, прогнозирования вероятности метастазирования и мониторинга эффективности терапии. Анализ ЦОК имеет значительный потенциал для разработки методов ранней диагностики.
ЦОК обладают характерными молекулярными и клеточными признаками, такими как экспрессия специфических клеточных маркеров (например, эпителиальных маркеров или маркеров мезенхимальных клеток), которые отличают их от нормальных клеток организма и позволяют их выявление [4]. ЦОК могут быть идентифицированы с использованием высокочувствительных методов, таких как полимеразная цепная реакция, поточная цитометрия, микрочиповые технологии и другие молекулярно-биологические методы [10]. Более того, современные методы позволяют идентифицировать уникальные фенотипические характеристики ЦОК, которые могут отличаться от клеток первичной опухоли [10]. Это имеет критическое значение для понимания механизмов метастазирования и разработки новых целевых терапевтических стратегий. Например, обнаружение специфических клеточных поверхностных маркеров, ассоциированных с высоким риском метастазирования, может быть использовано для целенаправленного уничтожения этих клеток с помощью иммунотерапии [10].
Изучение ЦОК представляет собой динамично развивающуюся область онкологических исследований. На данный момент ведутся активные эксперименты, направленные на улучшение чувствительности и специфичности методов обнаружения ЦОК, а также на интеграцию анализа ЦОК в клиническую практику для более точного прогнозирования и подбора терапии [11]. Будущее онкологической диагностики неразрывно связано с дальнейшим изучением циркулирующих опухолевых клеток.
Материалы и методы
 В исследование включены 21 пациентка с морфологически/иммуногистохимически верифицированным диагнозом РМЖ. У всех пациенток была установлена распространенная форма заболевания (IV стадия). Средний возраст составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (у 17 пациенток) и головного мозга (у 9 пациенток). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%); табл. 1.
В исследование включены 21 пациентка с морфологически/иммуногистохимически верифицированным диагнозом РМЖ. У всех пациенток была установлена распространенная форма заболевания (IV стадия). Средний возраст составил 52,7 года. Медиана наблюдения – 21,4 мес. У абсолютного большинства пациенток установлено вовлечение в опухолевый процесс регионарных лимфатических узлов (80,9%), наиболее часто отмечалось метастатическое поражение костей (у 17 пациенток) и головного мозга (у 9 пациенток). Самым распространенным биологическим подтипом опухоли был тройной негативный подтип (28,7%); табл. 1.Всем пациентам перед началом лечения проводилось определение циркулирующих опухолевых клеток методом многопараметровой проточной цитометрии с последующей оценкой их иммунологического фенотипа. Затем пациентки проходили противоопухолевую лекарственную терапию в соответствии с клиническими рекомендациями Минздрава России в зависимости от биологического типа опухоли.
Оценка количества и характеристик циркулирующих опухолевых клеток проводилась методом проточной цитометрии с применением оригинальной методики МРНЦ им. А.Ф. Цыба [12].
Для проведения исследования у пациентки из периферической вены забиралось 8 мл крови, из этой пробирки отбиралась аликвота 0,5 мл для подсчета лейкоцитарной формулы, 7,5 мл периферической крови брали для иммунологического исследования. На первом этапе проводили выделение лейкоцитов из всего объема путем осаждения клеточного осадка центрифугированием при 300 g и дальнейшим лизированием эритроцитов (стандартная манипуляция лизиса эритроцитов с применением готового лизирующего раствора, BD FACS Lysing Solution). Весь полученный клеточный объем делили на две пробы. Первая проба – опытный образец, который инкубировали с моноклональными антителами к исследуемым антигенам, пан-эпителиальным маркерам (CAM5.2 – цитокератины CD326 [EPCAM или BerEP4] – мембранный эпителиальный антиген) и общелейкоцитарному антигену CD45 и нуклеотропному красителю – syto 16, а также антитела для выявления экспрессии на клетках антигена CD133 (маркер, ассоциированный с фенотипом стволовых опухолевых клеток), молекулы HLA-DR (молекула главного комплекса гистосовместимости
II класса) и антигена CD95 – Fas-рецептор (англ. Fasreceptor, FasR), также известный как апоптозный антиген 1 (APO-1 или APT) [13]. В исследовании использовалась комбинация антител к панцитокератинам с CD326 или BerEP4 в зависимости от наличия антител в лаборатории. Вторая проба – контрольный образец, который инкубировался с изотипическими контролями, для оценки неспецифического связывания. Панель антител представлена в табл. 2.
Далее проводилась стандартная реакция иммунофлуоресцентной окраски. Клетки инкубировались с антителами в течение 20 мин в темноте и далее отмывались от не связавшихся антител центрифугированием в течение 5 мин при 300 g дважды (стандартная реакция иммунофлуореcценции). После этого осуществлялся счет клеток на проточном цитометре. Анализу подвергалось 10 000 000–25 000 000 клеток образца в зависимости от уровня лейкоцитов крови у пациентки. По завершении счета на проточном цитометре данные обрабатывались с применением программного обеспечения Kaluza 2.0, позволяющего анализировать нативные файлы проточной цитометрии на обычном персональном компьютере. Преимуществом программного обеспечения Kaluza является возможность анализа большого количества клеток.

Статистическая обработка данных проведена с применением программного пакета SPSS версии 27.0. Для оценки отдаленных результатов лечения расчет производился путем построения кривых по методике Каплана–Майера, отражающих показатели кумулятивной выживаемости к началу определенного временного интервала. Для построения кривой выживаемости без прогрессирования (ВБП) сроки жизни больных рассчитывались от даты начала терапии до прогрессирования, развития рецидива или последней явки больного. Для построения кривой, отражающей общую выживаемость (ОВ), сроки жизни рассчитывались от даты начала лечения до смерти или до даты последней явки больного. Для определения информативности ЦОК использовались следующие операционные характеристики: чувствительность, специфичность, точность. Для вычисления этих показателей применялся ROC-анализ (Receiver Operating Characteristic Analysis). Оценку выживаемости проводили методом Каплана–Майера.
 С целью сравнения кривых выживаемости между исследуемыми группами применялся тест логарифмического рангового критерия (log-rank test). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы и нижнего и верхнего квартилей (Q1–Q3). Для оценки статистической достоверности рассчитанных критериев применялись показатели и таблицы критических значений для приемлемых уровней значимости (р). Для статистики различия были приняты два основных уровня достоверности: достоверный – р<0,050, недостоверный – р>0,050.
С целью сравнения кривых выживаемости между исследуемыми группами применялся тест логарифмического рангового критерия (log-rank test). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы и нижнего и верхнего квартилей (Q1–Q3). Для оценки статистической достоверности рассчитанных критериев применялись показатели и таблицы критических значений для приемлемых уровней значимости (р). Для статистики различия были приняты два основных уровня достоверности: достоверный – р<0,050, недостоверный – р>0,050.Результаты
При проведении проточной цитометрии у 20 (95,3%) пациенток было установлено наличие ЦОК, количество их варьировало от 1 до 107 клеток. На основании оценки пан-эпителитальных маркеров выявлено присутствие различных субпопуляций ЦОК, отличных по экспрессии антигенов BEREP4 и CAM5.2 (табл. 3).Для оценки дискриминационной способности количества ЦОК при прогнозировании выживаемости пациентов нами был применен метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Так, нами было установлено, что ЦОК являются статистически значимым предиктором ОВ [AUC=0,856; 95% доверительный интервал (ДИ) 0,694–1,000, p=0,007]. Пороговое значение ЦОК в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 8 клеток. Смерть прогнозировалась при значении ЦОК выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 76,9% и 75,0% соответственно (рис. 1).
Гипотеза была проверена с помощью методики Каплана–Майера, с помощью которой была получена тенденция к статистической значимости. Так, 2-летняя ОВ в группе пациенток с 8 и более ЦОК (n=12) составила 50%, в группе с менее чем 8 ЦОК (n=9) – 77,8% (р=0,1); рис. 2.
Важно отметить, что при увеличении срока наблюдения в группе пациенток с 8 и более ЦОК отмечается повышение частоты летальных исходов, однако при настоящей медиане наблюдения оценка возможна лишь на 2-летний период. Вероятно, с увеличением времени наблюдения нами будут получены более достоверные различия в ОВ при полученном пороговом значении.
Идентичным образом был проведен анализ влияния ЦОК на риск прогрессирования РМЖ. Так, мы установили, что ЦОК являются статистически значимым предиктором прогрессирования опухоли (AUC=0,890; 95% ДИ 0,741–1,000, p=0,017). Пороговое значение ЦОК в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 5 клеток. Прогрессирование прогнозировалось при значении ЦОК выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 100% и 75% соответственно (рис. 3).
При анализе ВБП в соответствии с выдвинутой гипотезой нами было установлено, что в группе пациентов с 5 и более ЦОК 2-летняя ВБП составила 5,6%, в группе с менее чем 5 ЦОК – 100% (р=0,008); рис. 4.
Мы оценили влияние качественного состава ЦОК (субпопуляций ЦОК отличных по экспрессии пан-эпителиальных маркеров, см. табл. 3) на прогноз заболевания. Так, 2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7% (р=0,096); рис. 5.
При оценке 2-летняя ВБП при фенотипе CAM5.2+ BEREP4+ составила 0%, при фенотипе CAM5.2+ BEREP4- – 42,9% (р=0,002); рис. 6.

Обсуждение
Несмотря на современный уровень развития онкологии, метастатические формы злокачественных новообразований не поддаются лечению с помощью ныне доступных методов и являются причиной 90% смертей у онкологических больных [14]. Средняя продолжительность жизни пациентов с МРМЖ составляет примерно 28 мес, варьируясь от нескольких месяцев до нескольких лет в зависимости от типа и локализации заболевания [15].Изучение ЦОК в контексте пациентов с диссеминированными формами злокачественных новообразований имеет огромное значение. Во-первых, интеграция данного параметра в системы прогнозирования позволит на начальном этапе выявлять пациенток высокого риска, которым будет требоваться модификация терапии, чтобы не позволить опухоли распространиться за пределы первичного очага, что должно значительно снизить долю пациентов с метастатическими формами злокачественных новообразований, которых в структуре РМЖ в настоящее время около 25% [16]. Во-вторых, изучение фенотипических характеристик ЦОК у пациенток позволит разработать более чувствительные и специфичные варианты терапии, которые будут эффективны в каждом конкретном случае.
В настоящее время анализ ЦОК не входит в стандарты диагностики для пациенток с РМЖ, несмотря на то что многие исследования подтвердили прочную корреляцию между количеством ЦОК и как ОВ, так и ВБП, особенно у пациенток с МРМЖ [17, 18]. Связан данный аспект со сложностью интерпретации полученных данных и относительно высокой стоимостью оборудования.
В рамках нашего исследования было установлено, что пороговым значением ЦОК, достоверно ухудшающим прогноз течения заболевания, является 8 и более клеток относительно ОВ и 5 и более клеток относительно ВБП в 7,5 мл крови больных с МРМЖ. Однако важно отметить, что мировой опыт демонстрирует более низкое пороговое значение количества ЦОК в контексте ОВ. Так, ряд работ определяет 5 и более клеток как максимально достоверное пороговое значение [19–21]. Данные различия могут быть связаны с числом больных в нашем исследовании (21 пациентка), которое могло внести коррективы в полученные результаты.
Кроме того, нами проанализированы уникальные иммунофенотипические характеристики ЦОК: различия в экспрессии цитокератинов 7 и 8, выявляемых антителом CAM 5.2 в цитоплазме клетки, и молекулы клеточной адгезии эпителиальных клеток (EpCam, пан-эпителиальный антиген), выявляемой на мембране клеток посредством антител BerEP4, стандартно применяемых в иммуногистохимической практике при характеристике эпителиальных опухолей [22, 23]. Так, нами были установлены две субпопуляции ЦОК, отличные по экспрессии цитокератинов и пан-эпителиальных антигенов, – CAM5.2+BEREP4+ и CAM5.2+BEREP4-. При этом фенотип CAM5.2+BEREP4+ оказался предиктором неблагоприятного исхода как со стороны ОВ (2-летняя ОВ при фенотипе CAM5.2+BEREP4+ составила 46,2%, при фенотипе CAM5.2+BEREP4- – 85,7%, р=0,096), так и со стороны ВБП (2-летняя ВБП при фенотипе CAM5.2+ BEREP4+ составила 0%, при фенотипе CAM5.2+ BEREP4- – 42,9%, р=0,002).
Данные результаты подтверждают гетерогенность ЦОК, что неразрывно связано с исходами терапии и ее адекватностью в каждом конкретном случае. У нашего исследования есть ограничение в виде относительно небольшой выборки, однако результаты работы представляют собой потенциально важные данные, которые требуют дальнейшего изучения и внедрения в клиническую практику.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Соблюдение прав пациентов и правил биоэтики. Все пациенты, включенные в исследование, получали лечение в рамках рутинной практики после подписания информированного согласия на лечение. Персональные данные пациентов не использовались при проведении исследования.
Compliance with patient rights and principles of bioethics. All included patients received therapy in routine clinical practice after obtaining of inform consent for the therapy. Personal patient’s data were not used in the study.
Финансирование. Исследование не имело спонсорской поддержки.
Funding. The work was performed without external funding.
Участие авторов. Все авторы в равной степени участвовали в подготовке публикации: разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Authors’ contribution. All authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Информация об авторах
Information about the authors
Абдо Иман Абдулкадер Абдулхалим – аспирант, каф. онкологии и рентгенорадиологии им. В.П. Харченко, ФГАОУ ВО «РУДН им. Патриса Лумумбы». ORCID: 0009-0002-6631-3862
Iman A.A. Abdo – Graduate Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). ORCID: 0009-0002-6631-3862
Фалалеева Наталья Александровна – д-р мед. наук, проф., зав. отделом лекарственного лечения злокачественных новообразований, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-0023-4216
Natalia A. Falaleeva – Dr. Sci. (Med.), Full Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-0023-4216
Гривцова Людмила Юрьевна – д-р биол. наук, канд. мед. наук, зав. отд-нием клинической иммунологии, МРНЦ им.
А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-9103-9688
Luydmila Yu. Grivtsova – Dr. Sci. (Biol.), Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-9103-9688
Галицына Анастасия Борисовна – студентка, Обнинский институт атомной энергетики – ИАТЭ НИЯУ МИФИ. ORCID: 0009-0009-0188-8420
Anastasia B. Galitsyna – Student, Obninsk Institute of Atomic Energy – branch National Research Nuclear University MEPhI. ORCID: 0009-0009-0188-8420
Пимонова Ирина Сергеевна – врач-онколог, отд-ние противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0009-0002-3355-6980
Irina S. Pimonova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0002-3355-6980
Белохвостова Анна Сергеевна – канд. мед. наук, зав. отд-нием противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-4709-1726
Anna S. Belokhvostova – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-4709-1726
Софийчук Александр Александрович – аспирант, врач-онколог, отд-ние противоопухолевой лекарственной терапии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
ORCID: 0009-0008-0769-1736
Aleksandr A. Sofiochuk – Graduate Student, Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0009-0008-0769-1736
Поступила в редакцию: 19.06.2025
Поступила после рецензирования: 30.06.2025
Принята к публикации: 03.07.2025
Received: 19.06.2025
Revised: 30.06.2025
Accepted: 03.07.2025
Список исп. литературыСкрыть список1. Chia SK, Speers CH, D'Yachkova Y et al. The impact of new chemotherapeutic and hormone agents on survival in a population-based cohort of women with metastatic breast cancer. Cancer 2007;110:973-9. DOI: 10.1002/cncr.22867
2. Pagani O, Senkus E, Wood W et al. International guidelines for management of metastatic breast cancer: can metastatic breast cancer be cured? J Natl Cancer Inst 2010;102:456-63. DOI: 10.1093/jnci/djq029
3. Andreopoulou E, Hortobagyi GN. Prognostic factors in metastatic breast cancer: successes and challenges toward individualized therapy. J Clin Oncol 2008;26:3660-2. DOI: 10.1200/JCO.2008.16.1026
4. Schaffner F, Merlin J-L, von Bubnoff N. Tumor Liquid Biopsies. Springer, 2020. DOI: 10.1007/978-3-030-26439-0
5. Cristofanilli M, Budd GT, Ellis MJ et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med 2004;351:781-91. DOI: 10.1056/NEJMoa040766
6. Dawood S, Broglio K, Valero V et al. Circulating tumor cells in metastatic breast cancer: from prognostic stratification to modification of the staging system? Cancer 2008;113:2422-2430. DOI: 10.1002/cncr.23852
7. Cristofanilli M, Hayes DF, Budd GT et al. Circulating tumor cells: a novel prognostic factor for newly diagnosed metastatic breast cancer. J Clin Oncol 2005;23:1420-30. DOI: 10.1200/JCO.2005.08.140
8. Hayes DF, Cristofanilli M, Budd GT et al. Circulating tumor cells at each follow-up time point during therapy of metastatic breast cancer patients predict progression-free and overall survival. Clin Cancer Res 2006;12:4218-24. DOI: 10.1158/1078-0432.CCR-05-2821
9. Liu MC, Shields PG, Warren RD et al. Circulating tumor cells: a useful predictor of treatment efficacy in metastatic breast cancer. J Clin Oncol 2009;27:5153-9. DOI: 10.1200/JCO.2008.20.6664
10. Burčík D, Macko J, Podrojková N et al. Role of Cell Adhesion in Cancer Metastasis Formation: A Review. ACS Omega 2025;10(6):5193-213. DOI: 10.1021/acsomega.4c08140. PMID: 39989825; PMCID: PMC11840620.
11. Wei J, Shen Y, Ouyang G. Determination of circulating tumor cells by surface-enhanced Raman scattering based on molecularly imprinted polymers doped with silver nanoparticles. Anal Sci 2025. Feb 25. DOI: 10.1007/s44211-025-00719-7. Epub ahead of print. PMID: 39998807
12. Зацаренко С.В., Гривцова Л.Ю., Мушкарина Т.Ю. Способ выявления циркулирующих в крови опухолевых клеток методом многопараметровой проточной цитометрии. Патент на изобретение RU 2825188, 21.08.2024, заявка №2024103239 от 09.02.2024.
Zatsarenko S.V., Grivtsova L.Yu., Mushkarina T.Yu. A method for detecting tumor cells circulating in the blood by multiparameter flow cytometry. Patent for invention RU 2825188, 08/21/2024, application No. 2024103239 dated 02/09/2024. (in Russian).
13. Nagata S. Early work on the function of CD95, an interview with Shige Nagata. Cell Death and Differentiation 2004;11(S1):S23-S27. DOI: 10.1038/sj.cdd.4401453. PMID 15143352
14. Guan X. Cancer metastases: challenges and opportunities. Acta Pharm Sin 2015;5:402-18. DOI: 10.1016/j.apsb.2015.07.005
15. Chia SK, Speers CH, D’yachkova Y et al. The impact of new chemotherapeutic and hormone agents on survival in a population-based cohort of women with metastatic breast cancer Cancer 2007;110:973-79.
16. Злокачественные новообразования в России в 2023 году (заболеваемость и смертность). Под ред. А.Д. Каприна и др. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии», 2024. ISBN: 978-5-85502-298-8.
Malignant neoplasms in Russia in 2023 (morbidity and mortality). Edited by A.D. Kaprin et al. Moscow: Herzen Moscow Oncology Research Institute – branch of National Medical Research Center for Radiology, 2024. ISBN: 978-5-85502-298-8 (in Russian).
17. Cristofanilli M, Budd GT, Ellis MJ et al. Circulating tumor cells, disease progression and survival in metastatic breast cancer. N Engl J Med 2004;351:781-91.
18. Paoletti C, Smerage J, Hayes DF et al. Circulating tumor cells as a marker of prognosis. In: Principle sand Practice of Oncology Updates. Eds: DeVita VT Jr, Lawrence TS, Rosenberg SA. 2012;1-8:26. New York, NY Wolters Kluwer Health, 2012.
19. Smerageet JB, Barlow WE, Hortobagyi GN et al. Circulating Tumor Cells and Response to Chemotherapy in Metastatic Breast Cancer: SWOGS0500. JCO 2014;32:3483-9. DOI: 10.1200/JCO.2014.56.2561
20. Dawood S, Broglio K, Valero V et al. Circulating tumor cells in metastatic breast cancer: from prognostic stratification to modification of the staging system? Cancer 2008;113(9):2422-30. DOI: 10.1002/cncr.23852. PMID: 18785255.
21. Giuliano M, Giordano A, Jackson S et al. Circulating tumor cells as prognostic and predictive markers in metastatic breast cancer patients receiving first-line systemic treatment. Breast Cancer Res 2011;13(3):R67. DOI: 10.1186/bcr2907. PMID: 21699723; PMCID: PMC3218956.
22. Chang KL, Chao WR, Han CP. Anticytokeratin (CAM5.2) reagent identifies cytokeratins 7 and 8, not cytokeratin 18. Chest 2014;145(6):1441-2. DOI: 10.1378/chest.14-0168. PMID 24889460BEREP
23. Sunjaya AP, Sunjaya AF, Tan ST. Ber-EP4 (Epithelial Cell Adhesion Molecule/EPCAM) Immunostain, Technical Component Only. Mayo Clinic Laboratories. Retrieved 2019-12-16. The Use of BEREP4 Immunohistochemistry Staining for Detection of Basal Cell Carcinoma. J Skin Cancer 2017:2692604. DOI: 10.1155/2017/2692604. ISSN 2090-2905. PMC 5804366
20 октября 2025
Количество просмотров: 206