Клинический разбор в общей медицине №9 2025
Клинический разбор в общей медицине №9 2025
Ранние и отдаленные последствия новой коронавирусной инфекции у пациентов с хронической сердечной недостаточностью: от теории к практике
Номера страниц в выпуске:95-102
Аннотация
Актуальность. Пациенты с хронической сердечной недостаточностью (ХСН) составляют группу высокого риска развития и прогрессирования основного заболевания после перенесенной новой коронавирусной инфекции (НКВИ).
Цель. Анализ течения ХСН у пациентов в раннем (3 мес) и отдаленном (12 мес) периоде после перенесенной НКВИ в рамках наблюдения на этапе первичного звена здравоохранения врачом терапевтом.
Материалы и методы. В проспективное исследование включено 35 пациентов с ХСН, перенесших НКВИ, мужчин – 12, женщин – 23, медиана возраста Ме (25; 75) – 67,5 (53,7; 76,2) года. Через 3 и 12 мес после перенесенной НКВИ проведено общеклиническое обследование, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ).
Результаты. За 12 мес наблюдения у большей части пациентов отмечено прогрессивное снижение физической активности, появление отечного синдрома, увеличилось число пациентов, отмечающих повышение артериального давления и увеличение частоты сердечных сокращений. По результатам ЭКГ и ЭхоКГ наблюдается увеличение количества пациентов с нарушениями ритма (предсердная и желудочковая экстрасистолия), прогрессирующее снижение фракции выброса, неадаптивное ремоделирование миокарда левого желудочка, что сопровождалось повышением среднего давления в легочной артерии.
Заключение. Пациенты с ХСН, перенесшие НКВИ, в течение первого года нуждаются в тщательном наблюдении и обследовании для своевременной оценки состояния и интенсификации медикаментозной терапии или решения вопроса о необходимости хирургического лечения. Клинический случай демонстрирует актуальность своевременной оценки состояния, показаний для интенсификации медикаментозной терапии и хирургического лечения для улучшения качества жизни, прогноза для жизни и здоровья пациента, минимизации инвалидизации и смертности от декомпенсации ХСН в раннем и позднем постковидном периоде.
Ключевые слова: хроническая сердечная недостаточность, новая коронавирусная инфекция, ранние, отдаленные последствия, клинические проявления, инструментальные особенности.
Для цитирования: Багишева Н.В., Моисеева М.В., Мордык А.В., Викторова И.А., Трухан Д.И., Стрельцова В.В., Антипова Е.П. Ранние и отдаленные последствия новой коронавирусной инфекции у пациентов с хронической сердечной недостаточностью: от теории к практике. Клинический разбор в общей медицине. 2025; 6 (9): 95–102. DOI: 10.47407/kr2025.6.9.00679
Актуальность. Пациенты с хронической сердечной недостаточностью (ХСН) составляют группу высокого риска развития и прогрессирования основного заболевания после перенесенной новой коронавирусной инфекции (НКВИ).
Цель. Анализ течения ХСН у пациентов в раннем (3 мес) и отдаленном (12 мес) периоде после перенесенной НКВИ в рамках наблюдения на этапе первичного звена здравоохранения врачом терапевтом.
Материалы и методы. В проспективное исследование включено 35 пациентов с ХСН, перенесших НКВИ, мужчин – 12, женщин – 23, медиана возраста Ме (25; 75) – 67,5 (53,7; 76,2) года. Через 3 и 12 мес после перенесенной НКВИ проведено общеклиническое обследование, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ).
Результаты. За 12 мес наблюдения у большей части пациентов отмечено прогрессивное снижение физической активности, появление отечного синдрома, увеличилось число пациентов, отмечающих повышение артериального давления и увеличение частоты сердечных сокращений. По результатам ЭКГ и ЭхоКГ наблюдается увеличение количества пациентов с нарушениями ритма (предсердная и желудочковая экстрасистолия), прогрессирующее снижение фракции выброса, неадаптивное ремоделирование миокарда левого желудочка, что сопровождалось повышением среднего давления в легочной артерии.
Заключение. Пациенты с ХСН, перенесшие НКВИ, в течение первого года нуждаются в тщательном наблюдении и обследовании для своевременной оценки состояния и интенсификации медикаментозной терапии или решения вопроса о необходимости хирургического лечения. Клинический случай демонстрирует актуальность своевременной оценки состояния, показаний для интенсификации медикаментозной терапии и хирургического лечения для улучшения качества жизни, прогноза для жизни и здоровья пациента, минимизации инвалидизации и смертности от декомпенсации ХСН в раннем и позднем постковидном периоде.
Ключевые слова: хроническая сердечная недостаточность, новая коронавирусная инфекция, ранние, отдаленные последствия, клинические проявления, инструментальные особенности.
Для цитирования: Багишева Н.В., Моисеева М.В., Мордык А.В., Викторова И.А., Трухан Д.И., Стрельцова В.В., Антипова Е.П. Ранние и отдаленные последствия новой коронавирусной инфекции у пациентов с хронической сердечной недостаточностью: от теории к практике. Клинический разбор в общей медицине. 2025; 6 (9): 95–102. DOI: 10.47407/kr2025.6.9.00679
Original Article
Victoria V. Streltsova, Ekaterina P. Antipova
Omsk State Medical University, Omsk, Russia
ppi100@mail.ru
Abstract
Relevance. Patients with chronic heart failure (CHF) are at high risk of developing and progressing the underlying disease after a new coronavirus infection (NCVI).
Aim. The aim of this study was to analyze the course of CHF in patients in the early (3 months) and late (12 months) periods after NCVI during observation at the primary health care stage by a general practitioner.
Materials and methods. The prospective study included 35 patients with CHF who had undergone NCVI, 12 men, 23 women, median age Me (25; 75) – 67.5 (53.7; 76.2) years. A general clinical examination, ECG, and echocardiography were performed 3 and 12 months after NCVI.
Results. Over 12 months of observation, most patients showed a progressive decrease in physical activity, the appearance of edema syndrome, and an increase in the number of patients reporting increased blood pressure and heart rate. According to the results of ECG and EchoCG, an increase in the number of patients with rhythm disturbances (atrial and ventricular extrasystole), a progressive decrease in EF, non-adaptive remodeling of the LV myocardium, which was accompanied by an increase in SPPA, is observed.
Conclusion. Patients with CHF who have undergone NCVI need careful monitoring and examination during the first year for timely assessment of the condition and intensification of drug therapy or a decision on the need for surgical treatment. The clinical case demonstrates the relevance of timely assessment of the condition, indications for intensification of drug therapy and surgical treatment to improve the quality of life, prognosis for the life and health of the patient, minimization of disability and mortality from decompensation of CHF in the early and late post-mortem period.
Keywords: chronic heart failure, new coronavirus infection, early, late consequences, clinical manifestations, instrumental features.
For citation: Bagisheva N.V., Moiseeva M.V., Mordyk A.V., Viktorova I.A., Trukhan D.I., Streltsova V.V., Antipova E.P. Early and long-term consequences of the new coronavirus infection in patients with chronic heart failure: from theory to practice. Clinical review for general practice. 2025; 6 (9): 95–102 (In Russ.). DOI: 10.47407/kr2025.6.9.00679
Новая коронавирусная инфекция (НКВИ), вызванная вирусом SARS-CoV-2, стала грозной пандемией, которая поражает не только дыхательную систему, но и создает значительные проблемы для пациентов с фоновой хронической сердечной недостаточностью (ХСН). Поражение сердечно-сосудистой системы обусловлено несколькими составляющими: прямое вирусное повреждение миокарда, системная воспалительная реакция, нарушение регуляции ренин-ангиотензин-альдостероновой системы (РААС) с последующими гемодинамическими нарушениями. Изменения не завершаются с окончанием НКВИ. Ранние последствия COVID-19 у этих пациентов также носят многофакторный характер. Пациенты с ХСН представляют собой уязвимую субпопуляцию, поскольку их ограниченный сердечный резерв и уже существующие структурные и функциональные нарушения предрасполагают к неблагоприятным исходам при инфицировании COVID-19 [1]. Эти процессы способствуют возникновению острых случаев сердечной недостаточности, повышению уровня биомаркеров, изменению результатов визуализации и неблагоприятным клиническим исходам, включая повышенную внутрибольничную смертность.
Сочетание прямого вирусного повреждения, нарушения регуляции РААС и цитокин-индуцированного поражения миокарда создает среду, в которой даже субклиническая сердечная дисфункция может быстро прогрессировать до явной СН [2] или обусловливает развитие декомпенсации ХСН после перенесенной инфекции у ранее компенсированных пациентов [2].
Повышенные уровни сердечных биомаркеров, таких как высокочувствительный тропонин I и N-концевой про-B-тип натрийуретический пептид (NT-proBNP), обычно обнаруживаются у этой популяции пациентов, выступая в качестве индикаторов повреждения миокарда и сосудистой стенки [3].
К клиническим проявлениям прогрессирования ХСН могут быть отнесены развитие аритмий, в частности фибрилляция предсердий и различные желудочковые аритмии, усугубляющие нарушение гемодинамики [4].
Поздние последствия инфекции COVID-19 у пациентов с ХСН представляют собой многогранную клиническую единицу, характеризующуюся стойким повреждением миокарда, прогрессирующим структурным ремоделированием и сохраняющимся функциональным нарушением, которое может привести к дальнейшей декомпенсации работы сердца с течением времени [4].
Long-COVID-19 рассматривается в литературе как фаза последствий инфекции SARS-CoV-2 и признается критическим периодом, в течение которого у пациентов с уже существующей ХСН наблюдается дальнейшее ухудшение функции сердца, стойкое продолжающееся системное воспалительное повреждение и развитие структурных изменений сердца, которые также предрасполагают к аритмиям и отдаленным событиям сердечной недостаточности, в том числе развитием астенического, отечного, аритмического, бронхообструктивного синдромов с последующей декомпенсацией ХСН [5].
В исследовании А.А Агеева и соавт. (2022) отмечено, что статистически значимое снижение фракции выброса левого желудочка (ФВЛЖ) произошло в группе у пациентов с низкой или умеренно сниженной ФВ [6]. Увеличение среднего давления в легочной артерии (СДЛА) наблюдалось у большинства пациентов с ХСН независимо от ФВ [6].
Таким образом, пациенты с ХСН составляют особую группу риска тяжелого течения COVID-19 и очень высокого риска проявления осложнений. Утяжеление течения ХСН на фоне перенесенной коронавирусной инфекции возможно в связи с присоединением типичных для COVID-19 дыхательной недостаточности, фиброзных изменений в легочной ткани и усугубления сердечно-легочной недостаточности. В соответствии с этим, изучение отдельных аспектов течения ХСН в различные временные промежутки после перенесенной НКВИ остается актуальным при организации диспансерного наблюдения пациентов с ХСН в рамках первичного звена здравоохранения.
Цель исследования: анализ течения ХСН у пациентов в раннем (3 мес) и отдаленном (12 мес) периоде после перенесенной НКВИ в рамках наблюдения на этапе первичного звена здравоохранения врачом терапевтом.
Статистическая обработка данных проводилась с помощью пакета прикладных программ Statistica 10. Анализируемые данные не подчинялись закону нормального распределения, поэтому использовались непараметрические методы (критерий χ2).
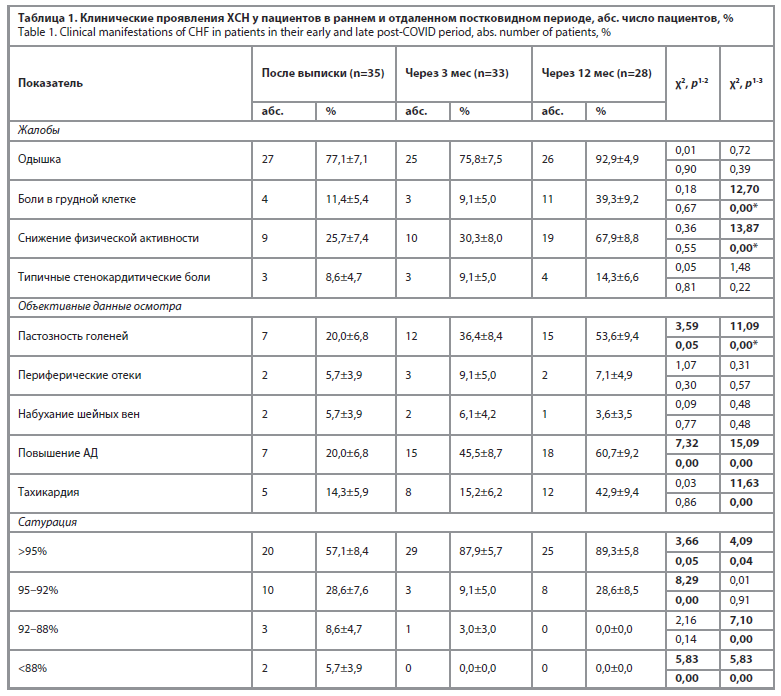
По результатам динамического наблюдения через 3 мес часть пациентов обращали внимание на появление пастозности голеней и тахикардии, в течение 12 мес большая часть пациентов отмечали значимое нарастание клинической симптоматики в виде снижения физической активности (исходно – 25% респондентов, через 12 мес – 67,9%; χ2=13,87; p=0,00), появления пастозности голеней (20% и 53,6% пациентов; χ2=11,09; p=0,00), тахикардии (14,3% исходно и 43,9% пациентов через 12 мес; χ2=11,63; p=0,00) у пациентов с ХСН, что может расцениваться как проявление декомпенсации хронической неинфекционной патологии в исходе НКВИ. Полученные нами результаты соотносятся с данными других авторов, в работах которых акцент был на пациентов с артериальной гипертензией и перенесенной НКВИ, что повышает вероятность прогрессирования заболевания и развития осложнений [11, 12].
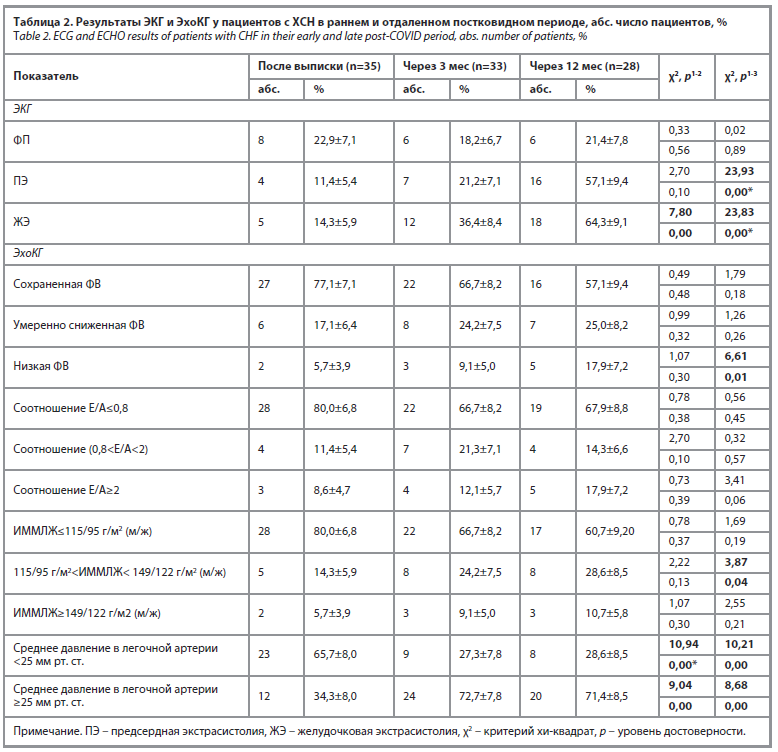
По результатам инструментального обследования через 3 мес увеличилось число пациентов, у которых отмечалось появление желудочковой экстрасистолии, а по данным ЭхоКГ – увеличение СДЛА. Через 12 мес обращает на себя внимание статистически значимое увеличение числа пациентов с нарушениями ритма: предсердная экстрасистолия исходно отмечалась по ЭКГ
у 11,4% респондентов, через 12 мес – у 57,1% (χ2=23,93; p=0,00), желудочковая экстрасистолия у 14,3% и 64,3% соответственно (χ2=23,83; p=0,00), прогрессирующее снижение ФВ (после выписки из стационара низкую ФВ имели 5,7% респондентов, через 12 мес – 17,9%; χ2=6,61; p=0,01), неадаптивное ремоделирование миокарда ЛЖ (115/95 г/м2<ИММЛЖ<149/122 г/м2 (м/ж) 14,3% и 26,8% соответственно; χ2=3,87; p=0,04), что сопровождалось повышением СДЛА≥25 мм рт. ст. (34,3% пациентов после выписки и 71,4% – через 12 мес; χ2=8,68; p=0,00). Это соотносится с данными других авторов, в работах которых акцент был на пациентов с ХСН с низкой ФВ [6], что делает эту группу уязвимой в отношении необратимого прогрессирования заболевания, повышая вероятность фатальных сердечно-сосудистых событий, смертности от всех причин [13].
Представленные в табл. 1 и 2 данные динамического наблюдения актуализируют необходимость ранней интенсификации медикаментозной терапии и, при необходимости, своевременного привлечения смежных специалистов с целью оказания специализированной, высокотехнологичной медицинской помощи [14].
Нами представлен клинический случай последствий COVID-19 у пациента с декомпенсацией ХСН в анамнезе. Мужчина 1955 г.р. (70 лет).
Анамнез заболевания: считает себя больным с 2006 г., когда после острой респираторной вирусной инфекции появилась одышка, сердцебиение, повысилось артериальное давление (АД) до 160/100 мм рт. ст. Проходил стационарное лечение по поводу острого миокардита, выявлена гипертоническая болезнь III стадии, по ЭхоКГ – гипертрофия миокарда ЛЖ, ФВ – 55%. После выписки наблюдался у кардиолога, рекомендованные препараты принимал регулярно. С мая 2015 г. появились отеки голеней, усилилась одышка, неоднократно проводилось стационарное лечение с декомпенсацией ХСН. В декабре 2015 г. стационарное лечение в Клиническом кардиологическом диспансере (ККД) с декомпенсацией ХСН. В течение семи лет наблюдался в ККД: гипертоническая болезнь III стадии, риск IV, контролируемая артериальная гипертензия. ХСН с сохраненной ФВ. Самочувствие стабильное, по лабораторно-инструментальным показателям без отрицательной динамики. Постоянно принимал: спиронолактон 25 мг/сут, метопролола сукцинат 25 мг/сут, периндоприл 5 мг/сут.
В декабре 2022 г. был госпитализирован по поводу НКВИ (ПЦР-тест COVID-19+), по мультиспиральной компьютерной томографии органов грудной клетки (МСКТ ОГК) – поражение легких 25%, получал лечение: фавипиравир 600 мг 2 раз в сутки, апиксабан 5 мг 2 раза в день, дексаметазон 20 мг/сут, кислородотерапия 4 дня (сатурация SpO2 – 94%). Выписан с улучшением состояния, по МСКТ ОГК – поражение легких 5%, но в клинической картине отмечал одышку, пастозность голеней и стоп, значительное снижение физической активности. Неоднократно обращался к участковому терапевту в течение 3–4 мес, амбулаторно проведена коррекция терапии: принимал Торасемид 10 мг регулярно, Спиронолактон 25 мг, метопролола сукцинат 25 мг/сут, периндоприл 5 мг/сут. В начале мая 2023 г. отмечал ухудшение самочувствия в течение двух недель, нарастание одышки, появление приступов удушья в горизонтальном положении. В мае 2023 г. госпитализирован в ККД с декомпенсацией ХСН, при выписке ЭхоКГ от 23.05.2023 – ФВЛЖ 36%.
Анамнез жизни: туберкулез, вирусный гепатит, венерологические заболевания, гемотрансфузии, медикаментозную аллергию, вредные привычки отрицает. Наследственность отягощена артериальной гипертензией по материнской линии, ишемической болезнью сердца, острым нарушением мозгового кровообращения – по отцовской линии. В анамнезе хронический геморрой, вне обострения. На фоне приема ривароксабана 20 мг появление крови в стуле.
Данные объективного обследования 18.05.2023: состояние средней степени тяжести; сознание ясное; положение активное; грудная клетка правильной формы, симметрична. В акте дыхания участвуют обе половины. Частота дыхательных движений – 22 в минуту. Перкуторно легочный звук. Аускультативно дыхание жесткое, хрипов нет, ослаблено справа в нижних отделах. Пульс – 90 в минуту, регулярный, S=D, удовлетворительного наполнения и напряжения. Пульсация артерий стоп сохранена. АД – 110/70 мм рт. ст. Границы сердца: правая по краю грудины, верхняя – III межреберье, левая – +1,0 см влево от левой среднеключичной линии. Тоны сердца ритмичные, приглушены, систолический шум во всех точках аускультации. Живот мягкий, безболезненный, увеличен за счет подкожно жировой клетчатки. Край печени выступает из-под края реберной дуги на 2 см, плотно-эластичный, ровный. Селезенка не пальпируется. Отеки бедер, голеней и стоп, плотные, холодные.
Результаты исследований. ЭхоКГ от 23.05.2023. Аорта уплотнена, синусы Вальсальвы – 3,2 см, индексированный размер – 1,8 см/м2, восходящий отдел аорты – 3,2 см, индексированный размер – 1,8 см/м2. Предсердия: левое предсердие – 5,0 см, S – 23,0 см2, объем левого предсердия – 79,0 мл, индексированный объем левого предсердия – 44,9 см/м2; правое предсердие – 4,3×3,1 см, S – 12,0 см2, объем правого предсердия – 31,0 мл, индексированный объем правого предсердия – 7,6 см/м2. ЛЖ: конечно-диастолический размер – 5,6 см, конечный систолический размер – 4,1 см, межжелудочковая перегородка (МЖП) – 1,2 см, задняя стенка ЛЖ (ЗСЛЖ) – 1,0 см, конечный диастолический объем (КДО) Simpson biplane – 130 мл, конечный систолический объем (КСО) Simpson biplane – 83,0 мл, ударный объем (УО) Simpson biplane – 46,0 мл, ФВ Simpson biplane – 36,0%, ИММЛЖ по ASE – 125,3 г/м2. Правый желудочек: срединный размер – 2,5 см, TAPSE – 2,4 мм. Диастолическая функция ЛЖ Емк/Амк – 1,3. Среднее давление в легочной артерии – 38 мм рт. ст. Повышена эхогенность стенок аорты и створок аортального клапана, аортальный клапан фиброзно изменен с кальцинатами на створках, ФК – 3,4 см, раскрытие створок – 1,1 см, аортальная регургитация 2-й степени, vena contracta – 4,9 мм, повышен максимальный градиент давления через клапан. Повышена эхогенность створок митрального клапана, митральная регургитация 2-й степени. Трикуспидальный клапан не изменен, трикуспидальная регургитация 3-й степени, V – 3,6 м/с, систолическое давление в легочной артерии – 38,0 мм рт. ст. Листки перикарда не изменены, эхо-свободное пространство в диастолу по задней стенке ЛЖ – 3 мм. Септальные дефекты не визуализируются, при цветовом допплеровском картировании (ЦДК) потоков транссептального сброса не зарегистрировано. Сократительная способность миокарда: глобальная сократительная способность миокарда ЛЖ снижена.
Комментарии. Исследование на фоне синусового ритма, зарегистрированы частые одиночные и парные предсердные экстрасистолы. Увеличены левые отделы сердца. Гипертрофия МЖП. ИММЛЖ увеличен. Гипертрофия миокарда ЛЖ (ИММЛЖ – 125,3 г/м2). Систолическая функция ЛЖ: ФВ – 36% по Симпсону. Диастолическая функция ЛЖ изменена. Легочная артерия расширена (диаметр – 3,3 см), в просвете ствола и ветвей легочной артерии дополнительных образований не выявлено. Нижняя полая вена расширена, не коллабирует. Систолическое давление в легочной артерии повышено. Дополнительных образований, характерных для вегетаций, на клапанном аппарате сердца достоверно не лоцируется.
Заключение. Диффузные склерогенные изменения сердца. Умеренно выраженная недостаточность аортального клапана. Умеренно выраженная недостаточность митрального клапана. Недостаточность
трикуспидального клапана умеренная. Дилатация левых полостей со снижением глобальной сократительной способности ЛЖ. Признаки диастолической дисфункции ЛЖ. Признаки легочной гипертензии.
МСКТ ОГК (24.05.2023): КТ-признаки перибронхиальных уплотнений в сегменте S6,7 левого легкого (более вероятно поствоспалительного характера), легочной гипертензии, кардиомегалии.
Общий анализ крови (21.05.2023): гемоглобин – 145 г/л, эритроциты – 4,93×1012/л, тромбоциты – 202×109/л, гематокрит – 31,4%, СОЭ – 24 мм/ч, эозинофилы – 2%, палочкоядерные нейтрофилы – 2%, сегментоядерные нейтрофилы – 61%, лимфоциты – 32%, моноциты – 3%.
Общий анализ мочи (21.05.2023): цвет желтый, реакция кислая, прозрачная, лейкоциты 0–1 в поле зрения, ед. клетки эпителия в поле зрения, слизь – ед. в поле зрения, глюкоза – отрицательный результат.
Биохимический анализ крови (21.05.2023): протромбиновый индекс – 32%, международное нормализованное отношение – 2,06, билирубин общий – 25,6 мкмоль/л, прямой – 12,2 мкмоль/л, непрямой – 13,7 мкмоль/л, гамма-глутамилтрансфераза – 140 Е/л, щелочная фосфатаза – 319 Е/л, креатинфосфокиназа – 65 Е/л, креатинфосфокиназа-МВ – 32 Е/л, лактатдегидрогеназа – 355 Е/л, общий белок – 8 г/л, альбумин – 41 г/л, калий – 3,6 ммоль/л, натрий – 135,0 ммоль/л, аспартатаминотрансфераза – 28 Е/л, аланинаминотранс-фераза – 25 Е/л, креатинин – 105 мкмоль/л.
ЭКГ (22.05.2023): электрическая ось QRS не отклонена. Метаболические изменения в миокарде.
Липидный спектр (21.05.2023): холестерин – 2,8 ммоль/л, триглицериды – 1,23 ммоль/л, липопротеины высокой плотности – 0,78 ммоль/л, липопротеины низкой плотности – 1,46 ммоль/л.
Иммуноферментный анализ на NT-proBNP (21.05.2023): 385,1 пг/мл.
Диагноз. Основной: стабильная ишемическая болезнь сердца, ишемическая кардиомиопатия. Осложнения: ХСН II со сниженной ФВ (36%), III функциональный класс, декомпенсация, недостаточность аортального клапана.
Сопутствующий: гипертоническая болезнь, стадия III, риск IV, артериальная гипертензия контролируемая, целевое АД достигнуто, дисциркуляторная энцефалопатия.
Лечение: режим полупостельный. Медикаментозное лечение: торасемид 10 мг регулярно, спиронолактон 50 мг, метопролола сукцинат 25 мг/сут, валсартан/сакубитрил 100 мг/сут, дапаглифлозин 10 мг.
Учитывая данные ЭхоКГ (увеличение диаметра аорты более 3,0 см; наличие аортальной регургитации 2-й степени; повышение СДЛА более 25 мм рт. ст.), пациенту было предложено хирургическое лечение (протезирование аортального клапана) [14], от которого он отказался.
В последующие 9 мес дважды стационарное лечение по поводу декомпенсации ХСН, интенсификация медикаментозной терапии: торасемид 10 мг регулярно, эплеренон 50 мг/сут, метопролола сукцинат 50 мг/сут, валсартан/сакубитрил 200 мг/сут, дапаглифлозин 10 мг. Несмотря на проводимую терапию, отмечалось нарастание одышки, выраженное снижение переносимости физических нагрузок до уровня самообслуживания, снижение АД до 80/56 мм рт. ст.
В мае 2024 г. после получения согласия пациента на оперативное лечение проведена трансапикальная транскатеторная имплантация аортального клапана в Научно-исследовательском институте кардиологии Томского национального исследовательского медицинского центра.
После проведения стационарного и санаторного этапов реабилитации пациент отмечал улучшение переносимости физических нагрузок, уменьшение одышки, нормализацию показателей АД.
Через 6 мес после проведенного оперативного лечения (ноябрь 2024 г.) выполнена ЭхоКГ. Аорта уплотнена, синусы Вальсальвы – 3,0 см, индексированный размер – 1,8 см/м2, восходящий отдел аорты – 3,0 см, индексированный размер – 1,8 см/м2. Предсердия: левое предсердие – 4,5 см; S – 19,0 см2, объем левого предсердия – 60,0 мл, индексированный объем левого предсердия – 34,1 мл/м2; правое предсердие – 4,2×3,1 см; S – 12,0 см2, объем правого предсердия – 32,0 мл, индексированный объем правого предсердия – 18,3 мл/м2.
ЛЖ: конечно-диастолический размер – 4,8 см, конечнo-систолический размер – 3,2 см, МЖП – 1,1 см, ЗСЛЖ – 1,0 см, КДО Simpson biplane – 122,0 мл, КСО Simpson biplane – 69,0 мл, УО Simpson biplane – 53,0 мл, ФВ Simpson biplane – 43,0%, ИММЛЖ по ASE – 122,1 г/м2. Правый желудочек: срединный размер – 2,8 см. Диастолическая функция ЛЖ Емк/Амк 0.8. Повышена эхогенность створок митрального клапана, митральная регургитация 1-й степени. Трикуспидальный клапан не изменен, трикуспидальная регургитация 1-й степени, V – 2,3 м/с, систолическое давление в легочной артерии – 27 мм рт. ст. Листки перикарда не изменены, эхо-свободное пространство в диастолу не визуализируется. Септальные дефекты не визуализируются, при ЦДК потоков транссептального сброса не зарегистрировано. Сократительная способность: глобальная сократительная способность миокарда ЛЖ снижена.
Комментарии. Полости сердца не увеличены. Толщина и экскурсия стенок в пределах нормы. ИММЛЖ увеличен. Гипертрофия миокарда ЛЖ (ИММЛЖ – 122,1 г/м2). Небольшое уплотнение МЖП. Систолическая функция ЛЖ снижена. ФВ – 43% по Симпсону. Диастолическая функция ЛЖ не изменена. Легочная артерия не расширена (диаметр – 2,0 см). Нижняя полая вена не расширена.
Заключение. Состояние после протезирования аортального клапана. Пиковый градиент на протезе аортального клапана 17 мм рт. ст. Снижение глобальной сократительной способности. Признаки концентрического ремоделирования ЛЖ. Недостаточность трикуспидального клапана.
В настоящее время (май 2025 г.) самочувствие пациента удовлетворительно, переносимость физических нагрузок хорошая, отеков нет, одышки нет, АД стабильное. Медикаментозная терапия: периндоприл/индапамид 4,0/1,25 в день, метопролола сукцинат 25 мг/сут, дапаглифлозин 10 мг.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Дополнительного финансирования не предусмотрено.
Funding. There is no extra funding.
Информация об авторах
Information about the authors
Багишева Наталья Викторовна – д-р мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Natalya V. Bagisheva – Dr. Sci. (Med.), Omsk State Medical University. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Моисеева Марина Викторовна – канд. мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: lisnyak80@mail.ru; ORCID: 0000-0003-3458-9346
Marina V. Moiseeva – Cand. Sci. (Med.), Omsk State Medical University. E-mail: lisnyak80@mail.ru; ORCID: 0000-0003-3458-9346
Мордык Анна Владимировна – д-р мед. наук, проф., зав. каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО ОмГМУ. E-mail: amordik@mail.ru; ORCID: 0000-0001-6196-7256
Anna V. Mordyk – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. E-mail: amordik@mail.ru; ORCID: 0000-0001-6196-7256
Викторова Инна Анатольевна – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: vic-inna@mail.ru; ORCID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. E-mail: vic-inna@mail.ru; ORCID: 0000-0001-8728-2722
Трухан Дмитрий Иванович – д-р мед. наук, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ.
E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Стрельцова Виктория Витальевна – соискатель каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО ОмГМУ. E-mail: vstrl1611@gmail.com; ORCID: 0009-0006-4188-1133
Victoria V. Streltsova – Candidate, Omsk State Medical University. E-mail: vstrl1611@gmail.com; ORCID: 0009-0006-4188-1133
Антипова Екатерина Петровна – ассистент каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО
ОмГМУ. E-mail: eantipova74@mail.ru; ORCID: 0000-0001-7138-3182
Ekaterina P. Antipova – Аssistant, Omsk State Medical University. E-mail: eantipova74@mail.ru; ORCID: 0000-0001-7138-3182
Поступила в редакцию: 07.07.2025
Поступила после рецензирования: 17.07.2025
Принята к публикации: 24.07.2025
Received: 07.07.2025
Revised: 17.07.2025
Accepted: 24.07.2025
Early and long-term consequences of the new coronavirus infection in patients with chronic heart failure: from theory to practice
Natalya V. Bagisheva, Marina V. Moiseeva, Anna V. Mordyk, Inna A. Viktorova, Dmitry I. Trukhan,Victoria V. Streltsova, Ekaterina P. Antipova
Omsk State Medical University, Omsk, Russia
ppi100@mail.ru
Abstract
Relevance. Patients with chronic heart failure (CHF) are at high risk of developing and progressing the underlying disease after a new coronavirus infection (NCVI).
Aim. The aim of this study was to analyze the course of CHF in patients in the early (3 months) and late (12 months) periods after NCVI during observation at the primary health care stage by a general practitioner.
Materials and methods. The prospective study included 35 patients with CHF who had undergone NCVI, 12 men, 23 women, median age Me (25; 75) – 67.5 (53.7; 76.2) years. A general clinical examination, ECG, and echocardiography were performed 3 and 12 months after NCVI.
Results. Over 12 months of observation, most patients showed a progressive decrease in physical activity, the appearance of edema syndrome, and an increase in the number of patients reporting increased blood pressure and heart rate. According to the results of ECG and EchoCG, an increase in the number of patients with rhythm disturbances (atrial and ventricular extrasystole), a progressive decrease in EF, non-adaptive remodeling of the LV myocardium, which was accompanied by an increase in SPPA, is observed.
Conclusion. Patients with CHF who have undergone NCVI need careful monitoring and examination during the first year for timely assessment of the condition and intensification of drug therapy or a decision on the need for surgical treatment. The clinical case demonstrates the relevance of timely assessment of the condition, indications for intensification of drug therapy and surgical treatment to improve the quality of life, prognosis for the life and health of the patient, minimization of disability and mortality from decompensation of CHF in the early and late post-mortem period.
Keywords: chronic heart failure, new coronavirus infection, early, late consequences, clinical manifestations, instrumental features.
For citation: Bagisheva N.V., Moiseeva M.V., Mordyk A.V., Viktorova I.A., Trukhan D.I., Streltsova V.V., Antipova E.P. Early and long-term consequences of the new coronavirus infection in patients with chronic heart failure: from theory to practice. Clinical review for general practice. 2025; 6 (9): 95–102 (In Russ.). DOI: 10.47407/kr2025.6.9.00679
Новая коронавирусная инфекция (НКВИ), вызванная вирусом SARS-CoV-2, стала грозной пандемией, которая поражает не только дыхательную систему, но и создает значительные проблемы для пациентов с фоновой хронической сердечной недостаточностью (ХСН). Поражение сердечно-сосудистой системы обусловлено несколькими составляющими: прямое вирусное повреждение миокарда, системная воспалительная реакция, нарушение регуляции ренин-ангиотензин-альдостероновой системы (РААС) с последующими гемодинамическими нарушениями. Изменения не завершаются с окончанием НКВИ. Ранние последствия COVID-19 у этих пациентов также носят многофакторный характер. Пациенты с ХСН представляют собой уязвимую субпопуляцию, поскольку их ограниченный сердечный резерв и уже существующие структурные и функциональные нарушения предрасполагают к неблагоприятным исходам при инфицировании COVID-19 [1]. Эти процессы способствуют возникновению острых случаев сердечной недостаточности, повышению уровня биомаркеров, изменению результатов визуализации и неблагоприятным клиническим исходам, включая повышенную внутрибольничную смертность.
Сочетание прямого вирусного повреждения, нарушения регуляции РААС и цитокин-индуцированного поражения миокарда создает среду, в которой даже субклиническая сердечная дисфункция может быстро прогрессировать до явной СН [2] или обусловливает развитие декомпенсации ХСН после перенесенной инфекции у ранее компенсированных пациентов [2].
Повышенные уровни сердечных биомаркеров, таких как высокочувствительный тропонин I и N-концевой про-B-тип натрийуретический пептид (NT-proBNP), обычно обнаруживаются у этой популяции пациентов, выступая в качестве индикаторов повреждения миокарда и сосудистой стенки [3].
К клиническим проявлениям прогрессирования ХСН могут быть отнесены развитие аритмий, в частности фибрилляция предсердий и различные желудочковые аритмии, усугубляющие нарушение гемодинамики [4].
Поздние последствия инфекции COVID-19 у пациентов с ХСН представляют собой многогранную клиническую единицу, характеризующуюся стойким повреждением миокарда, прогрессирующим структурным ремоделированием и сохраняющимся функциональным нарушением, которое может привести к дальнейшей декомпенсации работы сердца с течением времени [4].
Long-COVID-19 рассматривается в литературе как фаза последствий инфекции SARS-CoV-2 и признается критическим периодом, в течение которого у пациентов с уже существующей ХСН наблюдается дальнейшее ухудшение функции сердца, стойкое продолжающееся системное воспалительное повреждение и развитие структурных изменений сердца, которые также предрасполагают к аритмиям и отдаленным событиям сердечной недостаточности, в том числе развитием астенического, отечного, аритмического, бронхообструктивного синдромов с последующей декомпенсацией ХСН [5].
В исследовании А.А Агеева и соавт. (2022) отмечено, что статистически значимое снижение фракции выброса левого желудочка (ФВЛЖ) произошло в группе у пациентов с низкой или умеренно сниженной ФВ [6]. Увеличение среднего давления в легочной артерии (СДЛА) наблюдалось у большинства пациентов с ХСН независимо от ФВ [6].
Таким образом, пациенты с ХСН составляют особую группу риска тяжелого течения COVID-19 и очень высокого риска проявления осложнений. Утяжеление течения ХСН на фоне перенесенной коронавирусной инфекции возможно в связи с присоединением типичных для COVID-19 дыхательной недостаточности, фиброзных изменений в легочной ткани и усугубления сердечно-легочной недостаточности. В соответствии с этим, изучение отдельных аспектов течения ХСН в различные временные промежутки после перенесенной НКВИ остается актуальным при организации диспансерного наблюдения пациентов с ХСН в рамках первичного звена здравоохранения.
Цель исследования: анализ течения ХСН у пациентов в раннем (3 мес) и отдаленном (12 мес) периоде после перенесенной НКВИ в рамках наблюдения на этапе первичного звена здравоохранения врачом терапевтом.
Материалы и методы
В простое проспективное исследование включено 35 пациентов, страдающих ХСН, получивших стационарное лечение по поводу НКВИ, далее находившихся под наблюдением участкового терапевта. Среди них мужчин – 12, женщин – 23. Медиана возраста Ме (25; 75) – 67,5 (53,7; 76,2) года. Пациенты, выписанные из стационара, находились под наблюдением терапевта Центральной республиканской больницы Полтавского района Омской области после перенесенной НКВИ. Кратность наблюдения и обследования – не реже двух раз в год; пациенты приглашались на прием через 3 мес, через 12 мес. Объем обследования включал оценку жалоб пациента, данных объективного и инструментального обследования (электрокардиография – ЭКГ, эхокардиография – ЭхоКГ). По ЭКГ оценивалось наличие у пациентов эпизодов фибрилляции предсердий и/или предсердной, желудочковой экстрасистолии. По ЭхоКГ – индекс массы миокарда левого желудочка (ИММЛЖ), ФВ, СДЛА [7–10].Статистическая обработка данных проводилась с помощью пакета прикладных программ Statistica 10. Анализируемые данные не подчинялись закону нормального распределения, поэтому использовались непараметрические методы (критерий χ2).
Результаты и обсуждение
Исходно было обследовано 35 пациентов, через 3 мес на контрольный визит явились 33 пациента (2 пациента отказались от дальнейшего обследования и наблюдения), через год от начала наблюдения – 28 пациентов (3 пациента отказались от дальнейшего обследования и наблюдения, 1 пациент выехал в другой регион, 1 – летальный исход).По результатам динамического наблюдения через 3 мес часть пациентов обращали внимание на появление пастозности голеней и тахикардии, в течение 12 мес большая часть пациентов отмечали значимое нарастание клинической симптоматики в виде снижения физической активности (исходно – 25% респондентов, через 12 мес – 67,9%; χ2=13,87; p=0,00), появления пастозности голеней (20% и 53,6% пациентов; χ2=11,09; p=0,00), тахикардии (14,3% исходно и 43,9% пациентов через 12 мес; χ2=11,63; p=0,00) у пациентов с ХСН, что может расцениваться как проявление декомпенсации хронической неинфекционной патологии в исходе НКВИ. Полученные нами результаты соотносятся с данными других авторов, в работах которых акцент был на пациентов с артериальной гипертензией и перенесенной НКВИ, что повышает вероятность прогрессирования заболевания и развития осложнений [11, 12].
По результатам инструментального обследования через 3 мес увеличилось число пациентов, у которых отмечалось появление желудочковой экстрасистолии, а по данным ЭхоКГ – увеличение СДЛА. Через 12 мес обращает на себя внимание статистически значимое увеличение числа пациентов с нарушениями ритма: предсердная экстрасистолия исходно отмечалась по ЭКГ
у 11,4% респондентов, через 12 мес – у 57,1% (χ2=23,93; p=0,00), желудочковая экстрасистолия у 14,3% и 64,3% соответственно (χ2=23,83; p=0,00), прогрессирующее снижение ФВ (после выписки из стационара низкую ФВ имели 5,7% респондентов, через 12 мес – 17,9%; χ2=6,61; p=0,01), неадаптивное ремоделирование миокарда ЛЖ (115/95 г/м2<ИММЛЖ<149/122 г/м2 (м/ж) 14,3% и 26,8% соответственно; χ2=3,87; p=0,04), что сопровождалось повышением СДЛА≥25 мм рт. ст. (34,3% пациентов после выписки и 71,4% – через 12 мес; χ2=8,68; p=0,00). Это соотносится с данными других авторов, в работах которых акцент был на пациентов с ХСН с низкой ФВ [6], что делает эту группу уязвимой в отношении необратимого прогрессирования заболевания, повышая вероятность фатальных сердечно-сосудистых событий, смертности от всех причин [13].
Представленные в табл. 1 и 2 данные динамического наблюдения актуализируют необходимость ранней интенсификации медикаментозной терапии и, при необходимости, своевременного привлечения смежных специалистов с целью оказания специализированной, высокотехнологичной медицинской помощи [14].


Нами представлен клинический случай последствий COVID-19 у пациента с декомпенсацией ХСН в анамнезе. Мужчина 1955 г.р. (70 лет).
Анамнез заболевания: считает себя больным с 2006 г., когда после острой респираторной вирусной инфекции появилась одышка, сердцебиение, повысилось артериальное давление (АД) до 160/100 мм рт. ст. Проходил стационарное лечение по поводу острого миокардита, выявлена гипертоническая болезнь III стадии, по ЭхоКГ – гипертрофия миокарда ЛЖ, ФВ – 55%. После выписки наблюдался у кардиолога, рекомендованные препараты принимал регулярно. С мая 2015 г. появились отеки голеней, усилилась одышка, неоднократно проводилось стационарное лечение с декомпенсацией ХСН. В декабре 2015 г. стационарное лечение в Клиническом кардиологическом диспансере (ККД) с декомпенсацией ХСН. В течение семи лет наблюдался в ККД: гипертоническая болезнь III стадии, риск IV, контролируемая артериальная гипертензия. ХСН с сохраненной ФВ. Самочувствие стабильное, по лабораторно-инструментальным показателям без отрицательной динамики. Постоянно принимал: спиронолактон 25 мг/сут, метопролола сукцинат 25 мг/сут, периндоприл 5 мг/сут.
В декабре 2022 г. был госпитализирован по поводу НКВИ (ПЦР-тест COVID-19+), по мультиспиральной компьютерной томографии органов грудной клетки (МСКТ ОГК) – поражение легких 25%, получал лечение: фавипиравир 600 мг 2 раз в сутки, апиксабан 5 мг 2 раза в день, дексаметазон 20 мг/сут, кислородотерапия 4 дня (сатурация SpO2 – 94%). Выписан с улучшением состояния, по МСКТ ОГК – поражение легких 5%, но в клинической картине отмечал одышку, пастозность голеней и стоп, значительное снижение физической активности. Неоднократно обращался к участковому терапевту в течение 3–4 мес, амбулаторно проведена коррекция терапии: принимал Торасемид 10 мг регулярно, Спиронолактон 25 мг, метопролола сукцинат 25 мг/сут, периндоприл 5 мг/сут. В начале мая 2023 г. отмечал ухудшение самочувствия в течение двух недель, нарастание одышки, появление приступов удушья в горизонтальном положении. В мае 2023 г. госпитализирован в ККД с декомпенсацией ХСН, при выписке ЭхоКГ от 23.05.2023 – ФВЛЖ 36%.
Анамнез жизни: туберкулез, вирусный гепатит, венерологические заболевания, гемотрансфузии, медикаментозную аллергию, вредные привычки отрицает. Наследственность отягощена артериальной гипертензией по материнской линии, ишемической болезнью сердца, острым нарушением мозгового кровообращения – по отцовской линии. В анамнезе хронический геморрой, вне обострения. На фоне приема ривароксабана 20 мг появление крови в стуле.
Данные объективного обследования 18.05.2023: состояние средней степени тяжести; сознание ясное; положение активное; грудная клетка правильной формы, симметрична. В акте дыхания участвуют обе половины. Частота дыхательных движений – 22 в минуту. Перкуторно легочный звук. Аускультативно дыхание жесткое, хрипов нет, ослаблено справа в нижних отделах. Пульс – 90 в минуту, регулярный, S=D, удовлетворительного наполнения и напряжения. Пульсация артерий стоп сохранена. АД – 110/70 мм рт. ст. Границы сердца: правая по краю грудины, верхняя – III межреберье, левая – +1,0 см влево от левой среднеключичной линии. Тоны сердца ритмичные, приглушены, систолический шум во всех точках аускультации. Живот мягкий, безболезненный, увеличен за счет подкожно жировой клетчатки. Край печени выступает из-под края реберной дуги на 2 см, плотно-эластичный, ровный. Селезенка не пальпируется. Отеки бедер, голеней и стоп, плотные, холодные.
Результаты исследований. ЭхоКГ от 23.05.2023. Аорта уплотнена, синусы Вальсальвы – 3,2 см, индексированный размер – 1,8 см/м2, восходящий отдел аорты – 3,2 см, индексированный размер – 1,8 см/м2. Предсердия: левое предсердие – 5,0 см, S – 23,0 см2, объем левого предсердия – 79,0 мл, индексированный объем левого предсердия – 44,9 см/м2; правое предсердие – 4,3×3,1 см, S – 12,0 см2, объем правого предсердия – 31,0 мл, индексированный объем правого предсердия – 7,6 см/м2. ЛЖ: конечно-диастолический размер – 5,6 см, конечный систолический размер – 4,1 см, межжелудочковая перегородка (МЖП) – 1,2 см, задняя стенка ЛЖ (ЗСЛЖ) – 1,0 см, конечный диастолический объем (КДО) Simpson biplane – 130 мл, конечный систолический объем (КСО) Simpson biplane – 83,0 мл, ударный объем (УО) Simpson biplane – 46,0 мл, ФВ Simpson biplane – 36,0%, ИММЛЖ по ASE – 125,3 г/м2. Правый желудочек: срединный размер – 2,5 см, TAPSE – 2,4 мм. Диастолическая функция ЛЖ Емк/Амк – 1,3. Среднее давление в легочной артерии – 38 мм рт. ст. Повышена эхогенность стенок аорты и створок аортального клапана, аортальный клапан фиброзно изменен с кальцинатами на створках, ФК – 3,4 см, раскрытие створок – 1,1 см, аортальная регургитация 2-й степени, vena contracta – 4,9 мм, повышен максимальный градиент давления через клапан. Повышена эхогенность створок митрального клапана, митральная регургитация 2-й степени. Трикуспидальный клапан не изменен, трикуспидальная регургитация 3-й степени, V – 3,6 м/с, систолическое давление в легочной артерии – 38,0 мм рт. ст. Листки перикарда не изменены, эхо-свободное пространство в диастолу по задней стенке ЛЖ – 3 мм. Септальные дефекты не визуализируются, при цветовом допплеровском картировании (ЦДК) потоков транссептального сброса не зарегистрировано. Сократительная способность миокарда: глобальная сократительная способность миокарда ЛЖ снижена.
Комментарии. Исследование на фоне синусового ритма, зарегистрированы частые одиночные и парные предсердные экстрасистолы. Увеличены левые отделы сердца. Гипертрофия МЖП. ИММЛЖ увеличен. Гипертрофия миокарда ЛЖ (ИММЛЖ – 125,3 г/м2). Систолическая функция ЛЖ: ФВ – 36% по Симпсону. Диастолическая функция ЛЖ изменена. Легочная артерия расширена (диаметр – 3,3 см), в просвете ствола и ветвей легочной артерии дополнительных образований не выявлено. Нижняя полая вена расширена, не коллабирует. Систолическое давление в легочной артерии повышено. Дополнительных образований, характерных для вегетаций, на клапанном аппарате сердца достоверно не лоцируется.
Заключение. Диффузные склерогенные изменения сердца. Умеренно выраженная недостаточность аортального клапана. Умеренно выраженная недостаточность митрального клапана. Недостаточность
трикуспидального клапана умеренная. Дилатация левых полостей со снижением глобальной сократительной способности ЛЖ. Признаки диастолической дисфункции ЛЖ. Признаки легочной гипертензии.
МСКТ ОГК (24.05.2023): КТ-признаки перибронхиальных уплотнений в сегменте S6,7 левого легкого (более вероятно поствоспалительного характера), легочной гипертензии, кардиомегалии.
Общий анализ крови (21.05.2023): гемоглобин – 145 г/л, эритроциты – 4,93×1012/л, тромбоциты – 202×109/л, гематокрит – 31,4%, СОЭ – 24 мм/ч, эозинофилы – 2%, палочкоядерные нейтрофилы – 2%, сегментоядерные нейтрофилы – 61%, лимфоциты – 32%, моноциты – 3%.
Общий анализ мочи (21.05.2023): цвет желтый, реакция кислая, прозрачная, лейкоциты 0–1 в поле зрения, ед. клетки эпителия в поле зрения, слизь – ед. в поле зрения, глюкоза – отрицательный результат.
Биохимический анализ крови (21.05.2023): протромбиновый индекс – 32%, международное нормализованное отношение – 2,06, билирубин общий – 25,6 мкмоль/л, прямой – 12,2 мкмоль/л, непрямой – 13,7 мкмоль/л, гамма-глутамилтрансфераза – 140 Е/л, щелочная фосфатаза – 319 Е/л, креатинфосфокиназа – 65 Е/л, креатинфосфокиназа-МВ – 32 Е/л, лактатдегидрогеназа – 355 Е/л, общий белок – 8 г/л, альбумин – 41 г/л, калий – 3,6 ммоль/л, натрий – 135,0 ммоль/л, аспартатаминотрансфераза – 28 Е/л, аланинаминотранс-фераза – 25 Е/л, креатинин – 105 мкмоль/л.
ЭКГ (22.05.2023): электрическая ось QRS не отклонена. Метаболические изменения в миокарде.
Липидный спектр (21.05.2023): холестерин – 2,8 ммоль/л, триглицериды – 1,23 ммоль/л, липопротеины высокой плотности – 0,78 ммоль/л, липопротеины низкой плотности – 1,46 ммоль/л.
Иммуноферментный анализ на NT-proBNP (21.05.2023): 385,1 пг/мл.
Диагноз. Основной: стабильная ишемическая болезнь сердца, ишемическая кардиомиопатия. Осложнения: ХСН II со сниженной ФВ (36%), III функциональный класс, декомпенсация, недостаточность аортального клапана.
Сопутствующий: гипертоническая болезнь, стадия III, риск IV, артериальная гипертензия контролируемая, целевое АД достигнуто, дисциркуляторная энцефалопатия.
Лечение: режим полупостельный. Медикаментозное лечение: торасемид 10 мг регулярно, спиронолактон 50 мг, метопролола сукцинат 25 мг/сут, валсартан/сакубитрил 100 мг/сут, дапаглифлозин 10 мг.
Учитывая данные ЭхоКГ (увеличение диаметра аорты более 3,0 см; наличие аортальной регургитации 2-й степени; повышение СДЛА более 25 мм рт. ст.), пациенту было предложено хирургическое лечение (протезирование аортального клапана) [14], от которого он отказался.
В последующие 9 мес дважды стационарное лечение по поводу декомпенсации ХСН, интенсификация медикаментозной терапии: торасемид 10 мг регулярно, эплеренон 50 мг/сут, метопролола сукцинат 50 мг/сут, валсартан/сакубитрил 200 мг/сут, дапаглифлозин 10 мг. Несмотря на проводимую терапию, отмечалось нарастание одышки, выраженное снижение переносимости физических нагрузок до уровня самообслуживания, снижение АД до 80/56 мм рт. ст.
В мае 2024 г. после получения согласия пациента на оперативное лечение проведена трансапикальная транскатеторная имплантация аортального клапана в Научно-исследовательском институте кардиологии Томского национального исследовательского медицинского центра.
После проведения стационарного и санаторного этапов реабилитации пациент отмечал улучшение переносимости физических нагрузок, уменьшение одышки, нормализацию показателей АД.
Через 6 мес после проведенного оперативного лечения (ноябрь 2024 г.) выполнена ЭхоКГ. Аорта уплотнена, синусы Вальсальвы – 3,0 см, индексированный размер – 1,8 см/м2, восходящий отдел аорты – 3,0 см, индексированный размер – 1,8 см/м2. Предсердия: левое предсердие – 4,5 см; S – 19,0 см2, объем левого предсердия – 60,0 мл, индексированный объем левого предсердия – 34,1 мл/м2; правое предсердие – 4,2×3,1 см; S – 12,0 см2, объем правого предсердия – 32,0 мл, индексированный объем правого предсердия – 18,3 мл/м2.
ЛЖ: конечно-диастолический размер – 4,8 см, конечнo-систолический размер – 3,2 см, МЖП – 1,1 см, ЗСЛЖ – 1,0 см, КДО Simpson biplane – 122,0 мл, КСО Simpson biplane – 69,0 мл, УО Simpson biplane – 53,0 мл, ФВ Simpson biplane – 43,0%, ИММЛЖ по ASE – 122,1 г/м2. Правый желудочек: срединный размер – 2,8 см. Диастолическая функция ЛЖ Емк/Амк 0.8. Повышена эхогенность створок митрального клапана, митральная регургитация 1-й степени. Трикуспидальный клапан не изменен, трикуспидальная регургитация 1-й степени, V – 2,3 м/с, систолическое давление в легочной артерии – 27 мм рт. ст. Листки перикарда не изменены, эхо-свободное пространство в диастолу не визуализируется. Септальные дефекты не визуализируются, при ЦДК потоков транссептального сброса не зарегистрировано. Сократительная способность: глобальная сократительная способность миокарда ЛЖ снижена.
Комментарии. Полости сердца не увеличены. Толщина и экскурсия стенок в пределах нормы. ИММЛЖ увеличен. Гипертрофия миокарда ЛЖ (ИММЛЖ – 122,1 г/м2). Небольшое уплотнение МЖП. Систолическая функция ЛЖ снижена. ФВ – 43% по Симпсону. Диастолическая функция ЛЖ не изменена. Легочная артерия не расширена (диаметр – 2,0 см). Нижняя полая вена не расширена.
Заключение. Состояние после протезирования аортального клапана. Пиковый градиент на протезе аортального клапана 17 мм рт. ст. Снижение глобальной сократительной способности. Признаки концентрического ремоделирования ЛЖ. Недостаточность трикуспидального клапана.
В настоящее время (май 2025 г.) самочувствие пациента удовлетворительно, переносимость физических нагрузок хорошая, отеков нет, одышки нет, АД стабильное. Медикаментозная терапия: периндоприл/индапамид 4,0/1,25 в день, метопролола сукцинат 25 мг/сут, дапаглифлозин 10 мг.
Заключение
Данное клиническое исследование демонстрирует высокую вероятность декомпенсации ХСН у пациента старше 65 лет после СOVID-19. Что определяет необходимость клинического и инструментального мониторинга функционирования сердечно-сосудистой системы для интенсификации не только медикаментозной терапии, но и своевременного осуществления высокотехнологичной медицинской помощи (хирургического лечения).Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Дополнительного финансирования не предусмотрено.
Funding. There is no extra funding.
Информация об авторах
Information about the authors
Багишева Наталья Викторовна – д-р мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Natalya V. Bagisheva – Dr. Sci. (Med.), Omsk State Medical University. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Моисеева Марина Викторовна – канд. мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: lisnyak80@mail.ru; ORCID: 0000-0003-3458-9346
Marina V. Moiseeva – Cand. Sci. (Med.), Omsk State Medical University. E-mail: lisnyak80@mail.ru; ORCID: 0000-0003-3458-9346
Мордык Анна Владимировна – д-р мед. наук, проф., зав. каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО ОмГМУ. E-mail: amordik@mail.ru; ORCID: 0000-0001-6196-7256
Anna V. Mordyk – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. E-mail: amordik@mail.ru; ORCID: 0000-0001-6196-7256
Викторова Инна Анатольевна – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: vic-inna@mail.ru; ORCID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. E-mail: vic-inna@mail.ru; ORCID: 0000-0001-8728-2722
Трухан Дмитрий Иванович – д-р мед. наук, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ.
E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Стрельцова Виктория Витальевна – соискатель каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО ОмГМУ. E-mail: vstrl1611@gmail.com; ORCID: 0009-0006-4188-1133
Victoria V. Streltsova – Candidate, Omsk State Medical University. E-mail: vstrl1611@gmail.com; ORCID: 0009-0006-4188-1133
Антипова Екатерина Петровна – ассистент каф. фтизиатрии, пульмонологии и инфекционных болезней, ФГБОУ ВО
ОмГМУ. E-mail: eantipova74@mail.ru; ORCID: 0000-0001-7138-3182
Ekaterina P. Antipova – Аssistant, Omsk State Medical University. E-mail: eantipova74@mail.ru; ORCID: 0000-0001-7138-3182
Поступила в редакцию: 07.07.2025
Поступила после рецензирования: 17.07.2025
Принята к публикации: 24.07.2025
Received: 07.07.2025
Revised: 17.07.2025
Accepted: 24.07.2025
Список исп. литературыСкрыть список1. Italia L, Tomasoni D, Bisegna S et al. COVID-19 and heart Failure: from epidemiology during the pandemic to myocardial injury, myocarditis, and heart failure sequelae. Frontiers in cardiovascular medicine 2021;8:713560. DOI: 10.3389/fcvm.2021.713560
2. Onohuean H, Al-Kuraishy HM, Al-Gareeb AI et al. COVID-19 and development of heart failure: mystery and truth. Archives of Pharmacology 2021;396:2013-21. DOI: 10.1007/s00210-021-02147-6
3. Goyal P, Reshetnyak E, Khan S et al. Clinical characteristics and outcomes of adults with a history of heart failure hospitalized for COVID-19. Safford Circulation: Heart Failure 2021;14(9). DOI: 10.1161/CIRCHEARTFAILURE.121.008354
4. Bader F, Manla Y, Atallah B et al. Heart failure and COVID-19. Starling Heart failure reviews 2020;26:1-10. DOI: 10.1007/s10741-020-10008-2
5. Tomasoni D, Italia L, Adamo M et al. COVID-19 and heart failure: from infection to inflammation and angiotensin II stimulation. Searching for evidence from a new disease. Journal of Heart Failure 2020;22(6):957-66. DOI: 10.1002/ejhf.1871
6. Агеев А.А., Кожевникова М.В., Емельянов А.В. и др. Влияние перенесенной инфекции COVID-19 на функциональные изменения сердца в отдаленном периоде у пациентов с хронической сердечной недостаточностью. Кардиология. 2022;62(12):23-9. DOI: 10.18087/cardio.2022.12.n2265
Ageev A.A., Kozhevnikova M.V., Emel'yanov A.V. et al. The impact of previous COVID-19 infection on functional changes in the heart in the long term in patients with chronic heart failure. Kardiologiya 2022;62(12):23-9 DOI: 10.18087/cardio.2022.12.n2265 (in Russian).
7. Драпкина О.М., Джиоева О.Н. Современные эхокардиографические критерии сердечной недостаточности с сохраненной фракцией выброса: не только диастолическая дисфункция. Кардиоваскулярная терапия и профилактика. 2020;19(2):2454. DOI: 10.15829/1728-8800-2020-2454
Drapkina O.M., Dzhioeva O.N. Modern echocardiographic criteria for heart failure with preserved ejection fraction: not only diastolic dysfunction. Cardiovascular therapy and prevention. 2020;19(2):2454. DOI: 10.15829/1728-8800-2020-2454 (in Russian).
8. Хроническая сердечная недостаточность. Клинические рекомендации Минздрава России. М., 2024. URL: https://cr.minzdrav. gov.ru/preview-cr/156_2
Chronic heart failure. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2024.URL: https://cr.minzdrav.gov.ru/preview-cr/156_2 (in Russian).
9. Рекомендации ESC/EACTS по ведению пациентов с клапанной болезнью сердца. Российский кардиологический журнал. 2022;27(7):5160.
ESC/EACTS recommendations for the management of patients with valvular heart disease. Russian Journal of Cardiology. 2022;27(7):5160. DOI: 10.15829/1560-4071-2022-5160 (in Russian).
10. Легочная гипертензия, в том числе хроническая, тромбоэмболическая. Клинические рекомендации Минздрава России. М., 2024. URL: https://cr.minzdrav.gov.ru/preview-cr/159_2.
Pulmonary hypertension, including chronic, thromboembolic. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2024. URL: https://cr.minzdrav.gov.ru/preview-cr/156_2 (in Russian).
11. Золотовская И.А., Гиматдинова Г.Р., Давыдкин И.Л. Артериальная гипертензия у пациентов, перенесших COVID-19: особенности и возможности коррекции артериального давления. Профилактическая медицина. 2022;25(1):63-70. DOI: 10.17116/profmed20222501163
Zolotovskaya I.A., Gimatdinova G.R., Davydkin I.L. Arterial hypertension in patients who have undergone COVID-19: features and possibilities of blood pressure correction. Russian Journal of Preventive Medicine. 2022;25(1):63-70. DOI: 10.17116/profmed2022250116 3 (in Russian).
12. Антипова Е.П., Моисеева М.В., Багишева Н.В. и др. COVID-19 в когорте пациентов с артериальной гипертензией: роль рецепторов ангиотензинпревращающего фермента. Забайкальский медицинский вестник. 2023;(1):104-112. DOI: 10.52485/19986173_2023_1_104
Antipova E.P., Moiseeva M.V., Bagisheva N.V. et al. COVID-19 in a group of patients with arterial hypertension: the role of angiotensin-converting enzyme receptors. Zabaikalsky medical Bulletin. 2023;(1):104-12. DOI: 10.52485/19986173_2023_1_104 (in Russian).
13. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г. и др. Анализ влияния препаратов базовой терапии, применявшихся для лечения сопутствующих заболеваний в период, предшествующий инфицированию, на риск летального исхода при НКВИ. Данные международного регистра «Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2» (AКТИВ SARS-CoV-2). Кардиология. 2021;61(9):20-32. DOI: 10.18087/cardio.2021.9.n1680
Arutyunov G.P., Tarlovskaya E.I., Arutyunov A.G. et al. Analysis of the effect of basic therapy drugs used to treat concomitant diseases in the period preceding infection on the risk of death in a new coronavirus infection. Data from the international registry "Analysis of the dynamics of comorbid diseases in patients who have had SARS-CoV-2 infection" (SARS-CoV-2 ACTIVE). Kardiologiya. 2021;61(9):20-32. DOI: 10.18087/cardio.2021.9.n1680 (in Russian).
14. Бартош-Зеленая С.Ю., Найден Т.В., Гусева О.А. Современные подходы к эхокардиографической оценке тяжелой аортальной регургитации, показания к хирургическому лечению. Кардиология: новости, мнения, обучение. 2023;11(2):40-51.
Bartosh-Zelenaya S.Yu., Nayden T.V., Guseva O.A. Modern approaches to echocardiographic assessment of severe aortic regurgitation, indications for surgical treatment. Cardiology: news, opinions, training. 2023; 11(2):40-51. DOI: 10.33029/2309-1908-2023-11-2-40-51 (in Russian).