Клинический разбор в общей медицине №9 2025
Ural State Medical University, Ekaterinburg, Russia
inna-reznik2008@yandex.ru
Abstract
This paper analyzes aspects of the efficacy and safety of antiarrhythmic drugs in the treatment of atrial fibrillation. It considers drug-drug interactions of antiarrhythmics with other drugs, especially in the near circle, i.e. with anticoagulants, and outlines the principles of choosing the optimal antiarrhythmic therapy to prevent recurrent episodes of atrial fibrillation, stop arrhythmia paroxysms, and control heart rate. Particular attention is paid to the development of cardiac and extracardiac side effects that occur when using antiarrhythmic drugs, as well as topical issues in managing patients with atrial fibrillation.
Keywords: atrial fibrillation, rational pharmacotherapy, antiarrhythmic and anticoagulant drugs, drug interactions.
For citation: Bozhko Ya.G., Reznik I.I., Arkhipov M.V. Therapy for patient with atrial fibrillation: in search of a balance between efficacy and safety. Clinical review for general practice. 2025; 6 (9): 104–109 (In Russ.). DOI: 10.47407/kr2025.6.9.00680
В Российской Федерации сердечно-сосудистые заболевания по-прежнему являются основной причиной смертности и инвалидизации населения, в том числе лиц трудоспособного возраста. В структуре кардиологической патологии значительное место занимают нарушения сердечного ритма, среди которых наиболее распространенной аритмией является фибрилляция предсердий (ФП), опасная развитием грозных
кардиоэмболических осложнений. Развитие ФП неклапанного происхождения сопряжено не только с ухудшением качества жизни, но и с неблагоприятным прогнозом для большинства пациентов [1, 2].
В настоящее время убедительно показано, что неклапанная ФП – это заболевание с многофакторной этиологией. При том что нередко в развитии ФП ведущую роль играет генетическая предрасположенность, основное значение имеет ассоциация аритмии с коморбидными состояниями (артериальной гипертонией, сахарным диабетом, ожирением, хронической сердечной недостаточностью, синдромом обструктивного апноэ-гипопноэ сна, а также с гастроэзофагеальной рефлюксной болезнью, патологией гастро-дуоденальной зоны, заболеваниями щитовидной железы и др.) и модифицируемыми поведенческиими факторами (употреблением алкоголя, избыточным потреблением пищи в вечернее время) [3]. Также сегодня много внимания уделяется и нетрадиционным факторам риска ФП, включая факторы нездорового сна (работа в ночную смену), биомаркеры (микробиота кишечника, гиперурикемия, гомоцистеин), неблагоприятные состояния или заболевания (депрессия, эпилепсия, инфекции, астма) [4]. Ввиду вышесказанного, большое значение в патогенетическом лечении ФП приобретает не только upstream-терапия, предотвращающая развитие структурного ремоделирования предсердий, но и контроль коморбидной патологии, модификация образа жизни, питания, средовых воздействий. При этом важнейшими компонентами лечения, влияющими на прогноз, остаются антиаритмическая и антикоагулянтная терапия [5].
В последние годы появились убедительные данные в пользу стратегии контроля ритма, которая сопряжена с более благоприятными исходами, нежели чем контроль частоты сердечных сокращений [6]. Амиодарон является одним из наиболее часто используемых антиаритмических препаратов (ААП), но его применение ограничивается побочными эффектами, особенно если это касается пожилых пациентов. Из некардиальных побочных эффектов при приеме амиодарона наиболее часто встречаются нарушение функции щитовидной железы, причем в сторону как гипо-, так и гипертиреоза, фотосенсибилизация, микроотложения в роговице. Более редкие, но опасные осложнения включают развитие легочного фиброза, «амиодаронового сердца» и лекарственного гепатита. Все это обусловлено высокой липофильностью препарата, длительным периодом его полувыведения, а также выраженным накоплением во многих органах. В целом частота возникновения побочных эффектов при применении амиодарона достигает 70%. При длительном лечении амиодароном пациентам важно регулярно контролировать функцию щитовидной железы, уровень трансаминаз, проходить рентгенологическое исследование легких, а также наблюдаться у офтальмолога [7].
Важно отметить, что на фоне приема амиодарона существует потенциальная угроза удлинения интервала QT и развития жизнеугрожающей пируэтной желудочковой тахикардии. В этой связи в процессе динамического наблюдения за пациентами кардиологам важно отслеживать длительность интервала QT, что может послужить поводом для снижения дозы или отмены амиодарона с заменой его на прием бета-адреноблокатора. У ослабленных, пожилых больных, пациентов с сердечной недостаточностью доза амиодарона не должна превышать 100–200 мг/сут, нередко разделенная на два приема. Комбинации амиодарона с другими ААП являются нежелательными. Например, в случае сопутствующего применения бета-адреноблокатора доза последнего должна быть существенно снижена из-за риска развития клинически значимой брадикардии [8].
Еще один важный нюанс при применении амиодарона: для восстановления ритма категорически не рекомендуется введение препарата болюсно из-за риска развития парадоксального амиодаронового коллапса. На развитие данного жизнеугрожающего побочного эффекта существенно влияют скорость введения препарата, его концентрация, а также индивидуальная чувствительность бета-адренорецепторов аорты. В данном аспекте очень важно, что амиодарон не выводится из организма даже с помощью процедуры гемодиализа. Для восстановления ритма при необходимости использования амиодарона лучше предпочесть медленное внутривенное капельное введение препарата при его разведении в растворе глюкозы объемом не менее 250 мл. Необходимо помнить, что в случае использования амиодарона быстрого восстановления ритма обычно не наблюдается, но, как правило, на практике в суточном интервале ритм восстановить удается. [8] Дополнительная дотация калия и магния, например в виде аспарагинатного комплексного соединения, позволяет на четверть увеличить вероятность восстановления синусового ритма [9].
В связи с частыми побочными эффектами, наблюдаемыми при применении амиодарона, нередко возникает необходимость его замены на другие ААП, особенно на препараты I класса по классификации Vaughan Williams [10]. Эта замена возможна только при отсутствии выраженной органической патологии сердца (ВОПС), под которой понимают постинфарктный кардиосклероз, острые формы ишемической болезни сердца, хроническую сердечную недостаточность со сниженной фракцией выброса, гипертрофию левого желудочка более 1,4 см, полную блокаду ножек пучка Гиса [11]. Некоторые препараты IА класса, такие как дизопирамид и хинидин, утратили свою клиническую значимость, в то время как препараты IC класса (пропафенон, этацизин и аллапинин), вызывают особый интерес [12]. Пропафенон на сегодняшний день имеет наиболее убедительную доказательную базу своей эффективности и включен в европейские клинические рекомендации по лечению ФП, в то время как аллапинин и этацизин фигурируют лишь в отечественных рекомендациях [13].
Пропафенон, будучи блокатором быстрых натриевых каналов, дополнительно обладает бета-адреноблокирующими свойствами, что усиливает его антиаритмический эффект. Исследование ПРОМЕТЕЙ-ИНСК, в котором участвовали 388 пациентов с ФП длительностью менее года без структурных изменений сердца, оценивало сравнительную эффективность и скорость восстановления синусового ритма при внутривенном введении амиодарона или пропафенона. Оба препарата показали сопоставимую эффективность, однако восстановление ритма происходило быстрее в группе пропафенона (22 мин) по сравнению с группой амиодарона (110 мин). Учитывая данные этого исследования и наличие токсического профиля амиодарона, был сделан вывод, что амиодарон не следует рассматривать в качестве препарата 1-й линии для неотложной терапии пациентов с недавно возникшей ФП при отсутствии ВОПС [14]. В то же время пропафенон, эффективно восстанавливающий ритм при ФП, является единственным препаратом, который можно использовать в режиме «таблетка в кармане» для купирования приступов аритмии в домашних условиях в дозировке 300 мг перорально сразу и 300 мг per os повторно через 1 ч. При внутривенном капельном введении начальная доза пропафенона составляет 500 мкг/кг, при необходимости ее увеличивают до 1–2 мг/кг [15].
Наряду с купированием пароксизмов ФП важной задачей является предотвращение рецидивов аритмии. Согласно рекомендациям по диагностике и лечению пациентов с ФП, для поддержания синусового ритма с высоким уровнем доказательности могут применяться амиодарон, пропафенон и соталол. В плане эффективности противорецидивной терапии ФП наиболее сильным ААП является амиодарон, однако в вопросах безопасности наилучший профиль продемонстрировал пропафенон. Наиболее неблагоприятным оказалось применение соталола, обусловленное тем, что препарат способен значительно удлинять интервал QT, причем в большей степени, чем амиодарон, в результате резко возрастает риск развития тахикардии «torsades de pointеs» [16].
Соталол, используемый как ААП, представляет собой неселективный бета-адреноблокатор, который в повышенных концентрациях блокирует также калиевые каналы. Его применение возможно при лечении как желудочковых, так и наджелудочковых тахиаритмий, включая пациентов с ишемической болезнью сердца.
В суточной дозе до 160 мг соталол действует как бета-адреноблокатор и может быть использован для контроля частоты сердечных сокращений при ФП. Восстановление синусового ритма соталолом в настоящее время не рекомендуется ввиду высокой частоты возникновения проаритмических побочных эффектов. Пациентам с постинфарктным кардиосклерозом данный препарат назначают в дозе, не превышающей 160 мг в день, разделенной на несколько приемов, а при хронической сердечной недостаточности с фракцией выброса менее 40% применение соталола противопоказано. При снижении скорости клубочковой фильтрации менее 60 мл/мин дозу соталола следует уменьшить на четверть, а при клиренсе креатинина менее 40 мл/мин препарат желательно отменить [17].
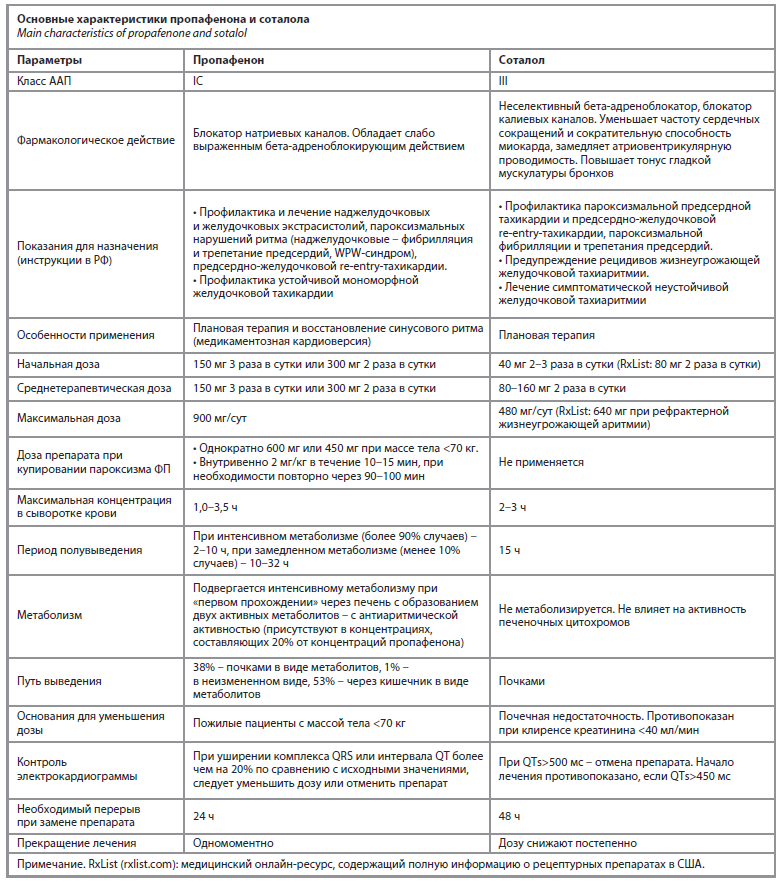
Основные характеристики, которые необходимо учитывать при назначении пропафенона и соталола, представлены в таблице [18].
При назначении ААП важно учитывать их фармакокинетическое взаимодействие с антикоагулянтами (ближний круг). В связи с печеночным метаболизмом амиодарона с участием изоферментов цитохрома P450 нескольких подсемейств (CYP1A2, 2C9, 2D6, ЗА4 и др.), существует высокий риск межлекарственных взаимодействий, наиболее опасным из которых является взаимодействие с варфарином. Оно опосредовано подсемействами цитохрома P-450 СYP 2D6 и 3А4. Одновременное назначение этих препаратов существенно увеличивает риск кровотечений, поэтому при необходимости применения амиодарона предпочтительнее назначение прямых оральных антикоагулянтов (ПОАК) [19, 20].
В отличие от амиодарона, пропафенон меньше влияет на метаболизм варфарина, в связи с чем не требуется альтернативных решений, но сохраняется необходимость тщательного контроля международного нормализованного отношения. Пропафенон также имеет преимущества во взаимодействии с ПОАК: препарат не влияет на их метаболизм, в то время как амиодарон усиливает действие дабигатрана и менее значимо – ривароксабана и апиксабана [21].
Соталол практически не подвергается метаболизму в печени (менее 1%), поэтому не влияет на активность изоферментов цитохрома Р450 и не вступает в фармакокинетические взаимодействия с другими лекарственными средствами. Тем не менее следует избегать одновременного приема соталола с препаратами, способными удлинять интервал QT, такими как противомикробные средства (макролиды, фторхинолоны) и некоторые антидепрессанты [17].
Система транспортных белков P-гликопротеинов (P-gp) играет важную роль во всасывании и выведении ПОАК. Изменение функции P-gp может влиять на концентрацию препаратов, их биодоступность и элиминацию. Амиодарон и пропафенон метаболизируются через эту систему и оба могут ингибировать метаболизм ПОАК, увеличивая тем самым их концентрацию, однако амиодарон является сильным ингибитором, а пропафенон – слабым. Последнее обстоятельство обеспечивает явные преимущества пропафенона [22].
Для контроля частоты сердечных сокращений (ЧСС) при наличии у пациента постоянной формы ФП используются бета-адреноблокаторы, дигоксин, верапамил и дилтиазем. Верапамил может значительно усиливать антикоагулянтный эффект дабигатрана, а дилтиазем – апиксабана. Поэтому при назначении верапамила для контроля ЧСС не рекомендуется использовать дабигатран, а при лечении дилтиаземом – апиксабан. Потенциально опасной является комбинация амиодарона и дигоксина ввиду увеличения риска развития дигиталисной интоксикации, при этом она весьма сомнительна в плане потенциальных клинических эффектов [23, 24].
В дальнем круге межлекарственных взаимодействий амиодарон, будучи сильным ингибитором CYP 3A4, замедляет метаболизм симвастатина и аторвастатина, увеличивая риск миопатии. В таких случаях предпочтительнее назначение розувастатина или питавастатина, которые не метаболизируются через CYP 3A4. Также во время лечения амиодароном не рекомендуется употребление грейпфрутового сока. Амиодарон, взаимодействуя с различными подсемействами цитохрома P450, способен замедлить метаболизм кофеина, парацетамола, метилксантинов (CYP 1А2), некоторых нестероидных противовоспалительных препаратов, сартанов и торасемида (CYP2С9), бета-блокаторов, антидепрессантов, наркотических анальгетиков (CYP2D6); а также макролидов, бензодиазепинов и бета2-адреномиметиков (CYP 3А4) [25, 26].
В контексте ведения пациентов с ФП для минимизации риска кровотечений чрезвычайно важными являются вопросы гастроэнтеропротекции. На сегодняшний день известно, что лечение эрозивно-язвенных поражений желудочно-кишечного тракта является патогенетическим, поскольку снижает ирритацию блуждающего нерва, который в значительной степени укорачивает потенциал действия предсердной ткани, способствуя развитию пароксизмальных нарушений сердечного ритма [27]. Кроме того, такой подход существенно увеличивает переносимость любого из назначаемых антикоагулянтных препаратов, снижая явления как верхней, так и нижней диспепсии, а также предотвращая развитие желудочно-
кишечных кровотечений [28].
Наиболее часто назначаемым вариантом гастроэнтеропротективной терапии является применение ингибиторов протонной помпы (ИПП). Длительный прием ИПП ассоциируется с такими неблагоприятными эффектами как развитие синдрома избыточного бактериального роста, гипергастринемии, а также увеличение риска колоректального рака, анемии, деменции, тубулоинтерстициальных заболеваний [29]. Кроме того, продолжительный прием ИПП способствует снижению внутриклеточного магния – важного регулятора потенциала действия кардиомиоцитов, универсального цитопротектора (!) за счет активного с ним комплексообразования, а также изменения всасывания в кишечнике. С позиции влияния на гомеостаз магния более неблагоприятным является назначение пантопразола и рабепразола, а предпочтительным – эзомепразола [30].
Консенсус экспертов по снижению риска желудочно-кишечных кровотечений у пациентов, получающих оральные антикоагулянты, подчеркнул, что ИПП не обладают в достаточной степени энтеропротективными свойствами и для достижения данной цели, а также минимизации риска развития неблагоприятных явлений на фоне применения ИПП важным шагом является назначение препарата из группы индуктора простагландинов – ребамипида. В случае наличия у пациента хотя бы одного из следующих факторов – возраст старше 75 лет, язвенный анамнез, сопутствующий прием антиагрегантной терапии или нестероидных противовоспалительных препаратов, предпочтение при выборе антикоагулянта следует отдать апиксабану и параллельно назначить ИПП с ребамипидом на 3 мес. Далее рассматривается возможность постепенного уменьшения приема ИПП – сначала в поддерживающей дозе, а после – исключительно по требованию. При этом прием ребамипида может продолжаться неопределенно долго ввиду хорошего профиля эффективности, безопасности и переносимости [31].
В заключение представляется важным подчеркнуть, что в процессе ведения пациента с ФП следует учесть множество важных нюансов – от верного выбора антиаритмической и антикоагулянтной терапии с учетом межлекарственных взаимодействий до обеспечения оптимальной гастроэнтеропротекции. Несмотря на распространенную практику инициации антиаритмической терапии при ФП с использования амиодарона, при отсутствии ВОПС предпочтение следует отдать препарату IС класса Пропафенону. Данный лекарственный препарат эффективен не только для купирования пароксизмов аритмии, но и для поддержания синусового ритма. Пропафенон характеризуется быстрым началом действия при внутривенном введении, а также возможностью самостоятельного купирования пароксизма ФП пациентом в амбулаторных условиях, что реализуется посредством стратегии «таблетка в кармане». Примечательно, что пропафенон, в сравнении с амиодароном, имеет меньший потенциал межлекарственных взаимодействий, опосредованных системой цитохрома P450 и транспортным белком Р-gp. Это обеспечивает возможность длительного применения препарата с минимальным риском изменения его клинических свойств при одновременном использовании антикоагулянтов и других лекарственных средств. В отличие от амиодарона и соталола, пропафенон не вызывает удлинения интервала QT, что существенно снижает риск возникновения проаритмических эффектов, в частности полиморфной желудочковой тахикардии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Божко Яков Григорьевич – канд. мед. наук, доц. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: yakov-bozhko@yandex.ru; ORCID: 0000-0003-4401-2209
Yakov G. Bozhko – Cand. Sci. (Med.), Ural State Medical University.
E-mail: yakov-bozhko@yandex.ru; ORCID: 0000-0003-4401-2209
Резник Инна Ильинична – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: inna-reznik2008@yandex.ru; ORCID: 0009-0004-3737-5241
Inna I. Reznik – Dr. Sci. (Med.), Prof., Ural State Medical University.
E-mail: inna-reznik2008@yandex.ru; ORCID: 0009-0004-3737-5241
Архипов Михаил Викторович – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: markhipov55@mail.ru; ORCID: 0000-0003-3601-9830
Mikhail V. Arkhipov – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: markhipov55@mail.ru; ORCID: 0000-0003-3601-9830
Поступила в редакцию: 05.09.2025
Поступила после рецензирования: 16.09.2025
Принята к публикации: 18.09.2025
Received: 05.09.2025
Revised: 16.09.2025
Accepted: 18.09.2025
Клинический разбор в общей медицине №9 2025
Терапия пациента с фибрилляцией предсердий: в поисках баланса между эффективностью и безопасностью
Номера страниц в выпуске:104-109
Аннотация
В данной работе анализируются аспекты эффективности и безопасности антиаритмических средств в терапии фибрилляции предсердий. Рассмотрены межлекарственные взаимодействия антиаритмиков с другими лекарственными препаратами, особенно в ближнем круге, т.е. с антикоагулянтами, изложены принципы выбора оптимальной антиаритмической терапии для предотвращения повторных эпизодов фибрилляции предсердий, купирования пароксизмов аритмии, а также контроля частоты сердечных сокращений. Особое внимание уделено развитию сердечных и внесердечных побочных эффектов, возникающих при использовании антиаритмических препаратов, а также злободневным вопросам ведения пациентов с фибрилляцией предсердий.
Ключевые слова: фибрилляция предсердий, рациональная фармакотерапия, антиаритмические и антикоагулянтные препараты, межлекарственные взаимодействия.
Для цитирования: Божко Я.Г., Резник И.И., Архипов М.В. Терапия пациента с фибрилляцией предсердий: в поисках баланса между эффективностью и безопасностью. Клинический разбор в общей медицине. 2025; 6 (9): 104–109. DOI: 10.47407/kr2025.6.9.00680
В данной работе анализируются аспекты эффективности и безопасности антиаритмических средств в терапии фибрилляции предсердий. Рассмотрены межлекарственные взаимодействия антиаритмиков с другими лекарственными препаратами, особенно в ближнем круге, т.е. с антикоагулянтами, изложены принципы выбора оптимальной антиаритмической терапии для предотвращения повторных эпизодов фибрилляции предсердий, купирования пароксизмов аритмии, а также контроля частоты сердечных сокращений. Особое внимание уделено развитию сердечных и внесердечных побочных эффектов, возникающих при использовании антиаритмических препаратов, а также злободневным вопросам ведения пациентов с фибрилляцией предсердий.
Ключевые слова: фибрилляция предсердий, рациональная фармакотерапия, антиаритмические и антикоагулянтные препараты, межлекарственные взаимодействия.
Для цитирования: Божко Я.Г., Резник И.И., Архипов М.В. Терапия пациента с фибрилляцией предсердий: в поисках баланса между эффективностью и безопасностью. Клинический разбор в общей медицине. 2025; 6 (9): 104–109. DOI: 10.47407/kr2025.6.9.00680
Therapy for patient with atrial fibrillation: in search of a balance between efficacy and safety
Yakov G. Bozhko, Inna I. Reznik, Mikhail V. ArkhipovUral State Medical University, Ekaterinburg, Russia
inna-reznik2008@yandex.ru
Abstract
This paper analyzes aspects of the efficacy and safety of antiarrhythmic drugs in the treatment of atrial fibrillation. It considers drug-drug interactions of antiarrhythmics with other drugs, especially in the near circle, i.e. with anticoagulants, and outlines the principles of choosing the optimal antiarrhythmic therapy to prevent recurrent episodes of atrial fibrillation, stop arrhythmia paroxysms, and control heart rate. Particular attention is paid to the development of cardiac and extracardiac side effects that occur when using antiarrhythmic drugs, as well as topical issues in managing patients with atrial fibrillation.
Keywords: atrial fibrillation, rational pharmacotherapy, antiarrhythmic and anticoagulant drugs, drug interactions.
For citation: Bozhko Ya.G., Reznik I.I., Arkhipov M.V. Therapy for patient with atrial fibrillation: in search of a balance between efficacy and safety. Clinical review for general practice. 2025; 6 (9): 104–109 (In Russ.). DOI: 10.47407/kr2025.6.9.00680
В Российской Федерации сердечно-сосудистые заболевания по-прежнему являются основной причиной смертности и инвалидизации населения, в том числе лиц трудоспособного возраста. В структуре кардиологической патологии значительное место занимают нарушения сердечного ритма, среди которых наиболее распространенной аритмией является фибрилляция предсердий (ФП), опасная развитием грозных
кардиоэмболических осложнений. Развитие ФП неклапанного происхождения сопряжено не только с ухудшением качества жизни, но и с неблагоприятным прогнозом для большинства пациентов [1, 2].
В настоящее время убедительно показано, что неклапанная ФП – это заболевание с многофакторной этиологией. При том что нередко в развитии ФП ведущую роль играет генетическая предрасположенность, основное значение имеет ассоциация аритмии с коморбидными состояниями (артериальной гипертонией, сахарным диабетом, ожирением, хронической сердечной недостаточностью, синдромом обструктивного апноэ-гипопноэ сна, а также с гастроэзофагеальной рефлюксной болезнью, патологией гастро-дуоденальной зоны, заболеваниями щитовидной железы и др.) и модифицируемыми поведенческиими факторами (употреблением алкоголя, избыточным потреблением пищи в вечернее время) [3]. Также сегодня много внимания уделяется и нетрадиционным факторам риска ФП, включая факторы нездорового сна (работа в ночную смену), биомаркеры (микробиота кишечника, гиперурикемия, гомоцистеин), неблагоприятные состояния или заболевания (депрессия, эпилепсия, инфекции, астма) [4]. Ввиду вышесказанного, большое значение в патогенетическом лечении ФП приобретает не только upstream-терапия, предотвращающая развитие структурного ремоделирования предсердий, но и контроль коморбидной патологии, модификация образа жизни, питания, средовых воздействий. При этом важнейшими компонентами лечения, влияющими на прогноз, остаются антиаритмическая и антикоагулянтная терапия [5].
В последние годы появились убедительные данные в пользу стратегии контроля ритма, которая сопряжена с более благоприятными исходами, нежели чем контроль частоты сердечных сокращений [6]. Амиодарон является одним из наиболее часто используемых антиаритмических препаратов (ААП), но его применение ограничивается побочными эффектами, особенно если это касается пожилых пациентов. Из некардиальных побочных эффектов при приеме амиодарона наиболее часто встречаются нарушение функции щитовидной железы, причем в сторону как гипо-, так и гипертиреоза, фотосенсибилизация, микроотложения в роговице. Более редкие, но опасные осложнения включают развитие легочного фиброза, «амиодаронового сердца» и лекарственного гепатита. Все это обусловлено высокой липофильностью препарата, длительным периодом его полувыведения, а также выраженным накоплением во многих органах. В целом частота возникновения побочных эффектов при применении амиодарона достигает 70%. При длительном лечении амиодароном пациентам важно регулярно контролировать функцию щитовидной железы, уровень трансаминаз, проходить рентгенологическое исследование легких, а также наблюдаться у офтальмолога [7].
Важно отметить, что на фоне приема амиодарона существует потенциальная угроза удлинения интервала QT и развития жизнеугрожающей пируэтной желудочковой тахикардии. В этой связи в процессе динамического наблюдения за пациентами кардиологам важно отслеживать длительность интервала QT, что может послужить поводом для снижения дозы или отмены амиодарона с заменой его на прием бета-адреноблокатора. У ослабленных, пожилых больных, пациентов с сердечной недостаточностью доза амиодарона не должна превышать 100–200 мг/сут, нередко разделенная на два приема. Комбинации амиодарона с другими ААП являются нежелательными. Например, в случае сопутствующего применения бета-адреноблокатора доза последнего должна быть существенно снижена из-за риска развития клинически значимой брадикардии [8].
Еще один важный нюанс при применении амиодарона: для восстановления ритма категорически не рекомендуется введение препарата болюсно из-за риска развития парадоксального амиодаронового коллапса. На развитие данного жизнеугрожающего побочного эффекта существенно влияют скорость введения препарата, его концентрация, а также индивидуальная чувствительность бета-адренорецепторов аорты. В данном аспекте очень важно, что амиодарон не выводится из организма даже с помощью процедуры гемодиализа. Для восстановления ритма при необходимости использования амиодарона лучше предпочесть медленное внутривенное капельное введение препарата при его разведении в растворе глюкозы объемом не менее 250 мл. Необходимо помнить, что в случае использования амиодарона быстрого восстановления ритма обычно не наблюдается, но, как правило, на практике в суточном интервале ритм восстановить удается. [8] Дополнительная дотация калия и магния, например в виде аспарагинатного комплексного соединения, позволяет на четверть увеличить вероятность восстановления синусового ритма [9].
В связи с частыми побочными эффектами, наблюдаемыми при применении амиодарона, нередко возникает необходимость его замены на другие ААП, особенно на препараты I класса по классификации Vaughan Williams [10]. Эта замена возможна только при отсутствии выраженной органической патологии сердца (ВОПС), под которой понимают постинфарктный кардиосклероз, острые формы ишемической болезни сердца, хроническую сердечную недостаточность со сниженной фракцией выброса, гипертрофию левого желудочка более 1,4 см, полную блокаду ножек пучка Гиса [11]. Некоторые препараты IА класса, такие как дизопирамид и хинидин, утратили свою клиническую значимость, в то время как препараты IC класса (пропафенон, этацизин и аллапинин), вызывают особый интерес [12]. Пропафенон на сегодняшний день имеет наиболее убедительную доказательную базу своей эффективности и включен в европейские клинические рекомендации по лечению ФП, в то время как аллапинин и этацизин фигурируют лишь в отечественных рекомендациях [13].
Пропафенон, будучи блокатором быстрых натриевых каналов, дополнительно обладает бета-адреноблокирующими свойствами, что усиливает его антиаритмический эффект. Исследование ПРОМЕТЕЙ-ИНСК, в котором участвовали 388 пациентов с ФП длительностью менее года без структурных изменений сердца, оценивало сравнительную эффективность и скорость восстановления синусового ритма при внутривенном введении амиодарона или пропафенона. Оба препарата показали сопоставимую эффективность, однако восстановление ритма происходило быстрее в группе пропафенона (22 мин) по сравнению с группой амиодарона (110 мин). Учитывая данные этого исследования и наличие токсического профиля амиодарона, был сделан вывод, что амиодарон не следует рассматривать в качестве препарата 1-й линии для неотложной терапии пациентов с недавно возникшей ФП при отсутствии ВОПС [14]. В то же время пропафенон, эффективно восстанавливающий ритм при ФП, является единственным препаратом, который можно использовать в режиме «таблетка в кармане» для купирования приступов аритмии в домашних условиях в дозировке 300 мг перорально сразу и 300 мг per os повторно через 1 ч. При внутривенном капельном введении начальная доза пропафенона составляет 500 мкг/кг, при необходимости ее увеличивают до 1–2 мг/кг [15].
Наряду с купированием пароксизмов ФП важной задачей является предотвращение рецидивов аритмии. Согласно рекомендациям по диагностике и лечению пациентов с ФП, для поддержания синусового ритма с высоким уровнем доказательности могут применяться амиодарон, пропафенон и соталол. В плане эффективности противорецидивной терапии ФП наиболее сильным ААП является амиодарон, однако в вопросах безопасности наилучший профиль продемонстрировал пропафенон. Наиболее неблагоприятным оказалось применение соталола, обусловленное тем, что препарат способен значительно удлинять интервал QT, причем в большей степени, чем амиодарон, в результате резко возрастает риск развития тахикардии «torsades de pointеs» [16].
Соталол, используемый как ААП, представляет собой неселективный бета-адреноблокатор, который в повышенных концентрациях блокирует также калиевые каналы. Его применение возможно при лечении как желудочковых, так и наджелудочковых тахиаритмий, включая пациентов с ишемической болезнью сердца.

В суточной дозе до 160 мг соталол действует как бета-адреноблокатор и может быть использован для контроля частоты сердечных сокращений при ФП. Восстановление синусового ритма соталолом в настоящее время не рекомендуется ввиду высокой частоты возникновения проаритмических побочных эффектов. Пациентам с постинфарктным кардиосклерозом данный препарат назначают в дозе, не превышающей 160 мг в день, разделенной на несколько приемов, а при хронической сердечной недостаточности с фракцией выброса менее 40% применение соталола противопоказано. При снижении скорости клубочковой фильтрации менее 60 мл/мин дозу соталола следует уменьшить на четверть, а при клиренсе креатинина менее 40 мл/мин препарат желательно отменить [17].
Основные характеристики, которые необходимо учитывать при назначении пропафенона и соталола, представлены в таблице [18].
При назначении ААП важно учитывать их фармакокинетическое взаимодействие с антикоагулянтами (ближний круг). В связи с печеночным метаболизмом амиодарона с участием изоферментов цитохрома P450 нескольких подсемейств (CYP1A2, 2C9, 2D6, ЗА4 и др.), существует высокий риск межлекарственных взаимодействий, наиболее опасным из которых является взаимодействие с варфарином. Оно опосредовано подсемействами цитохрома P-450 СYP 2D6 и 3А4. Одновременное назначение этих препаратов существенно увеличивает риск кровотечений, поэтому при необходимости применения амиодарона предпочтительнее назначение прямых оральных антикоагулянтов (ПОАК) [19, 20].
В отличие от амиодарона, пропафенон меньше влияет на метаболизм варфарина, в связи с чем не требуется альтернативных решений, но сохраняется необходимость тщательного контроля международного нормализованного отношения. Пропафенон также имеет преимущества во взаимодействии с ПОАК: препарат не влияет на их метаболизм, в то время как амиодарон усиливает действие дабигатрана и менее значимо – ривароксабана и апиксабана [21].
Соталол практически не подвергается метаболизму в печени (менее 1%), поэтому не влияет на активность изоферментов цитохрома Р450 и не вступает в фармакокинетические взаимодействия с другими лекарственными средствами. Тем не менее следует избегать одновременного приема соталола с препаратами, способными удлинять интервал QT, такими как противомикробные средства (макролиды, фторхинолоны) и некоторые антидепрессанты [17].
Система транспортных белков P-гликопротеинов (P-gp) играет важную роль во всасывании и выведении ПОАК. Изменение функции P-gp может влиять на концентрацию препаратов, их биодоступность и элиминацию. Амиодарон и пропафенон метаболизируются через эту систему и оба могут ингибировать метаболизм ПОАК, увеличивая тем самым их концентрацию, однако амиодарон является сильным ингибитором, а пропафенон – слабым. Последнее обстоятельство обеспечивает явные преимущества пропафенона [22].
Для контроля частоты сердечных сокращений (ЧСС) при наличии у пациента постоянной формы ФП используются бета-адреноблокаторы, дигоксин, верапамил и дилтиазем. Верапамил может значительно усиливать антикоагулянтный эффект дабигатрана, а дилтиазем – апиксабана. Поэтому при назначении верапамила для контроля ЧСС не рекомендуется использовать дабигатран, а при лечении дилтиаземом – апиксабан. Потенциально опасной является комбинация амиодарона и дигоксина ввиду увеличения риска развития дигиталисной интоксикации, при этом она весьма сомнительна в плане потенциальных клинических эффектов [23, 24].
В дальнем круге межлекарственных взаимодействий амиодарон, будучи сильным ингибитором CYP 3A4, замедляет метаболизм симвастатина и аторвастатина, увеличивая риск миопатии. В таких случаях предпочтительнее назначение розувастатина или питавастатина, которые не метаболизируются через CYP 3A4. Также во время лечения амиодароном не рекомендуется употребление грейпфрутового сока. Амиодарон, взаимодействуя с различными подсемействами цитохрома P450, способен замедлить метаболизм кофеина, парацетамола, метилксантинов (CYP 1А2), некоторых нестероидных противовоспалительных препаратов, сартанов и торасемида (CYP2С9), бета-блокаторов, антидепрессантов, наркотических анальгетиков (CYP2D6); а также макролидов, бензодиазепинов и бета2-адреномиметиков (CYP 3А4) [25, 26].
В контексте ведения пациентов с ФП для минимизации риска кровотечений чрезвычайно важными являются вопросы гастроэнтеропротекции. На сегодняшний день известно, что лечение эрозивно-язвенных поражений желудочно-кишечного тракта является патогенетическим, поскольку снижает ирритацию блуждающего нерва, который в значительной степени укорачивает потенциал действия предсердной ткани, способствуя развитию пароксизмальных нарушений сердечного ритма [27]. Кроме того, такой подход существенно увеличивает переносимость любого из назначаемых антикоагулянтных препаратов, снижая явления как верхней, так и нижней диспепсии, а также предотвращая развитие желудочно-
кишечных кровотечений [28].
Наиболее часто назначаемым вариантом гастроэнтеропротективной терапии является применение ингибиторов протонной помпы (ИПП). Длительный прием ИПП ассоциируется с такими неблагоприятными эффектами как развитие синдрома избыточного бактериального роста, гипергастринемии, а также увеличение риска колоректального рака, анемии, деменции, тубулоинтерстициальных заболеваний [29]. Кроме того, продолжительный прием ИПП способствует снижению внутриклеточного магния – важного регулятора потенциала действия кардиомиоцитов, универсального цитопротектора (!) за счет активного с ним комплексообразования, а также изменения всасывания в кишечнике. С позиции влияния на гомеостаз магния более неблагоприятным является назначение пантопразола и рабепразола, а предпочтительным – эзомепразола [30].
Консенсус экспертов по снижению риска желудочно-кишечных кровотечений у пациентов, получающих оральные антикоагулянты, подчеркнул, что ИПП не обладают в достаточной степени энтеропротективными свойствами и для достижения данной цели, а также минимизации риска развития неблагоприятных явлений на фоне применения ИПП важным шагом является назначение препарата из группы индуктора простагландинов – ребамипида. В случае наличия у пациента хотя бы одного из следующих факторов – возраст старше 75 лет, язвенный анамнез, сопутствующий прием антиагрегантной терапии или нестероидных противовоспалительных препаратов, предпочтение при выборе антикоагулянта следует отдать апиксабану и параллельно назначить ИПП с ребамипидом на 3 мес. Далее рассматривается возможность постепенного уменьшения приема ИПП – сначала в поддерживающей дозе, а после – исключительно по требованию. При этом прием ребамипида может продолжаться неопределенно долго ввиду хорошего профиля эффективности, безопасности и переносимости [31].
В заключение представляется важным подчеркнуть, что в процессе ведения пациента с ФП следует учесть множество важных нюансов – от верного выбора антиаритмической и антикоагулянтной терапии с учетом межлекарственных взаимодействий до обеспечения оптимальной гастроэнтеропротекции. Несмотря на распространенную практику инициации антиаритмической терапии при ФП с использования амиодарона, при отсутствии ВОПС предпочтение следует отдать препарату IС класса Пропафенону. Данный лекарственный препарат эффективен не только для купирования пароксизмов аритмии, но и для поддержания синусового ритма. Пропафенон характеризуется быстрым началом действия при внутривенном введении, а также возможностью самостоятельного купирования пароксизма ФП пациентом в амбулаторных условиях, что реализуется посредством стратегии «таблетка в кармане». Примечательно, что пропафенон, в сравнении с амиодароном, имеет меньший потенциал межлекарственных взаимодействий, опосредованных системой цитохрома P450 и транспортным белком Р-gp. Это обеспечивает возможность длительного применения препарата с минимальным риском изменения его клинических свойств при одновременном использовании антикоагулянтов и других лекарственных средств. В отличие от амиодарона и соталола, пропафенон не вызывает удлинения интервала QT, что существенно снижает риск возникновения проаритмических эффектов, в частности полиморфной желудочковой тахикардии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Божко Яков Григорьевич – канд. мед. наук, доц. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: yakov-bozhko@yandex.ru; ORCID: 0000-0003-4401-2209
Yakov G. Bozhko – Cand. Sci. (Med.), Ural State Medical University.
E-mail: yakov-bozhko@yandex.ru; ORCID: 0000-0003-4401-2209
Резник Инна Ильинична – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: inna-reznik2008@yandex.ru; ORCID: 0009-0004-3737-5241
Inna I. Reznik – Dr. Sci. (Med.), Prof., Ural State Medical University.
E-mail: inna-reznik2008@yandex.ru; ORCID: 0009-0004-3737-5241
Архипов Михаил Викторович – д-р мед. наук, проф. каф. поликлинической терапии, ФГБОУ ВО УГМУ.
E-mail: markhipov55@mail.ru; ORCID: 0000-0003-3601-9830
Mikhail V. Arkhipov – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: markhipov55@mail.ru; ORCID: 0000-0003-3601-9830
Поступила в редакцию: 05.09.2025
Поступила после рецензирования: 16.09.2025
Принята к публикации: 18.09.2025
Received: 05.09.2025
Revised: 16.09.2025
Accepted: 18.09.2025
Список исп. литературыСкрыть список1. Schnabel RB, Yin X, Gona P et al. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study. Lancet 2015;386:154-62. DOI: 10.1016/S0140-6736(14)61774-8
2. Мареев Ю.В., Поляков Д.С., Виноградова Н.Г. и др. ЭПОХА: Эпидемиология фибрилляции предсердий в репрезентативной выборке Европейской части Российской Федерации. Кардиология. 2022;62(4):12-19. DOI: 10.18087/cardio.2022.4.n1997
Mareev YuV, Polyakov DS, Vinogradova N et al. Epidemiology of atrial fibrillation in a representative sample of the European part of the Russian Federation. Analysis of EPOCH-CHF study. Kardiologiia 2022;62(4):12-19. DOI: 10.18087/cardio.2022.4.n1997 (in Russian).
3. Staerk L, Sherer JA, Ko D et al. Atrial Fibrillation: Epidemiology, Pathophysiology, and Clinical Outcomes. Circ Res 2017;120(9):1501-17. DOI: 10.1161/CIRCRESAHA.117.309732
4. Lu Y, Sun Y, Cai L et al. Non-traditional risk factors for atrial fibrillation: epidemiology, mechanisms, and strategies. Eur Heart J 2025;46(9):784-804. DOI: 10.1093/eurheartj/ehae887
5. Hindricks G, Potpara T, Dagres N et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021;42(5):373-498. DOI: 10.1093/eurheartj/ehaa612
6. Kirchhof P, Camm AJ, Goette A et al. EAST-AFNET 4 Trial Investigators. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med 2020;383(14):1305-16. DOI: 10.1056/NEJMoa2019422
7. Gelfman DM. Side Effects of Amiodarone. JACC Clin Electrophysiol 2022;8(8):1048. DOI: 10.1016/j.jacep.2022.05.019
8. Hamilton DSr, Nandkeolyar S, Lan H et al. Amiodarone: A Comprehensive Guide for Clinicians. Am J Cardiovasc Drugs 2020;20(6):549-58. DOI: 10.1007/s40256-020-00401-5
9. Cacioppo F, Reisenbauer D, Herkner H et al. Association of Intravenous Potassium and Magnesium Administration With Spontaneous Conversion of Atrial Fibrillation and Atrial Flutter in the Emergency Department. JAMA Netw Open 2022;5(10):e2237234. DOI: 10.1001/jamanetworkopen.2022.45392
10. Lei M, Wu L, Terrar DA et al. Modernized Classification of Cardiac Antiarrhythmic Drugs. Circulation 2018;138(17):1879-96. DOI: 10.1161/CIR.0000000000000675
11. McNamara RL, Tamariz LJ, Segal JB et al. Management of atrial fibrillation: review of the evidence for the role of pharmacologic therapy, electrical cardioversion, and echocardiography. Ann Intern Med 2003;139(12):1018-33. DOI: 10.7326/0003-4819-139-12-200312160-00012
12. Kapustnick Y, Lutsenko R, Sуdorenko A. Combined pharmacological therapy including several antiarrhythmic agents for treatment of different disorders of cardiac rhythm. Georgian Med News 2021;(315):85-93. PMID: 34365431
13. Hindricks G, Potpara T, Dagres N et al. ESC 2020 guidelines for the diagnosis and treatment of patients with atrial fibrillation, developed jointly with the european Association of cardiothoracic Surgery (EACTS). Russian Journal of Cardiology 2021;26(9):4701. DOI: 10.15829/1560-4071-2021-4701
14. Тарасов А.В., Косых С.А., Бушуева Е.В. и др. Сравнение эффективности инъекционных форм антиаритмических препаратов пропафенона и амиодарона при проведении фармакологической кардиоверсии пароксизмальной фибрилляции предсердий. Consilium Medicum. 2019;21(1):81-6.
Tarasov A.V., Kosykh S.A., Bushueva E.V. et al. Comparison of the effectiveness of injectable forms of antiarrhythmic drugs propafenone and amiodarone during pharmacological cardioversion of paroxysmal atrial fibrillation. Consilium Medicum. 2019;21(1):81-6 (in Russian).
15. А. Pill in the Pocket: A Safe and Useful Antiarrhythmic Strategy. JACC Clin Electrophysiol 2022; 8(12):1521-2. DOI: 10.1016/j.jacep.2022. 11.001
16. Freemantle N, C, S et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace 2011;13(3):329-45. DOI: 10.1093/europace/ euq450
17. Hohnloser SH, Woosley RL. Sotalol. N Engl J Med 1994;331(1):31-8. DOI: 10.1056/NEJM199407073310108
18. Doshchitsyn VL, Syrov AV Use of propafenone and sotalol in the treatment of atrial fibrillation. Therapy 2022;8:124-36. DOI: 10.18565/therapy.2022.8.124-136
19. Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmcol Ther 2013;138:103-41. DOI: 10.1016/j.pharmthera. 2012.12.007
20. Herink MC, Zhuo YF, Williams СD et al. Clinical management of pharmacokinetic drug interactions with direct oral anticoagulants (DOACs). Drugs 2019;79(15):625-34. DOI: 10.1007/s40265-019-01183-0
21. Voukalis С, Lip GY, Shantsila E. Drug-drug interactions of nonvitamin K oral anticoagulants. Expert Opin Drug Metab Toxico 2016;12(12):1445-61. DOI: 10.1080/17425 255.2016.1225037
22. Mendell J, Zahir H, Ridout G et al. Drug-drug interaction studies of cardiovascular drugs (amiodarone, digoxin, quinidine, atorvastatin and verapamil) involving P-glycoprotein (P-gp), an efflux transporter, on the pharmacokinetics and pharmacodynamics of edoxaban, an oral factor Xa inhibitor (abstr). J Am Coll Cardiol 2011;57:E1510. DOI: 10.1016/S0735-1097(11)61510-6
23. Konieczny K, Dorian P. Clinically Important Drug–Drug Interactions Between Antiarrhythmic Drugs and Anticoagulants. J Innov Cardiac Rhythm Manage 2019;10(3):3552-9. DOI: 10.19102/icrm.2019.100304
24. Mar PL, Horbal P, Chung MK et al. Drug Interactions Affecting Antiarrhythmic Drug Use. Circ Arrhythm Electrophysiol 2022;15(5):e007955. DOI: 10.1161/CIRCEP.121.007955
25. Dan GA, Martinez-Rubio A, Agewal S et al. Antiarrhythmic drugs–clinical use and clinical decision making: a consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology (ESC) Working Group on Cardiovascular Pharmacology, endorsed by the Heart Rhythm Society (HRS), AsiaPacific Heart Rhythm Society (APHRS) and International Society of Cardiovascular Pharmacotherapy (ISCP). Europace 2018;20(5):731-2an. DOI: 10.1093/europace/eux373
26. Nandkeolyar DHS, Lan H et al. Amiodarone: A Comprehensive Guide for Clinicians. Am J Cardiovasc Drugs 2020;20(6):49-558. DOI: 10.1007/s40256-020-00401-5
27. Bozhko YaG, Arkhipov MV, Molodykh SV Features of management of patients with sinus node dysfunction of non ischemic genesis: tachy-bradycardia syndrome is in the focus. URMJ 2019;04(172):64-7. DOI: 10.25694/URMJ.2019.04.16
28. Lanas-Gimeno A, Lanas A. Risk of gastrointestinal bleeding during anticoagulant treatment. Expert Opin Drug Saf 2017;16(6):673-85. DOI: 10.1080/14740338.2017.1325870
29. Haastrup PF, Thompson W, Sondergaard J et al. Side Effects of Long-Term Proton Pump Inhibitor Use: A Review. Basic Clin Pharmacol Toxicol 2018;123(2):114-21. DOI: 10.1111/bcpt.13023
30. Bozhko YG, Arkhipov MV, Belokonova NA. Study of the Effect of Proton Pump Inhibitors on the Development of Hypomagnesemia in Patients with Paroxysmal Atrial Fibrillation on the Background of Autonomic Sinus Node Dysfunction. Ration Pharmacother Cardiol 2019;15(6):840-846. DOI: 10.20996/1819-6446-2019-15-6-840-84
31. Experts consensus on reducing the risk of gastrointestinal bleeding in patients receiving oral anticoagulants. Therapy 2021; 10: 23–41. DOI: 10.18565/therapy.2021.10.23–41
20 октября 2025
Количество просмотров: 189