Клинический разбор в общей медицине №10 2025
Vladimir V. Hodus2, Anton V. Indutny1, Dmitry I. Trukhan1, Elena А. Sorokina2, Natalia А. Romashova2
1 Omsk State Medical University, Omsk, Russia;
2 Clinical Health Unit No. 9, Omsk, Russia
drukinna@yandex.ru
Abstract
Diabetic foot syndrome is one of the most severe and difficult-to-manage complications of diabetes mellitus, manifested by infection, ulcer, and/or neuroosteoarthropathy. Neuroosteoarthropathy is the strongest risk factor for trophic foot ulcers. Risk factors, genetic markers, screening indicators of the active stage, as well as remission, and neuroosteoarthropathy have not been fully studied. This type of diabetic foot syndrome is considered as an inflammatory process in people with peripheral polyneuropathy, which leads to damage to bones, joints and soft tissues, possibly in people with genetic risk factors. Assessment of the functional state of neutrophils in the aspect of netosis in various variants of diabetic foot syndrome seems relevant and promising from a scientific and practical point of view. The article presents the results of a study of netosis in patients with diabetic foot syndrome (trophic ulcers, neuroosteoarthropathy).
Keywords: diabetes, netosis, neutrophil traps, diabetic foot syndrome, neuroosteoarthropathy.
For citation: Druk I.V., Novikov D.G., Zolotov A.N., Kirichenko O.N., Kirkh E.A., Hodus V.V., Indutny A.V., Trukhan D.I., Sorokina E.A., Romashova O.N. Investigation of neutrophil extracellular traps in patients with type 2 diabetes mellitus, diabetic peripheral neuropathy and diabetic foot syndrome. Clinical review for general practice. 2025; 6 (10): 17–23 (In Russ.). DOI: 10.47407/kr2025.6.10.00688
Введение
По данным Международной федерации диабета (International Diabetes Federation, IDF), распространенность сахарного диабета (СД) в мире на 2025 г. составляет 589 млн человек в возрасте 20–79 лет, что соответствует 11,1% населения этой возрастной группы. Прогнозируется увеличение распространенности СД к 2050 г. до 852,5 млн человек, что составит 45%, на фоне увеличения прогнозируемой общей численности населения планеты на 25% [1]. В Европе распространенность СД на 2024 г. оценивают в 9,8% населения. По данным IDF, Российская Федерация входит в топ-5 европейских стран по абсолютной численности больных СД
(7,6 млн) [1]. Однако, по данным ГНЦ РФ ФГБУ НМИЦ эндокринологии, общее число пациентов с СД в РФ на 01.01.2025 составило 5 463 982 человека (3,5% населения), из них 92,4% представлены пациентами с СД 2-го типа (СД2), 5,5% – пациентами с СД 1-го типа (СД1) [2].
Следует обратить внимание, что, по данным IDF, в 2024 г. в мире среди взрослого населения 42,8% (251,7 млн человек) имеют недиагностированный СД [1]. Действительно, ранее было показано, что в регистре фиксируются только выявленные случаи СД, а число случаев недиагностированного СД составляет примерно половину от общего числа пациентов (46%), что подтверждается результатами масштабного национального эпидемиологического исследования NATION, по данным которого, фактическая распространенность СД2 при активном скрининге по уровню гликированного гемоглобина (HbA1c) в 2 раза выше регистрируемых цифр и составляет 5,4% населения РФ [3]. Таким образом, в мире значительная часть пациентов, имея недиагностированный СД, не получают лечение и подвергаются повышенному риску развития диабетических осложнений и преждевременной смерти. Глобальные демографические изменения, характеризующиеся постарением населения и тенденциями увеличения длительности жизни с СД, поддерживают актуальность проблемы хронических осложнений СД.
Диабетическая нейропатия (ДН) – одно из наиболее распространенных осложнений СД. По данным анализа динамики распространенности диабетических осложнений и их терминальных форм за период 2010–2022 гг., отмечена стабилизация распространенности диабетический нейропатии при СД1 на уровне 44,08–47,40%, при СД2 – 22,31–23,75% [4]. В настоящее время не существует специфического лечения, способного обратить вспять повреждение нервов. Контроль уровня глюкозы может эффективно предотвратить периферическую ДН и сердечно-сосудистую вегетативную нейропатию при СД1, незначительно замедлить их прогрессирование при СД2, но не может обратить вспять потерю нейронов. Контроль других модифицируемых факторов риска (включая массу тела, уровень липидов и артериальное давление) может помочь предотвратить прогрессирование ДН при СД2 и замедлить прогрессирование заболевания при СД1 [5].
Наличие периферической сенсорной нейропатии является наиболее распространенной причиной синдрома диабетической стопы (СДС), реже регистрируются ишемическая и нейроишемическая формы СДС. К нейропатическим формам СДС относят трофическую язву стоп и диабетическую нейроостеоартропатию (НОА). СДС – одно из наиболее тяжелых и трудно управляемых осложнений СД. СДС определяется как инфекция, язва и/или деструкция глубоких тканей, связанная с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей разной степени тяжести [2].
Согласно оценкам Глобального исследования бремени болезней, 199 млн человек страдают заболеваниями стоп, связанными с СД [6]. Примерно у 34% пациентов с СД в течение жизни развивается язва стопы. Примерно 20% пациентов с диабетической язвой стопы нуждаются в госпитализации, и от 15 до 20% госпитализированных пациентов подвергаются ампутации нижних конечностей [7].
СДС, возникающий в основном в результате ДН, представляет собой сложную проблему, которая приводит к значительной заболеваемости и становится все более серьезным бременем для здравоохранения.
В ходе многоцентрового исследования было установлено, что ДН является причиной язв у 78% людей с СД, а также что у 63% участников наблюдалась триада периферической сенсорной нейропатии, незначительной травмы и деформации стопы [5]. Недавний обзор показал, что 5-летняя смертность при НОА, язвах на стопе, малых и больших ампутациях составляет 29,0; 30,5; 46,2 и 56,6% соответственно [7]. Деформации костей и суставов, возникающие в результате активного течения НОА, предрасполагают к образованию язв и инфицированию, что значительно повышает риск ампутации нижней конечности. НОА – наиболее сильный фактор риска трофических язв стопы: развивающиеся вследствие НОА деформации стопы повышают риск хронических язв на стопе и ампутации нижней конечности в 15–40 раз [8]. Сочетание деформации, ограниченной подвижности, частых инфекций и госпитализаций оказывает значительное влияние на повседневную жизнь пациентов не только в физическом, но и в психологическом плане [9].
Истинная распространенность НОА неизвестна, в основном потому, что отсутствие боли при периферической ДН часто влияет на время обращения за медицинской помощью. В предыдущих исследованиях, проведенных в нескольких группах населения, сообщалось о распространенности СДС в диапазоне от 0,04 до 0,3–0,5% пациентов с СД. По некоторым зарубежным данным, распространенность НОА составляет 0,56–0,79%, а заболеваемость – 6,4–9,5 на 10 тыс. человек с СД [10, 11]. Факторы риска, генетические маркеры, скрининговые показатели НОА в полной мере не изучены [8, 12], что затрудняет раннее выявление и разработку эффективных методов профилактики. В современной зарубежной научной литературе появились работы, посвященные роли нейтрофилов в патогенезе СДС, а именно – исследованию функциональной активности нейтрофилов, формированию этими клетками внеклеточной ловушки (нетоз). Оценка функционального состояния нейтрофилов в аспекте нетоза при различных вариантах СДС представляется актуальной и перспективной задачей с научной (установления роли в патогенезе) и практической (в аспекте верификации активности НОА) точек зрения.
Цель исследования – оценить способность нейтрофилов периферической крови к формированию нейтрофильных внеклеточных ловушек (НВЛ) у пациентов с диабетическими поражениями стопы.
Материалы и методы
Способность нейтрофилов периферической крови к формированию НВЛ исследовали у здорового волонтера, у пациента с СД2, СДС, некрозом I пальца правой стопы, трофической язвой в области культи I пальца правой стопы (пациент с СДС – пациент 1) и у пациента с СД2, диабетической НОА справа, подострой стадии, экзартикуляцией V пальца левой стопы (пациент с СДС и НОА – пациент 2).
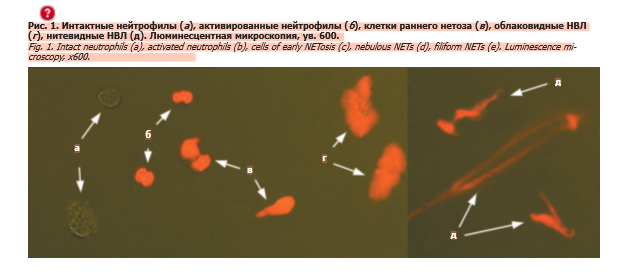
Выделение нейтрофилов проводили из гепаринизированной периферической венозной крови с использованием двойного градиента плотности фиколла-верографина (верхний слой – 1,077, нижний – 1,105). Нейтрофилы собирали на границе между слоями градиента, после чего дважды отмывали физиологическим раствором. Концентрацию клеток доводили до 5000 кл/мкл.
Для стимуляции нейтрофилов к формированию ими внеклеточных ловушек раздельно использовали два активатора: 1) смесь бактерий Lactobacillus (L.) reuteri,
L. acidophilus, L. rhamnosus и Bifidobacterium longum, которую разводили в физиологическом растворе в концентрации 2,5×109 бактерий на 1 мл раствора; 2) раствор тромбина с активностью 9 МЕ/мл (набор «Тромбин-реагент»; НПО «Ренам», Россия). Отношение объема каждого из стимуляторов к объему взвеси нейтрофилов составляло 1:10.
После 30-минутной инкубации с каждым из активаторов при 37 °C готовили препараты по методу «раздавленной капли». На предметное стекло наносили 8 мкл суспензии нейтрофилов, добавляли 2,5 мкл йодида пропидия (0,1 мг/мл) и аккуратно накрывали покровным стеклом (24×48×0,17 мм). Препараты анализировали с помощью комбинированного освещения: галогенового проходящего и испускаемого флюоресцентного света (возбуждение – 450–480 нм, эмиссия – от 515 нм). Проводили подсчет абсолютного числа нитевидных НВЛ, облаковидных НВЛ, клеток раннего нетоза, активированных и интактных нейтрофилов (рис. 1). Способность нейтрофилов к формированию НВЛ оценивали путем расчета процентного соотношения облаковидных и нитевидных НВЛ относительно общего числа флюоресцентно-позитивных (облаковидные и нитевидные НВЛ, клетки раннего нетоза, активированные нейтрофилы) и флюоресцентно-негативных (интактные нейтрофилы) объектов (см. рис. 1).
От обследуемых получено информированное добровольное согласие на участие в исследовании. Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (21.04.2025).
Результаты
Пациенты 1 и 2 – люди пожилого возраста с анамнезом длительного течения СД2, множественными хроническими диабетическими микрососудистыми осложнениями и атеросклеротическими поражениями сосудов – поступили в отделение гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9 (заведующий отделением – В.В. Ходус) в марте 2025 г. со сходными основными жалобами на общую слабость, выраженные боли в ногах при ходьбе, в покое, в том числе ночные боли.
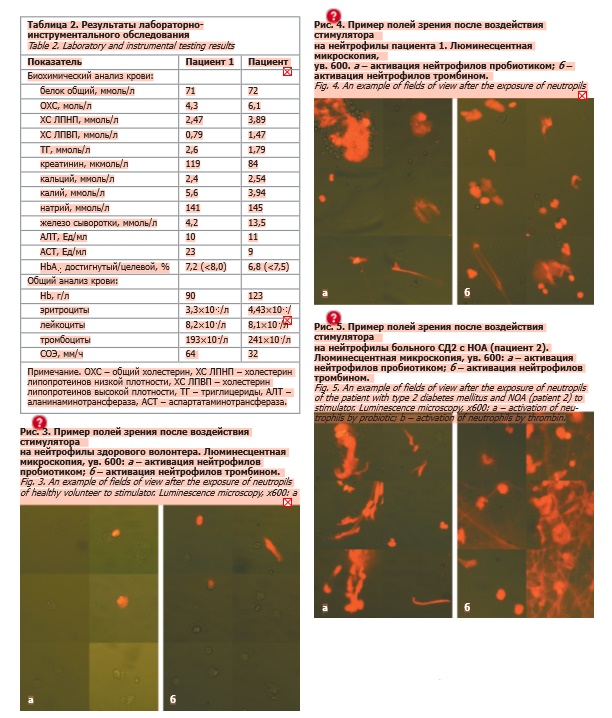
Клиническая характеристика обследованных пациентов представлена в табл. 1 и 2. При проведении инструментального обследования по результатам мультиспиральной компьютерной томографии сосудов нижних конечностей у пациента 1 выявлены признаки стенозов левых бедренной, подколенной артерий, диффузного поражения артерий обеих голеней; у пациента 2 – признаки окклюзии левой задней большеберцовой артерии. При электронейромиографии в обоих случаях установлены признаки аксонального демиелинизирующего поражения, функционального поражения моторных волокон малоберцового и большеберцового нервов правой нижней конечности. У пациента 1 в феврале 2025 г. возник некроз I пальца стопы (проведена ампутация I пальца правой стопы с резекцией головки плюсневой кости), у пациента 2 в 2021 г. по поводу СДС проведена ампутация V пальца левой стопы, а в августе 2024 г. после травмы правой стопы верифицирована диабетическая НОА.
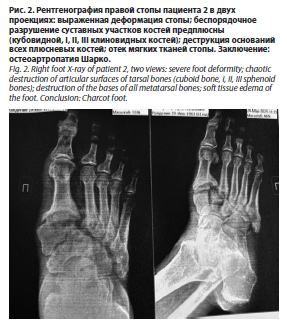 На момент поступления локальный статус (нижние конечности) пациентов имел следующие характеристики. Пациент 1: нижние конечности симметричны. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Кожные покровы теплые на ощупь. Пульсация на бедренных и подколенных артериях сохранена с обеих сторон, на берцовых артериях и АТС – отсутствует. В области культи I пальца правой стопы – трофическая язва (некроз краевых лоскутов). На тыле левой стопы – трофическая язва (некроз тыла стопы размером 6,5×10 см с некрозом сухожилия разгибателя I пальца и вовлечением плюснефалангового сустава). Гиперкератоз на подошвах. Ногтевые пластины деформированы. Пациент 2 (рентгенография правой стопы – рис. 2): нижние конечности симметричные. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Ампутационная культя V пальца левой стопы. Правая стопа умеренно отечна, свод уплощен, деформация костей плюсны, пролабирование кубовидной кости с формированием язвенного дефекта на подошвенной поверхности диаметром до 1 см, края раны плотные, гиперкератоз, скудное серозное отделяемое из раны. Пульсация на бедренных артериях сохранена, на подколенных артериях справа и слева – ослаблена, ниже – не определяется.
На момент поступления локальный статус (нижние конечности) пациентов имел следующие характеристики. Пациент 1: нижние конечности симметричны. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Кожные покровы теплые на ощупь. Пульсация на бедренных и подколенных артериях сохранена с обеих сторон, на берцовых артериях и АТС – отсутствует. В области культи I пальца правой стопы – трофическая язва (некроз краевых лоскутов). На тыле левой стопы – трофическая язва (некроз тыла стопы размером 6,5×10 см с некрозом сухожилия разгибателя I пальца и вовлечением плюснефалангового сустава). Гиперкератоз на подошвах. Ногтевые пластины деформированы. Пациент 2 (рентгенография правой стопы – рис. 2): нижние конечности симметричные. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Ампутационная культя V пальца левой стопы. Правая стопа умеренно отечна, свод уплощен, деформация костей плюсны, пролабирование кубовидной кости с формированием язвенного дефекта на подошвенной поверхности диаметром до 1 см, края раны плотные, гиперкератоз, скудное серозное отделяемое из раны. Пульсация на бедренных артериях сохранена, на подколенных артериях справа и слева – ослаблена, ниже – не определяется.
У пациентов с СД2, в отличие от здоровых доноров, наблюдалась повышенная способность нейтрофилов к образованию НВЛ при стимуляции как пробиотиком, так и тромбином (рис. 3–5). При этом нейтрофилы пациента с НОА (стопа Шарко) демонстрировали более выраженное формирование нитевидных НВЛ по сравнению с нейтрофилами пациента с СДС (рис. 4, 5).
Особый интерес представляла реакция нейтрофилов пациента со стопой Шарко на стимуляцию тромбином: в этом случае наблюдалось образование протяженных нитевидных НВЛ, объединявших как активированные, так и интактные нейтрофилы в крупные агрегированные структуры, занимающие несколько полей зрения. В случае же стимуляции пробиотиком у данного пациента преобладали нитевидные НВЛ увеличенной площади по сравнению с таковыми у пациента с СДС (см. рис. 5).
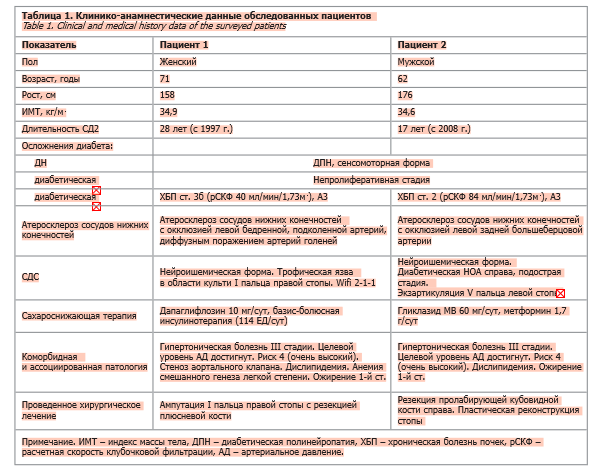
При микроскопии препаратов нейтрофилов пациента 1 после активации пробиотиком выявлялись единичные плотные агрегаты НВЛ, а также облаковидные НВЛ, клетки раннего нетоза и активированные нейтрофилы. После стимуляции тромбином в этой группе отмечалось значительное увеличение количества облаковидных НВЛ, клеток раннего нетоза и активированных нейтрофилов по сравнению с воздействием пробиотика (см. рис. 3).
У пациента с НОА (пациент 2) пробиотик индуцировал образование НВЛ менее интенсивно, чем тромбин, однако его стимулирующий эффект превышал таковой у пациента с СДС (см. рис. 3, 4). У пациента 2 после пробиотической стимуляции в препаратах обнаруживались активированные нейтрофилы и клетки раннего нетоза, но их доля была существенно ниже, чем при воздействии тромбина (см. рис. 4).
Полученные данные свидетельствуют о различиях в реактивности нейтрофилов у пациентов с разными формами диабетического поражения стоп, что может отражать особенности патогенеза этих состояний.
Обсуждение
Без своевременной диагностики и лечения СДС (включая НОА и язву стопы) в тяжелых случаях может привести к ампутации стопы или сепсису [13]. Особенно сложна диагностика НОА, которая, по некоторым данным, опаздывает в четверти случаев [8, 12]. На сегодняшний день одним из основных вопросов, требующих решения, является разработка четко сформулированных и подтвержденных, объективных и воспроизводимых критериев для диагностики активной стадии НОА, мониторинга активности заболевания и определения ремиссии. Используемые клинические признаки (локальная гипертермия) не изучены с точки зрения информативности для определения активности и ремиссии, лабораторные признаки (уровень С-реактивного белка, количество лейкоцитов, соотношения нейтрофилов и лимфоцитов, тромбоцитов и лимфоцитов, другие расчетные индексы воспалительных реакций, активность щелочной фосфатазы) подвержены широкому диапазону колебаний и не имеют доказательств значимости для диагностики активной НОА [14]. Экспертные сообщества отмечают, что также необходимы дальнейшие исследования, посвященные мониторингу активности заболевания с точки зрения визуализации, так как отсутствие четкого соответствия между данными магнитно-резонансной томографии и клиническими признаками затрудняет клиническую оценку актуального локального статуса [8, 12].
Согласно современным представлениям, НОА рассматривается как воспалительный процесс у людей с периферической полинейропатией, который приводит к повреждению костей, суставов и мягких тканей (возможно, у людей с генетическими факторами риска). Предполагается, что непропорциональное высвобождение провоспалительных и противовоспалительных цитокинов сопряжено с активацией ядерного фактора κB (NF-κB) через лиганд рецептора активатора NF-κB (RANKL), который стимулирует остеокластогенез. Происходит пролиферация и дифференцировка предшественников остеокластов в высокоагрессивные остеокласты с повышенной резорбирующей активностью в ответ на RANKL и фактор некроза опухоли α. Этот воспалительный процесс в сочетании с механическими усилиями при ходьбе на фоне ДН может привести к разрыву или ослаблению связок, вывихам суставов и/или переломам стопы/лодыжки [12]. Инфекция при СДС стимулирует формирование НВЛ как естественную реакцию на патоген, однако нарушение регуляции этого процесса, сопровождающееся избыточным формированием НВЛ – нетозом, может вызывать повреждение тканей и затруднять заживление тканевых дефектов при СДС: формирование НВЛ утрачивает свое биологическoе защитное действие и становится патологическим процессом [15]. Гипергликемия также может индуцировать нетоз посредством включения пути НАДФH-оксидазы и генерации активных форм кислорода (механизм суицидального нетоза) [16].
Нами было обнаружено, что нейтрофильные лейкоциты, выделенные из периферической крови больных СД2 с СДС, при воздействии стимуляторов нетоза способны формировать НВЛ. При этом НВЛ у них формируются в значительно большем количестве, чем у здоровых лиц, в особенности у пациентов с НОА. Доля НВЛ, формируемых в ответ на воздействие неспецифического антигенного стимулятора бактериальной природы, достаточно высока и сопоставима с ранее обнаруженными нами изменениями, наблюдавшимися у больных туберкулезом [16, 17] и язвенным колитом [18]. Такие изменения связаны с механизмом действия НВЛ. Формирование НВЛ является нормальной функцией нейтрофилов и направлено на уничтожение патогенов при помощи фиксированных на НВЛ протеолитических ферментов, продуктов ферментов, обеспечивающих генерацию активных форм кислорода и антибактериальных белков (таких как нейтрофильная эластаза, миелопероксидаза, кальпротектин и др.) [19]. Появление НВЛ является частью острофазового ответа и тесно связано с ним. Было показано наличие корреляционной связи между уровнем С-реактивного белка и выраженностью нетоза у пациентов с СД2 и сердечной недостаточностью. Более того, сыворотка крови этих больных вызывала формирование внеклеточных ловушек нейтрофилами, полученными от здоровых доноров [20]. Другой интересной находкой является способность нейтрофилов, изолированных из крови, к образованию внеклеточных ловушек под действием тромбина in vitro. Тромбин может влиять на протеом НВЛ [21], а сами события нетоза тесно связаны с процессами коагуляции [22]. Нарушение контроля процесса образования НВЛ может привести к существенным повреждениям тканей и стать причиной системного воспалительного ответа [15] или системных нарушений коагуляции – иммунотромбоза [23].
Заключение
Полученные результаты не противоречат гипотезе о том, что особенности формирования НВЛ при действии различных стимуляторов у больных СД2 могут отражать активность, клиническую форму СДС, возможно, маркировать развитие терминальной стадии, что представляется материалом для дальнейших исследований.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare no conflict of interest.
Финансирование. Исследование выполнено за счет гранта Российского научного фонда №25-25-20206, https://rscf.ru/project/25-25-20206/
Funding. The study was supported by the Russian Science Foundation grant No. 25-25-20206, https://rscf.ru/project/25-25-20206/
Информация об авторах
Information about the authors
Друк Инна Викторовна – д-р мед. наук, доц., зав. каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ. E-mail: drukinna@yandex.ru; ORCID: 0000-0001-8317-7765
Inna V. Druk – Dr. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: drukinna@yandex.ru. ORCID: 0000-0001-8317-7765
Новиков Дмитрий Георгиевич – канд. мед. наук, доц. каф. клинической лабораторной диагностики, зав. Центральной научно-исследовательской лабораторией ФГБОУ ВО ОмГМУ.
ORCID: 0000-0002-4339-2222
Dmitry G. Novikov – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. ORCID: 0000-0002-4339-2222
Золотов Александр Николаевич – канд. мед. наук, ст. науч. сотр. Центральной научно-исследовательской лаборатории ФГБОУ ВО ОмГМУ. ORCID: 0000-0002-6775-323X
Alexander N. Zolotov – Cand. Sci. (Med.), Senior Res. Officer, Omsk State Medical University. ORCID: 0000-0002-6775-323X
Кириченко Николай Александрович – мл. науч. сотр. Центральной научно-исследовательской лаборатории ФГБОУ ВО
ОмГМУ. ORCID: 0000-0002-8411-0973
Nikolay A. Kirichenko – Res. Assist., Omsk State Medical University. ORCID: 0000-0002-8411-0973
Кирх Елизавета Александровна – ординатор каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ
Elizabeth А. Kirch – Clinical Resident, Omsk State Medical University
Ходус Владимир Владимирович – зав. отд-нием гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9
Vladimir V. Hodus – surgeon, Clinical Health Unit No. 9
Индутный Антон Васильевич – д-р мед. наук, доц., зав. каф. клинической лабораторной диагностики ДПО ФГБОУ ВО ОмГМУ. ORCID: 0000-0003-1951-5824
Anton V. Indutny – Dr. Sci. (Med.), Assoc. Prof., Omsk State Medical University. ORCID: 0000-0003-1951-5824
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней ФГБОУ ВО
ОмГМУ. ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Assoc. Prof., Prof., Omsk State Medical University. ORCID: 0000-0002-1597-1876
Сорокина Елена Альбертовна - д-р мед. наук, зам. гл. врача по терапевтической помощи БУЗОО МСЧ №9
Elena А. Sorokina – Dr. Sci. (Med.), Deputy Chief Physician for therapeutic сare, Clinical Health Unit No. 9
Ромашова Наталья Александровна – врач-эндокринолог отд-ния гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9
Natalia А. Romashova – endocrinologist, Clinical Health Unit No. 9
Поступила в редакцию: 04.07.2025
Поступила после рецензирования: 25.07.2025
Принята к публикации: 24.07.2025
Received: 04.07.2025
Revised: 25.07.2025
Accepted: 24.07.2025
Клинический разбор в общей медицине №10 2025
Нейтрофильные внеклеточные ловушки у пациентов с сахарным диабетом 2-го типа и синдромом диабетической стопы
Номера страниц в выпуске:17-23
Аннотация
Синдром диабетической стопы (СДС) – одно из самых тяжелых и трудно управляемых осложнений сахарного диабета, проявляющееся инфекцией, язвой и/или нейроостеоартропатией (НОА). НОА – наиболее значимый фактор риска трофических язв стопы. Факторы риска, генетические маркеры, скрининговые показатели активной стадии, как и ремиссии, НОА в полной мере не изучены. Этот вариант СДС рассматривается как воспалительный процесс у людей с периферической полинейропатией, который приводит к повреждению костей, суставов и мягких тканей (возможно, у людей с генетическими факторами риска). Оценка функционального состояния нейтрофилов в аспекте нетоза при различных вариантах СДС представляется актуальной и перспективной задачей с научной и практической точек зрения. В статье представлены результаты исследования нетоза у пациентов с СДС (трофические язвы, НОА).
Ключевые слова: диабет, нетоз, нейтрофильные ловушки, синдром диабетической стопы, нейроостеоартропатия.
Для цитирования: Друк И.В., Новиков Д.Г., Золотов А.Н., Кириченко Н.А., Кирх Е.А., Ходус В.В., Индутный А.В., Трухан Д.И., Сорокина Е.А., Ромашова Н.А. Нейтрофильные внеклеточные ловушки у пациентов с сахарным диабетом 2-го типа и синдромом диабетической стопы. Клинический разбор в общей медицине. 2025; 6 (10): 17–23. DOI: 10.47407/kr2025.6.10.00688
Синдром диабетической стопы (СДС) – одно из самых тяжелых и трудно управляемых осложнений сахарного диабета, проявляющееся инфекцией, язвой и/или нейроостеоартропатией (НОА). НОА – наиболее значимый фактор риска трофических язв стопы. Факторы риска, генетические маркеры, скрининговые показатели активной стадии, как и ремиссии, НОА в полной мере не изучены. Этот вариант СДС рассматривается как воспалительный процесс у людей с периферической полинейропатией, который приводит к повреждению костей, суставов и мягких тканей (возможно, у людей с генетическими факторами риска). Оценка функционального состояния нейтрофилов в аспекте нетоза при различных вариантах СДС представляется актуальной и перспективной задачей с научной и практической точек зрения. В статье представлены результаты исследования нетоза у пациентов с СДС (трофические язвы, НОА).
Ключевые слова: диабет, нетоз, нейтрофильные ловушки, синдром диабетической стопы, нейроостеоартропатия.
Для цитирования: Друк И.В., Новиков Д.Г., Золотов А.Н., Кириченко Н.А., Кирх Е.А., Ходус В.В., Индутный А.В., Трухан Д.И., Сорокина Е.А., Ромашова Н.А. Нейтрофильные внеклеточные ловушки у пациентов с сахарным диабетом 2-го типа и синдромом диабетической стопы. Клинический разбор в общей медицине. 2025; 6 (10): 17–23. DOI: 10.47407/kr2025.6.10.00688
Investigation of neutrophil extracellular traps in patients with type 2 diabetes mellitus, diabetic peripheral neuropathy and diabetic foot syndrome
Inna V. Druk1, Dmitry G. Novikov1, Alexander N. Zolotov1, Nikolay A. Kirichenko1, Elizabeth А. Kirkh1,Vladimir V. Hodus2, Anton V. Indutny1, Dmitry I. Trukhan1, Elena А. Sorokina2, Natalia А. Romashova2
1 Omsk State Medical University, Omsk, Russia;
2 Clinical Health Unit No. 9, Omsk, Russia
drukinna@yandex.ru
Abstract
Diabetic foot syndrome is one of the most severe and difficult-to-manage complications of diabetes mellitus, manifested by infection, ulcer, and/or neuroosteoarthropathy. Neuroosteoarthropathy is the strongest risk factor for trophic foot ulcers. Risk factors, genetic markers, screening indicators of the active stage, as well as remission, and neuroosteoarthropathy have not been fully studied. This type of diabetic foot syndrome is considered as an inflammatory process in people with peripheral polyneuropathy, which leads to damage to bones, joints and soft tissues, possibly in people with genetic risk factors. Assessment of the functional state of neutrophils in the aspect of netosis in various variants of diabetic foot syndrome seems relevant and promising from a scientific and practical point of view. The article presents the results of a study of netosis in patients with diabetic foot syndrome (trophic ulcers, neuroosteoarthropathy).
Keywords: diabetes, netosis, neutrophil traps, diabetic foot syndrome, neuroosteoarthropathy.
For citation: Druk I.V., Novikov D.G., Zolotov A.N., Kirichenko O.N., Kirkh E.A., Hodus V.V., Indutny A.V., Trukhan D.I., Sorokina E.A., Romashova O.N. Investigation of neutrophil extracellular traps in patients with type 2 diabetes mellitus, diabetic peripheral neuropathy and diabetic foot syndrome. Clinical review for general practice. 2025; 6 (10): 17–23 (In Russ.). DOI: 10.47407/kr2025.6.10.00688
Введение
По данным Международной федерации диабета (International Diabetes Federation, IDF), распространенность сахарного диабета (СД) в мире на 2025 г. составляет 589 млн человек в возрасте 20–79 лет, что соответствует 11,1% населения этой возрастной группы. Прогнозируется увеличение распространенности СД к 2050 г. до 852,5 млн человек, что составит 45%, на фоне увеличения прогнозируемой общей численности населения планеты на 25% [1]. В Европе распространенность СД на 2024 г. оценивают в 9,8% населения. По данным IDF, Российская Федерация входит в топ-5 европейских стран по абсолютной численности больных СД
(7,6 млн) [1]. Однако, по данным ГНЦ РФ ФГБУ НМИЦ эндокринологии, общее число пациентов с СД в РФ на 01.01.2025 составило 5 463 982 человека (3,5% населения), из них 92,4% представлены пациентами с СД 2-го типа (СД2), 5,5% – пациентами с СД 1-го типа (СД1) [2].
Следует обратить внимание, что, по данным IDF, в 2024 г. в мире среди взрослого населения 42,8% (251,7 млн человек) имеют недиагностированный СД [1]. Действительно, ранее было показано, что в регистре фиксируются только выявленные случаи СД, а число случаев недиагностированного СД составляет примерно половину от общего числа пациентов (46%), что подтверждается результатами масштабного национального эпидемиологического исследования NATION, по данным которого, фактическая распространенность СД2 при активном скрининге по уровню гликированного гемоглобина (HbA1c) в 2 раза выше регистрируемых цифр и составляет 5,4% населения РФ [3]. Таким образом, в мире значительная часть пациентов, имея недиагностированный СД, не получают лечение и подвергаются повышенному риску развития диабетических осложнений и преждевременной смерти. Глобальные демографические изменения, характеризующиеся постарением населения и тенденциями увеличения длительности жизни с СД, поддерживают актуальность проблемы хронических осложнений СД.
Диабетическая нейропатия (ДН) – одно из наиболее распространенных осложнений СД. По данным анализа динамики распространенности диабетических осложнений и их терминальных форм за период 2010–2022 гг., отмечена стабилизация распространенности диабетический нейропатии при СД1 на уровне 44,08–47,40%, при СД2 – 22,31–23,75% [4]. В настоящее время не существует специфического лечения, способного обратить вспять повреждение нервов. Контроль уровня глюкозы может эффективно предотвратить периферическую ДН и сердечно-сосудистую вегетативную нейропатию при СД1, незначительно замедлить их прогрессирование при СД2, но не может обратить вспять потерю нейронов. Контроль других модифицируемых факторов риска (включая массу тела, уровень липидов и артериальное давление) может помочь предотвратить прогрессирование ДН при СД2 и замедлить прогрессирование заболевания при СД1 [5].
Наличие периферической сенсорной нейропатии является наиболее распространенной причиной синдрома диабетической стопы (СДС), реже регистрируются ишемическая и нейроишемическая формы СДС. К нейропатическим формам СДС относят трофическую язву стоп и диабетическую нейроостеоартропатию (НОА). СДС – одно из наиболее тяжелых и трудно управляемых осложнений СД. СДС определяется как инфекция, язва и/или деструкция глубоких тканей, связанная с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей разной степени тяжести [2].
Согласно оценкам Глобального исследования бремени болезней, 199 млн человек страдают заболеваниями стоп, связанными с СД [6]. Примерно у 34% пациентов с СД в течение жизни развивается язва стопы. Примерно 20% пациентов с диабетической язвой стопы нуждаются в госпитализации, и от 15 до 20% госпитализированных пациентов подвергаются ампутации нижних конечностей [7].
СДС, возникающий в основном в результате ДН, представляет собой сложную проблему, которая приводит к значительной заболеваемости и становится все более серьезным бременем для здравоохранения.
В ходе многоцентрового исследования было установлено, что ДН является причиной язв у 78% людей с СД, а также что у 63% участников наблюдалась триада периферической сенсорной нейропатии, незначительной травмы и деформации стопы [5]. Недавний обзор показал, что 5-летняя смертность при НОА, язвах на стопе, малых и больших ампутациях составляет 29,0; 30,5; 46,2 и 56,6% соответственно [7]. Деформации костей и суставов, возникающие в результате активного течения НОА, предрасполагают к образованию язв и инфицированию, что значительно повышает риск ампутации нижней конечности. НОА – наиболее сильный фактор риска трофических язв стопы: развивающиеся вследствие НОА деформации стопы повышают риск хронических язв на стопе и ампутации нижней конечности в 15–40 раз [8]. Сочетание деформации, ограниченной подвижности, частых инфекций и госпитализаций оказывает значительное влияние на повседневную жизнь пациентов не только в физическом, но и в психологическом плане [9].
Истинная распространенность НОА неизвестна, в основном потому, что отсутствие боли при периферической ДН часто влияет на время обращения за медицинской помощью. В предыдущих исследованиях, проведенных в нескольких группах населения, сообщалось о распространенности СДС в диапазоне от 0,04 до 0,3–0,5% пациентов с СД. По некоторым зарубежным данным, распространенность НОА составляет 0,56–0,79%, а заболеваемость – 6,4–9,5 на 10 тыс. человек с СД [10, 11]. Факторы риска, генетические маркеры, скрининговые показатели НОА в полной мере не изучены [8, 12], что затрудняет раннее выявление и разработку эффективных методов профилактики. В современной зарубежной научной литературе появились работы, посвященные роли нейтрофилов в патогенезе СДС, а именно – исследованию функциональной активности нейтрофилов, формированию этими клетками внеклеточной ловушки (нетоз). Оценка функционального состояния нейтрофилов в аспекте нетоза при различных вариантах СДС представляется актуальной и перспективной задачей с научной (установления роли в патогенезе) и практической (в аспекте верификации активности НОА) точек зрения.
Цель исследования – оценить способность нейтрофилов периферической крови к формированию нейтрофильных внеклеточных ловушек (НВЛ) у пациентов с диабетическими поражениями стопы.
Материалы и методы
Способность нейтрофилов периферической крови к формированию НВЛ исследовали у здорового волонтера, у пациента с СД2, СДС, некрозом I пальца правой стопы, трофической язвой в области культи I пальца правой стопы (пациент с СДС – пациент 1) и у пациента с СД2, диабетической НОА справа, подострой стадии, экзартикуляцией V пальца левой стопы (пациент с СДС и НОА – пациент 2).

Выделение нейтрофилов проводили из гепаринизированной периферической венозной крови с использованием двойного градиента плотности фиколла-верографина (верхний слой – 1,077, нижний – 1,105). Нейтрофилы собирали на границе между слоями градиента, после чего дважды отмывали физиологическим раствором. Концентрацию клеток доводили до 5000 кл/мкл.
Для стимуляции нейтрофилов к формированию ими внеклеточных ловушек раздельно использовали два активатора: 1) смесь бактерий Lactobacillus (L.) reuteri,
L. acidophilus, L. rhamnosus и Bifidobacterium longum, которую разводили в физиологическом растворе в концентрации 2,5×109 бактерий на 1 мл раствора; 2) раствор тромбина с активностью 9 МЕ/мл (набор «Тромбин-реагент»; НПО «Ренам», Россия). Отношение объема каждого из стимуляторов к объему взвеси нейтрофилов составляло 1:10.
После 30-минутной инкубации с каждым из активаторов при 37 °C готовили препараты по методу «раздавленной капли». На предметное стекло наносили 8 мкл суспензии нейтрофилов, добавляли 2,5 мкл йодида пропидия (0,1 мг/мл) и аккуратно накрывали покровным стеклом (24×48×0,17 мм). Препараты анализировали с помощью комбинированного освещения: галогенового проходящего и испускаемого флюоресцентного света (возбуждение – 450–480 нм, эмиссия – от 515 нм). Проводили подсчет абсолютного числа нитевидных НВЛ, облаковидных НВЛ, клеток раннего нетоза, активированных и интактных нейтрофилов (рис. 1). Способность нейтрофилов к формированию НВЛ оценивали путем расчета процентного соотношения облаковидных и нитевидных НВЛ относительно общего числа флюоресцентно-позитивных (облаковидные и нитевидные НВЛ, клетки раннего нетоза, активированные нейтрофилы) и флюоресцентно-негативных (интактные нейтрофилы) объектов (см. рис. 1).
От обследуемых получено информированное добровольное согласие на участие в исследовании. Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (21.04.2025).
Результаты
Пациенты 1 и 2 – люди пожилого возраста с анамнезом длительного течения СД2, множественными хроническими диабетическими микрососудистыми осложнениями и атеросклеротическими поражениями сосудов – поступили в отделение гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9 (заведующий отделением – В.В. Ходус) в марте 2025 г. со сходными основными жалобами на общую слабость, выраженные боли в ногах при ходьбе, в покое, в том числе ночные боли.
Клиническая характеристика обследованных пациентов представлена в табл. 1 и 2. При проведении инструментального обследования по результатам мультиспиральной компьютерной томографии сосудов нижних конечностей у пациента 1 выявлены признаки стенозов левых бедренной, подколенной артерий, диффузного поражения артерий обеих голеней; у пациента 2 – признаки окклюзии левой задней большеберцовой артерии. При электронейромиографии в обоих случаях установлены признаки аксонального демиелинизирующего поражения, функционального поражения моторных волокон малоберцового и большеберцового нервов правой нижней конечности. У пациента 1 в феврале 2025 г. возник некроз I пальца стопы (проведена ампутация I пальца правой стопы с резекцией головки плюсневой кости), у пациента 2 в 2021 г. по поводу СДС проведена ампутация V пальца левой стопы, а в августе 2024 г. после травмы правой стопы верифицирована диабетическая НОА.
 На момент поступления локальный статус (нижние конечности) пациентов имел следующие характеристики. Пациент 1: нижние конечности симметричны. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Кожные покровы теплые на ощупь. Пульсация на бедренных и подколенных артериях сохранена с обеих сторон, на берцовых артериях и АТС – отсутствует. В области культи I пальца правой стопы – трофическая язва (некроз краевых лоскутов). На тыле левой стопы – трофическая язва (некроз тыла стопы размером 6,5×10 см с некрозом сухожилия разгибателя I пальца и вовлечением плюснефалангового сустава). Гиперкератоз на подошвах. Ногтевые пластины деформированы. Пациент 2 (рентгенография правой стопы – рис. 2): нижние конечности симметричные. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Ампутационная культя V пальца левой стопы. Правая стопа умеренно отечна, свод уплощен, деформация костей плюсны, пролабирование кубовидной кости с формированием язвенного дефекта на подошвенной поверхности диаметром до 1 см, края раны плотные, гиперкератоз, скудное серозное отделяемое из раны. Пульсация на бедренных артериях сохранена, на подколенных артериях справа и слева – ослаблена, ниже – не определяется.
На момент поступления локальный статус (нижние конечности) пациентов имел следующие характеристики. Пациент 1: нижние конечности симметричны. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Кожные покровы теплые на ощупь. Пульсация на бедренных и подколенных артериях сохранена с обеих сторон, на берцовых артериях и АТС – отсутствует. В области культи I пальца правой стопы – трофическая язва (некроз краевых лоскутов). На тыле левой стопы – трофическая язва (некроз тыла стопы размером 6,5×10 см с некрозом сухожилия разгибателя I пальца и вовлечением плюснефалангового сустава). Гиперкератоз на подошвах. Ногтевые пластины деформированы. Пациент 2 (рентгенография правой стопы – рис. 2): нижние конечности симметричные. Нарушены все виды чувствительности (вибрационная – 0, тактильная, болевая, температурная – снижены). Ампутационная культя V пальца левой стопы. Правая стопа умеренно отечна, свод уплощен, деформация костей плюсны, пролабирование кубовидной кости с формированием язвенного дефекта на подошвенной поверхности диаметром до 1 см, края раны плотные, гиперкератоз, скудное серозное отделяемое из раны. Пульсация на бедренных артериях сохранена, на подколенных артериях справа и слева – ослаблена, ниже – не определяется. У пациентов с СД2, в отличие от здоровых доноров, наблюдалась повышенная способность нейтрофилов к образованию НВЛ при стимуляции как пробиотиком, так и тромбином (рис. 3–5). При этом нейтрофилы пациента с НОА (стопа Шарко) демонстрировали более выраженное формирование нитевидных НВЛ по сравнению с нейтрофилами пациента с СДС (рис. 4, 5).
Особый интерес представляла реакция нейтрофилов пациента со стопой Шарко на стимуляцию тромбином: в этом случае наблюдалось образование протяженных нитевидных НВЛ, объединявших как активированные, так и интактные нейтрофилы в крупные агрегированные структуры, занимающие несколько полей зрения. В случае же стимуляции пробиотиком у данного пациента преобладали нитевидные НВЛ увеличенной площади по сравнению с таковыми у пациента с СДС (см. рис. 5).


При микроскопии препаратов нейтрофилов пациента 1 после активации пробиотиком выявлялись единичные плотные агрегаты НВЛ, а также облаковидные НВЛ, клетки раннего нетоза и активированные нейтрофилы. После стимуляции тромбином в этой группе отмечалось значительное увеличение количества облаковидных НВЛ, клеток раннего нетоза и активированных нейтрофилов по сравнению с воздействием пробиотика (см. рис. 3).
У пациента с НОА (пациент 2) пробиотик индуцировал образование НВЛ менее интенсивно, чем тромбин, однако его стимулирующий эффект превышал таковой у пациента с СДС (см. рис. 3, 4). У пациента 2 после пробиотической стимуляции в препаратах обнаруживались активированные нейтрофилы и клетки раннего нетоза, но их доля была существенно ниже, чем при воздействии тромбина (см. рис. 4).
Полученные данные свидетельствуют о различиях в реактивности нейтрофилов у пациентов с разными формами диабетического поражения стоп, что может отражать особенности патогенеза этих состояний.
Обсуждение
Без своевременной диагностики и лечения СДС (включая НОА и язву стопы) в тяжелых случаях может привести к ампутации стопы или сепсису [13]. Особенно сложна диагностика НОА, которая, по некоторым данным, опаздывает в четверти случаев [8, 12]. На сегодняшний день одним из основных вопросов, требующих решения, является разработка четко сформулированных и подтвержденных, объективных и воспроизводимых критериев для диагностики активной стадии НОА, мониторинга активности заболевания и определения ремиссии. Используемые клинические признаки (локальная гипертермия) не изучены с точки зрения информативности для определения активности и ремиссии, лабораторные признаки (уровень С-реактивного белка, количество лейкоцитов, соотношения нейтрофилов и лимфоцитов, тромбоцитов и лимфоцитов, другие расчетные индексы воспалительных реакций, активность щелочной фосфатазы) подвержены широкому диапазону колебаний и не имеют доказательств значимости для диагностики активной НОА [14]. Экспертные сообщества отмечают, что также необходимы дальнейшие исследования, посвященные мониторингу активности заболевания с точки зрения визуализации, так как отсутствие четкого соответствия между данными магнитно-резонансной томографии и клиническими признаками затрудняет клиническую оценку актуального локального статуса [8, 12].
Согласно современным представлениям, НОА рассматривается как воспалительный процесс у людей с периферической полинейропатией, который приводит к повреждению костей, суставов и мягких тканей (возможно, у людей с генетическими факторами риска). Предполагается, что непропорциональное высвобождение провоспалительных и противовоспалительных цитокинов сопряжено с активацией ядерного фактора κB (NF-κB) через лиганд рецептора активатора NF-κB (RANKL), который стимулирует остеокластогенез. Происходит пролиферация и дифференцировка предшественников остеокластов в высокоагрессивные остеокласты с повышенной резорбирующей активностью в ответ на RANKL и фактор некроза опухоли α. Этот воспалительный процесс в сочетании с механическими усилиями при ходьбе на фоне ДН может привести к разрыву или ослаблению связок, вывихам суставов и/или переломам стопы/лодыжки [12]. Инфекция при СДС стимулирует формирование НВЛ как естественную реакцию на патоген, однако нарушение регуляции этого процесса, сопровождающееся избыточным формированием НВЛ – нетозом, может вызывать повреждение тканей и затруднять заживление тканевых дефектов при СДС: формирование НВЛ утрачивает свое биологическoе защитное действие и становится патологическим процессом [15]. Гипергликемия также может индуцировать нетоз посредством включения пути НАДФH-оксидазы и генерации активных форм кислорода (механизм суицидального нетоза) [16].
Нами было обнаружено, что нейтрофильные лейкоциты, выделенные из периферической крови больных СД2 с СДС, при воздействии стимуляторов нетоза способны формировать НВЛ. При этом НВЛ у них формируются в значительно большем количестве, чем у здоровых лиц, в особенности у пациентов с НОА. Доля НВЛ, формируемых в ответ на воздействие неспецифического антигенного стимулятора бактериальной природы, достаточно высока и сопоставима с ранее обнаруженными нами изменениями, наблюдавшимися у больных туберкулезом [16, 17] и язвенным колитом [18]. Такие изменения связаны с механизмом действия НВЛ. Формирование НВЛ является нормальной функцией нейтрофилов и направлено на уничтожение патогенов при помощи фиксированных на НВЛ протеолитических ферментов, продуктов ферментов, обеспечивающих генерацию активных форм кислорода и антибактериальных белков (таких как нейтрофильная эластаза, миелопероксидаза, кальпротектин и др.) [19]. Появление НВЛ является частью острофазового ответа и тесно связано с ним. Было показано наличие корреляционной связи между уровнем С-реактивного белка и выраженностью нетоза у пациентов с СД2 и сердечной недостаточностью. Более того, сыворотка крови этих больных вызывала формирование внеклеточных ловушек нейтрофилами, полученными от здоровых доноров [20]. Другой интересной находкой является способность нейтрофилов, изолированных из крови, к образованию внеклеточных ловушек под действием тромбина in vitro. Тромбин может влиять на протеом НВЛ [21], а сами события нетоза тесно связаны с процессами коагуляции [22]. Нарушение контроля процесса образования НВЛ может привести к существенным повреждениям тканей и стать причиной системного воспалительного ответа [15] или системных нарушений коагуляции – иммунотромбоза [23].
Заключение
Полученные результаты не противоречат гипотезе о том, что особенности формирования НВЛ при действии различных стимуляторов у больных СД2 могут отражать активность, клиническую форму СДС, возможно, маркировать развитие терминальной стадии, что представляется материалом для дальнейших исследований.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare no conflict of interest.
Финансирование. Исследование выполнено за счет гранта Российского научного фонда №25-25-20206, https://rscf.ru/project/25-25-20206/
Funding. The study was supported by the Russian Science Foundation grant No. 25-25-20206, https://rscf.ru/project/25-25-20206/
Информация об авторах
Information about the authors
Друк Инна Викторовна – д-р мед. наук, доц., зав. каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ. E-mail: drukinna@yandex.ru; ORCID: 0000-0001-8317-7765
Inna V. Druk – Dr. Sci. (Med.), Assoc. Prof., Omsk State Medical University. E-mail: drukinna@yandex.ru. ORCID: 0000-0001-8317-7765
Новиков Дмитрий Георгиевич – канд. мед. наук, доц. каф. клинической лабораторной диагностики, зав. Центральной научно-исследовательской лабораторией ФГБОУ ВО ОмГМУ.
ORCID: 0000-0002-4339-2222
Dmitry G. Novikov – Cand. Sci. (Med.), Assoc. Prof., Omsk State Medical University. ORCID: 0000-0002-4339-2222
Золотов Александр Николаевич – канд. мед. наук, ст. науч. сотр. Центральной научно-исследовательской лаборатории ФГБОУ ВО ОмГМУ. ORCID: 0000-0002-6775-323X
Alexander N. Zolotov – Cand. Sci. (Med.), Senior Res. Officer, Omsk State Medical University. ORCID: 0000-0002-6775-323X
Кириченко Николай Александрович – мл. науч. сотр. Центральной научно-исследовательской лаборатории ФГБОУ ВО
ОмГМУ. ORCID: 0000-0002-8411-0973
Nikolay A. Kirichenko – Res. Assist., Omsk State Medical University. ORCID: 0000-0002-8411-0973
Кирх Елизавета Александровна – ординатор каф. внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ
Elizabeth А. Kirch – Clinical Resident, Omsk State Medical University
Ходус Владимир Владимирович – зав. отд-нием гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9
Vladimir V. Hodus – surgeon, Clinical Health Unit No. 9
Индутный Антон Васильевич – д-р мед. наук, доц., зав. каф. клинической лабораторной диагностики ДПО ФГБОУ ВО ОмГМУ. ORCID: 0000-0003-1951-5824
Anton V. Indutny – Dr. Sci. (Med.), Assoc. Prof., Omsk State Medical University. ORCID: 0000-0003-1951-5824
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней ФГБОУ ВО
ОмГМУ. ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Assoc. Prof., Prof., Omsk State Medical University. ORCID: 0000-0002-1597-1876
Сорокина Елена Альбертовна - д-р мед. наук, зам. гл. врача по терапевтической помощи БУЗОО МСЧ №9
Elena А. Sorokina – Dr. Sci. (Med.), Deputy Chief Physician for therapeutic сare, Clinical Health Unit No. 9
Ромашова Наталья Александровна – врач-эндокринолог отд-ния гнойной хирургии №2 для больных с критической ишемией нижних конечностей и диабетической стопы БУЗОО МСЧ №9
Natalia А. Romashova – endocrinologist, Clinical Health Unit No. 9
Поступила в редакцию: 04.07.2025
Поступила после рецензирования: 25.07.2025
Принята к публикации: 24.07.2025
Received: 04.07.2025
Revised: 25.07.2025
Accepted: 24.07.2025
Список исп. литературыСкрыть список1. International Diabetes Federation. IDF Diabetes Atlas. 11th ed. Brussels: IDF; 2025. https://diabetesatlas.org/media/uploads/sites/3/2025/ 04/IDF_Atlas_11th_Edition_2025-1.pdf
2. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой, О.Ю. Сухаревой. 12-й выпуск. М.; 2025. 247 с.
Standards of Specialized Diabetes Care. Eds Dedov I.I., Shestakova M.V., Sukhareva O.Yu. 12th ed. Moscow; 2025. 247 р. (in Russian).
3. Дедов И.И., Шестакова М.В., Викулова О.К. и др. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным Федерального регистра сахарного диабета, статус 2017 г. Сахарный диабет. 2018;21(3):144-59. DOI: 10.14341/DM9686
Dedov I.I., Shestakova M.V., Vikulova O.K. et al. Diabetes mellitus in Russian Federation: prevalence, morbidity, mortality, parameters of glycaemic control and structure of glucose lowering therapy according to the Federal Diabetes Register, status 2017. Diabetes Mellitus. 2018;21(3):144-59. (in Russian).
4. Дедов И.И., Шестакова М.В., Викулова О.К. и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. Сахарный диабет. 2023;26(2):104-23.
Dedov I.I., Shestakova M.V., Vikulova O.K. et al. Diabetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the period 2010–2022. Diabetes Mellitus. 2023;26(2):104-23. (in Russian).
5. American Diabetes Association Professional Practice Committee; 12. Retinopathy, Neuropathy, and Foot Care: Standards of Care in Diabetes – 2025. Diabetes Care 2025;48(Suppl 1):S252-S265.
6. Zhang Y, Lazzarini PA, McPhail SM et al. Global disability burdens of diabetes-related lower-extremity complications in 1990 and 2016. Diabetes Care. 2020;43(5):964-74. DOI: 10.2337/dc19-1614
7. Armstrong DG, Tan TW, Boulton AJM, Bus SA. Diabetic Foot Ulcers: A Review. JAMA 2023 Jul 3;330(1):62-75. DOI: 10.1001/jama.2023.10578
8. Tsatsaris G, Rajamand Ekberg N, Fall T, Catrina SB. Risk factors for Charcot foot development in individuals with diabetes mellitus. Diabetologia 2024 Dec;67(12):2702-10. DOI: 10.1007/s00125-024-06271-9
9. Argyropoulos M, Wynell-Mayow W, Johnson O et al. Charcot neuro-osteoarthropathy: a review of key concepts and an evidence-based surgical management algorithm. Front Clin Diabetes Healthc 2024 Aug 16;5:1344359. DOI: 10.3389/fcdhc.2024.1344359
10. Svendsen OL, Rabe OC, Winther-Jensen M, Allin KH. How common is the rare Charcot foot in patients with diabetes? Diabetes Care 2021;44(4):e62-e63. DOI: 10.2337/dc20-2590
11. Tsatsaris G, Rajamand Ekberg N, Fall T, Catrina SB. Prevalence of Charcot foot in subjects with diabetes: a nationwide cohort study. Diabetes Care 2023;46(12):e217-e218. DOI: 10.2337/dc23-0628
12. Wukich DK, Schaper NC, Gooday C et al. Guidelines on the diagnosis and treatment of active Charcot neuro-osteoarthropathy in persons with diabetes mellitus (IWGDF 2023). Diabetes Metab Res Rev 2024;40(3):e3646. DOI: 10.1002/dmrr.3646
13. Armstrong DG, Swerdlow MA, Armstrong AA et al. Five year mortality and direct costs of care for people with diabetic foot complications are comparable to cancer. J Foot Ankle Res 2020;13:16. DOI: 10.1186/s13047-020-00383-2
14. Eckert AJ, Zimny S, Altmeier M et al. DPV-Wiss-Initiative. Response to “Commentary on factors associated with diabetic foot ulcers and lower limb amputations in type 1 and type 2 diabetes supported by real-world data from the German/Austrian DPV registry”. J Diabetes 2024;16(12):e70036. DOI: 10.1111/1753-0407.70036
15. Kaplan MJ, Radic M. Neutrophil extracellular traps: double-edged swords of innate immunity. J Immunol 2012;189(6):2689-95. DOI: 10.4049/jimmunol.1201719
16. Farhan A, Hassan G, Ali SHL et al. Spontaneous NETosis in diabetes: A role of hyperglycemia mediated ROS and autophagy. Front Med (Lausanne) 2023;10:1076690. DOI: 10.3389/fmed.2023.1076690
17. Мордык А.В., Золотов А.Н., Новиков Д.Г. и др. Нетозформирующая способность нейтрофилов у пациентов с ограниченным и распространенным туберкулезным процессом. Туберкулез и болезни легких. 2023;101(3):78-86.
Mordyk A.V., Zolotov A.N., Novikov D.G. et al. NETosis-Forming Ability of Neutrophils in Patients with Limited and Disseminated Tuberculous Lesions. Tuberculosis and Lung Diseases. 2023;101(3):78-86. (in Russian).
18. Ливзан М.А., Бикбавова Г.Р., Новиков Д.Г. и др. Оценка нетозобразующей способности нейтрофилов у пациентов с язвенным колитом. Медицинский алфавит. 2023;18:23-7.
Livzan M.A., Bikbavova G.R., Novikov D.G. et al. Assessment of neutrophil NETs-forming activity in patients with ulcerative colitis. Medical Alphabet. 2023;(18):23-7. (in Russian).
19. Baz AA, Hao H, Lan S et al. Neutrophil extracellular traps in bacterial infections and evasion strategies. Front Immunol 2024;15:1357967. DOI: 10.3389/fimmu.2024.1357967
20. Vulesevic B, Lavoie SS, Neagoe PE et al. CRP Induces NETosis in Heart Failure Patients with or without Diabetes. Immunohorizons 2019;3(8):378-388. DOI: 10.4049/immunohorizons.1900026
21. Lim CH, Adav SS, Sze SK et al. Thrombin and Plasmin Alter the Proteome of Neutrophil Extracellular Traps. Front Immunol 2018;9:1554. DOI: 10.3389/fimmu.2018.01554
22. De Bont CM, Boelens WC, Pruijn GJM. NETosis, complement, and coagulation: a triangular relationship. Cell Mol Immunol 2019;16(1):19-27. DOI: 10.1038/s41423-018-0024-0
23. Marcos-Jubilar M, Lecumberri R, Páramo JA. Immunothrombosis: Molecular Aspects and New Therapeutic Perspectives. J Clin Med 2023;12(4):1399. DOI: 10.3390/jcm12041399

