Клинический разбор в общей медицине №10 2025
1 Novosibirsk State Medical University, Novosibirsk, Russia;
2 Novosibirsk State University, Novosibirsk, Russia;
larut@list.ru
Abstract
Traditional methods of glycemic assessment, such as glycated hemoglobin (HbA1c) and the oral glucose tolerance test, may not reflect all aspects of carbohydrate metabolism, especially at the prediabetes stage.
Aim. To compare ambulatory glucose profiles obtained using the FreeStyle Libre 1 system in individuals with normal carbohydrate tolerance and dysglycemia.
Materials and methods. A single-center observational study including 32 patients (aged 31 to 72 years) with risk factors for type 2 diabetes mellitus. Anthropometric parameters, biochemical blood analysis, and continuous glucose monitoring (CGM) data over 14 days were assessed.
Results. Patients with prediabetes showed no statistically significant differences from healthy individuals in HbA1c levels; however, they exhibited higher levels of average glucose (AG) and the glucose management indicator (GMI). Time in tight target range (TITR) was significantly greater in the dysglycemia group. Correlations between glucose metrics varied depending on the presence of dysglycemia.
Conclusion. Continuous glucose monitoring allows for a more accurate assessment of glycemic control metrics and may be useful for early interventions in individuals at high risk of diabetes. Further research is needed to optimize the use of CGM and develop individualized intervention strategies.
Keywords: continuous glucose monitoring, glucose intolerance, prediabetes, glycemic variability, glycemic control, diabetes prevention.
For citation: Kovarenko M.A., Ruyatkina L.A., Ilushchenko A.A., Anmut V.A. Early dysglycemia in continuous glucose monitoring metrics. Clinical review for general practice. 2025; 6 (10): 24–31 (In Russ.). DOI: 10.47407/kr2025.6.10.00689
Введение
В течение многих лет в качестве «золотого стандарта» для оценки гликемических показателей используются гликированный гемоглобин (HbA1c) и пероральный глюкозотолерантный тест (ПГТТ) [1]. Появление в клинической практике непрерывного мониторинга глюкозы (НМГ) открывает новые возможности для оценки углеводного обмена, предоставляя дополнительную информацию, отличную от классических критериев.
Влияние вариабельности глюкозы (ВГ) на развитие хронических осложнений диабета в настоящее время является одним из дискуссионных вопросов в диабетологии [2]. Значение ВГ в комплексной оценке гликемического контроля при диабете, а также наиболее удачные математические модели расчета ВГ до настоящего времени не определены. Еще менее изучена вариабельность уровня глюкозы у лиц с предиабетом, установленным на основании классических диагностических критериев. Однако метаанализ, включающий 71 исследование, показал, что ВГ повышена уже в ситуации предиабета, потенциально связана с дисфункцией бета-клеток и развитием коронарного атеросклероза и может предсказывать сердечно-сосудистые события и сахарный диабет 2-го типа (СД2) [3]. Опубликованные к настоящему времени данные по НМГ у пациентов с предиабетом ставят под сомнение достаточность используемых классических диагностических инструментов (HbA1c, ПГТТ) [4, 5]. Также не вполне понятно, что первично в ходе развития нарушений регуляции глюкозы – изменения ВГ или увеличение средней гликемии, оцениваемой по уровню HbA1c.
Оценка ВГ при ранних нарушениях углеводного обмена могла бы стать комплементарным способом классификации толерантности к глюкозе и стратификации риска диабета, независимо от традиционных диагностических критериев. Кроме того, поскольку хронические осложнения СД присутствуют у части пациентов уже на стадии предиабета [2], анализ ВГ может помочь ответить на вопрос о ее потенциальной роли в развитии осложнений у этой категории пациентов. Недавнее исследование H. Sugimoto и соавт. (2025) продемонстрировало, что метрики НМГ превосходят диагностические модели, использующие традиционные данные (уровень глюкозы крови натощак, HbA1c и показатели ПГТТ), в прогнозировании индекса диспозиции, получаемого с помощью клэмп-тестов [6].
Целью исследования являлось сравнение амбулаторных профилей глюкозы с использованием данных периодически сканируемой системы FreeStyle Libre 1 у лиц с нормальной толерантностью к углеводам и дисгликемией, установленной с использованием критериев Американской диабетологической ассоциации (American Diabetes Association, ADA).
Этическая экспертиза. Исследование выполнено с соблюдением этических принципов проведения научных медицинских исследований с участием человека, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации, и в соответствии с этическими нормами и правилами, предусмотренными бюллетенем Высшей аттестационной комиссии Министерства образования Российской Федерации №3 от 2002 г. «О порядке проведения биомедицинских исследований у человека». Проведение исследования одобрено комитетом по этике ФГАОУ ВО «Новосибирский национальный исследовательский государственный университет» (протокол №114/1 от 20.11.2023).
Материалы и методы
Клиническое одноцентровое наблюдательное поперечное исследование проводилось с сентября 2023 г. по ноябрь 2024 г. на базе клинико-диагностического отделения АО МЦ «Авиценна», г. Новосибирск. В исследование были включены 32 пациента (в том числе 18 мужчин и 16 женщин) в возрасте от 31 года до 72 лет, обратившихся к терапевту для профилактического медицинского обследования, без специфических жалоб, имеющих по крайней мере один фактор риска СД2 (избыточная масса тела/ожирение, артериальная гипертония, дислипидемия, синдром поликистозных яичников, гиперурикемия, метаболически ассоциированная жировая болезнь печени, гестационный диабет в анамнезе), подписавших добровольное информированное согласие на участие в исследовании.
Критерии исключения: лица, которые имели хотя бы одно сердечно-сосудистое событие в течение жизни; установленный СД 1-го типа; наследственную дислипидемию; хронические заболевания почек; злокачественные новообразования любой локализации, в том числе в анамнезе; острые воспалительные или обострения хронических заболеваний; беременность; злоупотребление алкоголем или наркотическими/лекарственными препаратами; прием препаратов, влияющих на метаболизм глюкозы (сахароснижающие, препараты для лечения ожирения, глюкокортикоиды, нейролептики).
После клинического осмотра и измерения артериального давления оценены антропометрические параметры. Измерение роста производилось ростомером МСК-233 (с точностью до 0,1 см), измерение массы тела: натощак, без обуви, в легкой одежде – на медицинских весах ВЭМ-150.3-А2 (с точностью до 0,1 кг). Индекс массы тела (ИМТ) рассчитывался по формуле: ИМТ (кг/м2) = масса тела (кг) / (рост (м) × рост (м)). Исследован биохимический анализ крови с определением липидного профиля (общий холестерин – ХС, холестерин липопротеидов низкой плотности – ЛПНП, холестерин липопротеидов высокой плотности – ЛПВП, триглицериды – ТГ), глюкоза, гликированный гемоглобин. При уровне глюкозы плазмы натощак (ГПН) 5,6 ммоль/л глюкоза натощак исследовалась повторно. Триглицерид-глюкозный индекс (TyG) рассчитывали по формуле: Ln [ТГ натощак (мг/дл) × ГПН (мг/дл)/2], где Ln – логарифм [7].
После оценки состояния углеводного обмена исследуемые были разделены на две группы. В группу 1 вошли лица без дисгликемии в анамнезе и на момент обследования; в группу 2 – пациенты с впервые установленным предиабетом по критериям ADA 2025 г.:
HbA1c 5,7–6,4% (39–47 ммоль/моль) или ГПН 5,6–6,9 ммоль/л [8].
Мониторинг уровня глюкозы в межклеточной жидкости проводился в течение 14 дней с помощью периодически сканируемой системы FreeStyle Libre 1. Поскольку исследование является неинтервенционным, участникам не было рекомендовано соблюдать определенную диету или режим физической активности. Были даны рекомендации придерживаться обычного образа жизни для получения реальной картины уровня глюкозы в повседневных условиях. Пациенты, использовавшие датчик менее 14 дней из-за технических проблем (отсоединение датчика), в исследование не включались.
Получены данные о времени в целевом диапазоне 3,9–10,0 ммоль/л (TIR), времени ниже целевого диапазона – менее 3,9 ммоль/л (TBR), времени выше целевого диапазона – более 10,0 ммоль/л (TAR), времени в узком целевом диапазоне – 3,9–7,8 ммоль/л (TITR), времени выше узкого целевого диапазона – более
7,8 ммоль/л (выше TITR) в процентах, а также средняя концентрация глюкозы за исследуемый период в ммоль/л (AVG); коэффициент вариации CV в %; индикатор управления глюкозой (GMI) в %.
Статистическая обработка данных проводилась с помощью пакета программ Statistica 13.0 (StatSоft, Inc.). Проверка на нормальность распределения признаков осуществлялась с использованием критерия Шапиро–Уилка. Различия параметров амбулаторного профиля глюкозы между группами были оценены с использованием критерия U-критерия Манна–Уитни. Данные представлены в виде медианы и межквартильного диапазона (Me [Q1; Q3]). Статистически значимыми считались различия соответствующих критериев параметрической и непараметрической статистики при p<0,05. Для корреляционного анализа использован непараметрический критерий Спирмена. При значениях коэффициента Спирмена (R) <0,3 корреляция считалась слабой, 0,3–0,5 – умеренной, 0,5–0,7 – средней, 0,7–0,9 – высокой, >0,9 – очень высокой.
Результаты
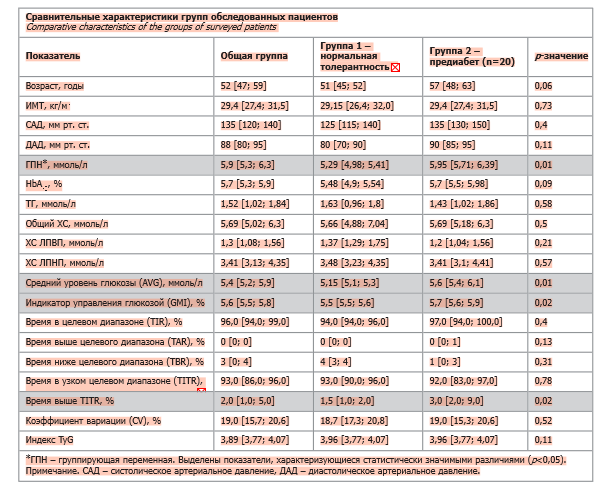
В анализируемых группах показатели возраста, ИМТ, гемодинамики, липидные профили были сравнимы (см. таблицу).
При статистически значимых различиях по уровню ГПН, традиционно маркирующей вариант предиабета – нарушенную гликемию натощак, разницы между группами по уровню HbA1c не отмечено. Также не различались следующие глюкозные параметры, оцененные с помощью периодически сканируемой системы FreeStyle Libre: TIR, TITR, CV, показатели времени выше и ниже целевого диапазона. При этом средний уровень глюкозы (AVG), индикатор управления глюкозой (GMI) и время выше узкого целевого диапазона в группе 2 статистически значимо превышали таковые в группе 1 (р=0,02–0,01).
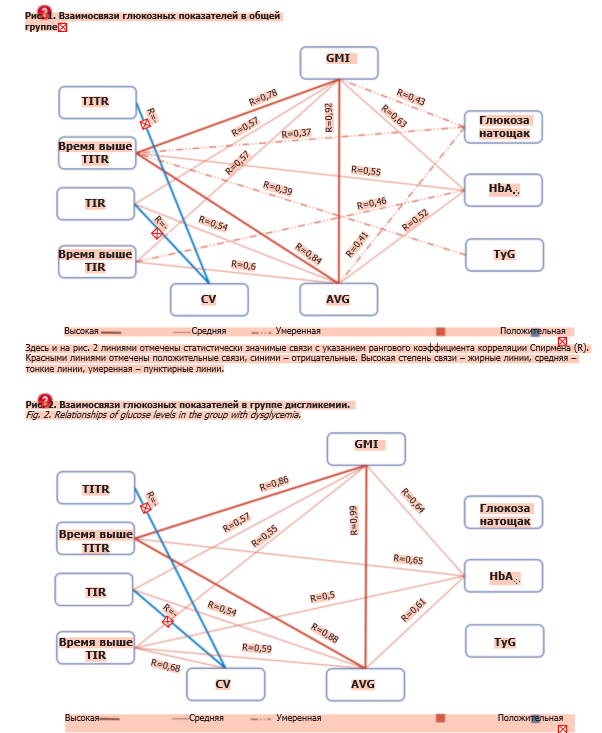
Показатель GMI тесно положительно коррелировал с TITR (R=0,78; р=0,008) и показателем AVG (R=0,92; р=0,006) в общей когорте лиц (рис. 1), с некоторым усилением указанных связей в группе с дисгликемией (рис. 2) соответственно (R=0,86 и R=0,99; р=0,006), образуя в обеих группах своеобразный треугольник. Наличие разносторонних связей глюкозных показателей в общей группе несколько изменяется при дисгликемии: усиливается зависимость TITR с HbA1c (R=0,65; р=0,01), но теряются корреляции GMI, AVG и TITR с ГПН.
Обсуждение
Введение НМГ для контроля углеводного обмена у пациентов с СД открыло новую эру в клинической практике, сместив характеристику гликемического контроля с HbA1c на новый показатель – ВГ [9]. Обосновано мнение о ключевой роли ВГ в ускоренном развитии диабетических осложнений [10], независимо от HbA1c [11], поскольку более строгий контроль HbA1c сам по себе недостаточен для предотвращения сердечно-сосудистых событий, вызванных длительной высокой ВГ [12].
Ранее было показано, что в физиологических условиях у здорового человека колебания уровня глюкозы происходят в очень узком диапазоне, характеризуясь низкой вариабельностью и высокой стабильностью [13]. Однако недавние исследования выявили существенную гетерогенность ВГ даже среди лиц, классифицированных как имеющих нормальную толерантность к глюкозе в соответствии с общепринятыми критериями [14, 15]. Вероятно, традиционные способы оценки углеводного обмена могут пропускать ранние изменения в регуляции глюкозы, предшествующие клинически выраженной дисгликемии. Действительно, сообщается, что снижение секреции инсулина и чувствительности к инсулину начинается за несколько лет до того, как будет диагностирован диабет [16]. Снижение функции бета-клеток, наблюдаемое у многих лиц с предиабетом, его неизбежное прогрессирование до СД2 без профилактических вмешательств подчеркивают важность ранней идентификации групп высокого риска [17].
Эпидемиологические исследования [18, 19] продемонстрировали клиническую значимость даже небольшого повышения уровня ГПН. Риски СД и сердечно-сосудистых заболеваний возрастают уже у лиц с уровнем ГПН, превышающим 5,6 ммоль/л, что подчеркивает ключевую роль раннего вмешательства в профилактике этих состояний [20]. Несоответствие между пороговыми значениями уровня глюкозы для диагностики предиабета, предложенными ADA (≥5,6 ммоль/л), и общепринятым консенсусом (>6,1 ммоль/л) означает «ускользание» отдельных пациентов из категории целевых вмешательств. Непрерывные данные о концентрации глюкозы, полученные с помощью систем непрерывного мониторинга, устраняют ограничения традиционных методов и представляют собой инструмент, позволяющий восполнить этот пробел в диагностике нарушений углеводного обмена.
Классические исследования L. Monnier и соавт. (2003) продемонстрировали преобладание относительного влияния постпрандиального уровня глюкозы на уровень HbA1c у достаточно контролируемых пациентов с СД2, а также постепенное увеличение вклада гипергликемии натощак в ухудшение течения диабета [21]. Однако диагностические возможности HbA1c в донозологической дисгликемии дискутируются. Согласно критериям ADA, уровень HbA1c 5,7–6,4% был идентифицирован как диагностический диапазон для предиабета [8]. Согласно критериям Всемирной организации здравоохранения, уровни HbA1c >6,0%, но <6,5% отражают повышенный риск СД2 [22], т.е. носят не диагностический для предиабета, а вспомогательный характер. При этом важно, что риск прогрессирования СД2 в зависимости от значений HbA1c является непрерывным и не имеет четких точек перегиба, поэтому риск перехода от нормогликемии к диабету в пределах данного периода времени выше для более высоких значений HbA1c (в 10–13 раз выше для порога HbA1c ≥6,0% и в 4–7 раз выше для порога HbA1c ≥5,7%) [23].
Анализ крупной выборки европейских популяционных данных продемонстрировал монотонно возрастающую связь между временем сердечно-сосудистых событий и уровнями HbA1c >5,7%, указывая на потенциальный риск сердечно-сосудистых заболеваний в диапазоне метаболических отклонений предиабета [24], который при сочетании его вариантов, нарушенной гликемии натощак, нарушенной толерантности к глюкозе и надпороговых уровней HbA1c превышает 20% [25]. Также активная диагностическая тактика в ситуации предиабета позволяет выявлять СД2 на ранней его стадии, актуализируя проблему регресса и ремиссии дисгликемии [23], в том числе с помощью медикаментозной коррекции в добавление к изменению образа жизни [22].
Важным преимуществом НМГ является возможность обнаружения постпрандиальной гипергликемии и ночного повышения уровня глюкозы в крови, которые связаны с увеличением риска прогрессирования СД2 [26, 27]. В целом опубликованные до настоящего времени данные указывают на многообещающую роль ВГ в диагностической и прогностической оценке гомеостаза глюкозы у лиц без диабета.
В настоящем исследовании пациенты группы с предиабетом и группы без нарушений углеводного обмена имели сходные антропометрические характеристики с увеличенным ИМТ, медиана которого соответствует избыточной массе тела (в группе 1 – 29,15 кг/м2, в группе 2 – 29,4 кг/м2; р=0,73). Метаболические параметры в группах (ТГ, общий ХС, ХС ЛПВП, ХС ЛПНП, индекс TyG) статистически значимо не различались, однако отражали наличие дислипидемии. В соответствии с критериями включения и исключения у части обследованных имелась артериальная гипертония, но и по гемодинамическим параметрам группы были сравнимы (см. таблицу).
Исследуемые группы не различались по уровню гликированного гемоглобина, однако продемонстрировали значимые различия в среднем уровне глюкозы AVG (р=0,01) и индикаторе управления глюкозой GMI (р=0,02), что, возможно, связано с временным промежутком, влияющим на исследуемые параметры, –
120 дней для HbA1c и 14 дней для метрик НМГ. Значительные различия между группами также были обнаружены в другом параметре гликемического контроля – времени, проведенном выше узкого целевого диапазона, тогда как время выше целевого диапазона статистически значимо не различалось.
Полученные данные демонстрируют, что в группе лиц с предиабетом (нарушенная глюкоза натощак и/или повышение уровня HbA1c по критериям ADA 2025 г. [8]) время, проведенное выше нормального уровня глюкозы (7,8 ммоль/л), оказалось больше, чем у здоровых, хотя и не достигало значений, характерных для СД. При этом ГПН, группирующая переменная, в группе предиабета не коррелировала с другими глюкозными показателями, что акцентируетт отсутствие информативности точечных показателей глюкозы с учетом их лабильности в сравнении с исследуемыми интегральными параметрами НМГ.
В общей группе гликированный гемоглобин продемонстрировал положительные корреляции средней силы с GMI, AVG и временем выше TITR, которые сохранялись в группе предиабета. Положительная корреляция HbA1c с временем выше целевого диапазона нарастала от умеренной в общей группе до средней в группе предиабета.
Таким образом, глюкоза, оцениваемая по GMI, среднему уровню и времени выше узкого целевого диапазона, была выше в группе предиабета, в то время как ВГ, оцениваемая по коэффициенту вариации CV, между группами не различалась. Несмотря на то что коэффициент вариации CV является более точным параметром по сравнению с SD, поскольку на него не оказывают влияния эффект дисперсии и отдельные выпадающие значения глюкозы, вероятно, указанный индекс вариабельности имеет низкую чувствительность в исследуемой группе. Возможно, это связано с различной ВГ в отдельных категориях предиабета (нарушенная толерантность к глюкозе натощак и нарушенная толерантность к углеводам), которые не выделялись в представленном исследовании из-за небольшого размера группы. ВГ при предиабете требует дальнейших исследований в более крупных группах.
Полученные результаты в отношении времени, проведенного в различных диапазонах концентрации глюкозы, подтверждают потенциальную роль НМГ в диагностике дисгликемии. Статистически значимые различия между группами по времени, проведенному выше узкого целевого диапазона (TITR), при отсутствии различий по времени выше целевого диапазона (TIR) свидетельствуют о том, что в повседневных условиях и вне супрафизиологических тестов (ПГТТ) постпрандиальный уровень глюкозы у лиц с нарушенной толерантностью к глюкозе часто превышает пороговые концентрации. Более того, в обеих группах были выявлены субъекты, имевшие хотя бы один эпизод гипергликемии, соответствующий критериям СД (в группе нормальной толерантности – 1 пациент, в группе дисгликемии – 3 пациента), что соотносится с наличием флуктуирующих стадий нормогликемии [23].
Опубликованные данные по НМГ при СД2 нередко фокусируются на гипогликемии как осложнении инсулинотерапии, однако имеются лишь очень ограниченные данные из реальных условий, особенно у пациентов с СД2, не получающих инсулин, или с предиабетом. Так, E. Castaldo и соавт. (2011) отметили увеличение времени, проведенного в гипогликемии, у лиц с нарушенной толерантностью к глюкозе по сравнению с субъектами с нормальной толерантностью к глюкозе, а также связь этого параметра с толщиной комплекса интима–медиа сонной артерии, маркером доклинического атеросклероза, предлагая рассматривать эпизоды гипогликемии как новый потенциальный фактор риска сердечно-сосудистых заболеваний для лиц с предиабетом [28]. В настоящем исследовании время в низком диапазоне не различалось между группами.
Полученные результаты демонстрируют, что изменения гомеостаза глюкозы при предиабете в исследуемой популяции связаны с повышением уровня средней гликемии, но не с повышением ВГ, оцениваемой по CV.
В целом это является подтверждением концепции об относительной независимости показателей гликированного гемоглобина и ВГ, дающих взаимодополняющую оценку гликемического контроля.
Таким образом, непрерывный мониторинг глюкозы является новым инструментом для оценки гомеостаза глюкозы на ранних этапах нарушений углеводного обмена. Кроме того, данные НМГ предоставляют информацию о гликемических паттернах продуктов у конкретного человека, позволяя персонализировать вмешательства (например, корректируя диету при выраженной постпрандиальной гипергликемии). Таким образом, помимо диагностической ценности, НМГ способствует вовлеченности пациента в управление углеводным обменом и соблюдению диетических рекомендаций [29–31].
Заключение
Появление систем НМГ в рутинной клинической практике может способствовать раннему выявлению нарушений углеводного обмена, разработке персонифицированных стратегий вмешательства и вовлечению пациентов в самоконтроль глюкозы. Безусловно, стоимость систем НМГ и необходимость обучения являются определенными барьерами, тем не менее потенциал НМГ в диагностике предиабета очевиден.
Будущие исследования должны быть направлены на разработку алгоритмов НМГ и использование искусственного интеллекта для оптимизации гликемического контроля. Оценка данных НМГ совместно с другими биомаркерами, отражающими чувствительность к инсулину и функцию бета-клеток, поможет более точному пониманию особенностей прогрессирования диабета и разработке индивидуальных подходов к лечению и профилактике, что важно с учетом ухудшения общего прогноза для лиц с предиабетом с течением времени.
Ограничения и преимущества исследования
Основным недостатком исследования является небольшое число участников, что ограничивает возможности статистического анализа по отдельным категориям предиабета (нарушенная глюкоза натощак и нарушенная толерантность к углеводам). Тем не менее результаты показывают определенные тенденции вариабельности уровня глюкозы и направление будущих исследований у лиц с предиабетом.
Поскольку исследование является неинтервенционным, во время 14-дневного периода наблюдения не были стандартизированы питание и физическая активность обследуемых. Кроме того, исследование не было заслепленным, и информация об уровне глюкозы была доступна пациенту в режиме реального времени, что не исключает возможность направленного влияния со стороны обследуемого.
Преимуществом исследования является длительность периода непрерывного мониторинга глюкозы (14 дней), поскольку в большом числе ранее опубликованных работ исследование проводилось в течение более короткого времени. Исследуемая популяция (лица с предиабетом) пока недостаточно изучена в отношении ВГ и связанного с ней риска развития СД2 и его хронических осложнений.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Коваренко Маргарита Анатольевна – канд. мед. наук, доц. каф. педиатрии ФПК и ППВ ФГБОУ ВО НГМУ. E-mail: grun-wald@yandex.ru; ORСID 0000-0002-5012-0364
Margarita A. Kovarenko – Cand. Sci. (Med.), Assoc. Prof., Novosibirsk State Medical University. E-mail: grun-wald@yandex.ru; ORCID: 0000-0002-5012-0364
Руяткина Людмила Александровна – д-р мед. наук, проф., проф. каф. неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ, председатель Ассоциации эндокринологов Новосибирской области. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Lyudmila A. Ruyatkina – Dr. Sci. (Med.), Full Prof., Prof., Novosibirsk State Medical University. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Илющенко Анна Александровна – студентка Института медицины и медицинских технологий ФГАОУ ВО НГУ. E-mail: a.ilyushchenko1@g.nsu.ru
Anna A. Ilushchenko – Student, Institute of Medicine and Medical Technologies, Novosibirsk State University.
E-mail: a.ilyushchenko1@g.nsu.ru
Анмут Виктория Михайловна – ординатор каф. неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ. E-mail: v.isakova@alumni.nsu.ru; ORСID: 0009-0001-1179-2002
Victoria M. Anmut – Clinical Resident, Novosibirsk State Medical University. E-mail: v.isakova@alumni.nsu.ru; ORСID: 0009-0001-1179-2002
Поступила в редакцию: 01.10.2025
Поступила после рецензирования: 10.10.2025
Принята к публикации: 16.10.2025
Received: 01.10.2025
Revised: 10.10.2025
Accepted: 16.10.2025
Клинический разбор в общей медицине №10 2025
Ранняя дисгликемия в параметрах непрерывного мониторинга глюкозы
Номера страниц в выпуске:24-31
Аннотация
Традиционные методы оценки гликемии, такие как определение уровня гликированного гемоглобина (HbA1c) и пероральный глюкозотолерантный тест, могут не отражать все аспекты углеводного обмена, особенно на стадии предиабета.
Цель. Сравнить амбулаторные профили глюкозы, полученные с помощью системы FreeStyle Libre 1, у лиц с нормальной толерантностью к углеводам и пациентов с дисгликемией.
Материалы и методы. В одноцентровое наблюдательное исследование были включены 32 пациента (возраст от 31 года до 72 лет) с факторами риска сахарного диабета 2-го типа. Оценивались антропометрические параметры, результаты биохимического анализа крови, а также данные непрерывного мониторинга глюкозы (НМГ) в течение 14 дней.
Результаты. У пациентов с предиабетом не выявлено статистически значимых отличий от здоровых лиц по уровню HbA1c, однако отмечены более высокие уровни средней глюкозы (AVG) и индикатора управления глюкозой (GMI). Время нахождения выше узкого целевого диапазона (TITR) было значимо больше в группе дисгликемии. Корреляции между показателями глюкозы изменялись в зависимости от наличия дисгликемии.
Заключение. НМГ позволяет более точно оценить показатели гликемического контроля и может быть полезен для ранних вмешательств у лиц из групп высокого риска диабета. Необходимы дальнейшие исследования для оптимизации использования НМГ и разработки индивидуализированных стратегий вмешательства.
Ключевые слова: мониторинг глюкозы, нарушенная толерантность к глюкозе, предиабет, вариабельность глюкозы, контроль глюкозы, профилактика диабета.
Для цитирования: Коваренко М.А., Руяткина Л.А., Илющенко А.А., Анмут В.М. Ранняя дисгликемия в параметрах непрерывного мониторинга глюкозы. Клинический разбор в общей медицине. 2025; 6 (10): 24–31. DOI: 10.47407/kr2025.6.10.00689
Традиционные методы оценки гликемии, такие как определение уровня гликированного гемоглобина (HbA1c) и пероральный глюкозотолерантный тест, могут не отражать все аспекты углеводного обмена, особенно на стадии предиабета.
Цель. Сравнить амбулаторные профили глюкозы, полученные с помощью системы FreeStyle Libre 1, у лиц с нормальной толерантностью к углеводам и пациентов с дисгликемией.
Материалы и методы. В одноцентровое наблюдательное исследование были включены 32 пациента (возраст от 31 года до 72 лет) с факторами риска сахарного диабета 2-го типа. Оценивались антропометрические параметры, результаты биохимического анализа крови, а также данные непрерывного мониторинга глюкозы (НМГ) в течение 14 дней.
Результаты. У пациентов с предиабетом не выявлено статистически значимых отличий от здоровых лиц по уровню HbA1c, однако отмечены более высокие уровни средней глюкозы (AVG) и индикатора управления глюкозой (GMI). Время нахождения выше узкого целевого диапазона (TITR) было значимо больше в группе дисгликемии. Корреляции между показателями глюкозы изменялись в зависимости от наличия дисгликемии.
Заключение. НМГ позволяет более точно оценить показатели гликемического контроля и может быть полезен для ранних вмешательств у лиц из групп высокого риска диабета. Необходимы дальнейшие исследования для оптимизации использования НМГ и разработки индивидуализированных стратегий вмешательства.
Ключевые слова: мониторинг глюкозы, нарушенная толерантность к глюкозе, предиабет, вариабельность глюкозы, контроль глюкозы, профилактика диабета.
Для цитирования: Коваренко М.А., Руяткина Л.А., Илющенко А.А., Анмут В.М. Ранняя дисгликемия в параметрах непрерывного мониторинга глюкозы. Клинический разбор в общей медицине. 2025; 6 (10): 24–31. DOI: 10.47407/kr2025.6.10.00689
Early dysglycemia in continuous glucose monitoring metrics
Margarita A. Kovarenko1, Lyudmila A. Ruyatkina1, Anna A. Ilushchenko2, Victoria M. Anmut11 Novosibirsk State Medical University, Novosibirsk, Russia;
2 Novosibirsk State University, Novosibirsk, Russia;
larut@list.ru
Abstract
Traditional methods of glycemic assessment, such as glycated hemoglobin (HbA1c) and the oral glucose tolerance test, may not reflect all aspects of carbohydrate metabolism, especially at the prediabetes stage.
Aim. To compare ambulatory glucose profiles obtained using the FreeStyle Libre 1 system in individuals with normal carbohydrate tolerance and dysglycemia.
Materials and methods. A single-center observational study including 32 patients (aged 31 to 72 years) with risk factors for type 2 diabetes mellitus. Anthropometric parameters, biochemical blood analysis, and continuous glucose monitoring (CGM) data over 14 days were assessed.
Results. Patients with prediabetes showed no statistically significant differences from healthy individuals in HbA1c levels; however, they exhibited higher levels of average glucose (AG) and the glucose management indicator (GMI). Time in tight target range (TITR) was significantly greater in the dysglycemia group. Correlations between glucose metrics varied depending on the presence of dysglycemia.
Conclusion. Continuous glucose monitoring allows for a more accurate assessment of glycemic control metrics and may be useful for early interventions in individuals at high risk of diabetes. Further research is needed to optimize the use of CGM and develop individualized intervention strategies.
Keywords: continuous glucose monitoring, glucose intolerance, prediabetes, glycemic variability, glycemic control, diabetes prevention.
For citation: Kovarenko M.A., Ruyatkina L.A., Ilushchenko A.A., Anmut V.A. Early dysglycemia in continuous glucose monitoring metrics. Clinical review for general practice. 2025; 6 (10): 24–31 (In Russ.). DOI: 10.47407/kr2025.6.10.00689
Введение
В течение многих лет в качестве «золотого стандарта» для оценки гликемических показателей используются гликированный гемоглобин (HbA1c) и пероральный глюкозотолерантный тест (ПГТТ) [1]. Появление в клинической практике непрерывного мониторинга глюкозы (НМГ) открывает новые возможности для оценки углеводного обмена, предоставляя дополнительную информацию, отличную от классических критериев.
Влияние вариабельности глюкозы (ВГ) на развитие хронических осложнений диабета в настоящее время является одним из дискуссионных вопросов в диабетологии [2]. Значение ВГ в комплексной оценке гликемического контроля при диабете, а также наиболее удачные математические модели расчета ВГ до настоящего времени не определены. Еще менее изучена вариабельность уровня глюкозы у лиц с предиабетом, установленным на основании классических диагностических критериев. Однако метаанализ, включающий 71 исследование, показал, что ВГ повышена уже в ситуации предиабета, потенциально связана с дисфункцией бета-клеток и развитием коронарного атеросклероза и может предсказывать сердечно-сосудистые события и сахарный диабет 2-го типа (СД2) [3]. Опубликованные к настоящему времени данные по НМГ у пациентов с предиабетом ставят под сомнение достаточность используемых классических диагностических инструментов (HbA1c, ПГТТ) [4, 5]. Также не вполне понятно, что первично в ходе развития нарушений регуляции глюкозы – изменения ВГ или увеличение средней гликемии, оцениваемой по уровню HbA1c.
Оценка ВГ при ранних нарушениях углеводного обмена могла бы стать комплементарным способом классификации толерантности к глюкозе и стратификации риска диабета, независимо от традиционных диагностических критериев. Кроме того, поскольку хронические осложнения СД присутствуют у части пациентов уже на стадии предиабета [2], анализ ВГ может помочь ответить на вопрос о ее потенциальной роли в развитии осложнений у этой категории пациентов. Недавнее исследование H. Sugimoto и соавт. (2025) продемонстрировало, что метрики НМГ превосходят диагностические модели, использующие традиционные данные (уровень глюкозы крови натощак, HbA1c и показатели ПГТТ), в прогнозировании индекса диспозиции, получаемого с помощью клэмп-тестов [6].
Целью исследования являлось сравнение амбулаторных профилей глюкозы с использованием данных периодически сканируемой системы FreeStyle Libre 1 у лиц с нормальной толерантностью к углеводам и дисгликемией, установленной с использованием критериев Американской диабетологической ассоциации (American Diabetes Association, ADA).
Этическая экспертиза. Исследование выполнено с соблюдением этических принципов проведения научных медицинских исследований с участием человека, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации, и в соответствии с этическими нормами и правилами, предусмотренными бюллетенем Высшей аттестационной комиссии Министерства образования Российской Федерации №3 от 2002 г. «О порядке проведения биомедицинских исследований у человека». Проведение исследования одобрено комитетом по этике ФГАОУ ВО «Новосибирский национальный исследовательский государственный университет» (протокол №114/1 от 20.11.2023).
Материалы и методы

Клиническое одноцентровое наблюдательное поперечное исследование проводилось с сентября 2023 г. по ноябрь 2024 г. на базе клинико-диагностического отделения АО МЦ «Авиценна», г. Новосибирск. В исследование были включены 32 пациента (в том числе 18 мужчин и 16 женщин) в возрасте от 31 года до 72 лет, обратившихся к терапевту для профилактического медицинского обследования, без специфических жалоб, имеющих по крайней мере один фактор риска СД2 (избыточная масса тела/ожирение, артериальная гипертония, дислипидемия, синдром поликистозных яичников, гиперурикемия, метаболически ассоциированная жировая болезнь печени, гестационный диабет в анамнезе), подписавших добровольное информированное согласие на участие в исследовании.
Критерии исключения: лица, которые имели хотя бы одно сердечно-сосудистое событие в течение жизни; установленный СД 1-го типа; наследственную дислипидемию; хронические заболевания почек; злокачественные новообразования любой локализации, в том числе в анамнезе; острые воспалительные или обострения хронических заболеваний; беременность; злоупотребление алкоголем или наркотическими/лекарственными препаратами; прием препаратов, влияющих на метаболизм глюкозы (сахароснижающие, препараты для лечения ожирения, глюкокортикоиды, нейролептики).
После клинического осмотра и измерения артериального давления оценены антропометрические параметры. Измерение роста производилось ростомером МСК-233 (с точностью до 0,1 см), измерение массы тела: натощак, без обуви, в легкой одежде – на медицинских весах ВЭМ-150.3-А2 (с точностью до 0,1 кг). Индекс массы тела (ИМТ) рассчитывался по формуле: ИМТ (кг/м2) = масса тела (кг) / (рост (м) × рост (м)). Исследован биохимический анализ крови с определением липидного профиля (общий холестерин – ХС, холестерин липопротеидов низкой плотности – ЛПНП, холестерин липопротеидов высокой плотности – ЛПВП, триглицериды – ТГ), глюкоза, гликированный гемоглобин. При уровне глюкозы плазмы натощак (ГПН) 5,6 ммоль/л глюкоза натощак исследовалась повторно. Триглицерид-глюкозный индекс (TyG) рассчитывали по формуле: Ln [ТГ натощак (мг/дл) × ГПН (мг/дл)/2], где Ln – логарифм [7].
После оценки состояния углеводного обмена исследуемые были разделены на две группы. В группу 1 вошли лица без дисгликемии в анамнезе и на момент обследования; в группу 2 – пациенты с впервые установленным предиабетом по критериям ADA 2025 г.:
HbA1c 5,7–6,4% (39–47 ммоль/моль) или ГПН 5,6–6,9 ммоль/л [8].
Мониторинг уровня глюкозы в межклеточной жидкости проводился в течение 14 дней с помощью периодически сканируемой системы FreeStyle Libre 1. Поскольку исследование является неинтервенционным, участникам не было рекомендовано соблюдать определенную диету или режим физической активности. Были даны рекомендации придерживаться обычного образа жизни для получения реальной картины уровня глюкозы в повседневных условиях. Пациенты, использовавшие датчик менее 14 дней из-за технических проблем (отсоединение датчика), в исследование не включались.
Получены данные о времени в целевом диапазоне 3,9–10,0 ммоль/л (TIR), времени ниже целевого диапазона – менее 3,9 ммоль/л (TBR), времени выше целевого диапазона – более 10,0 ммоль/л (TAR), времени в узком целевом диапазоне – 3,9–7,8 ммоль/л (TITR), времени выше узкого целевого диапазона – более
7,8 ммоль/л (выше TITR) в процентах, а также средняя концентрация глюкозы за исследуемый период в ммоль/л (AVG); коэффициент вариации CV в %; индикатор управления глюкозой (GMI) в %.
Статистическая обработка данных проводилась с помощью пакета программ Statistica 13.0 (StatSоft, Inc.). Проверка на нормальность распределения признаков осуществлялась с использованием критерия Шапиро–Уилка. Различия параметров амбулаторного профиля глюкозы между группами были оценены с использованием критерия U-критерия Манна–Уитни. Данные представлены в виде медианы и межквартильного диапазона (Me [Q1; Q3]). Статистически значимыми считались различия соответствующих критериев параметрической и непараметрической статистики при p<0,05. Для корреляционного анализа использован непараметрический критерий Спирмена. При значениях коэффициента Спирмена (R) <0,3 корреляция считалась слабой, 0,3–0,5 – умеренной, 0,5–0,7 – средней, 0,7–0,9 – высокой, >0,9 – очень высокой.
Результаты

В анализируемых группах показатели возраста, ИМТ, гемодинамики, липидные профили были сравнимы (см. таблицу).
При статистически значимых различиях по уровню ГПН, традиционно маркирующей вариант предиабета – нарушенную гликемию натощак, разницы между группами по уровню HbA1c не отмечено. Также не различались следующие глюкозные параметры, оцененные с помощью периодически сканируемой системы FreeStyle Libre: TIR, TITR, CV, показатели времени выше и ниже целевого диапазона. При этом средний уровень глюкозы (AVG), индикатор управления глюкозой (GMI) и время выше узкого целевого диапазона в группе 2 статистически значимо превышали таковые в группе 1 (р=0,02–0,01).
Показатель GMI тесно положительно коррелировал с TITR (R=0,78; р=0,008) и показателем AVG (R=0,92; р=0,006) в общей когорте лиц (рис. 1), с некоторым усилением указанных связей в группе с дисгликемией (рис. 2) соответственно (R=0,86 и R=0,99; р=0,006), образуя в обеих группах своеобразный треугольник. Наличие разносторонних связей глюкозных показателей в общей группе несколько изменяется при дисгликемии: усиливается зависимость TITR с HbA1c (R=0,65; р=0,01), но теряются корреляции GMI, AVG и TITR с ГПН.
Обсуждение
Введение НМГ для контроля углеводного обмена у пациентов с СД открыло новую эру в клинической практике, сместив характеристику гликемического контроля с HbA1c на новый показатель – ВГ [9]. Обосновано мнение о ключевой роли ВГ в ускоренном развитии диабетических осложнений [10], независимо от HbA1c [11], поскольку более строгий контроль HbA1c сам по себе недостаточен для предотвращения сердечно-сосудистых событий, вызванных длительной высокой ВГ [12].
Ранее было показано, что в физиологических условиях у здорового человека колебания уровня глюкозы происходят в очень узком диапазоне, характеризуясь низкой вариабельностью и высокой стабильностью [13]. Однако недавние исследования выявили существенную гетерогенность ВГ даже среди лиц, классифицированных как имеющих нормальную толерантность к глюкозе в соответствии с общепринятыми критериями [14, 15]. Вероятно, традиционные способы оценки углеводного обмена могут пропускать ранние изменения в регуляции глюкозы, предшествующие клинически выраженной дисгликемии. Действительно, сообщается, что снижение секреции инсулина и чувствительности к инсулину начинается за несколько лет до того, как будет диагностирован диабет [16]. Снижение функции бета-клеток, наблюдаемое у многих лиц с предиабетом, его неизбежное прогрессирование до СД2 без профилактических вмешательств подчеркивают важность ранней идентификации групп высокого риска [17].
Эпидемиологические исследования [18, 19] продемонстрировали клиническую значимость даже небольшого повышения уровня ГПН. Риски СД и сердечно-сосудистых заболеваний возрастают уже у лиц с уровнем ГПН, превышающим 5,6 ммоль/л, что подчеркивает ключевую роль раннего вмешательства в профилактике этих состояний [20]. Несоответствие между пороговыми значениями уровня глюкозы для диагностики предиабета, предложенными ADA (≥5,6 ммоль/л), и общепринятым консенсусом (>6,1 ммоль/л) означает «ускользание» отдельных пациентов из категории целевых вмешательств. Непрерывные данные о концентрации глюкозы, полученные с помощью систем непрерывного мониторинга, устраняют ограничения традиционных методов и представляют собой инструмент, позволяющий восполнить этот пробел в диагностике нарушений углеводного обмена.
Классические исследования L. Monnier и соавт. (2003) продемонстрировали преобладание относительного влияния постпрандиального уровня глюкозы на уровень HbA1c у достаточно контролируемых пациентов с СД2, а также постепенное увеличение вклада гипергликемии натощак в ухудшение течения диабета [21]. Однако диагностические возможности HbA1c в донозологической дисгликемии дискутируются. Согласно критериям ADA, уровень HbA1c 5,7–6,4% был идентифицирован как диагностический диапазон для предиабета [8]. Согласно критериям Всемирной организации здравоохранения, уровни HbA1c >6,0%, но <6,5% отражают повышенный риск СД2 [22], т.е. носят не диагностический для предиабета, а вспомогательный характер. При этом важно, что риск прогрессирования СД2 в зависимости от значений HbA1c является непрерывным и не имеет четких точек перегиба, поэтому риск перехода от нормогликемии к диабету в пределах данного периода времени выше для более высоких значений HbA1c (в 10–13 раз выше для порога HbA1c ≥6,0% и в 4–7 раз выше для порога HbA1c ≥5,7%) [23].
Анализ крупной выборки европейских популяционных данных продемонстрировал монотонно возрастающую связь между временем сердечно-сосудистых событий и уровнями HbA1c >5,7%, указывая на потенциальный риск сердечно-сосудистых заболеваний в диапазоне метаболических отклонений предиабета [24], который при сочетании его вариантов, нарушенной гликемии натощак, нарушенной толерантности к глюкозе и надпороговых уровней HbA1c превышает 20% [25]. Также активная диагностическая тактика в ситуации предиабета позволяет выявлять СД2 на ранней его стадии, актуализируя проблему регресса и ремиссии дисгликемии [23], в том числе с помощью медикаментозной коррекции в добавление к изменению образа жизни [22].
Важным преимуществом НМГ является возможность обнаружения постпрандиальной гипергликемии и ночного повышения уровня глюкозы в крови, которые связаны с увеличением риска прогрессирования СД2 [26, 27]. В целом опубликованные до настоящего времени данные указывают на многообещающую роль ВГ в диагностической и прогностической оценке гомеостаза глюкозы у лиц без диабета.
В настоящем исследовании пациенты группы с предиабетом и группы без нарушений углеводного обмена имели сходные антропометрические характеристики с увеличенным ИМТ, медиана которого соответствует избыточной массе тела (в группе 1 – 29,15 кг/м2, в группе 2 – 29,4 кг/м2; р=0,73). Метаболические параметры в группах (ТГ, общий ХС, ХС ЛПВП, ХС ЛПНП, индекс TyG) статистически значимо не различались, однако отражали наличие дислипидемии. В соответствии с критериями включения и исключения у части обследованных имелась артериальная гипертония, но и по гемодинамическим параметрам группы были сравнимы (см. таблицу).
Исследуемые группы не различались по уровню гликированного гемоглобина, однако продемонстрировали значимые различия в среднем уровне глюкозы AVG (р=0,01) и индикаторе управления глюкозой GMI (р=0,02), что, возможно, связано с временным промежутком, влияющим на исследуемые параметры, –
120 дней для HbA1c и 14 дней для метрик НМГ. Значительные различия между группами также были обнаружены в другом параметре гликемического контроля – времени, проведенном выше узкого целевого диапазона, тогда как время выше целевого диапазона статистически значимо не различалось.
Полученные данные демонстрируют, что в группе лиц с предиабетом (нарушенная глюкоза натощак и/или повышение уровня HbA1c по критериям ADA 2025 г. [8]) время, проведенное выше нормального уровня глюкозы (7,8 ммоль/л), оказалось больше, чем у здоровых, хотя и не достигало значений, характерных для СД. При этом ГПН, группирующая переменная, в группе предиабета не коррелировала с другими глюкозными показателями, что акцентируетт отсутствие информативности точечных показателей глюкозы с учетом их лабильности в сравнении с исследуемыми интегральными параметрами НМГ.
В общей группе гликированный гемоглобин продемонстрировал положительные корреляции средней силы с GMI, AVG и временем выше TITR, которые сохранялись в группе предиабета. Положительная корреляция HbA1c с временем выше целевого диапазона нарастала от умеренной в общей группе до средней в группе предиабета.
Таким образом, глюкоза, оцениваемая по GMI, среднему уровню и времени выше узкого целевого диапазона, была выше в группе предиабета, в то время как ВГ, оцениваемая по коэффициенту вариации CV, между группами не различалась. Несмотря на то что коэффициент вариации CV является более точным параметром по сравнению с SD, поскольку на него не оказывают влияния эффект дисперсии и отдельные выпадающие значения глюкозы, вероятно, указанный индекс вариабельности имеет низкую чувствительность в исследуемой группе. Возможно, это связано с различной ВГ в отдельных категориях предиабета (нарушенная толерантность к глюкозе натощак и нарушенная толерантность к углеводам), которые не выделялись в представленном исследовании из-за небольшого размера группы. ВГ при предиабете требует дальнейших исследований в более крупных группах.
Полученные результаты в отношении времени, проведенного в различных диапазонах концентрации глюкозы, подтверждают потенциальную роль НМГ в диагностике дисгликемии. Статистически значимые различия между группами по времени, проведенному выше узкого целевого диапазона (TITR), при отсутствии различий по времени выше целевого диапазона (TIR) свидетельствуют о том, что в повседневных условиях и вне супрафизиологических тестов (ПГТТ) постпрандиальный уровень глюкозы у лиц с нарушенной толерантностью к глюкозе часто превышает пороговые концентрации. Более того, в обеих группах были выявлены субъекты, имевшие хотя бы один эпизод гипергликемии, соответствующий критериям СД (в группе нормальной толерантности – 1 пациент, в группе дисгликемии – 3 пациента), что соотносится с наличием флуктуирующих стадий нормогликемии [23].
Опубликованные данные по НМГ при СД2 нередко фокусируются на гипогликемии как осложнении инсулинотерапии, однако имеются лишь очень ограниченные данные из реальных условий, особенно у пациентов с СД2, не получающих инсулин, или с предиабетом. Так, E. Castaldo и соавт. (2011) отметили увеличение времени, проведенного в гипогликемии, у лиц с нарушенной толерантностью к глюкозе по сравнению с субъектами с нормальной толерантностью к глюкозе, а также связь этого параметра с толщиной комплекса интима–медиа сонной артерии, маркером доклинического атеросклероза, предлагая рассматривать эпизоды гипогликемии как новый потенциальный фактор риска сердечно-сосудистых заболеваний для лиц с предиабетом [28]. В настоящем исследовании время в низком диапазоне не различалось между группами.
Полученные результаты демонстрируют, что изменения гомеостаза глюкозы при предиабете в исследуемой популяции связаны с повышением уровня средней гликемии, но не с повышением ВГ, оцениваемой по CV.
В целом это является подтверждением концепции об относительной независимости показателей гликированного гемоглобина и ВГ, дающих взаимодополняющую оценку гликемического контроля.
Таким образом, непрерывный мониторинг глюкозы является новым инструментом для оценки гомеостаза глюкозы на ранних этапах нарушений углеводного обмена. Кроме того, данные НМГ предоставляют информацию о гликемических паттернах продуктов у конкретного человека, позволяя персонализировать вмешательства (например, корректируя диету при выраженной постпрандиальной гипергликемии). Таким образом, помимо диагностической ценности, НМГ способствует вовлеченности пациента в управление углеводным обменом и соблюдению диетических рекомендаций [29–31].
Заключение
Появление систем НМГ в рутинной клинической практике может способствовать раннему выявлению нарушений углеводного обмена, разработке персонифицированных стратегий вмешательства и вовлечению пациентов в самоконтроль глюкозы. Безусловно, стоимость систем НМГ и необходимость обучения являются определенными барьерами, тем не менее потенциал НМГ в диагностике предиабета очевиден.
Будущие исследования должны быть направлены на разработку алгоритмов НМГ и использование искусственного интеллекта для оптимизации гликемического контроля. Оценка данных НМГ совместно с другими биомаркерами, отражающими чувствительность к инсулину и функцию бета-клеток, поможет более точному пониманию особенностей прогрессирования диабета и разработке индивидуальных подходов к лечению и профилактике, что важно с учетом ухудшения общего прогноза для лиц с предиабетом с течением времени.
Ограничения и преимущества исследования
Основным недостатком исследования является небольшое число участников, что ограничивает возможности статистического анализа по отдельным категориям предиабета (нарушенная глюкоза натощак и нарушенная толерантность к углеводам). Тем не менее результаты показывают определенные тенденции вариабельности уровня глюкозы и направление будущих исследований у лиц с предиабетом.
Поскольку исследование является неинтервенционным, во время 14-дневного периода наблюдения не были стандартизированы питание и физическая активность обследуемых. Кроме того, исследование не было заслепленным, и информация об уровне глюкозы была доступна пациенту в режиме реального времени, что не исключает возможность направленного влияния со стороны обследуемого.
Преимуществом исследования является длительность периода непрерывного мониторинга глюкозы (14 дней), поскольку в большом числе ранее опубликованных работ исследование проводилось в течение более короткого времени. Исследуемая популяция (лица с предиабетом) пока недостаточно изучена в отношении ВГ и связанного с ней риска развития СД2 и его хронических осложнений.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Коваренко Маргарита Анатольевна – канд. мед. наук, доц. каф. педиатрии ФПК и ППВ ФГБОУ ВО НГМУ. E-mail: grun-wald@yandex.ru; ORСID 0000-0002-5012-0364
Margarita A. Kovarenko – Cand. Sci. (Med.), Assoc. Prof., Novosibirsk State Medical University. E-mail: grun-wald@yandex.ru; ORCID: 0000-0002-5012-0364
Руяткина Людмила Александровна – д-р мед. наук, проф., проф. каф. неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ, председатель Ассоциации эндокринологов Новосибирской области. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Lyudmila A. Ruyatkina – Dr. Sci. (Med.), Full Prof., Prof., Novosibirsk State Medical University. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Илющенко Анна Александровна – студентка Института медицины и медицинских технологий ФГАОУ ВО НГУ. E-mail: a.ilyushchenko1@g.nsu.ru
Anna A. Ilushchenko – Student, Institute of Medicine and Medical Technologies, Novosibirsk State University.
E-mail: a.ilyushchenko1@g.nsu.ru
Анмут Виктория Михайловна – ординатор каф. неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ. E-mail: v.isakova@alumni.nsu.ru; ORСID: 0009-0001-1179-2002
Victoria M. Anmut – Clinical Resident, Novosibirsk State Medical University. E-mail: v.isakova@alumni.nsu.ru; ORСID: 0009-0001-1179-2002
Поступила в редакцию: 01.10.2025
Поступила после рецензирования: 10.10.2025
Принята к публикации: 16.10.2025
Received: 01.10.2025
Revised: 10.10.2025
Accepted: 16.10.2025
Список исп. литературыСкрыть список1. ElSayed NA, Aleppo G, Bannuru RR. 2. Diagnosis and classification of diabetes: standards of care in Diabetes – 2024. Diabetes Care 2024;47(Suppl 1):S20-s42. DOI: 10.2337/dc24-S002
2. Mutie PM, Pomares-Millan H, Atabaki-Pasdar N et al. An investigation of causal relationships between prediabetes and vascular complications. Nat Commun 2020 Sep 14;11(1):4592. DOI: 10.1038/s41467-020-18386-9. Erratum in: Nat Commun 2021;12(1):202. DOI: 10.1038/s41467-020-20663-6
3. Hjort A, Iggman D, Rosqvist F. Glycemic variability assessed using continuous glucose monitoring in individuals without diabetes and associations with cardiometabolic risk markers: A systematic review and meta-analysis. Clin Nutr 2024;43(4):915-25. DOI: 10.1016/j.clnu.2024. 02.014
4. Zhang J, Zhang Z, Zhang K et al. Early detection of type 2 diabetes risk: limitations of current diagnostic criteria. Front Endocrinol (Lausanne) 2023;14:1260623. DOI: 10.3389/fendo.2023.1260623
5. Liu X, Zhang J. Continuous Glucose Monitoring: A Transformative Approach to the Detection of Prediabetes. J Multidiscip Healthc 2024;17:5513-9. DOI: 10.2147/JMDH.S493128
6. Sugimoto H, Hironaka K, Nakamura T et al. Improved detection of decreased glucose handling capacities via continuous glucose monitoring-derived indices. Commun Med 2025;5:103. DOI: 10.1038/s43856-025-00819-5
7. Руяткина Л.А., Руяткин Д.С., Исхакова И.С. Возможности и варианты суррогатной оценки инсулинорезистентности. Ожирение и метаболизм. 2019;16(1):27-33. DOI: 10.14341/omet10082
Ruyatkina L.A., Ruyatkin D.S., Iskhakova I.S. Opportunities and options for surrogate assessment of insulin resistance. Obesity and Metabolism 2019;16(1):27-33. DOI: 10.14341/omet10082 (in Russian).
8. American Diabetes Association Professional Practice Committee. 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes-2025. Diabetes Care 2025;48(1 Suppl 1):S27-S49. DOI: 10.2337/dc25-S002
9. Psoma O, Makris M, Tselepis A, Tsimihodimos V. Short-term Glycemic Variability and Its Association With Macrovascular and Microvascular Complications in Patients With Diabetes. J Diabetes Sci Technol 2024;18(4):956-67. DOI: 10.1177/19322968221146808
10. Kovatchev B. Glycemic Variability: Risk Factors, Assessment, and Control. J Diabetes Sci Technol 2019;13(4):627-35. DOI: 10.1177/ 1932296819826111
11. Mo Y, Lu J, Zhou J. Glycemic variability: Measurement, target, impact on complications of diabetes and does it really matter? J Diabetes Investig 2024;15(1):5-14. DOI: 10.1111/jdi.14112
12. Lazar S, Ionita I, Reurean-Pintilei D, Timar B. How to Measure Glycemic Variability? A Literature Review. Medicina (Kaunas) 2023;60(1):61. DOI: 10.3390/medicina60010061
13. Аметов А.С., Пуговкина Я.В., Черникова Н.А. Гомеостаз глюкозы у здорового человека в различных условиях. Cовременный взгляд. Эндокринология: новости, мнения, обучение. 2016;(1):45-55.
Ametov A.S., Pugovkina Ya. V., Chernikova N.A. Glucose homeostasis in a healthy person under different conditions. The modern view. Endocrinology: News, Opinions, Training 2016;(1):45-55 (in Russian).
14. Keshet A, Shilo S, Godneva A et al. CGMap: Characterizing continuous glucose monitor data in thousands of non-diabetic individuals. Cell Metab 2023;35(5):758-69.e3. DOI: 10.1016/j.cmet.2023.04.002. Epub 2023 Apr 19.
15. Самойлова Ю.Г., Коваренко М.А., Олейник О.А. и др. Технология непрерывного мониторинга глюкозы у здоровых лиц: новые возможности превентивной медицины. Педиатрия им. Г.Н. Сперанского. 2022;101(3):205-11. DOI: 10.24110/0031-403X-2022-101-3-205-211
Samoilova Yu.G., Kovarenko M.A., Oleynik O.A. et al. Continuous glucose monitoring technology in healthy individuals: new opportunities for preventive medicine. Pediatria n.a. G.N. Speransky. 2022;101(3):205-211. DOI: 10.24110/0031-403X-2022-101-3-205-211 (in Russian).
16. Berry SE, Valdes AM, Drew DA et al. Human postprandial responses to food and potential for precision nutrition. Nat Med 2020 Jun;26(6):964-73. DOI: 10.1038/s41591-020-0934-0. Erratum in: Nat Med 2020 Nov;26(11):1802. DOI: 10.1038/s41591-020-1130-y
17. Bergman M. Prediabetes remission in people with obesity. Lancet Diabetes Endocrinol 2024;12(9):603-5. DOI: 10.1016/s2213-8587(24) 00193-1
18. Menke A, Casagrande S, Cowie CC. Contributions of A1c, fasting plasma glucose, and 2-hour plasma glucose to prediabetes prevalence: NHANES 2011-2014. Ann Epidemiol 2018;28(10):681-5.e2. DOI: 10.1016/j.annepidem.2018.07.012
19. Rooney MR, Fang M, Ogurtsova K et al. Global prevalence of prediabetes. Diabetes Care 2023;46(7):1388-94. DOI: 10.2337/dc22-2376
20. Echouffo-Tcheugui JB, Perreault L, Ji L, Dagogo-Jack S. Diagnosis and management of prediabetes: a review. JAMA 2023;329(14):1206-16. DOI: 10.1001/jama.2023.4063
21. Monnier L, Lapinski H, Colette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA(1c). Diabetes Care 2003;26(3):881-5. DOI: 10.2337/diacare.26.3.881
22. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: [рекомендации]. Под ред. И.И. Дедова,
М.В. Шестаковой, О.Ю. Сухаревой; Российская ассоциация эндокринологов, Национальный медицинский исследовательский центр эндокринологии. М., 2025. Вып. 12. 247 с. ISBN 978-5-6050065-8-9
Algorithms of specialized medical care for patients with diabetes mellitus: [recommendations]. Ed. by I.I. Dedov, M.V. Shestakova,
O.Yu. Sukhareva; Russian Association of Endocrinologists, National Medical Research Center of Endocrinology. Moscow, 2025. Is. 12. 247 p. ISBN 978-5-6050065-8-9 (in Russian).
23. Richter B, Hemmingsen B, Metzendorf MI, Takwoingi Y. Development of type 2 diabetes mellitus in people with intermediate hyperglycaemia. Cochrane Database Syst Rev 2018;10:CD012661. DOI: 10.1002/14651858.CD012661.pub2
24. Sinning C, Makarova N, Völzke H et al. Association of glycated hemoglobin A1c levels witlwh cardiovascular outcomes in the general population: results from the BiomarCaRE (Biomarker for Cardiovascular Risk Assessment in Europe) consortium. Cardiovasc Diabetol 2021;20(1):223. DOI: 10.1186/s12933-021-01413-4
25. Kashyap SR, Desouza C, Aroda VR et al. Glycemic and metabolic sub-classification of prediabetes and risk factors for cardiovascular disease in the D2d cohort. Am J Prev Cardiol 2023;15:100525. DOI: 10.1016/j.ajpc.2023.100525
26. Ajjan RA, Seidu S, Riveline JP. Perspective of continuous glucose monitoring-based interventions at the various stages of type 2 diabetes. Diabetes Ther 2024;15(8):1657-72. DOI: 10.1007/s13300-024-01607-5
27. Monnier L, Colette C, Dunseath GJ, Owens DR. The loss of postprandial glycemic control precedes stepwise deterioration of fasting with worsening diabetes. Diabetes Care 2007;30(2):263-9. DOI: 10.2337/dc06-1612
28. Castaldo E, Sabato D, Lauro D et al. Hypoglycemia assessed by continuous glucose monitoring is associated with preclinical atherosclerosis in individuals with impaired glucose tolerance. PLoS One 2011;6(12):e28312. DOI: 10.1371/journal.pone.0028312
29. Mubeen F, Low Wang CC et al. Digital Health and Shared Decision-Making in Diabetes Care – A Survey Initiative in Patients and Clinicians. Endocr Pract 2023;29(7):538-45. DOI: 10.1016/j.eprac.2023. 04.012
30. Owolabi EO, Boakye MD, Omololu SO et al. Technology-Based Interventions to Promote Diabetes Self-Management Behaviors for Persons Newly Diagnosed with Type 2 Diabetes: A Scoping Review. Curr Diab Rep 2024;24(12):257-72. DOI: 10.1007/s11892-024-01553-3
31. Clark TL, Polonsky WH, Soriano EC. The Potential Impact of Continuous Glucose Monitoring Use on Diabetes-Related Attitudes and Behaviors in Adults with Type 2 Diabetes: A Qualitative Investigation of the Patient Experience. Diabetes Technol Ther 2024;26(10):700-8. DOI: 10.1089/dia.2023.0612

