Клинический разбор в общей медицине №10 2025
Emilia R. Zagidullina
Georgievsky Medical Institute, Vernadsky Crimean Federal University, Simferopol, Russia
m.igarasi@yandex.ru
Abstract
Diabetes mellitus (DM) – is a systemic endocrinologic disorder linked to impaired processing of glucose either due to insufficient insulin levels, insluin resistance or excessive dietary carbs. DM puts a significant strain on a healthcare whereas patients with DM have much lower quality of life and imposing list of comorbidities and complications. Sustained long-term inflammation is a key driving factor that should be adressed while treating DM. Dietary factors, obesity, gut dysbiosis all contribute to higher levels of inflammation in DM patients. Endotoxemia (a condition known to reflect the impaired proper gut barrier function) plays an important role in the development of inflammatory state seen in DM patients.
Aim. To evaluate the role of endotoxinemia in DM in the development of systemic inflammation.
Materials and methods. Our prospective cross-sectional study involved 177 patients with verified diagnoses of type 1 diabetes mellitus (insulin-dependent) (DM1) (n=90), type 2 diabetes mellitus (non-insulin-dependent) (DM2) (n=45) and a control group (practically healthy) (n=42). Correlation analysis was used to establish the relationship between HBA1c and sCD14 as a marker of endotoxemia.
Results. Correlation analysis of the DM2 group showed associations of sCD14 with HbA1c (correlation strength 0.404), zonulin (0.398). Zonulin also correlated with endothelin-1 levels and body mass index, two traditional pro-inflammatory associations (0.312 and 0.343, respectively). LSB correlated with VEGF (0.620) and CRP (0.430). The same CRP correlated with such classical “proxies” of chronic systemic inflammation as LDL (0.333) and HbA1c (0.430).
Conclusions. Endotoxinemia in DM2 is metabolic in nature, while in DM1 it is more likely to be “autoimmune”, that is, more mediated through zonulin than through chronic inflammation observed in patients with DM2. For example, this is additionally confirmed by a higher incidence of celiac disease among DM1 patients. The role of endotoxinemia in patients with type 2 and type 1 diabetes remains a poorly understood issue.
Keywords: diabetes mellitus, metabolic endotoxemia, lipopolysaccharide, LPS binding protein.
For citation: Beloglazov V.A., Gorlov A.A., Yatskov I.A., Ageeva E.S., Repinskaya I.N., Zagidullina E.R. Metabolic endotoxemia in diabetes mellitus type 1 & 2 patients. Clinical review for general practice. 2025; 6 (10): 32–38 (In Russ.). DOI: 10.47407/kr2025.6.10.00690
Введение
Сахарный диабет (СД) 1-го (СД1) и 2-го (СД2) типа – самые распространенные эндокринологические патологии в мире [1]. Ожидается, что к 2045 г. число больных СД увеличится практически вдвое, аналогичная тенденция наблюдается в Российской Федерации – с 2000 по 2021 г. число пациентов с СД возросло в 2 раза и составило 169 тыс. человек [1]. СД1 и СД2 связаны с высоким уровнем коморбидностей (ишемическая болезнь сердца – ИБС, артериальная гипертензия – АГ, нерфропатия, полинейропатия, анигопатия нижних конечностей, ретинопатия) [2].
Воспаление является фундаментальным процессом развития подавляющего числа заболеваний, реализующим свой эффект в том числе через перекисное окисление липидов [3]. Особенный интерес представляет изучение особенностей воспалительного процесса при СД1 и СД2 и их различия между собой.
Липополисахарид (ЛПС) представляет собой «экзогормон адаптации», поддерживающий через взаимодействие с основным рецептором врожденного иммунитета – TLR4 – активность адаптивных систем на необходимом для нормального гомеостаза уровне [3].
Эндотоксинемия является состоянием, связанным с нарушением барьерной функции кишечника [3]. Она способствует повышению уровней провоспалительных маркеров и учащению сердечно-сосудистых событий [3].
В нашем исследовании мы обратили внимание на роль эндотоксинемии в формировании воспалительного статуса у пациентов с СД1 и СД2 и далеко идущие последствия такого влияния, проявляющиеся в виде клинических осложнений СД.
Материалы и методы
В исследовании участвовало 177 человек: пациенты с верифицированными диагнозами СД1 (инсулинзависимый; n=90) и СД2 (инсулиннезависимый; n=45), а также группа контроля (практически здоровые; n=42).
Критериями исключения являлись возраст младше 18 лет и старше 70 лет, беременность, наличие хронической болезни почек стадий С4 и С5, наличие острого коронарного синдрома менее 6 мес назад, онкологических, инфекционных заболеваний и воспалительных артропатий.
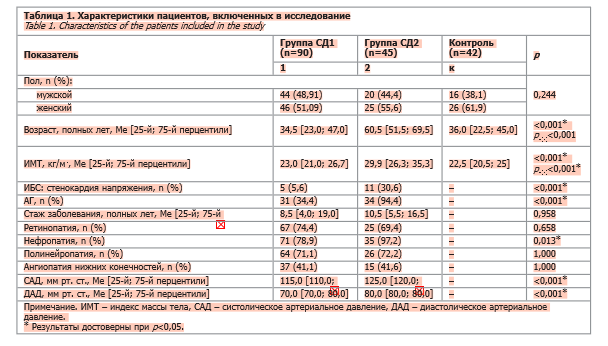
Группы имели сходную половую структуру (различия статистически незначимы; p=0,244). Группа СД1 и группа контроля не различались в плане возрастной структуры (p>0,05), в то время как зачисленные в исследование пациенты с СД2 были старше (p<0,001). Средний стаж заболевания между группами СД1 и СД2 статистически достоверно не различался. Диагноз ИБС (стенокардия напряжения), АГ, ангиопатии нижних конечностей, нефропатии, полинейропатии и ретинопатии устанавливали по данным предшествующей медицинской документации ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко» (работа над медицинской документацией производилась в соответствии с договором о сотрудничестве между ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко»).
Исследование одобрено комитетом по этике ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского» (протокол этической комиссии №5 от 10.10.2024), всеми участниками исследования было подписано добровольное информированное согласие.
Статистические данные вносили в Microsoft Excel 2022. Статистическую обработку данных проводили в пакете IBM SPSS Statistics 27. Данные представлены в виде абсолютных (n) и относительных (%) значений, а также в виде медианы (Ме) и межквартильного диапазона [25-й; 75-й перцентили].
Результаты
Основные характеристики пациентов, включенных в исследование, представлены в табл. 1.
Клинически пациенты с СД2 имели более высокие показатели ИМТ (29,9 кг/м2) в сравнении с группой СД1 (23 кг/м2) и группой контроля (22,5 кг/м2; p<0,001). Пациенты с СД2 имели наиболее высокие показатели встречаемости стенокардии напряжения: доли пациентов в группах СД1 и СД2 соотносились как 5,6% против 30,6%, причем это различие (p<0,001) сохранялось и в абсолютных значениях – 5 пациентов против 11, несмотря на вдвое меньший объем выборки в группе пациентов с СД2. Аналогичная картина сохранялась и при сопоставлении частоты встречаемости АГ (34,4% в группе СД1 против 94,4% в группе СД2; p<0,001). При этом пациенты с СД2 имели более высокие уровни САД и ДАД в сравнении с пациентами с СД1 (p<0,001).
У 74,4% пациентов с СД1 и 69,4% пациентов с СД2 наблюдалась ретинопатия, у 78,9 и 97,2% соответственно – диабетическая нефропатия. Полинейропатия встречалась с частотой 71,1 и 72,2% в группах СД1 и СД2. Ангиопатия была представлена в 41,1 и 41,6% случаев в группах СД1 и СД2. По частоте встречаемости ретинопатии, диабетической нефропатии, полинейропатии и ангиопатии не было замечено статистически значимых различий (p>0,05).
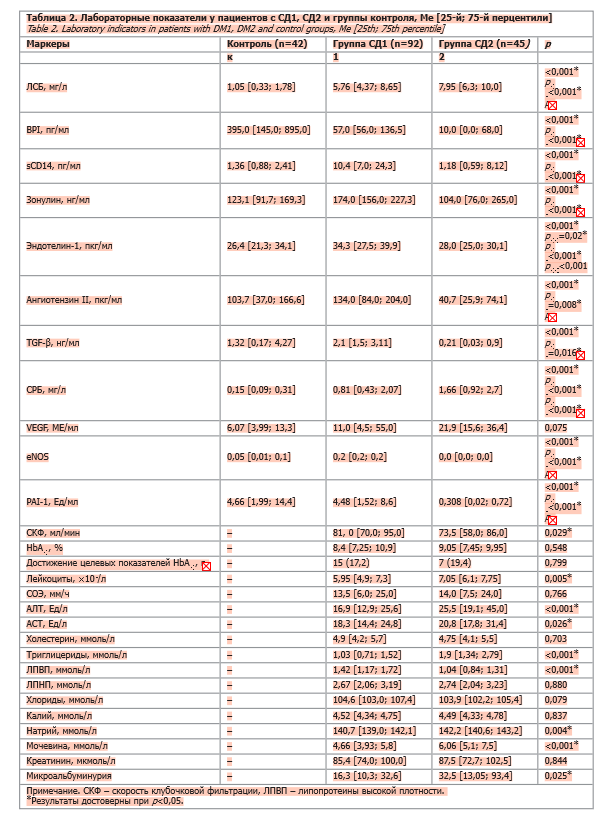
По данным лабораторных исследований (табл. 2), целевые показатели гликированного гемоглобина (HbA1c) были достигнуты у 17,2 и 19,4% пациентов в группах СД1 и СД2 соответственно (при этом показатель HbA1c составлял 8,4 и 9,05%) и статистически не различались между двумя группами (p<0,799 для достижения целевых уровней HbA1c и p<0,549 для непосредственно уровня HbA1c). Концентрации липополисахарид-связывающего белка (ЛСБ) были значительно выше в группах СД1 и СД2 по сравнению с группой контроля (p<0,001). При этом концентрация ЛСБ была наиболее высокой в группе СД2 в сравнении с пациентами группы СД1 (p<0,001). Титры BPI оказались наименьшими в группе СД2, были значительно снижены у пациентов с СД1 в сопоставлении с участниками группы контроля (p<0,001). Уровень SCD14 оказался наиболее высоким в группе СД1, в то время как группы СД2 и контроля имели сопоставимые уровни SCD14 (p<0,001). Титры зонулина имели наименьшее значение (p<0,001) при СД2 (несколько неожиданная находка), причем различия сохраняли статистическую значимость при сравнении не только с группой контроля, но и с группой СД1 (p<0,001). Уровень эндотелина-1 статистически значимо различался между всеми группами с наивысшими значениями в группе СД1 (p<0,001). Уровни трансформирующего фактора роста β (TGF-β) оказались наиболее высокими в группе СД1, в то время как пациенты с СД2 имели самые низкие концентрации после группы контроля (p<0,001). Аналогичные результаты наблюдались при определении титров ангиотензина II и eNOS, при этом наименьшие значения были определены в группе СД2 для PAI-1, ангиотензина II и eNOS (p<0,001). Предсказуемо уровни СРБ оказались наиболее высокими в группе СД2 и наиболее низкими – в группе контроля (p<0,001). Концентрации сосудистого эндотелиального фактора роста (VEGF) статистически не различались во всех трех группах (p<0,075). По данным клинического анализа крови, лишь уровень лейкоцитов был статистически значимо выше в группе СД2 (хотя и оставался в пределах референсных значений; p<0,005), в то время как скорость оседания эритроцитов (СОЭ) не различалась между группами СД1 и СД2 (p<0,766). Концентрации аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), мочевины были выше в группе СД2 (p<0,001, p=0,026, p<0,001 соответственно). При этом мы не обнаружили в нашем исследовании, чтобы параметры липидограммы у пациентов с СД2 были выше таковых у пациентов с СД1.
Корреляционный анализ группы СД2 показал связи sCD14 с HbA1c (сила корреляции 0,404), зонулином (0,398). Зонулин также коррелировал с уровнем эндотелина-1 и ИМТ (две традиционные провоспалительные ассоциации; 0,312 и 0,343 соответственно). ЛСБ коррелировал с VEGF (0,620) и СРБ (0,430). Тот же СРБ коррелировал с такими классическими «прокси» хронического системного воспаления, как липопротеины низкой плотности (ЛПНП; 0,333) и HbA1c (0,430).
Обсуждение
ЛСБ, BPI, SCD14 являются белками иммунного ответа на поступающий в системный кровоток ЛПС. Соответственно, их уровни должны быть повышены в сценариях хронического системного воспаления (воспалительные заболевания кишечника, атеросклероз, воспалительные артропатии). При СД2 титры ЛСБ и SCD14 значительно повышены. Ожирение, резистентность к инсулину, диетические факторы, дислипидемия оказывают сочетанное влияние на хроническое низкоинтенсивное воспаление и ассоциированные с ним изменения в параметрах кишечной проницаемости (ЛСБ, BPI, SCD14, зонулин).
Предположительно, при СД2 большую роль играет метаболическая эндотоксинемия – специфическое состояние повышенной проницаемости кишечного барьера, позволяющее ЛПС от грамнегативных бактерий входить в системный кровоток. В то же время метаболическая эндотоксинемия при СД1 выражена в значительно меньшей степени. Наблюдаемые метаболические нарушения при СД1 обусловлены прежде всего аутоиммунным процессом.
Наши данные дополнительно подтверждают эту идею: пациенты с СД2 имели в крови наиболее высокие среди всех групп концентрации ЛСБ. Уровни BPI были реципрокно снижены в группе пациентов с СД2, что подтверждает традиционный взгляд на антагонистические отношения ЛСБ и BPI. ЛСБ может рассматриваться как суррогатный маркер воспаления, реципрокное «падение» ЛСБ дополнительно подчеркивает повышенный уровень системного воспаления, наблюдаемого у пациентов с СД.
С другой стороны, концентрации зонулина, белка обратимой проницаемости кишечного барьера, были выше у пациентов с СД1. Мы не смогли найти однозначных объяснений этому феномену, так как ожидалось, что уровни зонулина должны быть выше в группе пациентов с СД2, что находится в согласии с данными литературы [4]. Наблюдаемое нами несоответствие может быть приписано сдвигу с зонулин-опосредованного каскада, повышающего кишечную проницаемость, на альтернативные механизмы.
Вероятно, что при СД2, особенно в случае хорошо контролируемого заболевания, зонулин играет меньшую роль в развитии эндотоксинемии. В то же время ЛСБ хотя и хорошо известен в литературе своей корреляцией с зонулином [5], тем не менее отражает именно транслокацию ЛПС по оси «кишечник – энтерогепатическая циркуляция», но не молекулярные механизмы кишечной проницаемости (в том числе опосредованные зонулином) [6]. Проницаемость кишечного эпителия могут повышать и другие факторы, помимо зонулина (бактериальный дисбиоз, в том числе синдром избыточного бактериального роста, диетические факторы и т.д.) [6].
СД2 характеризуется более выраженным в сравнении с СД1 низкоинтенсивным воспалением в кишечнике. Зонулиновый каскад может истощаться при СД2 в случае дисфункции кишечного эпителия (повреждение плотных соединений в результате хронического воспаления эпителиальных клеток) [7].
Постоянный приток ЛПС «извне» стимулирует синтез ЛСБ и СРБ. Помимо прочего, СРБ может рассматриваться как независимый системный фактор кишечного воспаления у пациентов с СД2 (что приводит к зонулин-независимой транслокации ЛПС через кишечный эпителий в кровоток).
Пациенты с СД2 имеют более высокие показатели ИМТ – наши экспериментальные данные согласуются с данными литературы [4]. Сам по себе более высокий ИМТ означает избыток висцеральной адипозной ткани, являющейся источником интерлейкина-6 (ИЛ-6), фактора некроза опухоли α (ФНО-α), которые могут усиливать кишечное воспаление (как через зонулиновый каскад, так и вне его) [8].
Отдельно следует упомянуть, что медикаменты (метформин, агонисты глюкагон-подобного пептида, ингибиторы ренин-ангиотензиновой системы) способны сами по себе улучшать барьерную функцию кишечника и снижать зонулин-опосредованную кишечную проницаемость [9, 10]. Так, даже при наличии ЛПС-обусловленного воспаления уровни зонулина могут оставаться сниженными.
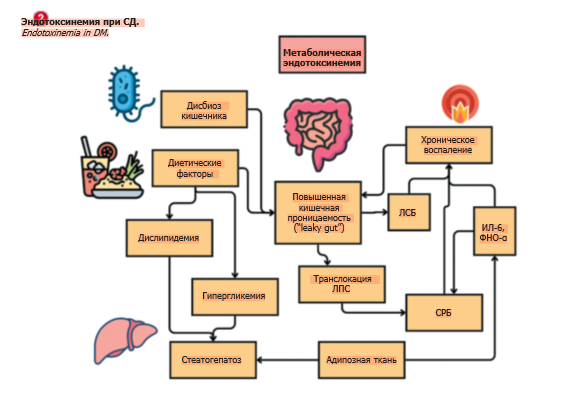
Наши данные показали корреляционные связи между ЛСБ, СРБ, ЛПНП и VEGF, наглядно демонстрируя, что метаболическая эндотоксинемия в контексте СД2 является частью системного процесса, характеризующегося хроническим воспалением (которое в свою очередь влечет наблюдаемую в нашем исследовании более высокую частоту диабетических осложнений), а не изолированным феноменом, относящимся к сфере патофизиологии кишечного тракта (см. рисунок).
Эндотоксинемия при СД1 характеризуется иным «портретом» воспалительных маркеров. Первым отличием, бросающимся в глаза, являются более низкие уровни ЛСБ, СРБ и более высокие – зонулина. Мы предполагаем, что это может быть частично объяснено тем, что ЛПС при СД1 выступает не только в качестве воспалительного «нагрузочного» материала (классический пример – «перегрузка» иммунной системы мышей in vivo высокими дозами эндотоксина с последующей провокацией острого артрита), но и как иммунный триггер, запускающий активацию дендритических клеток и моноцитов через Toll-like receptor 4. В нашем исследовании пациенты с СД1 имели значительно более высокие уровни зонулина, чем пациенты с СД2, – это может свидетельствовать об асимметричности роли зонулина при обоих заболеваниях. Мы можем предположить, что зонулин играет более значимую роль при СД1, чем при СД2. Это косвенно подтверждается данными литературы: уровень зонулина повышался в крови детей в период до дебюта СД1 [11].
Заключение
Эндотоксинемия при СД2 носит метаболический характер, в то время как при СД1 – скорее «аутоиммунный», т. е. в большей степени опосредованный через зонулин, чем через хроническое воспаление, наблюдаемое у пациентов с СД2. Например, дополнительно это подтверждается более высокой частотой встречаемости целиакии среди пациентов с СД1 [12].
Роль эндотоксинемии у пациентов с СД2 и СД1 остается не до конца изученным вопросом. Низкоинтенсивное воспаление и метаболическая эндотоксинемия тесно взаимосвязаны. Метаболическая эндотоксинемия, вероятно, является более значимым таргетом для терапии в контексте СД2, нежели СД1. Наши данные дополнительно подтверждают, что активный контроль над низкоинтенсивным воспалением и связанным с ним развитием клинических манифестаций является особенно актуальным для СД2.
Ограничения исследования. Клинические диагнозы и осложнения устанавливались на основании медицинской документации и, при возможности, соответствующих клинических критериев. Мы не проводили амбулаторное измерение артериального давления для установления диагноза АГ. Коронароангиография не проводилась в рамках нашего исследования для определения диагноза ИБС (стенокардия напряжения). Клинические диагнозы устанавливались профильными специалистами (эндокринолог, нефролог, офтальмолог, ангиохирург, невролог).
Частота клинических манифестаций СД1 и СД2 формально не оценивалась в группе контроля. Все участники группы контроля проходили осмотр терапевта и не предъявляли активных жалоб на момент рекрутирования в исследование и в течение исследования и были признаны практически здоровыми.
Мы не исследовали напрямую концентрации ЛПС в крови всех участников исследования. В первую очередь это связано с гетерогенностью понятия «липополисахарид». Ввиду этого мы отдали предпочтение стандартизированным методам оценки эндотоксинемии (ЛСБ, зонулин, SCD14, СРБ). Наш, несколько дискреционный, метод оценки основан на данных литературы, так как не существует формально унифицированных лабораторных критериев эндотоксинемии.
Ряд параметров не исследовался в группе контроля (СКФ, HbA1c, ДАД, САД, общий анализ крови, общий анализ мочи, СЭБ, АЛТ, АСТ, ЛПОНП, ЛПНП, ЛПВП, электролиты крови, креатинин, мочевина).
Финансирование и спонсорская поддержка. Исследование выполнено за счет гранта Российского научного фонда № 24-25-20052 (https://rscf.ru/project/24-25-20052/).
Financing and sponsorship. This work was supported by the Russian Science Foundation under grant no. 24-25-20052 (https://rscf.ru/project/24-25-20052/).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Белоглазов Владимир Алексеевич – д-р мед. наук, зав. каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского».
E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Vladimir A. Beloglazov – Dr. Sci. (Med.), Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Горлов Александр Александрович – ассистент каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: Alexander_gorloff@mail.ru; ORCID: 0000-0001-6597-8550
Aleksandr A. Gorlov – Assistant, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: Alexander_gorloff@mail.ru; ORCID: 0000-0001-6597-8550
Яцков Игорь Анатольевич – канд. мед. наук, доц. каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: egermd@yandex.ru; ORCID: 0000-0002-5486-7262
Igor A. Yatskov – Cand. Sci. (Med.), Assoc. Prof., Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: egermd@yandex.ru; ORCID: 0000-0002-5486-7262
Агеева Елизавета Сергеевна – д-р мед. наук, зав. каф. биологии, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: ageevaeliz@rambler.ru; ORCID: 0000-0003-4590-3580
Elizaveta S. Ageeva – Dr. Sci. (Med.), Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: ageevaeliz@rambler.ru; ORCID: 0000-0003-4590-3580
Репинская Ирина Николаевна – ассистент каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: repinskaya.irina@mail.ru; ORCID: 0000-0001-6200-1699
Irina N. Repinskaya – Assistant, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: repinskaya.irina@mail.ru; ORCID: 0000-0001-6200-1699
Загидуллина Эмилия Рафилевна – студент, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: m.igarasi@yandex.ru; ORCID: 0009-0005-9693-5461
Emilia R. Zagidullina – Student, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: m.igarasi@yandex.ru; ORCID: 0009-0005-9693-5461
Поступила в редакцию: 06.05.2025
Поступила после рецензирования: 14.05.2025
Принята к публикации: 15.05.2025
Received: 06.05.2025
Revised: 14.05.2025
Accepted: 15.05.2025
Клинический разбор в общей медицине №10 2025
Метаболическая эндотоксинемия у пациентов с сахарным диабетом 1-го и 2-го типа
Номера страниц в выпуске:32-38
Аннотация
Сахарный диабет (СД) – системное эндокринное заболевание, связанное с нарушением углеводного обмена по причине инсулиновой недостаточности, инсулиновой резистентности или избыточного поступления углеводов с диетой. СД влечет за собой значительные медико-социальные расходы. Пациенты с СД имеют, как правило, более низкое качество жизни и значительное количество осложнений. Хроническое системное воспаление – главный промоутер в формировании коморбидностей, наблюдаемых у пациентов с СД. Диета, ожирение, дисбиоз кишечника способствуют более высоким уровням воспаления среди пациентов с СД. Эндотоксинемия, состояние, связанное с нарушенной барьерной функцией кишечника, значительно способствует формированию провоспалительного фона при СД.
Цель исследования – оценить роль эндотоксинемии при СД в развитии системного воспаления.
Материалы и методы. В нашем кросс-секционном исследовании участвовало 177 человек: пациенты с верифицированными диагнозами сахарный диабет 1-го типа (СД1; инсулинзависимый; n=90), сахарный диабет 2-го типа (СД2; инсулиннезависимый; n=45), а также группа контроля (практически здоровые; n=42). С помощью корреляционного анализа устанавливалось наличие взаимосвязи между гликированным гемоглобином (HbA1c) и sCD14 как маркером эндотоксинемии.
Результаты. Корреляционный анализ группы СД2 показал связи sCD14 с HbA1c (сила корреляции 0,404), зонулином (0,398). Зонулин также коррелировал с уровнем эндотелина-1 и индексом массы тела (две традиционные провоспалительные ассоциации; 0,312 и 0,343 соответственно). Липополисахарид-связывающий белок (ЛСБ) коррелировал с сосудистым эндотелиальным фактором роста (VEGF; 0,620) и С-реактивным белком (СРБ; 0,430). Тот же СРБ коррелировал с такими классическими «прокси» хронического системного воспаления, как липопротеины низкой плотности (0,333) и HbA1c (0,430).
Заключение. Эндотоксинемия при СД2 носит метаболический характер, в то время как при СД1 – скорее «аутоиммунный», т.е. в большей степени опосредованный через зонулин, чем через хроническое воспаление, наблюдаемое у пациентов с СД2. Например, дополнительно это подтверждается более высокой частотой встречаемости целиакии среди пациентов с СД1. Роль эндотоксинемии у пациентов с СД2 и СД1 остается не до конца изученным вопросом.
Ключевые слова: сахарный диабет, метаболическая эндотоксинемия, липополисахарид, липополисахарид-связывающий белок.
Для цитирования: Белоглазов В.А., Горлов А.А., Яцков И.А., Агеева Е.С., Репинская И.Н., Загидуллина Э.Р. Метаболическая эндотоксинемия у пациентов с сахарным диабетом 1-го и 2-го типа. Клинический разбор в общей медицине. 2025; 6 (10): 32–38. DOI: 10.47407/kr2025.6.10.00690
Сахарный диабет (СД) – системное эндокринное заболевание, связанное с нарушением углеводного обмена по причине инсулиновой недостаточности, инсулиновой резистентности или избыточного поступления углеводов с диетой. СД влечет за собой значительные медико-социальные расходы. Пациенты с СД имеют, как правило, более низкое качество жизни и значительное количество осложнений. Хроническое системное воспаление – главный промоутер в формировании коморбидностей, наблюдаемых у пациентов с СД. Диета, ожирение, дисбиоз кишечника способствуют более высоким уровням воспаления среди пациентов с СД. Эндотоксинемия, состояние, связанное с нарушенной барьерной функцией кишечника, значительно способствует формированию провоспалительного фона при СД.
Цель исследования – оценить роль эндотоксинемии при СД в развитии системного воспаления.
Материалы и методы. В нашем кросс-секционном исследовании участвовало 177 человек: пациенты с верифицированными диагнозами сахарный диабет 1-го типа (СД1; инсулинзависимый; n=90), сахарный диабет 2-го типа (СД2; инсулиннезависимый; n=45), а также группа контроля (практически здоровые; n=42). С помощью корреляционного анализа устанавливалось наличие взаимосвязи между гликированным гемоглобином (HbA1c) и sCD14 как маркером эндотоксинемии.
Результаты. Корреляционный анализ группы СД2 показал связи sCD14 с HbA1c (сила корреляции 0,404), зонулином (0,398). Зонулин также коррелировал с уровнем эндотелина-1 и индексом массы тела (две традиционные провоспалительные ассоциации; 0,312 и 0,343 соответственно). Липополисахарид-связывающий белок (ЛСБ) коррелировал с сосудистым эндотелиальным фактором роста (VEGF; 0,620) и С-реактивным белком (СРБ; 0,430). Тот же СРБ коррелировал с такими классическими «прокси» хронического системного воспаления, как липопротеины низкой плотности (0,333) и HbA1c (0,430).
Заключение. Эндотоксинемия при СД2 носит метаболический характер, в то время как при СД1 – скорее «аутоиммунный», т.е. в большей степени опосредованный через зонулин, чем через хроническое воспаление, наблюдаемое у пациентов с СД2. Например, дополнительно это подтверждается более высокой частотой встречаемости целиакии среди пациентов с СД1. Роль эндотоксинемии у пациентов с СД2 и СД1 остается не до конца изученным вопросом.
Ключевые слова: сахарный диабет, метаболическая эндотоксинемия, липополисахарид, липополисахарид-связывающий белок.
Для цитирования: Белоглазов В.А., Горлов А.А., Яцков И.А., Агеева Е.С., Репинская И.Н., Загидуллина Э.Р. Метаболическая эндотоксинемия у пациентов с сахарным диабетом 1-го и 2-го типа. Клинический разбор в общей медицине. 2025; 6 (10): 32–38. DOI: 10.47407/kr2025.6.10.00690
Metabolic endotoxemia in diabetes mellitus type 1 & 2 patients
Vladimir A. Beloglazov, Aleksandr A. Gorlov, Igor A. Yatskov, Elizaveta S. Ageeva, Irina N. Repinskaya,Emilia R. Zagidullina
Georgievsky Medical Institute, Vernadsky Crimean Federal University, Simferopol, Russia
m.igarasi@yandex.ru
Abstract
Diabetes mellitus (DM) – is a systemic endocrinologic disorder linked to impaired processing of glucose either due to insufficient insulin levels, insluin resistance or excessive dietary carbs. DM puts a significant strain on a healthcare whereas patients with DM have much lower quality of life and imposing list of comorbidities and complications. Sustained long-term inflammation is a key driving factor that should be adressed while treating DM. Dietary factors, obesity, gut dysbiosis all contribute to higher levels of inflammation in DM patients. Endotoxemia (a condition known to reflect the impaired proper gut barrier function) plays an important role in the development of inflammatory state seen in DM patients.
Aim. To evaluate the role of endotoxinemia in DM in the development of systemic inflammation.
Materials and methods. Our prospective cross-sectional study involved 177 patients with verified diagnoses of type 1 diabetes mellitus (insulin-dependent) (DM1) (n=90), type 2 diabetes mellitus (non-insulin-dependent) (DM2) (n=45) and a control group (practically healthy) (n=42). Correlation analysis was used to establish the relationship between HBA1c and sCD14 as a marker of endotoxemia.
Results. Correlation analysis of the DM2 group showed associations of sCD14 with HbA1c (correlation strength 0.404), zonulin (0.398). Zonulin also correlated with endothelin-1 levels and body mass index, two traditional pro-inflammatory associations (0.312 and 0.343, respectively). LSB correlated with VEGF (0.620) and CRP (0.430). The same CRP correlated with such classical “proxies” of chronic systemic inflammation as LDL (0.333) and HbA1c (0.430).
Conclusions. Endotoxinemia in DM2 is metabolic in nature, while in DM1 it is more likely to be “autoimmune”, that is, more mediated through zonulin than through chronic inflammation observed in patients with DM2. For example, this is additionally confirmed by a higher incidence of celiac disease among DM1 patients. The role of endotoxinemia in patients with type 2 and type 1 diabetes remains a poorly understood issue.
Keywords: diabetes mellitus, metabolic endotoxemia, lipopolysaccharide, LPS binding protein.
For citation: Beloglazov V.A., Gorlov A.A., Yatskov I.A., Ageeva E.S., Repinskaya I.N., Zagidullina E.R. Metabolic endotoxemia in diabetes mellitus type 1 & 2 patients. Clinical review for general practice. 2025; 6 (10): 32–38 (In Russ.). DOI: 10.47407/kr2025.6.10.00690
Введение
Сахарный диабет (СД) 1-го (СД1) и 2-го (СД2) типа – самые распространенные эндокринологические патологии в мире [1]. Ожидается, что к 2045 г. число больных СД увеличится практически вдвое, аналогичная тенденция наблюдается в Российской Федерации – с 2000 по 2021 г. число пациентов с СД возросло в 2 раза и составило 169 тыс. человек [1]. СД1 и СД2 связаны с высоким уровнем коморбидностей (ишемическая болезнь сердца – ИБС, артериальная гипертензия – АГ, нерфропатия, полинейропатия, анигопатия нижних конечностей, ретинопатия) [2].
Воспаление является фундаментальным процессом развития подавляющего числа заболеваний, реализующим свой эффект в том числе через перекисное окисление липидов [3]. Особенный интерес представляет изучение особенностей воспалительного процесса при СД1 и СД2 и их различия между собой.
Липополисахарид (ЛПС) представляет собой «экзогормон адаптации», поддерживающий через взаимодействие с основным рецептором врожденного иммунитета – TLR4 – активность адаптивных систем на необходимом для нормального гомеостаза уровне [3].
Эндотоксинемия является состоянием, связанным с нарушением барьерной функции кишечника [3]. Она способствует повышению уровней провоспалительных маркеров и учащению сердечно-сосудистых событий [3].
В нашем исследовании мы обратили внимание на роль эндотоксинемии в формировании воспалительного статуса у пациентов с СД1 и СД2 и далеко идущие последствия такого влияния, проявляющиеся в виде клинических осложнений СД.
Материалы и методы
В исследовании участвовало 177 человек: пациенты с верифицированными диагнозами СД1 (инсулинзависимый; n=90) и СД2 (инсулиннезависимый; n=45), а также группа контроля (практически здоровые; n=42).
Критериями исключения являлись возраст младше 18 лет и старше 70 лет, беременность, наличие хронической болезни почек стадий С4 и С5, наличие острого коронарного синдрома менее 6 мес назад, онкологических, инфекционных заболеваний и воспалительных артропатий.
Группы имели сходную половую структуру (различия статистически незначимы; p=0,244). Группа СД1 и группа контроля не различались в плане возрастной структуры (p>0,05), в то время как зачисленные в исследование пациенты с СД2 были старше (p<0,001). Средний стаж заболевания между группами СД1 и СД2 статистически достоверно не различался. Диагноз ИБС (стенокардия напряжения), АГ, ангиопатии нижних конечностей, нефропатии, полинейропатии и ретинопатии устанавливали по данным предшествующей медицинской документации ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко» (работа над медицинской документацией производилась в соответствии с договором о сотрудничестве между ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко»).

Исследование одобрено комитетом по этике ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского» (протокол этической комиссии №5 от 10.10.2024), всеми участниками исследования было подписано добровольное информированное согласие.
Статистические данные вносили в Microsoft Excel 2022. Статистическую обработку данных проводили в пакете IBM SPSS Statistics 27. Данные представлены в виде абсолютных (n) и относительных (%) значений, а также в виде медианы (Ме) и межквартильного диапазона [25-й; 75-й перцентили].
Результаты
Основные характеристики пациентов, включенных в исследование, представлены в табл. 1.
Клинически пациенты с СД2 имели более высокие показатели ИМТ (29,9 кг/м2) в сравнении с группой СД1 (23 кг/м2) и группой контроля (22,5 кг/м2; p<0,001). Пациенты с СД2 имели наиболее высокие показатели встречаемости стенокардии напряжения: доли пациентов в группах СД1 и СД2 соотносились как 5,6% против 30,6%, причем это различие (p<0,001) сохранялось и в абсолютных значениях – 5 пациентов против 11, несмотря на вдвое меньший объем выборки в группе пациентов с СД2. Аналогичная картина сохранялась и при сопоставлении частоты встречаемости АГ (34,4% в группе СД1 против 94,4% в группе СД2; p<0,001). При этом пациенты с СД2 имели более высокие уровни САД и ДАД в сравнении с пациентами с СД1 (p<0,001).
У 74,4% пациентов с СД1 и 69,4% пациентов с СД2 наблюдалась ретинопатия, у 78,9 и 97,2% соответственно – диабетическая нефропатия. Полинейропатия встречалась с частотой 71,1 и 72,2% в группах СД1 и СД2. Ангиопатия была представлена в 41,1 и 41,6% случаев в группах СД1 и СД2. По частоте встречаемости ретинопатии, диабетической нефропатии, полинейропатии и ангиопатии не было замечено статистически значимых различий (p>0,05).
По данным лабораторных исследований (табл. 2), целевые показатели гликированного гемоглобина (HbA1c) были достигнуты у 17,2 и 19,4% пациентов в группах СД1 и СД2 соответственно (при этом показатель HbA1c составлял 8,4 и 9,05%) и статистически не различались между двумя группами (p<0,799 для достижения целевых уровней HbA1c и p<0,549 для непосредственно уровня HbA1c). Концентрации липополисахарид-связывающего белка (ЛСБ) были значительно выше в группах СД1 и СД2 по сравнению с группой контроля (p<0,001). При этом концентрация ЛСБ была наиболее высокой в группе СД2 в сравнении с пациентами группы СД1 (p<0,001). Титры BPI оказались наименьшими в группе СД2, были значительно снижены у пациентов с СД1 в сопоставлении с участниками группы контроля (p<0,001). Уровень SCD14 оказался наиболее высоким в группе СД1, в то время как группы СД2 и контроля имели сопоставимые уровни SCD14 (p<0,001). Титры зонулина имели наименьшее значение (p<0,001) при СД2 (несколько неожиданная находка), причем различия сохраняли статистическую значимость при сравнении не только с группой контроля, но и с группой СД1 (p<0,001). Уровень эндотелина-1 статистически значимо различался между всеми группами с наивысшими значениями в группе СД1 (p<0,001). Уровни трансформирующего фактора роста β (TGF-β) оказались наиболее высокими в группе СД1, в то время как пациенты с СД2 имели самые низкие концентрации после группы контроля (p<0,001). Аналогичные результаты наблюдались при определении титров ангиотензина II и eNOS, при этом наименьшие значения были определены в группе СД2 для PAI-1, ангиотензина II и eNOS (p<0,001). Предсказуемо уровни СРБ оказались наиболее высокими в группе СД2 и наиболее низкими – в группе контроля (p<0,001). Концентрации сосудистого эндотелиального фактора роста (VEGF) статистически не различались во всех трех группах (p<0,075). По данным клинического анализа крови, лишь уровень лейкоцитов был статистически значимо выше в группе СД2 (хотя и оставался в пределах референсных значений; p<0,005), в то время как скорость оседания эритроцитов (СОЭ) не различалась между группами СД1 и СД2 (p<0,766). Концентрации аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), мочевины были выше в группе СД2 (p<0,001, p=0,026, p<0,001 соответственно). При этом мы не обнаружили в нашем исследовании, чтобы параметры липидограммы у пациентов с СД2 были выше таковых у пациентов с СД1.
Корреляционный анализ группы СД2 показал связи sCD14 с HbA1c (сила корреляции 0,404), зонулином (0,398). Зонулин также коррелировал с уровнем эндотелина-1 и ИМТ (две традиционные провоспалительные ассоциации; 0,312 и 0,343 соответственно). ЛСБ коррелировал с VEGF (0,620) и СРБ (0,430). Тот же СРБ коррелировал с такими классическими «прокси» хронического системного воспаления, как липопротеины низкой плотности (ЛПНП; 0,333) и HbA1c (0,430).
Обсуждение
ЛСБ, BPI, SCD14 являются белками иммунного ответа на поступающий в системный кровоток ЛПС. Соответственно, их уровни должны быть повышены в сценариях хронического системного воспаления (воспалительные заболевания кишечника, атеросклероз, воспалительные артропатии). При СД2 титры ЛСБ и SCD14 значительно повышены. Ожирение, резистентность к инсулину, диетические факторы, дислипидемия оказывают сочетанное влияние на хроническое низкоинтенсивное воспаление и ассоциированные с ним изменения в параметрах кишечной проницаемости (ЛСБ, BPI, SCD14, зонулин).
Предположительно, при СД2 большую роль играет метаболическая эндотоксинемия – специфическое состояние повышенной проницаемости кишечного барьера, позволяющее ЛПС от грамнегативных бактерий входить в системный кровоток. В то же время метаболическая эндотоксинемия при СД1 выражена в значительно меньшей степени. Наблюдаемые метаболические нарушения при СД1 обусловлены прежде всего аутоиммунным процессом.
Наши данные дополнительно подтверждают эту идею: пациенты с СД2 имели в крови наиболее высокие среди всех групп концентрации ЛСБ. Уровни BPI были реципрокно снижены в группе пациентов с СД2, что подтверждает традиционный взгляд на антагонистические отношения ЛСБ и BPI. ЛСБ может рассматриваться как суррогатный маркер воспаления, реципрокное «падение» ЛСБ дополнительно подчеркивает повышенный уровень системного воспаления, наблюдаемого у пациентов с СД.
С другой стороны, концентрации зонулина, белка обратимой проницаемости кишечного барьера, были выше у пациентов с СД1. Мы не смогли найти однозначных объяснений этому феномену, так как ожидалось, что уровни зонулина должны быть выше в группе пациентов с СД2, что находится в согласии с данными литературы [4]. Наблюдаемое нами несоответствие может быть приписано сдвигу с зонулин-опосредованного каскада, повышающего кишечную проницаемость, на альтернативные механизмы.
Вероятно, что при СД2, особенно в случае хорошо контролируемого заболевания, зонулин играет меньшую роль в развитии эндотоксинемии. В то же время ЛСБ хотя и хорошо известен в литературе своей корреляцией с зонулином [5], тем не менее отражает именно транслокацию ЛПС по оси «кишечник – энтерогепатическая циркуляция», но не молекулярные механизмы кишечной проницаемости (в том числе опосредованные зонулином) [6]. Проницаемость кишечного эпителия могут повышать и другие факторы, помимо зонулина (бактериальный дисбиоз, в том числе синдром избыточного бактериального роста, диетические факторы и т.д.) [6].
СД2 характеризуется более выраженным в сравнении с СД1 низкоинтенсивным воспалением в кишечнике. Зонулиновый каскад может истощаться при СД2 в случае дисфункции кишечного эпителия (повреждение плотных соединений в результате хронического воспаления эпителиальных клеток) [7].
Постоянный приток ЛПС «извне» стимулирует синтез ЛСБ и СРБ. Помимо прочего, СРБ может рассматриваться как независимый системный фактор кишечного воспаления у пациентов с СД2 (что приводит к зонулин-независимой транслокации ЛПС через кишечный эпителий в кровоток).
Пациенты с СД2 имеют более высокие показатели ИМТ – наши экспериментальные данные согласуются с данными литературы [4]. Сам по себе более высокий ИМТ означает избыток висцеральной адипозной ткани, являющейся источником интерлейкина-6 (ИЛ-6), фактора некроза опухоли α (ФНО-α), которые могут усиливать кишечное воспаление (как через зонулиновый каскад, так и вне его) [8].
Отдельно следует упомянуть, что медикаменты (метформин, агонисты глюкагон-подобного пептида, ингибиторы ренин-ангиотензиновой системы) способны сами по себе улучшать барьерную функцию кишечника и снижать зонулин-опосредованную кишечную проницаемость [9, 10]. Так, даже при наличии ЛПС-обусловленного воспаления уровни зонулина могут оставаться сниженными.


Наши данные показали корреляционные связи между ЛСБ, СРБ, ЛПНП и VEGF, наглядно демонстрируя, что метаболическая эндотоксинемия в контексте СД2 является частью системного процесса, характеризующегося хроническим воспалением (которое в свою очередь влечет наблюдаемую в нашем исследовании более высокую частоту диабетических осложнений), а не изолированным феноменом, относящимся к сфере патофизиологии кишечного тракта (см. рисунок).
Эндотоксинемия при СД1 характеризуется иным «портретом» воспалительных маркеров. Первым отличием, бросающимся в глаза, являются более низкие уровни ЛСБ, СРБ и более высокие – зонулина. Мы предполагаем, что это может быть частично объяснено тем, что ЛПС при СД1 выступает не только в качестве воспалительного «нагрузочного» материала (классический пример – «перегрузка» иммунной системы мышей in vivo высокими дозами эндотоксина с последующей провокацией острого артрита), но и как иммунный триггер, запускающий активацию дендритических клеток и моноцитов через Toll-like receptor 4. В нашем исследовании пациенты с СД1 имели значительно более высокие уровни зонулина, чем пациенты с СД2, – это может свидетельствовать об асимметричности роли зонулина при обоих заболеваниях. Мы можем предположить, что зонулин играет более значимую роль при СД1, чем при СД2. Это косвенно подтверждается данными литературы: уровень зонулина повышался в крови детей в период до дебюта СД1 [11].
Заключение
Эндотоксинемия при СД2 носит метаболический характер, в то время как при СД1 – скорее «аутоиммунный», т. е. в большей степени опосредованный через зонулин, чем через хроническое воспаление, наблюдаемое у пациентов с СД2. Например, дополнительно это подтверждается более высокой частотой встречаемости целиакии среди пациентов с СД1 [12].
Роль эндотоксинемии у пациентов с СД2 и СД1 остается не до конца изученным вопросом. Низкоинтенсивное воспаление и метаболическая эндотоксинемия тесно взаимосвязаны. Метаболическая эндотоксинемия, вероятно, является более значимым таргетом для терапии в контексте СД2, нежели СД1. Наши данные дополнительно подтверждают, что активный контроль над низкоинтенсивным воспалением и связанным с ним развитием клинических манифестаций является особенно актуальным для СД2.
Ограничения исследования. Клинические диагнозы и осложнения устанавливались на основании медицинской документации и, при возможности, соответствующих клинических критериев. Мы не проводили амбулаторное измерение артериального давления для установления диагноза АГ. Коронароангиография не проводилась в рамках нашего исследования для определения диагноза ИБС (стенокардия напряжения). Клинические диагнозы устанавливались профильными специалистами (эндокринолог, нефролог, офтальмолог, ангиохирург, невролог).
Частота клинических манифестаций СД1 и СД2 формально не оценивалась в группе контроля. Все участники группы контроля проходили осмотр терапевта и не предъявляли активных жалоб на момент рекрутирования в исследование и в течение исследования и были признаны практически здоровыми.
Мы не исследовали напрямую концентрации ЛПС в крови всех участников исследования. В первую очередь это связано с гетерогенностью понятия «липополисахарид». Ввиду этого мы отдали предпочтение стандартизированным методам оценки эндотоксинемии (ЛСБ, зонулин, SCD14, СРБ). Наш, несколько дискреционный, метод оценки основан на данных литературы, так как не существует формально унифицированных лабораторных критериев эндотоксинемии.
Ряд параметров не исследовался в группе контроля (СКФ, HbA1c, ДАД, САД, общий анализ крови, общий анализ мочи, СЭБ, АЛТ, АСТ, ЛПОНП, ЛПНП, ЛПВП, электролиты крови, креатинин, мочевина).
Финансирование и спонсорская поддержка. Исследование выполнено за счет гранта Российского научного фонда № 24-25-20052 (https://rscf.ru/project/24-25-20052/).
Financing and sponsorship. This work was supported by the Russian Science Foundation under grant no. 24-25-20052 (https://rscf.ru/project/24-25-20052/).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Белоглазов Владимир Алексеевич – д-р мед. наук, зав. каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского».
E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Vladimir A. Beloglazov – Dr. Sci. (Med.), Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: biloglazov@mail.ru; ORCID: 0000-0001-9640-754X
Горлов Александр Александрович – ассистент каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: Alexander_gorloff@mail.ru; ORCID: 0000-0001-6597-8550
Aleksandr A. Gorlov – Assistant, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: Alexander_gorloff@mail.ru; ORCID: 0000-0001-6597-8550
Яцков Игорь Анатольевич – канд. мед. наук, доц. каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: egermd@yandex.ru; ORCID: 0000-0002-5486-7262
Igor A. Yatskov – Cand. Sci. (Med.), Assoc. Prof., Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: egermd@yandex.ru; ORCID: 0000-0002-5486-7262
Агеева Елизавета Сергеевна – д-р мед. наук, зав. каф. биологии, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: ageevaeliz@rambler.ru; ORCID: 0000-0003-4590-3580
Elizaveta S. Ageeva – Dr. Sci. (Med.), Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: ageevaeliz@rambler.ru; ORCID: 0000-0003-4590-3580
Репинская Ирина Николаевна – ассистент каф. внутренней медицины №2, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: repinskaya.irina@mail.ru; ORCID: 0000-0001-6200-1699
Irina N. Repinskaya – Assistant, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: repinskaya.irina@mail.ru; ORCID: 0000-0001-6200-1699
Загидуллина Эмилия Рафилевна – студент, Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: m.igarasi@yandex.ru; ORCID: 0009-0005-9693-5461
Emilia R. Zagidullina – Student, Georgievsky Medical Institute, Vernadsky Crimean Federal University. E-mail: m.igarasi@yandex.ru; ORCID: 0009-0005-9693-5461
Поступила в редакцию: 06.05.2025
Поступила после рецензирования: 14.05.2025
Принята к публикации: 15.05.2025
Received: 06.05.2025
Revised: 14.05.2025
Accepted: 15.05.2025
Список исп. литературыСкрыть список1. Дедов И.И., Шестакова М.В., Викулова О.К. и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. Сахарный диабет. 2023;26(2):104-23. DOI: 10.14341/DM13035
Dedov I.I., Shestakova M.V., Vikulova O.K. et al. Diabetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the period 2010–2022. Diabetes Mellitus 2023;26(2):104-23. DOI: 10.14341/DM13035 (in Russian).
2. Bodke H, Wagh V, Kakar G. Diabetes Mellitus and Prevalence of Other Comorbid Conditions: A Systematic Review. Cureus 2023 Nov 24;15(11):e49374.
3. Яковлев М.Ю. Системная эндотоксинемия. М.: Наука; 2021. 184 с.
Yakovlev M.Yu. Systemic endotoxemia. Moscow: Nauka; 2021. 184 p. (in Russian).
4. Khalil M., Addai Ali H., Alhilo M. Role of Zonulin level as new metabolic biomarker in diabetes mellitus patients and associated complications. AIP Conf Proc 2022 Jan 11;2386(1):030013.
5. Pellicano C, Oliva A, Colalillo A et al. Serum markers of microbial translocation and intestinal damage in assessment of gastrointestinal tract involvement in systemic sclerosis. Clin Exp Med 2024 Sep 19;24(1):225.
6. Haskey N, Eisele M, Bruno A et al. Biomarkers of Intestinal Permeability Are Influenced by Diet in Patients with Ulcerative Colitis-An Exploratory Study. Diagnostics (Basel) 2024 Nov 22;14(23):2629.
7. Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers 2016 Oct 21;4(4):e1251384.
8. Zihni C, Mills C, Matter K et al. Tight junctions: from simple barriers to multifunctional molecular gates. Nat Rev Mol Cell Biol. 2016;17:564-80.
9. Fernández-Valero A, Peña-Montero N, Lima-Rubio F et al. Changes in Oxidative Stress and Intestinal Permeability during Pregnancy in Women with Gestational Diabetes Mellitus Treated with Metformin or Insulin and Healthy Controls: A Randomized Controlled Trial. Antioxidants (Basel) 2023 Nov 8;12(11):1981.
10. Babu SN, Govindarajan S, Vijayalakshmi MA, Noor A. Role of zonulin and GLP-1/DPP-IV in alleviation of diabetes mellitus by peptide/polypeptide fraction of Aloe vera in streptozotocin- induced diabetic wistar rats. J Ethnopharmacol 2021 May 23;272:113949.
11. Sapone A, de Magistris L, Pietzak M et al. Zonulin upregulation is associated with increased gut permeability in subjects with type 1 diabetes and their relatives. Diabetes 2006 May;55(5):1443-9.
12. Wood Heickman LK, DeBoer MD, Fasano A. Zonulin as a potential putative biomarker of risk for shared type 1 diabetes and celiac disease autoimmunity. Diabetes Metab Res Rev 2020 Jul;36(5):e3309. DOI: 10.1002/dmrr.3309. Epub 2020 Mar 31.
3 декабря 2025
Количество просмотров: 206

