Клинический разбор в общей медицине №10 2025
1 Endocrinology Research Centre, Moscow, Russia;
2 N.P. Ogarev Mordovia State University, Saransk, Russia;
3 EFiS Research Center LLC, Moscow, Russia;
4 Pirogov Russian National Research Medical University, Moscow, Russia;
5 Tyumen State Medical University, Tyumen, Russia;
6 Russian University of Medicine, Moscow, Russia
fatima.dzgoeva@gmail.com
Abstract
Nonalcoholic fatty liver disease (NAFLD) is a key component of the cardio-reno-hepato-metabolic syndrome (CRHMS) and is closely associated with an increased risk of cardiovascular disease. The condition represents systemic metabolic dysfunction, including insulin resistance, dyslipidemia, and chronic inflammation, underscoring its relevance not only to gastroenterology but also to cardiology and endocrinology. Despite its high prevalence, data on the clinical and biochemical characteristics of NAFLD in the Russian population remain limited.
Aim. To evaluate the association of NAFLD with major cardiometabolic risk factors and to identify age- and sex-related features of the metabolic and biochemical parameters.
Materials and methods. A total of 256 adult patients were included, of whom 186 had imaging-confirmed NAFLD and 70 comprised the control group. Patients with viral hepatitis, excessive alcohol consumption, liver diseases of other established etiology, use of hepatotoxic or metabolism-modifying drugs, and pregnant or lactating women were excluded. All participants underwent anthropometric assessment and biochemical blood testing. Associations between risk factors and NAFLD were analyzed using univariate and multivariate logistic regression with calculation of odds ratios (ORs) and 95% confidence intervals (CIs).
Results. Male sex was associated with a 4-fold higher prevalence of NAFLD (OR = 3.97; p=0.0007). Overweight [body mass index (BMI) 25–30 kg/m2, excluding obesity] increased the likelihood of NAFLD more than 30-fold (OR = 30.6; p<0.001), compared with control group. When patients with obesity were included in the analysis, BMI ≥25 kg/m2 was associated with more than a 100-fold increase in the probability of NAFLD (OR = 109.8; p<0.001). Hyperglycemia ≥5.6 mmol/L increased the risk of NAFLD by 49 times (OR = 49.14; p<0.001). Both HOMA-IR and TyG indices were independent predictors of NAFLD (OR = 1.52 and 3.65; p<0.001). Elevated levels of non-HDL cholesterol (non-HDL-C) and triglycerides (TG) were associated with a 30–40% higher risk of NAFLD. Even moderate triglyceride elevations (1.7–2.3 mmol/L) tripled NAFLD prevalence (OR = 3.01; p=0.008). Among biochemical markers of liver function, higher levels of aspartate aminotransferase (AST), alanine aminotransferase (ALT), and alkaline phosphatase (ALP) were observed in patients with NAFLD (p<0.01). Age-stratified analysis demonstrated decreasing levels of ALT, AST, and ALP, accompanied by an increase in gamma-glutamyltransferase (GGT) levels in older age groups. This trend may indicate a shift in the pattern of liver dysfunction — from predominantly cytolytic to a cholestatic-fibrotic biochemical profile, reflecting fibrosis progression and the development of intrahepatic cholestasis.
Conclusions. In real-world Russian clinical practice, NAFLD is strongly associated with insulin resistance, abdominal obesity, atherogenic dyslipidemia, and age-related alterations in liver enzyme activity. Early risk stratification should incorporate HOMA-IR and TyG indices, fasting glucose ≥5.6 mmol/L, non-HDL-C and TG levels, together with age-specific evaluation of liver enzymes (ALT, AST, ALP, GGT).
Keywords: non-alcoholic fatty liver disease; metabolically associated fatty liver disease; insulin resistance; hyperglycemia; dyslipidemia; triglycerides; non-HDL cholesterol; alanine aminotransferase; aspartate aminotransferase; cardiometabolic risk; cardio-reno-hepato-metabolic syndrome.
For citation: Dzgoeva F.K., Radaeva O.A., Krasnoglazova K.A., Arkhipkin A.A., Mamieva E.K., Smetanina S.A., Vyuchnova E.S. Non-alcoholic fatty liver disease and cardiometabolic risk factors. Clinical review for general practice. 2025; 6 (10): 43–54 (In Russ.). DOI: 10.47407/ kr2025.6.10.00692
Введение
Неалкогольная жировая болезнь печени (НАЖБП) – наиболее распространенная форма хронического поражения печени, выявляемая у 25–35% взрослого населения России и более чем у трети мировой популяции. Для обозначения данного состояния предложен новый термин «метаболически ассоциированная жировая болезнь печени» (МАЖБП), отражающий роль системных метаболических нарушений в патогенезе заболевания, однако в действующих клинических рекомендациях Министерства здравоохранения Российской Федерации сохраняется официальное наименование НАЖБП [1–3].
Заболевание на ранних стадиях, как правило, протекает бессимптомно, но ассоциируется с высоким риском прогрессирования до фиброза, цирроза и гепатоцеллюлярной карциномы, а также внепеченочных осложнений, включая сердечно-сосудистые, эндокринные и онкологические заболевания [4].
В настоящее время НАЖБП рассматривается как важный компонент дисфункции кардио-рено-гепато-метаболической оси [5, 6]. В российской популяции пациентов с недавно диагностированной НАЖБП наиболее распространенными коморбидными состояниями являются ожирение (80,8%), гиперлипидемия (74,6%), артериальная гипертензия (>57,8%) и сахарный диабет 2-го типа (16,8%), что характеризует их как группу повышенного кардиометаболического риска [7]. С патогенетической точки зрения НАЖБП следует рассматривать не как пассивный маркер, а как активное звено кардиометаболического континуума, при котором накопление липидов в гепатоцитах способствует развитию инсулинорезистентности, хронического воспаления и эндотелиальной дисфункции, повышая сердечно-сосудистую смертность [8, 9].
Предпосылками для пересмотра подходов к НАЖБП стали растущая роль компонентов метаболического синдрома в формировании сердечно-сосудистого риска и смертности, развитие концепции синдемии метаболических заболеваний – взаимно усиливающегося взаимодействия ожирения, сахарного диабета и сердечно-сосудистой патологии, а также обновление представлений о кардио-рено-гепато-метаболическом синдроме (КРГМС). Все это подчеркивает необходимость более ранней диагностики и терапии НАЖБП – так называемого «сдвига влево», направленного на выявление заболевания и вмешательство на его доклинических стадиях, до развития структурных изменений печени. Такой проактивный подход требует участия специалистов разных профилей – гастроэнтерологов, кардиологов и эндокринологов [5, 6].
Несмотря на высокую распространенность НАЖБП среди взрослого населения России, данные о ранних кардиометаболических факторах риска в условиях реальной клинической практики остаются ограниченными. Восполнение этого пробела имеет важное значение для оптимизации скрининга, ранней диагностики у пациентов с субклиническими изменениями и стратификации риска НАЖБП в российской популяции. Особый интерес представляют показатели печеночного цитолиза [аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)], холестаза [щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП)], а также параметры липидного обмена – общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеидов низкой плотности (ХС ЛПНП), холестерин липопротеидов высокой плотности (ХС ЛПВП), холестерин липопротеидов невысокой плотности (ХС неЛПВП).
По данным литературы, у лиц молодого возраста с избыточной массой тела и инсулинорезистентностью преобладает фаза гепатоцеллюлярной реактивности: повышение уровней АЛТ и АСТ может указывать на сохраненную способность гепатоцитов реагировать на метаболическую перегрузку и воспалительный стимул [10–13]. С возрастом реактивность печени снижается: уровни трансаминаз постепенно уменьшаются или остаются в пределах референсных значений даже при наличии морфологических признаков фиброза [14–16]. Одновременно наблюдается повышение уровней ГГТП [17–20], что может отражать формирование внутрипеченочного холестаза, фибротических изменений и ремоделирование билиарного тракта [21, 22]. При этом отмечаются выраженные половые различия: у мужчин, как правило, наблюдаются более высокие уровни АЛТ, АСТ и ГГТП, тогда как активность ЩФ чаще выше у женщин, особенно в старших возрастных группах [23–26].
Возраст и пол оказывают выраженное влияние на липидный профиль. У мужчин среднего возраста отмечаются более высокие уровни ХС ЛПНП и ТГ по сравнению с женщинами, что связано с меньшей активностью эстроген-зависимого клиренса липидов. С возрастом у лиц обоих полов наблюдается тенденция к умеренному росту ХС ЛПНП и ТГ при одновременном снижении ХС ЛПВП, что формирует типичный «атерогенный сдвиг» липидного спектра, ассоциированный с увеличением сердечно-сосудистого риска и метаболической перегрузкой печени [27–31].
С клинической точки зрения такие возрастные и половые различия подтверждают необходимость дифференцированной интерпретации биохимического профиля при стратификации риска у пациентов с НАЖБП, особенно на доклинических стадиях заболевания.
С учетом изложенного, цель настоящего исследования заключалась в ретроспективной оценке ключевых кардиометаболических факторов риска, включая возрастные и половые особенности показателей функции печени, параметров углеводного и липидного обмена, ассоциированных с НАЖБП, и сопоставлении полученных данных с результатами международных и российских исследований.
Материалы и методы
Дизайн исследования и популяция
Исследование носило ретроспективный наблюдательный характер. В анализ были включены данные 256 взрослых пациентов, проходивших обследование в условиях амбулаторного и стационарного звена. Все участники подписали письменное информированное согласие на участие в исследовании.
Критерии включения:
• возраст от 18 до 65 лет;
• подтверждение НАЖБП методами визуализации (ультразвуковое исследование и/или магнитно-резонансная томография);
• наличие избыточной массы тела или ожирения;
• отсутствие тяжелых сопутствующих заболеваний (сахарного диабета 2-го типа, выраженной сердечно-сосудистой патологии, почечной недостаточности и других состояний, способных повлиять на результаты исследования).
Критерии невключения:
• злоупотребление алкоголем;
• вирусные гепатиты;
• аутоиммунные заболевания печени, гемохроматоз, болезнь Вильсона, врожденные нарушения метаболизма аминокислот (например, фенилкетонурия) и поражение печени другой установленной этиологии;
• прием препаратов, потенциально влияющих на метаболизм печени или аминокислотный состав (статины, гормональные препараты, гепатотоксичные вещества);
• беременность или период лактации;
• острые инфекционные или воспалительные заболевания на момент включения.
Сбор данных
Для анализа были отобраны сведения об антропометрических параметрах и лабораторных показателях, ассоциированных с повышенным кардиометаболическим риском.
Рост и массу тела определяли с использованием стандартизированных процедур. Индекс массы тела (ИМТ) рассчитывали как отношение массы тела в килограммах к квадрату роста в метрах. Дополнительно фиксировали окружность талии.
Для оценки лабораторных показателей образцы венозной крови отбирали в вакуумные пробирки VACUETTE с активатором свертывания и гелем. В течение 1 ч после забора кровь центрифугировали при 1800 g в течение 10–15 мин. Полученную сыворотку переносили во вторичные полипропиленовые пробирки и замораживали при температуре -80°C до момента анализа.
Статистический анализ
Статистическую обработку данных проводили с использованием программного пакета STATA версии 15.1 (StataCorp LLC, College Station, TX, USA).
Непрерывные переменные с нормальным распределением были описаны как среднее (М) ± стандартное отклонение (SD), при непараметрическом распределении – как медиана (Ме) и межквартильный размах [Q1; Q3]. Категориальные переменные были представлены в виде абсолютных значений и процентов.
Для первичного выявления факторов риска, ассоциированных с наличием НАЖБП, был проведен однофакторный логистический регрессионный анализ. В анализ включали следующие предикторы:
• демографические и антропометрические показатели: пол, масса тела, ИМТ, окружность талии;
• показатели углеводного обмена: уровень глюкозы, уровень инсулина, индекс HOMA-IR, рассчитанный по формуле: уровень инсулина натощак (мкЕд/мл) × уровень глюкозы натощак (ммоль/л) / 22,5, а также индекс TyG, рассчитанный по формуле:
ln (уровень ТГ натощак (мг/дл) × уровень глюкозы натощак (мг/дл) / 2);
• показатели липидного профиля: ОХС, ХС неЛПВП, ТГ;
• показатели функции печени: АЛТ, АСТ, ЩФ, ГГТП.
Для всех переменных были рассчитаны отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) и соответствующими p-значениями. Статистическая значимость устанавливалась при p<0,05. Анализ проводился как для непрерывных переменных, так и после их категоризации на клинически значимые группы (например, уровень глюкозы ≥5,6 ммоль/л, ИМТ >25 кг/м2 и др.).
С целью контроля потенциальных факторов смешения и оценки независимых ассоциаций с НАЖБП были построены модели множественной логистической регрессии. Переменные были включены в модель на основе значимости в однофакторном анализе и клинической обоснованности. В разных моделях были проанализированы:
• ХС неЛПВП (категориальный признак ≥2,6 ммоль/л);
• индекс TyG (непрерывная переменная);
• индекс инсулинорезистентности HOMA-IR (непрерывная переменная).
Ретроспективный характер исследования не предполагал проведения предварительного расчета размера выборки. Тем не менее итоговое число включенных пациентов (n=256) обеспечивало достаточную мощность исследования (>80%) для выявления ассоциаций с ОШ >2,0 при p<0,05.
Результаты исследования

В исследование были включены 256 пациентов, из которых 186 имели признаки НАЖБП, а 70 человек без признаков заболевания составили контрольную группу.
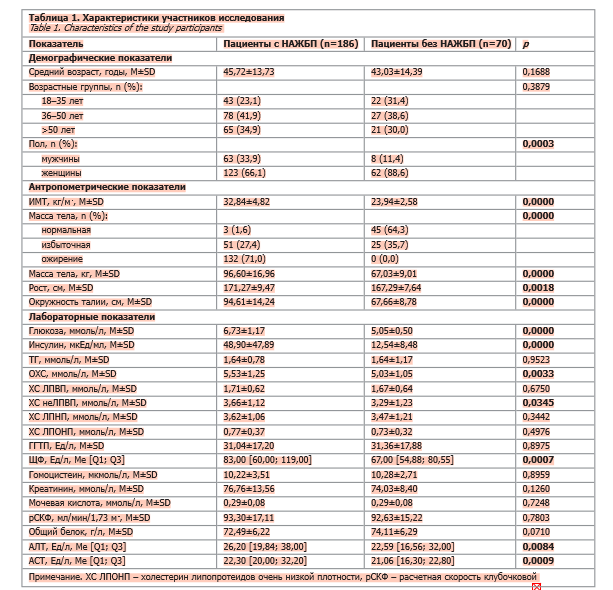
Среди участников исследования преобладали лица женского пола (72,3% против 27,7%; p=0,0003). Пациенты с НАЖБП и без НАЖБП были сопоставимы по среднему возрасту, который составлял 45,72±13,73 и 43,03±14,39 года соответственно (p=0,1688).
Демографические, антропометрические характеристики, а также лабораторные показатели участников исследования представлены в табл. 1.
Демографические характеристики, ассоциируемые с повышением распространенности НАЖБП
Несмотря на преобладание среди участников исследования лиц женского пола, однофакторный анализ показал, что у мужчин распространенность НАЖБП была почти в 4 раза выше, чем у женщин (ОШ 3,97; 95% ДИ 1,79–8,80; p=0,0007).
Антропометрические показатели, ассоциируемые с повышением распространенности НАЖБП
Пациенты с НАЖБП имели статистически значимо более высокие значения среднего ИМТ (32,84±4,82 кг/м2 против 23,94±2,58 кг/м2; p<0,00001). Избыточная масса тела или ожирение наблюдались у 98,4% пациентов с НАЖБП по сравнению с 35,7% пациентов контрольной группы (p<0,00001). Среднее значение окружности талии также было выше при наличии НАЖБП (94,61±14,24 см против 67,66±8,78 см; p<0,00001).
Рост антропометрических показателей сопровождался увеличением распространенности НАЖБП. Однофакторный анализ продемонстрировал, что увеличение ИМТ на одну единицу сопровождалось ростом распространенности НАЖБП почти в 3 раза. Масса тела и окружность талии также демонстрировали значимые ассоциации: каждый дополнительный килограмм массы тела увеличивал распространенность НАЖБП на 28%, а каждый сантиметр окружности талии – на 30% (рис. 1).
Даже при исключении пациентов с ожирением избыточная масса тела оставалась значимым предиктором НАЖБП и ассоциировалась с 30-кратным повышением распространенности (ОШ 30,6; 95% ДИ 1,33–6,81; p<0,001; n=124). В общей когорте, включающей всех участников исследования, ИМТ >25 кг/м2 ассоциировался с многократным увеличением распространенности НАЖБП – более чем в 100 раз (ОШ 109,8; 95% ДИ 31,74–379,87; p<0,001). Эти данные указывают на значимый вклад как доклинических стадий ожирения, так и выраженного увеличения массы тела в формирование риска НАЖБП.
Показатели углеводного обмена, ассоциируемые с повышением распространенности НАЖБП
У пациентов с НАЖБП наблюдалось значимое повышение уровней глюкозы (6,73±1,17 ммоль/л против 5,05±0,50 ммоль/л; p<0,00001) и инсулина (48,90±47,89 мкЕд/мл против 12,54±8,48 мкЕд/мл; p<0,00001) по сравнению с контрольной группой.
Однофакторный анализ показал, что увеличение уровня глюкозы на 1 ммоль/л ассоциировалось с увеличением распространенности НАЖБП более чем
в 37 раз, а увеличение уровня инсулина на 1 мкЕд/мл – на 9% (рис. 2).
Гипергликемия (уровень глюкозы ≥5,6 ммоль/л) сопровождалась 49-кратным увеличением распространенности НАЖБП (ОШ 49,14; 95% ДИ 22,09–109,35; p<0,001) по сравнению с пациентами с нормальным уровнем глюкозы (<5,6 ммоль/л). Уровни глюкозы в диапазоне 5,6–6,9 ммоль/л, ассоциировались с повышением распространенности НАЖБП более чем в 30 раз (ОШ 30,29; 95% ДИ 13,49–67,98; p<0,001). Шестьдесят шесть пациентов с установленным сахарным диабетом (уровень глюкозы ≥7,0 ммоль/л) были исключены из анализа ввиду полной предсказуемости наличия НАЖБП.
Индексы инсулинорезистентности также демонстрировали сильные ассоциации с заболеванием. Средние значения индекса HOMA-IR (15,96±17,99 против 2,84±1,95; p<0,00001) и TyG (8,97±0,50 против 8,59±0,63; p<0,00001) были значительно выше у пациентов с НАЖБП. Индекс HOMA-IR оказался независимым предиктором НАЖБП: каждое его увеличение на одну единицу ассоциировалось с ростом распространенности заболевания в 1,52 раза (ОШ 1,52; 95% ДИ 1,29–1,79; p<0,001). Индекс TyG демонстрировал еще более сильную зависимость: каждое его повышение на одну единицу увеличивало распространенность НАЖБП в 3,65 раза (ОШ 3,65; 95% ДИ 2,09–6,36; p<0,001).
В попарном сравнении было показано, что у женщин старше 45 лет, по сравнению с более молодыми, статистически значимо выше уровни ТГ, ОХС и индекса TyG (p<0,01). Эти данные согласуются с результатами предыдущих работ, где продемонстрировано, что гипертриглицеридемия [32], а также повышенный индекс TyG [33] у женщин в постменопаузе ассоциированы с повышенным риском сердечно-сосудистых заболеваний. Это подчеркивает необходимость регулярного обследования и раннего выявления кардиометаболических факторов риска у данной группы пациентов.
Показатели липидного обмена, ассоциируемые с повышением распространенности НАЖБП
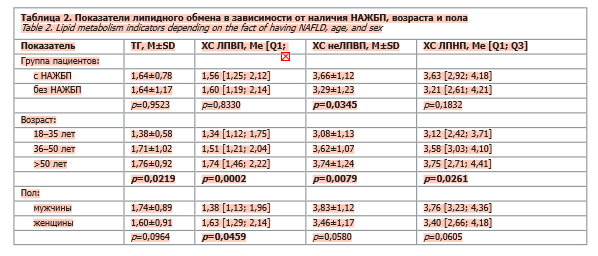
У пациентов с НАЖБП средняя концентрация ОХС была выше, чем в контрольной группе (5,53±1,25 ммоль/л против 5,03±1,05 ммоль/л; p=0,003). Уровни ТГ, ХС ЛПВП и ХС ЛПНП в группе НАЖБП были сопоставимы с контролем (табл. 2).
Повышение уровня ОХС на 1 ммоль/л ассоциировалось с увеличением распространенности НАЖБП на 44% (ОШ 1,44; 95% ДИ 1,12–1,85; p=0,0040), уровня ХС неЛПВП — на 32% (ОШ 1,32; 95% ДИ 1,02–1,72; p=0,036).
У пациентов с уровнем ХС неЛПВП ≥3,8 ммоль/л вероятность наличия НАЖБП увеличивалась почти вдвое (ОШ 1,99; 95% ДИ 1,06–3,73; p=0,033) по сравнению с пациентами с более низкими значениями данного показателя. Более чувствительный порог ХС неЛПВП ≥2,6 ммоль/л также продемонстрировал двукратное повышение распространенности НАЖБП (ОШ 2,15; 95% ДИ 1,03–4,49; p=0,040).
У пациентов с НАЖБП реже наблюдали уровень ТГ ≤1,6 ммоль/л по сравнению с участниками исследования без НАЖБП (58,6% против 71,4%; p=0,0172). Повышенные уровни ТГ (1,7–2,3 ммоль/л) были ассоциированы с трехкратным повышением распространенности НАЖБП (ОШ 3,01; p=0,008). При анализе отдельных возрастных подгрупп было продемонстрировано, что у пациентов старше 36 лет средний уровень ТГ превышал целевое значение в 1,7 ммоль/л, что подчеркивает возрастной компонент метаболических нарушений.
При стратификации пациентов по возрасту наблюдалась выраженная тенденция к нарастанию атерогенных липидных фракций: повышение уровней ТГ (p=0,0219), ХС неЛПВП (p=0,0079) и ХС ЛПНП (p=0,0261) у пациентов старше 50 лет. Уровень ХС ЛПВП увеличивался с возрастом (p=0,0002), однако при анализе по полу выявлено, что у женщин значения ХС ЛПВП были статистически значимо выше, что, вероятно, отражает гормонально обусловленные различия липидного обмена [27–29]. У мужчин также отмечалась тенденция к более высоким уровням ТГ, ХС ЛПНП и ХС неЛПВП, что формирует более атерогенный профиль, особенно в возрасте старше 35 лет (см. табл. 2).
Показатели функции печени, ассоциируемые с повышением распространенности НАЖБП
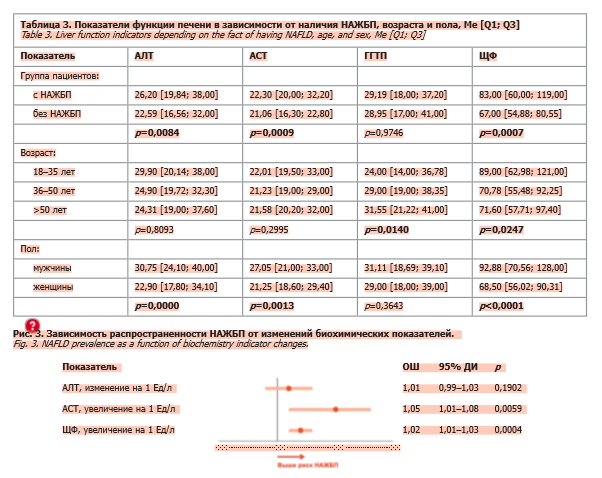
По результатам, отраженным в табл. 3, в группе пациентов с НАЖБП отмечались повышенные медианные значения АСТ, АЛТ, ЩФ; различия были статистически значимы. Для интерпретации уровней печеночных ферментов учитывались современные рекомендации [34], согласно которым даже значения в пределах ранее допустимого диапазона могут отражать патологические изменения функции печени.
У пациентов с НАЖБП чаще выявлялись отклонения печеночных показателей: повышенный уровень АЛТ отмечен у 70,3% пациентов против 29,7% в контрольной группе (при нормальных значениях 19–25 Ед/л для женщин и 29–33 Ед/л для мужчин [34]), хотя различия не достигли статистической значимости (p=0,4685). Повышение уровня АСТ >40 Ед/л наблюдалось у 14,5% пациентов против 4,3% соответственно (p=0,0267). Кроме того, у пациентов с НАЖБП чаще наблюдалось повышение ЩФ >120 Ед/л (21,9% против 4,4%; p=0,0009).
Полученные данные указывают, что активность печеночных ферментов может иметь прогностическое значение при НАЖБП (рис. 3). В частности, как показано в недавнем исследовании, повышенное соотношение АЛТ/АСТ ассоциировано с более высокими риском и степенью тяжести заболевания, что подтверждает целесообразность его использования в клинической практике [35]. При этом выявленные изменения могут отражать субклиническую нагрузку на печень и ранние нарушения ее детоксикационной функции, фиксируемые даже при «референсных» уровнях трансаминаз [34].
При стратификации пациентов по возрасту отмечено постепенное повышение уровней ГГТП (p=0,014), снижение уровней ЩФ (p=0,0247), а также тенденция к снижению уровней АЛТ и АСТ (см. табл. 3). Данные указывают на то, что у молодых пациентов преобладают признаки гепатоцеллюлярного цитолиза, тогда как с возрастом усиливается холестатический компонент биохимического профиля.
Гендерный анализ подтвердил более высокие значения АЛТ, АСТ, ЩФ (p<0,001) и ГГТП у мужчин по сравнению с женщинами, что согласуется с данными литературы и может свидетельствовать о большей выраженности метаболических нарушений у лиц мужского пола [23–26].
Совокупность полученных данных указывает на наличие возрастно-половых различий в биохимическом профиле пациентов с НАЖБП и подтверждает гипотезу о переходе от функциональной гиперреактивности печени у молодых к структурным изменениям с элементами фиброза в старших возрастных группах.
Обсуждение
Настоящее ретроспективное исследование подтверждает выраженную связь НАЖБП с ключевыми кардиометаболическими факторами риска в российской клинической популяции. Наиболее сильные ассоциации продемонстрировали показатели углеводного обмена (гипергликемия, инсулинорезистентность), параметры атерогенной дислипидемии (ХС неЛПВП, ТГ), антропометрические параметры (избыточная масса тела и абдоминальное ожирение), а также ферментативные показатели печени.
Уже на стадии избыточной массы тела до ожирения распространенность НАЖБП возрастала в десятки раз, а при наличии избыточной массы тела или ожирения (ИМТ ≥25 кг/м2) – более чем в сто раз. Полученные данные согласуются с результатами российских исследований, демонстрирующих, что избыточная масса тела или ожирение выявляются у 80% пациентов с НАЖБП [7]. Результаты подтверждают представление о первичности висцерального жира и липотоксичности в запуске стеатоза и воспалительной реакции печени.
В реальной практике необходима рутинная оценка окружности талии для стратификации риска даже при среднем ИМТ.
Уровень глюкозы ≥5,6 ммоль/л и повышение индексов HOMA-IR/TyG ассоциировались с НАЖБП независимо от антропометрических данных, что отражает центральную роль инсулинорезистентности. Полученные нами результаты соответствуют данным международных исследований, в которых продемонстрирована диагностическая значимость индексов HOMA-IR/TyG для оценки риска не только инсулинорезистентности, но и НАЖБП в популяции пациентов без сахарного диабета или ожирения [36, 37].
Повышение уровня ХС неЛПВП как суммарного индикатора всех атерогенных фракций оказалось тесно связано с наличием НАЖБП, что согласуется с данными о более высокой прогностической значимости ХС неЛПВП и аполипопротеина B по сравнению с изолированной оценкой ХС ЛПНП [2, 38]. В исследуемой когорте отмечено возраст-зависимое увеличение уровней ТГ, ХС неЛПВП и ХС ЛПНП, формирующее более атерогенный липидный фенотип, особенно выраженный у мужчин. В нашем исследовании наблюдалось также повышение уровней ХС ЛПВП, что нетипично для классической атерогенной дислипидемии, при которой этот показатель, как правило, снижается с возрастом. Вероятно, этот феномен связан с совокупным влиянием метаболических и гормональных факторов. В частности, у женщин уровни ХС ЛПВП традиционно выше и демонстрируют тенденцию к росту в перименопаузальном периоде, что подтверждено данными крупных популяционных исследований [27–29]. Следует отметить, что количественные показатели ХС ЛПВП не всегда отражают его функциональные свойства: при НАЖБП описан феномен «дисфункционального ХС ЛПВП», характеризующийся снижением антиоксидантной и противовоспалительной активности липопротеидов при сохранении или повышении их концентрации [39, 40]. Таким образом, выявленное повышение ХС ЛПВП, вероятно, отражает не истинный кардиопротективный эффект и требует дальнейшего анализа для уточнения его клинического и патофизиологического значения у пациентов с НАЖБП.
У пациентов с НАЖБП чаще выявлялись повышенные значения печеночных ферментов; различия средних уровней АСТ и ЩФ, а также медианных значений АЛТ были статистически значимыми. Согласно современным клиническим рекомендациям ACG (2016), даже умеренное повышение АЛТ, ранее считавшееся нормальным, может отражать патологические изменения, особенно у пациентов с избыточной массой тела [34]. Установлена линейная зависимость между уровнем АЛТ и индексом массы тела, что подтверждает роль ожирения и инсулинорезистентности в активации цитолитических процессов [41, 42]. Повышенная активность АЛТ в свою очередь ассоциируется не только с наличием НАЖБП, но и с увеличением риска сердечно-сосудистых осложнений, включая ишемическую болезнь сердца [43].
Новые данные указывают, что соотношение АЛТ/АСТ может служить более информативным показателем, позволяющим судить как о наличии, так и о степени тяжести НАЖБП [35]. В нашем исследовании выявлена четкая возрастная тенденция: у пациентов младших возрастных групп (до 35 лет) преобладает цитолитический тип ответа с повышением АЛТ и АСТ, тогда как у лиц старше 50 лет наблюдается снижение активности трансаминаз и ЩФ при одновременном росте уровней ГГТП. Такая динамика отражает постепенное истощение функциональной реактивности гепатоцитов и смещение метаболического профиля в сторону холестатическо-фибротического варианта.
Совокупность выявленных ассоциаций (инсулинорезистентность, висцеральное ожирение, атерогенная дислипидемия, «сдвиг» ферментов) отражает фенотипическую эволюцию печеночного компонента КРГМС: от гепатоцеллюлярной гиперреактивности у молодых к холестатическо-фибротическому варианту у старших пациентов [6]. По критериям клинического консенсуса Американской кардиологической ассоциации (AHA, 2023) значительная часть включенных в исследование пациентов соответствуют ранним стадиям кардио-рено-метаболического континуума (1–2-я стадии), когда уже фиксируются субклинические органные изменения при нарастающем системном риске [44]. Такой контекст подчеркивает, что НАЖБП следует рассматривать не только как локальное печеночное заболевание, но и как компонент системного риска, что диктует необходимость ранней стратификации и междисциплинарной коррекции факторов риска.
Ограничения исследования. Диспропорция по полу (женщины составляли 72,3% выборки) могла смягчать оценку половых различий; тем не менее распространенность НАЖБП у мужчин была почти в четыре раза выше, что согласуется с российскими данными многоцентрового исследования ЭССЕ-РФ-2 (распространенность по FLI ≥60: 38,5% у мужчин против 26,6% у женщин) [45].
Выводы и рекомендации
Проведенный ретроспективный анализ продемонстрировал, что НАЖБП в условиях реальной российской клинической практики тесно ассоциирована с основными компонентами кардиометаболического риска. Заболевание формирует типичный метаболический фенотип, включающий инсулинорезистентность, дислипидемию и висцеральное ожирение, что подтверждает системный характер НАЖБП как звена кардио-рено-гепато-метаболического континуума.
Наиболее значимые предикторы НАЖБП:
• инсулинорезистентность, оцениваемая по индексам HOMA-IR и TyG, – независимый фактор риска, сохраняющий прогностическую значимость даже у пациентов без установленного сахарного диабета 2-го типа;
• гипергликемия: значения глюкозы ≥5,6 ммоль/л;
• избыточная масса тела и ожирение – ведущие факторы риска, отражающие центральную роль висцерального жира и липотоксичности в патогенезе заболевания;
• дислипидемия, характеризующаяся повышением уровней ХС неЛПВП и ТГ, отражает нарастающий атерогенный потенциал метаболического профиля;
• повышение активности печеночных ферментов (АСТ, ЩФ, АЛТ, ГГТП) служит дополнительным маркером риска: даже умеренное повышение их уровней может указывать на ранние субклинические стадии НАЖБП, требующие наблюдения и коррекции.
Полученные результаты имеют практическое значение и позволяют сформулировать ряд рекомендаций:
1. Включать расчет индексов HOMA-IR и TyG в стандартное обследование пациентов с метаболическими факторами риска и/или подозрением на НАЖБП.
2. Использовать более низкий порог настороженности по уровню глюкозы (≥5,6 ммоль/л) даже при отсутствии манифестного диабета для раннего выявления пациентов с высоким риском НАЖБП.
3. Рассматривать показатели ХС неЛПВП и ТГ как важные маркеры риска НАЖБП и сердечно-сосудистых осложнений наряду с традиционными показателями липидного профиля.
4. Учитывать диагностическую значимость ферментативных показателей функции печени (АСТ, АЛТ, ЩФ, ГГТП) при оценке риска и мониторинге пациентов.
5. Разрабатывать локальные протоколы стратификации риска НАЖБП с учетом региональных особенностей и доступности методов лабораторной и инструментальной диагностики.
6. Продолжить проспективные исследования с использованием неинвазивных методов оценки стеатоза и фиброза печени (эластография, технология CAP), а также новых циркуляторных биомаркеров.
7. Усилить образовательные программы для врачей первичного звена, акцентируя внимание на НАЖБП как на системном метаболическом заболевании, требующем междисциплинарного подхода.
Результаты исследования подчеркивают необходимость ранней стратификации риска и междисциплинарного ведения пациентов с НАЖБП. Выявленные взаимосвязи с инсулинорезистентностью, атерогенной дислипидемией и ожирением подтверждают, что НАЖБП следует рассматривать не только как гепатологическую, но и как кардиометаболическую патологию, требующую интегрированного подхода к диагностике, профилактике и лечению.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Дзгоева Фатима Хаджимуратовна – канд. мед. наук, доц. каф. диабетологии и диетологии ИМ и ДПО, зав. отд. по оказанию диетологической помощи ГНЦ ФГБУ НМИЦ эндокринологии
им. акад. И.И. Дедова. E-mail: fatima.dzgoeva@ gmail.com; ORCID: 0000-0002-0327-4619; SPIN-код: 9315-0722
Fatima K. Dzgoeva – Cand. Sci. (Med.), Assoc. Prof., Endocrinology Research Centre. E-mail: fatima.dzgoeva@gmail.com; ORCID: 0000-0002-0327-4619; SPIN-code: 9315-0722
Радаева Ольга Александровна – д-р мед. наук, зав. каф. иммунологии, микробиологии и вирусологии Медицинского института ФГБОУ ВО «МГУ им. Н.П. Огарева». ORCID: 0000-0003-1383-2474
Olga A. Radaeva – Dr. Sci. (Med.), N.P. Ogarev Mordovia State University. ORCID: 0000-0003-1383-2474
Красноглазова Ксения Александровна – ассистент каф. иммунологии, микробиологии и вирусологии Медицинского института ФГБОУ ВО «МГУ им. Н.П. Огарева». ORCID: 0009-0008-7984-9053
Ksenia A. Krasnoglazova – Assistant, N.P. Ogarev Mordovia State University. ORCID: 0009-0008-7984-9053
Архипкин Александр Алексеевич – канд. биол. наук, зав. лаб., врач ООО «НЦ ЭФиС». ORCID: 0000-0001-7814-8409
Alexander A. Arkhipkin – Cand. Sci. (Biol.), Head of Laboratory, physician, EFiS Research Center LLC. ORCID: 0000- 0001-7814-8409
Мамиева Эрна Казбековна – студентка 6-го курса ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет). ORCID: 0009-0007-3479-8937
Erna K. Mamieva – 6th year Student, Pirogov Russian National Research Medical University. ORCID: 0009-0007-3479-8937
Сметанина Светлана Андреевна – д-р мед. наук, доц., зав. каф. детских болезней Института материнства и детства ФГБОУ ВО «Тюменский ГМУ». ORCID: 0000-0003-3525-9891
Svetlana A. Smetanina – Dr. Sc. (Med.), Assoc. Prof., Tyumen State Medical University. ORCID: 0000-0003-3525-9891
Вьючнова Елена Станиславовна – канд. мед. наук, доц. каф. пропедевтики внутренних болезней и гастроэнтерологии леч.
ф-та ФГБОУ ВО «Российский университет медицины»
Elena S. Vyuchnova – Cand. Sci. (Med.), Assoc. Prof., Russian University of Medicine
Поступила в редакцию: 23.10.2025
Поступила после рецензирования: 29.10.2025
Принята к публикации: 30.10.2025
Received: 23.10.2025
Revised: 29.10.2025
Accepted: 30.10.2025
Клинический разбор в общей медицине №10 2025
Неалкогольная жировая болезнь печени и кардиометаболические факторы риска
Номера страниц в выпуске:43-54
Аннотация
Неалкогольная жировая болезнь печени (НАЖБП) является ключевым компонентом кардио-рено-гепато-метаболического синдрома и тесно связана с повышением сердечно-сосудистого риска. Заболевание отражает системные нарушения обмена веществ, включая инсулинорезистентность, дислипидемию и хроническое воспаление, что определяет его значимость не только для гастроэнтерологии, но и для кардиологии и эндокринологии. Несмотря на высокую распространенность НАЖБП, сведения о клинико-биохимических особенностях заболевания в российской популяции остаются ограниченными.
Цель. Оценить взаимосвязь НАЖБП с ключевыми кардиометаболическими факторами риска, а также выявить возрастные и половые особенности метаболических и биохимических показателей.
Материалы и методы. В исследование включены 256 взрослых пациентов, из которых 186 имели визуально подтвержденную НАЖБП, а 70 составили контрольную группу. Исключались пациенты с вирусными гепатитами, злоупотреблением алкоголем, заболеваниями печени иной установленной этиологии, лица, принимавшие препараты, влияющие на функцию печени, а также беременные и кормящие женщины. Всем участникам проводили антропометрические измерения и биохимическое исследование крови. Ассоциации факторов риска с НАЖБП оценивали с помощью однофакторной и множественной логистической регрессии с расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ).
Результаты. Мужской пол ассоциировался с 4-кратным повышением распространенности НАЖБП (ОШ 3,97; p=0,0007). Избыточная масса тела [индекс массы тела (ИМТ) 25–30 кг/м2, категория ожирения исключена] увеличивала вероятность заболевания более чем в 30 раз (ОШ 30,6; p<0,001) по сравнению с контролем. При включении в анализ пациентов с ожирением продемонстрировано, что ИМТ ≥25 кг/м2 ассоциирован с увеличением вероятности развития НАЖБП более чем в 100 раз (ОШ 109,8; p<0,001). Гипергликемия ≥5,6 ммоль/л повышала риск НАЖБП в 49 раз (ОШ 49,14; p<0,001). Индексы HOMA-IR и TyG являлись независимыми предикторами риска НАЖБП (ОШ 1,52 и 3,65; p<0,001). Повышение уровней холестерина липопротеидов невысокой плотности (ХС неЛПВП) и триглицеридов (ТГ) сопровождалось ростом риска НАЖБП на 30–40%. Среди биохимических показателей функции печени более высокие уровни аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и щелочной фосфатазы (ЩФ) отмечались у пациентов с НАЖБП (p<0,01). При стратификации по возрасту выявлено снижение уровней АЛТ, АСТ и ЩФ, а также рост уровней гамма-глутамилтранспептидазы (ГГТП) в старших возрастных группах. Такая динамика указывает на смену характера нарушений функции печени – от преимущественно цитолитического к холестатическо-фибротическому типу биохимического ответа, отражающему прогрессирование фиброза и развитие внутрипеченочного холестаза.
Заключение. НАЖБП в российской клинической практике ассоциирована с инсулинорезистентностью, абдоминальным ожирением, атерогенной дислипидемией и возрастными сдвигами ферментного профиля. Для ранней стратификации риска целесообразно использовать индексы HOMA-IR и TyG, уровень глюкозы ≥5,6 ммоль/л, значения ХС неЛПВП и ТГ, а также возраст-специфическую оценку активности ферментов печени (АЛТ, АСТ, ЩФ, ГГТП).
Ключевые слова: неалкогольная жировая болезнь печени, метаболически ассоциированная болезнь печени, инсулинорезистентность, гипергликемия, дислипидемия, триглицериды, холестерин липопротеидов невысокой плотности, аланинаминотрансфераза, аспартатаминотрансфераза, кардиометаболический риск, кардио-рено-гепато-метаболический синдром.
Для цитирования: Дзгоева Ф.Х., Радаева О.А., Красноглазова К.А., Архипкин А.А., Мамиева Э.К., Сметанина С.А., Вьючнова Е.С. Неалкогольная жировая болезнь печени и кардиометаболические факторы риска. Клинический разбор в общей медицине. 2025; 6 (10): 43–54. DOI: 10.47407/kr2025.6.10.00692
Неалкогольная жировая болезнь печени (НАЖБП) является ключевым компонентом кардио-рено-гепато-метаболического синдрома и тесно связана с повышением сердечно-сосудистого риска. Заболевание отражает системные нарушения обмена веществ, включая инсулинорезистентность, дислипидемию и хроническое воспаление, что определяет его значимость не только для гастроэнтерологии, но и для кардиологии и эндокринологии. Несмотря на высокую распространенность НАЖБП, сведения о клинико-биохимических особенностях заболевания в российской популяции остаются ограниченными.
Цель. Оценить взаимосвязь НАЖБП с ключевыми кардиометаболическими факторами риска, а также выявить возрастные и половые особенности метаболических и биохимических показателей.
Материалы и методы. В исследование включены 256 взрослых пациентов, из которых 186 имели визуально подтвержденную НАЖБП, а 70 составили контрольную группу. Исключались пациенты с вирусными гепатитами, злоупотреблением алкоголем, заболеваниями печени иной установленной этиологии, лица, принимавшие препараты, влияющие на функцию печени, а также беременные и кормящие женщины. Всем участникам проводили антропометрические измерения и биохимическое исследование крови. Ассоциации факторов риска с НАЖБП оценивали с помощью однофакторной и множественной логистической регрессии с расчетом отношения шансов (ОШ) и 95% доверительного интервала (ДИ).
Результаты. Мужской пол ассоциировался с 4-кратным повышением распространенности НАЖБП (ОШ 3,97; p=0,0007). Избыточная масса тела [индекс массы тела (ИМТ) 25–30 кг/м2, категория ожирения исключена] увеличивала вероятность заболевания более чем в 30 раз (ОШ 30,6; p<0,001) по сравнению с контролем. При включении в анализ пациентов с ожирением продемонстрировано, что ИМТ ≥25 кг/м2 ассоциирован с увеличением вероятности развития НАЖБП более чем в 100 раз (ОШ 109,8; p<0,001). Гипергликемия ≥5,6 ммоль/л повышала риск НАЖБП в 49 раз (ОШ 49,14; p<0,001). Индексы HOMA-IR и TyG являлись независимыми предикторами риска НАЖБП (ОШ 1,52 и 3,65; p<0,001). Повышение уровней холестерина липопротеидов невысокой плотности (ХС неЛПВП) и триглицеридов (ТГ) сопровождалось ростом риска НАЖБП на 30–40%. Среди биохимических показателей функции печени более высокие уровни аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и щелочной фосфатазы (ЩФ) отмечались у пациентов с НАЖБП (p<0,01). При стратификации по возрасту выявлено снижение уровней АЛТ, АСТ и ЩФ, а также рост уровней гамма-глутамилтранспептидазы (ГГТП) в старших возрастных группах. Такая динамика указывает на смену характера нарушений функции печени – от преимущественно цитолитического к холестатическо-фибротическому типу биохимического ответа, отражающему прогрессирование фиброза и развитие внутрипеченочного холестаза.
Заключение. НАЖБП в российской клинической практике ассоциирована с инсулинорезистентностью, абдоминальным ожирением, атерогенной дислипидемией и возрастными сдвигами ферментного профиля. Для ранней стратификации риска целесообразно использовать индексы HOMA-IR и TyG, уровень глюкозы ≥5,6 ммоль/л, значения ХС неЛПВП и ТГ, а также возраст-специфическую оценку активности ферментов печени (АЛТ, АСТ, ЩФ, ГГТП).
Ключевые слова: неалкогольная жировая болезнь печени, метаболически ассоциированная болезнь печени, инсулинорезистентность, гипергликемия, дислипидемия, триглицериды, холестерин липопротеидов невысокой плотности, аланинаминотрансфераза, аспартатаминотрансфераза, кардиометаболический риск, кардио-рено-гепато-метаболический синдром.
Для цитирования: Дзгоева Ф.Х., Радаева О.А., Красноглазова К.А., Архипкин А.А., Мамиева Э.К., Сметанина С.А., Вьючнова Е.С. Неалкогольная жировая болезнь печени и кардиометаболические факторы риска. Клинический разбор в общей медицине. 2025; 6 (10): 43–54. DOI: 10.47407/kr2025.6.10.00692
Non-alcoholic fatty liver disease and cardiometabolic risk factors
Fatima K. Dzgoeva1, Olga A. Radaeva2, Ksenia A. Krasnoglazova2, Alexander A. Arkhipkin3, Erna K. Mamieva4, Svetlana A. Smetanina5, Elena S. Vyuchnova61 Endocrinology Research Centre, Moscow, Russia;
2 N.P. Ogarev Mordovia State University, Saransk, Russia;
3 EFiS Research Center LLC, Moscow, Russia;
4 Pirogov Russian National Research Medical University, Moscow, Russia;
5 Tyumen State Medical University, Tyumen, Russia;
6 Russian University of Medicine, Moscow, Russia
fatima.dzgoeva@gmail.com
Abstract
Nonalcoholic fatty liver disease (NAFLD) is a key component of the cardio-reno-hepato-metabolic syndrome (CRHMS) and is closely associated with an increased risk of cardiovascular disease. The condition represents systemic metabolic dysfunction, including insulin resistance, dyslipidemia, and chronic inflammation, underscoring its relevance not only to gastroenterology but also to cardiology and endocrinology. Despite its high prevalence, data on the clinical and biochemical characteristics of NAFLD in the Russian population remain limited.
Aim. To evaluate the association of NAFLD with major cardiometabolic risk factors and to identify age- and sex-related features of the metabolic and biochemical parameters.
Materials and methods. A total of 256 adult patients were included, of whom 186 had imaging-confirmed NAFLD and 70 comprised the control group. Patients with viral hepatitis, excessive alcohol consumption, liver diseases of other established etiology, use of hepatotoxic or metabolism-modifying drugs, and pregnant or lactating women were excluded. All participants underwent anthropometric assessment and biochemical blood testing. Associations between risk factors and NAFLD were analyzed using univariate and multivariate logistic regression with calculation of odds ratios (ORs) and 95% confidence intervals (CIs).
Results. Male sex was associated with a 4-fold higher prevalence of NAFLD (OR = 3.97; p=0.0007). Overweight [body mass index (BMI) 25–30 kg/m2, excluding obesity] increased the likelihood of NAFLD more than 30-fold (OR = 30.6; p<0.001), compared with control group. When patients with obesity were included in the analysis, BMI ≥25 kg/m2 was associated with more than a 100-fold increase in the probability of NAFLD (OR = 109.8; p<0.001). Hyperglycemia ≥5.6 mmol/L increased the risk of NAFLD by 49 times (OR = 49.14; p<0.001). Both HOMA-IR and TyG indices were independent predictors of NAFLD (OR = 1.52 and 3.65; p<0.001). Elevated levels of non-HDL cholesterol (non-HDL-C) and triglycerides (TG) were associated with a 30–40% higher risk of NAFLD. Even moderate triglyceride elevations (1.7–2.3 mmol/L) tripled NAFLD prevalence (OR = 3.01; p=0.008). Among biochemical markers of liver function, higher levels of aspartate aminotransferase (AST), alanine aminotransferase (ALT), and alkaline phosphatase (ALP) were observed in patients with NAFLD (p<0.01). Age-stratified analysis demonstrated decreasing levels of ALT, AST, and ALP, accompanied by an increase in gamma-glutamyltransferase (GGT) levels in older age groups. This trend may indicate a shift in the pattern of liver dysfunction — from predominantly cytolytic to a cholestatic-fibrotic biochemical profile, reflecting fibrosis progression and the development of intrahepatic cholestasis.
Conclusions. In real-world Russian clinical practice, NAFLD is strongly associated with insulin resistance, abdominal obesity, atherogenic dyslipidemia, and age-related alterations in liver enzyme activity. Early risk stratification should incorporate HOMA-IR and TyG indices, fasting glucose ≥5.6 mmol/L, non-HDL-C and TG levels, together with age-specific evaluation of liver enzymes (ALT, AST, ALP, GGT).
Keywords: non-alcoholic fatty liver disease; metabolically associated fatty liver disease; insulin resistance; hyperglycemia; dyslipidemia; triglycerides; non-HDL cholesterol; alanine aminotransferase; aspartate aminotransferase; cardiometabolic risk; cardio-reno-hepato-metabolic syndrome.
For citation: Dzgoeva F.K., Radaeva O.A., Krasnoglazova K.A., Arkhipkin A.A., Mamieva E.K., Smetanina S.A., Vyuchnova E.S. Non-alcoholic fatty liver disease and cardiometabolic risk factors. Clinical review for general practice. 2025; 6 (10): 43–54 (In Russ.). DOI: 10.47407/ kr2025.6.10.00692
Введение
Неалкогольная жировая болезнь печени (НАЖБП) – наиболее распространенная форма хронического поражения печени, выявляемая у 25–35% взрослого населения России и более чем у трети мировой популяции. Для обозначения данного состояния предложен новый термин «метаболически ассоциированная жировая болезнь печени» (МАЖБП), отражающий роль системных метаболических нарушений в патогенезе заболевания, однако в действующих клинических рекомендациях Министерства здравоохранения Российской Федерации сохраняется официальное наименование НАЖБП [1–3].
Заболевание на ранних стадиях, как правило, протекает бессимптомно, но ассоциируется с высоким риском прогрессирования до фиброза, цирроза и гепатоцеллюлярной карциномы, а также внепеченочных осложнений, включая сердечно-сосудистые, эндокринные и онкологические заболевания [4].
В настоящее время НАЖБП рассматривается как важный компонент дисфункции кардио-рено-гепато-метаболической оси [5, 6]. В российской популяции пациентов с недавно диагностированной НАЖБП наиболее распространенными коморбидными состояниями являются ожирение (80,8%), гиперлипидемия (74,6%), артериальная гипертензия (>57,8%) и сахарный диабет 2-го типа (16,8%), что характеризует их как группу повышенного кардиометаболического риска [7]. С патогенетической точки зрения НАЖБП следует рассматривать не как пассивный маркер, а как активное звено кардиометаболического континуума, при котором накопление липидов в гепатоцитах способствует развитию инсулинорезистентности, хронического воспаления и эндотелиальной дисфункции, повышая сердечно-сосудистую смертность [8, 9].
Предпосылками для пересмотра подходов к НАЖБП стали растущая роль компонентов метаболического синдрома в формировании сердечно-сосудистого риска и смертности, развитие концепции синдемии метаболических заболеваний – взаимно усиливающегося взаимодействия ожирения, сахарного диабета и сердечно-сосудистой патологии, а также обновление представлений о кардио-рено-гепато-метаболическом синдроме (КРГМС). Все это подчеркивает необходимость более ранней диагностики и терапии НАЖБП – так называемого «сдвига влево», направленного на выявление заболевания и вмешательство на его доклинических стадиях, до развития структурных изменений печени. Такой проактивный подход требует участия специалистов разных профилей – гастроэнтерологов, кардиологов и эндокринологов [5, 6].
Несмотря на высокую распространенность НАЖБП среди взрослого населения России, данные о ранних кардиометаболических факторах риска в условиях реальной клинической практики остаются ограниченными. Восполнение этого пробела имеет важное значение для оптимизации скрининга, ранней диагностики у пациентов с субклиническими изменениями и стратификации риска НАЖБП в российской популяции. Особый интерес представляют показатели печеночного цитолиза [аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)], холестаза [щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП)], а также параметры липидного обмена – общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеидов низкой плотности (ХС ЛПНП), холестерин липопротеидов высокой плотности (ХС ЛПВП), холестерин липопротеидов невысокой плотности (ХС неЛПВП).
По данным литературы, у лиц молодого возраста с избыточной массой тела и инсулинорезистентностью преобладает фаза гепатоцеллюлярной реактивности: повышение уровней АЛТ и АСТ может указывать на сохраненную способность гепатоцитов реагировать на метаболическую перегрузку и воспалительный стимул [10–13]. С возрастом реактивность печени снижается: уровни трансаминаз постепенно уменьшаются или остаются в пределах референсных значений даже при наличии морфологических признаков фиброза [14–16]. Одновременно наблюдается повышение уровней ГГТП [17–20], что может отражать формирование внутрипеченочного холестаза, фибротических изменений и ремоделирование билиарного тракта [21, 22]. При этом отмечаются выраженные половые различия: у мужчин, как правило, наблюдаются более высокие уровни АЛТ, АСТ и ГГТП, тогда как активность ЩФ чаще выше у женщин, особенно в старших возрастных группах [23–26].
Возраст и пол оказывают выраженное влияние на липидный профиль. У мужчин среднего возраста отмечаются более высокие уровни ХС ЛПНП и ТГ по сравнению с женщинами, что связано с меньшей активностью эстроген-зависимого клиренса липидов. С возрастом у лиц обоих полов наблюдается тенденция к умеренному росту ХС ЛПНП и ТГ при одновременном снижении ХС ЛПВП, что формирует типичный «атерогенный сдвиг» липидного спектра, ассоциированный с увеличением сердечно-сосудистого риска и метаболической перегрузкой печени [27–31].
С клинической точки зрения такие возрастные и половые различия подтверждают необходимость дифференцированной интерпретации биохимического профиля при стратификации риска у пациентов с НАЖБП, особенно на доклинических стадиях заболевания.
С учетом изложенного, цель настоящего исследования заключалась в ретроспективной оценке ключевых кардиометаболических факторов риска, включая возрастные и половые особенности показателей функции печени, параметров углеводного и липидного обмена, ассоциированных с НАЖБП, и сопоставлении полученных данных с результатами международных и российских исследований.
Материалы и методы
Дизайн исследования и популяция
Исследование носило ретроспективный наблюдательный характер. В анализ были включены данные 256 взрослых пациентов, проходивших обследование в условиях амбулаторного и стационарного звена. Все участники подписали письменное информированное согласие на участие в исследовании.
Критерии включения:
• возраст от 18 до 65 лет;
• подтверждение НАЖБП методами визуализации (ультразвуковое исследование и/или магнитно-резонансная томография);
• наличие избыточной массы тела или ожирения;
• отсутствие тяжелых сопутствующих заболеваний (сахарного диабета 2-го типа, выраженной сердечно-сосудистой патологии, почечной недостаточности и других состояний, способных повлиять на результаты исследования).
Критерии невключения:
• злоупотребление алкоголем;
• вирусные гепатиты;
• аутоиммунные заболевания печени, гемохроматоз, болезнь Вильсона, врожденные нарушения метаболизма аминокислот (например, фенилкетонурия) и поражение печени другой установленной этиологии;
• прием препаратов, потенциально влияющих на метаболизм печени или аминокислотный состав (статины, гормональные препараты, гепатотоксичные вещества);
• беременность или период лактации;
• острые инфекционные или воспалительные заболевания на момент включения.
Сбор данных
Для анализа были отобраны сведения об антропометрических параметрах и лабораторных показателях, ассоциированных с повышенным кардиометаболическим риском.
Рост и массу тела определяли с использованием стандартизированных процедур. Индекс массы тела (ИМТ) рассчитывали как отношение массы тела в килограммах к квадрату роста в метрах. Дополнительно фиксировали окружность талии.
Для оценки лабораторных показателей образцы венозной крови отбирали в вакуумные пробирки VACUETTE с активатором свертывания и гелем. В течение 1 ч после забора кровь центрифугировали при 1800 g в течение 10–15 мин. Полученную сыворотку переносили во вторичные полипропиленовые пробирки и замораживали при температуре -80°C до момента анализа.
Статистический анализ
Статистическую обработку данных проводили с использованием программного пакета STATA версии 15.1 (StataCorp LLC, College Station, TX, USA).
Непрерывные переменные с нормальным распределением были описаны как среднее (М) ± стандартное отклонение (SD), при непараметрическом распределении – как медиана (Ме) и межквартильный размах [Q1; Q3]. Категориальные переменные были представлены в виде абсолютных значений и процентов.
Для первичного выявления факторов риска, ассоциированных с наличием НАЖБП, был проведен однофакторный логистический регрессионный анализ. В анализ включали следующие предикторы:
• демографические и антропометрические показатели: пол, масса тела, ИМТ, окружность талии;
• показатели углеводного обмена: уровень глюкозы, уровень инсулина, индекс HOMA-IR, рассчитанный по формуле: уровень инсулина натощак (мкЕд/мл) × уровень глюкозы натощак (ммоль/л) / 22,5, а также индекс TyG, рассчитанный по формуле:
ln (уровень ТГ натощак (мг/дл) × уровень глюкозы натощак (мг/дл) / 2);
• показатели липидного профиля: ОХС, ХС неЛПВП, ТГ;
• показатели функции печени: АЛТ, АСТ, ЩФ, ГГТП.

Для всех переменных были рассчитаны отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) и соответствующими p-значениями. Статистическая значимость устанавливалась при p<0,05. Анализ проводился как для непрерывных переменных, так и после их категоризации на клинически значимые группы (например, уровень глюкозы ≥5,6 ммоль/л, ИМТ >25 кг/м2 и др.).
С целью контроля потенциальных факторов смешения и оценки независимых ассоциаций с НАЖБП были построены модели множественной логистической регрессии. Переменные были включены в модель на основе значимости в однофакторном анализе и клинической обоснованности. В разных моделях были проанализированы:
• ХС неЛПВП (категориальный признак ≥2,6 ммоль/л);
• индекс TyG (непрерывная переменная);
• индекс инсулинорезистентности HOMA-IR (непрерывная переменная).
Ретроспективный характер исследования не предполагал проведения предварительного расчета размера выборки. Тем не менее итоговое число включенных пациентов (n=256) обеспечивало достаточную мощность исследования (>80%) для выявления ассоциаций с ОШ >2,0 при p<0,05.
Результаты исследования


В исследование были включены 256 пациентов, из которых 186 имели признаки НАЖБП, а 70 человек без признаков заболевания составили контрольную группу.
Среди участников исследования преобладали лица женского пола (72,3% против 27,7%; p=0,0003). Пациенты с НАЖБП и без НАЖБП были сопоставимы по среднему возрасту, который составлял 45,72±13,73 и 43,03±14,39 года соответственно (p=0,1688).
Демографические, антропометрические характеристики, а также лабораторные показатели участников исследования представлены в табл. 1.
Демографические характеристики, ассоциируемые с повышением распространенности НАЖБП
Несмотря на преобладание среди участников исследования лиц женского пола, однофакторный анализ показал, что у мужчин распространенность НАЖБП была почти в 4 раза выше, чем у женщин (ОШ 3,97; 95% ДИ 1,79–8,80; p=0,0007).
Антропометрические показатели, ассоциируемые с повышением распространенности НАЖБП
Пациенты с НАЖБП имели статистически значимо более высокие значения среднего ИМТ (32,84±4,82 кг/м2 против 23,94±2,58 кг/м2; p<0,00001). Избыточная масса тела или ожирение наблюдались у 98,4% пациентов с НАЖБП по сравнению с 35,7% пациентов контрольной группы (p<0,00001). Среднее значение окружности талии также было выше при наличии НАЖБП (94,61±14,24 см против 67,66±8,78 см; p<0,00001).
Рост антропометрических показателей сопровождался увеличением распространенности НАЖБП. Однофакторный анализ продемонстрировал, что увеличение ИМТ на одну единицу сопровождалось ростом распространенности НАЖБП почти в 3 раза. Масса тела и окружность талии также демонстрировали значимые ассоциации: каждый дополнительный килограмм массы тела увеличивал распространенность НАЖБП на 28%, а каждый сантиметр окружности талии – на 30% (рис. 1).
Даже при исключении пациентов с ожирением избыточная масса тела оставалась значимым предиктором НАЖБП и ассоциировалась с 30-кратным повышением распространенности (ОШ 30,6; 95% ДИ 1,33–6,81; p<0,001; n=124). В общей когорте, включающей всех участников исследования, ИМТ >25 кг/м2 ассоциировался с многократным увеличением распространенности НАЖБП – более чем в 100 раз (ОШ 109,8; 95% ДИ 31,74–379,87; p<0,001). Эти данные указывают на значимый вклад как доклинических стадий ожирения, так и выраженного увеличения массы тела в формирование риска НАЖБП.
Показатели углеводного обмена, ассоциируемые с повышением распространенности НАЖБП
У пациентов с НАЖБП наблюдалось значимое повышение уровней глюкозы (6,73±1,17 ммоль/л против 5,05±0,50 ммоль/л; p<0,00001) и инсулина (48,90±47,89 мкЕд/мл против 12,54±8,48 мкЕд/мл; p<0,00001) по сравнению с контрольной группой.
Однофакторный анализ показал, что увеличение уровня глюкозы на 1 ммоль/л ассоциировалось с увеличением распространенности НАЖБП более чем
в 37 раз, а увеличение уровня инсулина на 1 мкЕд/мл – на 9% (рис. 2).
Гипергликемия (уровень глюкозы ≥5,6 ммоль/л) сопровождалась 49-кратным увеличением распространенности НАЖБП (ОШ 49,14; 95% ДИ 22,09–109,35; p<0,001) по сравнению с пациентами с нормальным уровнем глюкозы (<5,6 ммоль/л). Уровни глюкозы в диапазоне 5,6–6,9 ммоль/л, ассоциировались с повышением распространенности НАЖБП более чем в 30 раз (ОШ 30,29; 95% ДИ 13,49–67,98; p<0,001). Шестьдесят шесть пациентов с установленным сахарным диабетом (уровень глюкозы ≥7,0 ммоль/л) были исключены из анализа ввиду полной предсказуемости наличия НАЖБП.
Индексы инсулинорезистентности также демонстрировали сильные ассоциации с заболеванием. Средние значения индекса HOMA-IR (15,96±17,99 против 2,84±1,95; p<0,00001) и TyG (8,97±0,50 против 8,59±0,63; p<0,00001) были значительно выше у пациентов с НАЖБП. Индекс HOMA-IR оказался независимым предиктором НАЖБП: каждое его увеличение на одну единицу ассоциировалось с ростом распространенности заболевания в 1,52 раза (ОШ 1,52; 95% ДИ 1,29–1,79; p<0,001). Индекс TyG демонстрировал еще более сильную зависимость: каждое его повышение на одну единицу увеличивало распространенность НАЖБП в 3,65 раза (ОШ 3,65; 95% ДИ 2,09–6,36; p<0,001).
В попарном сравнении было показано, что у женщин старше 45 лет, по сравнению с более молодыми, статистически значимо выше уровни ТГ, ОХС и индекса TyG (p<0,01). Эти данные согласуются с результатами предыдущих работ, где продемонстрировано, что гипертриглицеридемия [32], а также повышенный индекс TyG [33] у женщин в постменопаузе ассоциированы с повышенным риском сердечно-сосудистых заболеваний. Это подчеркивает необходимость регулярного обследования и раннего выявления кардиометаболических факторов риска у данной группы пациентов.
Показатели липидного обмена, ассоциируемые с повышением распространенности НАЖБП
У пациентов с НАЖБП средняя концентрация ОХС была выше, чем в контрольной группе (5,53±1,25 ммоль/л против 5,03±1,05 ммоль/л; p=0,003). Уровни ТГ, ХС ЛПВП и ХС ЛПНП в группе НАЖБП были сопоставимы с контролем (табл. 2).
Повышение уровня ОХС на 1 ммоль/л ассоциировалось с увеличением распространенности НАЖБП на 44% (ОШ 1,44; 95% ДИ 1,12–1,85; p=0,0040), уровня ХС неЛПВП — на 32% (ОШ 1,32; 95% ДИ 1,02–1,72; p=0,036).
У пациентов с уровнем ХС неЛПВП ≥3,8 ммоль/л вероятность наличия НАЖБП увеличивалась почти вдвое (ОШ 1,99; 95% ДИ 1,06–3,73; p=0,033) по сравнению с пациентами с более низкими значениями данного показателя. Более чувствительный порог ХС неЛПВП ≥2,6 ммоль/л также продемонстрировал двукратное повышение распространенности НАЖБП (ОШ 2,15; 95% ДИ 1,03–4,49; p=0,040).
У пациентов с НАЖБП реже наблюдали уровень ТГ ≤1,6 ммоль/л по сравнению с участниками исследования без НАЖБП (58,6% против 71,4%; p=0,0172). Повышенные уровни ТГ (1,7–2,3 ммоль/л) были ассоциированы с трехкратным повышением распространенности НАЖБП (ОШ 3,01; p=0,008). При анализе отдельных возрастных подгрупп было продемонстрировано, что у пациентов старше 36 лет средний уровень ТГ превышал целевое значение в 1,7 ммоль/л, что подчеркивает возрастной компонент метаболических нарушений.
При стратификации пациентов по возрасту наблюдалась выраженная тенденция к нарастанию атерогенных липидных фракций: повышение уровней ТГ (p=0,0219), ХС неЛПВП (p=0,0079) и ХС ЛПНП (p=0,0261) у пациентов старше 50 лет. Уровень ХС ЛПВП увеличивался с возрастом (p=0,0002), однако при анализе по полу выявлено, что у женщин значения ХС ЛПВП были статистически значимо выше, что, вероятно, отражает гормонально обусловленные различия липидного обмена [27–29]. У мужчин также отмечалась тенденция к более высоким уровням ТГ, ХС ЛПНП и ХС неЛПВП, что формирует более атерогенный профиль, особенно в возрасте старше 35 лет (см. табл. 2).

Показатели функции печени, ассоциируемые с повышением распространенности НАЖБП
По результатам, отраженным в табл. 3, в группе пациентов с НАЖБП отмечались повышенные медианные значения АСТ, АЛТ, ЩФ; различия были статистически значимы. Для интерпретации уровней печеночных ферментов учитывались современные рекомендации [34], согласно которым даже значения в пределах ранее допустимого диапазона могут отражать патологические изменения функции печени.
У пациентов с НАЖБП чаще выявлялись отклонения печеночных показателей: повышенный уровень АЛТ отмечен у 70,3% пациентов против 29,7% в контрольной группе (при нормальных значениях 19–25 Ед/л для женщин и 29–33 Ед/л для мужчин [34]), хотя различия не достигли статистической значимости (p=0,4685). Повышение уровня АСТ >40 Ед/л наблюдалось у 14,5% пациентов против 4,3% соответственно (p=0,0267). Кроме того, у пациентов с НАЖБП чаще наблюдалось повышение ЩФ >120 Ед/л (21,9% против 4,4%; p=0,0009).
Полученные данные указывают, что активность печеночных ферментов может иметь прогностическое значение при НАЖБП (рис. 3). В частности, как показано в недавнем исследовании, повышенное соотношение АЛТ/АСТ ассоциировано с более высокими риском и степенью тяжести заболевания, что подтверждает целесообразность его использования в клинической практике [35]. При этом выявленные изменения могут отражать субклиническую нагрузку на печень и ранние нарушения ее детоксикационной функции, фиксируемые даже при «референсных» уровнях трансаминаз [34].
При стратификации пациентов по возрасту отмечено постепенное повышение уровней ГГТП (p=0,014), снижение уровней ЩФ (p=0,0247), а также тенденция к снижению уровней АЛТ и АСТ (см. табл. 3). Данные указывают на то, что у молодых пациентов преобладают признаки гепатоцеллюлярного цитолиза, тогда как с возрастом усиливается холестатический компонент биохимического профиля.
Гендерный анализ подтвердил более высокие значения АЛТ, АСТ, ЩФ (p<0,001) и ГГТП у мужчин по сравнению с женщинами, что согласуется с данными литературы и может свидетельствовать о большей выраженности метаболических нарушений у лиц мужского пола [23–26].
Совокупность полученных данных указывает на наличие возрастно-половых различий в биохимическом профиле пациентов с НАЖБП и подтверждает гипотезу о переходе от функциональной гиперреактивности печени у молодых к структурным изменениям с элементами фиброза в старших возрастных группах.
Обсуждение
Настоящее ретроспективное исследование подтверждает выраженную связь НАЖБП с ключевыми кардиометаболическими факторами риска в российской клинической популяции. Наиболее сильные ассоциации продемонстрировали показатели углеводного обмена (гипергликемия, инсулинорезистентность), параметры атерогенной дислипидемии (ХС неЛПВП, ТГ), антропометрические параметры (избыточная масса тела и абдоминальное ожирение), а также ферментативные показатели печени.
Уже на стадии избыточной массы тела до ожирения распространенность НАЖБП возрастала в десятки раз, а при наличии избыточной массы тела или ожирения (ИМТ ≥25 кг/м2) – более чем в сто раз. Полученные данные согласуются с результатами российских исследований, демонстрирующих, что избыточная масса тела или ожирение выявляются у 80% пациентов с НАЖБП [7]. Результаты подтверждают представление о первичности висцерального жира и липотоксичности в запуске стеатоза и воспалительной реакции печени.
В реальной практике необходима рутинная оценка окружности талии для стратификации риска даже при среднем ИМТ.
Уровень глюкозы ≥5,6 ммоль/л и повышение индексов HOMA-IR/TyG ассоциировались с НАЖБП независимо от антропометрических данных, что отражает центральную роль инсулинорезистентности. Полученные нами результаты соответствуют данным международных исследований, в которых продемонстрирована диагностическая значимость индексов HOMA-IR/TyG для оценки риска не только инсулинорезистентности, но и НАЖБП в популяции пациентов без сахарного диабета или ожирения [36, 37].
Повышение уровня ХС неЛПВП как суммарного индикатора всех атерогенных фракций оказалось тесно связано с наличием НАЖБП, что согласуется с данными о более высокой прогностической значимости ХС неЛПВП и аполипопротеина B по сравнению с изолированной оценкой ХС ЛПНП [2, 38]. В исследуемой когорте отмечено возраст-зависимое увеличение уровней ТГ, ХС неЛПВП и ХС ЛПНП, формирующее более атерогенный липидный фенотип, особенно выраженный у мужчин. В нашем исследовании наблюдалось также повышение уровней ХС ЛПВП, что нетипично для классической атерогенной дислипидемии, при которой этот показатель, как правило, снижается с возрастом. Вероятно, этот феномен связан с совокупным влиянием метаболических и гормональных факторов. В частности, у женщин уровни ХС ЛПВП традиционно выше и демонстрируют тенденцию к росту в перименопаузальном периоде, что подтверждено данными крупных популяционных исследований [27–29]. Следует отметить, что количественные показатели ХС ЛПВП не всегда отражают его функциональные свойства: при НАЖБП описан феномен «дисфункционального ХС ЛПВП», характеризующийся снижением антиоксидантной и противовоспалительной активности липопротеидов при сохранении или повышении их концентрации [39, 40]. Таким образом, выявленное повышение ХС ЛПВП, вероятно, отражает не истинный кардиопротективный эффект и требует дальнейшего анализа для уточнения его клинического и патофизиологического значения у пациентов с НАЖБП.
У пациентов с НАЖБП чаще выявлялись повышенные значения печеночных ферментов; различия средних уровней АСТ и ЩФ, а также медианных значений АЛТ были статистически значимыми. Согласно современным клиническим рекомендациям ACG (2016), даже умеренное повышение АЛТ, ранее считавшееся нормальным, может отражать патологические изменения, особенно у пациентов с избыточной массой тела [34]. Установлена линейная зависимость между уровнем АЛТ и индексом массы тела, что подтверждает роль ожирения и инсулинорезистентности в активации цитолитических процессов [41, 42]. Повышенная активность АЛТ в свою очередь ассоциируется не только с наличием НАЖБП, но и с увеличением риска сердечно-сосудистых осложнений, включая ишемическую болезнь сердца [43].
Новые данные указывают, что соотношение АЛТ/АСТ может служить более информативным показателем, позволяющим судить как о наличии, так и о степени тяжести НАЖБП [35]. В нашем исследовании выявлена четкая возрастная тенденция: у пациентов младших возрастных групп (до 35 лет) преобладает цитолитический тип ответа с повышением АЛТ и АСТ, тогда как у лиц старше 50 лет наблюдается снижение активности трансаминаз и ЩФ при одновременном росте уровней ГГТП. Такая динамика отражает постепенное истощение функциональной реактивности гепатоцитов и смещение метаболического профиля в сторону холестатическо-фибротического варианта.
Совокупность выявленных ассоциаций (инсулинорезистентность, висцеральное ожирение, атерогенная дислипидемия, «сдвиг» ферментов) отражает фенотипическую эволюцию печеночного компонента КРГМС: от гепатоцеллюлярной гиперреактивности у молодых к холестатическо-фибротическому варианту у старших пациентов [6]. По критериям клинического консенсуса Американской кардиологической ассоциации (AHA, 2023) значительная часть включенных в исследование пациентов соответствуют ранним стадиям кардио-рено-метаболического континуума (1–2-я стадии), когда уже фиксируются субклинические органные изменения при нарастающем системном риске [44]. Такой контекст подчеркивает, что НАЖБП следует рассматривать не только как локальное печеночное заболевание, но и как компонент системного риска, что диктует необходимость ранней стратификации и междисциплинарной коррекции факторов риска.
Ограничения исследования. Диспропорция по полу (женщины составляли 72,3% выборки) могла смягчать оценку половых различий; тем не менее распространенность НАЖБП у мужчин была почти в четыре раза выше, что согласуется с российскими данными многоцентрового исследования ЭССЕ-РФ-2 (распространенность по FLI ≥60: 38,5% у мужчин против 26,6% у женщин) [45].
Выводы и рекомендации
Проведенный ретроспективный анализ продемонстрировал, что НАЖБП в условиях реальной российской клинической практики тесно ассоциирована с основными компонентами кардиометаболического риска. Заболевание формирует типичный метаболический фенотип, включающий инсулинорезистентность, дислипидемию и висцеральное ожирение, что подтверждает системный характер НАЖБП как звена кардио-рено-гепато-метаболического континуума.
Наиболее значимые предикторы НАЖБП:
• инсулинорезистентность, оцениваемая по индексам HOMA-IR и TyG, – независимый фактор риска, сохраняющий прогностическую значимость даже у пациентов без установленного сахарного диабета 2-го типа;
• гипергликемия: значения глюкозы ≥5,6 ммоль/л;
• избыточная масса тела и ожирение – ведущие факторы риска, отражающие центральную роль висцерального жира и липотоксичности в патогенезе заболевания;
• дислипидемия, характеризующаяся повышением уровней ХС неЛПВП и ТГ, отражает нарастающий атерогенный потенциал метаболического профиля;
• повышение активности печеночных ферментов (АСТ, ЩФ, АЛТ, ГГТП) служит дополнительным маркером риска: даже умеренное повышение их уровней может указывать на ранние субклинические стадии НАЖБП, требующие наблюдения и коррекции.
Полученные результаты имеют практическое значение и позволяют сформулировать ряд рекомендаций:
1. Включать расчет индексов HOMA-IR и TyG в стандартное обследование пациентов с метаболическими факторами риска и/или подозрением на НАЖБП.
2. Использовать более низкий порог настороженности по уровню глюкозы (≥5,6 ммоль/л) даже при отсутствии манифестного диабета для раннего выявления пациентов с высоким риском НАЖБП.
3. Рассматривать показатели ХС неЛПВП и ТГ как важные маркеры риска НАЖБП и сердечно-сосудистых осложнений наряду с традиционными показателями липидного профиля.
4. Учитывать диагностическую значимость ферментативных показателей функции печени (АСТ, АЛТ, ЩФ, ГГТП) при оценке риска и мониторинге пациентов.
5. Разрабатывать локальные протоколы стратификации риска НАЖБП с учетом региональных особенностей и доступности методов лабораторной и инструментальной диагностики.
6. Продолжить проспективные исследования с использованием неинвазивных методов оценки стеатоза и фиброза печени (эластография, технология CAP), а также новых циркуляторных биомаркеров.
7. Усилить образовательные программы для врачей первичного звена, акцентируя внимание на НАЖБП как на системном метаболическом заболевании, требующем междисциплинарного подхода.
Результаты исследования подчеркивают необходимость ранней стратификации риска и междисциплинарного ведения пациентов с НАЖБП. Выявленные взаимосвязи с инсулинорезистентностью, атерогенной дислипидемией и ожирением подтверждают, что НАЖБП следует рассматривать не только как гепатологическую, но и как кардиометаболическую патологию, требующую интегрированного подхода к диагностике, профилактике и лечению.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Дзгоева Фатима Хаджимуратовна – канд. мед. наук, доц. каф. диабетологии и диетологии ИМ и ДПО, зав. отд. по оказанию диетологической помощи ГНЦ ФГБУ НМИЦ эндокринологии
им. акад. И.И. Дедова. E-mail: fatima.dzgoeva@ gmail.com; ORCID: 0000-0002-0327-4619; SPIN-код: 9315-0722
Fatima K. Dzgoeva – Cand. Sci. (Med.), Assoc. Prof., Endocrinology Research Centre. E-mail: fatima.dzgoeva@gmail.com; ORCID: 0000-0002-0327-4619; SPIN-code: 9315-0722
Радаева Ольга Александровна – д-р мед. наук, зав. каф. иммунологии, микробиологии и вирусологии Медицинского института ФГБОУ ВО «МГУ им. Н.П. Огарева». ORCID: 0000-0003-1383-2474
Olga A. Radaeva – Dr. Sci. (Med.), N.P. Ogarev Mordovia State University. ORCID: 0000-0003-1383-2474
Красноглазова Ксения Александровна – ассистент каф. иммунологии, микробиологии и вирусологии Медицинского института ФГБОУ ВО «МГУ им. Н.П. Огарева». ORCID: 0009-0008-7984-9053
Ksenia A. Krasnoglazova – Assistant, N.P. Ogarev Mordovia State University. ORCID: 0009-0008-7984-9053
Архипкин Александр Алексеевич – канд. биол. наук, зав. лаб., врач ООО «НЦ ЭФиС». ORCID: 0000-0001-7814-8409
Alexander A. Arkhipkin – Cand. Sci. (Biol.), Head of Laboratory, physician, EFiS Research Center LLC. ORCID: 0000- 0001-7814-8409
Мамиева Эрна Казбековна – студентка 6-го курса ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет). ORCID: 0009-0007-3479-8937
Erna K. Mamieva – 6th year Student, Pirogov Russian National Research Medical University. ORCID: 0009-0007-3479-8937
Сметанина Светлана Андреевна – д-р мед. наук, доц., зав. каф. детских болезней Института материнства и детства ФГБОУ ВО «Тюменский ГМУ». ORCID: 0000-0003-3525-9891
Svetlana A. Smetanina – Dr. Sc. (Med.), Assoc. Prof., Tyumen State Medical University. ORCID: 0000-0003-3525-9891
Вьючнова Елена Станиславовна – канд. мед. наук, доц. каф. пропедевтики внутренних болезней и гастроэнтерологии леч.
ф-та ФГБОУ ВО «Российский университет медицины»
Elena S. Vyuchnova – Cand. Sci. (Med.), Assoc. Prof., Russian University of Medicine
Поступила в редакцию: 23.10.2025
Поступила после рецензирования: 29.10.2025
Принята к публикации: 30.10.2025
Received: 23.10.2025
Revised: 29.10.2025
Accepted: 30.10.2025
Список исп. литературыСкрыть список1. Маев И.В., Андреев Д.Н., Кучерявый Ю.А. Распространенность неалкогольной жировой болезни печени в России: метаанализ. Consilium Medicum. 2023;25(5):313-9. DOI: 10.26442/20751753.2023.5.202155
Maev I.V., Andreev D.N., Kucheryavyy Yu.A. Prevalence of non-alcoholic fat disease liver in Russian Federation: meta-analysis. Consilium Medicum. 2023;25(5):313-9. DOI: 10.26442/20751753.2023.5.202155 (in Russian).
2. Teng ML, Ng CH, Huang DQ et al. Global incidence and prevalence of nonalcoholic fatty liver disease. Clin Mol Hepatol 2023;29(Suppl):S32-S42. DOI:10.3350/cmh.2022.0365
3. Неалкогольная жировая болезнь печени. Клинические рекомендации. 2024 г.
Nonalcoholic fatty liver disease. Clinical guidelines. 2024 (in Russian).
4. Tomeno W, Imajo K, Takayanagi T et al. Complications of Non-Alcoholic Fatty Liver Disease in Extrahepatic Organs. Diagnostics 2020;10(11):912. DOI: 10.3390/diagnostics10110912
5. Дзгоева Ф.Х., Радаева О.А., Архипкин А.А. и др. Роль адипонектина и ирисина в патогенезе неалкогольной жировой болезни печени у больных ожирением. РМЖ. 2025;(2):2-7. DOI: 10.32364/2225-2282-2025-2-1
Dzgoeva F.Kh., Radaeva O.A., Arkhipkin A.A. et al. The role of adiponectin and irisin in pathogenesis of non-alcoholic fatty liver disease in obese patients. RMJ 2025;(2):2-7. DOI: 10.32364/2225-2282-2025-2-1 (in Russian).
6. Шляхто Е.В., Недогода С.В., Бабенко А.Ю. и др. Концепция междисциплинарного согласительного документа по кардио-рено-гепато-метаболическому синдрому. Российский кардиологический журнал. 2025;30(1S):6533. DOI: 10.15829/1560-4071-2025-6533
Shlyakhto E..V, Nedogoda S.V., Babenko A.Yu. et al. Concept of an interdisciplinary consensus document on cardiovascular-renal-hepatic-metabolic syndrome. Russian Journal of Cardiology. 2025;30(1S): 6533. DOI: 10.15829/1560-4071-2025-6533 (in Russian).
7. Maev IV, Samsonov AA, Palgova LK et al. Real-world comorbidities and treatment patterns among patients with non-alcoholic fatty liver disease receiving phosphatidylcholine as adjunctive therapy in Russia. BMJ Open Gastroenterol 2019;6(1):e000307. DOI: 10.1136/bmjgast-2019-000307
8. Котовская Ю.В. Неалкогольная жировая болезнь печени и сердечно-сосудистые риски. Consilium Medicum. 2023;25(4):253-8. DOI: 10.26442/20751753.2023.4.202275
Kotovskaya Yu.V. Non-alcoholic fatty liver disease and cardiovascular risks: A review. Consilium Medicum 2023;25(4):253-8. DOI: 10.26442/20751753.2023.4.202275 (in Russian).
9. Мисан И.А., Аришева О.С., Гармаш И.В. и др. Распространенность и прогностическое значение неалкогольной жировой болезни печени у пациентов, госпитализированных с декомпенсацией хронической сердечной недостаточности. Кардиология. 2023;63(12): 72-6. DOI: 10.18087/cardio.2023.12.n2360
Misan I.A., Arisheva O.S., Garmash I.V. et al. Prevalence and Prognostic Value of Non-Alcoholic Fatty Liver Disease in Patients Hospitalized With Decompensated Chronic Heart Failure. Kardiologiia. 023;63(12):72-6. DOI: 10.18087/cardio.2023.12.n2360 (in Russian).
10. Homsanit M, Sanguankeo A, Upala S, Udol K. Abnormal liver enzymes in Thai patients with metabolic syndromes. J Med Assoc Thai 2012;95(3):444-51.
11. Liu C, Shao M, Lu L et al. Obesity, insulin resistance and their interaction on liver enzymes. PLOS One 2021;16(4):E0249299. DOI: 10.1371/journal.pone.0249299
12. VillasÌs-Keever MA, Zurita-Cruz JN, Nava-Sanchez KD et al. Liver enzyme levels in adolescents with obesity and insulin resistance: a propensity score matching analysis. Bol Med Hosp Infant Mex 2024;81(4). DOI: 10.24875/BMHIM.23000161
13. Ali N, Sumon AH, Fariha KA et al. Assessment of the relationship of serum liver enzymes activity with general and abdominal obesity in an urban Bangladeshi population. Sci Rep 2021;11(1):6640. DOI: 10.1038/s41598-021-86216-z
14. Dong MH, Bettencourt R, Brenner DA et al. Serum Levels of Alanine Aminotransferase Decrease With Age in Longitudinal Analysis. Clin Gastroenterol Hepatol 2012;10(3):285-90.e1. DOI: 10.1016/j.cgh.2011.10.014
15. Husain FS, Tey SL, Huynh DTT et al. Aging and liver health: liver chemistries and associated factors in community-dwelling older adults. BMC Geriatr 2025;25(1):658. DOI: 10.1186/s12877-025-06329-2
16. Petroff D, Bätz O, Jedrysiak K et al. Age Dependence of Liver Enzymes: An Analysis of Over 1,300,000 Consecutive Blood Samples. Clin Gastroenterol Hepatol 2022;20(3):641-50. DOI: 10.1016/j.cgh.2021.01.039
17. Praetorius Björk M, Johansson B. Gamma-Glutamyltransferase (GGT) as a biomarker of cognitive decline at the end of life: contrasting age and time to death trajectories. Int Psychogeriatr 2018;30(7):981-90. DOI: 10.1017/S1041610217002393
18. Cho EJ, Jeong SM, Chung GE et al. Gamma-glutamyl transferase and risk of all-cause and disease-specific mortality: a nationwide cohort study. Sci Rep 2023;13(1):1751. DOI: 10.1038/s41598-022-25970-0
19. Puukka K, Hietala J, Koivisto H et al. Age-related changes on serum GGT activity and the assessment of ethanol intake. Alcohol Alcohol 2006;41(5):522-7. DOI: 10.1093/alcalc/agl052
20. Danielsson J, Kangastupa P, Laatikainen T et al. Individual and Joint Impacts of Ethanol Use, BMI, Age and Gender on Serum Gamma-Glutamyltransferase Levels in Healthy Volunteers. Int J Mol Sci 2013;14(6):11929-41. DOI: 10.3390/ijms140611929
21. Diehl AM, Day C. Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. NEJM 2017;377(21):2063-72. DOI: 10.1056/NEJMra1503519
22. Sato K, Marzioni M, Meng F et al. Ductular Reaction in Liver Diseases: Pathological Mechanisms and Translational Significances. Hepatology. 2019;69(1):420-30. DOI: 10.1002/hep.30150
23. Jia S, Wei L, Shi X et al. Reference intervals of biochemical analytes in healthy adults from northern China: A population-based cross-sectional study. Medicine 2023;102(42):e35575. DOI: 10.1097/MD.0000000000035575
24. van Beek JHDA, de Moor MHM, de Geus EJC et al. The Genetic Architecture of Liver Enzyme Levels: GGT, ALT and AST. Behav Genet 2013;43(4):329-39. DOI: 10.1007/s10519-013-9593-y
25. Qiu J, Kuang M, He S et al. Gender perspective on the association between liver enzyme markers and non-alcoholic fatty liver disease: insights from the general population. Front Endocrinol (Lausanne) 2023;14. DOI: 10.3389/fendo.2023.1302322
26. Castells Vilella L, Sánchez-Pintos P, Muñiz Llama JF et al. Age- and Sex-Dynamic Fluctuations and Reference Intervals for Alkaline Phosphatase Among the Spanish Population. Arch Pathol Lab Med 2025;149(1):e19-e25. DOI: 10.5858/arpa.2023-0335-OA
27. Holven KB, Roeters van Lennep J. Sex differences in lipids: A life course approach. Atherosclerosis 2023;384:117270. DOI: 10.1016/j.atherosclerosis.2023.117270
28. Conlon DM, Welty FK, Reyes-Soffer G, Amengual J. Sex-Specific Differences in Lipoprotein Production and Clearance. Arterioscler Thromb Vasc Biol 2023;43(9):1617-25. DOI: 10.1161/ATVBAHA. 122.318247
29. Freedman DS, Otvos JD, Jeyarajah EJ et al. Sex and Age Differences in Lipoprotein Subclasses Measured by Nuclear Magnetic Resonance Spectroscopy: The Framingham Study. Clin Chem 2004;50(7):1189-200. DOI: 10.1373/clinchem.2004.032763
30. Zhao P, Liu S, Zhong Z, Liu J. Age- and sex-related difference of lipid profile in patients with ischemic stroke in China. Medicine 2018;97(23):e10930. DOI: 10.1097/MD.0000000000010930
31. Feng L, Nian S, Tong Z et al. Age-related trends in lipid levels: a large-scale cross-sectional study of the general Chinese population. BMJ Open 2020;10(3):e034226. DOI: 10.1136/bmjopen-2019-034226
32. Choe HJ, Park S, Han KD et al. Contribution of hypertriglyceridemia to ischemic cardiovascular disease in Korean women: A nationwide population-based study. J Clin Lipidol 2022;16(1):83-93. DOI: 10.1016/j.jacl.2021.11.008
33. Liu Q, Si F, Liu Z et al. Association between triglyceride-glucose index and risk of cardiovascular disease among postmenopausal women. Cardiovasc Diabetol 2023;22(1):21. DOI: 10.1186/s12933-023-01753-3
34. Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol 2017;112(1):18-35. DOI: 10.1038/ajg.2016.517
35. Xuan Y, Wu D, Zhang Q et al. Elevated ALT/AST ratio as a marker for NAFLD risk and severity: insights from a cross-sectional analysis in the United States. Front Endocrinol (Lausanne) 2024;15. DOI: 10.3389/fendo.2024.1457598
36. Zeng P, Cai X, Yu X et al. HOMA-IR is an effective biomarker of non-alcoholic fatty liver disease in non-diabetic population. J Int Med Res 2023;51(10). DOI: 10.1177/03000605231204462
37. Tian J, Cao Y, Zhang W et al. The potential of insulin resistance indices to predict non-alcoholic fatty liver disease in patients with type 2 diabetes. BMC Endocr Disord 2024;24(1):261. DOI: 10.1186/s12902-024-01794-z
38. Huh Y, Cho YJ, Nam GE. Recent Epidemiology and Risk Factors of Nonalcoholic Fatty Liver Disease. J Obes Metab Syndr 2022;31(1):17-27. DOI: 10.7570/jomes22021
39. Kantartzis K, Rittig K, Cegan A et al. Fatty Liver Is Independently Associated With Alterations in Circulating HDL2 and HDL3 Subfractions. Diabetes Care 2008;31(2):366-8. DOI: 10.2337/dc07-1558
40. Muzurović E, Peng CCH, Belanger MJ et al. Nonalcoholic Fatty Liver Disease and Cardiovascular Disease: a Review of Shared Cardiometabolic Risk Factors. Hypertension 2022;79(7):1319-26. DOI: 10.1161/HYPERTENSIONAHA.122.17982
41. Ruhl CE, Everhart JE. Determinants of the association of overweight with elevated serum alanine aminotransferase activity in the United States. Gastroenterology 2003;124(1):71-9. DOI: 10.1053/gast. 2003.50004
42. Ioannou GN, Boyko EJ, Lee SP. The Prevalence and Predictors of Elevated Serum Aminotransferase Activity in the United States in 1999-2002. Am J Gastroenterol 2006;101(1):76-82. DOI: 10.1111/j.1572-0241.2005.00341.x
43. Ioannou GN, Weiss NS, Boyko EJ et al. Elevated serum alanine aminotransferase activity and calculated risk of coronary heart disease in the United States. Hepatology 2006;43(5):1145-51. DOI: 10.1002/hep. 21171
44. Ndumele CE, Rangaswami J, Chow SL et al. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory From the American Heart Association. Circulation 2023;148(20):1606-35. DOI: 10.1161/CIR. 0000000000001184
45. Евстифеева С.Е., Шальнова С.А., Куценко В.А. и др. Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2). Кардиоваскулярная терапия и профилактика. 2022;21(9):3356. DOI: 10.15829/1728-8800-2022-3356
Evstifeeva S.E., Shalnova S.A., Kutsenko V.A. et al. Prevalence of non-alcoholic fatty liver disease among the working-age population: associations with socio-demographic indicators and behavioral risk factors (ESSE RF-2 data). Cardiovascular Therapy and Prevention. 2022;21(9):3356. DOI: 10.15829/1728-8800-2022-3356 (in Russian).
3 декабря 2025
Количество просмотров: 95


