Клинический разбор в общей медицине №10 2025
1 ABC Medicine, Moscow, Russia;
2 S.S. Yudin State Clinical Hospital, Moscow, Russia
murkudda@mail.ru
Abstract
Age-related hearing loss (ARHL) is a common condition among the elderly. Extracellular matrix (ECM) is an important cell-free structure of the body consisting of proteins such as collagen, proteoglycans and glycoproteins. It forms the structural framework of tissues, regulates cellular processes and maintains their function. In the cochlea, VSM regulates the morphogenesis and differentiation of auditory cells, and influences the function of hair cells and blood vessels. Aging of the body and age-related diseases such as Alzheimer's disease and hearing loss are associated with changes in the VKM, including fibrosis and impaired cellular function. Studies of the VSM in congenital hearing loss may help to understand its mechanisms and develop new treatments.
The aim of the study was to summarize the current literature data and to evaluate the mechanisms that occur in the ear in age-related hearing loss, as well as to identify gaps in knowledge that require further research.
Materials and methods. The authors searched for publications in the electronic databases PubMed, Google Scholar, and eLibrary. The search was conducted using the following keywords in Russian and English: “age-related hearing loss”, “ear anatomy”, “cochlea”, “hair cells of the ear”, “hearing loss diagnosis”, “causes of hearing loss”, “tectorial membrane”.
Results. Changes in the structure and composition of the VSM during cochlear aging may create prerequisites for the development of various pathologies, including CHD. However, the role of VCM-associated molecules in the development of CHD remains poorly understood. This indicates the need for further research in this area.
Conclusion. The VSM is a critical component of the cochlea of the inner ear. At the macroscopic level, the VSM not only ensures the structural integrity of the cochlea, but also plays a key role in the perception and transmission of sound signals and in maintaining ionic balance in the perilymph and endolymph. During cochlear aging, changes in the structure and composition of the VSM occur, which may set the stage for the development of CHD.
Keywords: extracellular matrix, cochlea, matrix metalloproteinases, age-related hearing loss, tectorial membrane, basal membrane, spiral ligament.
For citation: Dzhimgirov M.A., Dzhimgirova A.F. The role of cochlea extracellular matrix in age related hearing loss. Clinical review for general practice. 2025; 6 (10): 113–117 (In Russ.). DOI: 10.47407/kr2025.6.10.00700
Введение
Внеклеточный матрикс (ВКМ) – это трехмерная бесклеточная структура, присутствующая в тканях организма, преимущественно состоящая из белков. Основные компоненты ВКМ включают коллаген, протеогликаны и гликопротеины [1, 2]. В организме человека на долю ВКМ приходится примерно треть общей массы тела. Этот компонент выполняет ключевые функции в поддержании физиологической структуры и функционирования тканей. ВКМ не только создает каркас, но и активно регулирует клеточные процессы, такие как дифференцировка, пролиферация и миграция клеток.
Улитка как слуховой рецептор представляет собой тонко структурированный орган со специфичными топологией и механико-электрическими свойствами. Внутри улитки ВКМ включает текториальную и базилярную мембраны, спиральный лимб и спиральную связку, которые регулируют ее морфогенез и дифференцировку слуховых клеток [3, 4]. Вибрация текториальной и базилярной мембран обеспечивает механико-электрическое преобразование звуковых сигналов. Спиральная связка и сосудистый ствол поддерживают гомеостаз эндокохлеарного потенциала в улитке. Изменения во внеклеточном матриксе могут влиять на выживание и функционирование волосковых и поддерживающих клеток.
Старение представляет собой многокомпонентный биологический процесс, включающий многочисленные молекулярные и клеточные изменения. В результате исследований были идентифицированы двенадцать ключевых признаков старения, включающих геномную нестабильность, укорочение теломер, эпигенетические модификации, потерю протеостаза, нарушения в макроаутофагии, дерегуляцию метаболизма питательных веществ, митохондриальную дисфункцию, клеточное старение, истощение стволовых клеток, изменения в межклеточной коммуникации, хроническое воспаление и дисбиоз [5, 6]. ВКМ играет ключевую роль в этих процессах. Стареющий ВКМ способен передавать клеткам сигналы старения, а стареющие клетки в свою очередь могут влиять на состав и структуру ВКМ через секретируемые ими факторы [6]. Воспалительные цитокины, продуцируемые стареющими клетками, могут способствовать развитию возрастного фиброза [7]. Изменения в структуре и компонентах ВКМ оказывают влияние на функции стареющих клеток и играют важную роль в патогенезе таких нейродегенеративных заболеваний, как болезнь Альцгеймера и возрастная макулярная дегенерация [8].
Возрастная тугоухость, или пресбиакузис, является одним из наиболее распространенных слуховых нарушений у пожилых людей во всем мире. Она характеризуется прогрессирующей и необратимой потерей слуха, преимущественно в высокочастотном диапазоне, значительно снижая качество жизни пожилых людей [9, 10]. В условиях старения населения разработка методов профилактики и замедления прогрессирования пресбиакузиса, а также эффективных способов улучшения слуха у пациентов с этим заболеванием приобретает особую актуальность. Несмотря на значительный прогресс в изучении патогенеза данного состояния, механизмы его развития остаются недостаточно исследованными. Предполагается, что дегенеративные изменения внутренних и наружных волосковых клеток улитки, сосудов внутреннего уха и слухового нерва могут играть ключевую роль в развитии возрастной тугоухости [11]. Изменения в ВКМ улитки играют ключевую роль в патогенезе различных заболеваний, включая старение, повреждение слуховой системы, ототоксическую глухоту и фиброз, связанный с кохлеарными имплантатами. Число исследований, направленных на изучение влияния дегенерации ВКМ на развитие врожденной прогрессирующей тугоухости (ВПС), ограниченно.
Цель исследования – обобщить современные данные литературы и оценить роль механизмов, протекающих в ухе при ВПС, а также выявить пробелы в знаниях, требующие проведения дальнейших исследований.
Материалы и методы
Авторы провели поиск публикаций в электронных базах данных PubMed, Google Scholar и eLibrary. Поиск проводился по следующим ключевым словам на русском и английском языках: «возрастная потеря слуха», «анатомия уха», «улитка», «волосковые клетки уха», «hearing loss diagnosis», «causes of hearing loss», «tectorial membrane». Временной интервал поиска – с 2008 по 2025 г. В исследование включали статьи, опубликованные преимущественно за последние 5 лет, однако в случае высокой научной значимости включали и более ранние работы. При необходимости авторы проводили дополнительный поиск иной релевантной литературы, касающейся клинико-прогностического значения ВПС.
Авторы независимо друг от друга провели анализ заголовков и аннотаций статей, после чего извлекался полный текст релевантных исследований. В процессе подготовки обзора был использован следующий алгоритм для отбора источников: до начала скрининга исключались дубликаты; в процессе скрининга авторы анализировали названия и аннотации отобранных статей, проверяя их соответствие теме обзора и наличие полного текста, на данном этапе исключали тезисы, статьи и работы, не имеющие полного текста; полнотекстовые рукописи прошли оценку на соответствие критериям включения.
Критерии включения: оригинальные исследования, опубликованные в рецензируемых научных журналах полнотекстовые обзоры литературы, метаанализы, систематические обзоры, рандомизированные контролируемые или экспериментальные исследования in vitro, in vivo, а также описания клинических случаев на русском или английском языке, содержащие вышеуказанные ключевые слова.
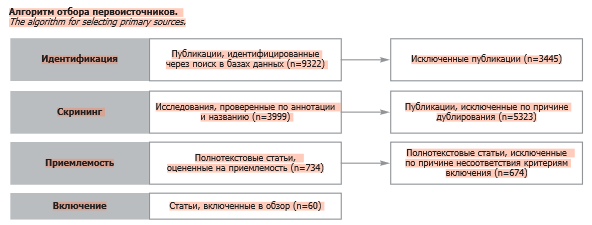
В конечном итоге в настоящий обзор было включено 60 источников. Алгоритм отбора продемонстрирован на рисунке.
Результаты и обсуждение
ВКМ улитки и внеклеточные протеазы
ВКМ улитки состоит из разнообразных белковых компонентов, называемых матрисомами [12, 13]. К ним относятся коллаген, гликопротеины, протеогликаны и другие белки. Эти компоненты играют ключевую роль в формировании и поддержании структуры ВКМ [14, 15]. Коллаген является основным структурным белком ВКМ, обеспечивающим его прочность и устойчивость к растяжению. Гликопротеины формируют базовую структуру матрикса и выполняют функцию лигандов для клеточных рецепторов, таких как интегрины, способствуя взаимодействию клеток с ВКМ. Протеогликаны состоят из белка, к которому присоединены гликозаминогликаны, придающие матриксу отрицательный заряд [16, 17]. Гликозаминогликаны, особенно гепарансульфат, регулируют гомеостаз ВКМ, взаимодействуя с различными факторами и способствуя их проникновению в матрикс. Кроме того, гликозаминогликаны и гликопротеины играют важную роль в связывании и транспорте факторов роста, цитокинов и других биологически активных молекул, обеспечивая ремоделирование и поддержание структуры ВКМ. Белки, участвующие в сшивании и ремоделировании ВКМ, включают факторы роста, цитокины и муцины [18].
Текториальная мембрана
Текториальная мембрана (ТМ), расположенная над кортиевым органом, имеет спиральную форму, аналогичную структуре самого органа. С возрастом в ТМ происходят морфологические и биохимические изменения. В образцах височных костей лиц престарелого возраста с ВПС наблюдаются истончение ТМ, ее отделение от спирального лимба и прикрепление апикальной части к мембране Рейсснера, а также деформация базальных участков ТМ [19]. С помощью трансмиссионной электронной микроскопии было исследовано старение улитки у мышей разного возраста. Установлено, что дегенеративные изменения в ТМ начинаются в апикальном отделе улитки и постепенно распространяются на средний и базальный отделы [20, 21]. У мышей в возрасте 12–18 мес наблюдаются признаки набухания и истончения ТМ, однако внутренние и наружные волосковые клетки кортиева органа, а также нейроны спирального ганглия остаются интактными [22]. Это указывает на то, что дегенеративные изменения в ТМ предшествуют потере сенсорных клеток и нейронов. На этом этапе у мышей отмечается легкая потеря слуха. К 24–30 мес аналогичные изменения происходят и в базальной части ТМ, что сопровождается усилением потери слуха. Кроме того, ТМ отделяется от спирального лимба и контактирует с мембраной Рейсснера. Матриксные компоненты подвергаются значительной деградации, что особенно выражено в ядре сухожилия и коллагеновых волокнах [23]. В матриксе сухожилия у 12-месячных мышей линии CBA/Ca выявлены обширные лакуны, что указывает на потерю матричного материала [23].
К 24–30 мес ядро сухожилия практически полностью исчезло, сохранив лишь плотные фибриллярные комплексы на поверхности и на дистальном конце.
Старение и дегенерация ТМ коррелируют с изменениями в экспрессии таких белков, как α-текторин, β-текторин и CEACAM16. Иммунофлюоресцентное окрашивание позволяет выявить снижение уровня экспрессии α-текторина и β-текторина в апикальной части ТМ у мышей линии CBA/Ca в возрасте 18–19 мес по сравнению с 6-месячными особями [17]. В базальной части ТМ уровень экспрессии этих белков оставался неизменным. С 24 мес наблюдается дальнейшее снижение экспрессии α-текторина и β-текторина как в апикальной, так и в базальной части ТМ. Параллельно с этим экспрессия CEACAM16 увеличивается с возрастом и уменьшается в направлении от апикальной к базальной части улитки. У мышей линии C57BL/6J с нокаутированным геном Ceacam16 (Ceacam16KO/KO) наблюдается ускоренное старение ТМ внутреннего уха. Уже к 6 мес у них отмечаются изменения в матриксе апикального поворота ТМ, которые к 12 мес распространяются на базальный поворот, а к 26 мес затрагивают все отделы. У мышей дикого типа (Ceacam16+/+) аналогичные изменения начинаются только с 6 мес [24]. Отмечается, что жесткость ТМ у мышей Ceacam16KO/KO снижена по сравнению с 3–4-месячными мышами из контрольной группы. Порог акустического рефлекса ствола мозга на частотах 4–12 кГц у них увеличивается уже к 12 мес, что сопровождается снижением порога отоакустической эмиссии на частоте продукта искажения [25]. Эти результаты свидетельствуют о фенотипе преждевременного старения у мышей Ceacam16KO/KO, что может указывать на роль Ceacam16 в патогенезе аутосомно-рецессивной ВПС [26]. Однако наиболее выраженные изменения у них наблюдаются в апикальном отделе ТМ, в то время как у мышей дикого типа тугоухость развивается в базальном отделе, что требует дальнейшего изучения механизмов старения ТМ [27]. Окрашивание гистологических срезов улитки толуидиновым синим у 12-месячных мышей-самцов линий C57BL/6J, S129SvEv и CBA/Ca выявило значительное повреждение матрикса тимпанальной мембраны у мышей линии C57BL/6J по сравнению с мышамиS129SvEv и CBA/Ca, у которых повреждения были минимальными. Наблюдается выраженная потеря матрикса апикальной части ТМ при минимальном повреждении базальной части. У мышей линии C57BL/6J в возрасте
26 мес были выявлены практически полная утрата экспрессии α-текторина, снижение экспрессии β-текторина и CEACAM16 в тимпанальной мембране. Аналогичные изменения были обнаружены у 30-месячных мышей линии CBA/Ca. Однако нельзя однозначно утверждать, что α-текторин наиболее чувствителен к возрастным изменениям [28, 29]. Остается неясным, какие клеточные элементы продуцируют и поддерживают уровень α-текторина, также неизвестны точные механизмы, приводящие к его снижению. С возрастом происходят значительные трансформации в морфологии, структурных характеристиках, химическом составе и функциональных свойствах тканей внутреннего уха, приводящих к развитию сенсоневральной тугоухости [30, 31]. Механизмы, обусловливающие прогрессирующую потерю слуха, требуют дальнейшего изучения.
Базилярная мембрана
Базилярная мембрана (БМ) – это слой ВКМ, расположенный между сенсорными эпителиальными клетками, состоящий из внутренних и наружных волосковых клеток, опорных клеток и мезотелиальных клеток, граничащих с барабанной перепонкой [32]. В гистологических срезах височной кости пациентов с ВПС наблюдаются утолщение и кальцификация БМ [33, 34]. На животных моделях 30-месячных крыс дикого типа выявлено значительное увеличение толщины БМ, которое отсутствовало у 2-месячных крыс данного типа. При этом не обнаружено существенных различий в толщине апикальной и средней БМ. Около 25% мРНК, экспрессирующихся во внутреннем ухе мыши, участвуют в процессах пролиферации, дифференцировки, морфогенеза и функционального созревания сенсорных эпителиальных клеток. J. Zhang и соавт. для исследования молекулярных изменений в улитке мышей разного возраста использовали микрочип GeneChip, предназначенный для анализа экспрессии мРНК [35]. Анализ проводился на материале улиток 21-дневных, 3-месячных и 9-месячных мышей линии C57BL/6J, а также 21-дневных, 9-месячных и 16-месячных мышей линии CBA/Ca. В результате исследования было выявлено, что экспрессия мРНК семейства miR-29 увеличивается с возрастом как у представителей линии C57BL/6J, так и у мышей CBA/Ca. мРНК miR-29 способна ингибировать экспрессию генов, кодирующих такие компоненты ВКМ, как коллаген, эластин и фибронектины [36, 37]. Экспрессия miR-29a была обнаружена не только в клетках кортиева органа, сосудистом русле и спиральном ганглии, но и в структурах ВКМ, включая спиральный край и БМ, что было подтверждено в исследованиях на мышах miR-29aKO/KO и C57BL/6J [38]. У первых (miR-29aKO/KO) в возрасте 2–5 мес наблюдалось прогрессирующее снижение слуха, что проявлялось в увеличении порогов слухового восприятия на частотах 8, 16 и 32 кГц при регистрации вызванных акустических рефлексов [39, 40]. Гистологическое исследование 4-месячных мышей линии miR-29aKO/KO позволило выявить значительную потерю наружных волосковых клеток в базальной и апикальной частях улитки, а также внутренних волосковых клеток в ее базальной части. Также наблюдались истончение сосудистого стриатума и уменьшение числа нейронов в базальной части спирального ганглия. Электронно-микроскопическое исследование выявило слияние оставшихся стереоцилий волосковых клеток у мышей miR-29aKO/KO [41, 42]. Было определено, что экспериментальное выведение из строя miR-29a у мышей приводит к усилению экспрессии генов, связанных с базальной мембраной улитки, включая COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, LAMB2 и LAMC1. Иммунофлюоресцентный анализ замороженных срезов улитки 4-месячных мышей с нокаутированной miR-29a показал значительное увеличение экспрессии COL4A1 и LAMB2 в БМ [43, 44]. Трансмиссионная электронная микроскопия выявила утолщение базальной пластинки в базальном отделе, а также увеличение коллагеновых волокон в БМ под клетками внутренней колонны и клетками Дейтера, что также подчеркивает важную роль miR-29a в поддержании структурной целостности БМ. Утолщение БМ в базальном повороте у мышей с нокаутированной miR-29a сходно с изменениями, наблюдаемыми в БМ стареющих крыс. Это позволяет предположить наличие связи между прогрессирующим старением улитки у мышей и утолщением БМ в базальном отделе [46]. Таким образом, утолщение БМ может быть одним из механизмов развития ВПС.
Спиральная связка
Спиральная связка является важной структурой латеральной стенки среднего канала улитки. Она расположена между сосудистой полоской и БМ [47]. Сосудистая полоска, находящаяся латеральнее спиральной связки, огибает внешнюю костную стенку улитки, проходя над мембраной Рейсснера в верхней части спирального канала, и нижним концом прикрепляется к БМ. Одним из патологических механизмов, лежащих в основе ВПС, является дегенерация сосудистой полоски и спирального органа на латеральной стенке улитки, что приводит к развитию метаболической тугоухости [48, 49]. Дегенеративные изменения в сосудистой полоске, проявляющиеся в потере фиброцитов, происходят раньше, чем в сосудистом стриатуме и волосковых клетках.
В ходе исследования был проанализирован 151 образец височной кости, включая 15 образцов от пожилых пациентов с потерей слуха. В этих образцах наблюдалась значительная дегенерация сосудистого сплетения, сопровождающаяся атрофией или исчезновением фиброцитов. Эти данные указывают на то, что дегенерация сосудистого сплетения может быть одним из ключевых механизмов развития ВПС [50, 51]. Для оценки возрастных изменений в морфологии сосудистого сплетения образцы височной кости были разделены на три возрастные группы: 15–38 лет (8 образцов), 51–59 лет (8 образцов) и 64–84 года (9 образцов). В результате исследования было установлено, что объем сосудистого сплетения у представителей группы 64–84 лет значительно меньше по сравнению с группой 15–38 лет. Это свидетельствует о значительных морфологических изменениях и уменьшении объема сосудистого сплетения при старении организма.
Роль молекул ВКМ, потенциально ассоциируемых с развитием ВПС
Матриксные металлопротеиназы (ММП) и тканевые ингибиторы металлопротеиназ являются ключевыми молекулами, регулирующими ВКМ, которые участвуют в процессах ремоделирования и поддержания гомеостаза ВКМ. ММП играют важную роль в клеточных процессах, включая жизненный цикл клеток, их старение, апоптоз и другие регуляторные функции [52]. Семейства ММП опосредуют процессы регуляции клеточного старения через секреторный фенотип [53, 54].
В исследовании, проведенном на базе данных Биобанка клиники Мэйо, было изучено 28 белков у 1923 лиц старше 65 лет с одним хроническим заболеванием. Целью было выявление связи между плазменными уровнями этих белков и риском смерти. При использовании логистической регрессии и последующего анализа LASSO 36 белков было обнаружено, что концентрация ММП-12 отрицательно коррелирует с продолжительностью жизни, что указывает на наличие потенциальной связи между повышенным содержанием MMП-12 в плазме и продолжительности жизни [55, 56]. Семейства ММП также активно исследуются в контексте дегенеративных заболеваний сетчатки, где они играют важную роль в поддержании жизнеспособности клеток сетчатки и нейронов. ММП и тканевые ингибиторы металлопротеиназ активно экспрессируются в различных тканях внутреннего уха, таких как сосудистый стриатум, слуховой сенсорный эпителий и спиральный ганглий. Данные ферменты играют ключевую роль в патогенезе шумоиндуцированной и аминогликозид-индуцированной потери слуха, а также в развитии наследственной тугоухости, включая синдром Альпорта и гипергомоцистеинемию [57, 58]. Тем не менее их роль в формировании врожденных пороков развития уха остается недостаточно изученной.
Роль MMП в нарушениях слуха
Исследования, посвященные отношению роли семейства MMП к нарушениям слуха, включают анализ геномных ассоциаций, направленных на выявление генетических факторов, связанных с потерей слуха [59]. Установлено наличие положительной корреляции между MMП-2 и ВПС. Анализ экспрессии MMП-9 в слуховой коре и гиппокампе мышей линии C57BL/6J показал увеличение уровня экспрессии у 15-месячных животных по сравнению с 3-месячными. Изучение спинномозговой жидкости 65 пациентов с болезнью Альцгеймера и 44 пациентов с болезнью Альцгеймера и сопутствующей потерей слуха выявило разницу в среднем уровне MMП-3 в спинномозговой жидкости. Так, у лиц первой группы концентрация ММП-3 составила 0,52 нг/мл, тогда как у второй – 0,37 нг/мл. Уровень MMП-3 в спинномозговой жидкости пациентов с ВПС оказался значимо выше (p=0,004) и коррелировал с порогом чистого тона [60]. Несмотря на ключевую роль молекул ВКМ в нейродегенеративных процессах, число исследований, посвященных изменениям ВКМ при ВПС, остается ограниченным. Недостаточно изучены взаимосвязи между ВКМ и механизмами развития нарушений слуха.
Заключение
ВКМ является критически важным компонентом улитки. На макроскопическом уровне ВКМ не только обеспечивает структурную целостность улитки, но и играет ключевую роль в восприятии и передаче звуковых сигналов, а также в поддержании ионного баланса в перилимфе и эндолимфе. На микроскопическом уровне компоненты ВКМ участвуют в развитии и жизненном цикле слуховых сенсорных клеток. В последние годы активно исследуется роль ВКМ в дифференцировке этих клеток. Патогенез ВПС представляет собой сложный процесс. В ходе старения улитки происходят изменения в структуре и составе ВКМ, что может создавать предпосылки для развития ВПС. Молекулы, ассоциированные с ВКМ, такие как MMП и тканевые ингибиторы металлопротеиназ, также вовлечены в патогенез различных форм сенсоневральной тугоухости, однако их роль в развитии ВПС остается недостаточно изученной.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Джимгиров Мерген Аюкаевич – врач-оториноларинголог, ABC медицина. E-mail: murkudda@mail.ru; ORCID: 0009-0006-6468-4837
Mergen A. Dzhimgirov – otorhinolaryngologist, ABC Medicine.
E-mail: murkudda@mail.ru; ORCID: 0009-0006-6468-4837
Джимгирова Алина Федоровна – врач ультразвуковой диагностики ГБУЗ «Городская клиническая больница им. С.С. Юдина». E-mail: www.akp94@mail.ru; ORCID: 0009-0006-2647-4644
Alina F. Dzhimgirova – ultrasound doctor, S.S. Yudin State Clinical Hospital. E-mail: www.akp94@mail.ru; ORCID: 0009-0006-2647-4644
Поступила в редакцию: 27.03.2025
Поступила после рецензирования: 23.04.2025
Принята к публикации: 15.05.2025
Received: 27.03.2025
Revised: 23.04.2025
Accepted: 15.05.2025
Клинический разбор в общей медицине №10 2025
Значение экстрацеллюлярного матрикса улитки в процессе развития возрастной тугоухости
Номера страниц в выпуске:113-117
Аннотация
Возрастная потеря слуха (ВПС) – распространенное заболевание среди людей преклонного возраста. Внеклеточный матрикс (ВКМ) – важная бесклеточная структура организма, состоящая из белков, таких как коллаген, протеогликаны и гликопротеины. Он формирует структурный каркас тканей, регулирует клеточные процессы и поддерживает их функции. В улитке ВКМ регулирует морфогенез и дифференцировку слуховых клеток, а также влияет на работу волосковых клеток и сосудов. Старение организма и возрастные заболевания, такие как болезнь Альцгеймера и тугоухость, связаны с изменениями в ВКМ, включая фиброз и нарушение клеточных функций. Исследования ВКМ при врожденной тугоухости могут помочь понять ее механизмы и разработать новые методы лечения.
Цель. Обобщить современные данные литературы и оценить роль механизмов, протекающих в ухе при ВПС, а также выявить пробелы в знаниях, требующие проведения дальнейших исследований.
Материалы и методы. Авторы провели поиск публикаций в электронных базах данных PubMed, Google Scholar и eLibrary. Поиск проводился по следующим ключевым словам на русском и английском языках: «возрастная потеря слуха», «анатомия уха», «улитка», «волосковые клетки уха», «hearing loss diagnosis», «causes of hearing loss», «tectorial membrane».
Результаты. Изменения в структуре и составе ВКМ в ходе старения улитки могут создавать предпосылки для развития различных патологий, включая ВПС. Однако роль молекул, ассоциированных с ВКМ, в развитии ВПС остается недостаточно изученной. Это указывает на необходимость дальнейших исследований в данной области.
Заключение. ВКМ является критически важным компонентом улитки внутреннего уха. На макроскопическом уровне ВКМ не только обеспечивает структурную целостность улитки, но и играет ключевую роль в восприятии и передаче звуковых сигналов, а также в поддержании ионного баланса в перилимфе и эндолимфе. В ходе старения улитки происходят изменения в структуре и составе ВКМ, что может создавать предпосылки для развития ВПС.
Ключевые слова: внеклеточный матрикс, улитка, матриксные металлопротеиназы, возрастная потеря слуха, текториальная мембрана, базальная мембрана, спиральная связка.
Для цитирования: Джимгиров М.А., Джимгирова А.Ф. Значение экстрацеллюлярного матрикса улитки в процессе развития возрастной тугоухости. Клинический разбор в общей медицине. 2025; 6 (10): 113–117. DOI: 10.47407/kr2025.6.10.00700
Возрастная потеря слуха (ВПС) – распространенное заболевание среди людей преклонного возраста. Внеклеточный матрикс (ВКМ) – важная бесклеточная структура организма, состоящая из белков, таких как коллаген, протеогликаны и гликопротеины. Он формирует структурный каркас тканей, регулирует клеточные процессы и поддерживает их функции. В улитке ВКМ регулирует морфогенез и дифференцировку слуховых клеток, а также влияет на работу волосковых клеток и сосудов. Старение организма и возрастные заболевания, такие как болезнь Альцгеймера и тугоухость, связаны с изменениями в ВКМ, включая фиброз и нарушение клеточных функций. Исследования ВКМ при врожденной тугоухости могут помочь понять ее механизмы и разработать новые методы лечения.
Цель. Обобщить современные данные литературы и оценить роль механизмов, протекающих в ухе при ВПС, а также выявить пробелы в знаниях, требующие проведения дальнейших исследований.
Материалы и методы. Авторы провели поиск публикаций в электронных базах данных PubMed, Google Scholar и eLibrary. Поиск проводился по следующим ключевым словам на русском и английском языках: «возрастная потеря слуха», «анатомия уха», «улитка», «волосковые клетки уха», «hearing loss diagnosis», «causes of hearing loss», «tectorial membrane».
Результаты. Изменения в структуре и составе ВКМ в ходе старения улитки могут создавать предпосылки для развития различных патологий, включая ВПС. Однако роль молекул, ассоциированных с ВКМ, в развитии ВПС остается недостаточно изученной. Это указывает на необходимость дальнейших исследований в данной области.
Заключение. ВКМ является критически важным компонентом улитки внутреннего уха. На макроскопическом уровне ВКМ не только обеспечивает структурную целостность улитки, но и играет ключевую роль в восприятии и передаче звуковых сигналов, а также в поддержании ионного баланса в перилимфе и эндолимфе. В ходе старения улитки происходят изменения в структуре и составе ВКМ, что может создавать предпосылки для развития ВПС.
Ключевые слова: внеклеточный матрикс, улитка, матриксные металлопротеиназы, возрастная потеря слуха, текториальная мембрана, базальная мембрана, спиральная связка.
Для цитирования: Джимгиров М.А., Джимгирова А.Ф. Значение экстрацеллюлярного матрикса улитки в процессе развития возрастной тугоухости. Клинический разбор в общей медицине. 2025; 6 (10): 113–117. DOI: 10.47407/kr2025.6.10.00700
The role of cochlea extracellular matrix in age related hearing loss
Mergen A. Dzhimgirov1, Alina F. Dzhimgirova21 ABC Medicine, Moscow, Russia;
2 S.S. Yudin State Clinical Hospital, Moscow, Russia
murkudda@mail.ru
Abstract
Age-related hearing loss (ARHL) is a common condition among the elderly. Extracellular matrix (ECM) is an important cell-free structure of the body consisting of proteins such as collagen, proteoglycans and glycoproteins. It forms the structural framework of tissues, regulates cellular processes and maintains their function. In the cochlea, VSM regulates the morphogenesis and differentiation of auditory cells, and influences the function of hair cells and blood vessels. Aging of the body and age-related diseases such as Alzheimer's disease and hearing loss are associated with changes in the VKM, including fibrosis and impaired cellular function. Studies of the VSM in congenital hearing loss may help to understand its mechanisms and develop new treatments.
The aim of the study was to summarize the current literature data and to evaluate the mechanisms that occur in the ear in age-related hearing loss, as well as to identify gaps in knowledge that require further research.
Materials and methods. The authors searched for publications in the electronic databases PubMed, Google Scholar, and eLibrary. The search was conducted using the following keywords in Russian and English: “age-related hearing loss”, “ear anatomy”, “cochlea”, “hair cells of the ear”, “hearing loss diagnosis”, “causes of hearing loss”, “tectorial membrane”.
Results. Changes in the structure and composition of the VSM during cochlear aging may create prerequisites for the development of various pathologies, including CHD. However, the role of VCM-associated molecules in the development of CHD remains poorly understood. This indicates the need for further research in this area.
Conclusion. The VSM is a critical component of the cochlea of the inner ear. At the macroscopic level, the VSM not only ensures the structural integrity of the cochlea, but also plays a key role in the perception and transmission of sound signals and in maintaining ionic balance in the perilymph and endolymph. During cochlear aging, changes in the structure and composition of the VSM occur, which may set the stage for the development of CHD.
Keywords: extracellular matrix, cochlea, matrix metalloproteinases, age-related hearing loss, tectorial membrane, basal membrane, spiral ligament.
For citation: Dzhimgirov M.A., Dzhimgirova A.F. The role of cochlea extracellular matrix in age related hearing loss. Clinical review for general practice. 2025; 6 (10): 113–117 (In Russ.). DOI: 10.47407/kr2025.6.10.00700
Введение
Внеклеточный матрикс (ВКМ) – это трехмерная бесклеточная структура, присутствующая в тканях организма, преимущественно состоящая из белков. Основные компоненты ВКМ включают коллаген, протеогликаны и гликопротеины [1, 2]. В организме человека на долю ВКМ приходится примерно треть общей массы тела. Этот компонент выполняет ключевые функции в поддержании физиологической структуры и функционирования тканей. ВКМ не только создает каркас, но и активно регулирует клеточные процессы, такие как дифференцировка, пролиферация и миграция клеток.
Улитка как слуховой рецептор представляет собой тонко структурированный орган со специфичными топологией и механико-электрическими свойствами. Внутри улитки ВКМ включает текториальную и базилярную мембраны, спиральный лимб и спиральную связку, которые регулируют ее морфогенез и дифференцировку слуховых клеток [3, 4]. Вибрация текториальной и базилярной мембран обеспечивает механико-электрическое преобразование звуковых сигналов. Спиральная связка и сосудистый ствол поддерживают гомеостаз эндокохлеарного потенциала в улитке. Изменения во внеклеточном матриксе могут влиять на выживание и функционирование волосковых и поддерживающих клеток.
Старение представляет собой многокомпонентный биологический процесс, включающий многочисленные молекулярные и клеточные изменения. В результате исследований были идентифицированы двенадцать ключевых признаков старения, включающих геномную нестабильность, укорочение теломер, эпигенетические модификации, потерю протеостаза, нарушения в макроаутофагии, дерегуляцию метаболизма питательных веществ, митохондриальную дисфункцию, клеточное старение, истощение стволовых клеток, изменения в межклеточной коммуникации, хроническое воспаление и дисбиоз [5, 6]. ВКМ играет ключевую роль в этих процессах. Стареющий ВКМ способен передавать клеткам сигналы старения, а стареющие клетки в свою очередь могут влиять на состав и структуру ВКМ через секретируемые ими факторы [6]. Воспалительные цитокины, продуцируемые стареющими клетками, могут способствовать развитию возрастного фиброза [7]. Изменения в структуре и компонентах ВКМ оказывают влияние на функции стареющих клеток и играют важную роль в патогенезе таких нейродегенеративных заболеваний, как болезнь Альцгеймера и возрастная макулярная дегенерация [8].
Возрастная тугоухость, или пресбиакузис, является одним из наиболее распространенных слуховых нарушений у пожилых людей во всем мире. Она характеризуется прогрессирующей и необратимой потерей слуха, преимущественно в высокочастотном диапазоне, значительно снижая качество жизни пожилых людей [9, 10]. В условиях старения населения разработка методов профилактики и замедления прогрессирования пресбиакузиса, а также эффективных способов улучшения слуха у пациентов с этим заболеванием приобретает особую актуальность. Несмотря на значительный прогресс в изучении патогенеза данного состояния, механизмы его развития остаются недостаточно исследованными. Предполагается, что дегенеративные изменения внутренних и наружных волосковых клеток улитки, сосудов внутреннего уха и слухового нерва могут играть ключевую роль в развитии возрастной тугоухости [11]. Изменения в ВКМ улитки играют ключевую роль в патогенезе различных заболеваний, включая старение, повреждение слуховой системы, ототоксическую глухоту и фиброз, связанный с кохлеарными имплантатами. Число исследований, направленных на изучение влияния дегенерации ВКМ на развитие врожденной прогрессирующей тугоухости (ВПС), ограниченно.
Цель исследования – обобщить современные данные литературы и оценить роль механизмов, протекающих в ухе при ВПС, а также выявить пробелы в знаниях, требующие проведения дальнейших исследований.
Материалы и методы
Авторы провели поиск публикаций в электронных базах данных PubMed, Google Scholar и eLibrary. Поиск проводился по следующим ключевым словам на русском и английском языках: «возрастная потеря слуха», «анатомия уха», «улитка», «волосковые клетки уха», «hearing loss diagnosis», «causes of hearing loss», «tectorial membrane». Временной интервал поиска – с 2008 по 2025 г. В исследование включали статьи, опубликованные преимущественно за последние 5 лет, однако в случае высокой научной значимости включали и более ранние работы. При необходимости авторы проводили дополнительный поиск иной релевантной литературы, касающейся клинико-прогностического значения ВПС.
Авторы независимо друг от друга провели анализ заголовков и аннотаций статей, после чего извлекался полный текст релевантных исследований. В процессе подготовки обзора был использован следующий алгоритм для отбора источников: до начала скрининга исключались дубликаты; в процессе скрининга авторы анализировали названия и аннотации отобранных статей, проверяя их соответствие теме обзора и наличие полного текста, на данном этапе исключали тезисы, статьи и работы, не имеющие полного текста; полнотекстовые рукописи прошли оценку на соответствие критериям включения.
Критерии включения: оригинальные исследования, опубликованные в рецензируемых научных журналах полнотекстовые обзоры литературы, метаанализы, систематические обзоры, рандомизированные контролируемые или экспериментальные исследования in vitro, in vivo, а также описания клинических случаев на русском или английском языке, содержащие вышеуказанные ключевые слова.
В конечном итоге в настоящий обзор было включено 60 источников. Алгоритм отбора продемонстрирован на рисунке.
Результаты и обсуждение

ВКМ улитки и внеклеточные протеазы
ВКМ улитки состоит из разнообразных белковых компонентов, называемых матрисомами [12, 13]. К ним относятся коллаген, гликопротеины, протеогликаны и другие белки. Эти компоненты играют ключевую роль в формировании и поддержании структуры ВКМ [14, 15]. Коллаген является основным структурным белком ВКМ, обеспечивающим его прочность и устойчивость к растяжению. Гликопротеины формируют базовую структуру матрикса и выполняют функцию лигандов для клеточных рецепторов, таких как интегрины, способствуя взаимодействию клеток с ВКМ. Протеогликаны состоят из белка, к которому присоединены гликозаминогликаны, придающие матриксу отрицательный заряд [16, 17]. Гликозаминогликаны, особенно гепарансульфат, регулируют гомеостаз ВКМ, взаимодействуя с различными факторами и способствуя их проникновению в матрикс. Кроме того, гликозаминогликаны и гликопротеины играют важную роль в связывании и транспорте факторов роста, цитокинов и других биологически активных молекул, обеспечивая ремоделирование и поддержание структуры ВКМ. Белки, участвующие в сшивании и ремоделировании ВКМ, включают факторы роста, цитокины и муцины [18].
Текториальная мембрана
Текториальная мембрана (ТМ), расположенная над кортиевым органом, имеет спиральную форму, аналогичную структуре самого органа. С возрастом в ТМ происходят морфологические и биохимические изменения. В образцах височных костей лиц престарелого возраста с ВПС наблюдаются истончение ТМ, ее отделение от спирального лимба и прикрепление апикальной части к мембране Рейсснера, а также деформация базальных участков ТМ [19]. С помощью трансмиссионной электронной микроскопии было исследовано старение улитки у мышей разного возраста. Установлено, что дегенеративные изменения в ТМ начинаются в апикальном отделе улитки и постепенно распространяются на средний и базальный отделы [20, 21]. У мышей в возрасте 12–18 мес наблюдаются признаки набухания и истончения ТМ, однако внутренние и наружные волосковые клетки кортиева органа, а также нейроны спирального ганглия остаются интактными [22]. Это указывает на то, что дегенеративные изменения в ТМ предшествуют потере сенсорных клеток и нейронов. На этом этапе у мышей отмечается легкая потеря слуха. К 24–30 мес аналогичные изменения происходят и в базальной части ТМ, что сопровождается усилением потери слуха. Кроме того, ТМ отделяется от спирального лимба и контактирует с мембраной Рейсснера. Матриксные компоненты подвергаются значительной деградации, что особенно выражено в ядре сухожилия и коллагеновых волокнах [23]. В матриксе сухожилия у 12-месячных мышей линии CBA/Ca выявлены обширные лакуны, что указывает на потерю матричного материала [23].
К 24–30 мес ядро сухожилия практически полностью исчезло, сохранив лишь плотные фибриллярные комплексы на поверхности и на дистальном конце.
Старение и дегенерация ТМ коррелируют с изменениями в экспрессии таких белков, как α-текторин, β-текторин и CEACAM16. Иммунофлюоресцентное окрашивание позволяет выявить снижение уровня экспрессии α-текторина и β-текторина в апикальной части ТМ у мышей линии CBA/Ca в возрасте 18–19 мес по сравнению с 6-месячными особями [17]. В базальной части ТМ уровень экспрессии этих белков оставался неизменным. С 24 мес наблюдается дальнейшее снижение экспрессии α-текторина и β-текторина как в апикальной, так и в базальной части ТМ. Параллельно с этим экспрессия CEACAM16 увеличивается с возрастом и уменьшается в направлении от апикальной к базальной части улитки. У мышей линии C57BL/6J с нокаутированным геном Ceacam16 (Ceacam16KO/KO) наблюдается ускоренное старение ТМ внутреннего уха. Уже к 6 мес у них отмечаются изменения в матриксе апикального поворота ТМ, которые к 12 мес распространяются на базальный поворот, а к 26 мес затрагивают все отделы. У мышей дикого типа (Ceacam16+/+) аналогичные изменения начинаются только с 6 мес [24]. Отмечается, что жесткость ТМ у мышей Ceacam16KO/KO снижена по сравнению с 3–4-месячными мышами из контрольной группы. Порог акустического рефлекса ствола мозга на частотах 4–12 кГц у них увеличивается уже к 12 мес, что сопровождается снижением порога отоакустической эмиссии на частоте продукта искажения [25]. Эти результаты свидетельствуют о фенотипе преждевременного старения у мышей Ceacam16KO/KO, что может указывать на роль Ceacam16 в патогенезе аутосомно-рецессивной ВПС [26]. Однако наиболее выраженные изменения у них наблюдаются в апикальном отделе ТМ, в то время как у мышей дикого типа тугоухость развивается в базальном отделе, что требует дальнейшего изучения механизмов старения ТМ [27]. Окрашивание гистологических срезов улитки толуидиновым синим у 12-месячных мышей-самцов линий C57BL/6J, S129SvEv и CBA/Ca выявило значительное повреждение матрикса тимпанальной мембраны у мышей линии C57BL/6J по сравнению с мышамиS129SvEv и CBA/Ca, у которых повреждения были минимальными. Наблюдается выраженная потеря матрикса апикальной части ТМ при минимальном повреждении базальной части. У мышей линии C57BL/6J в возрасте
26 мес были выявлены практически полная утрата экспрессии α-текторина, снижение экспрессии β-текторина и CEACAM16 в тимпанальной мембране. Аналогичные изменения были обнаружены у 30-месячных мышей линии CBA/Ca. Однако нельзя однозначно утверждать, что α-текторин наиболее чувствителен к возрастным изменениям [28, 29]. Остается неясным, какие клеточные элементы продуцируют и поддерживают уровень α-текторина, также неизвестны точные механизмы, приводящие к его снижению. С возрастом происходят значительные трансформации в морфологии, структурных характеристиках, химическом составе и функциональных свойствах тканей внутреннего уха, приводящих к развитию сенсоневральной тугоухости [30, 31]. Механизмы, обусловливающие прогрессирующую потерю слуха, требуют дальнейшего изучения.
Базилярная мембрана
Базилярная мембрана (БМ) – это слой ВКМ, расположенный между сенсорными эпителиальными клетками, состоящий из внутренних и наружных волосковых клеток, опорных клеток и мезотелиальных клеток, граничащих с барабанной перепонкой [32]. В гистологических срезах височной кости пациентов с ВПС наблюдаются утолщение и кальцификация БМ [33, 34]. На животных моделях 30-месячных крыс дикого типа выявлено значительное увеличение толщины БМ, которое отсутствовало у 2-месячных крыс данного типа. При этом не обнаружено существенных различий в толщине апикальной и средней БМ. Около 25% мРНК, экспрессирующихся во внутреннем ухе мыши, участвуют в процессах пролиферации, дифференцировки, морфогенеза и функционального созревания сенсорных эпителиальных клеток. J. Zhang и соавт. для исследования молекулярных изменений в улитке мышей разного возраста использовали микрочип GeneChip, предназначенный для анализа экспрессии мРНК [35]. Анализ проводился на материале улиток 21-дневных, 3-месячных и 9-месячных мышей линии C57BL/6J, а также 21-дневных, 9-месячных и 16-месячных мышей линии CBA/Ca. В результате исследования было выявлено, что экспрессия мРНК семейства miR-29 увеличивается с возрастом как у представителей линии C57BL/6J, так и у мышей CBA/Ca. мРНК miR-29 способна ингибировать экспрессию генов, кодирующих такие компоненты ВКМ, как коллаген, эластин и фибронектины [36, 37]. Экспрессия miR-29a была обнаружена не только в клетках кортиева органа, сосудистом русле и спиральном ганглии, но и в структурах ВКМ, включая спиральный край и БМ, что было подтверждено в исследованиях на мышах miR-29aKO/KO и C57BL/6J [38]. У первых (miR-29aKO/KO) в возрасте 2–5 мес наблюдалось прогрессирующее снижение слуха, что проявлялось в увеличении порогов слухового восприятия на частотах 8, 16 и 32 кГц при регистрации вызванных акустических рефлексов [39, 40]. Гистологическое исследование 4-месячных мышей линии miR-29aKO/KO позволило выявить значительную потерю наружных волосковых клеток в базальной и апикальной частях улитки, а также внутренних волосковых клеток в ее базальной части. Также наблюдались истончение сосудистого стриатума и уменьшение числа нейронов в базальной части спирального ганглия. Электронно-микроскопическое исследование выявило слияние оставшихся стереоцилий волосковых клеток у мышей miR-29aKO/KO [41, 42]. Было определено, что экспериментальное выведение из строя miR-29a у мышей приводит к усилению экспрессии генов, связанных с базальной мембраной улитки, включая COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, LAMB2 и LAMC1. Иммунофлюоресцентный анализ замороженных срезов улитки 4-месячных мышей с нокаутированной miR-29a показал значительное увеличение экспрессии COL4A1 и LAMB2 в БМ [43, 44]. Трансмиссионная электронная микроскопия выявила утолщение базальной пластинки в базальном отделе, а также увеличение коллагеновых волокон в БМ под клетками внутренней колонны и клетками Дейтера, что также подчеркивает важную роль miR-29a в поддержании структурной целостности БМ. Утолщение БМ в базальном повороте у мышей с нокаутированной miR-29a сходно с изменениями, наблюдаемыми в БМ стареющих крыс. Это позволяет предположить наличие связи между прогрессирующим старением улитки у мышей и утолщением БМ в базальном отделе [46]. Таким образом, утолщение БМ может быть одним из механизмов развития ВПС.
Спиральная связка
Спиральная связка является важной структурой латеральной стенки среднего канала улитки. Она расположена между сосудистой полоской и БМ [47]. Сосудистая полоска, находящаяся латеральнее спиральной связки, огибает внешнюю костную стенку улитки, проходя над мембраной Рейсснера в верхней части спирального канала, и нижним концом прикрепляется к БМ. Одним из патологических механизмов, лежащих в основе ВПС, является дегенерация сосудистой полоски и спирального органа на латеральной стенке улитки, что приводит к развитию метаболической тугоухости [48, 49]. Дегенеративные изменения в сосудистой полоске, проявляющиеся в потере фиброцитов, происходят раньше, чем в сосудистом стриатуме и волосковых клетках.
В ходе исследования был проанализирован 151 образец височной кости, включая 15 образцов от пожилых пациентов с потерей слуха. В этих образцах наблюдалась значительная дегенерация сосудистого сплетения, сопровождающаяся атрофией или исчезновением фиброцитов. Эти данные указывают на то, что дегенерация сосудистого сплетения может быть одним из ключевых механизмов развития ВПС [50, 51]. Для оценки возрастных изменений в морфологии сосудистого сплетения образцы височной кости были разделены на три возрастные группы: 15–38 лет (8 образцов), 51–59 лет (8 образцов) и 64–84 года (9 образцов). В результате исследования было установлено, что объем сосудистого сплетения у представителей группы 64–84 лет значительно меньше по сравнению с группой 15–38 лет. Это свидетельствует о значительных морфологических изменениях и уменьшении объема сосудистого сплетения при старении организма.
Роль молекул ВКМ, потенциально ассоциируемых с развитием ВПС
Матриксные металлопротеиназы (ММП) и тканевые ингибиторы металлопротеиназ являются ключевыми молекулами, регулирующими ВКМ, которые участвуют в процессах ремоделирования и поддержания гомеостаза ВКМ. ММП играют важную роль в клеточных процессах, включая жизненный цикл клеток, их старение, апоптоз и другие регуляторные функции [52]. Семейства ММП опосредуют процессы регуляции клеточного старения через секреторный фенотип [53, 54].
В исследовании, проведенном на базе данных Биобанка клиники Мэйо, было изучено 28 белков у 1923 лиц старше 65 лет с одним хроническим заболеванием. Целью было выявление связи между плазменными уровнями этих белков и риском смерти. При использовании логистической регрессии и последующего анализа LASSO 36 белков было обнаружено, что концентрация ММП-12 отрицательно коррелирует с продолжительностью жизни, что указывает на наличие потенциальной связи между повышенным содержанием MMП-12 в плазме и продолжительности жизни [55, 56]. Семейства ММП также активно исследуются в контексте дегенеративных заболеваний сетчатки, где они играют важную роль в поддержании жизнеспособности клеток сетчатки и нейронов. ММП и тканевые ингибиторы металлопротеиназ активно экспрессируются в различных тканях внутреннего уха, таких как сосудистый стриатум, слуховой сенсорный эпителий и спиральный ганглий. Данные ферменты играют ключевую роль в патогенезе шумоиндуцированной и аминогликозид-индуцированной потери слуха, а также в развитии наследственной тугоухости, включая синдром Альпорта и гипергомоцистеинемию [57, 58]. Тем не менее их роль в формировании врожденных пороков развития уха остается недостаточно изученной.
Роль MMП в нарушениях слуха
Исследования, посвященные отношению роли семейства MMП к нарушениям слуха, включают анализ геномных ассоциаций, направленных на выявление генетических факторов, связанных с потерей слуха [59]. Установлено наличие положительной корреляции между MMП-2 и ВПС. Анализ экспрессии MMП-9 в слуховой коре и гиппокампе мышей линии C57BL/6J показал увеличение уровня экспрессии у 15-месячных животных по сравнению с 3-месячными. Изучение спинномозговой жидкости 65 пациентов с болезнью Альцгеймера и 44 пациентов с болезнью Альцгеймера и сопутствующей потерей слуха выявило разницу в среднем уровне MMП-3 в спинномозговой жидкости. Так, у лиц первой группы концентрация ММП-3 составила 0,52 нг/мл, тогда как у второй – 0,37 нг/мл. Уровень MMП-3 в спинномозговой жидкости пациентов с ВПС оказался значимо выше (p=0,004) и коррелировал с порогом чистого тона [60]. Несмотря на ключевую роль молекул ВКМ в нейродегенеративных процессах, число исследований, посвященных изменениям ВКМ при ВПС, остается ограниченным. Недостаточно изучены взаимосвязи между ВКМ и механизмами развития нарушений слуха.
Заключение
ВКМ является критически важным компонентом улитки. На макроскопическом уровне ВКМ не только обеспечивает структурную целостность улитки, но и играет ключевую роль в восприятии и передаче звуковых сигналов, а также в поддержании ионного баланса в перилимфе и эндолимфе. На микроскопическом уровне компоненты ВКМ участвуют в развитии и жизненном цикле слуховых сенсорных клеток. В последние годы активно исследуется роль ВКМ в дифференцировке этих клеток. Патогенез ВПС представляет собой сложный процесс. В ходе старения улитки происходят изменения в структуре и составе ВКМ, что может создавать предпосылки для развития ВПС. Молекулы, ассоциированные с ВКМ, такие как MMП и тканевые ингибиторы металлопротеиназ, также вовлечены в патогенез различных форм сенсоневральной тугоухости, однако их роль в развитии ВПС остается недостаточно изученной.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Джимгиров Мерген Аюкаевич – врач-оториноларинголог, ABC медицина. E-mail: murkudda@mail.ru; ORCID: 0009-0006-6468-4837
Mergen A. Dzhimgirov – otorhinolaryngologist, ABC Medicine.
E-mail: murkudda@mail.ru; ORCID: 0009-0006-6468-4837
Джимгирова Алина Федоровна – врач ультразвуковой диагностики ГБУЗ «Городская клиническая больница им. С.С. Юдина». E-mail: www.akp94@mail.ru; ORCID: 0009-0006-2647-4644
Alina F. Dzhimgirova – ultrasound doctor, S.S. Yudin State Clinical Hospital. E-mail: www.akp94@mail.ru; ORCID: 0009-0006-2647-4644
Поступила в редакцию: 27.03.2025
Поступила после рецензирования: 23.04.2025
Принята к публикации: 15.05.2025
Received: 27.03.2025
Revised: 23.04.2025
Accepted: 15.05.2025
Список исп. литературыСкрыть список1. Cao R, Takechi M, Wang X. Temporal and regulatory dynamics of the inner ear transcriptome during development in mice. Sci Rep 2022;12(1):21196. DOI: 10.1038/s41598-022-25808-9
2. Liu P, Edassery SL, Ali L et al. Long-lived metabolic enzymes in the crystalline lens identified by pulse-labeling of mice and mass spectrometry. Elife 2019;8:e50170. DOI: 10.7554/eLife.50170
3. Mozaffari M, Nash R, Tucker AS. Anatomy and Development of the Mammalian External Auditory Canal: Implications for Understanding Canal Disease and Deformity. Front Cell Dev Biol 2021;8:617354. DOI: 10.3389/fcell.2020.617354
4. Мелконян К.И., Бирюкова А.О., Улитина Н.Н. и др. Компоненты внеклеточного матрикса в восстановлении поврежденных тканей: биохимические взаимодействия и протективный эффект. Крымский журнал экспериментальной и клинической медицины. 2019;9(4):55-62.
Melkonyan K.I., Biryukova A.O., Ulitina N.N. et al.Components of extracellular matrix in the repair of damaged tissues: biochemical interactions and protective effect. Crimean Journal of Experimental and Clinical Medicine. 2019;9(4):55-62. (in Russian).
5. von Gablenz P, Holube I. Hˆrverlust und Sprachverstehen im Alter [Hearing Loss and Speech Recognition in the Elderly]. Laryngorhinootologie 2017;96(11):759-64. DOI: 10.1055/s-0043-119388
6. Statzer C, Park JYC, Ewald CY. Extracellular Matrix Dynamics as an Emerging yet Understudied Hallmark of Aging and Longevity. Aging Dis 2023;14(3):670-93. DOI: 10.14336/AD.2022.1116
7. Salminen A. The role of immunosuppressive myofibroblasts in the aging process and age-related diseases. J Mol Med (Berl) 2023;101(10):1169-89. DOI: 10.1007/s00109-023-02360-1
8. Артемьева О.В., Ганковская Л.В. Воспалительное старение как основа возраст-ассоциированной патологии. Медицинская иммунология. 2020;22(3):419-32. DOI:
Artemyeva O.V., Gankovskaya L.V. Inflammatory aging as a basis for age-associated pathology. Medical Immunology 2020;22(3):419-32. DOI: (in Russian).
9. Johnson JCS, Marshall CR, Weil RS et al. Hearing and dementia: from ears to brain. Brain 2021;144(2):391-401. DOI: 10.1093/brain/ awaa429
10. Valero MD, Burton JA, Hauser SN et al. Noise-induced cochlear synaptopathy in rhesus monkeys (Macaca mulatta). Hear Res 2017;353:213-23. DOI: 10.1016/j.heares.2017.07.003
11. Аденинская Е.Е., Бухтияров И.В., Бушманов А.Ю. и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике потери слуха, вызванной шумом. Медицина труда и промышленная экология. 2016;(3):37-48.
Adeninskaya E.E., Bukhtiarov I.V., Bushmanov A.Yu. et al. Federal clinical recommendations in diagnosis, treatment and prevention of hearing loss due to noise. Russian Journal of Occupational Health and Industrial Ecology. 2016;(3):37-48 (in Russian).
12. Liberman MC. Auditory-nerve response from cats raised in a low-noise chamber. J Acoust Soc Am 1978;63(2):442-55. DOI: 10.1121/1.381736
13. PressÈ MT, Malgrange B, Delacroix L. The cochlear matrisome: Importance in hearing and deafness. Matrix Biol 2024;125:40-58. DOI: 10.1016/j.matbio.2023.12.002
14. Усенко В.В., Тарабрин И.В., Войтенко А.С. Аминокислотный состав мягких тканей виноградной улитки (Helix pomatia). Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. 2022;179:246-63. DOI: 10.17650/2313-805X-2018-5-1-8-25
Usenko V.V, Tarabrin I.V., Voitenko A.S. Aminocyclotic constitution of the flexible tickets of the vinograd Snail (Helix pomatia). Polythematic Network Electronic Scientific Journal of Kuban State Agrarian University. 2022;179:246-63. DOI: 10.17650/2313-805X-2018-5-1-8-25 (in Russian).
15. Iozzo RV. Matrix proteoglycans: from molecular design to cellular function. Annu Rev Biochem 1998;67:609-52. DOI: 10.1146/annurev. biochem.67.1.609
16. Суховских А.В., Григорьева Э.В. Протеогликаны в нормальной физиологии и канцерогенезе. Успехи молекулярной онкологии. 2018;5(1):8-25.
Sukhovskikh A.V., Grigorieva E.V. Proteoglycans in normal physiology and carcinogenesis. Advances in Molecular Oncology 2018;5(1):8-25. (in Russian).
17. de Sousa Lobo Ferreira Querido R, Ji X, Lakha R. Visualizing Collagen Fibrils in the Cochlea's Tectorial and Basilar Membranes Using a Fluorescently Labeled Collagen-Binding Protein Fragment. J Assoc Res Otolaryngol 2023;24(2):147-57. DOI: 10.1007/s10162-023-00889-z
18. Bertagnoli LE, Seist R, Batts S, Stankovic KM. Potential Ototoxicity of Insulin-like Growth Factor 1 Receptor Signaling Inhibitors: An In Silico Drug Repurposing Study of the Regenerating Cochlear Neuron Transcriptome. J Clin Med 2023;12(10):3485. DOI: 10.3390/jcm12103485
19. Wu PZ, O'Malley JT, de Gruttola V, Liberman MC. Primary Neural Degeneration in Noise-Exposed Human Cochleas: Correlations with Outer Hair Cell Loss and Word-Discrimination Scores. J Neurosci 2021;41(20):4439-47.
20. Новоселецкий В.А., Хоров О.Г. Современное состояние вопросов этиопатогенеза патологии, приводящей к деструкции цепи слуховых косточек (обзор литературы). Проблемы здоровья и экологии. 2015;(1):9-15. DOI: 10.17116/otorino20248901121
Novoseletsky V.A., Horov O.G. Current state of the issues of etiopathogenesis of pathology leading to destruction of the auditory ossicle chain (literature review). Problems of Health and Ecology. 2015;(1):9-15. DOI: 10.17116/otorino20248901121 (in Russian).
21. Mepani AM, Verhulst S, Hancock KE et al. Envelope following responses predict speech-in-noise performance in normal-hearing listeners. J Neurophysiol 2021;125(4):1213-22. DOI: 10.1152/jn.00620.2020
22. Huang W, Zhong Y, Chen K et al. The role of cochlea extracellular matrix in age-related hearing loss. Biogerontology 2024;26(1):8. DOI: 10.1007/s10522-024-10149-z
23. Sternberg AR, Martos-Rus C, Davidson RJ et al. Pre-clinical evaluation of an enhanced-function factor VIII variant for durable hemophilia A gene therapy in male mice. Nat Commun 2024;15(1):7193. DOI: 10.1038/s41467-024-51296-8
24. Bernardinelli E, Roesch S, Simoni E et al. Novel POU3F4 variants identified in patients with inner ear malformations exhibit aberrant cellular distribution and lack of SLC6A20 transcriptional upregulation. Front Mol Neurosci 2022;15:999833. DOI: 10.3389/fnmol.2022.999833
25. Gu X, Jiang K, Chen R et al. Identification of common stria vascularis cellular alteration in sensorineural hearing loss based on ScRNA-seq. BMC Genomics 2024;25(1):213. DOI: 10.1186/s12864-024-10122-7
26. Olgun Y, Altun Z, Tütüncü M et al. The Impact of Oleuropein on Cisplatin-Induced Toxicity in Cochlear Cells in Relation to the Expression of Deoxyribonucleic Acid Damage-Associated Genes. J Int Adv Otol 2024;20(3):189-95. DOI: 10.5152/iao.2024.231288
27. Roman-Naranjo P, Parra-Perez AM, Escalera-Balsera A et al. Defective α-tectorin may involve tectorial membrane in familial Meniere disease. Clin Transl Med 2022;12(6):e829. DOI: 10.1002/ctm2.829
28. Rzepakowska A, Borowy A, Siedlecki E et al. Contemporary directions in the therapy of sensory hearing loss. Otolaryngol Pol 2024;78(4):29-38.
29. Тополянская С.В. Фактор некроза опухоли-альфа и возраст-ассоциированная патология. Архивъ внутренней медицины. 2020;10(6):414-21.
Topolyanskaya S.V. Necrosis factor of opucholi-alpha necrosis and whole-associated pathology. Archives of Internal Medicine 2020;10(6):414-21. (in Russian).
30. Liang J, Xie W, Yao W, Duan M. Effects of basilar-membrane lesions on dynamic responses of the middle ear. Acta Otolaryngol 2023;143(4):255-61. DOI: 10.1080/00016489.2023.2187451
31. Забирова А.Р. Этиология и патогенез сенсоневральной тугоухости. Российская оториноларингология. 2012;(2):162-7. DOI: 10.18692/1810-4800-2020-6-23-29
Zabirova A.R. Ethiology and pathogenesis of sensoneural toxicity. Russian Otorhinolaryngology 2012;(2):162-7. DOI: 10.18692/1810-4800-2020-6-23-29 (in Russian).
32. Bom Braga GO, Parrilli A, Zboray R et al. Quantitative Evaluation of the 3D Anatomy of the Human Osseous Spiral Lamina Using MicroCT. J Assoc Res Otolaryngol 2023;24(4):441-52. DOI: 10.1007/s10162-023-00904-3
33. Shi DL, Cheng XN, Saquet A, Grifone R. Emerging Roles of RNA-Binding Proteins in Inner Ear Hair Cell Development and Regeneration. Int J Mol Sci 2022;23(20):12393. DOI: 10.3390/ijms232012393
34. Michelena HI, Della Corte A, Evangelista A et al. International consensus statement on nomenclature and classification of the congenital bicuspid aortic valve and its aortopathy, for clinical, surgical, interventional and research purposes. Eur J Cardiothorac Surg 2021;60(3):448-76. DOI: 10.1093/ejcts/ezab038
35. Zhang J, Liu L, Li Y et al. Mouse Embryonic Fibroblasts-Derived Extracellular Matrix Facilitates Expansion of Inner Ear-Derived Cells. Cell J 2023;25(7):447-54. DOI: 10.22074/cellj.2023.1989426.1228
36. Bai X, Wang J, Zhang X et al. Deficiency of miR-29a/b1 leads to premature aging and dopaminergic neuroprotection in mice. Front Mol Neurosci 2022;15:978191. DOI: 10.3389/fnmol.2022.978191
37. Ступникова Т.В., Еремин И.И., Зорин В.Л. и др. Роль компонентов внеклеточного матрикса скелетной мышечной ткани в миогенезе. Гены и клетки. 2018;13(4):17-23.
Stupnikova T.V., Eremin I.I., Zorin V.L. et al. Role of extracellular matrix components of skeletal muscle tissue in myogenesis. Genes and Cells 2018;13(4):17-23. (in Russian).
38. Yang ZJ, Zhao CL, Liang WQ et al. ROS-induced oxidative stress and mitochondrial dysfunction: a possible mechanism responsible for noise-induced ribbon synaptic damage. Am J Transl Res 2024;16(1): 272-84. DOI: 10.62347/EVDE9449
39. Hakizimana P, Fridberger A. Inner hair cell stereocilia are embedded in the tectorial membrane. Nat Commun 2021;12(1):2604. DOI: 10.1038/s41467-021-22870-1
40. Заболотный Д.И., Шидловская Т.В., Куренева Е.Ю. Характеристика различных показателей акустического рефлекса внутриушных мышц у больных с сенсоневральной тугоухостью. Российская оториноларингология. 2008;(2):90-1. DOI: 10.3109/17482960802379004
Zabolotny D.I., Shidlovskaya T.V., Kureneva E.Yu. Characteristics of different acustical reflex positions of the intrius muscles in patients with sensoneural thoughts. Russian Otorhinolaryngology 2008;(2):90-1. DOI: 10.3109/17482960802379004 (in Russian).
41. Haghjooy-Javanmard S, Ghasemi A, Laher I et al. Influence of morphine on TLR4/ NF-kB signaling pathway of MCF-7 cells. Bratisl Lek Listy 2018;119(4):229-33. DOI: 10.4149/BLL_2018_043
42. Мусина Л.А., Байгильдин С.С., Дюдьбин О.В., Мусин И.Ф. Электронно-микроскопическое исследование сетчатки глаза крыс линии WАG/RIJ – экспериментальной модели ретинита. Медицинский вестник Башкортостана. 2021;16(5):32-5. DOI:
Musina L.A., Baigildin S.S., Dyudbin O.V., Musin I.F. Electron-microscopic research of the eye retina of rats of the WAG/RIJ line – experimental model of retinitis. Medical Bulletin of Bashkortostan. 2021;16(5):32-5. DOI: (in Russian).
43. Zheng J, Takahashi S, Zhou Y, Cheatham MA. Prestin and electromotility may serve multiple roles in cochlear outer hair cells. Hear Res 2022;423:108428. DOI: 10.1016/j.heares.2021.108428
44. Богуш Т.А., Калюжный С.А., Башарина А.А. и др. Иммунофлуоресцентный анализ экспрессии виментина в эпителиальных клетках. Вестник Московского университета. Химия. 2019;60(6):384-91.
Bogush T.A., Kalyuzhny S.A., Basharina A.A. et al. Immunofluorescence analysis of vimentin expression in epithelial cells. Bulletin of Moscow University. Chemistry 2019;60(6):384-91. (in Russian).
45. Pýnarbaþlý MÖ, Yýlmaz TD, Gürbüz MK et al. Risk of malignancy in patients with Reinke's Edema: evaluation of long-term follow-up results. Eur Arch Otorhinolaryngol 2025;282(1):327-31. DOI: 10.1007/s00405-024-09040-x
46. Hosoya M, Iwabu K, Kitama T et al. Development of cochlear spiral ligament fibrocytes of the common marmoset, a nonhuman model animal. Sci Rep 2023;13(1):11789. DOI: 10.1038/s41598-023-39003-x
47. Trinh TT, Blasco H, Maillot F, Bakhos D. Hearing loss in inherited metabolic disorders: A systematic review. Metabolism. 2021;122: 154841. DOI: 10.1016/j.metabol.2021.154841
48. Trinh M, Kalloniatis M, Nivison-Smith L. Radial Peripapillary Capillary Plexus Sparing and Underlying Retinal Vascular Impairment in Intermediate Age-Related Macular Degeneration. Invest Ophthalmol Vis Sci 2021;62(4):2. DOI: 10.1167/iovs.62.4.2
49. Бойко Е.Р., Паршукова О.И., Бойко С.Г. и др. Функциональная роль метаболитов оксида азота в патогенезе острой сенсоневральной тугоухости. Российская оториноларингология. 2014;4(71):16-21.
Boyko E.R., Parshukova O.I., Boyko S.G. et al. Functional role of nitric oxide metabolites in the pathogenesis of acute sensorineural hearing loss. Russian Otorhinolaryngology. 2014;4(71):16-21. DOI: 10.14341/2072-0351-5479 (in Russian).
50. de Almeida LGN, Thode H, Eslambolchi Y et al. Matrix Metalloproteinases: From Molecular Mechanisms to Physiology, Pathophysiology, and Pharmacology. Pharmacol Rev 2022;74(3):712-68. DOI: 10.1124/pharmrev.121.000349
51. Чепурных Е.Е., Григорьев Е.Г. Врожденные пороки сердца. Байкальский медицинский журнал. 2014;126(3):121-7. DOI: 10.29413/ABS.2019-4.3.15
Chepurnykh E.E., Grigoriev E.G. Congenital heart defects. Baikal Medical Journal 2014;126(3):121-7. DOI: 10.29413/ABS.2019-4.3.15 (in Russian).
52. Kim IS, Yang WS, Kim CH. Physiological Properties, Functions, and Trends in the Matrix Metalloproteinase Inhibitors in Inflammation-Mediated Human Diseases. Curr Med Chem 2023;30(18):2075-112. DOI: 10.2174/0929867329666220823112731
53. Tang G, Qi L, Sun Z et al. Evaluation and analysis of incidence and risk factors of lower extremity venous thrombosis after urologic surgeries: A prospective two-center cohort study using LASSO-logistic regression. Int J Surg 2021;89:105948. DOI: 10.1016/j.ijsu.2021.105948
54. Игрункова А.В., Валиева Я.М., Калиниченко А.М. и др. Клеточное старение: молекулярный и морфологический аспекты. Молекулярная медицина. 2022;20(4):16-21.
Igrunkova A.V., Valieva Ya.M., Kalinichenko A.M. et al. Cellular aging: molecular and morphological aspects. Molecular Medicine. 2022;20(4):16-21. DOI: 10.14341/probl13278 (in Russian).
55. Wan CY, Li L, Liu LS et al. Expression of Matrix Metalloproteinases and Tissue Inhibitor of Matrix Metalloproteinases during Apical Periodontitis Development. J Endod 2021;47(7):1118-25. DOI: 10.1016/j.joen. 2021.04.005
56. Медведев О.С. Замедление процессов старения: в фокусе коэнзим q10. Трудный пациент. 2012;10(4):50-60. DOI: 10.3389/fphys.2018. 00044
Medvedev O.S. Slowdown of aging processes: in focus coenzyme q10. Difficult Patient 2012;10(4):50-60. DOI: 10.3389/fphys.2018.00044 (in Russian).
57. Mehana EE, Khafaga AF, El-Blehi SS. The role of matrix metalloproteinases in osteoarthritis pathogenesis: An updated review. Life Sci 2019;234:116786. DOI: 10.1016/j.lfs.2019.116786
58. Gaafar D, Baxter N, Cranswick N et al. Pharmacogenetics of aminoglycoside-related ototoxicity: a systematic review. J Antimicrob Chemother 2024;79(7):1508-28. DOI: 10.1093/jac/dkae106
59. Johnson ECB, Dammer EB, Duong DM et al. Large-scale proteomic analysis of Alzheimer's disease brain and cerebrospinal fluid reveals early changes in energy metabolism associated with microglia and astrocyte activation. Nat Med 2020;26(5):769-80. DOI: 10.1038/s41591-020-0815-6
60. Ковальская А.Н., Бикбаева Г.Р., Дупляков Д.В., Савинова Е.В. Особенности простых маркеров воспаления в оценке уязвимости атеросклеротических бляшек у пациентов с острым коронарным синдромом. Российский кардиологический журнал. 2025;30(1):33-40. DOI: 10.15829/1560-4071-2025-5850
Kovalskaya A.N., Bikbaeva G.R., Dupliakov D.V., Savinova E.В. Features of simple inflammatory markers in the assessment of atherosclerotic plaque vulnerability in patients with acute coronary syndrome. Russian Journal of Cardiology. 2025;30(1):33-40. DOI: 10.15829/1560-4071-2025-5850 (in Russian).


