Клинический разбор в общей медицине №10 2025
Endocrinology Research Centre, Moscow, Russia
kacobashvili.ilana@mail.ru
Abstract
Vitamin D plays a key role in maintaining calcium and phosphorus homeostasis, influences normal fetal development, and reduces the risk of hypocalcemia, muscle cramps, and respiratory infections in children. Although total 25-hydroxyvitamin D (25(OH)D) is the generally accepted marker of vitamin D status, it does not fully reflect the complex biological effects of the numerous vitamin D metabolites. The specific metabolic adaptation of the maternal organism during pregnancy requires a detailed investigation of the dynamics of both 25(OH)D and other metabolites of vitamin D, as well as their relationship with calcium-phosphorus metabolism.
Aim. Study of the features of vitamin D metabolism and its relationship with calcium-phosphorus homeostasis in normal pregnancy compared with a control group of healthy non-pregnant women.
Materials and methods. A single-center observational, prospective, dynamic, comparative study was conducted, in which a group of pregnant women (n=38) underwent sequential examinations in the first, second, and third trimesters to assess the vitamin D metabolome using ultra-performance liquid chromatography coupled with tandem mass spectrometry (UPLC-MS/MS). For comparison, a control group of non-pregnant women (n=20), matched for age (p=0.076), was formed.
Results. The study revealed significant alterations in calcium and vitamin D metabolism in pregnant women compared with the control group. Across all trimesters, pregnant women showed decreased levels of total calcium, albumin, and parathyroid hormone (PTH), while albumin-corrected calcium and phosphorus remained unchanged. Regarding vitamin D metabolites, pregnant women demonstrated substantially higher levels of 25(OH)D3, 3-epi-25(OH)D3, and 1,25(OH)2D3, with a progressive increase toward the third trimester, whereas 24,25(OH)2D3 showed a tendency to rise in the second trimester. The ratios of 3-epi-25(OH)D3/25(OH)D3 and 25(OH)D3/24,25(OH)2D3, reflecting the activity of 3-epimerization and 24-hydroxylation respectively, were consistently higher in all trimesters compared with controls, while the ratio of 1,25(OH)2D3/25(OH)D3, reflecting 1α-hydroxylation activity, exhibited a complex pattern, with a decline in the second trimester followed by an increase in the third trimester.
Conclusion. For the first time, a comprehensive assessment of vitamin D metabolites in normal pregnancy has been conducted. The findings confirm the existence of a complex and highly coordinated regulatory system of vitamin D metabolism during pregnancy, aimed at meeting fetal requirements while maintaining maternal mineral homeostasis. Enhanced activation and epimerization, along with reduced deactivation, appear to represent a physiological adaptation critically important for the normal course of pregnancy and fetal development.
Keywords: vitamin D, pregnancy, vitamin D metabolites, calcitriol, 3-epi-25(OH)D3, 24,25(OH)2D3, PTH-related peptide.
For citation: Pigarova E.A., Katsobashvili I.A., Vorotnikova S.Yu., Bibik E.E., Dzeranova L.K., Ioutsi V.A., Nikankina L.V. Features of vitamin D metabolism and regulation of calcium phosphorus homeostasis in normal pregnancy. Clinical review for general practice. 2025; 6 (10): 118–127
(In Russ.). DOI: 10.47407/kr2025.6.10.00701
Введение
К настоящему времени установлено существование более 50 метаболитов витамина D, из которых наиболее изученными остаются лишь два – 25(OH)D3 и 1,25(OH)2D3. Это связано прежде всего с их ключевой ролью в регуляции кальций-фосфорного обмена. При этом 25(OH)D3, или кальцидиол, рассматривается как оптимальный маркер обеспеченности витамином D, что, однако, приводит к потенциальной недооценке биологической значимости других метаболитов [1]. В литературе представлено ограниченное количество данных о специфике метаболизма витамина D во время беременности, а имеющиеся результаты требуют подтверждения с использованием более точных аналитических методов. Согласно ряду исследований [2], у беременных женщин с ранних сроков наблюдается физиологическое повышение уровней циркулирующего 1,25(OH)2D3 и его транспортного белка с трехкратным увеличением в III триместре и последующей нормализацией после родов. Кроме того, в некоторых исследованиях отмечено конкордантное повышение уровня С3-эпимера – 3-epi-25(OH)D3 [3].
Механизмы, лежащие в основе активации почечной 1α-гидроксилазы во время беременности, до конца не ясны. Известно, что классические регуляторы, такие как паратгормон (ПТГ), в этот период, как правило, остаются стабильными [4]. Предполагается, что в регуляции активности фермента могут участвовать и другие гормональные факторы, включая ПТГ-подобный пептид (ПТГпп), эстрадиол, пролактин и плацентарный лактоген. Остаются также не полностью изученными причины роста уровня 1,25(OH)2D3 во время беременности [5], его соотношение с 25(OH)D3 [6], а также тот факт, что значительно повышенные уровни кальци-триола не сопровождаются гиперкальциемией у беременных [7]. Витамин D играет важную роль в регуляции системы «мать–плацента–плод», способствуя нормальному росту и развитию плода, а также снижая риск гипокальциемии, судорог и инфекций дыхательных путей у новорожденных [8]. Современные исследования подчеркивают целесообразность одновременного определения концентраций различных метаболитов витамина D в крови (витамин-D-метаболома) [9]. Это позволяет более точно оценивать активность различных метаболических путей и может служить основой для понимания патогенеза нарушений, связанных с дефицитом витамина D.
Таким образом, дальнейшее изучение особенностей метаболизма витамина D в период беременности представляется актуальной задачей, важной для углубления представлений о физиологической адаптации и разработки стратегий, направленных на оптимизацию здоровья матери и ребенка.
Цель исследования – изучение особенностей метаболизма витамина D и их связи с кальций-фосфорным обменом при нормальной беременности в сравнении с контрольной группой здоровых женщин.
Материалы и методы
Исследование проведено в ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России. Набор групп и обследование выполнены в период с сентября 2023 г. по май 2025 г.

В исследовании приняли участие две группы: группа беременных женщин (1-я группа 1; n=38), которые обследовались в I, II и III триместрах, и контрольная группа (2-я группа; n=20) условно здоровых небеременных женщин, сопоставимых по возрасту и индексу массы тела (ИМТ) (табл. 1).
Критерии включения в 1-ю группу:
• женский пол;
• возраст от 18 лет до 45 лет;
• беременность;
• подписанное информированное согласие.
Критерии включения во 2-ю группу:
• женский пол;
• возраст от 18 лет до 45 лет;
• подписанное информированное согласие.
Критерии исключения (для обеих групп):
• наличие тяжелых соматических заболеваний;
• прием препаратов, оказывающих влияние на всасывание/метаболизм витамина D на протяжении 3 мес, предшествующих исследованию (альфакальцидол, парикальцитол, кальцитриол, колекальциферол в дозах выше профилактических, глюкокортикостероиды, тиазидные диуретики, спиронолактон, антиретровирусные препараты, противогрибковые препараты, холестирамин, орлистат, противоэпилептические препараты, антидепрессанты, противомикробные средства, химиотерапия, иммуносупрессанты, антагонисты Н2-рецепторов);
• синдром мальабсорбции;
• беременность (для 2-й группы).
Формирование выборки осуществлялось сплошным методом. Отбор участниц осуществлялся при наличии их добровольного информированного согласия на участие и возможности трехкратного последующего наблюдения в рамках одного медицинского учреждения.
Контрольная группа была сформирована методом целенаправленной выборки из числа условно здоровых небеременных женщин репродуктивного возраста, сопоставимых по возрасту и ИМТ с участницами основной группы.
Дизайн исследования – одноцентровое обсервационное динамическое проспективное двухвыборочное сравнительное нерандоминизированное не маскированное исследование с поперечным сравнением.
График обследований: каждая беременная обследовалась трижды за беременность – в I (до 13-й недели), II (24–28-я неделя) и III (30–38-я неделя) триместрах.
Все лабораторные исследования образцов сыворотки крови проводились в клинико-диагностической лаборатории ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России.
Биохимические параметры сыворотки крови: кальций общий (референсный интервал, РИ, 2,15–2,55 ммоль/л), альбумин (РИ 35–50 г/л), фосфор
(РИ 0,74–1,52 ммоль/л) исследованы на автоматическом биохимическом анализаторе ARCHITECТ с8000 (Abbott, CША).
Исследование интактного ПТГ крови (иПТГ; РИ 15–65 пг/мл) проводилось иммунохемилюминесцентным методом на анализаторах Cobas 6000 Module e601 (Roche, Швейцария).
Уровень альбумин-скорректированного кальция (РИ 2,15–2,55 ммоль/л) рассчитывался по формуле: общий кальций (ммоль/л) = измеренный уровень кальция сыворотки (ммоль/л) + 0,02 × (40 – измеренный уровень альбумина (г/л)).
ИМТ рассчитывался по формуле (до беременности/ исходный): ИМТ = масса тела (кг) / рост (м)2.
Оценка метаболитов витамина D. Исследование метаболитов витамина D выполнено в лаборатории метаболомных и протеомных исследований (зав. лабораторией – канд. хим. наук В.А. Иоутси).
Уровни метаболитов витамина D: 25(OH)D3, общий 25(ОН)D, 1,25(OH)2D3 (РИ 18–78 нг/мл), 3-epi-25(OH)D3 (РИ 1–10 нг/мл) и 24,25(OH)2D3 (РИ 0,5–5,6 нг/мл) – в сыворотке крови определяли методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС/МС) с использованием собственного разработанного метода, успешно прошедшего схему внешнего контроля DEQAS и ранее опубликованного [10]. Отдельные РИ для 25(OH)D3 не разработаны, РИ для суммы показателей (25(OH)D) ≥30 нг/мл определен на основе клинических рекомендаций Российской ассоциации эндокринологов.
Для оценки активности ферментов, осуществляющих метаболизм витамина D, рассчитаны соответствующие соотношения: 25(OH)D3/24,25(OH)2D3 (РИ 7–25), косвенно отражающее активность 24-гидроксилирования; 1,25(ОН)2D3 /25(ОН)D3 (РИ не разработан) – 1α-гидроксилирования; 3-epi-25(OH)D3 / 25(ОН)D3 (РИ не разработан) – 3-эпимеризации.
Образцы сыворотки для измерения метаболитов витамина D хранили при температуре –80°C, избегая повторных циклов замораживания-оттаивания. Работа выполнена с использованием материалов Уникальной научной установки «Коллекция биологического материала пациентов с эндокринными патологиями» ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России.
Статистический анализ проведен в программных пакетах Statistica v.13 (StatSoft, США). Описательная статистика количественных показателей представлена медианами, первым и третьим квартилями – в виде Me [Q1; Q3], качественных – абсолютными и относительными частотами. Сравнение двух независимых групп для количественных данных выполнялось с помощью критерия Манна–Уитни (U-тест), двух зависимых групп – с помощью критерия Вилкоксона. Для сравнения трех и более зависимых выборок был использован критерий Фридмана. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05, при выполнении множественных сравнений применялась поправка Бонферрони. Значения р в диапазоне от скорректированного поправкой порогового уровня значимости до 0,05 рассматривались как статистическая тенденция.
Результаты
Сравнительный анализ контрольной группы и группы беременных в I триместре
Основные параметры кальций-фосфорного обмена, подробная характеристика метаболитов витамина D
в I триместре и их сравнительный анализ между группами представлены в табл. 2.
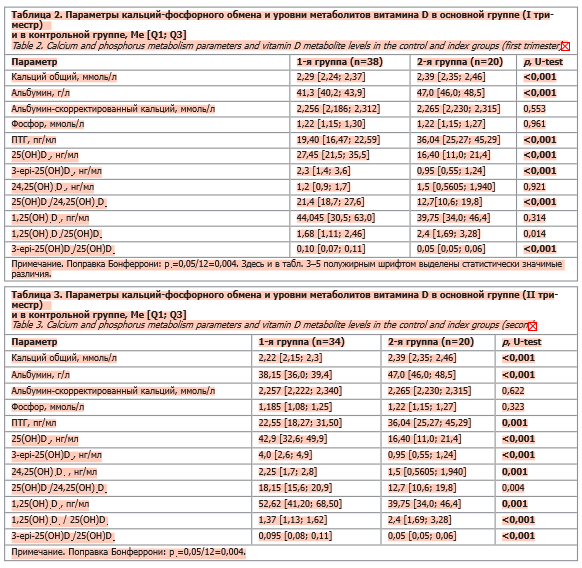
В ходе настоящего исследования проведен сравнительный анализ параметров кальций-фосфорного обмена и различных метаболитов витамина D у беременных женщин в I триместре гестации и у небеременных женщин (2-я группа).
Результаты показали достоверные различия между группами по ряду ключевых показателей. У беременных выявлены статистически значимо более низкие значения уровня общего кальция и альбумина, а также снижение ПТГ по сравнению с контролем, при этом уровни скорректированного кальция и фосфора существенно не отличались. В отношении метаболитов витамина D отмечены статистически значимо более высокие уровни 25(OH)D3 и 3-epi-25(OH)D3 у беременных по сравнению с контролем. Значения 25(OH)D3/24,25(OH)2D3 и 3-epi-25(OH)D3/25(OH)D3 были статистически значимо выше в 1-й группе. Во 2-й группе отмечалась тенденция к более высоким значениям 1,25(OH)2D3/25(OH)D3.
Сравнительный анализ контрольной группы и группы беременных во II триместре
Во II триместре в группе беременных также отмечались статистически значимо более низкие значения уровней общего кальция и альбумина и значимое снижение ПТГ по сравнению с контролем (табл. 3).
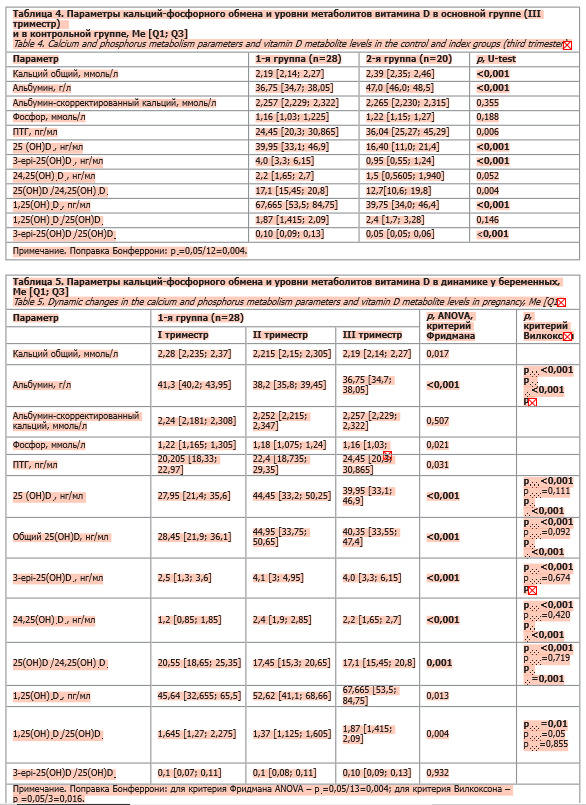
У беременных женщин также обнаружены статистически значимо более высокие уровни 25(OH)D3, 3-epi-25(OH)D3, 24,25(OH)2D3, 1,25(OH)2D3 по сравнению с контрольной группой, статистически значимое снижение соотношения 1,25(OH)2D3/25(OH)D3 в группе беременных. Напротив, соотношение 3-epi-25(OH)D3/ 25(OH)D3 у беременных было достоверно выше, а также отмечалась тенденция к увеличению соотношения 25(OH)D3/24,25(OH)2D3.
Сравнительный анализ контрольной группы и группы беременных в III триместре
При сравнении показателей кальций-фосфорного обмена у беременных, как и ранее, выявлены статистически значимо более низкие уровни общего кальция и альбумина, а также тенденция к снижению ПТГ по сравнению с контролем. Уровень скорректированного кальция и фосфора, как и ранее, существенно не отличался (табл. 4).
Метаболизм витамина D у беременных характеризовался статистически значимо более высокими концентрациями основного метаболита 25(OH)D3, 3-epi-25(OH)D3 и 1,25(OH)2D3 по сравнению с контролем.
У беременных женщин сохранялись статистически значимо более высокое соотношение 3-epi-25(OH)D3/ 25(OH)D3, а также тенденция к увеличению соотношения 25(OH)D3/24,25(OH)2D3. При этом показатели соотношения 1,25(OH)2D3/25(OH)D3 между основной и контрольной группами не различались.
Динамика параметров кальций-фосфорного обмена и метаболитов витамина D у беременных
В ходе анализа динамики параметров кальций-фосфорного обмена и метаболизма витамина D у женщин в разные триместры беременности выявлены следующие изменения (табл. 5). По мере прогрессирования беременности отмечались тенденция к снижению уровня общего кальция к III триместру, статистически значимое снижение концентрации альбумина. При этом уровень альбумин-корректированного кальция оставался стабильным на протяжении всей беременности. Уровень фосфора имел тенденцию к снижению, а уровень ПТГ – к увеличению.
Метаболизм витамина D у беременных по мере прогрессирования беременности характеризовался статистически значимо более высокими концентрациями метаболитов 25(OH)D3, общего 25(OH)D, 3-epi-25(OH)D3, 24,25(OH)2D3 от I ко II триместру и от I к III триместру, а в период от II к III триместру уровни данных метаболитов незначительно снижались, однако это изменение не достигало уровня статистической значимости. Отмечалась тенденция к повышению к III триместру уровня активной формы витамина D – 1,25(OH)2D3. При этом соотношение 1,25(OH)2D3/25(OH)D3 демонстрировало сложную динамику: статистически значимое снижение ко II триместру с дальнейшей тенденцией к увеличению к III триместру. Отмечалось статистически значимое снижение соотношения 25(OH)D3/24,25(OH)2D3 ко II триместру с сохранением на том же уровне в III триместре.
Таким образом, беременность сопровождается достоверными сдвигами в метаболизме кальция и витамина D, особенно выраженными во II триместре, с последующей адаптацией в III триместре, направленной на поддержание активных метаболитов и обеспечение фетального минерального обмена.
Обсуждение
Репрезентативность выборок
Несмотря на небольшой объем выборки, обусловленный особенностями изучаемой популяции (беременные женщины), и одноцентровой характер исследования, репрезентативность представляется достаточной благодаря сплошному методу формирования выборки и проспективному дизайну исследования.
Сопоставление с другими публикациями
Полученные в настоящем исследовании результаты подтверждают, что беременность сопровождается значительными изменениями в метаболизме витамина D и кальций-фосфорном обмене. Уже в I триместре выявлены физиологические сдвиги, направленные на адаптацию организма матери к возрастающим метаболическим потребностям.
На протяжении всех триместров беременности отмечались более низкие уровни общего кальция и альбумина по сравнению с контрольной группой. Уровни общего кальция и альбумина демонстрировали постепенное снижение, достигая минимальных значений к III триместру. Очевидно, что данное снижение носит физиологический характер и, вероятно, связано с увеличением объема циркулирующей плазмы (гемодилюцией), а также с изменением белкового состава крови, в том числе концентрации альбумина [11]. Уровень общего кальция помимо гипоальбуминемии может также снижаться за счет активного транспорта кальция от матери к плоду и повышения его экскреции с мочой (увеличение скорости клубочковой фильтрации во время беременности) [11]. Несмотря на это, значения альбумин-скорректированного кальция оставались стабильными на протяжении всей беременности, что соответствует данным литературы [12] и описывается как псевдогипокальциемия.
Концентрация фосфора в сыворотке крови оставалась в пределах референсных значений на протяжении всей беременности, и при сравнении с группой контроля различий не выявлено. Однако в ходе настоящего исследования отмечена тенденция к снижению уровня фосфора к III триместру гестации (p<0,021), клинически незначимая. При этом в литературных источниках [13] указывается, что физиологическая беременность, как правило, сопровождается стабильным уровнем сывороточного фосфора. Обнаруженная в настоящей работе особенность может отражать физиологические адаптационные процессы, включая возрастающую потребность плода в фосфате, активизацию его трансплацентарного транспорта, а также усиление почечной экскреции фосфора на фоне гестационной гиперфильтрации. По мере прогрессирования беременности интенсивность передачи кальция и фосфора от матери к плоду значительно возрастает, достигая максимума в III триместре. Согласно литературным данным, около 80% кальция и фосфора, аккумулируемых в скелете плода к моменту доношенной беременности, транспортируются через плаценту именно в последние недели гестации, преимущественно за счет поступления из материнского рациона [14].
Уровень ПТГ у беременных был значительно ниже в I триместре по сравнению с небеременными (р<0,001), с умеренным повышением ко II триместру, не достигая верхних референсных значений на последних сроках гестации, что подтверждается данными литературы о тенденции к низко-нормальному уровню ПТГ в течение всей беременности с возможным небольшим повышением в поздние сроки [15]. Данная особенность отражает физиологическую супрессию ПТГ на фоне увеличения продукции кальцитриола (1,25(OH)2D3) и ПТГпп, синтезируемого плацентой, что отражает доминантную роль кальцитриола и ПТГпп в регуляции кальций-фосфорного обмена уже c 13-й недели гестации [14]. Постепенное увеличение ПТГ к III триместру может носить компенсаторный характер, особенно в условиях недостаточного поступления кальция с пищей, что чаще всего отмечается в популяционных исследованиях среди женщин с низким потреблением кальция в рационе [14]. Однако в нашем исследовании повышение уровня ПТГ к III триместру было клинически не значимым; это может быть связано с тем, что, несмотря на рост потребности в кальции, увеличение концентрации 1,25(OH)2D3 к III триместру и экспрессия ПТГпп продолжают обеспечивать адекватный кальциевый гомеостаз, подавляя секрецию ПТГ.
При беременности уровень основного метаболита 25(OH)D3, отражающего запасы витамина D, начиная с I триместра был значимо выше, чем в контрольной группе (27,45 vs 16,4 нг/мл), что отражает лучшую обеспеченность витамином D, возможно, вследствие прегравидарной подготовки, что также могло оказать влияние на концентрацию других метаболитов – 3-epi-25(OH)D3, 1,25(OH)2D3, 24,25(OH)2D3. При этом выявлено повышение активности 3-эпимеразы (0,1 vs 0,05 соответственно). Важно отметить, что активность фермента была стабильна в течение всего периода гестации. При сравнении с группой контроля как концентрация метаболита 3-epi-25(OH)D3, так и соотношение 3-epi-25(OH)D3/25(OH)D3 были достоверно выше в каждом триместре. Причины повышения активности 3-эпимеразы во время беременности до конца не изучены. Известно, что сам фермент не идентифицирован в плаценте, однако метаболит 3-epi-25(OH)D3 в плаценте широко обнаруживается [16], что, вероятно, связано с доставкой метаболита из кровотока матери после внеплацентарного синтеза. 3-epi-25(OH)D3 в плацентарной ткани определяли методом ВЭЖХ-МС/МС после экстракции из гомогената плаценты [16].
В ряде исследований также отмечено повышение концентрации 3-epi-25(OH)D3 у беременных женщин по сравнению с небеременными [17]. Физиологическое значение данного факта остается предметом изучения [3], это может как быть следствием более высокого уровня витамина D у беременных, так и обеспечивать иную роль в здоровье матери и плода [18].
Известно, что эпимеризация осуществляется ферментом 3-эпимеразой, локализованной в эндоплазматическом ретикулуме клеток печени, костной ткани и кожи [19]. Данный фермент катализирует инверсию конфигурации 3β → 3α, в результате чего образуется метаболит 3-epi-25(OH)D3. Последний может далее метаболизироваться в 3-epi-1,25(OH)2D3 – форму с существенно пониженной биологической активностью по сравнению с 1,25(OH)2D3, что связано с 35–120-кратным снижением аффинности к рецептору витамина D (VDR) и как следствие слабо выраженной способностью стимулировать всасывание кальция в кишечнике и экспрессию 24-гидроксилазы. Однако в некоторых случаях 3-epi-1,25(OH)2D3 проявляет даже более высокую биологическую активность по сравнению с 1,25(OH)2D3, например в стимуляции синтеза сурфактанта во время перинатального созревания легких [20]. 3-epi-1,25(OH)2D3, по-видимому, обладает большей метаболической стабильностью, чем 1,25(OH)2D3, поэтому, несмотря на более низкую биологическую активность, он может иметь более продолжительные эффекты in vivo, в том числе по подавлению секреции ПТГ культивированными паратиреоцитами [21].
По химической природе витамин D и его активные метаболиты относятся к производным холестерина, в связи с чем, как и другие стероидные гормоны, они могут подвергаться множественным структурным модификациям (гидроксилирование, эпимеризация, окисление и др.). Подобно селективным модуляторам рецепторов эстрогенов (SERM) или андрогенов (SARM), 3-epi-1,25(OH)2D3 может действовать как селективный модулятор VDR (рецептора витамина D), усиливая транскрипцию одних генов в определенных тканях (усиление образования сурфактанта) и практически не влияя на другие.
Уровень кальцитриола достоверно превышал значения контрольной группы (p=0,001) со II триместра и демонстрировал постепенное повышение в течение гестации (не достигая уровня трехкратного повышения, описанного в литературе [14]), возможно, обусловленное тем, что в исследуемой когорте не фиксировались критически низкие значения кальция, требующие активной гормональной компенсации. Увеличение уровня кальцитриола со II триместра может быть связано с индивидуальными особенностями метаболизма витамина D, уровнем 25(OH)D3 как субстрата, стимуляцией 1α-гидроксилазы не только в почках, но и в плаценте под влиянием эстрогенов, пролактина, плацентарного лактогена и ПТГпп [14]. Указанная динамика отражает физиологическое усиление продукции активного метаболита витамина D на фоне увеличивающихся потребностей организма в кальции.
Также в ходе исследования было выявлено снижение соотношения 1,25(OH)2D3/25(OH)D3 во II триместре, отражающее активность 1α-гидроксилазы. Ранее в литературных источниках не описывалось уменьшение данного показателя, что подчеркивает новизну и важность данного наблюдения. Таким образом, снижение этого соотношения во II триместре представляет собой перспективное направление для дальнейших исследований, нацеленных на понимание тонкой регуляции метаболизма витамина D в разные периоды беременности и ее влияния на здоровье матери и плода.
К III триместру уровень 1,25(OH)2D3 продолжил возрастать, при этом соотношение 1,25(OH)2D3/25(OH)D3 увеличилось, что, по-видимому, отражает активизацию синтеза кальцитриола под действием гестационных гормонов в ответ на усиление потребностей плода в кальции на данном сроке гестации.
В ходе настоящего исследования установлено, что концентрация метаболита 24,25(OH)2D3, основного продукта инактивации витамина D, достоверно увеличивалась ко II триместру беременности, что может быть связано с повышением уровня 25(ОН)D3 и согласуется с данными литературы [22].
Увеличение соотношения 25(OH)D3/24,25(OH)2D3 во всех триместрах у беременных по сравнению с контрольной группой свидетельствует о снижении активности 24-гидроксилазы (CYP24A1), ответственной за дезактивацию витамина D, вероятно, для сохранения активной формы витамина D, что продемонстрировано в ранее опубликованном рандомизированном контролируемом исследовании [18]. Одновременно известно, что, кроме экспрессии данного фермента в почках, CYP24A1 также представлена в плаценте, где ее уровень не сопоставим с высокой активностью плацентарной 1α-гидроксилазы (CYP27B1), за счет метилирования гена CYP24A1, что, скорее всего, и обусловлено снижением активности данного фермента в период гестации.
В отличие от большинства соматических тканей, где синтез 1,25(OH)2D3 уравновешен катаболизмом, в плаценте наблюдается смещение баланса в пользу локального образования активной формы 1,25(OH)2D3 на фетоматеринской границе [23].
Однако при динамическом наблюдении во время гестации выявлено, что соотношение 25(OH)D3/ 24,25(OH)2D3 достоверно снижается ко II триместру, что указывает на повышенную активность 24-гидроксилазы, но уровень кальцитриола прогрессивно повышается. Данное наблюдение ранее не описано в литературе. Выявленную особенность можно связать с более выраженной активностью 1α-гидроксилазы в плаценте, которая превалирует над инактивацией 24-гидроксилазы. Таким образом, наблюдается метаболический сдвиг в сторону сохранения активных форм витамина D, что представляет собой физиологическую адаптацию к возросшим потребностям фетоплацентарного кальциевого транспорта для формирования костной ткани плода.
Учитывая, что в российской популяции витамин D2 (эргокальциферол) не играет ведущей роли, поскольку его поступление ограничено (в рационе практически отсутствует, используется редко в составе препаратов и пищевых добавок), а эндогенный синтез возможен только для витамина D3 (холекальциферола), мы не анализировали метаболические пути для витамина D2. Кроме того, эргокальциферол обладает меньшей биологической активностью: хуже связывается с витамин-D-связывающим белком, быстрее метаболизируется и выводится из организма. Поэтому именно витамин D3 является основной формой, определяющей уровень 25(OH)D в крови и обеспечивающей физиологические эффекты у жителей России, в том числе у беременных женщин.
Во многих ранее представленных работах исследование метаболитов витамина D проводилось с использованием иммунохемилюминесцентного анализа или иммуноферментного анализа, однако использование традиционных иммунологических методов может приводить к значительным погрешностям в определении метаболитов витамина D из-за неспособности четко отделять эпимеры и тем самым завышать истинные значения основного метаболита – 25(ОН)D, в то время как ВЭЖХ-МС/МС позволяет однозначно идентифицировать и количественно определять все формы витамина D, включая 3-epi-25(OH)D3, что обеспечивает более высокую точность и надежность результатов. В нашем исследовании использование ВЭЖХ-МС/МС позволило минимизировать влияние 3-эпимера на результаты и получить более достоверную картину метаболизма витамина D у беременных.
Клиническая значимость результатов
Анализ изменений концентраций этих метаболитов на разных сроках беременности и сравнение с контрольной группой небеременных женщин позволит глубже понять механизмы эндокринной регуляции кальций-фосфорного обмена и обеспечить научную базу для разработки профилактических и лечебных стратегий в отношении дефицита витамина D у беременных.
Ограничения исследования
Ограничения исследования обусловлены тем, что все участницы принимали витамин D в составе стандартной профилактики его дефицита в рекомендованных дозах (не более 2000 МЕ/сут), что отражает условия реальной клинической практики. Исследование не предусматривало назначения витамина D в рамках протокола и, таким образом, является наблюдательным (обсервационным). Отсутствие приема препаратов витамина D контрольной группой в динамике затрудняет разграничение выявленных различий, связанных с метаболизмом витамина D.
Заключение
Полученные данные подтверждают существование комплексной и высоко координированной системы регуляции витамина D при беременности, направленной на обеспечение потребностей плода и поддержание минерального гомеостаза матери. Усиление активации, эпимеризации и снижение дезактивации витамина D рассматриваются как часть физиологической адаптации, критически важной для нормального течения беременности и развития плода.
Раскрытие интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Disclosure of interest. The authors declare that they have no competing interests.
Источник финансирования. Статья подготовлена в рамках тематики государственного задания на выполнение НИР (№123021300171-7).
Funding source. This work was carried out as part of the state assignment for research project No. 123021300171-7.
Соответствие принципам этики. Проект научного исследования был рассмотрен и одобрен на заседании локального этического комитета ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России (протокол № 13 от 12.07.2023).
Ethics approval. The research project was reviewed and approved by the Local Ethics Committee of the Endocrinology Research Center (Protocol №13 dated 12.07.2023).
Информированное согласие на публикацию. Пациенты подписали форму добровольного информированного согласия на публикацию медицинской информации.
Consent for publication. The patients signed a voluntary informed consent form for the publication of medical information.
Вклад авторов. Кацобашвили И.А. – разработка концепции статьи, получение и анализ фактических данных, написание текста; Пигарова Е.А. – написание и редактирование текста статьи, проверка и утверждение текста статьи; Воротникова С.Ю., Дзеранова Л.К., Иоутси В.А., Никанкина Л.В. – внесение существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Authors’ contribution. Ilana A. Katsobashvili – study concept and design, data acquisition and analysis, drafting of the manuscript; Ekaterina A. Pigarova – manuscript writing and editing, critical revision, and final approval of the text; Svetlana Yг. Vorotnikova, Larisa K. Dzeranova, Vitaliy A. Ioutsi , Larisa V. Nikankina – substantial revision aimed at improving the scientific value of the article.
All authors approved the final version of the manuscript prior to publication and agreed to be responsible for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Информация об авторах
Information about the authors
Пигарова Екатерина Александровна – д-р мед. наук, вед. науч. сотр., эндокринолог, дир. Ин-та высш. и доп. проф. образования ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: kpigarova@gmail.com; ORCID: 0000-0001-6539-466X; eLibrary SPIN: 6912-6331; Scopus Author ID: 55655098500; ResearcherId: T-9424-2018
Ekaterina A. Pigarova – Dr. Sci. (Med.), endocrinologist, Leading Res. Officer, Endocrinology Research Centre. E-mail: kpigarova@gmail.com; ORCID: 0000-0001-6539-466X; eLibrary SPIN: 6912-6331; Scopus Author ID: 55655098500; Researcher Id:
T-9424-2018
Кацобашвили Илана Александровна – врач-эндокринолог, аспирант ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад.
И.И. Дедова». E-mail: kacobashvili.ilana@mail.ru; ORCID: 0000-0002-4388-6097; eLibrary SPIN: 7274-3990
Ilana A. Katsobashvili – endocrinologist, Graduate Student,
Endocrinology Research Centre. E-mail: kacobashvili.ilana@mail.ru; ORCID: 0000-0002-4388-6097; eLibrary SPIN: 7274-3990
Воротникова Светлана Юрьевна – канд. мед. наук, эндокринолог, рук. центра «Эндокринопатии и беременность» ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова».
E-mail: bra_svetix@list.ru; ORCID: 0000-0001-7470-1676; eLibrary SPIN: 6571-1206
Svetlana Yu. Vorotnikova – Cand. Sci. (Med.), endocrinologist, Endocrinology Research Centre. E-mail: bra_svetix@list.ru; ORCID: 0000-0001-7470-1676; eLibrary SPIN: 6571-1206
Бибик Екатерина Евгеньевна – канд. мед. наук, эндокринолог, ст. науч. сотр. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: bibikaterina@mail.ru; ORCID: 0000-0001-5952-5846; eLibrary SPIN: 8522-9466; Scopus Author ID: 57195679482; ResearcherID: AAY-3052-2020
Ekaterina E. Bibik – Cand. Sci. (Med.), endocrinologist, Senior Res. Officer, Endocrinology Research Centre. E-mail: bibikaterina@mail.ru; ORCID: 0000-0001-5952-5846; eLibrary SPIN: 8522-9466; Scopus Author ID: 57195679482; Researcher ID: AAY-3052-2020
Дзеранова Лариса Константиновна – д-р мед. наук, эндокринолог, проф. каф. эндокринологии Ин-та высш. и доп. проф. образования, гл. науч. сотр. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: dzeranovalk@yandex.ru; ORCID: 0000-0002-0327-4619; eLibrary SPIN: 2958-5555
Larisa K. Dzeranova – Dr. Sci. (Med.), endocrinologist, Prof., Chief Res. Officer, Endocrinology Research Centre. E-mail: dzeranovalk@yandex.ru; ORCID: 0000-0002-0327-4619; eLibrary SPIN: 2958-5555
Иоутси Виталий Алексеевич – канд. хим. наук, доц., зав. лаб. метаболомных и протеомных исследований ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». ORCID: 0000-0001-9002-1662; eLibrary SPIN: 9734-0997
Vitali A. Ioutsi – Cand. Sci. (Chem.), Assoc. Prof., Endocrinology Research Centre. ORCID: 0000-0001-9002-1662; eLibrary SPIN: 9734-0997
Никанкина Лариса Вячеславовна – канд. мед. наук, врач клинической лабораторной диагностики, зав. клинико-диагностической лаб. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: larisa.nikankina@yandex.ru; ORCID: 0000-0002-1120-8240; SPIN-код: 2794-0008
Larisa V. Nikankina – Cand. Sci. (Med.), clinical laboratory diagnostics doctor, Endocrinology Research Centre. E-mail: larisa.nikankina@yandex.ru; ORCID: 0000-0002-1120-8240; SPIN-код: 2794-0008
Поступила в редакцию: 25.10.2025
Поступила после рецензирования: 27.10.2025
Принята к публикации: 30.10.2025
Received: 25.10.2025
Revised: 27.10.2025
Accepted: 30.10.2025
Клинический разбор в общей медицине №10 2025
Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена при нормальной беременности
Номера страниц в выпуске:118-127
Аннотация
Витамин D играет ключевую роль в поддержании гомеостаза кальция и фосфора, а также влияет на нормальное развитие плода и снижает риск гипокальциемии, мышечных судорог и инфекций дыхательных путей у детей. Несмотря на то что общий уровень 25-гидроксивитамина D (25(OH)D) является общепринятым маркером обеспеченности витамином D, он не полностью отражает сложные биологические эффекты многочисленных метаболитов витамина D. Особая физиологическая адаптация организма женщины в период беременности требует детального изучения динамики как 25(OH)D, так и других метаболитов витамина и их связи с кальций-фосфорным обменом.
Цель. Изучение особенностей метаболизма витамина D и их связи с кальций-фосфорным обменом при нормальной беременности в сравнении с контрольной группой здоровых женщин.
Материалы и методы. Проведено одноцентровое обсервационное динамическое проспективное сравнительное исследование, в рамках которого у группы беременных женщин (n=38) проводилось динамическое обследование в I, II и III триместрах для оценки ряда показателей метаболома витамина D методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. Для сравнения сформирована контрольная группа небеременных женщин (n=20), сопоставимых по возрасту (р=0,076).
Результаты. В исследовании у беременных женщин по сравнению с контрольной группой выявлены значимые изменения в обмене кальция и витамина D. У беременных во всех триместрах отмечалось снижение уровней общего кальция и альбумина, а также паратгормона (ПТГ), при этом концентрации скорректированных кальция и фосфора не изменялись. По метаболитам витамина D у беременных зарегистрированы более высокие уровни 25(OH)D3, 3-epi-25(OH)D3 и 1,25(OH)2D3 с постепенным увеличением к III триместру, для 24,25(OH)2D3 отмечена тенденция к росту во II триместре. Соотношения 3-epi-25(OH)D3/25(OH)D3 и 25(OH)D3/24,25(OH)2D3, отражающие активность 3-эпимеризации и 24-гидроксилирования соответственно, были выше во всех триместрах по сравнению с контролем, а соотношение 1,25(OH)2D3/25(OH)D3, отражающее активность 1α-гидроксилирования, продемонстрировало сложную динамику со снижением во II триместре и дальнейшим ростом в III триместре.
Заключение. Впервые проведена комплексная оценка метаболитов витамина D при нормальной беременности. Полученные данные подтверждают существование комплексной и высококоординированной системы регуляции витамина D при беременности, направленной на обеспечение потребностей плода и поддержание минерального гомеостаза матери. Усиление активации и эпимеризации, снижение дезактивации рассматриваются как часть физиологической адаптации, критически важной для нормального течения беременности и развития плода.
Ключевые слова: витамин D, беременность, метаболиты витамина D, кальцитриол, 3-epi-25(OH)D3, 24,25(OH)2D3, ПТГ-подобный пептид.
Для цитирования: Пигарова Е.А., Кацобашвили И.А., Воротникова С.Ю., Бибик Е.Е., Дзеранова Л.К., Иоутси В.А., Никанкина Л.В. Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена при нормальной беременности). Клинический разбор в общей медицине. 2025; 6 (10): 118–127. DOI: 10.47407/kr2025.6.10.00701
Витамин D играет ключевую роль в поддержании гомеостаза кальция и фосфора, а также влияет на нормальное развитие плода и снижает риск гипокальциемии, мышечных судорог и инфекций дыхательных путей у детей. Несмотря на то что общий уровень 25-гидроксивитамина D (25(OH)D) является общепринятым маркером обеспеченности витамином D, он не полностью отражает сложные биологические эффекты многочисленных метаболитов витамина D. Особая физиологическая адаптация организма женщины в период беременности требует детального изучения динамики как 25(OH)D, так и других метаболитов витамина и их связи с кальций-фосфорным обменом.
Цель. Изучение особенностей метаболизма витамина D и их связи с кальций-фосфорным обменом при нормальной беременности в сравнении с контрольной группой здоровых женщин.
Материалы и методы. Проведено одноцентровое обсервационное динамическое проспективное сравнительное исследование, в рамках которого у группы беременных женщин (n=38) проводилось динамическое обследование в I, II и III триместрах для оценки ряда показателей метаболома витамина D методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. Для сравнения сформирована контрольная группа небеременных женщин (n=20), сопоставимых по возрасту (р=0,076).
Результаты. В исследовании у беременных женщин по сравнению с контрольной группой выявлены значимые изменения в обмене кальция и витамина D. У беременных во всех триместрах отмечалось снижение уровней общего кальция и альбумина, а также паратгормона (ПТГ), при этом концентрации скорректированных кальция и фосфора не изменялись. По метаболитам витамина D у беременных зарегистрированы более высокие уровни 25(OH)D3, 3-epi-25(OH)D3 и 1,25(OH)2D3 с постепенным увеличением к III триместру, для 24,25(OH)2D3 отмечена тенденция к росту во II триместре. Соотношения 3-epi-25(OH)D3/25(OH)D3 и 25(OH)D3/24,25(OH)2D3, отражающие активность 3-эпимеризации и 24-гидроксилирования соответственно, были выше во всех триместрах по сравнению с контролем, а соотношение 1,25(OH)2D3/25(OH)D3, отражающее активность 1α-гидроксилирования, продемонстрировало сложную динамику со снижением во II триместре и дальнейшим ростом в III триместре.
Заключение. Впервые проведена комплексная оценка метаболитов витамина D при нормальной беременности. Полученные данные подтверждают существование комплексной и высококоординированной системы регуляции витамина D при беременности, направленной на обеспечение потребностей плода и поддержание минерального гомеостаза матери. Усиление активации и эпимеризации, снижение дезактивации рассматриваются как часть физиологической адаптации, критически важной для нормального течения беременности и развития плода.
Ключевые слова: витамин D, беременность, метаболиты витамина D, кальцитриол, 3-epi-25(OH)D3, 24,25(OH)2D3, ПТГ-подобный пептид.
Для цитирования: Пигарова Е.А., Кацобашвили И.А., Воротникова С.Ю., Бибик Е.Е., Дзеранова Л.К., Иоутси В.А., Никанкина Л.В. Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена при нормальной беременности). Клинический разбор в общей медицине. 2025; 6 (10): 118–127. DOI: 10.47407/kr2025.6.10.00701
Features of vitamin D metabolism and regulation of calcium phosphorus homeostasis in normal pregnancy
Ekaterina A. Pigarova, Ilana A. Katsobashvili, Svetlana Yu. Vorotnikova, Ekaterina E. Bibik, Larisa K. Dzeranova, Vitaliy A. Ioutsi, Larisa V. NikankinaEndocrinology Research Centre, Moscow, Russia
kacobashvili.ilana@mail.ru
Abstract
Vitamin D plays a key role in maintaining calcium and phosphorus homeostasis, influences normal fetal development, and reduces the risk of hypocalcemia, muscle cramps, and respiratory infections in children. Although total 25-hydroxyvitamin D (25(OH)D) is the generally accepted marker of vitamin D status, it does not fully reflect the complex biological effects of the numerous vitamin D metabolites. The specific metabolic adaptation of the maternal organism during pregnancy requires a detailed investigation of the dynamics of both 25(OH)D and other metabolites of vitamin D, as well as their relationship with calcium-phosphorus metabolism.
Aim. Study of the features of vitamin D metabolism and its relationship with calcium-phosphorus homeostasis in normal pregnancy compared with a control group of healthy non-pregnant women.
Materials and methods. A single-center observational, prospective, dynamic, comparative study was conducted, in which a group of pregnant women (n=38) underwent sequential examinations in the first, second, and third trimesters to assess the vitamin D metabolome using ultra-performance liquid chromatography coupled with tandem mass spectrometry (UPLC-MS/MS). For comparison, a control group of non-pregnant women (n=20), matched for age (p=0.076), was formed.
Results. The study revealed significant alterations in calcium and vitamin D metabolism in pregnant women compared with the control group. Across all trimesters, pregnant women showed decreased levels of total calcium, albumin, and parathyroid hormone (PTH), while albumin-corrected calcium and phosphorus remained unchanged. Regarding vitamin D metabolites, pregnant women demonstrated substantially higher levels of 25(OH)D3, 3-epi-25(OH)D3, and 1,25(OH)2D3, with a progressive increase toward the third trimester, whereas 24,25(OH)2D3 showed a tendency to rise in the second trimester. The ratios of 3-epi-25(OH)D3/25(OH)D3 and 25(OH)D3/24,25(OH)2D3, reflecting the activity of 3-epimerization and 24-hydroxylation respectively, were consistently higher in all trimesters compared with controls, while the ratio of 1,25(OH)2D3/25(OH)D3, reflecting 1α-hydroxylation activity, exhibited a complex pattern, with a decline in the second trimester followed by an increase in the third trimester.
Conclusion. For the first time, a comprehensive assessment of vitamin D metabolites in normal pregnancy has been conducted. The findings confirm the existence of a complex and highly coordinated regulatory system of vitamin D metabolism during pregnancy, aimed at meeting fetal requirements while maintaining maternal mineral homeostasis. Enhanced activation and epimerization, along with reduced deactivation, appear to represent a physiological adaptation critically important for the normal course of pregnancy and fetal development.
Keywords: vitamin D, pregnancy, vitamin D metabolites, calcitriol, 3-epi-25(OH)D3, 24,25(OH)2D3, PTH-related peptide.
For citation: Pigarova E.A., Katsobashvili I.A., Vorotnikova S.Yu., Bibik E.E., Dzeranova L.K., Ioutsi V.A., Nikankina L.V. Features of vitamin D metabolism and regulation of calcium phosphorus homeostasis in normal pregnancy. Clinical review for general practice. 2025; 6 (10): 118–127
(In Russ.). DOI: 10.47407/kr2025.6.10.00701
Введение
К настоящему времени установлено существование более 50 метаболитов витамина D, из которых наиболее изученными остаются лишь два – 25(OH)D3 и 1,25(OH)2D3. Это связано прежде всего с их ключевой ролью в регуляции кальций-фосфорного обмена. При этом 25(OH)D3, или кальцидиол, рассматривается как оптимальный маркер обеспеченности витамином D, что, однако, приводит к потенциальной недооценке биологической значимости других метаболитов [1]. В литературе представлено ограниченное количество данных о специфике метаболизма витамина D во время беременности, а имеющиеся результаты требуют подтверждения с использованием более точных аналитических методов. Согласно ряду исследований [2], у беременных женщин с ранних сроков наблюдается физиологическое повышение уровней циркулирующего 1,25(OH)2D3 и его транспортного белка с трехкратным увеличением в III триместре и последующей нормализацией после родов. Кроме того, в некоторых исследованиях отмечено конкордантное повышение уровня С3-эпимера – 3-epi-25(OH)D3 [3].
Механизмы, лежащие в основе активации почечной 1α-гидроксилазы во время беременности, до конца не ясны. Известно, что классические регуляторы, такие как паратгормон (ПТГ), в этот период, как правило, остаются стабильными [4]. Предполагается, что в регуляции активности фермента могут участвовать и другие гормональные факторы, включая ПТГ-подобный пептид (ПТГпп), эстрадиол, пролактин и плацентарный лактоген. Остаются также не полностью изученными причины роста уровня 1,25(OH)2D3 во время беременности [5], его соотношение с 25(OH)D3 [6], а также тот факт, что значительно повышенные уровни кальци-триола не сопровождаются гиперкальциемией у беременных [7]. Витамин D играет важную роль в регуляции системы «мать–плацента–плод», способствуя нормальному росту и развитию плода, а также снижая риск гипокальциемии, судорог и инфекций дыхательных путей у новорожденных [8]. Современные исследования подчеркивают целесообразность одновременного определения концентраций различных метаболитов витамина D в крови (витамин-D-метаболома) [9]. Это позволяет более точно оценивать активность различных метаболических путей и может служить основой для понимания патогенеза нарушений, связанных с дефицитом витамина D.
Таким образом, дальнейшее изучение особенностей метаболизма витамина D в период беременности представляется актуальной задачей, важной для углубления представлений о физиологической адаптации и разработки стратегий, направленных на оптимизацию здоровья матери и ребенка.
Цель исследования – изучение особенностей метаболизма витамина D и их связи с кальций-фосфорным обменом при нормальной беременности в сравнении с контрольной группой здоровых женщин.
Материалы и методы
Исследование проведено в ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России. Набор групп и обследование выполнены в период с сентября 2023 г. по май 2025 г.

В исследовании приняли участие две группы: группа беременных женщин (1-я группа 1; n=38), которые обследовались в I, II и III триместрах, и контрольная группа (2-я группа; n=20) условно здоровых небеременных женщин, сопоставимых по возрасту и индексу массы тела (ИМТ) (табл. 1).
Критерии включения в 1-ю группу:
• женский пол;
• возраст от 18 лет до 45 лет;
• беременность;
• подписанное информированное согласие.
Критерии включения во 2-ю группу:
• женский пол;
• возраст от 18 лет до 45 лет;
• подписанное информированное согласие.
Критерии исключения (для обеих групп):
• наличие тяжелых соматических заболеваний;
• прием препаратов, оказывающих влияние на всасывание/метаболизм витамина D на протяжении 3 мес, предшествующих исследованию (альфакальцидол, парикальцитол, кальцитриол, колекальциферол в дозах выше профилактических, глюкокортикостероиды, тиазидные диуретики, спиронолактон, антиретровирусные препараты, противогрибковые препараты, холестирамин, орлистат, противоэпилептические препараты, антидепрессанты, противомикробные средства, химиотерапия, иммуносупрессанты, антагонисты Н2-рецепторов);
• синдром мальабсорбции;
• беременность (для 2-й группы).
Формирование выборки осуществлялось сплошным методом. Отбор участниц осуществлялся при наличии их добровольного информированного согласия на участие и возможности трехкратного последующего наблюдения в рамках одного медицинского учреждения.
Контрольная группа была сформирована методом целенаправленной выборки из числа условно здоровых небеременных женщин репродуктивного возраста, сопоставимых по возрасту и ИМТ с участницами основной группы.
Дизайн исследования – одноцентровое обсервационное динамическое проспективное двухвыборочное сравнительное нерандоминизированное не маскированное исследование с поперечным сравнением.
График обследований: каждая беременная обследовалась трижды за беременность – в I (до 13-й недели), II (24–28-я неделя) и III (30–38-я неделя) триместрах.
Все лабораторные исследования образцов сыворотки крови проводились в клинико-диагностической лаборатории ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России.
Биохимические параметры сыворотки крови: кальций общий (референсный интервал, РИ, 2,15–2,55 ммоль/л), альбумин (РИ 35–50 г/л), фосфор
(РИ 0,74–1,52 ммоль/л) исследованы на автоматическом биохимическом анализаторе ARCHITECТ с8000 (Abbott, CША).
Исследование интактного ПТГ крови (иПТГ; РИ 15–65 пг/мл) проводилось иммунохемилюминесцентным методом на анализаторах Cobas 6000 Module e601 (Roche, Швейцария).
Уровень альбумин-скорректированного кальция (РИ 2,15–2,55 ммоль/л) рассчитывался по формуле: общий кальций (ммоль/л) = измеренный уровень кальция сыворотки (ммоль/л) + 0,02 × (40 – измеренный уровень альбумина (г/л)).
ИМТ рассчитывался по формуле (до беременности/ исходный): ИМТ = масса тела (кг) / рост (м)2.
Оценка метаболитов витамина D. Исследование метаболитов витамина D выполнено в лаборатории метаболомных и протеомных исследований (зав. лабораторией – канд. хим. наук В.А. Иоутси).
Уровни метаболитов витамина D: 25(OH)D3, общий 25(ОН)D, 1,25(OH)2D3 (РИ 18–78 нг/мл), 3-epi-25(OH)D3 (РИ 1–10 нг/мл) и 24,25(OH)2D3 (РИ 0,5–5,6 нг/мл) – в сыворотке крови определяли методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС/МС) с использованием собственного разработанного метода, успешно прошедшего схему внешнего контроля DEQAS и ранее опубликованного [10]. Отдельные РИ для 25(OH)D3 не разработаны, РИ для суммы показателей (25(OH)D) ≥30 нг/мл определен на основе клинических рекомендаций Российской ассоциации эндокринологов.
Для оценки активности ферментов, осуществляющих метаболизм витамина D, рассчитаны соответствующие соотношения: 25(OH)D3/24,25(OH)2D3 (РИ 7–25), косвенно отражающее активность 24-гидроксилирования; 1,25(ОН)2D3 /25(ОН)D3 (РИ не разработан) – 1α-гидроксилирования; 3-epi-25(OH)D3 / 25(ОН)D3 (РИ не разработан) – 3-эпимеризации.
Образцы сыворотки для измерения метаболитов витамина D хранили при температуре –80°C, избегая повторных циклов замораживания-оттаивания. Работа выполнена с использованием материалов Уникальной научной установки «Коллекция биологического материала пациентов с эндокринными патологиями» ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России.
Статистический анализ проведен в программных пакетах Statistica v.13 (StatSoft, США). Описательная статистика количественных показателей представлена медианами, первым и третьим квартилями – в виде Me [Q1; Q3], качественных – абсолютными и относительными частотами. Сравнение двух независимых групп для количественных данных выполнялось с помощью критерия Манна–Уитни (U-тест), двух зависимых групп – с помощью критерия Вилкоксона. Для сравнения трех и более зависимых выборок был использован критерий Фридмана. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05, при выполнении множественных сравнений применялась поправка Бонферрони. Значения р в диапазоне от скорректированного поправкой порогового уровня значимости до 0,05 рассматривались как статистическая тенденция.
Результаты
Сравнительный анализ контрольной группы и группы беременных в I триместре
Основные параметры кальций-фосфорного обмена, подробная характеристика метаболитов витамина D
в I триместре и их сравнительный анализ между группами представлены в табл. 2.

В ходе настоящего исследования проведен сравнительный анализ параметров кальций-фосфорного обмена и различных метаболитов витамина D у беременных женщин в I триместре гестации и у небеременных женщин (2-я группа).
Результаты показали достоверные различия между группами по ряду ключевых показателей. У беременных выявлены статистически значимо более низкие значения уровня общего кальция и альбумина, а также снижение ПТГ по сравнению с контролем, при этом уровни скорректированного кальция и фосфора существенно не отличались. В отношении метаболитов витамина D отмечены статистически значимо более высокие уровни 25(OH)D3 и 3-epi-25(OH)D3 у беременных по сравнению с контролем. Значения 25(OH)D3/24,25(OH)2D3 и 3-epi-25(OH)D3/25(OH)D3 были статистически значимо выше в 1-й группе. Во 2-й группе отмечалась тенденция к более высоким значениям 1,25(OH)2D3/25(OH)D3.
Сравнительный анализ контрольной группы и группы беременных во II триместре
Во II триместре в группе беременных также отмечались статистически значимо более низкие значения уровней общего кальция и альбумина и значимое снижение ПТГ по сравнению с контролем (табл. 3).

У беременных женщин также обнаружены статистически значимо более высокие уровни 25(OH)D3, 3-epi-25(OH)D3, 24,25(OH)2D3, 1,25(OH)2D3 по сравнению с контрольной группой, статистически значимое снижение соотношения 1,25(OH)2D3/25(OH)D3 в группе беременных. Напротив, соотношение 3-epi-25(OH)D3/ 25(OH)D3 у беременных было достоверно выше, а также отмечалась тенденция к увеличению соотношения 25(OH)D3/24,25(OH)2D3.
Сравнительный анализ контрольной группы и группы беременных в III триместре
При сравнении показателей кальций-фосфорного обмена у беременных, как и ранее, выявлены статистически значимо более низкие уровни общего кальция и альбумина, а также тенденция к снижению ПТГ по сравнению с контролем. Уровень скорректированного кальция и фосфора, как и ранее, существенно не отличался (табл. 4).
Метаболизм витамина D у беременных характеризовался статистически значимо более высокими концентрациями основного метаболита 25(OH)D3, 3-epi-25(OH)D3 и 1,25(OH)2D3 по сравнению с контролем.
У беременных женщин сохранялись статистически значимо более высокое соотношение 3-epi-25(OH)D3/ 25(OH)D3, а также тенденция к увеличению соотношения 25(OH)D3/24,25(OH)2D3. При этом показатели соотношения 1,25(OH)2D3/25(OH)D3 между основной и контрольной группами не различались.
Динамика параметров кальций-фосфорного обмена и метаболитов витамина D у беременных
В ходе анализа динамики параметров кальций-фосфорного обмена и метаболизма витамина D у женщин в разные триместры беременности выявлены следующие изменения (табл. 5). По мере прогрессирования беременности отмечались тенденция к снижению уровня общего кальция к III триместру, статистически значимое снижение концентрации альбумина. При этом уровень альбумин-корректированного кальция оставался стабильным на протяжении всей беременности. Уровень фосфора имел тенденцию к снижению, а уровень ПТГ – к увеличению.
Метаболизм витамина D у беременных по мере прогрессирования беременности характеризовался статистически значимо более высокими концентрациями метаболитов 25(OH)D3, общего 25(OH)D, 3-epi-25(OH)D3, 24,25(OH)2D3 от I ко II триместру и от I к III триместру, а в период от II к III триместру уровни данных метаболитов незначительно снижались, однако это изменение не достигало уровня статистической значимости. Отмечалась тенденция к повышению к III триместру уровня активной формы витамина D – 1,25(OH)2D3. При этом соотношение 1,25(OH)2D3/25(OH)D3 демонстрировало сложную динамику: статистически значимое снижение ко II триместру с дальнейшей тенденцией к увеличению к III триместру. Отмечалось статистически значимое снижение соотношения 25(OH)D3/24,25(OH)2D3 ко II триместру с сохранением на том же уровне в III триместре.
Таким образом, беременность сопровождается достоверными сдвигами в метаболизме кальция и витамина D, особенно выраженными во II триместре, с последующей адаптацией в III триместре, направленной на поддержание активных метаболитов и обеспечение фетального минерального обмена.
Обсуждение
Репрезентативность выборок
Несмотря на небольшой объем выборки, обусловленный особенностями изучаемой популяции (беременные женщины), и одноцентровой характер исследования, репрезентативность представляется достаточной благодаря сплошному методу формирования выборки и проспективному дизайну исследования.
Сопоставление с другими публикациями
Полученные в настоящем исследовании результаты подтверждают, что беременность сопровождается значительными изменениями в метаболизме витамина D и кальций-фосфорном обмене. Уже в I триместре выявлены физиологические сдвиги, направленные на адаптацию организма матери к возрастающим метаболическим потребностям.
На протяжении всех триместров беременности отмечались более низкие уровни общего кальция и альбумина по сравнению с контрольной группой. Уровни общего кальция и альбумина демонстрировали постепенное снижение, достигая минимальных значений к III триместру. Очевидно, что данное снижение носит физиологический характер и, вероятно, связано с увеличением объема циркулирующей плазмы (гемодилюцией), а также с изменением белкового состава крови, в том числе концентрации альбумина [11]. Уровень общего кальция помимо гипоальбуминемии может также снижаться за счет активного транспорта кальция от матери к плоду и повышения его экскреции с мочой (увеличение скорости клубочковой фильтрации во время беременности) [11]. Несмотря на это, значения альбумин-скорректированного кальция оставались стабильными на протяжении всей беременности, что соответствует данным литературы [12] и описывается как псевдогипокальциемия.
Концентрация фосфора в сыворотке крови оставалась в пределах референсных значений на протяжении всей беременности, и при сравнении с группой контроля различий не выявлено. Однако в ходе настоящего исследования отмечена тенденция к снижению уровня фосфора к III триместру гестации (p<0,021), клинически незначимая. При этом в литературных источниках [13] указывается, что физиологическая беременность, как правило, сопровождается стабильным уровнем сывороточного фосфора. Обнаруженная в настоящей работе особенность может отражать физиологические адаптационные процессы, включая возрастающую потребность плода в фосфате, активизацию его трансплацентарного транспорта, а также усиление почечной экскреции фосфора на фоне гестационной гиперфильтрации. По мере прогрессирования беременности интенсивность передачи кальция и фосфора от матери к плоду значительно возрастает, достигая максимума в III триместре. Согласно литературным данным, около 80% кальция и фосфора, аккумулируемых в скелете плода к моменту доношенной беременности, транспортируются через плаценту именно в последние недели гестации, преимущественно за счет поступления из материнского рациона [14].
Уровень ПТГ у беременных был значительно ниже в I триместре по сравнению с небеременными (р<0,001), с умеренным повышением ко II триместру, не достигая верхних референсных значений на последних сроках гестации, что подтверждается данными литературы о тенденции к низко-нормальному уровню ПТГ в течение всей беременности с возможным небольшим повышением в поздние сроки [15]. Данная особенность отражает физиологическую супрессию ПТГ на фоне увеличения продукции кальцитриола (1,25(OH)2D3) и ПТГпп, синтезируемого плацентой, что отражает доминантную роль кальцитриола и ПТГпп в регуляции кальций-фосфорного обмена уже c 13-й недели гестации [14]. Постепенное увеличение ПТГ к III триместру может носить компенсаторный характер, особенно в условиях недостаточного поступления кальция с пищей, что чаще всего отмечается в популяционных исследованиях среди женщин с низким потреблением кальция в рационе [14]. Однако в нашем исследовании повышение уровня ПТГ к III триместру было клинически не значимым; это может быть связано с тем, что, несмотря на рост потребности в кальции, увеличение концентрации 1,25(OH)2D3 к III триместру и экспрессия ПТГпп продолжают обеспечивать адекватный кальциевый гомеостаз, подавляя секрецию ПТГ.
При беременности уровень основного метаболита 25(OH)D3, отражающего запасы витамина D, начиная с I триместра был значимо выше, чем в контрольной группе (27,45 vs 16,4 нг/мл), что отражает лучшую обеспеченность витамином D, возможно, вследствие прегравидарной подготовки, что также могло оказать влияние на концентрацию других метаболитов – 3-epi-25(OH)D3, 1,25(OH)2D3, 24,25(OH)2D3. При этом выявлено повышение активности 3-эпимеразы (0,1 vs 0,05 соответственно). Важно отметить, что активность фермента была стабильна в течение всего периода гестации. При сравнении с группой контроля как концентрация метаболита 3-epi-25(OH)D3, так и соотношение 3-epi-25(OH)D3/25(OH)D3 были достоверно выше в каждом триместре. Причины повышения активности 3-эпимеразы во время беременности до конца не изучены. Известно, что сам фермент не идентифицирован в плаценте, однако метаболит 3-epi-25(OH)D3 в плаценте широко обнаруживается [16], что, вероятно, связано с доставкой метаболита из кровотока матери после внеплацентарного синтеза. 3-epi-25(OH)D3 в плацентарной ткани определяли методом ВЭЖХ-МС/МС после экстракции из гомогената плаценты [16].
В ряде исследований также отмечено повышение концентрации 3-epi-25(OH)D3 у беременных женщин по сравнению с небеременными [17]. Физиологическое значение данного факта остается предметом изучения [3], это может как быть следствием более высокого уровня витамина D у беременных, так и обеспечивать иную роль в здоровье матери и плода [18].
Известно, что эпимеризация осуществляется ферментом 3-эпимеразой, локализованной в эндоплазматическом ретикулуме клеток печени, костной ткани и кожи [19]. Данный фермент катализирует инверсию конфигурации 3β → 3α, в результате чего образуется метаболит 3-epi-25(OH)D3. Последний может далее метаболизироваться в 3-epi-1,25(OH)2D3 – форму с существенно пониженной биологической активностью по сравнению с 1,25(OH)2D3, что связано с 35–120-кратным снижением аффинности к рецептору витамина D (VDR) и как следствие слабо выраженной способностью стимулировать всасывание кальция в кишечнике и экспрессию 24-гидроксилазы. Однако в некоторых случаях 3-epi-1,25(OH)2D3 проявляет даже более высокую биологическую активность по сравнению с 1,25(OH)2D3, например в стимуляции синтеза сурфактанта во время перинатального созревания легких [20]. 3-epi-1,25(OH)2D3, по-видимому, обладает большей метаболической стабильностью, чем 1,25(OH)2D3, поэтому, несмотря на более низкую биологическую активность, он может иметь более продолжительные эффекты in vivo, в том числе по подавлению секреции ПТГ культивированными паратиреоцитами [21].
По химической природе витамин D и его активные метаболиты относятся к производным холестерина, в связи с чем, как и другие стероидные гормоны, они могут подвергаться множественным структурным модификациям (гидроксилирование, эпимеризация, окисление и др.). Подобно селективным модуляторам рецепторов эстрогенов (SERM) или андрогенов (SARM), 3-epi-1,25(OH)2D3 может действовать как селективный модулятор VDR (рецептора витамина D), усиливая транскрипцию одних генов в определенных тканях (усиление образования сурфактанта) и практически не влияя на другие.
Уровень кальцитриола достоверно превышал значения контрольной группы (p=0,001) со II триместра и демонстрировал постепенное повышение в течение гестации (не достигая уровня трехкратного повышения, описанного в литературе [14]), возможно, обусловленное тем, что в исследуемой когорте не фиксировались критически низкие значения кальция, требующие активной гормональной компенсации. Увеличение уровня кальцитриола со II триместра может быть связано с индивидуальными особенностями метаболизма витамина D, уровнем 25(OH)D3 как субстрата, стимуляцией 1α-гидроксилазы не только в почках, но и в плаценте под влиянием эстрогенов, пролактина, плацентарного лактогена и ПТГпп [14]. Указанная динамика отражает физиологическое усиление продукции активного метаболита витамина D на фоне увеличивающихся потребностей организма в кальции.
Также в ходе исследования было выявлено снижение соотношения 1,25(OH)2D3/25(OH)D3 во II триместре, отражающее активность 1α-гидроксилазы. Ранее в литературных источниках не описывалось уменьшение данного показателя, что подчеркивает новизну и важность данного наблюдения. Таким образом, снижение этого соотношения во II триместре представляет собой перспективное направление для дальнейших исследований, нацеленных на понимание тонкой регуляции метаболизма витамина D в разные периоды беременности и ее влияния на здоровье матери и плода.
К III триместру уровень 1,25(OH)2D3 продолжил возрастать, при этом соотношение 1,25(OH)2D3/25(OH)D3 увеличилось, что, по-видимому, отражает активизацию синтеза кальцитриола под действием гестационных гормонов в ответ на усиление потребностей плода в кальции на данном сроке гестации.
В ходе настоящего исследования установлено, что концентрация метаболита 24,25(OH)2D3, основного продукта инактивации витамина D, достоверно увеличивалась ко II триместру беременности, что может быть связано с повышением уровня 25(ОН)D3 и согласуется с данными литературы [22].
Увеличение соотношения 25(OH)D3/24,25(OH)2D3 во всех триместрах у беременных по сравнению с контрольной группой свидетельствует о снижении активности 24-гидроксилазы (CYP24A1), ответственной за дезактивацию витамина D, вероятно, для сохранения активной формы витамина D, что продемонстрировано в ранее опубликованном рандомизированном контролируемом исследовании [18]. Одновременно известно, что, кроме экспрессии данного фермента в почках, CYP24A1 также представлена в плаценте, где ее уровень не сопоставим с высокой активностью плацентарной 1α-гидроксилазы (CYP27B1), за счет метилирования гена CYP24A1, что, скорее всего, и обусловлено снижением активности данного фермента в период гестации.
В отличие от большинства соматических тканей, где синтез 1,25(OH)2D3 уравновешен катаболизмом, в плаценте наблюдается смещение баланса в пользу локального образования активной формы 1,25(OH)2D3 на фетоматеринской границе [23].
Однако при динамическом наблюдении во время гестации выявлено, что соотношение 25(OH)D3/ 24,25(OH)2D3 достоверно снижается ко II триместру, что указывает на повышенную активность 24-гидроксилазы, но уровень кальцитриола прогрессивно повышается. Данное наблюдение ранее не описано в литературе. Выявленную особенность можно связать с более выраженной активностью 1α-гидроксилазы в плаценте, которая превалирует над инактивацией 24-гидроксилазы. Таким образом, наблюдается метаболический сдвиг в сторону сохранения активных форм витамина D, что представляет собой физиологическую адаптацию к возросшим потребностям фетоплацентарного кальциевого транспорта для формирования костной ткани плода.
Учитывая, что в российской популяции витамин D2 (эргокальциферол) не играет ведущей роли, поскольку его поступление ограничено (в рационе практически отсутствует, используется редко в составе препаратов и пищевых добавок), а эндогенный синтез возможен только для витамина D3 (холекальциферола), мы не анализировали метаболические пути для витамина D2. Кроме того, эргокальциферол обладает меньшей биологической активностью: хуже связывается с витамин-D-связывающим белком, быстрее метаболизируется и выводится из организма. Поэтому именно витамин D3 является основной формой, определяющей уровень 25(OH)D в крови и обеспечивающей физиологические эффекты у жителей России, в том числе у беременных женщин.
Во многих ранее представленных работах исследование метаболитов витамина D проводилось с использованием иммунохемилюминесцентного анализа или иммуноферментного анализа, однако использование традиционных иммунологических методов может приводить к значительным погрешностям в определении метаболитов витамина D из-за неспособности четко отделять эпимеры и тем самым завышать истинные значения основного метаболита – 25(ОН)D, в то время как ВЭЖХ-МС/МС позволяет однозначно идентифицировать и количественно определять все формы витамина D, включая 3-epi-25(OH)D3, что обеспечивает более высокую точность и надежность результатов. В нашем исследовании использование ВЭЖХ-МС/МС позволило минимизировать влияние 3-эпимера на результаты и получить более достоверную картину метаболизма витамина D у беременных.
Клиническая значимость результатов
Анализ изменений концентраций этих метаболитов на разных сроках беременности и сравнение с контрольной группой небеременных женщин позволит глубже понять механизмы эндокринной регуляции кальций-фосфорного обмена и обеспечить научную базу для разработки профилактических и лечебных стратегий в отношении дефицита витамина D у беременных.
Ограничения исследования
Ограничения исследования обусловлены тем, что все участницы принимали витамин D в составе стандартной профилактики его дефицита в рекомендованных дозах (не более 2000 МЕ/сут), что отражает условия реальной клинической практики. Исследование не предусматривало назначения витамина D в рамках протокола и, таким образом, является наблюдательным (обсервационным). Отсутствие приема препаратов витамина D контрольной группой в динамике затрудняет разграничение выявленных различий, связанных с метаболизмом витамина D.
Заключение
Полученные данные подтверждают существование комплексной и высоко координированной системы регуляции витамина D при беременности, направленной на обеспечение потребностей плода и поддержание минерального гомеостаза матери. Усиление активации, эпимеризации и снижение дезактивации витамина D рассматриваются как часть физиологической адаптации, критически важной для нормального течения беременности и развития плода.
Раскрытие интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Disclosure of interest. The authors declare that they have no competing interests.
Источник финансирования. Статья подготовлена в рамках тематики государственного задания на выполнение НИР (№123021300171-7).
Funding source. This work was carried out as part of the state assignment for research project No. 123021300171-7.
Соответствие принципам этики. Проект научного исследования был рассмотрен и одобрен на заседании локального этического комитета ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова» Минздрава России (протокол № 13 от 12.07.2023).
Ethics approval. The research project was reviewed and approved by the Local Ethics Committee of the Endocrinology Research Center (Protocol №13 dated 12.07.2023).
Информированное согласие на публикацию. Пациенты подписали форму добровольного информированного согласия на публикацию медицинской информации.
Consent for publication. The patients signed a voluntary informed consent form for the publication of medical information.
Вклад авторов. Кацобашвили И.А. – разработка концепции статьи, получение и анализ фактических данных, написание текста; Пигарова Е.А. – написание и редактирование текста статьи, проверка и утверждение текста статьи; Воротникова С.Ю., Дзеранова Л.К., Иоутси В.А., Никанкина Л.В. – внесение существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Authors’ contribution. Ilana A. Katsobashvili – study concept and design, data acquisition and analysis, drafting of the manuscript; Ekaterina A. Pigarova – manuscript writing and editing, critical revision, and final approval of the text; Svetlana Yг. Vorotnikova, Larisa K. Dzeranova, Vitaliy A. Ioutsi , Larisa V. Nikankina – substantial revision aimed at improving the scientific value of the article.
All authors approved the final version of the manuscript prior to publication and agreed to be responsible for all aspects of the work, ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Информация об авторах
Information about the authors
Пигарова Екатерина Александровна – д-р мед. наук, вед. науч. сотр., эндокринолог, дир. Ин-та высш. и доп. проф. образования ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: kpigarova@gmail.com; ORCID: 0000-0001-6539-466X; eLibrary SPIN: 6912-6331; Scopus Author ID: 55655098500; ResearcherId: T-9424-2018
Ekaterina A. Pigarova – Dr. Sci. (Med.), endocrinologist, Leading Res. Officer, Endocrinology Research Centre. E-mail: kpigarova@gmail.com; ORCID: 0000-0001-6539-466X; eLibrary SPIN: 6912-6331; Scopus Author ID: 55655098500; Researcher Id:
T-9424-2018
Кацобашвили Илана Александровна – врач-эндокринолог, аспирант ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад.
И.И. Дедова». E-mail: kacobashvili.ilana@mail.ru; ORCID: 0000-0002-4388-6097; eLibrary SPIN: 7274-3990
Ilana A. Katsobashvili – endocrinologist, Graduate Student,
Endocrinology Research Centre. E-mail: kacobashvili.ilana@mail.ru; ORCID: 0000-0002-4388-6097; eLibrary SPIN: 7274-3990
Воротникова Светлана Юрьевна – канд. мед. наук, эндокринолог, рук. центра «Эндокринопатии и беременность» ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова».
E-mail: bra_svetix@list.ru; ORCID: 0000-0001-7470-1676; eLibrary SPIN: 6571-1206
Svetlana Yu. Vorotnikova – Cand. Sci. (Med.), endocrinologist, Endocrinology Research Centre. E-mail: bra_svetix@list.ru; ORCID: 0000-0001-7470-1676; eLibrary SPIN: 6571-1206
Бибик Екатерина Евгеньевна – канд. мед. наук, эндокринолог, ст. науч. сотр. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: bibikaterina@mail.ru; ORCID: 0000-0001-5952-5846; eLibrary SPIN: 8522-9466; Scopus Author ID: 57195679482; ResearcherID: AAY-3052-2020
Ekaterina E. Bibik – Cand. Sci. (Med.), endocrinologist, Senior Res. Officer, Endocrinology Research Centre. E-mail: bibikaterina@mail.ru; ORCID: 0000-0001-5952-5846; eLibrary SPIN: 8522-9466; Scopus Author ID: 57195679482; Researcher ID: AAY-3052-2020
Дзеранова Лариса Константиновна – д-р мед. наук, эндокринолог, проф. каф. эндокринологии Ин-та высш. и доп. проф. образования, гл. науч. сотр. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: dzeranovalk@yandex.ru; ORCID: 0000-0002-0327-4619; eLibrary SPIN: 2958-5555
Larisa K. Dzeranova – Dr. Sci. (Med.), endocrinologist, Prof., Chief Res. Officer, Endocrinology Research Centre. E-mail: dzeranovalk@yandex.ru; ORCID: 0000-0002-0327-4619; eLibrary SPIN: 2958-5555
Иоутси Виталий Алексеевич – канд. хим. наук, доц., зав. лаб. метаболомных и протеомных исследований ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». ORCID: 0000-0001-9002-1662; eLibrary SPIN: 9734-0997
Vitali A. Ioutsi – Cand. Sci. (Chem.), Assoc. Prof., Endocrinology Research Centre. ORCID: 0000-0001-9002-1662; eLibrary SPIN: 9734-0997
Никанкина Лариса Вячеславовна – канд. мед. наук, врач клинической лабораторной диагностики, зав. клинико-диагностической лаб. ГНЦ РФ ФГБУ «НМИЦ эндокринологии им. акад. И.И. Дедова». E-mail: larisa.nikankina@yandex.ru; ORCID: 0000-0002-1120-8240; SPIN-код: 2794-0008
Larisa V. Nikankina – Cand. Sci. (Med.), clinical laboratory diagnostics doctor, Endocrinology Research Centre. E-mail: larisa.nikankina@yandex.ru; ORCID: 0000-0002-1120-8240; SPIN-код: 2794-0008
Поступила в редакцию: 25.10.2025
Поступила после рецензирования: 27.10.2025
Принята к публикации: 30.10.2025
Received: 25.10.2025
Revised: 27.10.2025
Accepted: 30.10.2025
Список исп. литературыСкрыть список1. Müller MJ, Stokes CS, Lammert F et al. Chemotyping the distribution of vitamin D metabolites in human serum. Sci Rep 2016;6:21080. DOI: 10.1038/srep21080
2. Papapetrou PD. The interrelationship of serum 1,25-dihydroxyvitamin D, 25-hydroxyvitamin D and 24,25-dihydroxyvitamin D in pregnancy at term: a meta-analysis. Hormones Athens 2010;9(2):136-44. DOI: 10.14310/horm.2002.1263
3. Bennett SE, Casey C, McPeake J et al. 3-Epi-25 hydroxyvitamin D in pregnancy. Pregnancy Hypertens 2014;4(3):236. DOI: 10.1016/ j.preghy.2014.03.021
4. Karras SN, Wagner CL, Castracane VD et al. Understanding vitamin D metabolism in pregnancy: From physiology to pathophysiology and clinical outcomes. Metabolism 2018;86:112-23. DOI: 10.1016/ j.metabol.2017.10.001
5. Платонова Н.М., Рыбакова А.А., Никанкина Л.В. и др. Витамин D и беременность: современное состояние проблемы в центральных регионах РФ. Проблемы эндокринологии. 2020;66(6):81-7. DOI: 10.14341/probl12693
Platonova N.M., Rybakova A.A., Nikankina L.V. et al. Vitamin D and pregnancy: current state of the problem in the central regions of the Russian Federation. Problems of Endocrinology. 2020;66(6):81-7. DOI: 10.14341/probl12693 (in Russian).
6. Figueiredo ACC, Cocate PG, Adegboye ARA et al. Changes in plasma concentrations of 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D during pregnancy: a Brazilian cohort. Eur J Nutr 2018;57:1059-72. DOI: 10.1007/s00394-017-1389-z
7. Wagner CL, Hollis BW. The extraordinary metabolism of vitamin D. Elife 2022;11:e77539. DOI: 10.7554/eLife.77539
8. Kiely ME, Wagner CL, Roth DE. Vitamin D in pregnancy: Where we are and where we should go. J Steroid Biochem Mol Biol 2020;201:105669. DOI: 10.1016/j.jsbmb.2020.105669
9. Tuckey RC, Cheng C, Slominski A. The serum vitamin D metabolome: What we know and what is still to discover. J Steroid Biochem Mol Biol 2018;186:4-21.
10. Usoltseva L, Ioutsi V, Panov Y et al. Serum vitamin D metabolites by HPLC-MS/MS combined with differential ion mobility spectrometry: aspects of sample preparation without derivatization. Int J Mol Sci 2023;24:8111. DOI: 10.3390/ijms24098111
11. Vricella LK. Emerging understanding and measurement of plasma volume expansion in pregnancy. Am J Clin Nutr 2017;106 Suppl 6:1620S-1625S. DOI: 10.3945/ajcn.117.155903
12. Hanna B. The role of calcium correction during normal pregnancy at third trimester in Mosul. Oman Med J 2009;24(3):188-94. DOI: 10.5001/omj.2009.37
13. Chandran M, Tan SYT. Disorders of bone and mineral metabolism in pregnancy and lactation: A case based clinical review. Osteoporos Sarcopenia 2025;11(1):1-8. DOI: 10.1016/j.afos.2025.03.002
14. Kovacs CS. Maternal mineral and bone metabolism during pregnancy, lactation, and post-weaning recovery. Physiol Rev 2016;96:449-547.
15. Meng DH, Zhang Y, Ma SS et al. The role of parathyroid hormone during pregnancy on the relationship between maternal vitamin D deficiency and fetal growth restriction: a prospective birth cohort study. Br J Nutr 2020;124(4):432-9. DOI: 10.1017/S0007114520001105
16. Tamblyn JA, Susarla R, Jenkinson C et al. Dysregulation of maternal and placental vitamin D metabolism in preeclampsia. Placenta 2017;50:70-7. DOI: 10.1016/j.placenta.2016.12.019
17. Takatani T, Kunii Y, Satoh M et al. Vitamin D metabolite ratio in pregnant women with low blood vitamin D concentrations is associated with neonatal anthropometric data. Nutrients 2022;14(11):2201. DOI: 10.3390/nu14112201
18. Park H, Brannon PM, West AA et al. Vitamin D metabolism varies among women in different reproductive states consuming the same intakes of vitamin D and related nutrients. J Nutr 2016;146(8):1537-45. DOI: 10.3945/jn.116.229971
19. Al-Zohily B, Al-Menhali A, Gariballa S et al. Epimers of vitamin D: A review. Int J Mol Sci 2020;21(2):470. DOI: 10.3390/ijms21020470
20. Rehan VK, Torday JS, Peleg S et al. 1Alpha,25-dihydroxy-3-epi-vitamin D3, a natural metabolite of 1alpha,25-dihydroxy vitamin D3: production and biological activity studies in pulmonary alveolar type II cells. Mol Genet Metab 2002;76(1):46-56. DOI: 10.1016/s1096-7192(02)00022-7
21. Brown AJ, Ritter C, Slatopolsky E et al. 1Alpha,25-dihydroxy-3-epi-vitamin D3, a natural metabolite of 1alpha,25-dihydroxyvitamin D3, is a potent suppressor of parathyroid hormone secretion. J Cell Biochem 1999;73(1):106-13.
22. Best CM, Pressman EK, Queenan RA et al. Gestational age and maternal serum 25-hydroxyvitamin D concentration interact to affect the 24,25-dihydroxyvitamin D concentration in pregnant adolescents. J Nutr 2018;148(6):868-75. DOI: 10.1093/jn/nxy043
23. Novakovic B, Sibson M, Ng HK et al. Placenta-specific methylation of the vitamin D 24-hydroxylase gene: implications for feedback autoregulation of active vitamin D levels at the fetomaternal interface. J Biol Chem 2009;284(22):14838-48. DOI: 10.1074/jbc.M809542200


