Клинический разбор в общей медицине №11 2025
1 Patrice Lumumba Peoples’ Friendship University of Russia, Moscow, Russia;
2 Morozovskaya Children’s City Clinical Hospital, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia;
4 National Medical Research Center for Children’s Health, Moscow, Russia
karpenko.ma@mail.ru
Abstract
Primary ciliary dyskinesia (PCD) is a genetically determined disease characterized by structural and functional abnormalities of the cilia of the ciliated epithelium. Chronic cough, wheezing, and reversible bronchial obstruction in patients with PCD can mimic bronchial asthma (BA), leading to diagnostic and therapeutic errors. However, the combination of PCD and BA is possible and represents a special clinical situation. The article presents two clinical cases of children with genetically confirmed PCD (mutations in the CCDC39 and DNAH5 genes), in whom additional examination allowed for the diagnosis of BA. The prescription of inhaled glucocorticosteroids in combination with long-acting β2-agonists led to a sustained improvement in their condition, a reduction in the frequency of exacerbations, and an increase in exercise tolerance. The presented cases highlight the need for clinical awareness of the combination of PCD and BA, regular functional assessment of the respiratory system, and individualized therapy with mandatory regulation of physical activity and sports.
Keywords: primary ciliary dyskinesia, bronchial asthma, comorbidity, clinical cases, children.
For citation: Karpenko M.A., Ovsyannikov D.Yu., Strelnikova V.А., Kolganova N.I., Malyshev O.G., Rylev T.A., Samunjan Ya.A., Rymar M.A., Bogoyavlenskaya A.D., Koniakhina A.D., Blakhina A.V., Lobov A.N., Pushkov A.А., Savostianov K.V. Bronchial asthma in children with primary ciliary dyskinesia: two clinical cases. Clinical review for general practice. 2025; 6 (11): 16–20 (In Russ.). DOI: 10.47407/kr2025.6.11.00705

 Первичная цилиарная дискинезия (ПЦД) – редкое (частота от 1 на 2265 до 1 на 40 000 населения) генетически детерминированное заболевание с преимущественно аутосомно-рецессивным типом наследования, в основе которого лежит нарушение структуры и функции ресничек мерцательного эпителия, что приводит к снижению эффективности мукоцилиарного клиренса, хроническим инфекциям дыхательных путей, бронхоэктазам и постепенному снижению функции легких. ПЦД сопровождается обратным расположением внутренних органов (синдром Зиверта–Картагенера) в 35% случаев. За развитие ПЦД ответственны более 50 генов [1, 2]. Устанавливают диагноз ПЦД на основании данных анамнеза, оценки >5 баллов по предиктивной шкале PICADAR (PrImary CiliAry DyskinesiA Rule), по которой оценивают пациентов, имеющих персистирующий влажный кашель (см. таблицу), результатов световой и электронной микроскопии мерцательного эпителия и генетического исследования [1–4].
Первичная цилиарная дискинезия (ПЦД) – редкое (частота от 1 на 2265 до 1 на 40 000 населения) генетически детерминированное заболевание с преимущественно аутосомно-рецессивным типом наследования, в основе которого лежит нарушение структуры и функции ресничек мерцательного эпителия, что приводит к снижению эффективности мукоцилиарного клиренса, хроническим инфекциям дыхательных путей, бронхоэктазам и постепенному снижению функции легких. ПЦД сопровождается обратным расположением внутренних органов (синдром Зиверта–Картагенера) в 35% случаев. За развитие ПЦД ответственны более 50 генов [1, 2]. Устанавливают диагноз ПЦД на основании данных анамнеза, оценки >5 баллов по предиктивной шкале PICADAR (PrImary CiliAry DyskinesiA Rule), по которой оценивают пациентов, имеющих персистирующий влажный кашель (см. таблицу), результатов световой и электронной микроскопии мерцательного эпителия и генетического исследования [1–4].
В связи с наличием кашля, одышки при физической нагрузке, влажных и/или сухих хрипов при аускультации легких, обратимой обструкции дыхательных путей дети с ПЦД в некоторых случаях ошибочно рассматриваются как пациенты с бронхиальной астмой (БА), что приводит к длительному и неэффективному применению ингаляционных глюкокортикостероидов (ИГКС) и бронхолитиков [5–7]. С другой стороны, сочетание ПЦД и БА также возможно, что существенно осложняет диагностику и выбор терапии [6].
Цель – представить клинические наблюдения двух детей с сочетанием ПЦД и БА, демонстрирующие диагностические и терапевтические сложности ведения таких пациентов.
Клиническое наблюдение 1
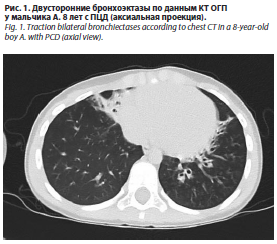
Мальчик А., 8 лет, рожденный от 2-й беременности (1-я беременность – мальчик, здоров), протекавшей без осложнений, 2-х самопроизвольных родов на 39-й неделе. Масса тела при рождении 3900 г, длина 52 см. Оценка по шкале Апгар 7/8 баллов. После рождения находился в отделении реанимации и интенсивной терапии новорожденных по поводу врожденной пневмонии, получал респираторную терапию. В грудном и раннем возрасте отмечались замедленные темпы роста. Из анамнеза известно, что с 1 мес отмечаются частые обструктивные бронхиты (всего перенес >10 раз), которые купировались ингаляционными бронхолитиками, ИГКС; круглогодичный ринит, частые эпизоды экссудативного отита, хронический влажный кашель. В рамках плановой госпитализации в 6 лет была проведена потовая проба – отрицательная, компьютерная томография (КТ) органов грудной полости (ОГП) – без патологии, КТ придаточных пазух носа – признаки полисинусита. Учитывая уровень эозинофилов 320 кл/мкл в клиническом анализе крови, уровень общего иммуноглобулина E 1104 МЕ/мл, у ребенка была заподозрена БА. Периодически получал короткие курсы ИГКС и бронхолитиков при бронхите с бронхообструктивным синдромом (БОС). Для уточнения диагноза проведена спирометрия с бронходилатационной пробой – отрицательная. Получал пробную терапию будесонидом в течение 3 мес с незначительным положительным эффектом – эпизоды БОС отмечались реже, кашель сохранялся. Учитывая наличие хронического влажного кашля, в 8 лет проведена оценка по предиктивной шкале PICADAR (8 баллов), в связи с чем был госпитализирован в пульмонологическое отделение Морозовской детской городской клинической больницы г. Москвы. При проведении КТ ОГП были выявлены бронхоэктазы средней доли правого легкого и язычковых сегментов левого легкого (рис. 1).
Учитывая оценку 8 баллов по шкале PICADAR, результаты КТ ОГП, проведено полноэкзомное секвенирование, по результатам которого в экзоне 13 гена CCDC39 выявлен нуклеотидный вариант c.1874G>T (chr3:180641993C>A; NM_181426.2) в гомозиготном состоянии, приводящий к аминокислотному варианту p.S625I. В соответствии с российским Руководством по интерпретации данных последовательности ДНК человека выявленный нуклеотидный вариант следует расценивать как вероятно патогенный, на основании чего был установлен диагноз ПЦД. В связи с сохраняющимися эпизодами БОС с быстрым эффектом бронхолитической терапии проведены аллергообследование и повторная спирометрия с бронходилатационной пробой: выявлена сенсибилизация к эпидермальным, пищевым и пыльцевым аллергенам, проба с сальбутамолом положительная (прирост объема форсированного выдоха за 1-ю секунду >12%). На основании полученных результатов был установлен диагноз БА, назначена базисная терапия III ступени в соответствии с рекомендациями GINA [8] – будесонид + формотерол (Симбикорт Рапихалер со спейсером) с положительным эффектом – эпизоды БОС прекратились, повысилась толерантность к физической нагрузке. Наблюдение за пациентом продолжается.
 Клиническое наблюдение 2
Клиническое наблюдение 2
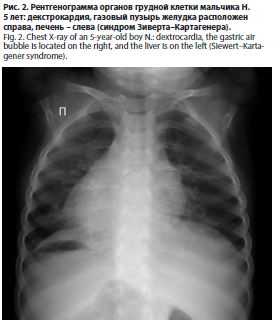
Мальчик Н., 5 лет, рожденный от 1-й беременности, протекавшей без осложнений, 1-х самопроизвольных родов на 40-й неделе. В анамнезе отмечались частые эпизоды бронхитов с БОС с положительным эффектом от терапии ингаляционными бронхолитиками и ИГКС, неоднократные госпитализации в связи с дыхательной недостаточностью 1–2-й степени, во время которых было выявлено зеркальное расположение внутренних органов (situs inversus); рис. 2.
Оценка по предиктивной шкале PICADAR составила 10 баллов. Учитывая полученные результаты, в возрасте 6 мес было проведено молекулярно-генетическое исследование. По результатам полноэкзомного секвенирования выявлены биаллельные варианты в гене DNAH5: ранее описанная инсерция со сдвигом рамки считывания, нуклеотидный вариант c.13458dup (chr5:13701316T>TA; NM_001369.3) в гетерозиготном состоянии, приводящий к аминокислотному варианту p.N4487*. В соответствии с российским Руководством по интерпретации данных последовательности ДНК человека выявленный нуклеотидный вариант следует расценивать как патогенный и ранее не описанный интронный вариант c.11212-4A>G (chr5:13737499T>C; NM_001369.3) неизвестного клинического значения. Был проведен анализ наследования вариантов от родителей, который подтвердил транс-положение вариантов. Установлен диагноз «ПЦД, синдром Зиверта–Картагенера». Также ребенок наблюдался по поводу атопического дерматита.
Несмотря на проводимую терапию ПЦД, которая включала дренажный массаж, дыхательную гимнастику, периодически отмечались эпизоды БОС с положительным эффектом от терапии ингаляционными бронхолитиками и ИГКС. На основании проявлений у ребенка рецидивирующего БОС была заподозрена БА. В возрасте 5 лет ребенку выполнена спирометрия с пробой с бронхолитиком – положительная (прирост объема форсированного выдоха за 1-ю секунду >12%), по результатам аллергообследования сенсибилизация к ингаляционным аллергенам выявлена не была. Учитывая наличие у ребенка атопического дерматита, частых эпизодов БОС, положительного эффекта от применения ИГКС, результаты спирометрии, был установлен диагноз БА. На фоне базисной терапии III ступени по GINA [8] – будесонид + формотерол (Симбикорт Рапихалер со спейсером) – эпизоды БОС больше не регистрировались, улучшилась переносимость физической нагрузки. Наблюдение за пациентом продолжается.
Обсуждение
Несмотря на наличие существенных отличий манифестации БА и ПЦД (возраст дебюта; характер кашля – сухой при БА, влажный при ПЦД; сопутствующие заболевания и проявления – атопические заболевания при БА, бронхоэктазы, чаще в средней доле, язычковых сегментах при ПЦД; эффект противоастматической терапии), дифференциальная диагностика данных заболеваний может вызывать сложности, связанные с ограничением диагностических возможностей: труднодоступность световой и электронной микроскопии мерцательного респираторного эпителия, спирометрии по месту жительства, сложности в корректном проведении данных исследований, высокая стоимость генетических исследований.
Клиническое наблюдение мальчика А. 8 лет демонстрирует трудности диагностики и терапии как БА, так и ПЦД. Хронический влажный кашель связывали с наличием постназального затека, и ребенок получал лишь симптоматическую терапию. Имеющиеся рецидивирующие бронхиты с БОС в анамнезе в комплексе с другими проявлениями уже указывали на возможность БА, а недостаточная эффективность будесонида в лечении рецидивирующих бронхитов с БОС была связана с несоответствием ступени терапии БА по GINA [8] и наличием сопутствующей ПЦД. Клиническое наблюдение мальчика Н. 5 лет демонстрирует гиподиагностику БА, возможную и при ПЦД.
Учитывая нейтрофильный тип воспаления при ПЦД, данный диагноз может стать причиной ошибочного исключения БА, для которой характерен преимущественно эозинофильный тип воспаления. Однако особенности патогенеза ПЦД, сопровождающейся стазом аллергенов на слизистой оболочке дыхательных путей, могут способствовать возникновению эозинофильного воспаления, обусловливающего манифестацию БА [9]. Согласно данным A. Owora и соавт. ПЦД повышает риск развития БА в 9 раз (отношение шансов 9,65; 95% доверительный интервал 5,20–17,90; p<0,01) [10].
Заключение
Несмотря на низкую распространенность в популяции, необходимо иметь клиническую настороженность в отношении ПЦД. В качестве скрининга можно использовать предиктивную шкалу PICADAR. Наличие рецидивирующих бронхитов с БОС у пациентов с ПЦД является веской причиной для проведения диагностики БА. Назначение противоастматической терапии позволяет повысить толерантность к физической нагрузке, рекомендуемой как важный компонент ведения больных с бронхоэктазами.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без спонсорской поддержки.
Acknowledgements. The study had no sponsorship.
Соответствие нормам этики. Информированное согласие от родителей пациентов получено. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Compliance with ethical standards. The patients submitted the informed consent. The study was conducted in accordance with the principles of the Declaration of Helsinki.
Информация об авторах
Information about the authors
Карпенко Максим Александрович – канд. мед. наук, доц. каф. педиатрии Медицинского института ФГАОУ ВО РУДН.
E-mail: karpenko.ma@mail.ru; ORCID: 0000-0001-7937-722X
Maksim A. Karpenko – Cand. Sci. (Med.), Associate Professor, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: karpenko.ma@mail.ru; ORCID: 0000-0001-7937-722X
Овсянников Дмитрий Юрьевич – д-р мед. наук, проф., зав. каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: ovsyannikov_dyu@pfur.ru; ORCID: 0000-0002-4961-384X
Dmitry Yu. Ovsyannikov – Dr. Sci. (Med.), Professor, Head of the Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital. E-mail: ovsyannikov_dyu@pfur.ru; ORCID: 0000-0002-4961-384X
Стрельникова Валерия Алексеевна – ассистент каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ».
E-mail: doc.strelnikova@mail.ru; ORCID: 0000-0002-2082-5531
Valeriia A. Strelnikova – Assistant, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital. E-mail: doc.strelnikova@mail.ru; ORCID: 0000-0002-2082-5531
Колганова Наталия Игоревна – аспирант каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-педиатр ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: kolganova-ni@rudn.ru; ORCID: 0000-0001-6923-6060
Nataliya I. Kolganova – Postgraduate Student, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pediatrician of Morozovskaya Children’s City Clinical Hospital. E-mail: kolganova-ni@rudn.ru; ORCID: 0000-0001-6923-6060
Малышев Олег Геннадьевич – ассистент каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: omalyshev03@vk.com; ORCID: 0000-0003-1174-0736
Oleg G. Malyshev – Assistant, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital.
E-mail: omalyshev03@vk.com; ORCID: 0000-0003-1174-0736
Рылев Тимофей Андреевич – студент лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: kwensy@mail.ru; ORCID: 0009-0004-2082-0783
Timofey A. Rylev – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: kwensy@mail.ru; ORCID: 0009-0004-2082-0783
Самунджян Яна Арменаковна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: yanasamunjan@mail.ru; ORCID: 0009-0005-9878-7140
Yana A. Samunjan – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: yanasamunjan@mail.ru; ORCID: 0009-0005-9878-7140
Рымарь Мария Александровна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: marusyarym7@gmail.com; ORCID: 0009-0000-7959-3555
Maria A. Rymar – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: marusyarym7@gmail.com; ORCID: 0009-0000-7959-3555
Богоявленская Анастасия Дмитриевна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: nastya21062002@gmail.com; ORCID: 0009-0000-3444-4804
Anastasiya D. Bogoyavlenskaya – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: nastya21062002@gmail.com; ORCID: 0009-0000-3444-4804
Коняхина Алена Дмитриевна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: alna.konyakhina.02@mail.ru; ORCID: 0009-0004-5838-9909
Alena D. Koniakhina – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: alna.konyakhina.02@mail.ru; ORCID: 0009-0004-5838-9909
Блахина Анна Владимировна – ординатор каф. дерматовенерологии, косметологии и аллергологии Медицинского института ФГАОУ ВО РУДН. E-mail: anya.blakhina@mail.ru; ORCID: 0009-0002-1224-5489
Anna V. Blakhina – Resident of the Department of Dermatovenereology, Cosmetology and Allergology of the Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: anya.blakhina@mail.ru; ORCID: 0009-0002-1224-5489
Лобов Андрей Николаевич – д-р мед. наук, проф., каф. реабилитации, спортивной медицины и физической культуры Института профилактической медицины им. З.П. Соловьева ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». Е-mail: a_lobov@mail.ru; ORCID: 0000-0003-2088-6139
Andrey N. Lobov – Dr. Sci. (Med.), Professor, Department of Rehabilitation, Sports Medicine and Physical Culture, Institute of Professional Education, Pirogov Russian National Research Medical University. E-mail: a_lobov@mail.ru; ORCID: 0000-0003-2088-6139
Пушков Александр Алексеевич – канд. биол. наук, вед. науч. сотр. лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей». Е-mail: pushkovgenetika@gmail.com; ORCID:0000-0001-6648-2063
Aleksandr A. Pushkov – Cand. Sci. (Biol.), Leading Researcher at the Laboratory of Medical Genomics, National Medical Research Center for Children’s Health. Е-mail: pushkovgenetika@gmail.com;
ORCID: 0000-0001-6648-2063
Савостьянов Кирилл Викторович – д-р биол. наук, начальник Медико-генетического центра, зав. лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей». E-mail: savostyanovkv@nczd.ru; ORCID:0000-0003-4885-4171
Kirill V. Savostyanov – Dr. Sci. (Biol.), Head of the Medical Gene-tic Center, Head of the Laboratory of Medical Genomics, National Medical Research Center for Children’s Health.
E-mail: savostyanovkv@nczd.ru; ORCID: 0000-0003-4885-4171
Поступила в редакцию: 31.10.2025
Поступила после рецензирования: 05.11.2025
Принята к публикации: 06.11.2025
Received: 31.10.2025
Revised: 05.11.2025
Accepted: 06.11.2025
Клинический разбор в общей медицине №11 2025
Бронхиальная астма у детей с первичной цилиарной дискинезией: два клинических наблюдения
Номера страниц в выпуске:16-20
Аннотация
Первичная цилиарная дискинезия (ПЦД) – генетически детерминированное заболевание, характеризующееся нарушением структуры и функции ресничек мерцательного эпителия. Хронический кашель, хрипы, обратимая бронхиальная обструкция у больных с ПЦД могут имитировать бронхиальную астму (БА), приводя к ошибкам диагностики и терапии. Вместе с тем сочетание ПЦД и БА, возможно, представляет собой особую клиническую ситуацию. В статье представлены два клинических наблюдения детей с генетически подтвержденной ПЦД (мутации в генах CCDC39 и DNAH5), у которых проведение дополнительного обследования позволило установить диагноз БА. Назначение ингаляционных глюкокортикостероидов в комбинации с длительно действующими β2-агонистами привело к стойкому улучшению состояния, снижению частоты обострений и повышению толерантности к физической нагрузке. Представленные наблюдения подчеркивают необходимость клинической настороженности в отношении сочетания ПЦД и БА, регулярной функциональной оценки органов дыхания и индивидуализации терапии с обязательной регламентацией физической нагрузки и спорта.
Ключевые слова: первичная цилиарная дискинезия, бронхиальная астма, коморбидность, клинические наблюдения, дети.
Для цитирования: Карпенко М.А., Овсянников Д.Ю., Стрельникова В.А., Колганова Н.И., Малышев О.Г., Рылев Т.А., Самунджян Я.А., Рымарь М.А., Богоявленская А.Д., Коняхина А.Д., Блахина А.В., Лобов А.Н., Пушков А.А., Савостьянов К.В. Бронхиальная астма у детей с первичной цилиарной дискинезией: два клинических наблюдения. Клинический разбор в общей медицине. 2025; 6 (11): 16–20. DOI: 10.47407/kr2025.6.11.00705
Первичная цилиарная дискинезия (ПЦД) – генетически детерминированное заболевание, характеризующееся нарушением структуры и функции ресничек мерцательного эпителия. Хронический кашель, хрипы, обратимая бронхиальная обструкция у больных с ПЦД могут имитировать бронхиальную астму (БА), приводя к ошибкам диагностики и терапии. Вместе с тем сочетание ПЦД и БА, возможно, представляет собой особую клиническую ситуацию. В статье представлены два клинических наблюдения детей с генетически подтвержденной ПЦД (мутации в генах CCDC39 и DNAH5), у которых проведение дополнительного обследования позволило установить диагноз БА. Назначение ингаляционных глюкокортикостероидов в комбинации с длительно действующими β2-агонистами привело к стойкому улучшению состояния, снижению частоты обострений и повышению толерантности к физической нагрузке. Представленные наблюдения подчеркивают необходимость клинической настороженности в отношении сочетания ПЦД и БА, регулярной функциональной оценки органов дыхания и индивидуализации терапии с обязательной регламентацией физической нагрузки и спорта.
Ключевые слова: первичная цилиарная дискинезия, бронхиальная астма, коморбидность, клинические наблюдения, дети.
Для цитирования: Карпенко М.А., Овсянников Д.Ю., Стрельникова В.А., Колганова Н.И., Малышев О.Г., Рылев Т.А., Самунджян Я.А., Рымарь М.А., Богоявленская А.Д., Коняхина А.Д., Блахина А.В., Лобов А.Н., Пушков А.А., Савостьянов К.В. Бронхиальная астма у детей с первичной цилиарной дискинезией: два клинических наблюдения. Клинический разбор в общей медицине. 2025; 6 (11): 16–20. DOI: 10.47407/kr2025.6.11.00705
Bronchial asthma in children with primary ciliary dyskinesia: two clinical cases
Maxim A. Karpenko1, Dmitriy Yu. Ovsyannikov1,2, Valeriia А. Strelnikova1,2, Nataliya I. Kolganova1,2, Oleg G. Malyshev1,2, Timofey A. Rylev1, Yana A. Samunjan1, Maria A. Rymar1, Anastasiya D. Bogoyavlenskaya1, Alena D. Koniakhina1, Anna V. Blakhina1, Andrey N. Lobov3, Alexander А. Pushkov4, Kirill V. Savostianov41 Patrice Lumumba Peoples’ Friendship University of Russia, Moscow, Russia;
2 Morozovskaya Children’s City Clinical Hospital, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia;
4 National Medical Research Center for Children’s Health, Moscow, Russia
karpenko.ma@mail.ru
Abstract
Primary ciliary dyskinesia (PCD) is a genetically determined disease characterized by structural and functional abnormalities of the cilia of the ciliated epithelium. Chronic cough, wheezing, and reversible bronchial obstruction in patients with PCD can mimic bronchial asthma (BA), leading to diagnostic and therapeutic errors. However, the combination of PCD and BA is possible and represents a special clinical situation. The article presents two clinical cases of children with genetically confirmed PCD (mutations in the CCDC39 and DNAH5 genes), in whom additional examination allowed for the diagnosis of BA. The prescription of inhaled glucocorticosteroids in combination with long-acting β2-agonists led to a sustained improvement in their condition, a reduction in the frequency of exacerbations, and an increase in exercise tolerance. The presented cases highlight the need for clinical awareness of the combination of PCD and BA, regular functional assessment of the respiratory system, and individualized therapy with mandatory regulation of physical activity and sports.
Keywords: primary ciliary dyskinesia, bronchial asthma, comorbidity, clinical cases, children.
For citation: Karpenko M.A., Ovsyannikov D.Yu., Strelnikova V.А., Kolganova N.I., Malyshev O.G., Rylev T.A., Samunjan Ya.A., Rymar M.A., Bogoyavlenskaya A.D., Koniakhina A.D., Blakhina A.V., Lobov A.N., Pushkov A.А., Savostianov K.V. Bronchial asthma in children with primary ciliary dyskinesia: two clinical cases. Clinical review for general practice. 2025; 6 (11): 16–20 (In Russ.). DOI: 10.47407/kr2025.6.11.00705

 Первичная цилиарная дискинезия (ПЦД) – редкое (частота от 1 на 2265 до 1 на 40 000 населения) генетически детерминированное заболевание с преимущественно аутосомно-рецессивным типом наследования, в основе которого лежит нарушение структуры и функции ресничек мерцательного эпителия, что приводит к снижению эффективности мукоцилиарного клиренса, хроническим инфекциям дыхательных путей, бронхоэктазам и постепенному снижению функции легких. ПЦД сопровождается обратным расположением внутренних органов (синдром Зиверта–Картагенера) в 35% случаев. За развитие ПЦД ответственны более 50 генов [1, 2]. Устанавливают диагноз ПЦД на основании данных анамнеза, оценки >5 баллов по предиктивной шкале PICADAR (PrImary CiliAry DyskinesiA Rule), по которой оценивают пациентов, имеющих персистирующий влажный кашель (см. таблицу), результатов световой и электронной микроскопии мерцательного эпителия и генетического исследования [1–4].
Первичная цилиарная дискинезия (ПЦД) – редкое (частота от 1 на 2265 до 1 на 40 000 населения) генетически детерминированное заболевание с преимущественно аутосомно-рецессивным типом наследования, в основе которого лежит нарушение структуры и функции ресничек мерцательного эпителия, что приводит к снижению эффективности мукоцилиарного клиренса, хроническим инфекциям дыхательных путей, бронхоэктазам и постепенному снижению функции легких. ПЦД сопровождается обратным расположением внутренних органов (синдром Зиверта–Картагенера) в 35% случаев. За развитие ПЦД ответственны более 50 генов [1, 2]. Устанавливают диагноз ПЦД на основании данных анамнеза, оценки >5 баллов по предиктивной шкале PICADAR (PrImary CiliAry DyskinesiA Rule), по которой оценивают пациентов, имеющих персистирующий влажный кашель (см. таблицу), результатов световой и электронной микроскопии мерцательного эпителия и генетического исследования [1–4].В связи с наличием кашля, одышки при физической нагрузке, влажных и/или сухих хрипов при аускультации легких, обратимой обструкции дыхательных путей дети с ПЦД в некоторых случаях ошибочно рассматриваются как пациенты с бронхиальной астмой (БА), что приводит к длительному и неэффективному применению ингаляционных глюкокортикостероидов (ИГКС) и бронхолитиков [5–7]. С другой стороны, сочетание ПЦД и БА также возможно, что существенно осложняет диагностику и выбор терапии [6].
Цель – представить клинические наблюдения двух детей с сочетанием ПЦД и БА, демонстрирующие диагностические и терапевтические сложности ведения таких пациентов.
Клиническое наблюдение 1
Мальчик А., 8 лет, рожденный от 2-й беременности (1-я беременность – мальчик, здоров), протекавшей без осложнений, 2-х самопроизвольных родов на 39-й неделе. Масса тела при рождении 3900 г, длина 52 см. Оценка по шкале Апгар 7/8 баллов. После рождения находился в отделении реанимации и интенсивной терапии новорожденных по поводу врожденной пневмонии, получал респираторную терапию. В грудном и раннем возрасте отмечались замедленные темпы роста. Из анамнеза известно, что с 1 мес отмечаются частые обструктивные бронхиты (всего перенес >10 раз), которые купировались ингаляционными бронхолитиками, ИГКС; круглогодичный ринит, частые эпизоды экссудативного отита, хронический влажный кашель. В рамках плановой госпитализации в 6 лет была проведена потовая проба – отрицательная, компьютерная томография (КТ) органов грудной полости (ОГП) – без патологии, КТ придаточных пазух носа – признаки полисинусита. Учитывая уровень эозинофилов 320 кл/мкл в клиническом анализе крови, уровень общего иммуноглобулина E 1104 МЕ/мл, у ребенка была заподозрена БА. Периодически получал короткие курсы ИГКС и бронхолитиков при бронхите с бронхообструктивным синдромом (БОС). Для уточнения диагноза проведена спирометрия с бронходилатационной пробой – отрицательная. Получал пробную терапию будесонидом в течение 3 мес с незначительным положительным эффектом – эпизоды БОС отмечались реже, кашель сохранялся. Учитывая наличие хронического влажного кашля, в 8 лет проведена оценка по предиктивной шкале PICADAR (8 баллов), в связи с чем был госпитализирован в пульмонологическое отделение Морозовской детской городской клинической больницы г. Москвы. При проведении КТ ОГП были выявлены бронхоэктазы средней доли правого легкого и язычковых сегментов левого легкого (рис. 1).
Учитывая оценку 8 баллов по шкале PICADAR, результаты КТ ОГП, проведено полноэкзомное секвенирование, по результатам которого в экзоне 13 гена CCDC39 выявлен нуклеотидный вариант c.1874G>T (chr3:180641993C>A; NM_181426.2) в гомозиготном состоянии, приводящий к аминокислотному варианту p.S625I. В соответствии с российским Руководством по интерпретации данных последовательности ДНК человека выявленный нуклеотидный вариант следует расценивать как вероятно патогенный, на основании чего был установлен диагноз ПЦД. В связи с сохраняющимися эпизодами БОС с быстрым эффектом бронхолитической терапии проведены аллергообследование и повторная спирометрия с бронходилатационной пробой: выявлена сенсибилизация к эпидермальным, пищевым и пыльцевым аллергенам, проба с сальбутамолом положительная (прирост объема форсированного выдоха за 1-ю секунду >12%). На основании полученных результатов был установлен диагноз БА, назначена базисная терапия III ступени в соответствии с рекомендациями GINA [8] – будесонид + формотерол (Симбикорт Рапихалер со спейсером) с положительным эффектом – эпизоды БОС прекратились, повысилась толерантность к физической нагрузке. Наблюдение за пациентом продолжается.
 Клиническое наблюдение 2
Клиническое наблюдение 2Мальчик Н., 5 лет, рожденный от 1-й беременности, протекавшей без осложнений, 1-х самопроизвольных родов на 40-й неделе. В анамнезе отмечались частые эпизоды бронхитов с БОС с положительным эффектом от терапии ингаляционными бронхолитиками и ИГКС, неоднократные госпитализации в связи с дыхательной недостаточностью 1–2-й степени, во время которых было выявлено зеркальное расположение внутренних органов (situs inversus); рис. 2.
Оценка по предиктивной шкале PICADAR составила 10 баллов. Учитывая полученные результаты, в возрасте 6 мес было проведено молекулярно-генетическое исследование. По результатам полноэкзомного секвенирования выявлены биаллельные варианты в гене DNAH5: ранее описанная инсерция со сдвигом рамки считывания, нуклеотидный вариант c.13458dup (chr5:13701316T>TA; NM_001369.3) в гетерозиготном состоянии, приводящий к аминокислотному варианту p.N4487*. В соответствии с российским Руководством по интерпретации данных последовательности ДНК человека выявленный нуклеотидный вариант следует расценивать как патогенный и ранее не описанный интронный вариант c.11212-4A>G (chr5:13737499T>C; NM_001369.3) неизвестного клинического значения. Был проведен анализ наследования вариантов от родителей, который подтвердил транс-положение вариантов. Установлен диагноз «ПЦД, синдром Зиверта–Картагенера». Также ребенок наблюдался по поводу атопического дерматита.
Несмотря на проводимую терапию ПЦД, которая включала дренажный массаж, дыхательную гимнастику, периодически отмечались эпизоды БОС с положительным эффектом от терапии ингаляционными бронхолитиками и ИГКС. На основании проявлений у ребенка рецидивирующего БОС была заподозрена БА. В возрасте 5 лет ребенку выполнена спирометрия с пробой с бронхолитиком – положительная (прирост объема форсированного выдоха за 1-ю секунду >12%), по результатам аллергообследования сенсибилизация к ингаляционным аллергенам выявлена не была. Учитывая наличие у ребенка атопического дерматита, частых эпизодов БОС, положительного эффекта от применения ИГКС, результаты спирометрии, был установлен диагноз БА. На фоне базисной терапии III ступени по GINA [8] – будесонид + формотерол (Симбикорт Рапихалер со спейсером) – эпизоды БОС больше не регистрировались, улучшилась переносимость физической нагрузки. Наблюдение за пациентом продолжается.
Обсуждение
Несмотря на наличие существенных отличий манифестации БА и ПЦД (возраст дебюта; характер кашля – сухой при БА, влажный при ПЦД; сопутствующие заболевания и проявления – атопические заболевания при БА, бронхоэктазы, чаще в средней доле, язычковых сегментах при ПЦД; эффект противоастматической терапии), дифференциальная диагностика данных заболеваний может вызывать сложности, связанные с ограничением диагностических возможностей: труднодоступность световой и электронной микроскопии мерцательного респираторного эпителия, спирометрии по месту жительства, сложности в корректном проведении данных исследований, высокая стоимость генетических исследований.
Клиническое наблюдение мальчика А. 8 лет демонстрирует трудности диагностики и терапии как БА, так и ПЦД. Хронический влажный кашель связывали с наличием постназального затека, и ребенок получал лишь симптоматическую терапию. Имеющиеся рецидивирующие бронхиты с БОС в анамнезе в комплексе с другими проявлениями уже указывали на возможность БА, а недостаточная эффективность будесонида в лечении рецидивирующих бронхитов с БОС была связана с несоответствием ступени терапии БА по GINA [8] и наличием сопутствующей ПЦД. Клиническое наблюдение мальчика Н. 5 лет демонстрирует гиподиагностику БА, возможную и при ПЦД.
Учитывая нейтрофильный тип воспаления при ПЦД, данный диагноз может стать причиной ошибочного исключения БА, для которой характерен преимущественно эозинофильный тип воспаления. Однако особенности патогенеза ПЦД, сопровождающейся стазом аллергенов на слизистой оболочке дыхательных путей, могут способствовать возникновению эозинофильного воспаления, обусловливающего манифестацию БА [9]. Согласно данным A. Owora и соавт. ПЦД повышает риск развития БА в 9 раз (отношение шансов 9,65; 95% доверительный интервал 5,20–17,90; p<0,01) [10].
Заключение
Несмотря на низкую распространенность в популяции, необходимо иметь клиническую настороженность в отношении ПЦД. В качестве скрининга можно использовать предиктивную шкалу PICADAR. Наличие рецидивирующих бронхитов с БОС у пациентов с ПЦД является веской причиной для проведения диагностики БА. Назначение противоастматической терапии позволяет повысить толерантность к физической нагрузке, рекомендуемой как важный компонент ведения больных с бронхоэктазами.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Финансирование. Исследование выполнено без спонсорской поддержки.
Acknowledgements. The study had no sponsorship.
Соответствие нормам этики. Информированное согласие от родителей пациентов получено. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Compliance with ethical standards. The patients submitted the informed consent. The study was conducted in accordance with the principles of the Declaration of Helsinki.
Информация об авторах
Information about the authors
Карпенко Максим Александрович – канд. мед. наук, доц. каф. педиатрии Медицинского института ФГАОУ ВО РУДН.
E-mail: karpenko.ma@mail.ru; ORCID: 0000-0001-7937-722X
Maksim A. Karpenko – Cand. Sci. (Med.), Associate Professor, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: karpenko.ma@mail.ru; ORCID: 0000-0001-7937-722X
Овсянников Дмитрий Юрьевич – д-р мед. наук, проф., зав. каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: ovsyannikov_dyu@pfur.ru; ORCID: 0000-0002-4961-384X
Dmitry Yu. Ovsyannikov – Dr. Sci. (Med.), Professor, Head of the Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital. E-mail: ovsyannikov_dyu@pfur.ru; ORCID: 0000-0002-4961-384X
Стрельникова Валерия Алексеевна – ассистент каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ».
E-mail: doc.strelnikova@mail.ru; ORCID: 0000-0002-2082-5531
Valeriia A. Strelnikova – Assistant, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital. E-mail: doc.strelnikova@mail.ru; ORCID: 0000-0002-2082-5531
Колганова Наталия Игоревна – аспирант каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-педиатр ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: kolganova-ni@rudn.ru; ORCID: 0000-0001-6923-6060
Nataliya I. Kolganova – Postgraduate Student, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pediatrician of Morozovskaya Children’s City Clinical Hospital. E-mail: kolganova-ni@rudn.ru; ORCID: 0000-0001-6923-6060
Малышев Олег Геннадьевич – ассистент каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: omalyshev03@vk.com; ORCID: 0000-0003-1174-0736
Oleg G. Malyshev – Assistant, Department of Pediatrics, Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia; pulmonologist of Morozovskaya Children’s City Clinical Hospital.
E-mail: omalyshev03@vk.com; ORCID: 0000-0003-1174-0736
Рылев Тимофей Андреевич – студент лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: kwensy@mail.ru; ORCID: 0009-0004-2082-0783
Timofey A. Rylev – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: kwensy@mail.ru; ORCID: 0009-0004-2082-0783
Самунджян Яна Арменаковна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: yanasamunjan@mail.ru; ORCID: 0009-0005-9878-7140
Yana A. Samunjan – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: yanasamunjan@mail.ru; ORCID: 0009-0005-9878-7140
Рымарь Мария Александровна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: marusyarym7@gmail.com; ORCID: 0009-0000-7959-3555
Maria A. Rymar – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: marusyarym7@gmail.com; ORCID: 0009-0000-7959-3555
Богоявленская Анастасия Дмитриевна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: nastya21062002@gmail.com; ORCID: 0009-0000-3444-4804
Anastasiya D. Bogoyavlenskaya – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: nastya21062002@gmail.com; ORCID: 0009-0000-3444-4804
Коняхина Алена Дмитриевна – студентка лечебного фак-та Медицинского института ФГАОУ ВО РУДН. E-mail: alna.konyakhina.02@mail.ru; ORCID: 0009-0004-5838-9909
Alena D. Koniakhina – student of the Faculty of Medicine, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: alna.konyakhina.02@mail.ru; ORCID: 0009-0004-5838-9909
Блахина Анна Владимировна – ординатор каф. дерматовенерологии, косметологии и аллергологии Медицинского института ФГАОУ ВО РУДН. E-mail: anya.blakhina@mail.ru; ORCID: 0009-0002-1224-5489
Anna V. Blakhina – Resident of the Department of Dermatovenereology, Cosmetology and Allergology of the Medical Institute, Patrice Lumumba Peoples’ Friendship University of Russia. E-mail: anya.blakhina@mail.ru; ORCID: 0009-0002-1224-5489
Лобов Андрей Николаевич – д-р мед. наук, проф., каф. реабилитации, спортивной медицины и физической культуры Института профилактической медицины им. З.П. Соловьева ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». Е-mail: a_lobov@mail.ru; ORCID: 0000-0003-2088-6139
Andrey N. Lobov – Dr. Sci. (Med.), Professor, Department of Rehabilitation, Sports Medicine and Physical Culture, Institute of Professional Education, Pirogov Russian National Research Medical University. E-mail: a_lobov@mail.ru; ORCID: 0000-0003-2088-6139
Пушков Александр Алексеевич – канд. биол. наук, вед. науч. сотр. лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей». Е-mail: pushkovgenetika@gmail.com; ORCID:0000-0001-6648-2063
Aleksandr A. Pushkov – Cand. Sci. (Biol.), Leading Researcher at the Laboratory of Medical Genomics, National Medical Research Center for Children’s Health. Е-mail: pushkovgenetika@gmail.com;
ORCID: 0000-0001-6648-2063
Савостьянов Кирилл Викторович – д-р биол. наук, начальник Медико-генетического центра, зав. лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей». E-mail: savostyanovkv@nczd.ru; ORCID:0000-0003-4885-4171
Kirill V. Savostyanov – Dr. Sci. (Biol.), Head of the Medical Gene-tic Center, Head of the Laboratory of Medical Genomics, National Medical Research Center for Children’s Health.
E-mail: savostyanovkv@nczd.ru; ORCID: 0000-0003-4885-4171
Поступила в редакцию: 31.10.2025
Поступила после рецензирования: 05.11.2025
Принята к публикации: 06.11.2025
Received: 31.10.2025
Revised: 05.11.2025
Accepted: 06.11.2025
Список исп. литературыСкрыть список1. Lucas JS, Barbato A, Collins SA et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. Eur Respir J 2016;19(1):1-26. DOI: 10.1183/13993003.01090-2016
2. Стрельникова В.А., Овсянников Д.Ю., Пушков А.А. и др. Первичная цилиарная дискинезия у детей: клиническая, лабораторно-инструментальная и генетическая характеристика. Педиатрия. Consilium Medicum. 2024;(3):280-8. DOI: 10.26442/26586630.2024.3. 202914
Strelnikova V.A., Ovsyannikov D.Yu., Pushkov A.A. et al. Primary ciliary dyskinesia in children: Clinical, laboratory-instrumental and genetic characteristics. Pediatrics. Consilium Medicum. 2024;(3):280-8. DOI: 10.26442/26586630.2024.3.202914 (in Russian).
3. Фролов П.А., Колганова Н.И., Овсянников Д.Ю. и др. Возможности ранней диагностики первичной цилиарной дискинезии. Педиатрия им. Г.Н. Сперанского. 2022;101(1):107-14. DOI: 10.24110/0031-403X-2022-101-1-107-114
Frolov P.A., Kolganova N.I., Ovsyannikov D.Yu. et al. Possibilities of early diagnosis of primary ciliary dyskinesia. Pediatria n.a. G.N. Speransky. 2022;101(1):107-14. DOI: 10.24110/0031-403X-2022-101-1-107-114 (in Russian).
4. Behan L, Dimitrov BD, Kuehni CE et al. PICADAR: a diagnostic predictive tool for primary ciliary dyskinesia. Eur Respir J 2016;47(4):1103-112. DOI: 10.1183/13993003.01551-2015
5. Levine H, Bar-On O, Nir V et al. Reversible Bronchial Obstruction in Primary Ciliary Dyskinesia. J Clin Med 2022;11(22):6791. DOI: 10.3390/jcm11226791
6. Zein J, Owora A, Kim HJ et al. Asthma Among Children With Primary Ciliary Dyskinesia. JAMA Netw Open 2024;7(12):e2449795. DOI: 10.1001/jamanetworkopen.2024.49795
7. Despotes KA, Zariwala MA, Davis SD, Ferkol TW. Primary Ciliary Dyskinesia: A Clinical Review. Cells 2024;13(11):974. DOI: 10.3390/cells13110974
8. Global Initiative for аsthma (GINA): Global strategy for asthma management and prevention. 2025. Available at: http://www.ginaasthma.org
9. Gaston B, Smith LA, Davis MD et al. Antigen stasis and airway nitrosative stress in human primary ciliary dyskinesia. Am J Physiol Lung Cell Mol Physiol 2024;326(4):L468-L476. DOI: 10.1152/ajplung.00208.2022
10. Owora A, Gaston B, Marozkina N. Asthma in primary ciliary dyskinesia: A local airway response rather than a feature of systemic allergic response. Eur Respir J 2024;64(68):PA3139.

