Клинический разбор в общей медицине №11 2025
1 Morozovskaya Children’s City Clinical Hospital, Moscow, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia;
3 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia
Abstract
A clinical case of an infant patient with orphan autoinflammatory syndrome, Blau syndrome, is presented. The issues of pathogenesis, genetics, clinical symptoms, laboratory and instrumental characteristics, as well as management tactics for patients with this pathology are considered.
The analysis of the presented clinical observation illustrates the difficulties of diagnosis and therapy of Blau syndrome.
Keywords: Blau syndrome, autoinflammatory diseases, genetics, children.
For citation: Valieva S.I., Kurbanova S.Kh., Sologub A.S., Gaziev I.R., Ovsyannikov D.Yu. Diagnostic challenges in Blau syndrome: case report of pediatric patient with confirmed NOD2 gene mutation. Clinical review for general practice. 2025; 6 (11): 27–33 (In Russ.). DOI: 10.47407/kr2025.6.11.00707
Синдром Блау (СБ) – это редкое хроническое аутовоспалительное заболевание (АВЗ), обусловленное мутациями в гене NOD2, расположенном на участке хромосомы 16q12, характеризующееся триадой симптомов: артритом, рецидивирующим увеитом и кожной сыпью в виде гранулематозного дерматита [1–3]. СБ манифестирует преимущественно у детей в возрасте до 4–5 лет [4, 5]. Из-за низкой частоты и клинического полиморфизма СБ часто ошибочно принимают за ювенильный идиопатический артрит (ЮИА) или ряд АВЗ [6, 7]. Распространенность СБ остается неясной.
СБ вызывается мутациями с усилением функции (gain-of-function) в гене NOD2 (ранее известном как CARD15), который кодирует белок 2, содержащий нуклеотидсвязывающий домен олигомеризации (NOD2), играющий важную роль во врожденном иммунитете, так как распознает компоненты бактериальной клеточной стенки [6]. Предполагается, что такие мутации приводят к неконтролируемой активации ядерного фактора каппа-B (NF-κB) – ключевого регулятора воспалительных реакций, что вызывает избыточную продукцию провоспалительных цитокинов, таких как интерлейкин (ИЛ)-1β, ИЛ-6, фактор некроза опухоли α (ФНО-α) и ИЛ-18 [8]. Вместе с тем большинство мутаций с потерей функции (loss-of-function) в NOD2 ассоциированы с болезнью Крона [9] и другими АВЗ [10]. СБ может иметь как наследственную (аутосомно-доминантную), так и спорадическую формы. При этом ранее под термином СБ понимали наследуемые (семейные) формы, а спорадические случаи описывались как саркоидоз с ранним началом [11].
У большинства пациентов в дебюте заболевания не отмечается типичной триады симптомов и присутствуют только кожные симптомы или симптомы артрита, а позднее присоединяется увеит. Вместе с тем у части пациентов классическая клиническая триада отсутствует в течение всего заболевания [12]. Таким образом, дифференциальная диагностика СБ может быть сложной из-за неспецифичности симптомов и их неодновременного появления.
Артрит при СБ, как правило, полиартикулярный, поражает мелкие и крупные суставы, чаще – суставы пальцев, лучезапястные, локтевые и коленные суставы. Вовлечение тазобедренного и височно-нижнечелюстного сустава отмечается у 9% и 3% пациентов соответственно [13]. Поражение суставов проявляется в виде мягких безболезненных припухлостей с синовиальной гипертрофией. Артрит при СБ часто описывается как «дряблый» (boggy) и характеризуется выраженным теносиновитом [14–17]. Интересно, что объем движений в суставах, как правило, сохраняется вплоть до поздних стадий заболевания. Эрозии при СБ редки, однако возможны диспластические деформации, включая камптодактилию, при которой один или несколько пальцев рук или ног постоянно согнуты; дисплазию запястья; аномальную форму локтевой и лучевой костей [4, 13, 18].
Кожные проявления являются вторыми по частоте при СБ и обычно возникают в первые месяцы жизни, предшествуя симптомам со стороны суставов. Зачастую проявляются незудящими эритематозными папулами размером с булавочную головку [19], макулопапулезной или микропапулезной, а также ихтиозоподобной сыпью [14, 20]. Биопсия кожи помогает подтвердить диагноз, выявляя признаки гранулематозного дерматита в виде наличия неказеозных гранулем [4].
Несмотря на то что дебют СБ чаще характеризуется появлением артрита и полиморфной сыпи, наиболее тяжелым проявлением заболевания является увеит. Он развивается на более поздних этапах и даже при активной иммуносупрессивной терапии нередко приводит к тяжелым офтальмологическим последствиям, включая необратимую потерю зрения [15, 21]. Воспаление сосудистой оболочки глаза при СБ чаще бывает двусторонним, хроническим, с гранулематозным или негранулематозным передним увеитом, вовлечением среднего (витреит) и заднего отделов глаза или панувеитом. При гранулематозном увеите регистрируются преципитаты, широкие задние синехии, хориоидальные и ретинальные гранулемы, макулярный отек, васкулит, витреальные мембраны [14, 15]. Осложнения, включая катаракту, лентовидную кератопатию, хориоретинальные поражения, поражение зрительного нерва (отек диска, бледность диска, узловые образования на его краях), отслойку сетчатки и глаукому, приводящие к нарушению зрения и требующие хирургического вмешательства, возникают часто, несмотря на местное и системное лечение [13, 15, 21].
Примечательно, что в некоторых исследованиях сообщается о рецидивирующей лихорадке и поражении других органов и систем (сердечно-сосудистой, нервной системы, кишечника, печени и почек) [13, 22, 23]. У пациентов с СБ описывали панникулит, гранулематозную лимфаденопатию, инфаркт мозга, саркоидные гранулемы печени, васкулит крупных сосудов, в том числе Такаясу-подобный, кардиопатию, артериальную гипертензию, гранулематозный гломерулонефрит, интерстициальный нефрит, краниальную невропатию, гранулематозное поражение яичек [3, 20, 24–26]. Поражение легких при СБ встречается крайне редко [11, 27], что отличает его от саркоидоза у взрослых.
СБ считается тяжелым и резистентным к терапии заболеванием [1]. Ввиду редкости СБ и отсутствия стандартизированных клинических рекомендаций лечение проводится на основе экспертных мнений.
Благодаря своему противовоспалительному эффекту глюкокортикостероиды (ГКС) широко применяются при СБ. Местные ГКС являются терапией первой линии для лечения кожных симптомов и увеита легкой и средней степени тяжести. Системные ГКС обычно необходимы пациентам с поражением глаз и/или суставов [20]. Одной из основных проблем у пациентов с СБ является длительное применение высоких или поддерживающих доз ГКС, более 10 мг в день, для устойчивой ремиссии заболевания, что ограничивает их использование ввиду развития побочных эффектов [28] и приводит к назначению дополнительных иммуносупрессивных препаратов в большинстве случаев [11, 29]. Помимо этого, в многоцентровом исследовании C. Roseì и соавт. (2015 г.) продемонстрировали, что только у 4 (13%) из 31 пациента заболевание оставалось неактивным на фоне терапии ГКС [13].
При увеитах в рамках СБ комбинированная местная и системная терапия ГКС остается одним из основных подходов. Однако длительное применение ГКС проблематично, особенно в высоких дозах и в детском возрасте. В метаанализе I. Maccora и соавт. (2025 г.), включавшем 11 исследований, не выявлено достаточной доказательной базы для выбора оптимальной терапии увеита при СБ. Эффективность всех препаратов оставалась низкой (20–22%). Относительная эффективность талидомида, адалимумаба и инфликсимаба требует дальнейших исследований для определения их роли в клинической практике [30]. В проспективном исследовании H. Nascimento и соавт. (2018 г.) была продемонстрирована эффективность внутриглазных инъекций ГКС в качестве адъювантной терапии при рефрактерном увеите [31]. Таким образом, увеит при СБ остается тяжелым и резистентным к терапии состоянием с высоким риском потери зрения. Перспективными направлениями являются изучение ингибиторов JAK-STAT пути, который гиперреактивен при СБ, и разработка таргетной терапии [30]. Хирургическое вмешательство может быть рассмотрено при катаракте, осложняющей зрение, после купирования воспаления [32].
Сообщалось, что низкие дозы метотрексата (10–15 мг/м² в неделю) могут быть эффективны при костно-мышечных и кожных проявлениях СБ, уменьшая симптоматику артрита и предотвращая деформации суставов [14, 33, 34], а также снижая риск осложнений со стороны глаз [23, 29, 35]. Однако при лечении метотрексатом часто требуется его комбинация с ГКС и другими иммуносупрессантами [28]. В исследовании C. Roseì с соавт. (2015 г.) метотрексат назначался 55% пациентов, однако ремиссия у данных пациентов не достигалась [13].
Талидомид, использующийся при многих ревматических заболеваниях у взрослых, благодаря своей способности подавлять сигнальный путь ФНО-α/NF-κB, может быть эффективен в контроле кожных, суставных и глазных проявлений у пациентов с СБ [11, 28, 36–38]. Однако необходим строгий мониторинг неврологических симптомов, так как прием талидомида может привести к периферической нейропатии [39].
В настоящее время наибольшую эффективность в лечении СБ демонстрируют препараты генно-инженерной биологической терапии (ГИБТ), из которых чаще всего используются ингибиторы ФНО-α. Моноклональные антитела, такие как инфликсимаб и адалимумаб, блокируют активацию макрофагов и образование гигантских клеток, предотвращая развитие гранулем [23, 40]. Данные препараты демонстрируют способность достижения длительной ремиссии, нормализуя уровень маркеров воспаления и улучшая функциональные исходы [41]. Адалимумаб, в частности, показал эффективность в контроле увеита и предотвращении потери зрения [23, 42], хотя в некоторых случаях отмечались рецидивы при увеличении интервалов между введениями [41]. Этанерцепт, растворимый рецептор ФНО-α, демонстрирует меньшую эффективность и ассоциирован с риском осложнений, таких как миелопатия, что ограничивает его применение [43].
Блокаторы ИЛ-1, включая анакинру и канакинумаб, обычно используются при неэффективности анти-ФНО-α-терапии. Данные препараты продемонстрировали потенциал в контроле рефрактерного увеита и системного воспаления [16, 44]. Так, канакинумаб позволил достичь ремиссии у пациента с устойчивым к множественным вариантам терапии увеитом [44]. Однако случаи первичной неэффективности подчеркивают вариабельность ответа и необходимость тщательного отбора пациентов [45].
На фоне применения тоцилизумаба (моноклональное антитело к рецептору ИЛ-6) при СБ в ряде случаев отмечалось клиническое улучшение [3], в других – не удалось достичь стойкой ремиссии [40]. Повышенный уровень ИЛ-6 у пациентов с СБ теоретически обосновывает использование тоцилизумаба [3, 16, 40], однако недостаточная доказательная база диктует необходимость дальнейших исследований.
Активация сигнального пути JAK-STAT, включающего янус-киназы (JAKs) и белок-трансдуктор, активатор транскрипции STAT, приводит к повышению уровней цитокинов, таких как интерферон-γ и ИЛ-6, продуцируемых Т-клетками и макрофагами, что играет ключевую роль в патогенезе СБ. Таким образом, ингибирование пути JAK-STAT может стать эффективной стратегией лечения СБ. В работе S. Zhang и соавт. (2021 г.) был продемонстрирован опыт успешного лечения трех детей с СБ ингибитором янус-киназ тофацитинибом [46].
Комбинация ГКС, иммуносупрессивных препаратов (например, метотрексата) и ГИБТ часто необходима для контроля тяжелых проявлений СБ. Длительное применение ГКС ограничено побочными эффектами, что требует раннего подключения стероидсберегающих препаратов [11, 29]. Сочетание метотрексата с анти-ФНО-α-терапией или анти-ИЛ-6-терапией повышает эффективность и снижает риск формирования нейтрализующих антител [23, 41]. Однако даже агрессивные схемы не всегда обеспечивают ремиссию, зачастую заболевание остается активным, несмотря на проводимую терапию [15, 28].
В статье представлено наблюдение ребенка раннего возраста с СБ, иллюстрирующее диагностические сложности и эффективность своевременно назначенной терапии.
Клиническое наблюдение
Мальчик, 1 год 4 мес, поступил в отделение ревматологии Морозовской детской городской клинической больницы (МДГКБ) с жалобами на длительную фебрильную лихорадку (до 39°C), полиморфную сыпь (пятнисто-папулезная с шелушением) и суставной синдром.
Из анамнеза известно, что заболевание дебютировало за месяц до поступления в отделение ревматологии с развитием рецидивирующей сыпи на туловище и конечностях. На фоне терапии местными антибактериальными и противовоспалительными средствами отмечалась минимальная положительная динамика. Через 2 нед присоединилась фебрильная лихорадка (до 39°C), что потребовало госпитализации. Во время обследования в стационаре были выявлены лейкоцитоз (22,1×109/л) с доминированием нейтрофилов, повышение С-реактивного белка (СРБ) до 151 мг/л, назначена антибактериальная терапия (цефтриаксон). При проведении эхокардиографии (ЭхоКГ) размеры полостей сердца были в пределах нормы, толщина миокарда – в пределах нормы, коронарные артерии не расширены. Через 5 дней от начала антибактериальной терапии от дальнейшего нахождения в стационаре мать отказалась. Спустя 1 нед ребенок был вновь госпитализирован, установлен диагноз «болезнь Кавасаки». Получал внутривенный иммуноглобулин в дозе 2 г/кг, ацетилсалициловую кислоту 50 мг/кг, однако несмотря на проводимую терапию сохранялась фебрильная лихорадка, ввиду чего ребенок был переведен в отделение ревматологии МДГКБ.
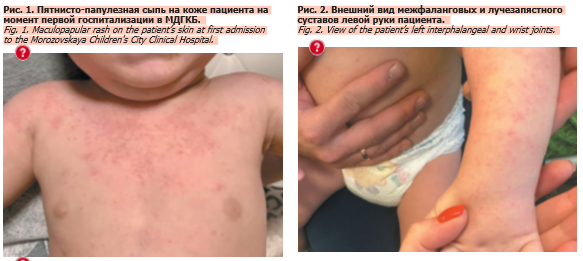
 При поступлении наблюдались фебрильная лихорадка (до 39°C) и полиморфная сыпь (на лице, туловище и конечностях) – папулезно-пятнистые элементы с участками шелушения, без зуда (рис. 1). Суставной синдром не регистрировался. На фоне проводимой антибактериальной терапии (меропенем) сохранялось повышение температуры тела до 38°С один раз в день в утренние часы, сыпь без динамики. В анализах крови воспалительная активность (в динамике СРБ с нарастанием до 149 мг/л, уровень прокальцитонина в норме, посевы крови роста не дали). При ЭхоКГ была обнаружена эктазия ствола левой коронарной артерии, при этом клапаны сердца – без значимых нарушений структуры и функции, размеры полостей сердца, перегородки сердца, сократимость левого желудочка – в пределах нормы, фракция выброса левого желудочка 65%. Произведена смена антибактериальной терапии (добавлен ванкомицин), проведено введение внутривенного иммуноглобулина из расчета 2 г/кг.
При поступлении наблюдались фебрильная лихорадка (до 39°C) и полиморфная сыпь (на лице, туловище и конечностях) – папулезно-пятнистые элементы с участками шелушения, без зуда (рис. 1). Суставной синдром не регистрировался. На фоне проводимой антибактериальной терапии (меропенем) сохранялось повышение температуры тела до 38°С один раз в день в утренние часы, сыпь без динамики. В анализах крови воспалительная активность (в динамике СРБ с нарастанием до 149 мг/л, уровень прокальцитонина в норме, посевы крови роста не дали). При ЭхоКГ была обнаружена эктазия ствола левой коронарной артерии, при этом клапаны сердца – без значимых нарушений структуры и функции, размеры полостей сердца, перегородки сердца, сократимость левого желудочка – в пределах нормы, фракция выброса левого желудочка 65%. Произведена смена антибактериальной терапии (добавлен ванкомицин), проведено введение внутривенного иммуноглобулина из расчета 2 г/кг.
При компьютерной томографии органов грудной клетки с контрастированием выявлены гиповентиляционные изменения, малый гидроторакс слева, интерстициальные изменения в базальных отделах легких, внутригрудная и подмышечная лимфаденопатия.
На компьютерной томографии органов брюшной полости с внутривенным введением контрастного вещества – гепатоспленомегалия, снижение плотности паренхимы печени, единичный конкремент в правом надпочечнике. При исследовании пунктата костного мозга данных в пользу онкогематологических заболеваний не получено.
Учитывая возраст дебюта, длительную лихорадку, отсутствие эффекта от проводимой терапии, исключение объемных, лимфопролиферативных образований, лейкоза ребенку был установлен диагноз «ЮИА с системным началом, активность 3-й степени, рентгенологическая стадия I, функциональный класс 2». Была инициирована ГИБТ препаратом анакинра (антагонист рецептора ИЛ-1, 2 мг/кг в сутки). На фоне отсутствия клинического ответа (сохранение лихорадки, отсутствие динамики сыпи, воспалительные изменения по лабораторным данным) произведена смена ГИБТ на тоцилизумаб (антитела к рецептору ИЛ-6, 12 мг/кг на введение) в комбинации с пульс-терапией метилпреднизолоном. Зарегистрирован клинический ответ на проводимую терапию в виде нормализации температуры тела, уменьшения сыпи, купирования маркеров воспалительной активности по данным лабораторного обследования.
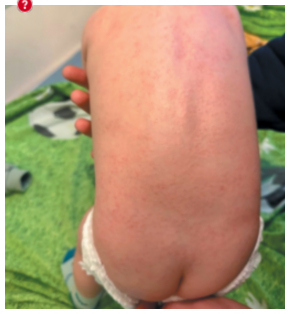
Через 1 мес ребенок поступил в отделение для планового введения тоцилизумаба и контроля лабораторных анализов крови. При осмотре зарегистрировано развитие суставного синдрома (рис. 2): пастозность и ограничение движения в лучезапястных суставах, припухлость межфаланговых суставов обеих кистей, со слов родителей утренней скованности не отмечалось. По данным ультразвукового исследования суставов определялись однородный жидкостной компонент в небольшом количестве в обоих лучезапястных суставах, умеренная инфильтрация окружающих мягких тканей межфаланговых суставов кистей с обеих сторон без признаков скопления жидкости в проекции суставов. Согласно лабораторным данным, сохранялись воспалительная активность (лейкоцитоз 28,9 тыс./мкл, СРБ 12,4 мг/л), тромбоцитоз (459×109/л). Проведена инфузия тоцилизумабом внутривенно из расчета 12 мг/кг на введение. Учитывая развитие суставного синдрома, инициирована терапия метотрексатом 7,5 мг подкожно.
При госпитализации по поводу 3-го введения тоцилизумаба отмечались отек, ограничение сгибания и разгибания лучезапястных суставов, отек межфаланговых суставов всех пальцев (кроме большого) на руках и ногах, утренняя скованность не регистрировалась. Лабораторно отмечалась нормализация показателей общего анализа крови и СРБ.
В динамике через 6 мес от старта терапии тоцилизумабом состояние ребенка – с выраженной положительной динамикой: кожные покровы чистые от сыпи, эпизодов лихорадки не отмечалось, суставной синдром сохранялся в виде незначительной отечности межфаланговых суставов. При ультразвуковом исследовании межфаланговых и лучезапястных суставов в их проекции – без признаков структурной патологии и патологического жидкостного содержимого, визуализируемые фрагменты синовиальной оболочки не утолщены, сухожильно-связочный аппарат без особенностей, окружающие мягкие ткани не изменены. На компьютерных томограммах органов грудной клетки очаговых и инфильтративных изменений в легких не выявлено. Важно отметить, что во все госпитализации ребенок осматривался офтальмологом, данных в пользу увеита и другой офтальмопатологии не получено.
С 2023 г. в отделении ревматологии МДГКБ детям с диагнозом системной формы ЮИА проводится генетическое исследование с целью исключения моногенных АВЗ. При секвенировании 119 генов, ассоциированных с АВЗ, у пациента была идентифицирована гетерозиготная мутация в гене NOD2 (c.1001G>A, p.Arg334Gln), классифицируемая как патогенная (OMIM: 605956.0004, dbSNP: rs104895461). Наличие данной мутации в сочетании с клиническими и лабораторными признаками позволило диагностировать СБ. Таким образом, верификация диагноза у нашего пациента состоялась через 5 мес от дебюта первых симптомов СБ.
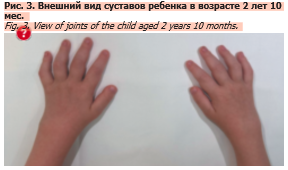
На момент последней госпитализации возраст ребенка 2 года 10 мес. При осмотре лучезапястных суставов отмечались ограничения сгибания и разгибания, в области межфаланговых суставов всех пальцев, кроме большого, выраженный отек, формирующаяся камптодактилия (рис. 3). Помимо этого регистрировался суставной синдром в обоих коленных суставах с изменением походки (деформация суставов с формированием контрактур). Ребенок осмотрен офтальмологом, выявлены кератоконъюнктивит слева, субэпителиальные инфильтраты роговицы. Со слов матери известно, что за полгода до последней госпитализации ребенок амбулаторно получал лечение по поводу кератоконъюнктивита с инфильтратами в роговице.
Учитывая отрицательную динамику, к терапии подключен тофацитиниб (ингибитор янус-киназ, 2,5 мг 2 раза в день). Продолжено наблюдение.
 Обсуждение
Обсуждение
У пациентов с СБ часто диагностируется ЮИА. В исследовании Z. Zhong и соавт. (2024 г.) целевое секвенирование гена NOD2, выполненное у 123 пациентов с ранее установленным диагнозом ЮИА, у которых наблюдались увеит или кожные поражения на фоне артрита, подтвердило молекулярный диагноз СБ у 26 (21%) больных и привело к изменению тактики лечения у 10 из них. Таким образом, секвенирование NOD2 для пересмотра диагноза ЮИА является важной частью ведения данной группы пациентов, в особенности при наличии дополнительных клинических признаков, указывающих на СБ [47]. У ребенка в нашем клиническом наблюдении не было никаких офтальмологических симптомов, однако наличие артрита с длительно сохраняющимися и рецидивирующими кожными проявлениями может требовать исключения СБ у пациентов с ранее диагностируемым ЮИА. Кроме того, после верификации СБ у нашего пациента не требовалось проводить смену терапии, учитывая хороший эффект от лечения тоцилизумабом. При наличии увеита важным для дифференциальной диагностики является тот факт, что воспаление при увеите, ассоциированном с ЮИА, ограничивается передним сегментом глаза, тогда как СБ может привести к выраженным воспалительным поражениям глазного дна [6]. Кожный синдром при СБ часто ошибочно принимается за атопический дерматит или сыпь, ассоциированную с аллергической реакцией [20]. Так, в нашем клиническом наблюдении сыпь у ребенка в первые месяцы жизни расценивалась как проявления атопического дерматита.
Ошибочная диагностика СБ как болезни Кавасаки с последующим назначением внутривенного иммуноглобулина, как в нашем клиническом наблюдении, также описана в литературе. K. Cho и соавт. (2022 г.) представили наблюдение 13-месячного мальчика с рецидивирующей лихорадкой и генерализованной сыпью, у которого изначально была диагностирована болезнь Кавасаки с рефрактерным течением. Пациент поступил в стационар с температурой тела 38,7°C, конъюнктивальной инъекцией, генерализованной эритематозно-папулезной сыпью и увеличением шейных лимфатических узлов. Лабораторные анализы выявили лейкоцитоз, анемию, повышенный уровень СРБ и NT-proBNP.
Несмотря на двукратное лечение внутривенным иммуноглобулином и высокими дозами ГКС, симптомы сохранялись, что потребовало углубленного обследования. Была выполнена биопсия кожи, обнаружившая неказеозные гранулемы. Генетическое исследование подтвердило диагноз СБ (гетерозиготная мутация p.Arg334Trp в гене NOD2). В динамике у данного пациента развились системные осложнения: асцит, плевральный выпот и гепатоспленомегалия, потребовавшие назначения пульс-терапии метилпреднизолоном с последующим переходом на пероральный преднизолон и метотрексат. Несмотря на первоначальный ответ, в возрасте 3 лет присоединился артрит коленных суставов, что стало показанием для введения адалимумаба – ингибитора ФНО-α. К 4 годам у пациента развился передний увеит, купированный топическими ГКС [48]. Таким образом, ключевыми дифференциально-диагностическими признаками СБ и болезни Кавасаки являются отсутствие при СБ изменений на слизистых оболочках и коронарных осложнений, а также гистологическое подтверждение неказеозных гранулем. Однако проведение инвазивной биопсии может быть недоступным и проведение секвенирования гена NOD2 является предпочтительной стратегией. В целом при резистентности к терапии у пациентов с подозрением на ЮИА или болезнь Кавасаки целесообразно проведение секвенирования гена NOD2 для исключения СБ, что позволяет своевременно скорректировать лечение.
Отмечается широкая вариабельность симптомов у пациентов с СБ. У некоторых больных отмечается только классическая триада симптомов, у других данная триада не регистрируется. Могут быть вовлечены и другие органы и системы помимо кожи, глаз и суставов. Остается неясным, с чем связана данная вариабельность даже у пациентов с одной и той же мутацией гена NOD2. В работе C. Córdova-Fletes и соавт. (2020 г.), включающей описание трех пациентов с СБ, у всех детей были обнаружены патогенные варианты в других генах (PRR12, TLR10, MEFV, SLC22A5), у 1 ребенка – мутация в гене MEFV, ассоциированная с семейной средиземноморской лихорадкой, что может объяснять комбинированный фенотип в виде сочетания симптомов СБ и рецидивирующего полисерозита [49].
У ребенка в описанном нами клиническом наблюдении в гене NOD2 была выявлена гетерозиготная мутация p.Arg334Gln, локализующаяся в нуклеотидсвязывающем домене, влияющем на активность аденозинтрифосфатазы и активацию NF-κB [17]. Данная мутация является одной из наиболее распространенных при СБ и обычно характеризуется типичным фенотипом СБ. Однако описаны и редкие варианты клинической презентации у пациентов с данной мутацией. Так, в работе M. Whyte и соавт. (2018 г.) представлено клиническое наблюдение 4-летней девочки, у которой наблюдались тяжелая гиперкальциемия (до 13,6 мг/дл), вызванная избыточной продукцией 1,25-дигидроксивитамина D – 1,25(OH)₂D, нефрокальциноз, нарушение функции почек и генерализованный остеосклероз, имитирующий остеопетроз. При рентгенологическом исследовании у ребенка были выявлены диффузное повышение плотности костей, синовит и теносиновит, а при гистопатологическом исследовании костного мозга – сохранение нерезорбированного хряща, что характерно для остеопетроза, однако маркеры костного обмена указывали на активный метаболизм. Ребенок получал лечение ГКС (преднизолон), метотрексатом и ингибиторами ФНО-α (адалимумаб, инфликсимаб), что привело к нормализации уровня кальция, подавлению уровня 1,25(OH)₂D, улучшению функции почек и уменьшению суставных симптомов. Спонтанное разрешение метафизарного остеосклероза произошло на фоне диеты с ограничением кальция. Таким образом, у ребенка в данном наблюдении отмечалось отсутствие классических проявлений СБ при наличии тяжелой гиперкальциемии и остеосклероза, что подтверждает влияние мутаций гена NOD2 на остеокластогенез и внепочечный синтез 1,25(OH)₂D посредством нарушения регуляции NF-κB, доказательством чего является эффективность противовоспалительной терапии в коррекции метаболических и почечных нарушений [50].
Артериит средних и крупных сосудов является редким клиническим проявлением у пациентов с СБ [12]. Тщательное обследование периферического пульса и регулярное измерение артериального давления могут способствовать раннему выявлению сосудистых осложнений. Однако, как демонстрирует наше клиническое наблюдение, поражение коронарных артерий также требует внимания, несмотря на отсутствие типичных для СБ изменений в крупных сосудах. У описанного нами пациента с подтвержденным диагнозом на ЭхоКГ выявлена эктазия левой коронарной артерии, что расширяет спектр возможных сосудистых осложнений СБ и подчеркивает необходимость регулярного кардиологического мониторинга даже при отсутствии классических признаков артериита.
В нашем наблюдении у ребенка отмечена отчетливая положительная динамика на фоне инициации терапии тоцилизумабом, однако в последующем было зарегистрировано ухудшение состояния в виде прогрессирования суставного синдрома, развития камптодактилии, формирования контрактур в коленных суставах, появления изменений со стороны глаз (кератоконъюнктивит с инфильтратами роговицы), что потребовало усиления терапии тофацитинибом. Исходя из данных литературы, действительно, не у всех детей удается достичь стойкого эффекта на одном препарате ГИБТ. Так, в работе Т. Nagakura и соавт. (2017 г.) сообщалось об улучшении клинической картины на фоне терапии тоцилизумабом с последующим рецидивом артрита у одного ребенка, а также о необходимости смены терапии ввиду наличия иммуноглобулинов Е к тоцилизумабу у другого пациента [40]. Сложность подбора эффективной терапии обусловлена редкостью СБ, отсутствием стандартизированных протоколов и высокой вариабельностью ответа на различные препараты ГИБТ, такие как анти-ИЛ-6 (тоцилизумаб), анти-ФНО-α (адалимумаб, инфликсимаб), анти-ИЛ-1 (анакинра, канакинумаб) и ингибиторы янус-киназ (тофацитиниб), что подтверждается как данным клиническим наблюдением (первоначальный ответ на тоцилизумаб с последующей потерей эффективности), так и описанными в литературе [16, 23, 30–34, 36–38, 41, 42, 46, 51]. Необходимы индивидуальный подбор терапии и готовность к смене класса препарата при неэффективности или потере ответа.
Заключение
Представленное клиническое наблюдение подчеркивает ключевые диагностические и терапевтические сложности при СБ и необходимость тщательного дифференцированного подхода. Неполная или атипичная манифестация классической триады (дерматит, артрит, увеит), а также сходство симптомов с ЮИА или болезнью Кавасаки нередко приводят к ошибочной интерпретации клинической картины. При подозрении на СБ целевое секвенирование гена NOD2 позволяет установить диагноз. В свою очередь, ранняя верификация диагноза позволяет своевременно назначить патогенетическую терапию и предотвратить необратимые осложнения. Междисциплинарное взаимодействие (педиатр, ревматолог, офтальмолог, генетик, кардиолог) и персонализированный подход остаются основой успешного ведения пациентов с этим редким АВЗ.
Информация о финансировании. Исследование выполнено за счет гранта Московского центра инновационных технологий в здравоохранении на реализацию научно-практического проекта в сфере медицины (проект №1803-14).
Funding information. The study was supported by a grant from the Moscow Center for Innovative Technologies in Healthcare for the implementation of a scientific-practical project in medicine (Project No. 1803-14).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информированное согласие. Авторы получили письменное согласие законных представителей пациента на публикацию медицинских данных и фотографий.
Informed consent. Written informed consent was obtained from the patient’s legal representatives for the publication of medical data and photographs.
Информация об авторах
Information about the authors
Валиева Сания Ириковна – д-р мед. наук, зам. глав. врача по медицинской части и научно-образовательной работе ГБУЗ «Морозовская ДГКБ ДЗМ», проф. каф. педиатрии им. акад. М.Я. Студеникина ИКМ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: valieva.sania@yandex.ru; ORCID: 0009-0009-6241-9142
Saniya I. Valieva – Dr. Sci. (Med.), Deputy Chief Physician, Morozovskaya Children’s City Clinical Hospital, Professor, Pirogov Russian National Research Medical University. E-mail: valieva.sania@yandex.ru; ORCID: 0009-0009-6241-9142
Курбанова Седа Хасановна – канд. мед. наук, зав. отд-ния ревматологии ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: seda2709@mail.ru; ORCID: 0000-0003-0509-1055
Seda Kh. Kurbanova – Cand. Sci. (Med.), Head of the Rheumatology Department, Morozovskaya Children’s City Clinical Hospital.
E-mail: seda2709@mail.ru; ORCID: 0000-0003-0509-1055
Сологуб Анна Сергеевна – врач-ревматолог отд-ния ревматологии ГБУЗ «Морозовская ДГКБ ДЗМ»
Anna S. Sologub – rheumatologist, Morozovskaya Children’s City Clinical Hospital
Газиев Иван Рубенович – врач клинической лабораторной диагностики молекулярно-биологической лаборатории ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: gazi3003@yandex.ru; ORCID: 0009-0006-8751-0434
Ivan R. Gaziev – Medical Doctor in Clinical Laboratory Diagnostics, Morozovskaya Children’s City Clinical Hospital. E-mail: gazi3003@yandex.ru; ORCID: 0009-0006-8751-0434
Овсянников Дмитрий Юрьевич – д-р мед. наук, проф., зав. каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: mdovsyannikov@yahoo.com; ORCID: 0000-0002-4961-384X
Dmitry Yu. Ovsyannikov – Dr. Sci. (Med.), Professor, Head of the Department of Pediatrics, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: mdovsyannikov@yahoo.com; ORCID: 0000-0002-4961-384X
Поступила в редакцию: 10.07.2025
Поступила после рецензирования: 18.07.2025
Принята к публикации: 24.07.2025
Received: 10.07.2025
Revised: 18.07.2025
Accepted: 24.07.2025
Клинический разбор в общей медицине №11 2025
Трудности диагностики и терапии синдрома Блау: клиническое наблюдение ребенка раннего возраста с верифицированной мутацией в гене NOD2
Номера страниц в выпуске:27-33
Аннотация
Представлено клиническое наблюдение пациента раннего возраста с орфанным аутовоспалительным синдромом – синдромом Блау. Рассмотрены вопросы патогенеза, генетики, клинические симптомы, лабораторно-инструментальные характеристики, а также тактика ведения пациентов с данной патологией. Анализ представленного клинического наблюдения иллюстрирует трудности диагностики и терапии синдрома Блау.
Ключевые слова: синдром Блау, аутовоспалительные заболевания, генетика, дети.
Для цитирования: Валиева С.И., Курбанова С.Х., Сологуб А.С., Газиев И.Р., Овсянников Д.Ю. Трудности диагностики и терапии синдрома Блау: клиническое наблюдение ребенка раннего возраста с верифицированной мутацией в гене NOD2. Клинический разбор в общей медицине. 2025; 6 (11): 27–33. DOI: 10.47407/kr2025.6.11.00707
Представлено клиническое наблюдение пациента раннего возраста с орфанным аутовоспалительным синдромом – синдромом Блау. Рассмотрены вопросы патогенеза, генетики, клинические симптомы, лабораторно-инструментальные характеристики, а также тактика ведения пациентов с данной патологией. Анализ представленного клинического наблюдения иллюстрирует трудности диагностики и терапии синдрома Блау.
Ключевые слова: синдром Блау, аутовоспалительные заболевания, генетика, дети.
Для цитирования: Валиева С.И., Курбанова С.Х., Сологуб А.С., Газиев И.Р., Овсянников Д.Ю. Трудности диагностики и терапии синдрома Блау: клиническое наблюдение ребенка раннего возраста с верифицированной мутацией в гене NOD2. Клинический разбор в общей медицине. 2025; 6 (11): 27–33. DOI: 10.47407/kr2025.6.11.00707
Diagnostic challenges in Blau syndrome: case report of pediatric patient with confirmed NOD2 gene mutation
Saniya I. Valieva1,2, Seda Kh. Kurbanova1, Anna S. Sologub1, Ivan R. Gaziev1, Dmitry Yu. Ovsyannikov1,31 Morozovskaya Children’s City Clinical Hospital, Moscow, Russia;
2 Pirogov Russian National Research Medical University, Moscow, Russia;
3 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia
Abstract
A clinical case of an infant patient with orphan autoinflammatory syndrome, Blau syndrome, is presented. The issues of pathogenesis, genetics, clinical symptoms, laboratory and instrumental characteristics, as well as management tactics for patients with this pathology are considered.
The analysis of the presented clinical observation illustrates the difficulties of diagnosis and therapy of Blau syndrome.
Keywords: Blau syndrome, autoinflammatory diseases, genetics, children.
For citation: Valieva S.I., Kurbanova S.Kh., Sologub A.S., Gaziev I.R., Ovsyannikov D.Yu. Diagnostic challenges in Blau syndrome: case report of pediatric patient with confirmed NOD2 gene mutation. Clinical review for general practice. 2025; 6 (11): 27–33 (In Russ.). DOI: 10.47407/kr2025.6.11.00707
Синдром Блау (СБ) – это редкое хроническое аутовоспалительное заболевание (АВЗ), обусловленное мутациями в гене NOD2, расположенном на участке хромосомы 16q12, характеризующееся триадой симптомов: артритом, рецидивирующим увеитом и кожной сыпью в виде гранулематозного дерматита [1–3]. СБ манифестирует преимущественно у детей в возрасте до 4–5 лет [4, 5]. Из-за низкой частоты и клинического полиморфизма СБ часто ошибочно принимают за ювенильный идиопатический артрит (ЮИА) или ряд АВЗ [6, 7]. Распространенность СБ остается неясной.
СБ вызывается мутациями с усилением функции (gain-of-function) в гене NOD2 (ранее известном как CARD15), который кодирует белок 2, содержащий нуклеотидсвязывающий домен олигомеризации (NOD2), играющий важную роль во врожденном иммунитете, так как распознает компоненты бактериальной клеточной стенки [6]. Предполагается, что такие мутации приводят к неконтролируемой активации ядерного фактора каппа-B (NF-κB) – ключевого регулятора воспалительных реакций, что вызывает избыточную продукцию провоспалительных цитокинов, таких как интерлейкин (ИЛ)-1β, ИЛ-6, фактор некроза опухоли α (ФНО-α) и ИЛ-18 [8]. Вместе с тем большинство мутаций с потерей функции (loss-of-function) в NOD2 ассоциированы с болезнью Крона [9] и другими АВЗ [10]. СБ может иметь как наследственную (аутосомно-доминантную), так и спорадическую формы. При этом ранее под термином СБ понимали наследуемые (семейные) формы, а спорадические случаи описывались как саркоидоз с ранним началом [11].
У большинства пациентов в дебюте заболевания не отмечается типичной триады симптомов и присутствуют только кожные симптомы или симптомы артрита, а позднее присоединяется увеит. Вместе с тем у части пациентов классическая клиническая триада отсутствует в течение всего заболевания [12]. Таким образом, дифференциальная диагностика СБ может быть сложной из-за неспецифичности симптомов и их неодновременного появления.
Артрит при СБ, как правило, полиартикулярный, поражает мелкие и крупные суставы, чаще – суставы пальцев, лучезапястные, локтевые и коленные суставы. Вовлечение тазобедренного и височно-нижнечелюстного сустава отмечается у 9% и 3% пациентов соответственно [13]. Поражение суставов проявляется в виде мягких безболезненных припухлостей с синовиальной гипертрофией. Артрит при СБ часто описывается как «дряблый» (boggy) и характеризуется выраженным теносиновитом [14–17]. Интересно, что объем движений в суставах, как правило, сохраняется вплоть до поздних стадий заболевания. Эрозии при СБ редки, однако возможны диспластические деформации, включая камптодактилию, при которой один или несколько пальцев рук или ног постоянно согнуты; дисплазию запястья; аномальную форму локтевой и лучевой костей [4, 13, 18].
Кожные проявления являются вторыми по частоте при СБ и обычно возникают в первые месяцы жизни, предшествуя симптомам со стороны суставов. Зачастую проявляются незудящими эритематозными папулами размером с булавочную головку [19], макулопапулезной или микропапулезной, а также ихтиозоподобной сыпью [14, 20]. Биопсия кожи помогает подтвердить диагноз, выявляя признаки гранулематозного дерматита в виде наличия неказеозных гранулем [4].
Несмотря на то что дебют СБ чаще характеризуется появлением артрита и полиморфной сыпи, наиболее тяжелым проявлением заболевания является увеит. Он развивается на более поздних этапах и даже при активной иммуносупрессивной терапии нередко приводит к тяжелым офтальмологическим последствиям, включая необратимую потерю зрения [15, 21]. Воспаление сосудистой оболочки глаза при СБ чаще бывает двусторонним, хроническим, с гранулематозным или негранулематозным передним увеитом, вовлечением среднего (витреит) и заднего отделов глаза или панувеитом. При гранулематозном увеите регистрируются преципитаты, широкие задние синехии, хориоидальные и ретинальные гранулемы, макулярный отек, васкулит, витреальные мембраны [14, 15]. Осложнения, включая катаракту, лентовидную кератопатию, хориоретинальные поражения, поражение зрительного нерва (отек диска, бледность диска, узловые образования на его краях), отслойку сетчатки и глаукому, приводящие к нарушению зрения и требующие хирургического вмешательства, возникают часто, несмотря на местное и системное лечение [13, 15, 21].
Примечательно, что в некоторых исследованиях сообщается о рецидивирующей лихорадке и поражении других органов и систем (сердечно-сосудистой, нервной системы, кишечника, печени и почек) [13, 22, 23]. У пациентов с СБ описывали панникулит, гранулематозную лимфаденопатию, инфаркт мозга, саркоидные гранулемы печени, васкулит крупных сосудов, в том числе Такаясу-подобный, кардиопатию, артериальную гипертензию, гранулематозный гломерулонефрит, интерстициальный нефрит, краниальную невропатию, гранулематозное поражение яичек [3, 20, 24–26]. Поражение легких при СБ встречается крайне редко [11, 27], что отличает его от саркоидоза у взрослых.
СБ считается тяжелым и резистентным к терапии заболеванием [1]. Ввиду редкости СБ и отсутствия стандартизированных клинических рекомендаций лечение проводится на основе экспертных мнений.
Благодаря своему противовоспалительному эффекту глюкокортикостероиды (ГКС) широко применяются при СБ. Местные ГКС являются терапией первой линии для лечения кожных симптомов и увеита легкой и средней степени тяжести. Системные ГКС обычно необходимы пациентам с поражением глаз и/или суставов [20]. Одной из основных проблем у пациентов с СБ является длительное применение высоких или поддерживающих доз ГКС, более 10 мг в день, для устойчивой ремиссии заболевания, что ограничивает их использование ввиду развития побочных эффектов [28] и приводит к назначению дополнительных иммуносупрессивных препаратов в большинстве случаев [11, 29]. Помимо этого, в многоцентровом исследовании C. Roseì и соавт. (2015 г.) продемонстрировали, что только у 4 (13%) из 31 пациента заболевание оставалось неактивным на фоне терапии ГКС [13].
При увеитах в рамках СБ комбинированная местная и системная терапия ГКС остается одним из основных подходов. Однако длительное применение ГКС проблематично, особенно в высоких дозах и в детском возрасте. В метаанализе I. Maccora и соавт. (2025 г.), включавшем 11 исследований, не выявлено достаточной доказательной базы для выбора оптимальной терапии увеита при СБ. Эффективность всех препаратов оставалась низкой (20–22%). Относительная эффективность талидомида, адалимумаба и инфликсимаба требует дальнейших исследований для определения их роли в клинической практике [30]. В проспективном исследовании H. Nascimento и соавт. (2018 г.) была продемонстрирована эффективность внутриглазных инъекций ГКС в качестве адъювантной терапии при рефрактерном увеите [31]. Таким образом, увеит при СБ остается тяжелым и резистентным к терапии состоянием с высоким риском потери зрения. Перспективными направлениями являются изучение ингибиторов JAK-STAT пути, который гиперреактивен при СБ, и разработка таргетной терапии [30]. Хирургическое вмешательство может быть рассмотрено при катаракте, осложняющей зрение, после купирования воспаления [32].
Сообщалось, что низкие дозы метотрексата (10–15 мг/м² в неделю) могут быть эффективны при костно-мышечных и кожных проявлениях СБ, уменьшая симптоматику артрита и предотвращая деформации суставов [14, 33, 34], а также снижая риск осложнений со стороны глаз [23, 29, 35]. Однако при лечении метотрексатом часто требуется его комбинация с ГКС и другими иммуносупрессантами [28]. В исследовании C. Roseì с соавт. (2015 г.) метотрексат назначался 55% пациентов, однако ремиссия у данных пациентов не достигалась [13].
Талидомид, использующийся при многих ревматических заболеваниях у взрослых, благодаря своей способности подавлять сигнальный путь ФНО-α/NF-κB, может быть эффективен в контроле кожных, суставных и глазных проявлений у пациентов с СБ [11, 28, 36–38]. Однако необходим строгий мониторинг неврологических симптомов, так как прием талидомида может привести к периферической нейропатии [39].
В настоящее время наибольшую эффективность в лечении СБ демонстрируют препараты генно-инженерной биологической терапии (ГИБТ), из которых чаще всего используются ингибиторы ФНО-α. Моноклональные антитела, такие как инфликсимаб и адалимумаб, блокируют активацию макрофагов и образование гигантских клеток, предотвращая развитие гранулем [23, 40]. Данные препараты демонстрируют способность достижения длительной ремиссии, нормализуя уровень маркеров воспаления и улучшая функциональные исходы [41]. Адалимумаб, в частности, показал эффективность в контроле увеита и предотвращении потери зрения [23, 42], хотя в некоторых случаях отмечались рецидивы при увеличении интервалов между введениями [41]. Этанерцепт, растворимый рецептор ФНО-α, демонстрирует меньшую эффективность и ассоциирован с риском осложнений, таких как миелопатия, что ограничивает его применение [43].
Блокаторы ИЛ-1, включая анакинру и канакинумаб, обычно используются при неэффективности анти-ФНО-α-терапии. Данные препараты продемонстрировали потенциал в контроле рефрактерного увеита и системного воспаления [16, 44]. Так, канакинумаб позволил достичь ремиссии у пациента с устойчивым к множественным вариантам терапии увеитом [44]. Однако случаи первичной неэффективности подчеркивают вариабельность ответа и необходимость тщательного отбора пациентов [45].
На фоне применения тоцилизумаба (моноклональное антитело к рецептору ИЛ-6) при СБ в ряде случаев отмечалось клиническое улучшение [3], в других – не удалось достичь стойкой ремиссии [40]. Повышенный уровень ИЛ-6 у пациентов с СБ теоретически обосновывает использование тоцилизумаба [3, 16, 40], однако недостаточная доказательная база диктует необходимость дальнейших исследований.
Активация сигнального пути JAK-STAT, включающего янус-киназы (JAKs) и белок-трансдуктор, активатор транскрипции STAT, приводит к повышению уровней цитокинов, таких как интерферон-γ и ИЛ-6, продуцируемых Т-клетками и макрофагами, что играет ключевую роль в патогенезе СБ. Таким образом, ингибирование пути JAK-STAT может стать эффективной стратегией лечения СБ. В работе S. Zhang и соавт. (2021 г.) был продемонстрирован опыт успешного лечения трех детей с СБ ингибитором янус-киназ тофацитинибом [46].
Комбинация ГКС, иммуносупрессивных препаратов (например, метотрексата) и ГИБТ часто необходима для контроля тяжелых проявлений СБ. Длительное применение ГКС ограничено побочными эффектами, что требует раннего подключения стероидсберегающих препаратов [11, 29]. Сочетание метотрексата с анти-ФНО-α-терапией или анти-ИЛ-6-терапией повышает эффективность и снижает риск формирования нейтрализующих антител [23, 41]. Однако даже агрессивные схемы не всегда обеспечивают ремиссию, зачастую заболевание остается активным, несмотря на проводимую терапию [15, 28].
В статье представлено наблюдение ребенка раннего возраста с СБ, иллюстрирующее диагностические сложности и эффективность своевременно назначенной терапии.
Клиническое наблюдение
Мальчик, 1 год 4 мес, поступил в отделение ревматологии Морозовской детской городской клинической больницы (МДГКБ) с жалобами на длительную фебрильную лихорадку (до 39°C), полиморфную сыпь (пятнисто-папулезная с шелушением) и суставной синдром.
Из анамнеза известно, что заболевание дебютировало за месяц до поступления в отделение ревматологии с развитием рецидивирующей сыпи на туловище и конечностях. На фоне терапии местными антибактериальными и противовоспалительными средствами отмечалась минимальная положительная динамика. Через 2 нед присоединилась фебрильная лихорадка (до 39°C), что потребовало госпитализации. Во время обследования в стационаре были выявлены лейкоцитоз (22,1×109/л) с доминированием нейтрофилов, повышение С-реактивного белка (СРБ) до 151 мг/л, назначена антибактериальная терапия (цефтриаксон). При проведении эхокардиографии (ЭхоКГ) размеры полостей сердца были в пределах нормы, толщина миокарда – в пределах нормы, коронарные артерии не расширены. Через 5 дней от начала антибактериальной терапии от дальнейшего нахождения в стационаре мать отказалась. Спустя 1 нед ребенок был вновь госпитализирован, установлен диагноз «болезнь Кавасаки». Получал внутривенный иммуноглобулин в дозе 2 г/кг, ацетилсалициловую кислоту 50 мг/кг, однако несмотря на проводимую терапию сохранялась фебрильная лихорадка, ввиду чего ребенок был переведен в отделение ревматологии МДГКБ.

 При поступлении наблюдались фебрильная лихорадка (до 39°C) и полиморфная сыпь (на лице, туловище и конечностях) – папулезно-пятнистые элементы с участками шелушения, без зуда (рис. 1). Суставной синдром не регистрировался. На фоне проводимой антибактериальной терапии (меропенем) сохранялось повышение температуры тела до 38°С один раз в день в утренние часы, сыпь без динамики. В анализах крови воспалительная активность (в динамике СРБ с нарастанием до 149 мг/л, уровень прокальцитонина в норме, посевы крови роста не дали). При ЭхоКГ была обнаружена эктазия ствола левой коронарной артерии, при этом клапаны сердца – без значимых нарушений структуры и функции, размеры полостей сердца, перегородки сердца, сократимость левого желудочка – в пределах нормы, фракция выброса левого желудочка 65%. Произведена смена антибактериальной терапии (добавлен ванкомицин), проведено введение внутривенного иммуноглобулина из расчета 2 г/кг.
При поступлении наблюдались фебрильная лихорадка (до 39°C) и полиморфная сыпь (на лице, туловище и конечностях) – папулезно-пятнистые элементы с участками шелушения, без зуда (рис. 1). Суставной синдром не регистрировался. На фоне проводимой антибактериальной терапии (меропенем) сохранялось повышение температуры тела до 38°С один раз в день в утренние часы, сыпь без динамики. В анализах крови воспалительная активность (в динамике СРБ с нарастанием до 149 мг/л, уровень прокальцитонина в норме, посевы крови роста не дали). При ЭхоКГ была обнаружена эктазия ствола левой коронарной артерии, при этом клапаны сердца – без значимых нарушений структуры и функции, размеры полостей сердца, перегородки сердца, сократимость левого желудочка – в пределах нормы, фракция выброса левого желудочка 65%. Произведена смена антибактериальной терапии (добавлен ванкомицин), проведено введение внутривенного иммуноглобулина из расчета 2 г/кг.При компьютерной томографии органов грудной клетки с контрастированием выявлены гиповентиляционные изменения, малый гидроторакс слева, интерстициальные изменения в базальных отделах легких, внутригрудная и подмышечная лимфаденопатия.
На компьютерной томографии органов брюшной полости с внутривенным введением контрастного вещества – гепатоспленомегалия, снижение плотности паренхимы печени, единичный конкремент в правом надпочечнике. При исследовании пунктата костного мозга данных в пользу онкогематологических заболеваний не получено.
Учитывая возраст дебюта, длительную лихорадку, отсутствие эффекта от проводимой терапии, исключение объемных, лимфопролиферативных образований, лейкоза ребенку был установлен диагноз «ЮИА с системным началом, активность 3-й степени, рентгенологическая стадия I, функциональный класс 2». Была инициирована ГИБТ препаратом анакинра (антагонист рецептора ИЛ-1, 2 мг/кг в сутки). На фоне отсутствия клинического ответа (сохранение лихорадки, отсутствие динамики сыпи, воспалительные изменения по лабораторным данным) произведена смена ГИБТ на тоцилизумаб (антитела к рецептору ИЛ-6, 12 мг/кг на введение) в комбинации с пульс-терапией метилпреднизолоном. Зарегистрирован клинический ответ на проводимую терапию в виде нормализации температуры тела, уменьшения сыпи, купирования маркеров воспалительной активности по данным лабораторного обследования.
Через 1 мес ребенок поступил в отделение для планового введения тоцилизумаба и контроля лабораторных анализов крови. При осмотре зарегистрировано развитие суставного синдрома (рис. 2): пастозность и ограничение движения в лучезапястных суставах, припухлость межфаланговых суставов обеих кистей, со слов родителей утренней скованности не отмечалось. По данным ультразвукового исследования суставов определялись однородный жидкостной компонент в небольшом количестве в обоих лучезапястных суставах, умеренная инфильтрация окружающих мягких тканей межфаланговых суставов кистей с обеих сторон без признаков скопления жидкости в проекции суставов. Согласно лабораторным данным, сохранялись воспалительная активность (лейкоцитоз 28,9 тыс./мкл, СРБ 12,4 мг/л), тромбоцитоз (459×109/л). Проведена инфузия тоцилизумабом внутривенно из расчета 12 мг/кг на введение. Учитывая развитие суставного синдрома, инициирована терапия метотрексатом 7,5 мг подкожно.
При госпитализации по поводу 3-го введения тоцилизумаба отмечались отек, ограничение сгибания и разгибания лучезапястных суставов, отек межфаланговых суставов всех пальцев (кроме большого) на руках и ногах, утренняя скованность не регистрировалась. Лабораторно отмечалась нормализация показателей общего анализа крови и СРБ.
В динамике через 6 мес от старта терапии тоцилизумабом состояние ребенка – с выраженной положительной динамикой: кожные покровы чистые от сыпи, эпизодов лихорадки не отмечалось, суставной синдром сохранялся в виде незначительной отечности межфаланговых суставов. При ультразвуковом исследовании межфаланговых и лучезапястных суставов в их проекции – без признаков структурной патологии и патологического жидкостного содержимого, визуализируемые фрагменты синовиальной оболочки не утолщены, сухожильно-связочный аппарат без особенностей, окружающие мягкие ткани не изменены. На компьютерных томограммах органов грудной клетки очаговых и инфильтративных изменений в легких не выявлено. Важно отметить, что во все госпитализации ребенок осматривался офтальмологом, данных в пользу увеита и другой офтальмопатологии не получено.
С 2023 г. в отделении ревматологии МДГКБ детям с диагнозом системной формы ЮИА проводится генетическое исследование с целью исключения моногенных АВЗ. При секвенировании 119 генов, ассоциированных с АВЗ, у пациента была идентифицирована гетерозиготная мутация в гене NOD2 (c.1001G>A, p.Arg334Gln), классифицируемая как патогенная (OMIM: 605956.0004, dbSNP: rs104895461). Наличие данной мутации в сочетании с клиническими и лабораторными признаками позволило диагностировать СБ. Таким образом, верификация диагноза у нашего пациента состоялась через 5 мес от дебюта первых симптомов СБ.
На момент последней госпитализации возраст ребенка 2 года 10 мес. При осмотре лучезапястных суставов отмечались ограничения сгибания и разгибания, в области межфаланговых суставов всех пальцев, кроме большого, выраженный отек, формирующаяся камптодактилия (рис. 3). Помимо этого регистрировался суставной синдром в обоих коленных суставах с изменением походки (деформация суставов с формированием контрактур). Ребенок осмотрен офтальмологом, выявлены кератоконъюнктивит слева, субэпителиальные инфильтраты роговицы. Со слов матери известно, что за полгода до последней госпитализации ребенок амбулаторно получал лечение по поводу кератоконъюнктивита с инфильтратами в роговице.
Учитывая отрицательную динамику, к терапии подключен тофацитиниб (ингибитор янус-киназ, 2,5 мг 2 раза в день). Продолжено наблюдение.
 Обсуждение
ОбсуждениеУ пациентов с СБ часто диагностируется ЮИА. В исследовании Z. Zhong и соавт. (2024 г.) целевое секвенирование гена NOD2, выполненное у 123 пациентов с ранее установленным диагнозом ЮИА, у которых наблюдались увеит или кожные поражения на фоне артрита, подтвердило молекулярный диагноз СБ у 26 (21%) больных и привело к изменению тактики лечения у 10 из них. Таким образом, секвенирование NOD2 для пересмотра диагноза ЮИА является важной частью ведения данной группы пациентов, в особенности при наличии дополнительных клинических признаков, указывающих на СБ [47]. У ребенка в нашем клиническом наблюдении не было никаких офтальмологических симптомов, однако наличие артрита с длительно сохраняющимися и рецидивирующими кожными проявлениями может требовать исключения СБ у пациентов с ранее диагностируемым ЮИА. Кроме того, после верификации СБ у нашего пациента не требовалось проводить смену терапии, учитывая хороший эффект от лечения тоцилизумабом. При наличии увеита важным для дифференциальной диагностики является тот факт, что воспаление при увеите, ассоциированном с ЮИА, ограничивается передним сегментом глаза, тогда как СБ может привести к выраженным воспалительным поражениям глазного дна [6]. Кожный синдром при СБ часто ошибочно принимается за атопический дерматит или сыпь, ассоциированную с аллергической реакцией [20]. Так, в нашем клиническом наблюдении сыпь у ребенка в первые месяцы жизни расценивалась как проявления атопического дерматита.
Ошибочная диагностика СБ как болезни Кавасаки с последующим назначением внутривенного иммуноглобулина, как в нашем клиническом наблюдении, также описана в литературе. K. Cho и соавт. (2022 г.) представили наблюдение 13-месячного мальчика с рецидивирующей лихорадкой и генерализованной сыпью, у которого изначально была диагностирована болезнь Кавасаки с рефрактерным течением. Пациент поступил в стационар с температурой тела 38,7°C, конъюнктивальной инъекцией, генерализованной эритематозно-папулезной сыпью и увеличением шейных лимфатических узлов. Лабораторные анализы выявили лейкоцитоз, анемию, повышенный уровень СРБ и NT-proBNP.
Несмотря на двукратное лечение внутривенным иммуноглобулином и высокими дозами ГКС, симптомы сохранялись, что потребовало углубленного обследования. Была выполнена биопсия кожи, обнаружившая неказеозные гранулемы. Генетическое исследование подтвердило диагноз СБ (гетерозиготная мутация p.Arg334Trp в гене NOD2). В динамике у данного пациента развились системные осложнения: асцит, плевральный выпот и гепатоспленомегалия, потребовавшие назначения пульс-терапии метилпреднизолоном с последующим переходом на пероральный преднизолон и метотрексат. Несмотря на первоначальный ответ, в возрасте 3 лет присоединился артрит коленных суставов, что стало показанием для введения адалимумаба – ингибитора ФНО-α. К 4 годам у пациента развился передний увеит, купированный топическими ГКС [48]. Таким образом, ключевыми дифференциально-диагностическими признаками СБ и болезни Кавасаки являются отсутствие при СБ изменений на слизистых оболочках и коронарных осложнений, а также гистологическое подтверждение неказеозных гранулем. Однако проведение инвазивной биопсии может быть недоступным и проведение секвенирования гена NOD2 является предпочтительной стратегией. В целом при резистентности к терапии у пациентов с подозрением на ЮИА или болезнь Кавасаки целесообразно проведение секвенирования гена NOD2 для исключения СБ, что позволяет своевременно скорректировать лечение.
Отмечается широкая вариабельность симптомов у пациентов с СБ. У некоторых больных отмечается только классическая триада симптомов, у других данная триада не регистрируется. Могут быть вовлечены и другие органы и системы помимо кожи, глаз и суставов. Остается неясным, с чем связана данная вариабельность даже у пациентов с одной и той же мутацией гена NOD2. В работе C. Córdova-Fletes и соавт. (2020 г.), включающей описание трех пациентов с СБ, у всех детей были обнаружены патогенные варианты в других генах (PRR12, TLR10, MEFV, SLC22A5), у 1 ребенка – мутация в гене MEFV, ассоциированная с семейной средиземноморской лихорадкой, что может объяснять комбинированный фенотип в виде сочетания симптомов СБ и рецидивирующего полисерозита [49].
У ребенка в описанном нами клиническом наблюдении в гене NOD2 была выявлена гетерозиготная мутация p.Arg334Gln, локализующаяся в нуклеотидсвязывающем домене, влияющем на активность аденозинтрифосфатазы и активацию NF-κB [17]. Данная мутация является одной из наиболее распространенных при СБ и обычно характеризуется типичным фенотипом СБ. Однако описаны и редкие варианты клинической презентации у пациентов с данной мутацией. Так, в работе M. Whyte и соавт. (2018 г.) представлено клиническое наблюдение 4-летней девочки, у которой наблюдались тяжелая гиперкальциемия (до 13,6 мг/дл), вызванная избыточной продукцией 1,25-дигидроксивитамина D – 1,25(OH)₂D, нефрокальциноз, нарушение функции почек и генерализованный остеосклероз, имитирующий остеопетроз. При рентгенологическом исследовании у ребенка были выявлены диффузное повышение плотности костей, синовит и теносиновит, а при гистопатологическом исследовании костного мозга – сохранение нерезорбированного хряща, что характерно для остеопетроза, однако маркеры костного обмена указывали на активный метаболизм. Ребенок получал лечение ГКС (преднизолон), метотрексатом и ингибиторами ФНО-α (адалимумаб, инфликсимаб), что привело к нормализации уровня кальция, подавлению уровня 1,25(OH)₂D, улучшению функции почек и уменьшению суставных симптомов. Спонтанное разрешение метафизарного остеосклероза произошло на фоне диеты с ограничением кальция. Таким образом, у ребенка в данном наблюдении отмечалось отсутствие классических проявлений СБ при наличии тяжелой гиперкальциемии и остеосклероза, что подтверждает влияние мутаций гена NOD2 на остеокластогенез и внепочечный синтез 1,25(OH)₂D посредством нарушения регуляции NF-κB, доказательством чего является эффективность противовоспалительной терапии в коррекции метаболических и почечных нарушений [50].
Артериит средних и крупных сосудов является редким клиническим проявлением у пациентов с СБ [12]. Тщательное обследование периферического пульса и регулярное измерение артериального давления могут способствовать раннему выявлению сосудистых осложнений. Однако, как демонстрирует наше клиническое наблюдение, поражение коронарных артерий также требует внимания, несмотря на отсутствие типичных для СБ изменений в крупных сосудах. У описанного нами пациента с подтвержденным диагнозом на ЭхоКГ выявлена эктазия левой коронарной артерии, что расширяет спектр возможных сосудистых осложнений СБ и подчеркивает необходимость регулярного кардиологического мониторинга даже при отсутствии классических признаков артериита.
В нашем наблюдении у ребенка отмечена отчетливая положительная динамика на фоне инициации терапии тоцилизумабом, однако в последующем было зарегистрировано ухудшение состояния в виде прогрессирования суставного синдрома, развития камптодактилии, формирования контрактур в коленных суставах, появления изменений со стороны глаз (кератоконъюнктивит с инфильтратами роговицы), что потребовало усиления терапии тофацитинибом. Исходя из данных литературы, действительно, не у всех детей удается достичь стойкого эффекта на одном препарате ГИБТ. Так, в работе Т. Nagakura и соавт. (2017 г.) сообщалось об улучшении клинической картины на фоне терапии тоцилизумабом с последующим рецидивом артрита у одного ребенка, а также о необходимости смены терапии ввиду наличия иммуноглобулинов Е к тоцилизумабу у другого пациента [40]. Сложность подбора эффективной терапии обусловлена редкостью СБ, отсутствием стандартизированных протоколов и высокой вариабельностью ответа на различные препараты ГИБТ, такие как анти-ИЛ-6 (тоцилизумаб), анти-ФНО-α (адалимумаб, инфликсимаб), анти-ИЛ-1 (анакинра, канакинумаб) и ингибиторы янус-киназ (тофацитиниб), что подтверждается как данным клиническим наблюдением (первоначальный ответ на тоцилизумаб с последующей потерей эффективности), так и описанными в литературе [16, 23, 30–34, 36–38, 41, 42, 46, 51]. Необходимы индивидуальный подбор терапии и готовность к смене класса препарата при неэффективности или потере ответа.
Заключение
Представленное клиническое наблюдение подчеркивает ключевые диагностические и терапевтические сложности при СБ и необходимость тщательного дифференцированного подхода. Неполная или атипичная манифестация классической триады (дерматит, артрит, увеит), а также сходство симптомов с ЮИА или болезнью Кавасаки нередко приводят к ошибочной интерпретации клинической картины. При подозрении на СБ целевое секвенирование гена NOD2 позволяет установить диагноз. В свою очередь, ранняя верификация диагноза позволяет своевременно назначить патогенетическую терапию и предотвратить необратимые осложнения. Междисциплинарное взаимодействие (педиатр, ревматолог, офтальмолог, генетик, кардиолог) и персонализированный подход остаются основой успешного ведения пациентов с этим редким АВЗ.
Информация о финансировании. Исследование выполнено за счет гранта Московского центра инновационных технологий в здравоохранении на реализацию научно-практического проекта в сфере медицины (проект №1803-14).
Funding information. The study was supported by a grant from the Moscow Center for Innovative Technologies in Healthcare for the implementation of a scientific-practical project in medicine (Project No. 1803-14).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информированное согласие. Авторы получили письменное согласие законных представителей пациента на публикацию медицинских данных и фотографий.
Informed consent. Written informed consent was obtained from the patient’s legal representatives for the publication of medical data and photographs.
Информация об авторах
Information about the authors
Валиева Сания Ириковна – д-р мед. наук, зам. глав. врача по медицинской части и научно-образовательной работе ГБУЗ «Морозовская ДГКБ ДЗМ», проф. каф. педиатрии им. акад. М.Я. Студеникина ИКМ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: valieva.sania@yandex.ru; ORCID: 0009-0009-6241-9142
Saniya I. Valieva – Dr. Sci. (Med.), Deputy Chief Physician, Morozovskaya Children’s City Clinical Hospital, Professor, Pirogov Russian National Research Medical University. E-mail: valieva.sania@yandex.ru; ORCID: 0009-0009-6241-9142
Курбанова Седа Хасановна – канд. мед. наук, зав. отд-ния ревматологии ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: seda2709@mail.ru; ORCID: 0000-0003-0509-1055
Seda Kh. Kurbanova – Cand. Sci. (Med.), Head of the Rheumatology Department, Morozovskaya Children’s City Clinical Hospital.
E-mail: seda2709@mail.ru; ORCID: 0000-0003-0509-1055
Сологуб Анна Сергеевна – врач-ревматолог отд-ния ревматологии ГБУЗ «Морозовская ДГКБ ДЗМ»
Anna S. Sologub – rheumatologist, Morozovskaya Children’s City Clinical Hospital
Газиев Иван Рубенович – врач клинической лабораторной диагностики молекулярно-биологической лаборатории ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: gazi3003@yandex.ru; ORCID: 0009-0006-8751-0434
Ivan R. Gaziev – Medical Doctor in Clinical Laboratory Diagnostics, Morozovskaya Children’s City Clinical Hospital. E-mail: gazi3003@yandex.ru; ORCID: 0009-0006-8751-0434
Овсянников Дмитрий Юрьевич – д-р мед. наук, проф., зав. каф. педиатрии Медицинского института ФГАОУ ВО РУДН, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ». E-mail: mdovsyannikov@yahoo.com; ORCID: 0000-0002-4961-384X
Dmitry Yu. Ovsyannikov – Dr. Sci. (Med.), Professor, Head of the Department of Pediatrics, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: mdovsyannikov@yahoo.com; ORCID: 0000-0002-4961-384X
Поступила в редакцию: 10.07.2025
Поступила после рецензирования: 18.07.2025
Принята к публикации: 24.07.2025
Received: 10.07.2025
Revised: 18.07.2025
Accepted: 24.07.2025
Список исп. литературыСкрыть список1. Zeybek C, Basbozkurt G, Gul D et al. A New Mutation in Blau Syndrome. Case Rep Rheumatol 2015;(2015):463959. DOI: 10.1155/2015/463959
2. Ong LT, Nachbur U, Rowczenio D et al. A novel nucleotide oligomerisation domain 2 mutation in a family with Blau syndrome: Phenotype and function. Innate Immun 2017;23(7):578-83. DOI: 10.1177/1753425917727063
3. Lu L, Shen M, Jiang D et al. Blau syndrome with good Reponses to Tocilizumab: A case report and focused literature review. Semin Arthritis Rheum 2018;47(5):727-31. DOI: 10.1016/j.semarthrit.2017.09.010
4. Kaufman KP, Becker ML. Distinguishing Blau Syndrome from Systemic Sarcoidosis. Curr Allergy Asthma Rep 2021;21(2):10. DOI: 10.1007/s11882-021-00991-3
5. Takada S, Saito MK, Kambe N. Blau Syndrome: NOD2-related systemic autoinflammatory granulomatosis. G Ital Dermatol E Venereol 2020;155(5):537-41. DOI: 10.23736/S0392-0488.19.06524-6
6. Holland GN, Rosenbaum JT. The Challenge of Blau Syndrome. Am J Ophthalmol 2018;(187):xviii-xix. DOI: 10.1016/j.ajo.2017.12.006
7. Imayoshi M, Ogata Y, Yamamoto S. A Case of Sporadic Blau Syndrome with an Uncommon Clinical Course. Case Rep Rheumatol 2018;(2018):6292308. DOI: 10.1155/2018/6292308
8. Rose CD. Blau Syndrome: A Systemic Granulomatous Disease of Cutaneous Onset and Phenotypic Complexity. Pediatr Dermatol 2017;34(2):216-8. DOI: 10.1111/pde.13021
9. Parkhouse R, Boyle JP, Monie TP. Blau syndrome polymorphisms in NOD2 identify nucleotide hydrolysis and helical domain 1 as signalling regulators. FEBS Lett 2014;588(18):3382-9. DOI: 10.1016/j.febslet.2014.07.029
10. Yao Q, Li E, Shen B. Autoinflammatory disease with focus on NOD2-associated disease in the era of genomic medicine. Autoimmunity 2019;52(2):48-56. DOI: 10.1080/08916934.2019.1613382
11. Sfriso P, Caso F, Tognon S et al. Blau syndrome, clinical and genetic aspects. Autoimmun Rev 2012;12(1):44-51. DOI: 10.1016/j.autrev.2012.07.028
12. Khubchandani RP, Hasija R, Touitou I et al. Blau arteritis resembling Takayasu disease with a novel NOD2 mutation. J Rheumatol 2012;39(9):1888-92. DOI: 10.3899/jrheum.120156
13. Rose CD, Pans S, Casteels I et al. Blau syndrome: cross-sectional data from a multicentre study of clinical, radiological and functional outcomes. Rheumatology 2015;54(6):1008-16. DOI: 10.1093/rheumatology/keu437
14. Jindal AK, Pilania RK, Suri D et al. A young female with early onset arthritis, uveitis, hepatic, and renal granulomas: a clinical tryst with Blau syndrome over 20 years and case-based review. Rheumatol Int 2021;41(1):173-81. DOI: 10.1007/s00296-019-04316-6
15. Sarens IL, Casteels I, Anton J et al. Blau Syndrome–Associated Uveitis: Preliminary Results From an International Prospective Interventional Case Series. Am J Ophthalmol 2018;(187):158-66. DOI: 10.1016/j.ajo. 2017.08.017
16. Aróstegui JI, Arnal C, Merino R et al. NOD2 gene-associated pediatric granulomatous arthritis: clinical diversity, novel and recurrent mutations, and evidence of clinical improvement with interleukin-1 blockade in a Spanish cohort. Arthritis Rheum 2007;56(11):3805-13. DOI: 10.1002/art.22966
17. Rose CD, Martin TM, Wouters CH. Blau syndrome revisited. Curr Opin Rheumatol 2011;23(5):411-8. DOI: 10.1097/BOR.0b013e328349c430
18. Poline J, Bourrat E, Meinzer U. Camptodactlyly in Pediatric Practice: Blau Syndrome. J Pediatr 2020;(221):257-9. DOI: 10.1016/j.jpeds.2020.01.057
19. Poline J, Fogel O, Pajot C et al. Early-onset granulomatous arthritis, uveitis and skin rash: characterization of skin involvement in Blau syndrome. J Eur Acad Dermatol Venereol JEADV 2020;34(2):340-8. DOI: 10.1111/jdv.15963
20. Федоров Е.С., Салугина С.О., Шаповаленко А.Н. и др. Синдром Блау, или моногенный саркоидоз с ранним началом: российская когорта пациентов. Педиатрия. Журнал им. Г.Н. Сперанского. 2021;100(5):99-109. DOI: 10.24110/0031-403X-2021-100-5-99-109
Fedorov E.S., Salugina S.O., Shapovalenko A.N., et al. Blau syndrome, or early-onset monogenic sarcoidosis: a Russian cohort of patients. Pediatrics. Speransky Journal. 2021;100(5):99-109. DOI: 10.24110/0031-403X-2021-100-5-99-109 (in Russian).
21. Kreps EO, Al Julandani D, Guly CM et al. Long-Term Visual Outcome of Patients with Blau Syndrome. Ocul Immunol Inflamm 2024;32(8):1728-32. DOI: 10.1080/09273948.2023.2293922
22. Sinharay R, McKeown L, Phillips C et al. First report of liver transplantation in Blau syndrome: The challenges faced in this rare granulomatous liver disease. Transpl Immunol 2021;(65):101378. DOI: 10.1016/j.trim. 2021.101378
23. Wu D, Shen M. Two Chinese pedigrees of Blau syndrome with thirteen affected members. Clin Rheumatol 2018;37(1):265-70. DOI: 10.1007/s10067-017-3758-7
24. Jain L, Gupta N, Reddy MM et al. A Novel Mutation in Helical Domain 2 of NOD2 in Sporadic Blau Syndrome. Ocul Immunol Inflamm. 2018;26(2):292-4. DOI: 10.1080/09273948.2016.1207789
25. Zhong L, Wang W, Tang X et al. Phenotype of Takayasu-like vasculitis and cardiopathy in patients with Blau syndrome. Clin Rheumatol 2024;43(3):1171-81. DOI: 10.1007/s10067-024-06876-w
26. Yao F, Tan B, Wu D, Shen M. Blau syndrome with hypertension and hepatic granulomas: a case report and literature review. Front Pediatr 2023;(11):1063222. DOI: 10.3389/fped.2023.1063222
27. Su J, Liu D. Blau syndrome with pulmonary nodule in a child. Australas J Dermatol 2021;62(2):217-20. DOI: 10.1111/ajd.13551
28. Matsuda T, Kambe N, Takimoto-Ito R et al. Potential Benefits of TNF Targeting Therapy in Blau Syndrome, a NOD2-Associated Systemic Autoinflammatory Granulomatosis. Front Immunol 2022;(13):895765. DOI: 10.3389/fimmu.2022.895765
29. Marín-Noriega MA, Muñoz-Ortiz J, Mosquera C, de-la-Torre A. Ophthalmological treatment of early-onset sarcoidosis/Blau syndrome in a Colombian child: A case report. Am J Ophthalmol Case Rep 2020;(18):100714. DOI: 10.1016/j.ajoc.2020.100714
30. Maccora I, Wouters C, Rosè CD et al. Treatment of uveitis in Blau syndrome: A systematic review and meta-analysis. J Autoimmun 2025;(153):103401. DOI: 10.1016/j.jaut.2025.103401
31. Nascimento H, Sousa JM, Fernández DG et al. Blau-Jabs Syndrome in a Tertiary Ophthalmologic Center. Ophthalmic Surg Lasers Imaging Retina 2018;49(1):70-5. DOI: 10.3928/23258160-20171215-12
32. Babu K, Rao AP. Clinical Profile in Genetically Proven Blau Syndrome: A Case Series from South India. Ocul Immunol Inflamm 2021;29(2):250-6. DOI: 10.1080/09273948.2020.1746353
33. Millington GWM, Dobson J, Holden S et al. Sporadic Blau syndrome treated with adalimumab. Clin Exp Dermatol 2019;44(7):811-3. DOI: 10.1111/ced.14016
34. PaÇ Kisaarslan A, SÖzerÝ B, ÞahÝn N et al. Blau Syndrome and Early-Onset Sarcoidosis: A Six Case Series and Review of the Literature. Arch Rheumatol 2020;35(1):117-27. DOI: 10.5606/ArchRheumatol.2020.7060
35. Kumrah R, Pilania RK, Menia NK et al. Blau syndrome: Lessons learned in a tertiary care centre at Chandigarh, North India. Front Immunol 2022;(13):932919. DOI: 10.3389/fimmu.2022.932919
36. Wang W, Wang W, Zhong LQ et al. Thalidomide may be an effective drug for Blau syndrome: a case report. Ann Palliat Med 2022;11(7):2538-43. DOI: 10.21037/apm-21-2216
37. Yasui K, Yashiro M, Tsuge M et al. Thalidomide dramatically improves the symptoms of early-onset sarcoidosis/Blau syndrome: its possible action and mechanism. Arthritis Rheum 2010;62(1):250-7. DOI: 10.1002/ art.25035
38. Sidiqi A, Pegado V. Blau syndrome following a bacterial infection. J AAPOS 2020;24(2):118-20. DOI: 10.1016/j.jaapos.2019.12.008
39. Soper JR, Bonar SF, O’Sullivan DJ et al. Thalidomide and neurotrophism. Skeletal Radiol 2019;48(4):517-25. DOI: 10.1007/s00256-018-3086-2
40. Nagakura T, Wakiguchi H, Kubota T et al. Tumor Necrosis Factor Inhibitors Provide Longterm Clinical Benefits in Pediatric and Young Adult Patients with Blau Syndrome. J Rheumatol 2017;44(4):536-8. DOI: 10.3899/jrheum.160672
41. Chen J, Luo Y, Zhao M et al. Effective treatment of TNFα inhibitors in Chinese patients with Blau syndrome. Arthritis Res Ther 2019;21(1):236. DOI: 10.1186/s13075-019-2017-5
42. Naik A, Annamalai R, Biswas J. Uveitis in sporadic Blau syndrome: Long-term follow-up of a refractory case treated successfully with adalimumab. Indian J Ophthalmol 2018;66(10):1483. DOI: 10.4103/ijo.IJO_629_18
43. Caracseghi F, Izquierdo-Blasco J, Sanchez-Montanez A et al. Etanercept-induced myelopathy in a pediatric case of blau syndrome. Case Rep Rheumatol 2011;(2011):134106. DOI: 10.1155/2011/134106
44. Simonini G, Xu Z, Caputo R et al. Clinical and transcriptional response to the long-acting interleukin-1 blocker canakinumab in Blau syndrome-related uveitis. Arthritis Rheum 2013;65(2):513-8. DOI: 10.1002/art.37776
45. Martin TM, Zhang Z, Kurz P et al. The NOD2 defect in Blau syndrome does not result in excess interleukin-1 activity. Arthritis Rheum 2009;60(2):611-8. DOI: 10.1002/art.24222
46. Zhang S, Cai Z, Mo X, Zeng H. Tofacitinib effectiveness in Blau syndrome: a case series of Chinese paediatric patients. Pediatr Rheumatol 2021;19(1):160. DOI: 10.1186/s12969-021-00634-x
47. Zhong Z, Dai L, Ding J et al. Molecular diagnostic yield for Blau syndrome in previously diagnosed juvenile idiopathic arthritis with uveitis or cutaneous lesions. Rheumatology 2024;63(SI2):SI260-SI268. DOI: 10.1093/rheumatology/kead596
48. Cho K, Yoon Y, Choi J-sik et al. A Boy With Blau Syndrome Misdiagnosed as Refractory Kawasaki Disease. Pediatr Infect Vaccine 2022;29(3):166. DOI: 10.14776/piv.2022.29.e22
49. Córdova-Fletes C, Rangel-Sosa MM, Martínez-Jacobo LA et al. Whole-exome sequencing in three children with sporadic Blau syndrome, one of them co-presenting with recurrent polyserositis. Autoimmunity 2020;53(6):344-52. DOI: 10.1080/08916934.2020.1786068
50. Whyte MP, Lim E, McAlister WH et al. Unique Variant of NOD2 Pediatric Granulomatous Arthritis With Severe 1,25-Dihydroxyvitamin D-Mediated Hypercalcemia and Generalized Osteosclerosis. J Bone Miner Res 2018;33(11):2071-80. DOI: 10.1002/jbmr.3532
51. Валиева С.И., Курбанова С.Х., Овсянников Д.Ю. Современные представления о моногенных аутовоспалительных заболеваниях. Педиатрия. Журнал им. Г.Н. Сперанского. 2024;103(6):172-82. DOI: 10.24110/0031-403X-2024-103-6-172-182
Valieva S.I., Kurbanova S.Kh., Ovsyannikov D.Yu. Modern ideas about monogenic autoinflammatory diseases. Pediatrics. Journal named after G.N. Speransky. 2024;103(6):172-82. DOI: 10.24110/0031-403X-2024-103-6-172-182 (in Russian).
30 декабря 2025
Количество просмотров: 89

