Клинический разбор в общей медицине №11 2025
1 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Nikita & Co, Moscow, Russia
dr@igor-guchev.ru
Abstract
Community-acquired pneumonia (CAP) contributes greatly to the structure of the infectious disease morbidity and mortality rates, especially in people of older age groups and patients suffering from chronic diseases of internal organs. Streptococcus pneumoniae and Haemophilus influenzae represent the most common CAP causative agents that often contribute to rapid disease progression and therefore require early prescription of adequate antimicrobial therapy. According to the clinical guidelines, the first line drugs are beta-lactams and in certain cases “respiratory” fluoroquinolones. After the end of the COVID-19 pandemic, during which anti-epidemic measures limiting transmission of viral and bacterial agents were widely used, growth of the rate of pneumonia associated with Mycoplasma pneumonia was reported in many countries. In most cases, mycoplasmal pneumonia has a mild course and is characterized by favorable prognosis, which, however, does not eliminate severe disease forms. The growing number of cases of mycoplasmal infection resistant to macrolide therapy should also be considered.
Keywords: community-acquired pneumonia caused by Mycoplasma pneumoniae, diagnosis and antimicrobial therapy of mycoplasmal pneumonia.
For citation: Sinopalnikov A.I., Tyurin I.E., Guchev I.A. Community-acquired pneumonia associated with Mycoplasma pneumoniae: diagnostic and treatment approaches. Clinical review for general practice. 2025; 6 (11): 43–50 (In Russ.). DOI: 10.47407/kr2025.6.11.00710
Введение
Согласно общепринятому определению, пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации. Внебольничной пневмонией (ВП) считают случаи легочного воспаления, развившиеся вне стационара либо диагностированные в первые 48 ч с момента госпитализации. Заболевание сопровождается симптомами инфекции нижних дыхательных путей (повышение температуры тела, кашель, отделение мокроты, боль в грудной клетке, одышка), симптомами интоксикации и свежими очагово-инфильтративными изменениями в легких при отсутствии очевидной диагностической альтернативы [1].
Диагностика пневмонии традиционно базируется на результатах клинического и параклинического обследования, впрочем, не являющихся строго специфичными и высокочувствительными, особенно при установлении этиологического диагноза [2, 3]. В связи с этим лечение ВП является эмпирическим, основанном на предположении о конкретном виновном патогене и знании его чувствительности к определенному кругу антибиотиков.
Самым распространенным бактериальным возбудителем ВП является Streptococcus pneumoniae, который наряду с существенно менее часто встречающимися Staphylococcus aureus и Klebsiella pneumoniae обусловливает нередко тяжелое течение заболевания и его неблагоприятный исход [4–7]. При нетяжелых формах заболевания S. aureus, а также K. pneumoniae и ряд других грамотрицательных бактерий, встречаются существенно реже [8, 9]. С практической точки зрения следует отметить, что этиологическая роль H. influenzae оказывается сопоставимой с пневмококком у пациентов с хроническими бронхолегочными заболеваниями и/или хронической сердечной недостаточностью [5, 8–11]. Именно среди последних отмечена наибольшая распространенность ВП, требующих госпитализации и нередко заканчивающихся летально [12].
Важную роль, преимущественно у детей, подростков и лиц молодого возраста, играют некоторые атипичные возбудители, среди которых доминирующее место занимает Mycoplasma pneumoniae. И именно годы, последовавшие после пандемии COVID-19, были отмечены взрывным ростом случаев микоплазменной инфекции, в том числе и среди госпитализированных больных с ВП, достигая, по данным ряда авторов, 44% среди всех этиологически верифицированных случаев заболевания [5, 13–18]. Впрочем, представленные результаты следует оценивать с осторожностью, поскольку без подтверждения соответствующей динамики специфичных антител в остром периоде заболевания и в периоде реконвалесценции крайне затруднительно судить об этиологической роли микроорганизма, способного длительное время персистировать на слизистой оболочке ротоглотки. Так, например, в ходе недавно проведенного российского исследования присутствие M. pneumoniae в материале верхних дыхательных путей у здоровых взрослых было подтверждено в 4% случаев [19]. Здесь важно заметить, что если еще недавно микоплазменная инфекция, в том числе и в форме пневмонии, считалась едва ли не исключительной «привилегией» детей и юношей, то согласно современным данным частота M. pneumoniae в этиологической структуре ВП у пожилых и стариков составляет 2,3–5% [13, 20, 21].
В большинстве случаев микоплазменная инфекция дыхательных путей манифестируется как фарингит и трахеобронхит, существенно реже – как пневмония [22]. Чаще инфекция протекает легко и склонна к спонтанному излечению [13, 18, 23–25]. В то же время у пациентов с сопутствующими заболеваниями, например с ожирением, артериальной гипертензией, хронической печеночной недостаточностью и др., благоприятное течение микоплазменной пневмонии (МП) менее вероятно, особенно при применении антибиотиков, неактивных против микоплазмы [14, 26, 27]. Более тяжелого течения микоплазменной ВП также можно ожидать при вирусной и бактериальной, в первую очередь хламидийной, гемофильной и пневмококковой, коинфекциях [28–30].
Актуальный «ренессанс» МП видоизменил наши традиционные представления об эпидемиологии заболевания и особенностях его клинического течения. Так, в частности, среди лиц 18 лет и старше 19–25% заболевших МП требуют госпитализации, причем среди лиц старше 75 лет их частота доходит до 48–61% [31]. При этом до 11% пациентов госпитализируются в отделения интенсивной терапии в основном в связи с развитием острой дыхательной недостаточности [32]. Кумулятивная госпитальная летальность у взрослых достигает 2% [14] или 0,38% [33] в общей популяции лиц, переносящих МП. И все же, несмотря на приведенные свидетельства значимого вклада M. pneumoniae в этиологию ВП среди пациентов, требующих госпитализации, к результатам цитируемых исследований следует относиться сдержанно, поскольку неясно, сопровождали ли микоплазменную инфекцию иные, неидентифицированные микроорганизмы, определявшие фактическую тяжесть заболевания.
Антибактериальная терапия ВП является эмпирической, что связано с трудностями идентификации возбудителей, в том числе ограниченными минимальными возможностями установления этиологического диагноза при анализе анамнестических, клинических и параклинических данных [1]. Для большинства взрослых пациентов с ВП (50–80%) характер и объем терапевтических вмешательств может быть ограничен амбулаторным лечением [34–37]. При этом в случае последнего предпочтительна монотерапия, а не комбинированное лечение, с назначением антибиотиков ограниченного спектра активности в пероральной лекарственной форме [1, 38–49]. В обсуждаемой клинической ситуации в качестве стартовой терапии рекомендуется применение аминопенициллинов, оральных цефалоспоринов с приемлемой антипневмококковой активностью и респираторных фторхинолонов. В регионах с доказанно высоким уровнем чувствительности пневмококка к макролидам, а также в случаях обоснованного предположения об атипичной природе нетяжелой ВП также целесообразно назначение представителей этого класса антибиотиков.
В ряде зарубежных клинических руководств в рамках эмпирической терапии нетяжелой ВП у пациентов с сопутствующими заболеваниями рекомендовано одновременно с бета-лактамом применение макролида или доксициклина. Впрочем, здесь следует принимать во внимание тот факт, что до настоящего времени свидетельства в пользу комбинированной антибактериальной терапии над монотерапией не свободны от контр-аргументов [1, 50].
M. pneumoniae: общая характеристика
Особенности инфекций респираторного тракта, связанных с M. pneumoniae, определяются способностью микроорганизма к тесному взаимодействию с эпителием дыхательных путей. Прикрепление возбудителя к клетке и периэпителиальная инвазия приводят к обездвиживанию ресничек, апоптозу и десквамации мерцательного эпителия слизистой дыхательных путей. Здесь важно подчеркнуть, что нарушения двигательной активности ресничек могут сохраняться до 12 мес [51].
M. pneumoniae склонна к длительной персистенции на поверхности респираторного эпителия с формированием биопленки [52]. Затрудняет элиминацию микроорганизма и его способность к интрацеллюлярному переживанию, ограничивающему провоспалительный ответ со стороны иммунной системы хозяина [53, 54]. Выявленная при М. pneumoniae повышенная продукция MUC-5AC является чувствительным маркером формирования слизистых пробок, обтурирующих просвет бронхов и бронхиол (так называемая мукоидная закупорка бронхов) [55].
Учитывая распространенность МП, при определении тактики эмпирической терапии целесообразно рассмотреть чувствительность возбудителя к основным антибиотикам, применяемым в соответствии с существующими клиническими рекомендациями [1].
С 2000 г. в Японии, а также в других странах Азиатско-Тихоокеанского региона и Юго-Восточной Азии отмечается снижение чувствительности микоплазмы к макролидам [14, 56, 57]. Уровень устойчивости составляет, например, 27–100% в Китае [57], 88% на Тайване (детская популяция) [58], 60% в Японии [59]. Более низкие уровни устойчивости подтверждены в США и Европе, где они достигали 9% (5–12%) и 6% (1–12%) соответственно [60].
По данным P. Xie и соавт. [61], у устойчивых к макролидам штаммов идентифицирована замена аденина на гуанин в 2063-й позиции V домена гена 23S рибосомальной РНК. В ряде случаев определялись маркеры систем активного выброса. Отмечено, что наличие мутации A2063G в комбинации или без системы активного выброса не влияло или незначительно повышало уровни минимальной подавляющей концентрации 16-членных макролидов, но сопровождалось существенном увеличением минимальной подавляющей концентрации 14- и 15-членных макролидов [61, 62].
Сведения о резистентности M. pneumoniae к макролидам в Российской Федерации в настоящее время весьма ограничены. Низкая (7%) резистентность, ассоциированная с мутацией в локусе A2063G, продемонстрирована Е. Ворониной и соавт., исследовавшими 117 геномов M. pneumoniae, выделенных в 2015–2018 гг. [63]. При анализе 3 генетических копий, полученных в стационаре г. Москвы в 2023–2024 гг., продемонстрировано отсутствие детерминант устойчивости к макролидам. В то же время выявленные сиквенс-типы были внутри клады, для которой характерна повышенная мутабельность геномов, в том числе связанных с устойчивостью к макролидам [64]. Менее благоприятная ситуация описана в еще одном исследовании 2023–2024 гг., в ходе которого при тестировании образцов, полученных от 193 детей 7–17 лет, уровень резистентности к макролидам (мутация 2063 A/G) составил 40,8% в Европейской части России и 35,7% на Дальнем Востоке [19]. Результаты данного исследования нельзя полностью переносить на взрослую популяцию, поскольку уровни резистентности у детей и взрослых отличаются и первые из них демонстрирует более высокие показатели. Однако, учитывая модель заражения (от ребенка к взрослому индивиду), высокие уровни резистентности M. pneumoniae к макролидам во взрослой популяции весьма вероятны.
Ранее было показано, что устойчивость микоплазмы к макролидам может сопровождаться прогрессированием заболевания, его рефрактерным течением, а также удлинением сроков клинического и рентгенологического выздоровления [26, 27, 65]. При наличии устойчивого к макролидам возбудителя благоприятного течения микоплазменной ВП можно ожидать при применении доксициклина и респираторных фторхинолонов [27, 66]. Указанные различия в клиническом течении заболевания в условиях распространения устойчивых к макролидам азиатских клад M. pneumoniae требуют поиска ранних маркеров МП.
Возможности диагностики МП
Анализ актуальной клинической симптоматики делает маловероятным надежную дифференциацию микоплазменной и любой иной этиологии ВП [3, 22]. Впрочем, длительный продромальный период, интермиттирующий субфебрилитет, малопродуктивный кашель, в том числе с приступами до рвоты, невысокий уровень С-реактивного белка и чаще нормальное содержание лейкоцитов крови могут, особенно при наличии указаний на семейные вспышки и вспышки синдромо-сходной респираторной инфекции в организованных коллективах, настроить врача на предположение о микоплазменной инфекции [22, 67, 68]. В ходе клинической диагностики респираторного микоплазмоза (исключались случаи пневмонии) можно опираться на исследование N. Miyashita и соавт., результаты которого свидетельствовали о таких часто встречавшихся при микоплазменной инфекции симптомах, как кашель (98%), боли в горле (61%), продукция мокроты (67%). Одновременно авторами была отмечена редкость такого симптома, как заложенность носа и ринорея (9%), в то время как у лиц без подтвержденной M. pneumoniae инфекции данные симптомы выявлялись в 70% случаев. Однако все перечисленные клинические признаки справедливо были оценены как низкоспецифичные [69].
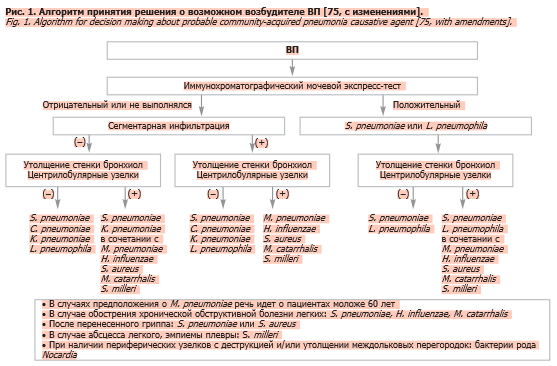
Более точному установлению этиологического диагноза могут способствовать дополнительные данные, полученные при проведении лучевых и лабораторных исследований. С практической точки зрения следует отметить невысокую чувствительность и специфичность рентгенологического исследования, рассматриваемого в клинических рекомендациях в качестве основы для подтверждения диагноза «пневмония» [1].
Так, в ходе многоцентрового когортного исследования взрослых пациентов (n=3423, медиана возраста 52–54 года), общими симптомами для которых являлись остро возникшие одышка, боли в груди и кашель, рентгенография органов грудной клетки продемонстрировала низкие показатели чувствительности (43,5%; 95% доверительный интервал 36,4–50,8%) и положительной прогностической ценности (26,9%; 95% доверительный интервал 22,1–32,2%) в выявлении очаговых легочных затемнений. Авторы сделали вывод, что использование рентгенографии в качестве основного метода диагностики пневмонии может приводить к значительному количеству ошибочных диагнозов [70]. Еще одним свидетельством низкой чувствительности рентгенографии органов грудной клетки в диагностике пневмонии, выполненной в первые 2 сут заболевания, явилось исследование D. Ibrahim и соавт. [71]: было показано, что в 41,5% случаев отрицательного или неопределенного результата рентгенографии последующее выполнение компьютерной томографии (КТ) органов грудной клетки подтверждало наличие очагово-инфильтративных изменений в легких. Основными причинами недостаточной чувствительности рентгенографии являются транспозиция очага и такие не выявляемые при этом исследовании паттерны, как «дерево в почках», «матовое стекло».
К числу недостатков рентгенографии следует отнести и трудности в дифференциации собственно пневмонии с такими патологическими процессами, как обтурационный ателектаз, локальная гиповентиляция, инфаркт легкого, стелящаяся аденокарцинома и др.
Относительно чувствительные признаки МП удается выявить при выполнении КТ высокого разрешения (КТВР) [72–74]. К их числу относятся центрилобулярные очаги, ограниченные размерами дольки участки «матового стекла» и паттерн «дерево в почках».
По данным китайских исследователей, изучивших КТВР у 400 пациентов с ВП различной, в том числе и микоплазменной, этиологии, наиболее чувствительными лучевыми признаками последней являлись незначительные по протяженности участки «матового стекла», накладывающиеся на «дерево в почках» при отсутствии воздушной бронхограммы в зоне инфильтрации. Для этого типа изменений ими был предложен термин «дерево в тумане» (tree in fog) [73].
Заслуживают внимания и результаты исследования, в ходе которого была предпринята попытка приблизиться к этиологической расшифровке ВП с учетом доминирующих КТ-паттернов [75], учитывающих, в частности, распространенность затемнения (сегментарное или субсегментарное), наличие или отсутствие центилобулярных узелков и утолщения стенки бронхиол (рис. 1).

Сопоставлению патоморфологических и радиологических находок при МП было посвящено исследование H. Tanaka [74]. Автор выделил три основные морфорадиологическое корреляции:
а) перибронхиальная и периваскулярная муфтообразная инфильтрация мононуклеарными клетками соответствовала утолщению бронховаскулярных пучков на КТВР, что являлось наиболее частым признаком данной пневмонии;
б) бронхиолит с наличием экссудата или грануляционной ткани в просвете в мелких дыхательных путях визуализировался в виде центрилобулярных узелков;
в) внутриальвеолярная инфильтрация нейтрофилами манифестировала участками «воздушной» консолидации или «матового стекла».
Примечательно, что у пациентов с преобладанием центрилобулярных узелков на КТ отмечался высокий уровень клеточного иммунитета; в противоположность этому более сдержанный ответ клеточного иммунитета чаще соседствовал с паттерном «матового стекала» и консолидацией легочной ткани. В этой связи автором было высказано оригинальное предположение о том, что морфологические изменения и их рентгенологические ассоциации при ВП, вызванной M. pneumoniae, могут варьировать в зависимости от уровня клеточного иммунного ответа.
Оценивая прогностическую значимость КТ-изменений и клинических симптомов при диагностике/дифференциальной диагностике МП, нельзя не упомянуть опубликованное в 2011 г. исследование N. Miyashita и соавт. [76], в ходе которого авторами было показано некоторое превосходство клинико-лабораторных критериев атипичной пневмонии Японского респираторного общества (см. таблицу) над результатами КТВР при оценке чувствительности (85 и 73%) и специфичности (90 и 83%) соответственно.
С клинической и прогностической точек зрения интересным представляется анализ течения и исходов МП у детей [77]. Авторами в частности было показано, что наличие внелегочных симптомов заболевания, гомогенной лобарной консолидации и парапевмонического плеврита надежно корреспондирует с длительно сохраняющейся лихорадкой (≥7 сут) с начала лечения и не зависит от возможной резистентности возбудителя к макролидам.
Наиболее точная этиологическая диагностика основывается на применении полимеразной цепной реакции (ПЦР). Однако в связи с возможностью длительной (≥4 мес) персистенции M. pneumoniae на респираторном эпителии обнаружение генетических маркеров возбудителя не позволяет уверенно судить о соответствующей этиологии пневмонии [78–80]. Поэтому в целях надежной этиологической диагностики микоплазменной инфекции целесообразно сочетание ПЦР с определением специфичных антител: IgA, а также оценкой динамики IgM и IgG в остром периоде заболевания и в периоде реконвалесценции. В исследовательских целях также определяется активность специфичных к антигену микоплазмы секретирующих Ig плазмоцитов [58, 78, 80–83].
Клиническое наблюдение
Ниже мы приводим клиническое наблюдение, демонстрирующее трудности ведения больных с ВП, встающие перед врачом амбулаторного звена.
Пациентка 33 лет, страдающая вторичным гипотиреозом, компенсированным Эутироксом, обратилась в поликлинику 13.04.2025 с жалобами на малопродуктивный кашель с отделением скудной светлой вязкой мокроты, непостоянную боль в горле и заложенность носа без ринореи. Из анамнеза известно, что заболевание манифестировало 06.04.2025, когда на фоне персистирующего в течение последних 5–6 сут редкого покашливания появились надсадный сухой кашель, постоянная боль в горле. На следующий день температура тела повысилась до 38°С, а также усилился кашель, который приобрел приступообразный характер, возникая как в дневное, так и в ночное время. На 3-и сутки болезни, 08.04.2025, температура достигла 38,8°С, прием парацетамола сопровождался непродолжительным снижением температуры тела до уровня высокого субфебрилитета. На 4-е сутки заболевания (09.04.2025) пациентка была осмотрена врачом поликлиники, установлен диагноз «трахеит» и назначена симптоматическая терапия. В связи с сохранением фебрильной лихорадки на 6-е сутки, 11.04.2025, начато лечение цефтриаксоном 1,0 г 2 раза в день внутримышечно, дополнительно применялся эрдостеин.
На фоне антибактериальной терапии у пациентки сохранялся высокий субфебрилитет, беспокоил приступообразный малопродуктивный кашель. Консультация пульмонолога 13.04.2025: при осмотре аксиллярная температура 36,9°С, SpO2 97%, пульс 108 в минуту, артериальное давление 110/74 мм рт. ст., частота дыхания 18 в минуту. При аускультации над левым легким выслушивались немногочисленные разнотембровые сухие свистящие хрипы.
Учитывая неэффективность терапии цефтриаксоном, подострое начало заболевания с симптомов инфекции верхних дыхательных путей, отсутствие демонстративных острофазовых изменений лабораторных показателей (анализ крови от 12.04.2025: С-реактивный белок 18,75 мг/л, лейкоциты 4860/мкл), было высказано предположение о микоплазменной этиологии пневмонии.
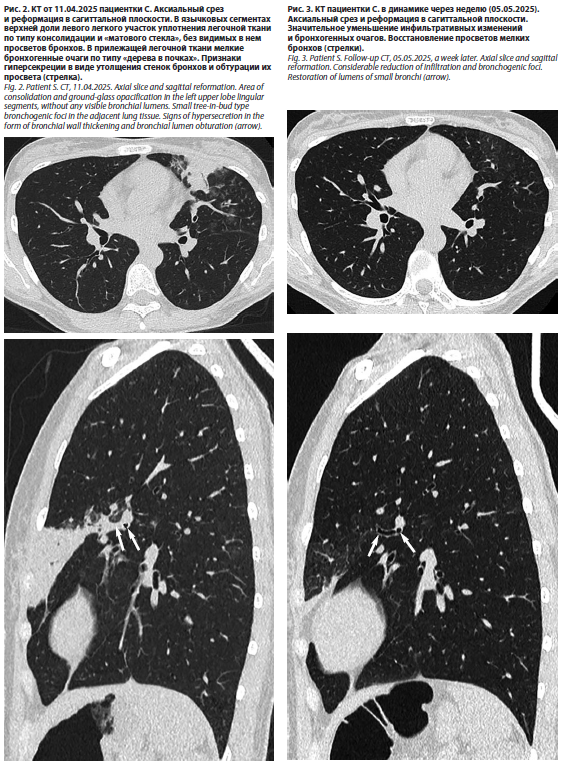
Не противоречили этому диагнозу и результаты КТ-исследования от 11.04.2025 (рис. 2).
Учитывая риск устойчивости предполагаемого возбудителя (M. pneumoniae) к макролидам, после отмены цефтриаксона был назначен моксифлоксацин внутрь (Кимокс®) в дозе 400 мг. На фоне терапии к исходу 3-х суток приема респираторного фторхинолона температура тела стойко нормализовалась, уменьшилась интенсивность кашля, сопровождавшегося отделением скудной светло-желтой мокроты.
 Позднее были получены результаты лабораторных исследований, подтвердившие высказанное предположение о микоплазменной этиологии пневмонии. Антитела к M. pneumoniae от 12.04.2025: IgG – коэффициент позитивности 0,01 (отрицательный результат), IgM – коэффициент позитивности 5,7 (положительный результат). Метод качественной ПЦР (мазок слизистой ротоглотки) от 13.04.2025 – выявлена ДНК M. pneumoniae. Антитела к M. pneumoniae (иммуноферментный анализ) 05.05.2025 – IgG 4 УЕ, IgM 3,05 УЕ.
Позднее были получены результаты лабораторных исследований, подтвердившие высказанное предположение о микоплазменной этиологии пневмонии. Антитела к M. pneumoniae от 12.04.2025: IgG – коэффициент позитивности 0,01 (отрицательный результат), IgM – коэффициент позитивности 5,7 (положительный результат). Метод качественной ПЦР (мазок слизистой ротоглотки) от 13.04.2025 – выявлена ДНК M. pneumoniae. Антитела к M. pneumoniae (иммуноферментный анализ) 05.05.2025 – IgG 4 УЕ, IgM 3,05 УЕ.
При оценке результатов КТ органов грудной клетки в динамике был отмечен регресс очагово-инфильтративных изменений в левом легком (рис. 3).
Рассмотренный клинический случай, являющийся нередким в амбулаторной практике, демонстрирует сложности клинико-инструментальной диагностики микоплазменной инфекции, что, в свою очередь, затрудняет выбор ориентированной на причинный возбудитель целенаправленной антимикробной терапии. Отсутствие лейкоцитоза, скудные аускультативные данные, упорный малопродуктивный кашель, боли в горле являются относительно специфичными дифференциально-диагностическими критериями, позволяющими предположить МП при первом контакте с пациентом [3, 69, 84]. Дополнительную помощь в ходе дифференциальной диагностики могут оказать анамнестические данные. Отсутствие эффекта при применении адекватной с учетом текущего уровня устойчивости [85] дозы цефтриаксона наряду со стабильным течением заболевания делает менее вероятным предположение о пневмококковой инфекции, а отсутствие анамнестических указаний на курение, хронический бронхит или хроническую обструктивную болезнь легких минимизирует риск H. influenzae.
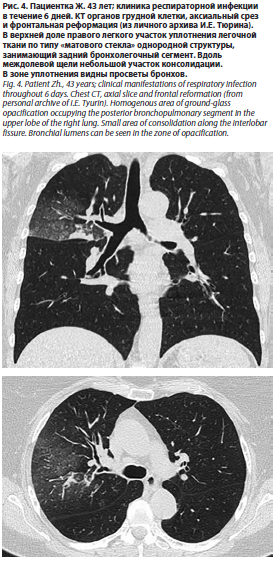
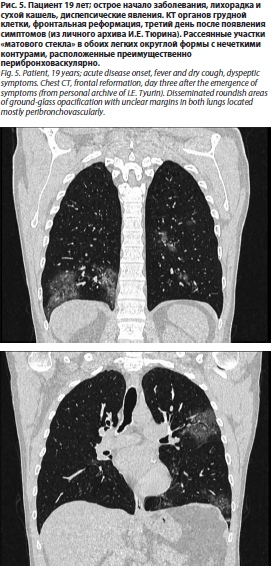
Что же касается результатов КТ, то они, также не являясь строго специфичными, могут оказать дополнительную помощь при обнаружении таких рентгенологических находок, как участки «матового стекла», утолщение стенок бронхов/бронхиол, цетрилобулярные очаги (рис. 4, 5).
Очевидно, что решающую роль в этиологической диагностике микоплазменной инфекции играют иммуносерологические и молекулярно-биологические методы диагностики. Положительный результат ПЦР наряду с нарастанием титров IgG и повышением титра IgM уменьшили риск ложноположительного результата, который мог быть связан с фарингеальным носительством и персистенцией микоплазмы [76].
В лечении предполагаемой МП был использован моксифлоксацин (Кимокс®), обеспечивающий надежную эрадикацию M. pneumoniae, в том числе и штаммов, устойчивых к макролидам. Его применение способствовало быстрой, в течение 3 сут, нормализации температуры, уменьшению частоты и интенсивности кашлевых пароксизмов.
Рассматривая целесообразность эмпирического применения альтернативных макролидам препаратов, мы исходили из имеющихся данных о повышенном риске устойчивости к 14- и 15-членным макролидам возбудителей, несущих мутации в локусе A2063G гена 23SрРНК [19].
 Выводы
Выводы
Представленный клинический случай и обзор литературы демонстрируют сложности этиологический диагностики ВП на основании клинических, лабораторных и лучевых методов исследования. Распространившиеся в постпандемический период респираторные инфекции, ассоциированные с M. pneumoniae, не всегда склонны к быстрому спонтанному разрешению. При выборе стартовой антибактериальной терапии ВП, безусловно принимая во внимание соответствующие анамнестические и клинические данные, следует применять препараты с учетом структуры и чувствительности основных возбудителей заболевания [1].
Решение задачи целенаправленной, а не общепринятой эмпирической стартовой терапии ставит во главу угла раннюю этиологическую диагностику ВП. С этой целью помимо клинико-анамнестических данных используются результаты лабораторных тестов, в том числе направленных на выявление этиологии ВП. Следует признать, что в ходе первичного приема получение результатов параклинических исследований вряд ли возможно, что затрудняет не только этиологическую диагностику, но порой и саму возможность выявления пневмонии.
С практической точки зрения представляется логичным расширение показаний к проведению КТ, особенно у лиц с факторами риска неблагоприятного течения пневмонии и клинико-анамнестическими признаками, подозрительными в отношении респираторного микоплазмоза. При этом обнаружение таких патологических изменений, как цетрилобулярные очаги, участки интерстициальной инфильтрации («матовое стекло»), могут оказать поддержку ранней этиологической диагностике.
Пациентам, у которых при первичном осмотре выявлены клинические и лучевые признаки, подозрительные в отношении МП, равно как и при неэффективности стартовой терапии бета-лактамом, целесообразно назначение альтернативных антибиотиков. Наиболее эффективны в данной ситуации респираторные фторхинолоны [1].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Синопальников Александр Игоревич – д-р мед наук, проф., зав. каф. пульмонологии ФГБОУ ДПО РМАНПО, засл. врач РФ
Alexander I. Sinopalnikov – Dr. Sci. (Med.), Professor, Russian Medical Academy of Continuous Professional Education
Тюрин Игорь Евгеньевич – д-р мед наук, проф., зав. каф. рентгенологии и радиологии ФГБОУ ДПО РМАНПО
Igor E. Tyurin – Dr. Sci. (Med.), Professor, Russian Medical Academy of Continuous Professional Education
Гучев Игорь Анатольевич – канд. мед. наук, врач-пульмонолог ООО «Никита и Ко». E-mail: dr@igor-guchev.ru; ORCID: 0000-0002-8958-5767
Igor A. Guchev – Cand. Sci. (Med.), pulmonologist, Nikita & Co.
E-mail: dr@igor-guchev.ru; ORCID: 0000-0002-8958-5767
Поступила в редакцию: 15.08.2025
Поступила после рецензирования: 22.08.2025
Принята к публикации: 28.08.2025
Received: 15.08.2025
Revised: 22.08.2025
Accepted: 28.08.2025
Клинический разбор в общей медицине №11 2025
Внебольничная пневмония, ассоциированная с Mycoplasma pneumoniae: подходы к диагностике и лечению
Номера страниц в выпуске:43-50
Аннотация
Внебольничная пневмония (ВП) вносит существенный вклад в структуру инфекционной заболеваемости и смертности, особенно у лиц старших возрастных групп и больных, страдающих хроническими заболеваниями внутренних органов. Streptococcus pneumoniae и Haemophilus influenzae – наиболее распространенные возбудители ВП, нередко обусловливающие быстрое прогрессирование заболевания и потому требующие раннего назначения адекватной антибактериальной терапии. В соответствии с клиническими рекомендациями препаратами первой линии являются бета-лактамы и в определенных случаях – респираторные фторхинолоны. После завершения пандемии COVID-19, в ходе которой широко использовались противоэпидемические мероприятия, ограничивавшие передачу вирусных и бактериальных агентов, во многих странах был отмечен рост числа пневмоний, ассоциированных с Mycoplasma pneumoniae. В своем большинстве микоплазменная пневмония протекает нетяжело и характеризуется благоприятным прогнозом, что, однако, не исключает тяжелых форм заболевания. Следует также учитывать и возрастающее число случаев микоплазменной инфекции, устойчивой к терапии макролидами.
Ключевые слова: внебольничная пневмония, вызываемая Mycoplasma pneumoniae, диагностика и антибактериальная терапия микоплазменной пневмонии.
Для цитирования: Синопальников А.И., Тюрин И.Е., Гучев И.А. Внебольничная пневмония, ассоциированной с Mycoplasma pneumoniae: подходы к диагностике и лечению. Клинический разбор в общей медицине. 2025; 6 (11): 43–50. DOI: 10.47407/kr2025.6.11.00710
Внебольничная пневмония (ВП) вносит существенный вклад в структуру инфекционной заболеваемости и смертности, особенно у лиц старших возрастных групп и больных, страдающих хроническими заболеваниями внутренних органов. Streptococcus pneumoniae и Haemophilus influenzae – наиболее распространенные возбудители ВП, нередко обусловливающие быстрое прогрессирование заболевания и потому требующие раннего назначения адекватной антибактериальной терапии. В соответствии с клиническими рекомендациями препаратами первой линии являются бета-лактамы и в определенных случаях – респираторные фторхинолоны. После завершения пандемии COVID-19, в ходе которой широко использовались противоэпидемические мероприятия, ограничивавшие передачу вирусных и бактериальных агентов, во многих странах был отмечен рост числа пневмоний, ассоциированных с Mycoplasma pneumoniae. В своем большинстве микоплазменная пневмония протекает нетяжело и характеризуется благоприятным прогнозом, что, однако, не исключает тяжелых форм заболевания. Следует также учитывать и возрастающее число случаев микоплазменной инфекции, устойчивой к терапии макролидами.
Ключевые слова: внебольничная пневмония, вызываемая Mycoplasma pneumoniae, диагностика и антибактериальная терапия микоплазменной пневмонии.
Для цитирования: Синопальников А.И., Тюрин И.Е., Гучев И.А. Внебольничная пневмония, ассоциированной с Mycoplasma pneumoniae: подходы к диагностике и лечению. Клинический разбор в общей медицине. 2025; 6 (11): 43–50. DOI: 10.47407/kr2025.6.11.00710
Community-acquired pneumonia associated with Mycoplasma pneumoniae: diagnostic and treatment approaches
Alexander I. Sinopalnikov1, Igor E. Tyurin1, Igor A. Guchev21 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Nikita & Co, Moscow, Russia
dr@igor-guchev.ru
Abstract
Community-acquired pneumonia (CAP) contributes greatly to the structure of the infectious disease morbidity and mortality rates, especially in people of older age groups and patients suffering from chronic diseases of internal organs. Streptococcus pneumoniae and Haemophilus influenzae represent the most common CAP causative agents that often contribute to rapid disease progression and therefore require early prescription of adequate antimicrobial therapy. According to the clinical guidelines, the first line drugs are beta-lactams and in certain cases “respiratory” fluoroquinolones. After the end of the COVID-19 pandemic, during which anti-epidemic measures limiting transmission of viral and bacterial agents were widely used, growth of the rate of pneumonia associated with Mycoplasma pneumonia was reported in many countries. In most cases, mycoplasmal pneumonia has a mild course and is characterized by favorable prognosis, which, however, does not eliminate severe disease forms. The growing number of cases of mycoplasmal infection resistant to macrolide therapy should also be considered.
Keywords: community-acquired pneumonia caused by Mycoplasma pneumoniae, diagnosis and antimicrobial therapy of mycoplasmal pneumonia.
For citation: Sinopalnikov A.I., Tyurin I.E., Guchev I.A. Community-acquired pneumonia associated with Mycoplasma pneumoniae: diagnostic and treatment approaches. Clinical review for general practice. 2025; 6 (11): 43–50 (In Russ.). DOI: 10.47407/kr2025.6.11.00710
Введение
Согласно общепринятому определению, пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации. Внебольничной пневмонией (ВП) считают случаи легочного воспаления, развившиеся вне стационара либо диагностированные в первые 48 ч с момента госпитализации. Заболевание сопровождается симптомами инфекции нижних дыхательных путей (повышение температуры тела, кашель, отделение мокроты, боль в грудной клетке, одышка), симптомами интоксикации и свежими очагово-инфильтративными изменениями в легких при отсутствии очевидной диагностической альтернативы [1].
Диагностика пневмонии традиционно базируется на результатах клинического и параклинического обследования, впрочем, не являющихся строго специфичными и высокочувствительными, особенно при установлении этиологического диагноза [2, 3]. В связи с этим лечение ВП является эмпирическим, основанном на предположении о конкретном виновном патогене и знании его чувствительности к определенному кругу антибиотиков.
Самым распространенным бактериальным возбудителем ВП является Streptococcus pneumoniae, который наряду с существенно менее часто встречающимися Staphylococcus aureus и Klebsiella pneumoniae обусловливает нередко тяжелое течение заболевания и его неблагоприятный исход [4–7]. При нетяжелых формах заболевания S. aureus, а также K. pneumoniae и ряд других грамотрицательных бактерий, встречаются существенно реже [8, 9]. С практической точки зрения следует отметить, что этиологическая роль H. influenzae оказывается сопоставимой с пневмококком у пациентов с хроническими бронхолегочными заболеваниями и/или хронической сердечной недостаточностью [5, 8–11]. Именно среди последних отмечена наибольшая распространенность ВП, требующих госпитализации и нередко заканчивающихся летально [12].
Важную роль, преимущественно у детей, подростков и лиц молодого возраста, играют некоторые атипичные возбудители, среди которых доминирующее место занимает Mycoplasma pneumoniae. И именно годы, последовавшие после пандемии COVID-19, были отмечены взрывным ростом случаев микоплазменной инфекции, в том числе и среди госпитализированных больных с ВП, достигая, по данным ряда авторов, 44% среди всех этиологически верифицированных случаев заболевания [5, 13–18]. Впрочем, представленные результаты следует оценивать с осторожностью, поскольку без подтверждения соответствующей динамики специфичных антител в остром периоде заболевания и в периоде реконвалесценции крайне затруднительно судить об этиологической роли микроорганизма, способного длительное время персистировать на слизистой оболочке ротоглотки. Так, например, в ходе недавно проведенного российского исследования присутствие M. pneumoniae в материале верхних дыхательных путей у здоровых взрослых было подтверждено в 4% случаев [19]. Здесь важно заметить, что если еще недавно микоплазменная инфекция, в том числе и в форме пневмонии, считалась едва ли не исключительной «привилегией» детей и юношей, то согласно современным данным частота M. pneumoniae в этиологической структуре ВП у пожилых и стариков составляет 2,3–5% [13, 20, 21].
В большинстве случаев микоплазменная инфекция дыхательных путей манифестируется как фарингит и трахеобронхит, существенно реже – как пневмония [22]. Чаще инфекция протекает легко и склонна к спонтанному излечению [13, 18, 23–25]. В то же время у пациентов с сопутствующими заболеваниями, например с ожирением, артериальной гипертензией, хронической печеночной недостаточностью и др., благоприятное течение микоплазменной пневмонии (МП) менее вероятно, особенно при применении антибиотиков, неактивных против микоплазмы [14, 26, 27]. Более тяжелого течения микоплазменной ВП также можно ожидать при вирусной и бактериальной, в первую очередь хламидийной, гемофильной и пневмококковой, коинфекциях [28–30].
Актуальный «ренессанс» МП видоизменил наши традиционные представления об эпидемиологии заболевания и особенностях его клинического течения. Так, в частности, среди лиц 18 лет и старше 19–25% заболевших МП требуют госпитализации, причем среди лиц старше 75 лет их частота доходит до 48–61% [31]. При этом до 11% пациентов госпитализируются в отделения интенсивной терапии в основном в связи с развитием острой дыхательной недостаточности [32]. Кумулятивная госпитальная летальность у взрослых достигает 2% [14] или 0,38% [33] в общей популяции лиц, переносящих МП. И все же, несмотря на приведенные свидетельства значимого вклада M. pneumoniae в этиологию ВП среди пациентов, требующих госпитализации, к результатам цитируемых исследований следует относиться сдержанно, поскольку неясно, сопровождали ли микоплазменную инфекцию иные, неидентифицированные микроорганизмы, определявшие фактическую тяжесть заболевания.
Антибактериальная терапия ВП является эмпирической, что связано с трудностями идентификации возбудителей, в том числе ограниченными минимальными возможностями установления этиологического диагноза при анализе анамнестических, клинических и параклинических данных [1]. Для большинства взрослых пациентов с ВП (50–80%) характер и объем терапевтических вмешательств может быть ограничен амбулаторным лечением [34–37]. При этом в случае последнего предпочтительна монотерапия, а не комбинированное лечение, с назначением антибиотиков ограниченного спектра активности в пероральной лекарственной форме [1, 38–49]. В обсуждаемой клинической ситуации в качестве стартовой терапии рекомендуется применение аминопенициллинов, оральных цефалоспоринов с приемлемой антипневмококковой активностью и респираторных фторхинолонов. В регионах с доказанно высоким уровнем чувствительности пневмококка к макролидам, а также в случаях обоснованного предположения об атипичной природе нетяжелой ВП также целесообразно назначение представителей этого класса антибиотиков.
В ряде зарубежных клинических руководств в рамках эмпирической терапии нетяжелой ВП у пациентов с сопутствующими заболеваниями рекомендовано одновременно с бета-лактамом применение макролида или доксициклина. Впрочем, здесь следует принимать во внимание тот факт, что до настоящего времени свидетельства в пользу комбинированной антибактериальной терапии над монотерапией не свободны от контр-аргументов [1, 50].
M. pneumoniae: общая характеристика
Особенности инфекций респираторного тракта, связанных с M. pneumoniae, определяются способностью микроорганизма к тесному взаимодействию с эпителием дыхательных путей. Прикрепление возбудителя к клетке и периэпителиальная инвазия приводят к обездвиживанию ресничек, апоптозу и десквамации мерцательного эпителия слизистой дыхательных путей. Здесь важно подчеркнуть, что нарушения двигательной активности ресничек могут сохраняться до 12 мес [51].
M. pneumoniae склонна к длительной персистенции на поверхности респираторного эпителия с формированием биопленки [52]. Затрудняет элиминацию микроорганизма и его способность к интрацеллюлярному переживанию, ограничивающему провоспалительный ответ со стороны иммунной системы хозяина [53, 54]. Выявленная при М. pneumoniae повышенная продукция MUC-5AC является чувствительным маркером формирования слизистых пробок, обтурирующих просвет бронхов и бронхиол (так называемая мукоидная закупорка бронхов) [55].
Учитывая распространенность МП, при определении тактики эмпирической терапии целесообразно рассмотреть чувствительность возбудителя к основным антибиотикам, применяемым в соответствии с существующими клиническими рекомендациями [1].
С 2000 г. в Японии, а также в других странах Азиатско-Тихоокеанского региона и Юго-Восточной Азии отмечается снижение чувствительности микоплазмы к макролидам [14, 56, 57]. Уровень устойчивости составляет, например, 27–100% в Китае [57], 88% на Тайване (детская популяция) [58], 60% в Японии [59]. Более низкие уровни устойчивости подтверждены в США и Европе, где они достигали 9% (5–12%) и 6% (1–12%) соответственно [60].
По данным P. Xie и соавт. [61], у устойчивых к макролидам штаммов идентифицирована замена аденина на гуанин в 2063-й позиции V домена гена 23S рибосомальной РНК. В ряде случаев определялись маркеры систем активного выброса. Отмечено, что наличие мутации A2063G в комбинации или без системы активного выброса не влияло или незначительно повышало уровни минимальной подавляющей концентрации 16-членных макролидов, но сопровождалось существенном увеличением минимальной подавляющей концентрации 14- и 15-членных макролидов [61, 62].
Сведения о резистентности M. pneumoniae к макролидам в Российской Федерации в настоящее время весьма ограничены. Низкая (7%) резистентность, ассоциированная с мутацией в локусе A2063G, продемонстрирована Е. Ворониной и соавт., исследовавшими 117 геномов M. pneumoniae, выделенных в 2015–2018 гг. [63]. При анализе 3 генетических копий, полученных в стационаре г. Москвы в 2023–2024 гг., продемонстрировано отсутствие детерминант устойчивости к макролидам. В то же время выявленные сиквенс-типы были внутри клады, для которой характерна повышенная мутабельность геномов, в том числе связанных с устойчивостью к макролидам [64]. Менее благоприятная ситуация описана в еще одном исследовании 2023–2024 гг., в ходе которого при тестировании образцов, полученных от 193 детей 7–17 лет, уровень резистентности к макролидам (мутация 2063 A/G) составил 40,8% в Европейской части России и 35,7% на Дальнем Востоке [19]. Результаты данного исследования нельзя полностью переносить на взрослую популяцию, поскольку уровни резистентности у детей и взрослых отличаются и первые из них демонстрирует более высокие показатели. Однако, учитывая модель заражения (от ребенка к взрослому индивиду), высокие уровни резистентности M. pneumoniae к макролидам во взрослой популяции весьма вероятны.
Ранее было показано, что устойчивость микоплазмы к макролидам может сопровождаться прогрессированием заболевания, его рефрактерным течением, а также удлинением сроков клинического и рентгенологического выздоровления [26, 27, 65]. При наличии устойчивого к макролидам возбудителя благоприятного течения микоплазменной ВП можно ожидать при применении доксициклина и респираторных фторхинолонов [27, 66]. Указанные различия в клиническом течении заболевания в условиях распространения устойчивых к макролидам азиатских клад M. pneumoniae требуют поиска ранних маркеров МП.
Возможности диагностики МП
Анализ актуальной клинической симптоматики делает маловероятным надежную дифференциацию микоплазменной и любой иной этиологии ВП [3, 22]. Впрочем, длительный продромальный период, интермиттирующий субфебрилитет, малопродуктивный кашель, в том числе с приступами до рвоты, невысокий уровень С-реактивного белка и чаще нормальное содержание лейкоцитов крови могут, особенно при наличии указаний на семейные вспышки и вспышки синдромо-сходной респираторной инфекции в организованных коллективах, настроить врача на предположение о микоплазменной инфекции [22, 67, 68]. В ходе клинической диагностики респираторного микоплазмоза (исключались случаи пневмонии) можно опираться на исследование N. Miyashita и соавт., результаты которого свидетельствовали о таких часто встречавшихся при микоплазменной инфекции симптомах, как кашель (98%), боли в горле (61%), продукция мокроты (67%). Одновременно авторами была отмечена редкость такого симптома, как заложенность носа и ринорея (9%), в то время как у лиц без подтвержденной M. pneumoniae инфекции данные симптомы выявлялись в 70% случаев. Однако все перечисленные клинические признаки справедливо были оценены как низкоспецифичные [69].

Более точному установлению этиологического диагноза могут способствовать дополнительные данные, полученные при проведении лучевых и лабораторных исследований. С практической точки зрения следует отметить невысокую чувствительность и специфичность рентгенологического исследования, рассматриваемого в клинических рекомендациях в качестве основы для подтверждения диагноза «пневмония» [1].
Так, в ходе многоцентрового когортного исследования взрослых пациентов (n=3423, медиана возраста 52–54 года), общими симптомами для которых являлись остро возникшие одышка, боли в груди и кашель, рентгенография органов грудной клетки продемонстрировала низкие показатели чувствительности (43,5%; 95% доверительный интервал 36,4–50,8%) и положительной прогностической ценности (26,9%; 95% доверительный интервал 22,1–32,2%) в выявлении очаговых легочных затемнений. Авторы сделали вывод, что использование рентгенографии в качестве основного метода диагностики пневмонии может приводить к значительному количеству ошибочных диагнозов [70]. Еще одним свидетельством низкой чувствительности рентгенографии органов грудной клетки в диагностике пневмонии, выполненной в первые 2 сут заболевания, явилось исследование D. Ibrahim и соавт. [71]: было показано, что в 41,5% случаев отрицательного или неопределенного результата рентгенографии последующее выполнение компьютерной томографии (КТ) органов грудной клетки подтверждало наличие очагово-инфильтративных изменений в легких. Основными причинами недостаточной чувствительности рентгенографии являются транспозиция очага и такие не выявляемые при этом исследовании паттерны, как «дерево в почках», «матовое стекло».
К числу недостатков рентгенографии следует отнести и трудности в дифференциации собственно пневмонии с такими патологическими процессами, как обтурационный ателектаз, локальная гиповентиляция, инфаркт легкого, стелящаяся аденокарцинома и др.
Относительно чувствительные признаки МП удается выявить при выполнении КТ высокого разрешения (КТВР) [72–74]. К их числу относятся центрилобулярные очаги, ограниченные размерами дольки участки «матового стекла» и паттерн «дерево в почках».
По данным китайских исследователей, изучивших КТВР у 400 пациентов с ВП различной, в том числе и микоплазменной, этиологии, наиболее чувствительными лучевыми признаками последней являлись незначительные по протяженности участки «матового стекла», накладывающиеся на «дерево в почках» при отсутствии воздушной бронхограммы в зоне инфильтрации. Для этого типа изменений ими был предложен термин «дерево в тумане» (tree in fog) [73].
Заслуживают внимания и результаты исследования, в ходе которого была предпринята попытка приблизиться к этиологической расшифровке ВП с учетом доминирующих КТ-паттернов [75], учитывающих, в частности, распространенность затемнения (сегментарное или субсегментарное), наличие или отсутствие центилобулярных узелков и утолщения стенки бронхиол (рис. 1).

Сопоставлению патоморфологических и радиологических находок при МП было посвящено исследование H. Tanaka [74]. Автор выделил три основные морфорадиологическое корреляции:
а) перибронхиальная и периваскулярная муфтообразная инфильтрация мононуклеарными клетками соответствовала утолщению бронховаскулярных пучков на КТВР, что являлось наиболее частым признаком данной пневмонии;
б) бронхиолит с наличием экссудата или грануляционной ткани в просвете в мелких дыхательных путях визуализировался в виде центрилобулярных узелков;
в) внутриальвеолярная инфильтрация нейтрофилами манифестировала участками «воздушной» консолидации или «матового стекла».
Примечательно, что у пациентов с преобладанием центрилобулярных узелков на КТ отмечался высокий уровень клеточного иммунитета; в противоположность этому более сдержанный ответ клеточного иммунитета чаще соседствовал с паттерном «матового стекала» и консолидацией легочной ткани. В этой связи автором было высказано оригинальное предположение о том, что морфологические изменения и их рентгенологические ассоциации при ВП, вызванной M. pneumoniae, могут варьировать в зависимости от уровня клеточного иммунного ответа.
Оценивая прогностическую значимость КТ-изменений и клинических симптомов при диагностике/дифференциальной диагностике МП, нельзя не упомянуть опубликованное в 2011 г. исследование N. Miyashita и соавт. [76], в ходе которого авторами было показано некоторое превосходство клинико-лабораторных критериев атипичной пневмонии Японского респираторного общества (см. таблицу) над результатами КТВР при оценке чувствительности (85 и 73%) и специфичности (90 и 83%) соответственно.
С клинической и прогностической точек зрения интересным представляется анализ течения и исходов МП у детей [77]. Авторами в частности было показано, что наличие внелегочных симптомов заболевания, гомогенной лобарной консолидации и парапевмонического плеврита надежно корреспондирует с длительно сохраняющейся лихорадкой (≥7 сут) с начала лечения и не зависит от возможной резистентности возбудителя к макролидам.
Наиболее точная этиологическая диагностика основывается на применении полимеразной цепной реакции (ПЦР). Однако в связи с возможностью длительной (≥4 мес) персистенции M. pneumoniae на респираторном эпителии обнаружение генетических маркеров возбудителя не позволяет уверенно судить о соответствующей этиологии пневмонии [78–80]. Поэтому в целях надежной этиологической диагностики микоплазменной инфекции целесообразно сочетание ПЦР с определением специфичных антител: IgA, а также оценкой динамики IgM и IgG в остром периоде заболевания и в периоде реконвалесценции. В исследовательских целях также определяется активность специфичных к антигену микоплазмы секретирующих Ig плазмоцитов [58, 78, 80–83].
Клиническое наблюдение
Ниже мы приводим клиническое наблюдение, демонстрирующее трудности ведения больных с ВП, встающие перед врачом амбулаторного звена.
Пациентка 33 лет, страдающая вторичным гипотиреозом, компенсированным Эутироксом, обратилась в поликлинику 13.04.2025 с жалобами на малопродуктивный кашель с отделением скудной светлой вязкой мокроты, непостоянную боль в горле и заложенность носа без ринореи. Из анамнеза известно, что заболевание манифестировало 06.04.2025, когда на фоне персистирующего в течение последних 5–6 сут редкого покашливания появились надсадный сухой кашель, постоянная боль в горле. На следующий день температура тела повысилась до 38°С, а также усилился кашель, который приобрел приступообразный характер, возникая как в дневное, так и в ночное время. На 3-и сутки болезни, 08.04.2025, температура достигла 38,8°С, прием парацетамола сопровождался непродолжительным снижением температуры тела до уровня высокого субфебрилитета. На 4-е сутки заболевания (09.04.2025) пациентка была осмотрена врачом поликлиники, установлен диагноз «трахеит» и назначена симптоматическая терапия. В связи с сохранением фебрильной лихорадки на 6-е сутки, 11.04.2025, начато лечение цефтриаксоном 1,0 г 2 раза в день внутримышечно, дополнительно применялся эрдостеин.
На фоне антибактериальной терапии у пациентки сохранялся высокий субфебрилитет, беспокоил приступообразный малопродуктивный кашель. Консультация пульмонолога 13.04.2025: при осмотре аксиллярная температура 36,9°С, SpO2 97%, пульс 108 в минуту, артериальное давление 110/74 мм рт. ст., частота дыхания 18 в минуту. При аускультации над левым легким выслушивались немногочисленные разнотембровые сухие свистящие хрипы.
Учитывая неэффективность терапии цефтриаксоном, подострое начало заболевания с симптомов инфекции верхних дыхательных путей, отсутствие демонстративных острофазовых изменений лабораторных показателей (анализ крови от 12.04.2025: С-реактивный белок 18,75 мг/л, лейкоциты 4860/мкл), было высказано предположение о микоплазменной этиологии пневмонии.
Не противоречили этому диагнозу и результаты КТ-исследования от 11.04.2025 (рис. 2).

Учитывая риск устойчивости предполагаемого возбудителя (M. pneumoniae) к макролидам, после отмены цефтриаксона был назначен моксифлоксацин внутрь (Кимокс®) в дозе 400 мг. На фоне терапии к исходу 3-х суток приема респираторного фторхинолона температура тела стойко нормализовалась, уменьшилась интенсивность кашля, сопровождавшегося отделением скудной светло-желтой мокроты.
 Позднее были получены результаты лабораторных исследований, подтвердившие высказанное предположение о микоплазменной этиологии пневмонии. Антитела к M. pneumoniae от 12.04.2025: IgG – коэффициент позитивности 0,01 (отрицательный результат), IgM – коэффициент позитивности 5,7 (положительный результат). Метод качественной ПЦР (мазок слизистой ротоглотки) от 13.04.2025 – выявлена ДНК M. pneumoniae. Антитела к M. pneumoniae (иммуноферментный анализ) 05.05.2025 – IgG 4 УЕ, IgM 3,05 УЕ.
Позднее были получены результаты лабораторных исследований, подтвердившие высказанное предположение о микоплазменной этиологии пневмонии. Антитела к M. pneumoniae от 12.04.2025: IgG – коэффициент позитивности 0,01 (отрицательный результат), IgM – коэффициент позитивности 5,7 (положительный результат). Метод качественной ПЦР (мазок слизистой ротоглотки) от 13.04.2025 – выявлена ДНК M. pneumoniae. Антитела к M. pneumoniae (иммуноферментный анализ) 05.05.2025 – IgG 4 УЕ, IgM 3,05 УЕ.При оценке результатов КТ органов грудной клетки в динамике был отмечен регресс очагово-инфильтративных изменений в левом легком (рис. 3).
Рассмотренный клинический случай, являющийся нередким в амбулаторной практике, демонстрирует сложности клинико-инструментальной диагностики микоплазменной инфекции, что, в свою очередь, затрудняет выбор ориентированной на причинный возбудитель целенаправленной антимикробной терапии. Отсутствие лейкоцитоза, скудные аускультативные данные, упорный малопродуктивный кашель, боли в горле являются относительно специфичными дифференциально-диагностическими критериями, позволяющими предположить МП при первом контакте с пациентом [3, 69, 84]. Дополнительную помощь в ходе дифференциальной диагностики могут оказать анамнестические данные. Отсутствие эффекта при применении адекватной с учетом текущего уровня устойчивости [85] дозы цефтриаксона наряду со стабильным течением заболевания делает менее вероятным предположение о пневмококковой инфекции, а отсутствие анамнестических указаний на курение, хронический бронхит или хроническую обструктивную болезнь легких минимизирует риск H. influenzae.
Что же касается результатов КТ, то они, также не являясь строго специфичными, могут оказать дополнительную помощь при обнаружении таких рентгенологических находок, как участки «матового стекла», утолщение стенок бронхов/бронхиол, цетрилобулярные очаги (рис. 4, 5).
Очевидно, что решающую роль в этиологической диагностике микоплазменной инфекции играют иммуносерологические и молекулярно-биологические методы диагностики. Положительный результат ПЦР наряду с нарастанием титров IgG и повышением титра IgM уменьшили риск ложноположительного результата, который мог быть связан с фарингеальным носительством и персистенцией микоплазмы [76].
В лечении предполагаемой МП был использован моксифлоксацин (Кимокс®), обеспечивающий надежную эрадикацию M. pneumoniae, в том числе и штаммов, устойчивых к макролидам. Его применение способствовало быстрой, в течение 3 сут, нормализации температуры, уменьшению частоты и интенсивности кашлевых пароксизмов.
Рассматривая целесообразность эмпирического применения альтернативных макролидам препаратов, мы исходили из имеющихся данных о повышенном риске устойчивости к 14- и 15-членным макролидам возбудителей, несущих мутации в локусе A2063G гена 23SрРНК [19].
 Выводы
ВыводыПредставленный клинический случай и обзор литературы демонстрируют сложности этиологический диагностики ВП на основании клинических, лабораторных и лучевых методов исследования. Распространившиеся в постпандемический период респираторные инфекции, ассоциированные с M. pneumoniae, не всегда склонны к быстрому спонтанному разрешению. При выборе стартовой антибактериальной терапии ВП, безусловно принимая во внимание соответствующие анамнестические и клинические данные, следует применять препараты с учетом структуры и чувствительности основных возбудителей заболевания [1].
Решение задачи целенаправленной, а не общепринятой эмпирической стартовой терапии ставит во главу угла раннюю этиологическую диагностику ВП. С этой целью помимо клинико-анамнестических данных используются результаты лабораторных тестов, в том числе направленных на выявление этиологии ВП. Следует признать, что в ходе первичного приема получение результатов параклинических исследований вряд ли возможно, что затрудняет не только этиологическую диагностику, но порой и саму возможность выявления пневмонии.
С практической точки зрения представляется логичным расширение показаний к проведению КТ, особенно у лиц с факторами риска неблагоприятного течения пневмонии и клинико-анамнестическими признаками, подозрительными в отношении респираторного микоплазмоза. При этом обнаружение таких патологических изменений, как цетрилобулярные очаги, участки интерстициальной инфильтрации («матовое стекло»), могут оказать поддержку ранней этиологической диагностике.
Пациентам, у которых при первичном осмотре выявлены клинические и лучевые признаки, подозрительные в отношении МП, равно как и при неэффективности стартовой терапии бета-лактамом, целесообразно назначение альтернативных антибиотиков. Наиболее эффективны в данной ситуации респираторные фторхинолоны [1].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Синопальников Александр Игоревич – д-р мед наук, проф., зав. каф. пульмонологии ФГБОУ ДПО РМАНПО, засл. врач РФ
Alexander I. Sinopalnikov – Dr. Sci. (Med.), Professor, Russian Medical Academy of Continuous Professional Education
Тюрин Игорь Евгеньевич – д-р мед наук, проф., зав. каф. рентгенологии и радиологии ФГБОУ ДПО РМАНПО
Igor E. Tyurin – Dr. Sci. (Med.), Professor, Russian Medical Academy of Continuous Professional Education
Гучев Игорь Анатольевич – канд. мед. наук, врач-пульмонолог ООО «Никита и Ко». E-mail: dr@igor-guchev.ru; ORCID: 0000-0002-8958-5767
Igor A. Guchev – Cand. Sci. (Med.), pulmonologist, Nikita & Co.
E-mail: dr@igor-guchev.ru; ORCID: 0000-0002-8958-5767
Поступила в редакцию: 15.08.2025
Поступила после рецензирования: 22.08.2025
Принята к публикации: 28.08.2025
Received: 15.08.2025
Revised: 22.08.2025
Accepted: 28.08.2025
Список исп. литературыСкрыть список1. Клинические рекомендации. Внебольничная пневмония у взрослых. ID 654_2. Российское респираторное общество, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. 2024.
Clinical guidelines. Community-acquired pneumonia in adults. ID 654_2. Russian Respiratory Society, Interregional Association for Clinical Microbiology and Antimicrobial Chemotherapy. 2024 (in Russian).
2. Gupta AB, Flanders SA, Petty LA et al. Inappropriate diagnosis of pneumonia among hospitalized adults. JAMA Internal Med 2024;184(5):548-56.
3. Ishida T, Miyashita N, Nakahama C. Clinical differentiation of atypical pneumonia using Japanese guidelines. Respirology 2007;12(1):
104-10.
4. Riano-Sanchez LF, Alvarez-Moreno CA, Godoy M et al. Multiplex PCR Pneumonia Panel in Critically Ill Patients Did Not Modify Mortality: A Cohort Study. Antibiotics (Basel) 2025;14(3).
5. Rachina SA, Kupryushina OA, Strelkova DA et al. Etiology of community-acquired pneumonia in adults in Russian hospitals after the COVID-19 pandemic: results of a multicenter prospective study. Clin Microbiol Antimicrobial Chemother 2024;26(2):141-7.
6. Jain S, Self WH, Wunderink RG et al. Community-Acquired Pneumonia Requiring Hospitalization among U.S. Adults. N Engl J Med 2015;373(5):415-27.
7. Иванчик Н.В., Козлов С.Н., Рачина С.А. и др. Антибиотикорезистентность возбудителей фатальных внебольничных пневмоний у взрослых. Клиническая микробиология и антимикробная химиотерапия. 2008;10(4):368-80.
Ivanchik N.V., Kozlov S.N., Rachina S.A., et al. Antibiotic resistance of pathogens causing fatal community-acquired pneumonia in adults. Clinical microbiology and antimicrobial chemotherapy. 2008;10(4):368-80 (in Russian).
8. Markussen DL, Kommedal O, Knoop ST et al. Microbial aetiology of community-acquired pneumonia in hospitalised adults: A prospective study utilising comprehensive molecular testing. Int J Infect Dis 2024;(143):107019.
9. Abelenda-Alonso G, Calatayud L, Rombauts A et al. Multiplex real-time PCR in non-invasive respiratory samples to reduce antibiotic use in community-acquired pneumonia: a randomised trial. Nature Communications 2024;15(1).
10. Shoar S, Musher DM. Etiology of community-acquired pneumonia in adults: a systematic review. Pneumonia (Nathan) 2020;(12):11.
11. Gadsby NJ, Russell CD, McHugh MP et al. Comprehensive Molecular Testing for Respiratory Pathogens in Community-Acquired Pneumonia. Clin Infect Dis 2016;62(7):817-23.
12. Bordon J, Slomka M, Gupta R et al. Hospitalization due to community-acquired pneumonia in patients with chronic obstructive pulmonary disease: incidence, epidemiology and outcomes. Clin Microbiol Infect 2020;26(2):220-6.
13. Waldeck F, Kramer TS, Boutin S et al. Re-emergence of Mycoplasma pneumoniae before and after COVID-19 pandemic in Germany. BMC Infect Dis 2025;25(1):318.
14. Gavaud A, Holub M, Asquier-Khati A et al. Mycoplasma pneumoniae infection in adult inpatients during the 2023-24 outbreak in France (MYCADO): a national, retrospective, observational study. Lancet Infect Dis 2025.
15. Garzoni C, Bernasconi E, Zehnder C et al. Unexpected increase of severe Mycoplasma pneumoniae pneumonia in adults in Southern Switzerland. Clin Microbiol Infect 2024;30(7):953-4.
16. Hansen K, Yamba Yamba L, Wasserstrom L et al. Exploring the microbial landscape: uncovering the pathogens associated with community-acquired pneumonia in hospitalized patients. Front Public Health 2023;(11):1258981.
17. Meyer Sauteur PM, Beeton ML, group EtEMs. Mycoplasma pneumoniae: gone forever? Lancet Microbe 2023;4(10):e763.
18. Edelstein IA, Ivanova OV, Romashov OI, Kozlov RS. Course of Lower Respiratory Tract Infection in Young People Treated at the Military Hospital of Smolensk Garrison with Detected Mycoplasma pneumoniae Carrying a Macrolide-Resistant Mutation in 23S rRNA Gene. Pathogens 2023;12(1).
19. Korneenko E, Rog I, Chudinov I et al. Antibiotic resistance and viral co-infection in children diagnosed with pneumonia caused by Mycoplasma pneumoniae admitted to Russian hospitals during October 2023-February 2024. BMC Infect Dis 2025;25(1):363.
20. Lieberman D, Lieberman D, Schlaeffer F, Porath A. Community-acquired pneumonia in old age: a prospective study of 91 patients admitted from home. Age Ageing 1997;26(2):69-75.
21. Orr PH, Peeling RW, Fast M et al. Serological study of responses to selected pathogens causing respiratory tract infection in the institutionalized elderly. Clin Infect Dis 1996;23(6):1240-5.
22. Waites KB, Xiao L, Liu Y et al. Mycoplasma pneumoniae from the Respiratory Tract and Beyond. Clin Microbiol Rev 2017;30(3):747-809.
23. Clyde WA, Jr. Clinical overview of typical Mycoplasma pneumoniae infections. Clin Infect Dis 1993;17(Suppl.1):S32-36.
24. Chambers ST, Town GI, Neill AM et al. Legionella, Chlamydia pneumoniae and Mycoplasma infection in patients admitted to Christchurch Hospital with pneumonia. N Zealand Med J 1999;112(1090):222-4.
25. Kim CK, Chung CY, Kim JS et al. Late abnormal findings on high-resolution computed tomography after Mycoplasma pneumonia. Pediatrics 2000;105(2):372-8.
26. Pereyre S, Goret J, Bebear C. Mycoplasma pneumoniae: Current Knowledge on Macrolide Resistance and Treatment. Front Microbiol 2016;(7):974.
27. Matsumoto M, Nagaoka K, Suzuki M et al. An adult case of severe life-threatening Mycoplasma pneumoniae pneumonia due to a macrolide-resistant strain, Japan: a case report. BMC Infect Dis 2019;19(1):204.
28. Chen B, Pan J, Peng Y et al. Characteristics and risk factors for outcomes in patients with Mycoplasma pneumoniae mono- and coinfections: A multicenter surveillance study in Wuhan, China, 2023. Infect Dis Model 2025.
29. Qu J, Zhang J, Chen Y et al. Aetiology of severe community acquired pneumonia in adults identified by combined detection methods: a multi-centre prospective study in China. Emerg Microbes Infect 2022;11(1):556-66.
30. Lim YK, Kweon OJ, Kim HR et al. Impact of bacterial and viral coinfection in community-acquired pneumonia in adults. Diagnostic Microbiol Infect Dis 2019;94(1):50-4.
31. Nordholm AC, Soborg B, Jokelainen P et al. Mycoplasma pneumoniae epidemic in Denmark, October to December, 2023. Euro Surveill 2024;29(2):2300707.
32. Bolluyt DC, Euser SM, Souverein D et al. Increased incidence of Mycoplasma pneumoniae infections and hospital admissions in the Netherlands, November to December 2023. Euro Surveill 2024;29(4).
33. ESGMAC Maps study group. Global spatiotemporal dynamics of Mycoplasma pneumoniae re-emergence after COVID-19 pandemic restrictions: an epidemiological and transmission modelling study. Lancet Microbe 2025;6(4):101019.
34. Castelan-Martinez OD, Hernandez-Carbajal E, Contreras-Garcia CE et al. [Effectiveness of the outpatient treatment of the community-acquired pneumonia: systematic review and meta-analysis]. Rev Med Inst Mex Seguro Soc 2016;54(1):128-36.
35. Matuz M, Bognar J, Hajdu E et al. Treatment of Community-Acquired Pneumonia in Adults: Analysis of the National Dispensing Database. Basic Clin Pharmacol Toxicol 2015;117(5):330-4.
36. Ye X, Sikirica V, Schein JR et al. Treatment failure rates and health care utilization and costs among patients with community-acquired pneumonia treated with levofloxacin or macrolides in an outpatient setting: a retrospective claims database analysis. Clin Ther 2008;30(2):358-71.
37. Pomilla PV, Brown RB. Outpatient treatment of community-acquired pneumonia in adults. Arch Intern Med 1994;154(16):1793-802.
38. Ewig S, Kolditz M, Pletz M et al. [Management of Adult Community-Acquired Pneumonia and Prevention – Update 2021 – Guideline of the German Respiratory Society (DGP), the Paul-Ehrlich-Society for Chemotherapy (PEG), the German Society for Infectious Diseases (DGI), the German Society of Medical Intensive Care and Emergency Medicine (DGIIN), the German Viological Society (DGV), the Competence Network CAPNETZ, the German College of General Practitioneers and Family Physicians (DEGAM), the German Society for Geriatric Medicine (DGG), the German Palliative Society (DGP), the Austrian Society of Pneumology Society (OGP), the Austrian Society for Infectious and Tropical Diseases (OGIT), the Swiss Respiratory Society (SGP) and the Swiss Society for Infectious Diseases Society (SSI)]. Pneumologie (Stuttgart) 2021;75(9):665-729.
39. Metlay JP, Waterer GW, Long AC et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. Am J Respir Crit Care Med 2019;200(7):e45-e67.
40. Heffelfinger JD, Dowell SF, Jorgensen JH et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drug-Resistant Streptococcus pneumoniae Therapeutic Working Group. Arch Intern Med 2000;160(10):1399-408.
41. Martin-Loeches I, Torres A, Nagavci B et al. ERS/ESICM/ESCMID/ ALAT guidelines for the management of severe community-acquired pneumonia. Eur Respir J 2023;61(4).
42. Mandell LA, Marrie TJ, Grossman RF et al. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group. Clin Infect Dis 2000;31(2):383-421.
43. Mandell LA, Bartlett JG, Dowell SF et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults. Clin Infect Dis 2003;37(11):1405-33.
44. Summary of the evidence. Pneumonia (community-acquired): antimicrobial prescribing. Guidance. NICE. Available at: https://www.nice.org.uk/guidance/ng138/chapter/Summary-of-the-evidence; accessed: 16.02.2025.
45. Lim WS, Smith DL, Wise MP et al. British Thoracic Society community acquired pneumonia guideline and the NICE pneumonia guideline: how they fit together. Thorax 2015;70(7):698-700.
46. Rodriguez-Leal CM, Gonzalez-Corralejo C, Candel FJ, Salavert M. Medical societies for the 5th edition of Pneumonia D. Candent issues in pneumonia. Reflections from the Fifth Annual Meeting of Spanish Experts 2023. Rev Esp Quimioter 2024;37(3):221-51.
47. Candel FJ, Salavert M, Basaras M et al. Ten Issues for Updating in Community-Acquired Pneumonia: An Expert Review. J Clin Med 2023;12(21).
48. Yanagihara K, Kohno S, Matsusima T. Japanese guidelines for the management of community-acquired pneumonia. Int J Antimicrob Agents 2001;18(Suppl.1):S45-48.
49. Yatera K, Yamasaki K. Management of the Diagnosis and Treatment of Pneumonia in an Aging Society. Intern Med (Tokyo) 2024.
50. Akinosoglou K, Leventogiannis K, Tasouli E et al. Clarithromycin for improved clinical outcomes in community-acquired pneumonia: A subgroup analysis of the ACCESS trial. Int J Antimicrob Agents 2025;65(2):107406.
51. Edelstein IA. Mycoplasma pneumoniae – modern data on the structure, molecular biology and epidemiology of the pathogen. Clin Microbiol Antimicrobial Chemother 2023;25(4):332-49.
52. Feng M, Burgess AC, Cuellar RR et al. Modelling persistent Mycoplasma pneumoniae biofilm infections in a submerged BEAS-2B bronchial epithelial tissue culture model. J Med Microbiol 2021;70(1).
53. De Groot RCA, Zhu H, Hoogenboezem T et al. Mycoplasma pneumoniae Compared to Streptococcus pneumoniae Avoids Induction of Proinflammatory Epithelial Cell Responses despite Robustly Inducing TLR2 Signaling. Infect Immunity 2022;90(8):e0012922.
54. Benedetti F, Curreli S, Zella D. Mycoplasmas-Host Interaction: Mechanisms of Inflammation and Association with Cellular Transformation. Microorganisms 2020;8(9).
55. Li P, Lili Z, Lin L et al. Expression and clinical significance of MUC5AC in airway of children with Mycoplasma pneumoniae pneumonia. J Pract Med = Shiyong Yixue Zazhi 2023;39(20).
56. Kim K, Jung S, Kim M et al. Global Trends in the Proportion of Macrolide-Resistant Mycoplasma pneumoniae Infections: A Systematic Review and Meta-analysis. JAMA Netw Open 2022;5(7):e2220949.
57. Chih-Cheng L, Hsueh CC, Hsu CK et al. Disease burden and macrolide resistance of Mycoplasma pneumoniae infection in adults in the Asia-Pacific region. Int J Antimicrob Agents 2024;64(2):107205.
58. Kuo CY, Tsai WC, Lee HF et al. The epidemiology, clinical characteristics, and macrolide susceptibility of Mycoplasma pneumoniae pneumonia in children in Southern Taiwan, 2019-2020. J Microbiol Immunol Infection = Wei mian yu gan ran za zhi 2022;55(4):611-9.
59. Miyashita N, Ogata M, Fukuda N et al. Macrolide-resistant Mycoplasma pneumoniae infection prevalence increases again in Osaka. Respiratory investigation. 2025;63(4):517-520.
60. Darazam IA, Rabiei MM, Gharehbagh FJ et al. Recent Macrolide Resistance Pattern of Mycoplasma Pneumonia in the World: A Systematic Review and Meta-Analysis. Iranian J Public Health 2025;54(3):530-41.
61. Xie P, Zhang Y, Qin Y et al. Macrolide resistance in Mycoplasma pneumoniae in adult patients. Front Cellular Infect Microbiol 2025;(15):1496521.
62. Wang N, Zhou Y, Zhang H, Liu Y. In vitro activities of acetylmidecamycin and other antimicrobials against human macrolide-resistant Mycoplasma pneumoniae isolates. J Antimicrob Chemother 2020;75(6):1513-7.
63. Voronina EN, Gordukova MA, Turina IE et al. Molecular characterization of Mycoplasma pneumoniae infections in Moscow from 2015 to 2018. Eur J Clin Microbiol Infect Dis 2020;39(2):257-63.
64. Matsvay AD, Bezrukov V, Nikolaeva P et al. Cultivation and molecular characterization of complete genome sequences of M. pneumoniae isolated in Russia. Clin Microbiol Antimicrob Chemother 2024;26(3):274-84.
65. Miyashita N, Akaike H, Teranishi H et al. Macrolide-resistant Mycoplasma pneumoniae pneumonia in adolescents and adults: clinical findings, drug susceptibility, and therapeutic efficacy. Antimicrob Agents Chemother 2013;57(10):5181-5.
66. Yue H, Sheng Q, Wang X et al. A comparison of diagnostic and therapeutic approaches for Mycoplasma pneumoniae pneumonia in children and adults, during the post-COVID-19 pandemic era. Eur J Clin Microbiol Infect Dis 2025.
67. Guchev IA, Yu VL, Sinopalnikov A et al. Management of nonsevere pneumonia in military trainees with the urinary antigen test for Streptococcus pneumoniae: an innovative approach to targeted therapy. Clin Infect Dis 2005;40(11):1608-16.
68. Park S, Oh KC, Kim KS et al. Role of Atypical Pathogens and the Antibiotic Prescription Pattern in Acute Bronchitis: A Multicenter Study in Korea. J Korean Med Sci 2015;30(10):1446-52.
69. Miyashita N, Kawai Y, Kato T et al. Rapid diagnostic method for the identification of Mycoplasma pneumoniae respiratory tract infection. J Infect Chemother 2016;22(5):327-30.
70. Self WH, Courtney DM, McNaughton CD et al. High discordance of chest x-ray and computed tomography for detection of pulmonary opacities in ED patients: implications for diagnosing pneumonia. Am J Emerg Med 2013;31(2):401-5.
71. Ibrahim D, Bizri AR, El Amine MA, Halabi Z. Chest computed tomography and chest X-ray in the diagnosis of community-acquired pneumonia: a retrospective observational study. J Int Med Res 2021;49(8):3000605211039791.
72. Miyashita N, Nakamori Y, Ogata M et al. Clinical Differences between Community-Acquired Mycoplasma pneumoniae Pneumonia and COVID-19 Pneumonia. J Clin Med 2022;11(4).
73. Sui DX, Ma HC, Wang CC et al. Diagnostic significance of HRCT imaging features in adult mycoplasma pneumonia: a retrospective study. Sci Rep 2024;14(1):153.
74. Tanaka H. Correlation between Radiological and Pathological Findings in Patients with Mycoplasma pneumoniae Pneumonia. Front Microbiol 2016;(7):695.
75. Sato H, Okada F, Nakao Y, Asayama Y. A decision tree for predicting the causative pathogens of community-acquired pneumonia from thin-section computed tomography. Jpn J Radiol 2025;43(3):412-21.
76. Miyashita N, Kawai Y, Yamaguchi T et al, Atypical Pathogen Study G. Clinical potential of diagnostic methods for the rapid diagnosis of Mycoplasma pneumoniae pneumonia in adults. Eur J Clin Microbiol Infect Dis 2011;30(3):439-46.
77. Yoon IA, Hong KB, Lee HJ et al. Radiologic findings as a determinant and no effect of macrolide resistance on clinical course of Mycoplasma pneumoniae pneumonia. BMC Infect Dis 2017;17(1):402.
78. Meyer Sauteur PM, Krautter S, Ambroggio L et al. Improved Diagnostics Help to Identify Clinical Features and Biomarkers That Predict Mycoplasma pneumoniae Community-acquired Pneumonia in Children. Clin Infect Dis 2020;71(7):1645-54.
79. Riordan A. In children with respiratory symptoms are Mycoplasma pneumoniae PCR and serology clinically significant? Arch Dis Child Educ Pract Ed 2014;99(4):157.
80. Spuesens EB, Fraaij PL, Visser EG et al. Carriage of Mycoplasma pneumoniae in the upper respiratory tract of symptomatic and asymptomatic children: an observational study. PLoS Med 2013;10(5):e1001444.
81. Meyer Sauteur PM, Seiler M, Truck J et al. Diagnosis of Mycoplasma pneumoniae Pneumonia with Measurement of Specific Antibody-Secreting Cells. Am J Respir Crit Care Med 2019;200(8):1066-9.
82. Carter MJ, Mitchell RM, Meyer Sauteur PM et al. The Antibody-Secreting Cell Response to Infection: Kinetics and Clinical Applications. Front Immunol 2017;(8):630.
83. Watkins-Riedel T, Stanek G, Daxboeck F. Comparison of SeroMP IgA with four other commercial assays for serodiagnosis of Mycoplasma pneumoniae pneumonia. Diagnostic Microbiol Infect Dis 2001;40(1-2):21-5.
84. Ishida T, Hashimoto T, Arita M et al. [Evaluation of community-acquired pneumonia guidelines of Japanese Respiratory Society: differentiation of atypical pneumonia and bacterial pneumonia]. J Jap Respir Soc = Nihon Kokyuki Gakkai zasshi 2002;40(12):929-35.
85. Kozlov RS, Ivanchik NV, Skleenova EY et al. In vitro activity of cefpodoxime against Russian clinical isolates of Haemophilus influenzae, Streptococcus pneumoniae and Streptococcus pyogenes. Clin Microbiol Antimicrobial Chemother 2023;25(4):372-8.
30 декабря 2025
Количество просмотров: 204

