Клинический разбор в общей медицине №11 2025
1 Sklifosovsky Research Institute for Emergency Medicine, Moscow, Russia;
2 National Medical Research Center for Therapy and Preventive Medicine, Moscow, Russia;
alidzhanovahg@sklif.mos.ru
Abstract
Arrhythmia is a common cardiovascular disease (CVD) that can lead to hemodynamic instability, worsening the pregnant woman’s condition (gestosis, threatened miscarriage, placental abruption, pregnancy loss, fetal hypoxia), the fetus’s condition (intrauterine growth restriction, central nervous system disorders in a newborn), and the course of labor (uterine contractility disorders). A history of CVD and arrhythmia prior to pregnancy predicts a higher likelihood of arrhythmia recurrence and complications. For many years, pregnant women were excluded from large trials on the treatment of arrhythmias. Arrhythmia management was therefore based on pregnancy physiology and the benefit-risk ratio for the pregnant woman and the fetus. Treating arrhythmias in pregnancy nowadays requires multidisciplinary and individualized approaches that take into account the history of CVD and arrhythmia, its severity, gestational age, and the potential risks to both the pregnant woman and the fetus. Many antiarrhythmic and other cardiologic drugs are teratogenic early in pregnancy; at later stages they may impair fetal growth and development. It is crucial to understand and appropriately manage arrhythmias during pregnancy, labor, and the postpartum period, and to provide timely interventions to protect the health of the pregnant woman and the fetus.
Keywords: pregnancy, cardiac electrophysiology in pregnancy, arrhythmia, maternal mortality, arrhythmia management, antiarrhythmic drugs.
For citation: Alidzhanova Kh.G., Tarasov A.V., Kanunova T.A., Shahova O.B., Movsisyan D.M. Antiarrhythmic therapy in pregnancy. Clinical review for general practice. 2025; 6 (11): 82–90 (In Russ.). DOI: 10.47407/kr2025.6.11.00716
Введение
Сердечно-сосудистая система беременной женщины претерпевает динамические физиологические изменения, которые могут спровоцировать сердечную патологию или усугубить течение имеющейся сердечной дисфункции [1]. С другой стороны, неспособность организма матери адаптироваться к физиологическим изменениям указывает на скрытую сердечную патологию [2]. Сердечно-сосудистые заболевания (ССЗ) осложняют течение беременности и послеродовой период у 10% женщин [3, 4], повышая риск развития аритмий, являясь основной причиной смерти (21–25%) [5, 6], намного превышая акушерскую (тромбоэмболические осложнения) [7, 8]. Среди ССЗ заболевания миокарда/кардиомиопатии (27%), ишемия миокарда (24%) и нарушения ритма сердца (НРС) при морфологически нормальном сердце (18%) являются главными причинами материнской смертности [4, 9–11], которых можно было избежать в 68% случаях [12].
Беременность повышает риск аритмии вследствие проаритмических механизмов, вызванных сердечно-сосудистыми, вегетативными и гормональными изменениями [13, 14], но наиболее значимым фактором риска развития аритмии являются наличие ССЗ и НРС до беременности [15, 16]. Аритмический синдром у женщин, поступивших на родоразрешение, наблюдается в среднем у 1 из 1 тыс. женщин со структурно нормальным сердцем. Аритмия при беременности увеличивает сроки госпитализации и двукратно повышает частоту кесарева сечения и преждевременных родов [11], приводит к гемодинамической нестабильности, ухудшая состояние матери (преэклампсия/эклампсия, угроза прерывания беременности, преждевременная отслойка нормально расположенной плаценты), плода (гипоксия плода, задержка внутриутробного развития, нарушения центральной нервной системы у новорожденного) и процесс родов (аномалии родовой деятельности) [16]. Наиболее частым нежелательным явлением являются преждевременные роды, на частоту развития которых влияет не только сама аритмия, но и лечение антикоагулянтами, антиаритмическими препаратами (ААП) и другими кардиологическими средствами. В исследовании V. Vaidya и соавт. [17] частота аритмий была выше у женщин в возрасте 41–50 лет; чаще наблюдалась фибрилляция предсердий (ФП); желудочковые аритмии (ЖА) были основной причиной смертности и перинатальных осложнений, а число госпитализаций беременных с НРС увеличилось на 58%. Аритмии могут варьировать от доброкачественных и саморазрешающихся до смертельно опасных; чаще наблюдаются у пациенток со структурными заболеваниями сердца [16]. При затянувшемся приступе тахиаритмии ухудшается сердечная деятельность плода, повышается возбудимость матки, возникает угроза прерывания беременности [10].
В некоторых случаях беременность может спровоцировать прогрессирование уже существующих аритмий, тогда как в других – аритмии могут проявиться впервые во время беременности. По результатам кардиоскрининга беременных в 27% случаях диагностированы различные НРС, превалирующие по частоте над другими ССЗ [18]. Увеличение материнского возраста, ожирение, сахарный диабет, артериальная гипертония, вредные привычки и диагностированные до беременности ССЗ – основные причины НРС у беременных [4, 14, 19]. Беременные женщины исключались из крупных исследований по лечению аритмии, и в большинстве случаев при оказании клинической помощи руководствовались знанием физиологии беременности и обоснованными решениями о риске/пользе лечебных мероприятий для матери и плода [17, 20]. С другой стороны, существуют проблема выявляемости аритмии, связанная с неустойчивостью пароксизмов или маскировкой под типичное учащение ритма сердца, и проблема выбора правильного лечения фоновых НРС, связанная прежде всего с малочисленностью рандомизированных контролируемых исследований по ССЗ у беременных и использованию ААП [13, 14]. В связи с этим уровень доказанности низкий, поэтому рекомендации для выбора антиаритмической терапии (ААТ) остаются дискутабельными. Это подчеркивает важность понимания и управления аритмиями во время беременности, необходимость междисциплинарного подхода, мониторинга сердечно-сосудистой системы и своевременного вмешательства для защиты здоровья матери и обеспечения оптимальных исходов для плода. Пациентки с наследственными аритмиями в анамнезе должны находиться под тщательным наблюдением на протяжении всей беременности и в послеродовом периоде. Этот подход особенно важен для беременных пациенток с синдромом удлиненного интервала QT 2-го типа, у которых осложнения чаще наблюдаются в послеродовом периоде (до 40 нед после родов) [4, 14].
Цель исследования – изучить современные тенденции в ведении беременных с аритмиями и особенности выбора эффективного и безопасного ААП.
Методология исследования
Поиск литературных данных проводился на русском и английском языках в системах индексирования научных публикаций Google Scholar, PubMed, Web of Science, eLibrary, Cyberleninka. Поиск проводили по заголовкам и ключевым словам: «беременность», «электрофизиология сердца беременных», «нарушения ритма сердца», «материнская смертность», «лечение аритмий», «антиаритмические препараты». Проанализированы 47 литературных источников по аритмиям у беременных.
Гендерные различия электрофизиологии сердца
В клеточной и клинической электрофизиологии сердца существуют гендерные различия, влияющие на нормальную работу сердца, восприимчивость к НРС, а также частоту и этиологию сердечной аритмии [21]. Существует очевидная гендерная фенотипическая неоднородность при наследственных аритмиях. Женский пол связан с более высоким риском смертельных сердечных осложнений у пациентов с врожденным синдромом удлиненного интервала QT. Напротив, женщины реже страдают синдромом Бругада. У женщин гораздо чаще наблюдаются удлинение интервала QT в ответ на прием ААП, высокий риск инсульта при ФП. На моделях животных продемонстрированы антиаритмические эффекты эстрогена. Вместе с тем эстроген приводит к увеличению длительности потенциала действия и удлинению QT, тогда как прогестерон и тестостерон сокращают длительность потенциала действия и продолжительность QT, возможно, оказывая антиаритмический эффект [22, 23].
Во время беременности наблюдается прямая взаимосвязь между уровнем эстрогена и пролактина: эстрогены, повышаясь в период беременности, вызывают увеличение концентрации пролактина, который необходим для подготовки молочных желез к лактации. Высокие уровни пролактина во время беременности являются физиологической нормой. Уровень пролактина остается высоким до тех пор, пока продолжается грудное вскармливание. Высокие уровни пролактина увеличивают желудочковую активность и способствуют проаритмическому эффекту [24].
Электрофизиологические и электрокардиографические изменения сердца беременных
Электрофизиологические свойства сердца при беременности могут изменяться вследствие повышенной сердечной нагрузки, значительных гормональных изменений, снижения парасимпатической и повышения симпатической активности, повышения уровня катехоламинов, электролитного дисбаланса, увеличения скорости основного обмена и др. [22, 25]. Растяжение камер сердца, особенно левого предсердия, вызывает нарушения сердечной проводимости.
Гестационная сердечная гипертрофия и физическое смещение сердца способствуют изменениям на электрокардиограмме. Кроме того, электрокардиограмма беременных, очевидно, является результатом изменений в экспрессии и поведении ионных каналов. Однако ионная основа электрического ремоделирования сердца остается неясной [13]. Увеличение частоты сердечных сокращений (ЧСС), достигающее пика в III триместре, необходимо для приспособления организма матери к увеличенному объему крови и сердечному выбросу. Вместе с тем это приводит к синусовой тахикардии (СТ), которая встречается у 50% беременных в последнем триместре. Ось QRS смещается влево из-за физического смещения сердца по мере увеличения размеров расширения матки, особенно во II и III триместрах; интервал PR укорачивается. Хотя интервал QT может изначально укорачиваться из-за увеличения ЧСС, во II и III триместрах он удлиняется и остается в пределах нормы. Зубец Q появляется в отведении III; на поздних сроках беременности амплитуда комплекса QRS немного увеличивается. Неспецифические изменения сегмента ST и зубца T наблюдаются у 4–14% женщин в левых прекардиальных отведениях, которые исчезают после родов. В отведениях III и
V1-2 регистрируется инверсия зубца Т [26, 27]. При последующих беременностях эти изменения часто рецидивируют.
Патофизиологические механизмы развития аритмии у беременных
Точный механизм развития аритмии во время беременности неясен, но, вероятно, связан с сочетанием гемодинамических, гормональных и вегетативных изменений [14, 21]. Материнская гемодинамика претерпевает глубокие изменения на протяжении всей беременности, причем значительные изменения начинаются вскоре после зачатия, достигают пика во II и начале III триместра и поддерживают относительную стабильность до начала родов. Эти гемодинамические сдвиги играют решающую роль в поддержке развивающегося плода и адаптации к меняющимся требованиям беременности [28]. Во время родов организм матери вновь подвергается гемодинамическим и гормональным изменениям [1].
Вызванные беременностью изменения сердечно-сосудистой системы (повышенная ЧСС в состоянии покоя и объем крови, приводящий к расширению камер сердца, более высокие уровни плацентарных потенциально аритмогенных гормонов, повышение уровня циркулирующих катехоламинов) и повышенный симпатический тонус предрасполагают к возникновению новых аритмий или усугублению предыдущих НРС [21, 23]. Растяжение миокарда предсердий и желудочков приводит к активации чувствительных к растяжению ионных каналов с последующей деполяризацией мембраны, укороченной рефрактерностью, замедленной проводимостью и пространственной дисперсией рефрактерности [17].
Эпидемиология НРС у беременных
Аритмия беременных – наиболее частое осложнение (4–10% случаев) [14, 23], распространенность которого продолжает расти [9]. Наиболее частым НРС является предсердная аритмия, а именно ФП, которая развивается во II триместре, и ее частота зависит от тяжести ССЗ [29]. Отмечается, что частота ФП прогрессивно растет [6, 15, 21], составляя 27 случаев на 100 тыс. госпитализаций беременных по поводу аритмии [22]. Повышают вероятность развития ФП такие факторы риска, как ожирение, возраст старше 40 лет, врожденные заболевания сердца, анамнез ФП, прием β-адреноблокаторов (β-АБ) до беременности и клапанные заболевания сердца [30]. При беременности ФП/трепетание предсердий (ТП) приводят к неблагоприятным исходам для матери – сердечной недостаточности (СН) и тромбоэмболическим осложнениям; для плода – к задержке внутриутробного развития, внутрижелудочковым кровоизлияниям и высокой частоте госпитализаций в отделение интенсивной терапии новорожденных. Кроме того, препараты, используемые для контроля ЧСС, могут вызывать гипотонию у матери и снижение плацентарного кровотока, что повышает риск преждевременных родов [31]. Типичное ТП встречается реже, однако у беременных женщин с кардиохирургической операцией в анамнезе (в том числе катетерной абляцией – КА устьев легочных вен) чаще наблюдается атипичное ТП, которое возникает с участием послеоперационного рубца. При этом имеются ограниченные данные о распространенности только ТП [11]. Беременность протекает с прокоагулянтным синдромом, и при этих НРС риск тромбоэмболии возрастает. Вместе с тем шкалы тромбоэмболического риска беременных не валидированы [14, 32, 33]. Стратификация риска тромбоэмболии у беременных женщин аналогична стратификации у небеременных женщин, поскольку беременность не включена в качестве фактора риска в общепринятые шкалы.
Второе место по частоте встречаемости занимает наджелудочковая тахикардия (НЖТ), являясь причиной 22 из 100 тыс. госпитализаций беременных [33]. Наиболее распространенными подтипами НЖТ являются атриовентрикулярная узловая реципрокная тахикардия (АВУРТ) и атриовентрикулярная реципрокная тахикардия (АВРТ) с участием дополнительных путей проведения – синдром Вольфа–Паркинсона–Уайта (WPW). Примерно у 20% женщин с уже существующей НЖТ наблюдаются обострения во время беременности: АВУРТ может индуцироваться в I триместре, но во II триместре чаще прекращается, а пароксизмы АВРТ обычно прогрессируют со II триместра. Симптомы включают внезапное сердцебиение, часто сопровождающееся одышкой, дискомфортом в груди или «предобморочным» состоянием.
Частота ЖА у беременных изучена недостаточно, а данные о желудочковой тахикардии (ЖТ) особенно скудны [4, 14]. ЖТ осложняет течение беременности примерно у 2–16 женщин на 100 тыс., а фибрилляция желудочков – у 2 женщин на 100 тыс. беременностей. Рецидив ЖТ наблюдается у 27% женщин с анамнезом ЖТ [8]. У женщин с ССЗ чаще встречается ЖТ, которая осложняет 1,4% беременностей; при врожденных пороках сердца (ВПС) – 1,2%, клапанной патологии – 0,6%, ишемической болезни сердца – 2,1%, патологии аорты – 3% и кардиомиопатии – 5,9% [10].
При беременности редко наблюдается ЖТ (2 на 100 тыс. случаев госпитализаций). Обычно беременность усугубляет существующие ЖА, при этом рецидивирующая тахикардия возникает в 27% случаев беременности у женщин с анамнезом аритмии [16]. Аритмия чаще развивается при ВПС, неишемических или ишемических кардиомиопатиях, наследственных каналопатиях, удлинении интервала QT вследствие приема лекарственных препаратов или нарушениях электролитного баланса [30]. Наиболее высокий риск рецидива ЖТ отмечен у пациентов с ВПС (27%). При отсутствии ССЗ ЖА, как правило, не приводит к гемодинамическим нарушениям и имеет хороший прогноз. Угроза развития гемодинамически нестабильных состояний зависит от механизма ЖА. Так, ЖА по эктопическому механизму при повышении симпатической активности рецидивируют реже и в большинстве случаев носят неустойчивый характер. Снижение парасимпатической активности и повышение уровня катехоламинов при беременности способствуют развитию ЖА по триггерному механизму у лиц с генетическими каналопатиями, удлиненным интервалом QT, которые проявляются «ранней» и чаще групповой экстрасистолией и пароксизмами полиморфной ЖТ. Они составляют наибольшую угрозу для матери и плода вследствие развития опасных гемодинамически значимых аритмий. Устойчивые пароксизмы ЖТ могут приводить к развитию острой левожелудочковой СН, а при затянувшемся приступе тахикардии – ухудшают сердечную деятельность плода, повышают возбудимость матки, вызывая угрозу прерывания беременности.
Среди женщин с синдромом наследственных аритмий в 8 раз выше частота мертворождений и в 2 раза – частота выкидышей. Роды и послеродовой период являются периодами повышенного риска возникновения аритмии и внезапной сердечной смерти [11, 14]. Большинство наследственных аритмий обусловлены синдромом удлиненного QT; они предопределяют повышенный риск смерти в течение 9 мес после родов, особенно у женщин с генотипом LQT2 [11].
Брадиаритмии встречаются редко, поскольку беременные женщины не предрасположены к атриовентрикулярным блокадам (АВ-блокадам) высокой степени, за исключением врожденной АВ-блокады [35, 36]. Однако у женщин с оперированным ВПС или другими операциями на сердце риск аритмии увеличивается. Брадиаритмии, если они присутствуют, часто выявляются до беременности. В случаях, когда возникает необходимость в имплантации внутрисердечного устройства, процедура может быть выполнена безопасно с минимальной флюороскопией и под эхокардиографическим контролем [29, 36].
Принципы лечения НРС при беременности
Ведение беременности и родов различается у женщин с впервые выявленными или уже имеющимися ССЗ и зависит от правильной оценки степени риска, коммуникации и персонифицированного подхода [37].
Возможности применения традиционных методов лечения аритмий у беременных в значительной степени ограничены [21, 23, 38] вследствие отсутствия рандомизированных клинических испытаний ААП во время беременности [39]. При лечении следует учитывать меняющийся портрет будущей матери (беременность у женщин старшего репродуктивного возраста, с ВПС, другими ССЗ и сердечно-сосудистыми рисками). Вместе с тем лечение аритмий у беременных во многом аналогично лечению небеременных женщин, но с учетом безопасности для плода [40]. Вопрос необходимости и целесообразности ААТ у беременных является ключевым. Фармакотерапию НРС беременных проводят только при клинически значимых НРС (гемодинамически значимых и жизнеугрожающих) с возможностью избегать назначения ААП на постоянной основе, особенно в I триместре [21, 41]. При назначении ААТ следует понимать, что при применении некоторых препаратов возрастет риск развития фетальных осложнений, так как ряд веществ проникает через плаценту и секретируется в грудное молоко. Большинство из них в I триместре оказывает тератогенное действие, другие побочные эффекты сохраняются в более поздние сроки беременности. Более того, использование ААП во время беременности требует внимания к потенциальным изменениям в фармакокинетике матери (увеличение внутрисосудистого объема в период лактации).
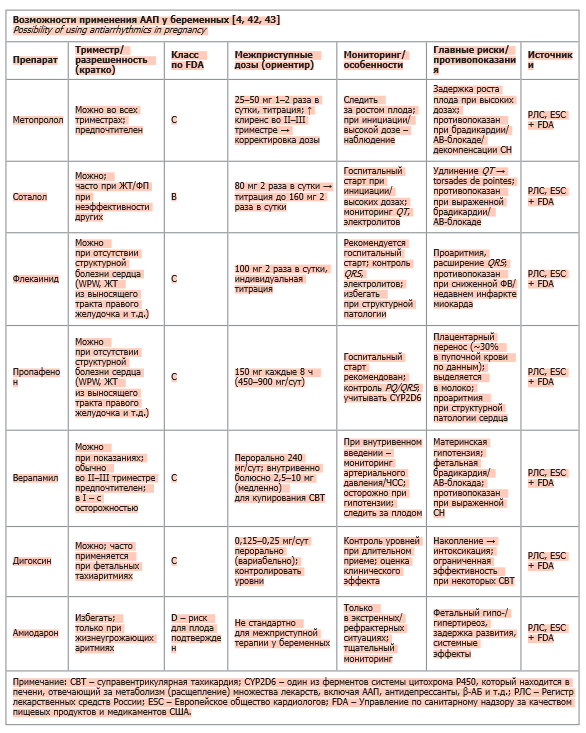
Лечение аритмий зависит от типа аритмии и угрозы развития опасных осложнений. Нестабильные аритмии требуют в качестве основного лечения электрической кардиоверсии (ЭКВ), которая безопасна при беременности [14, 20, 21]. При гемодинамически значимых аритмиях требуется скорейшее восстановление нормальной гемодинамики [34] путем использования наиболее эффективного из доступных методов терапии (кардиоверсия, инфузия ААП или КА) с соответствующим мониторингом состояния плода и мерами по минимизации воздействия радиации при проведении КА [11, 17]. В таблице представлены возможности применения ААП у беременных женщин.
Подходы к лечению различных нарушений ритма в период беременности
Синусовая тахикардия
У беременных СТ, которая в большинстве случаев носит компенсаторный характер, не требует ААТ [38, 44]. При СТ необходимо исключить наличие гипертиреоза, анемии, ВПС. Для профилактики и лечения СТ показаны ограничения физических и эмоциональных нагрузок [45]. Симптомная СТ со средней ЧСС за сутки свыше 120 у больных со структурными заболеваниями сердца является прогностически неблагоприятным признаком, так как быстро развивается СН. Показано назначение небольших доз β-АБ.
Экстрасистолия
Экстрасистолия наджелудочковая и желудочковая чаще диагностируются при плановой регистрации электрокардиограммы, не являются противопоказанием к естественным родам и не требуют ААТ. В большинстве случаев достаточно коррекции психоэмоционального статуса и исключения факторов, провоцирующих аритмию [45, 46]. Если количество экстрасистолий более порогового значения, необходимо оценить их прогностическое значение и риск развития неуправляемых ЖТ. К таким неблагоприятным характеристикам относятся ранние желудочковые экстрасистолы с пробежками неустойчивой ЖТ. В данном случае требуется частый мониторинг аритмии; к ААТ следует прибегать только при высоком риске развития ЖТ. Для лечения частых политопных, групповых или ранних желудочковых экстрасистолий, угрожающих переходом в более тяжелые виды аритмии с ухудшением гемодинамики и появлением признаков СН, выраженным снижением качества жизни, используют β-АБ (метопролол) при триггерном механизме ЖА, реже IC класса (флекаинид или пропафенон) при эктопическом механизме [47]. При частой наджелудочковой экстрасистолии ААТ не рекомендована. Если наджелудочковая экстрасистолия запускает устойчивые предсердные тахикардии с гемодинамическими расстройствами и снижением качества жизни, назначают кардиоселективные β-АБ или верапамил, а при их неэффективности – ААП IС класса: флекаинид или пропафенон [48].
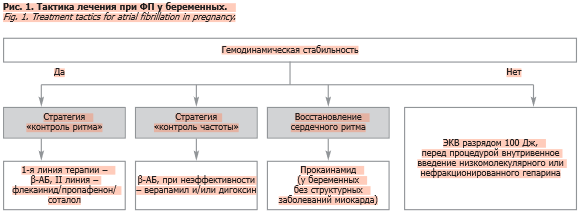
Фибрилляция/трепетание предсердий
При гемодинамически стабильном течении ФП/ТП предпочтительнее стратегия контроля ЧСС. Контроль ЧСС обычно осуществляют с помощью β-АБ (пропранолол, метопролол), дигоксина или верапамила [4, 34, 35]. Блокаторы кальциевых каналов (БКК), β-АБ и сердечные гликозиды являются начальными методами лечения ФП, как пульсурежающая терапия. С целью снижения риска инсульта назначаются антикоагулянты. При стабильной гемодинамике восстановление синусового ритма возможно с использованием внутривенного введения пропафенона или флекаинида. Для противорецидивной терапии у женщин со структурно нормальным сердцем назначаются ААП, например пропафенон, флекаинид и соталол (рис. 1), не связанные с негативным воздействием на плод, хотя β-адреноблокирующий эффект соталола требует мониторинга роста плода [21]. У гемодинамически стабильных пациенток, но с не поддающейся контролю ЧСС, можно провести фармакологическую кардиоверсию или ЭКВ. Амиодарон у беременных не используется, так как проникает через плаценту и его следует избегать, особенно в I триместре.
Гемодинамически нестабильным пациенткам требуется ЭКВ постоянным током с мониторингом ЧСС плода [41]. Как и у небеременных взрослых, беременные женщины с ФП, длящейся более 48 ч или неизвестной продолжительности, должны получать антикоагулянты в течение 4 нед до и после кардиоверсии [14, 20]. Предпочтительны профилактические дозы низкомолекулярных гепаринов, но следует воздержаться от приема перед родами или анестезией. Варфарин не назначают из-за повышенного риска кровотечения в I и III триместрах беременности. Назначается низкомолекулярный или нефракционированный гепарин. За 4–6 ч до родов нефракционированный гепарин отменяется.
У беременных женщин с персистирующей или постоянной формой ФП решение о назначении антикоагулянтов принимают так же, как и у небеременных, в зависимости от риска тромбоэмболических осложнений по шкале CHA2DS2-VASc [14, 31]. При беременности пороговое значение шкалы CHA2DS2-VASc≥2 для антикоагулянтной терапии не валидировано [14]. Пероральные антикоагулянты противопоказаны при беременности, кроме пациенток с наличием механического клапана или умеренного или тяжелого митрального стеноза, которым требуется назначение варфарина. При тяжелых, рефрактерных к ААП пароксизмах ФП возможно проведение радиочастотной абляции [48]. Выбор способа родоразрешения должен основываться на акушерских показаниях.
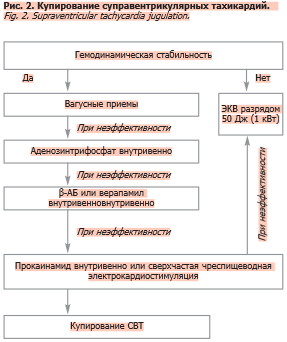 Наджелудочковая тахикардия
Наджелудочковая тахикардия
При лечении НЖТ важно учитывать стабильность состояния пациентки, срок беременности и безопасность лекарственных препаратов. Для острого прекращения пароксизма первичной терапией являются вагусные маневры (модифицированный маневр Вальсальвы, массаж каротидного синуса) [27]. В качестве препарата выбора рекомендуется использовать аденозин (6–18 мг болюсно), который можно вводить при всех видах НЖТ, которые либо прекращают тахикардию, либо замедляют атриовентрикулярную проводимость и, следовательно, частоту желудочковых сокращений. При неэффективности аденозина пациенткам без WPW назначают безопасные внутривенные селективные β-АБ (метопролол), недигидропиридиновые БКК (верапамил) или дигоксин (рис. 2). При синдроме WPW применяют флекаинид или прокаинамид. В качестве монотерапии следует избегать применения β-АБ, дигоксина и БКК. Для профилактики пароксизмов НЖТ при синдроме WPW необходимо избегать атриовентрикулярных узловых блокаторов в монотерапии, и для подавления приступов можно применять флекаинамид. У пациенток без предвозбуждения целесообразно использовать препараты из группы β-АБ (за исключением атенолола), БКК или дигоксин. Следует отметить, что данные препараты не предупреждают приступы НЖТ, а уменьшают вероятность гемодинамически значимых аритмий, поэтому назначаются только при частых рецидивах [30, 35]. В случае рефрактерности аритмии к ААТ (при синдроме преждевременного возбуждения желудочков) или плохой переносимости во время беременности может быть рекомендована радиочастотная абляция, которую целесообразно осуществлять на 26–28-й неделе беременности [49]. При невозможности проведения КА рекомендована имплантация кардиовертера-дефибриллятора [30]. При стабильной гемодинамике можно применять стимуляцию блуждающего нерва или чреспищеводную стимуляцию предсердий, при которых задействованы минимальные дозы энергии [48].
В случаях гемодинамической нестабильности и беспокойства за перфузию кровоснабжения плода проводится экстренная ЭКВ. Синхронизированная кардиоверсия безопасна на всех сроках беременности. Дозировка энергии должна быть такой же, как у небеременных пациенток [20, 21, 41].
Желудочковая тахикардия
При устойчивой гемодинамически стабильной ЖТ предпочтительным является использование β-АБ, лидокаина, при неэффективности которых назначается прокаинамид или хинидин. При рефрактерной и жизнеугрожающей ЖТ применяется амиодарон (при отсутствии альтернатив). При рефрактерной ЖТ проводится КА, которую по возможности следует отложить до послеродового периода [20].
В условиях гемодинамической нестабильности и высокого риска компрометации нарушения кровоснабжения плода следует проводить экстренную электрическую дефибрилляцию 50–100 Дж (и при необходимости – более высокие энергии от 100 до 360 Дж). При torsades de pointes (пируэтной тахикадии) используют инфузии магния сульфата (1–2 мг) [21].
Амиодарон относительно противопоказан при беременности, хотя может использоваться в экстренных ситуациях (если показания убедительны и определены риск/польза для пациентки). Применение амиодарона во время беременности нежелательно и должно быть ограничено случаями использования у женщин с рефрактерными или опасными для жизни аритмиями, которые не поддаются лечению другими ААП. При назначении амиодарона необходимо тщательное наблюдение за плодом на предмет возможных побочных эффектов, таких как брадикардия или задержка внутриутробного развития.
Для профилактики ЖТ назначается β-АБ [4, 16].
В случае рефрактерности или противопоказаний к β-АБ рекомендуется ААТ флекаинидом, соталолом или хинидином. Идиопатическую ЖТ из выходного тракта правого желудочка можно предотвратить с помощью β-АБ или верапамила.
Женщинам с синдромом наследственных аритмий лечение (фармакологическая или аппаратная терапия) проводят во время беременности и в послеродовом периоде. Беременным с синдромом удлиненного QT назначаются β-АБ длительного действия (надолол и пропранолол с замедленным высвобождением) [14]. Беременные с QTс более 500 мс являются кандидатами для имплантации кардиовертера-дефибриллятора [14, 35]. При катехоламинергической полиморфной ЖТ лечение проводят β-АБ (при необходимости – флекаинидом) во время беременности и после родов. При синдроме Бругада при аритмии назначают хинидин. В случае аритмогенной правожелудочковой кардиомиопатии необходимо продолжить прием β-АБ.
Заключение
НРС беременной женщины – сложная клиническая проблема, требующая междисциплинарного подхода. Частота выявления беременных с различными аритмиями растет. Несмотря на доступность современных методов диагностики и лечения, аритмии представляют риск для здоровья матери и плода. Проведено немного рандомизированных исследований безопасности ААП для матери и плода; назначение ААТ остается непростым выбором. Применение ААП показано только при клинически значимых аритмиях с возможностью избегать их назначения на постоянной основе, особенно в I триместре беременности.
Лечение аритмии у беременных требует индивидуального подхода с учетом анамнеза ССЗ, вида аритмии и ее тяжести, гестационного возраста, а также потенциальных рисков для матери и плода. Многие аритмии беременных можно безопасно купировать консервативными методами, однако жизнеугрожающие состояния требуют незамедлительной и решительной терапии, включая кардиоверсию, радиочастотную абляцию и имплантацию кардиовертера-дефибриллятора.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Алиджанова Хафиза Гафуровна – д-р мед. наук., ст. преподаватель учебного центра, ст. науч. сотр. отд. неотложной кардиологии с методами неинвазивной диагностики ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: alidzhanovahg@sklif.mos.ru; ORCID: 0000-0002-6229-8629
Khafiza G. Alidzhanova – Dr. Sci. (Med.), Senior Research Officer, Sklifosovsky Research Institute for Emergency Medicine. E-mail: alidzhanovahg@sklif.mos.ru; ORCID: 0000-0002-6229-8629
Тарасов Алексей Владимирович – зав. отд. хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ НМИЦ ТПМ. E-mail: a730tv@yandex.ru; ORCID: 0000-0003-4277-1711
Aleksey V. Tarasov – Head of the Department, National Medical Research Center for Therapy and Preventive Medicine. E-mail: a730tv@yandex.ru; ORCID: 0000-0003-4277-1711
Канунова Татьяна Андреевна – клинический ординатор по направлению «Кардиология» ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: kanunova_tanya@mail.ru; ORCID: 0000-0001-9285-4254
Tatiana A. Kanunova – Clinical Resident, Sklifosovsky Research Institute for Emergency Medicine. E-mail: kanunova_tanya@mail.ru; ORCID: 0000-0001-9285-4254
Шахова Ольга Борисовна – канд. мед. наук, ст. науч. сотр. отд. острых гинекологических заболеваний ГБУЗ «НИИ СП им.
Н.В. Склифосовского ДЗМ». E-mail: ShakhovaOB@sklif.mos.ru; ORCID: 0000-0002-7244-8563
Olga B. Shahova – Cand. Sci. (Med.), Senior Research Officer, Sklifosovsky Research Institute for Emergency Medicine. E-mail: ShakhovaOB@sklif.mos.ru; ORCID: 0000-0002-7244-8563
Мовсисян Давид Моисович – мл. науч. сотр. отд. неотложной клинической кардиологии с методами неинвазивной функциональной диагностики ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: davidmovsisyan1112@gmail.com; ORCID: 0009-0001-8861-8221
David M. Movsisyan – Research Assistant, Sklifosovsky Research Institute for Emergency Medicine.
E-mail: davidmovsisyan1112@gmail.com;
ORCID: 0009-0001-8861-8221
Поступила в редакцию: 10.11.2025
Поступила после рецензирования: 19.11.2025
Принята к публикации: 20.11.2025
Received: 10.11.2025
Revised: 19.11.2025
Accepted: 20.11.2025
Клинический разбор в общей медицине №11 2025
Антиаритмическая терапия при нарушениях ритма сердца у беременных
Номера страниц в выпуске:82-90
Аннотация
Аритмия – частое сердечно-сосудистое заболевание (ССЗ), которое приводит к гемодинамической нестабильности, ухудшая состояние матери (преэклампсия/эклампсия, угроза прерывания беременности, преждевременная отслойка нормально расположенной плаценты) и плода (гипоксия плода, задержка внутриутробного развития, нарушения центральной нервной системы у новорожденного) и процесс родов (аномалии родовой деятельности). Анамнез ССЗ и аритмии до беременности предсказывает большую вероятность рецидива аритмии и осложнений во время гестации. Беременные женщины долгое время исключались из крупных исследований по лечению аритмий, и руководство по лечению базировалось на физиологии беременности и оценке риска/пользы лечебных мероприятий для матери и плода. Сегодня лечение аритмий у беременных требует междисциплинарного и индивидуального подхода с учетом анамнеза ССЗ и аритмии, ее тяжести, гестационного возраста, а также потенциальных рисков для матери и плода. Многие антиаритмические и другие кардиологические препараты имеют тератогенное действие в начале беременности, в поздние сроки нарушают рост и развитие плода. Важно понимать и правильно управлять аритмиями при беременности, родах, в послеродовом периоде и оказывать своевременное вмешательство для защиты здоровья матери и плода.
Ключевые слова: беременность, электрофизиология сердца беременных, нарушения ритма сердца, материнская смертность, лечение аритмий, антиаритмические препараты.
Для цитирования: Алиджанова Х.Г., Тарасов А.В., Канунова Т.В., Шахова О.Б., Мовсисян Д.М. Антиаритмическая терапия при нарушениях ритма сердца у беременных. Клинический разбор в общей медицине. 2025; 6 (11): 82–90. DOI: 10.47407/kr2025.6.11.00716
Аритмия – частое сердечно-сосудистое заболевание (ССЗ), которое приводит к гемодинамической нестабильности, ухудшая состояние матери (преэклампсия/эклампсия, угроза прерывания беременности, преждевременная отслойка нормально расположенной плаценты) и плода (гипоксия плода, задержка внутриутробного развития, нарушения центральной нервной системы у новорожденного) и процесс родов (аномалии родовой деятельности). Анамнез ССЗ и аритмии до беременности предсказывает большую вероятность рецидива аритмии и осложнений во время гестации. Беременные женщины долгое время исключались из крупных исследований по лечению аритмий, и руководство по лечению базировалось на физиологии беременности и оценке риска/пользы лечебных мероприятий для матери и плода. Сегодня лечение аритмий у беременных требует междисциплинарного и индивидуального подхода с учетом анамнеза ССЗ и аритмии, ее тяжести, гестационного возраста, а также потенциальных рисков для матери и плода. Многие антиаритмические и другие кардиологические препараты имеют тератогенное действие в начале беременности, в поздние сроки нарушают рост и развитие плода. Важно понимать и правильно управлять аритмиями при беременности, родах, в послеродовом периоде и оказывать своевременное вмешательство для защиты здоровья матери и плода.
Ключевые слова: беременность, электрофизиология сердца беременных, нарушения ритма сердца, материнская смертность, лечение аритмий, антиаритмические препараты.
Для цитирования: Алиджанова Х.Г., Тарасов А.В., Канунова Т.В., Шахова О.Б., Мовсисян Д.М. Антиаритмическая терапия при нарушениях ритма сердца у беременных. Клинический разбор в общей медицине. 2025; 6 (11): 82–90. DOI: 10.47407/kr2025.6.11.00716
Antiarrhythmic therapy in pregnancy
Khafiza G. Alidzhanova1, Aleksey V. Tarasov2, Tatiana A. Kanunova1, Olga B. Shahova1, David M. Movsisyan11 Sklifosovsky Research Institute for Emergency Medicine, Moscow, Russia;
2 National Medical Research Center for Therapy and Preventive Medicine, Moscow, Russia;
alidzhanovahg@sklif.mos.ru
Abstract
Arrhythmia is a common cardiovascular disease (CVD) that can lead to hemodynamic instability, worsening the pregnant woman’s condition (gestosis, threatened miscarriage, placental abruption, pregnancy loss, fetal hypoxia), the fetus’s condition (intrauterine growth restriction, central nervous system disorders in a newborn), and the course of labor (uterine contractility disorders). A history of CVD and arrhythmia prior to pregnancy predicts a higher likelihood of arrhythmia recurrence and complications. For many years, pregnant women were excluded from large trials on the treatment of arrhythmias. Arrhythmia management was therefore based on pregnancy physiology and the benefit-risk ratio for the pregnant woman and the fetus. Treating arrhythmias in pregnancy nowadays requires multidisciplinary and individualized approaches that take into account the history of CVD and arrhythmia, its severity, gestational age, and the potential risks to both the pregnant woman and the fetus. Many antiarrhythmic and other cardiologic drugs are teratogenic early in pregnancy; at later stages they may impair fetal growth and development. It is crucial to understand and appropriately manage arrhythmias during pregnancy, labor, and the postpartum period, and to provide timely interventions to protect the health of the pregnant woman and the fetus.
Keywords: pregnancy, cardiac electrophysiology in pregnancy, arrhythmia, maternal mortality, arrhythmia management, antiarrhythmic drugs.
For citation: Alidzhanova Kh.G., Tarasov A.V., Kanunova T.A., Shahova O.B., Movsisyan D.M. Antiarrhythmic therapy in pregnancy. Clinical review for general practice. 2025; 6 (11): 82–90 (In Russ.). DOI: 10.47407/kr2025.6.11.00716
Введение
Сердечно-сосудистая система беременной женщины претерпевает динамические физиологические изменения, которые могут спровоцировать сердечную патологию или усугубить течение имеющейся сердечной дисфункции [1]. С другой стороны, неспособность организма матери адаптироваться к физиологическим изменениям указывает на скрытую сердечную патологию [2]. Сердечно-сосудистые заболевания (ССЗ) осложняют течение беременности и послеродовой период у 10% женщин [3, 4], повышая риск развития аритмий, являясь основной причиной смерти (21–25%) [5, 6], намного превышая акушерскую (тромбоэмболические осложнения) [7, 8]. Среди ССЗ заболевания миокарда/кардиомиопатии (27%), ишемия миокарда (24%) и нарушения ритма сердца (НРС) при морфологически нормальном сердце (18%) являются главными причинами материнской смертности [4, 9–11], которых можно было избежать в 68% случаях [12].
Беременность повышает риск аритмии вследствие проаритмических механизмов, вызванных сердечно-сосудистыми, вегетативными и гормональными изменениями [13, 14], но наиболее значимым фактором риска развития аритмии являются наличие ССЗ и НРС до беременности [15, 16]. Аритмический синдром у женщин, поступивших на родоразрешение, наблюдается в среднем у 1 из 1 тыс. женщин со структурно нормальным сердцем. Аритмия при беременности увеличивает сроки госпитализации и двукратно повышает частоту кесарева сечения и преждевременных родов [11], приводит к гемодинамической нестабильности, ухудшая состояние матери (преэклампсия/эклампсия, угроза прерывания беременности, преждевременная отслойка нормально расположенной плаценты), плода (гипоксия плода, задержка внутриутробного развития, нарушения центральной нервной системы у новорожденного) и процесс родов (аномалии родовой деятельности) [16]. Наиболее частым нежелательным явлением являются преждевременные роды, на частоту развития которых влияет не только сама аритмия, но и лечение антикоагулянтами, антиаритмическими препаратами (ААП) и другими кардиологическими средствами. В исследовании V. Vaidya и соавт. [17] частота аритмий была выше у женщин в возрасте 41–50 лет; чаще наблюдалась фибрилляция предсердий (ФП); желудочковые аритмии (ЖА) были основной причиной смертности и перинатальных осложнений, а число госпитализаций беременных с НРС увеличилось на 58%. Аритмии могут варьировать от доброкачественных и саморазрешающихся до смертельно опасных; чаще наблюдаются у пациенток со структурными заболеваниями сердца [16]. При затянувшемся приступе тахиаритмии ухудшается сердечная деятельность плода, повышается возбудимость матки, возникает угроза прерывания беременности [10].
В некоторых случаях беременность может спровоцировать прогрессирование уже существующих аритмий, тогда как в других – аритмии могут проявиться впервые во время беременности. По результатам кардиоскрининга беременных в 27% случаях диагностированы различные НРС, превалирующие по частоте над другими ССЗ [18]. Увеличение материнского возраста, ожирение, сахарный диабет, артериальная гипертония, вредные привычки и диагностированные до беременности ССЗ – основные причины НРС у беременных [4, 14, 19]. Беременные женщины исключались из крупных исследований по лечению аритмии, и в большинстве случаев при оказании клинической помощи руководствовались знанием физиологии беременности и обоснованными решениями о риске/пользе лечебных мероприятий для матери и плода [17, 20]. С другой стороны, существуют проблема выявляемости аритмии, связанная с неустойчивостью пароксизмов или маскировкой под типичное учащение ритма сердца, и проблема выбора правильного лечения фоновых НРС, связанная прежде всего с малочисленностью рандомизированных контролируемых исследований по ССЗ у беременных и использованию ААП [13, 14]. В связи с этим уровень доказанности низкий, поэтому рекомендации для выбора антиаритмической терапии (ААТ) остаются дискутабельными. Это подчеркивает важность понимания и управления аритмиями во время беременности, необходимость междисциплинарного подхода, мониторинга сердечно-сосудистой системы и своевременного вмешательства для защиты здоровья матери и обеспечения оптимальных исходов для плода. Пациентки с наследственными аритмиями в анамнезе должны находиться под тщательным наблюдением на протяжении всей беременности и в послеродовом периоде. Этот подход особенно важен для беременных пациенток с синдромом удлиненного интервала QT 2-го типа, у которых осложнения чаще наблюдаются в послеродовом периоде (до 40 нед после родов) [4, 14].
Цель исследования – изучить современные тенденции в ведении беременных с аритмиями и особенности выбора эффективного и безопасного ААП.
Методология исследования
Поиск литературных данных проводился на русском и английском языках в системах индексирования научных публикаций Google Scholar, PubMed, Web of Science, eLibrary, Cyberleninka. Поиск проводили по заголовкам и ключевым словам: «беременность», «электрофизиология сердца беременных», «нарушения ритма сердца», «материнская смертность», «лечение аритмий», «антиаритмические препараты». Проанализированы 47 литературных источников по аритмиям у беременных.
Гендерные различия электрофизиологии сердца
В клеточной и клинической электрофизиологии сердца существуют гендерные различия, влияющие на нормальную работу сердца, восприимчивость к НРС, а также частоту и этиологию сердечной аритмии [21]. Существует очевидная гендерная фенотипическая неоднородность при наследственных аритмиях. Женский пол связан с более высоким риском смертельных сердечных осложнений у пациентов с врожденным синдромом удлиненного интервала QT. Напротив, женщины реже страдают синдромом Бругада. У женщин гораздо чаще наблюдаются удлинение интервала QT в ответ на прием ААП, высокий риск инсульта при ФП. На моделях животных продемонстрированы антиаритмические эффекты эстрогена. Вместе с тем эстроген приводит к увеличению длительности потенциала действия и удлинению QT, тогда как прогестерон и тестостерон сокращают длительность потенциала действия и продолжительность QT, возможно, оказывая антиаритмический эффект [22, 23].
Во время беременности наблюдается прямая взаимосвязь между уровнем эстрогена и пролактина: эстрогены, повышаясь в период беременности, вызывают увеличение концентрации пролактина, который необходим для подготовки молочных желез к лактации. Высокие уровни пролактина во время беременности являются физиологической нормой. Уровень пролактина остается высоким до тех пор, пока продолжается грудное вскармливание. Высокие уровни пролактина увеличивают желудочковую активность и способствуют проаритмическому эффекту [24].
Электрофизиологические и электрокардиографические изменения сердца беременных
Электрофизиологические свойства сердца при беременности могут изменяться вследствие повышенной сердечной нагрузки, значительных гормональных изменений, снижения парасимпатической и повышения симпатической активности, повышения уровня катехоламинов, электролитного дисбаланса, увеличения скорости основного обмена и др. [22, 25]. Растяжение камер сердца, особенно левого предсердия, вызывает нарушения сердечной проводимости.
Гестационная сердечная гипертрофия и физическое смещение сердца способствуют изменениям на электрокардиограмме. Кроме того, электрокардиограмма беременных, очевидно, является результатом изменений в экспрессии и поведении ионных каналов. Однако ионная основа электрического ремоделирования сердца остается неясной [13]. Увеличение частоты сердечных сокращений (ЧСС), достигающее пика в III триместре, необходимо для приспособления организма матери к увеличенному объему крови и сердечному выбросу. Вместе с тем это приводит к синусовой тахикардии (СТ), которая встречается у 50% беременных в последнем триместре. Ось QRS смещается влево из-за физического смещения сердца по мере увеличения размеров расширения матки, особенно во II и III триместрах; интервал PR укорачивается. Хотя интервал QT может изначально укорачиваться из-за увеличения ЧСС, во II и III триместрах он удлиняется и остается в пределах нормы. Зубец Q появляется в отведении III; на поздних сроках беременности амплитуда комплекса QRS немного увеличивается. Неспецифические изменения сегмента ST и зубца T наблюдаются у 4–14% женщин в левых прекардиальных отведениях, которые исчезают после родов. В отведениях III и
V1-2 регистрируется инверсия зубца Т [26, 27]. При последующих беременностях эти изменения часто рецидивируют.
Патофизиологические механизмы развития аритмии у беременных
Точный механизм развития аритмии во время беременности неясен, но, вероятно, связан с сочетанием гемодинамических, гормональных и вегетативных изменений [14, 21]. Материнская гемодинамика претерпевает глубокие изменения на протяжении всей беременности, причем значительные изменения начинаются вскоре после зачатия, достигают пика во II и начале III триместра и поддерживают относительную стабильность до начала родов. Эти гемодинамические сдвиги играют решающую роль в поддержке развивающегося плода и адаптации к меняющимся требованиям беременности [28]. Во время родов организм матери вновь подвергается гемодинамическим и гормональным изменениям [1].
Вызванные беременностью изменения сердечно-сосудистой системы (повышенная ЧСС в состоянии покоя и объем крови, приводящий к расширению камер сердца, более высокие уровни плацентарных потенциально аритмогенных гормонов, повышение уровня циркулирующих катехоламинов) и повышенный симпатический тонус предрасполагают к возникновению новых аритмий или усугублению предыдущих НРС [21, 23]. Растяжение миокарда предсердий и желудочков приводит к активации чувствительных к растяжению ионных каналов с последующей деполяризацией мембраны, укороченной рефрактерностью, замедленной проводимостью и пространственной дисперсией рефрактерности [17].
Эпидемиология НРС у беременных
Аритмия беременных – наиболее частое осложнение (4–10% случаев) [14, 23], распространенность которого продолжает расти [9]. Наиболее частым НРС является предсердная аритмия, а именно ФП, которая развивается во II триместре, и ее частота зависит от тяжести ССЗ [29]. Отмечается, что частота ФП прогрессивно растет [6, 15, 21], составляя 27 случаев на 100 тыс. госпитализаций беременных по поводу аритмии [22]. Повышают вероятность развития ФП такие факторы риска, как ожирение, возраст старше 40 лет, врожденные заболевания сердца, анамнез ФП, прием β-адреноблокаторов (β-АБ) до беременности и клапанные заболевания сердца [30]. При беременности ФП/трепетание предсердий (ТП) приводят к неблагоприятным исходам для матери – сердечной недостаточности (СН) и тромбоэмболическим осложнениям; для плода – к задержке внутриутробного развития, внутрижелудочковым кровоизлияниям и высокой частоте госпитализаций в отделение интенсивной терапии новорожденных. Кроме того, препараты, используемые для контроля ЧСС, могут вызывать гипотонию у матери и снижение плацентарного кровотока, что повышает риск преждевременных родов [31]. Типичное ТП встречается реже, однако у беременных женщин с кардиохирургической операцией в анамнезе (в том числе катетерной абляцией – КА устьев легочных вен) чаще наблюдается атипичное ТП, которое возникает с участием послеоперационного рубца. При этом имеются ограниченные данные о распространенности только ТП [11]. Беременность протекает с прокоагулянтным синдромом, и при этих НРС риск тромбоэмболии возрастает. Вместе с тем шкалы тромбоэмболического риска беременных не валидированы [14, 32, 33]. Стратификация риска тромбоэмболии у беременных женщин аналогична стратификации у небеременных женщин, поскольку беременность не включена в качестве фактора риска в общепринятые шкалы.
Второе место по частоте встречаемости занимает наджелудочковая тахикардия (НЖТ), являясь причиной 22 из 100 тыс. госпитализаций беременных [33]. Наиболее распространенными подтипами НЖТ являются атриовентрикулярная узловая реципрокная тахикардия (АВУРТ) и атриовентрикулярная реципрокная тахикардия (АВРТ) с участием дополнительных путей проведения – синдром Вольфа–Паркинсона–Уайта (WPW). Примерно у 20% женщин с уже существующей НЖТ наблюдаются обострения во время беременности: АВУРТ может индуцироваться в I триместре, но во II триместре чаще прекращается, а пароксизмы АВРТ обычно прогрессируют со II триместра. Симптомы включают внезапное сердцебиение, часто сопровождающееся одышкой, дискомфортом в груди или «предобморочным» состоянием.
Частота ЖА у беременных изучена недостаточно, а данные о желудочковой тахикардии (ЖТ) особенно скудны [4, 14]. ЖТ осложняет течение беременности примерно у 2–16 женщин на 100 тыс., а фибрилляция желудочков – у 2 женщин на 100 тыс. беременностей. Рецидив ЖТ наблюдается у 27% женщин с анамнезом ЖТ [8]. У женщин с ССЗ чаще встречается ЖТ, которая осложняет 1,4% беременностей; при врожденных пороках сердца (ВПС) – 1,2%, клапанной патологии – 0,6%, ишемической болезни сердца – 2,1%, патологии аорты – 3% и кардиомиопатии – 5,9% [10].
При беременности редко наблюдается ЖТ (2 на 100 тыс. случаев госпитализаций). Обычно беременность усугубляет существующие ЖА, при этом рецидивирующая тахикардия возникает в 27% случаев беременности у женщин с анамнезом аритмии [16]. Аритмия чаще развивается при ВПС, неишемических или ишемических кардиомиопатиях, наследственных каналопатиях, удлинении интервала QT вследствие приема лекарственных препаратов или нарушениях электролитного баланса [30]. Наиболее высокий риск рецидива ЖТ отмечен у пациентов с ВПС (27%). При отсутствии ССЗ ЖА, как правило, не приводит к гемодинамическим нарушениям и имеет хороший прогноз. Угроза развития гемодинамически нестабильных состояний зависит от механизма ЖА. Так, ЖА по эктопическому механизму при повышении симпатической активности рецидивируют реже и в большинстве случаев носят неустойчивый характер. Снижение парасимпатической активности и повышение уровня катехоламинов при беременности способствуют развитию ЖА по триггерному механизму у лиц с генетическими каналопатиями, удлиненным интервалом QT, которые проявляются «ранней» и чаще групповой экстрасистолией и пароксизмами полиморфной ЖТ. Они составляют наибольшую угрозу для матери и плода вследствие развития опасных гемодинамически значимых аритмий. Устойчивые пароксизмы ЖТ могут приводить к развитию острой левожелудочковой СН, а при затянувшемся приступе тахикардии – ухудшают сердечную деятельность плода, повышают возбудимость матки, вызывая угрозу прерывания беременности.
Среди женщин с синдромом наследственных аритмий в 8 раз выше частота мертворождений и в 2 раза – частота выкидышей. Роды и послеродовой период являются периодами повышенного риска возникновения аритмии и внезапной сердечной смерти [11, 14]. Большинство наследственных аритмий обусловлены синдромом удлиненного QT; они предопределяют повышенный риск смерти в течение 9 мес после родов, особенно у женщин с генотипом LQT2 [11].
Брадиаритмии встречаются редко, поскольку беременные женщины не предрасположены к атриовентрикулярным блокадам (АВ-блокадам) высокой степени, за исключением врожденной АВ-блокады [35, 36]. Однако у женщин с оперированным ВПС или другими операциями на сердце риск аритмии увеличивается. Брадиаритмии, если они присутствуют, часто выявляются до беременности. В случаях, когда возникает необходимость в имплантации внутрисердечного устройства, процедура может быть выполнена безопасно с минимальной флюороскопией и под эхокардиографическим контролем [29, 36].
Принципы лечения НРС при беременности
Ведение беременности и родов различается у женщин с впервые выявленными или уже имеющимися ССЗ и зависит от правильной оценки степени риска, коммуникации и персонифицированного подхода [37].
Возможности применения традиционных методов лечения аритмий у беременных в значительной степени ограничены [21, 23, 38] вследствие отсутствия рандомизированных клинических испытаний ААП во время беременности [39]. При лечении следует учитывать меняющийся портрет будущей матери (беременность у женщин старшего репродуктивного возраста, с ВПС, другими ССЗ и сердечно-сосудистыми рисками). Вместе с тем лечение аритмий у беременных во многом аналогично лечению небеременных женщин, но с учетом безопасности для плода [40]. Вопрос необходимости и целесообразности ААТ у беременных является ключевым. Фармакотерапию НРС беременных проводят только при клинически значимых НРС (гемодинамически значимых и жизнеугрожающих) с возможностью избегать назначения ААП на постоянной основе, особенно в I триместре [21, 41]. При назначении ААТ следует понимать, что при применении некоторых препаратов возрастет риск развития фетальных осложнений, так как ряд веществ проникает через плаценту и секретируется в грудное молоко. Большинство из них в I триместре оказывает тератогенное действие, другие побочные эффекты сохраняются в более поздние сроки беременности. Более того, использование ААП во время беременности требует внимания к потенциальным изменениям в фармакокинетике матери (увеличение внутрисосудистого объема в период лактации).

Лечение аритмий зависит от типа аритмии и угрозы развития опасных осложнений. Нестабильные аритмии требуют в качестве основного лечения электрической кардиоверсии (ЭКВ), которая безопасна при беременности [14, 20, 21]. При гемодинамически значимых аритмиях требуется скорейшее восстановление нормальной гемодинамики [34] путем использования наиболее эффективного из доступных методов терапии (кардиоверсия, инфузия ААП или КА) с соответствующим мониторингом состояния плода и мерами по минимизации воздействия радиации при проведении КА [11, 17]. В таблице представлены возможности применения ААП у беременных женщин.
Подходы к лечению различных нарушений ритма в период беременности
Синусовая тахикардия
У беременных СТ, которая в большинстве случаев носит компенсаторный характер, не требует ААТ [38, 44]. При СТ необходимо исключить наличие гипертиреоза, анемии, ВПС. Для профилактики и лечения СТ показаны ограничения физических и эмоциональных нагрузок [45]. Симптомная СТ со средней ЧСС за сутки свыше 120 у больных со структурными заболеваниями сердца является прогностически неблагоприятным признаком, так как быстро развивается СН. Показано назначение небольших доз β-АБ.
Экстрасистолия
Экстрасистолия наджелудочковая и желудочковая чаще диагностируются при плановой регистрации электрокардиограммы, не являются противопоказанием к естественным родам и не требуют ААТ. В большинстве случаев достаточно коррекции психоэмоционального статуса и исключения факторов, провоцирующих аритмию [45, 46]. Если количество экстрасистолий более порогового значения, необходимо оценить их прогностическое значение и риск развития неуправляемых ЖТ. К таким неблагоприятным характеристикам относятся ранние желудочковые экстрасистолы с пробежками неустойчивой ЖТ. В данном случае требуется частый мониторинг аритмии; к ААТ следует прибегать только при высоком риске развития ЖТ. Для лечения частых политопных, групповых или ранних желудочковых экстрасистолий, угрожающих переходом в более тяжелые виды аритмии с ухудшением гемодинамики и появлением признаков СН, выраженным снижением качества жизни, используют β-АБ (метопролол) при триггерном механизме ЖА, реже IC класса (флекаинид или пропафенон) при эктопическом механизме [47]. При частой наджелудочковой экстрасистолии ААТ не рекомендована. Если наджелудочковая экстрасистолия запускает устойчивые предсердные тахикардии с гемодинамическими расстройствами и снижением качества жизни, назначают кардиоселективные β-АБ или верапамил, а при их неэффективности – ААП IС класса: флекаинид или пропафенон [48].

Фибрилляция/трепетание предсердий
При гемодинамически стабильном течении ФП/ТП предпочтительнее стратегия контроля ЧСС. Контроль ЧСС обычно осуществляют с помощью β-АБ (пропранолол, метопролол), дигоксина или верапамила [4, 34, 35]. Блокаторы кальциевых каналов (БКК), β-АБ и сердечные гликозиды являются начальными методами лечения ФП, как пульсурежающая терапия. С целью снижения риска инсульта назначаются антикоагулянты. При стабильной гемодинамике восстановление синусового ритма возможно с использованием внутривенного введения пропафенона или флекаинида. Для противорецидивной терапии у женщин со структурно нормальным сердцем назначаются ААП, например пропафенон, флекаинид и соталол (рис. 1), не связанные с негативным воздействием на плод, хотя β-адреноблокирующий эффект соталола требует мониторинга роста плода [21]. У гемодинамически стабильных пациенток, но с не поддающейся контролю ЧСС, можно провести фармакологическую кардиоверсию или ЭКВ. Амиодарон у беременных не используется, так как проникает через плаценту и его следует избегать, особенно в I триместре.
Гемодинамически нестабильным пациенткам требуется ЭКВ постоянным током с мониторингом ЧСС плода [41]. Как и у небеременных взрослых, беременные женщины с ФП, длящейся более 48 ч или неизвестной продолжительности, должны получать антикоагулянты в течение 4 нед до и после кардиоверсии [14, 20]. Предпочтительны профилактические дозы низкомолекулярных гепаринов, но следует воздержаться от приема перед родами или анестезией. Варфарин не назначают из-за повышенного риска кровотечения в I и III триместрах беременности. Назначается низкомолекулярный или нефракционированный гепарин. За 4–6 ч до родов нефракционированный гепарин отменяется.
У беременных женщин с персистирующей или постоянной формой ФП решение о назначении антикоагулянтов принимают так же, как и у небеременных, в зависимости от риска тромбоэмболических осложнений по шкале CHA2DS2-VASc [14, 31]. При беременности пороговое значение шкалы CHA2DS2-VASc≥2 для антикоагулянтной терапии не валидировано [14]. Пероральные антикоагулянты противопоказаны при беременности, кроме пациенток с наличием механического клапана или умеренного или тяжелого митрального стеноза, которым требуется назначение варфарина. При тяжелых, рефрактерных к ААП пароксизмах ФП возможно проведение радиочастотной абляции [48]. Выбор способа родоразрешения должен основываться на акушерских показаниях.
 Наджелудочковая тахикардия
Наджелудочковая тахикардияПри лечении НЖТ важно учитывать стабильность состояния пациентки, срок беременности и безопасность лекарственных препаратов. Для острого прекращения пароксизма первичной терапией являются вагусные маневры (модифицированный маневр Вальсальвы, массаж каротидного синуса) [27]. В качестве препарата выбора рекомендуется использовать аденозин (6–18 мг болюсно), который можно вводить при всех видах НЖТ, которые либо прекращают тахикардию, либо замедляют атриовентрикулярную проводимость и, следовательно, частоту желудочковых сокращений. При неэффективности аденозина пациенткам без WPW назначают безопасные внутривенные селективные β-АБ (метопролол), недигидропиридиновые БКК (верапамил) или дигоксин (рис. 2). При синдроме WPW применяют флекаинид или прокаинамид. В качестве монотерапии следует избегать применения β-АБ, дигоксина и БКК. Для профилактики пароксизмов НЖТ при синдроме WPW необходимо избегать атриовентрикулярных узловых блокаторов в монотерапии, и для подавления приступов можно применять флекаинамид. У пациенток без предвозбуждения целесообразно использовать препараты из группы β-АБ (за исключением атенолола), БКК или дигоксин. Следует отметить, что данные препараты не предупреждают приступы НЖТ, а уменьшают вероятность гемодинамически значимых аритмий, поэтому назначаются только при частых рецидивах [30, 35]. В случае рефрактерности аритмии к ААТ (при синдроме преждевременного возбуждения желудочков) или плохой переносимости во время беременности может быть рекомендована радиочастотная абляция, которую целесообразно осуществлять на 26–28-й неделе беременности [49]. При невозможности проведения КА рекомендована имплантация кардиовертера-дефибриллятора [30]. При стабильной гемодинамике можно применять стимуляцию блуждающего нерва или чреспищеводную стимуляцию предсердий, при которых задействованы минимальные дозы энергии [48].
В случаях гемодинамической нестабильности и беспокойства за перфузию кровоснабжения плода проводится экстренная ЭКВ. Синхронизированная кардиоверсия безопасна на всех сроках беременности. Дозировка энергии должна быть такой же, как у небеременных пациенток [20, 21, 41].
Желудочковая тахикардия
При устойчивой гемодинамически стабильной ЖТ предпочтительным является использование β-АБ, лидокаина, при неэффективности которых назначается прокаинамид или хинидин. При рефрактерной и жизнеугрожающей ЖТ применяется амиодарон (при отсутствии альтернатив). При рефрактерной ЖТ проводится КА, которую по возможности следует отложить до послеродового периода [20].
В условиях гемодинамической нестабильности и высокого риска компрометации нарушения кровоснабжения плода следует проводить экстренную электрическую дефибрилляцию 50–100 Дж (и при необходимости – более высокие энергии от 100 до 360 Дж). При torsades de pointes (пируэтной тахикадии) используют инфузии магния сульфата (1–2 мг) [21].
Амиодарон относительно противопоказан при беременности, хотя может использоваться в экстренных ситуациях (если показания убедительны и определены риск/польза для пациентки). Применение амиодарона во время беременности нежелательно и должно быть ограничено случаями использования у женщин с рефрактерными или опасными для жизни аритмиями, которые не поддаются лечению другими ААП. При назначении амиодарона необходимо тщательное наблюдение за плодом на предмет возможных побочных эффектов, таких как брадикардия или задержка внутриутробного развития.
Для профилактики ЖТ назначается β-АБ [4, 16].
В случае рефрактерности или противопоказаний к β-АБ рекомендуется ААТ флекаинидом, соталолом или хинидином. Идиопатическую ЖТ из выходного тракта правого желудочка можно предотвратить с помощью β-АБ или верапамила.
Женщинам с синдромом наследственных аритмий лечение (фармакологическая или аппаратная терапия) проводят во время беременности и в послеродовом периоде. Беременным с синдромом удлиненного QT назначаются β-АБ длительного действия (надолол и пропранолол с замедленным высвобождением) [14]. Беременные с QTс более 500 мс являются кандидатами для имплантации кардиовертера-дефибриллятора [14, 35]. При катехоламинергической полиморфной ЖТ лечение проводят β-АБ (при необходимости – флекаинидом) во время беременности и после родов. При синдроме Бругада при аритмии назначают хинидин. В случае аритмогенной правожелудочковой кардиомиопатии необходимо продолжить прием β-АБ.
Заключение
НРС беременной женщины – сложная клиническая проблема, требующая междисциплинарного подхода. Частота выявления беременных с различными аритмиями растет. Несмотря на доступность современных методов диагностики и лечения, аритмии представляют риск для здоровья матери и плода. Проведено немного рандомизированных исследований безопасности ААП для матери и плода; назначение ААТ остается непростым выбором. Применение ААП показано только при клинически значимых аритмиях с возможностью избегать их назначения на постоянной основе, особенно в I триместре беременности.
Лечение аритмии у беременных требует индивидуального подхода с учетом анамнеза ССЗ, вида аритмии и ее тяжести, гестационного возраста, а также потенциальных рисков для матери и плода. Многие аритмии беременных можно безопасно купировать консервативными методами, однако жизнеугрожающие состояния требуют незамедлительной и решительной терапии, включая кардиоверсию, радиочастотную абляцию и имплантацию кардиовертера-дефибриллятора.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Алиджанова Хафиза Гафуровна – д-р мед. наук., ст. преподаватель учебного центра, ст. науч. сотр. отд. неотложной кардиологии с методами неинвазивной диагностики ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: alidzhanovahg@sklif.mos.ru; ORCID: 0000-0002-6229-8629
Khafiza G. Alidzhanova – Dr. Sci. (Med.), Senior Research Officer, Sklifosovsky Research Institute for Emergency Medicine. E-mail: alidzhanovahg@sklif.mos.ru; ORCID: 0000-0002-6229-8629
Тарасов Алексей Владимирович – зав. отд. хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ НМИЦ ТПМ. E-mail: a730tv@yandex.ru; ORCID: 0000-0003-4277-1711
Aleksey V. Tarasov – Head of the Department, National Medical Research Center for Therapy and Preventive Medicine. E-mail: a730tv@yandex.ru; ORCID: 0000-0003-4277-1711
Канунова Татьяна Андреевна – клинический ординатор по направлению «Кардиология» ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: kanunova_tanya@mail.ru; ORCID: 0000-0001-9285-4254
Tatiana A. Kanunova – Clinical Resident, Sklifosovsky Research Institute for Emergency Medicine. E-mail: kanunova_tanya@mail.ru; ORCID: 0000-0001-9285-4254
Шахова Ольга Борисовна – канд. мед. наук, ст. науч. сотр. отд. острых гинекологических заболеваний ГБУЗ «НИИ СП им.
Н.В. Склифосовского ДЗМ». E-mail: ShakhovaOB@sklif.mos.ru; ORCID: 0000-0002-7244-8563
Olga B. Shahova – Cand. Sci. (Med.), Senior Research Officer, Sklifosovsky Research Institute for Emergency Medicine. E-mail: ShakhovaOB@sklif.mos.ru; ORCID: 0000-0002-7244-8563
Мовсисян Давид Моисович – мл. науч. сотр. отд. неотложной клинической кардиологии с методами неинвазивной функциональной диагностики ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». E-mail: davidmovsisyan1112@gmail.com; ORCID: 0009-0001-8861-8221
David M. Movsisyan – Research Assistant, Sklifosovsky Research Institute for Emergency Medicine.
E-mail: davidmovsisyan1112@gmail.com;
ORCID: 0009-0001-8861-8221
Поступила в редакцию: 10.11.2025
Поступила после рецензирования: 19.11.2025
Принята к публикации: 20.11.2025
Received: 10.11.2025
Revised: 19.11.2025
Accepted: 20.11.2025
Список исп. литературыСкрыть список1. Sanghavi M, Rutherford JD. Cardiovascular physiology of pregnancy. Circulation 2014;130(12):1003-8. DOI: 10.1161/CIRCULATIONAHA.114.009029
2. McCoy JA, Kim YY, Nyman A, Levine LD. Pregnancy-related cardiac outcomes among patients with congenital heart disease after formalization of a cardio-obstetrics program. Am J Obstet Gynecol MFM 2024;6(4):101335. DOI: 10.1016/j.ajogmf.2024.101335
3. Crump C, Sundquist J, McLaughlin MA et al. Adverse pregnancy outcomes and long term risk of ischemic heart disease in mothers: national cohort and co-sibling study. BMJ 2023;380:e072112. DOI: 10.1136/bmj-2022-072112
4. De Backer J, Haugaa KH, Eide Hasselberg N et al.; ESC Scientific Document Group. 2025 ESC Guidelines for the management of cardiovascular disease and pregnancy: Developed by the task force on the management of cardiovascular disease and pregnancy of the European Society of Cardiology (ESC). Endorsed by the European Society of Gynecology (ESG). European Heart J 2025;ehaf193. DOI: 10.1093/eurheartj/ehaf193
5. Keepanasseril A, Pfaller B, Metcalfe A et al. Cardiovascular Deaths in Pregnancy: Growing Concerns and Preventive Strategies. Can J Cardiol 2021;37(12):1969-78. DOI: 10.1016/j.cjca.2021.09.022
6. Thakkar A, Hameed AB, Makshood M et al. Assessment and Prediction of Cardiovascular Contributions to Severe Maternal Morbidity. JACC Adv 2023;2(2):100275. DOI: 10.1016/j.jacadv.2023.100275
7. Dilmaghani D, Nath KA, Garovic VD. Increasing Maternal Mortality in the United States: Looking Beneath and Beyond the Numbers. Mayo Clin Proc 2024;99(6):873-7. DOI: 10.1016/j.mayocp.2024.04.002
8. Grodzinsky A, Schmidt L. Cardiovascular Contribution to Maternal Mortality. Cardiol Clin 2021;39(1):1-5. DOI: 10.1016/j.ccl.2020.09.001
9. Филиппов О.С., Гусева Е.В., Павлов К.Д. Мировые и отечественные тренды в динамике материнской смертности. Проблемы репродукции. 2024;30(1):100-8. DOI: 10.17116/repro202430011100
Filippov OS, Guseva EV, Pavlov KD. Global and Russian trends in Maternal mortality. Russian Journal of Human Reproduction. 2024;30(1):100-8. DOI: 10.17116/repro202430011100 (in Russian).
10. Grandi SM, Filion KB, Yoon S et al. Cardiovascular Disease-Related Morbidity and Mortality in Women With a History of Pregnancy Complications. Circulation 2019;139(8):1069-79. DOI: 10.1161/CIRCULATIONAHA.118.036748
11. Tamirisa KP, Elkayam U, Briller JE et al. Arrhythmias in Pregnancy. JACC Clin Electrophysiol 2022;8(1):120-35. DOI: 10.1016/j.jacep.2021.10.004
12. Joseph KS, Boutin A, Lisonkova S et al. Maternal Mortality in the United States: Recent Trends, Current Status, and Future Considerations. Obstet Gynecol 2021;137(5):763-71. DOI: 10.1097/aog. 0000000000004361
13. Rizi S, Wiens E, Hunt J, Ducas R. Cardiac physiology and pathophysiology in pregnancy. Can J Physiol Pharmacol 2024;102(10):552-71. DOI: 10.1139/cjpp-2024-0010
14. Joglar JA, Kapa S, Saarel EV et al. 2023 HRS expert consensus statement on the management of arrhythmias during pregnancy. Heart Rhythm 2023;20(10):e175-e264. DOI: 10.1016/j.hrthm.2023.05.017
15. MacIntyre C, Iwuala C, Parkash R. Cardiac Arrhythmias and Pregnancy. Curr Treat Options Cardiovasc Med 2018;20(8):63. DOI: 10.1007/s11936-018-0660-9
16. Sharma N, Coleman K, Ma R et al. Prevalence and clinical significance of arrhythmias during labour in women with structurally normal hearts. Open Heart 2022;9(2):e002117. DOI: 10.1136/openhrt-2022-002117
17. Vaidya VR, Arora S, Patel N et al. Burden of Arrhythmia in Pregnancy. Circulation 2017;135(6):619-21. DOI: 10.1161/CIRCULATIONAHA.116.026681
18. Шигабутдинова Т.Н., Габидуллина Р.И., Имангулова Л.И., Шарифуллина К.И. Сердечно-сосудистые заболевания у беременных в программе кардиоскрининга. Акушерство и гинекология. 2025;13(1):66-71. DOI: 10.33029/2303-9698-2025-13-1-66-71
Shigabutdinova TN, Gabidullina RI, Imangulova LI, Sharifullina KI. Cardiovascular Diseases in Pregnancy in the Cardiac Screening Program. Obstetrics and Gynecology. 2025;13(1):66-71. DOI: 10.33029/2303-9698-2025-13-1-66-71 (in Russian).
19. Усеинова Р.Х., Сулима А.Н., Рыбалка А.Н. и др. Современный взгляд на этиопатогенез нарушений ритма сердца у женщин в период беременности и методы их коррекции. Акушерство, гинекология и репродукция. 2021;15(4):419-29. DOI: 10.17749/2313-7347/ob.gyn. rep.2021.201
Useinova RKh, Sulima AN, Rybalka AN et al. Modern view on the etiopathogenesis of heart rhythm disorders and methods of their correction in pregnant women. Obstetrics, Gynecology and Reproduction. 2021;15(4):419-29. DOI: 10.17749/2313-7347/ob.gyn. rep.2021.201 (in Russian).
20. Conti E, Cascio ND, Paluan P et al. Pregnancy Arrhythmias: Management in the Emergency Department and Critical Care. J Clin Med 2024;13(4):1095. DOI: 10.3390/jcm13041095
21. Tamirisa KP, Oliveros E, Paulraj S et al. An Overview of Arrhythmias in Pregnancy. Methodist Debakey Cardiovasc J 2024;20(2):36-50. DOI: 10.14797/mdcvj.1325
22. Ravens U. Sex differences in cardiac electrophysiology. Can J Physiol Pharmacol 2018;96(10):985-90. DOI: 10.1139/cjpp-2018-0179
23. Linde C, Bongiorni MG, Birgersdotter-Green U et al.; ESC Scientific Document Group. Sex differences in cardiac arrhythmia: a consensus document of the European Heart Rhythm Association, endorsed by the Heart Rhythm Society and Asia Pacific Heart Rhythm Society. Europace 2018;20(10):1565–1565ao. DOI: 10.1093/europace/euy067
24. Compagnone M, Marinelli A, Dall'Ara G et al. Prolactin Inhibition to Treat Postpartum Arrhythmic Storm. JACC Case Rep 2024;29(4):102211. DOI: 10.1016/j.jaccas.2023.102211
25. Malik M. Sex differences in cardiac electrophysiology. Heart Rhythm 2022;19(11):1872-3. DOI: 10.1016/j.hrthm.2022.07.027
26. Rajani R, Shaik P, Babu PS et al. A Cross-Sectional study on electrocardiographic changes in normal pregnancy in a tertiary care teaching hospital. Eur J Cardiovas Med 2024;14(3):1186-97.
27. Ananthakrishnan R, Shradha S, Sudhir J et al. ECG Changes in Pregnancy – An Observational Study. J Marine Med Soc 2020;22(2):187-92. DOI: 10.4103/jmms.jmms_6_20
28. Аракелянц А.А., Морозова Т.Е., Барабанова Е.А., Самохина Е.О. Структурно-функциональные изменения сердца при беременности у женщин с сердечно-сосудистыми заболеваниями. Лечащий врач. 2021;7(24):18-23. DOI: 10.51793/OS.2021.24.7.004
Arakelyants AA, Morozova TE, Barabanova EA, Samokhina EO. Structural and functional heart features in pregnancy with concomitant cardiovascular diseases. Attending physician. 2021;7(24):18-23. DOI: 10.51793/OS.2021.24.7.004 (in Russian).
29. Lucà F, Abrignani MG, Oliva F et al. Multidisciplinary Approach in Atrial Fibrillation: As Good as Gold. J Clin Med 2024;13(16):4621. DOI: 10.3390/jcm13164621
30. Lucà F, Oliva F, Giuseppe M et al.; The Management and Quality Working Group Pediatric Cardiology Working Group and Arrhythmias Working Groups Anmco OBO. The Challenge of Managing Atrial Fibrillation during Pregnancy. Rev Cardiovasc Med 2023;24(10):279. DOI: 10.31083/j.rcm2410279
31. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J et al.; ESC Scientific Document Group. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018;39(34):3165-241. DOI: 10.1093/eurheartj/ehy340
32. Joglar JA, Chung MK, Armbruster AL et al.; Peer Review Committee Members. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2024;149(1):e1-e156. DOI: 10.1161/CIR.0000000000001193
33. Smagulova A, Ainabekova B, Albaev R et al. Tachyarrhythmia during gestation: peculiarities of manifestations and clinic. Europace 2024;26(Suppl.1):euae102.831. DOI: 10.1093/europace/euae102.831
34. Lindley KJ, Judge N. Arrhythmias in Pregnancy. Clin Obstet Gynecol 2020;63(4):878-92. DOI: 10.1097/GRF.0000000000000567
35. Hallmark AK, Lindley KJ, Banayan JM. Peripartum management of cardiac arrhythmias: a narrative review. Int J Obstet Anesth 2024;60:104243. DOI: 10.1016/j.ijoa.2024.104243
36. Tandon A, Satia M, Badhwar V. Successful management of a patient with severe brady-arrhythmia in peripartum period. Int J Reprod Contracept Obstet Gynecol 2019;8(3):1211-4. DOI: 10.18203/2320-1770.ijrcog20190909
37. Kiley JX, Corlett A, Mitchell-Sparke E et al. Antenatal experiences of pregnant women with cardiac conditions: a systematic review and meta-synthesis. AJOG Glob Rep 2025;5(3):100522. DOI: 10.1016/j.xagr.2025.100522
38. Senarath S, Nanayakkara P, Beale AL et al. Diagnosis and management of arrhythmias in pregnancy. Europace 2022;24(7):1041-51. DOI: 10.1093/europace/euab297
39. Mariani MV, Pierucci N, La Fazia VM et al. Antiarrhythmic Drug Use in Pregnancy: Considerations and Safety Profiles. J Cardiovasc Dev Dis 2024;11(8):243. DOI: 10.3390/jcdd11080243
40. Patel P, Goyal A. Antiarrhythmic Medications. 2024 Feb 28. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2025.
41. Albertini L, Spears DA. Management of arrhythmias during pregnancy. Heart Rhythm O2 2023;4(10):597-8. DOI: 10.1016/j.hroo.2023.09.004
42. https://open.fda.gov/fdalabels/proprietary_name/
43. https://www.rlsnet.ru/
44. Coad F, Frise C. Tachycardia in pregnancy: when to worry? Clin Med (Lond) 2021;21(5):e434-e437. DOI: 10.7861/clinmed.2021-0495
45. Varrias D, Sharma N, Hentz R et al. Clinical significance of unexplained persistent sinus tachycardia in women with structurally normal heart during the peripartum period. BMC Pregnancy Childbirth 2022;22(1):677. DOI: 10.1186/s12884-022-05012-3
46. Виноградова О.П., Рахматуллов Ф.К., Останин М.А., Рахматуллов Р.Ф. Оценка влияния экстрасистолической аритмии у беременных женщин на состояние плода. Астраханский медицинский журнал. 2023;18(3):56-66. DOI: 10.17021/1992-6499-2023-3-56-66
Vinogradova OP, Rakhmatullov FK, Ostanin MA, Rakhmatullov RF. Evaluation of the effect of extrasystolic arrhythmia in pregnant women on fetal condition. Astrakhan medical journal. 2023;18(3):56-66. DOI: 10.17021/1992-6499-2023-3-56-66 (in Russian).
47. Safavi-Naeini P, Sorurbakhsh NZ, Razavi M. Cardiac Arrhythmias During Pregnancy. Tex Heart Inst J 2021;48(4):e217548. DOI: 10.14503/THIJ-21-7548
48. Pan D, Chen Z, Chen H. Managing supraventricular tachyarrhythmia in pregnant patients within the emergency department. Front Cardiovasc Med 2024;11:1517990. DOI: 10.3389/fcvm.2024.1517990
49. Киргизова М.А., Дедкова А.А., Кистенева И.В., Криволапов С.Н. Сложности лечения нарушений ритма сердца у беременных. случай радиочастотной аблации предсердной тахикардии у беременной с использованием системы трехмерной нефлюороскопической навигации. Сибирский медицинский журнал. 2019;34(2):106-12. DOI: 10.29001/2073-8552-2019-34-2-106-112
Kirgizova MA, Dedkova AA, Kisteneva IV, Krivolapov SN. The complexity of the treatment of cardiac arrhythmias in pregnant women. case of radiofrequency ablation of atrial tachycardia in a pregnant woman using a three-dimensional nonfluoroscopic navigation system. Siberian Journal of Medicine. 2019;34(2):106-12. DOI: 10.29001/2073-8552-2019-34-2-106-112 (in Russian).
30 декабря 2025
Количество просмотров: 156

