Клинический разбор в общей медицине №11 2025
1 Novosibirsk State Medical University, Novosibirsk, Russia;
2 Institute of Internal and Preventive Medicine – a branch of the Institute of Cytology and Genetics, Novosibirsk, Russia
larut@list.ru
Abstract
The critical role of insulin resistance (IR), closely associated with abdominal obesity (AO), in the initiation and progression of cardiometabolic risk (CMR) during perimenopause necessitates studying the associations of waist circumference (WC), a clinical marker of AO, with parameters of menopausal metabolic syndrome (MetS).
Aim. To study the relationships between waist circumference, the TyG index, MetS characteristics, and the hormonal chronology of perimenopause in a cohort of women with different blood pressure (BP) levels.
Materials and methods. Of the 88 women aged 35–59 years, 58 had hypertension and 30 were normotensive. The following parameters were determined: WC, blood pressure, triglycerides (TG), HDL-C, insulin, follicle-stimulating hormone (FSH), estradiol, glucose, TyG index, and postmenopausal duration (PMD). The following parameters were assessed (SPSS, version 23): median [25th; 75th percentiles]; intergroup differences using the Mann-Whitney test; comparison of proportions using the Pearson χ2 test; Spearman correlation (R) and partial correlation (Rрс) analyses were performed to adjust for the influence of age.
Results. Statistically significant associations of WC were identified: negative with estradiol and HDL-C levels, positive with PMD, TyG, glucose, TG, blood pressure, and insulin levels, with no associations with FSH. WC also showed a Spearman correlation with the TyG index (R=0.526; p<0.001), which correlated with age-dependent FSH (R=0.212; p<0.05) and independently with age-dependent estradiol (R=0.252; p<0.01) and PMD (R=0.338; p<0.001). FSH and estradiol levels correlated with MetS markers completely in an age-dependent manner. The associations of PMD with FSH and TyG were more stable, persisting after age adjustment.
Conclusions. Correlations of perimenopausal parameters clarify their influence on MetS components, with the additional effect of PMD as a parameter of reproductive aging in addition to chronological aging. The OT association complex, reflecting the importance of anthropometric indicators as predictors of metabolic disorders, clarifies the factors that shape OT during perimenopause, drawing attention to its early stages for timely preventive interventions.
Keywords: perimenopause, insulin resistance, TyG index, abdominal obesity, waist circumference, metabolic syndrome, cardiometabolic risk, incretin analogs.
For citation: Ruyatkin D.S., Ruyatkina L.A., Shcherbakova L.V. Beyond the menopause horizon: searching for the clinical onset of cardiometabolic risk. Clinical review for general practice. 2025; 6 (11): 96–106 (In Russ.). DOI: 10.47407/kr2025.6.11.00717
Введение
Треть жизни женщины – период постменопаузы. Это процесс [1], сопровождающийся резким ростом метаболического синдрома (МетС) с риском кардиометаболических заболеваний (КМЗ): сахарного диабета 2-го типа (СД 2), сердечно-сосудистых заболеваний (ССЗ) и общей смертности [2, 3]. МетС представляет собой платформу факторов риска КМЗ: артериальной гипертонии (АГ), инсулинорезистентности (ИР), проатерогенной дислипидемии (повышение уровня триглицеридов, ТГ, и снижение уровня холестерина липопротеидов высокой плотности, ХС ЛПВП), абдоминального ожирения (АО) и дисгликемии, связывая их в общую патологию [4]. Наличие уникального дополнительного фактора риска для женщин, менопаузы, определяет менопаузальный фенотип МетС. Хотя ССЗ часто считаются «болезнью мужчин», на самом деле это «катастрофа женщин» [5] со значительным увеличением смертности по этой причине за последние 60 лет. Несмотря на некоторый прогресс в контроле артериального давления (АД) и липидного профиля, общее кардиометаболическое здоровье населения ухудшилось со значительным ростом распространенности МетС при лидирующей роли ожирения [6].
Отдельные компоненты МетС у женщин и мужчин одинаковы, однако важно, как и когда эти компоненты проявляются [7]. У женщин компоненты МетС прогностически более значимы для кардиометаболического риска (КМР) в сравнении с мужчинами [3] с особыми закономерностями. Его формирование имеет свою траекторию, тесно связанную с изменением функционального состояния оси гипофиз–яичники: от пременопаузы к собственно менопаузе (менопаузальный переход, МП) и постменопаузе [8]. Период, включающий МП и раннюю постменопаузу, обозначают термином «перименопауза»; она признана ключевым периодом КМР [9] вследствие значительных метаболических и сердечно-сосудистых изменений в тесной связи с формированием менопаузального МетС на фоне репродуктивного старения. Более высокая распространенность МетС у женщин в постменопаузе (до 70% по сравнению с 14–45% в пременопаузе) может быть обусловлена в большей степени изменениями во время МП, чем собственно постменопаузой, что важно для оценки наступления КМР относительно менопаузы [10].
В патофизиологии МетС центральным звеном остается ИР с менопаузой как потенциальным фактором риска ее развития независимо от возраста [1]. Снижение уровня эстрадиола (Е2) считают основным фактором риска КМЗ у женщин в менопаузе [11]. Однако ИР и связанные с ней метаболические нарушения: дислипидемия, нарастание массы тела (оцененное по индексу массы тела, ИМТ, и окружности талии, ОТ) и дисгликемия – отмечаются уже в пременопаузе [12] с тенденцией к резкому нарастанию с наступлением менопаузы [13].
Менопауза устанавливается ретроспективно, после 12 месяцев аменореи [5]; возрастной диапазон физиологической менопаузы определен как 45–55 лет при среднем возрасте 51,3 года [14]. Пременопауза может наступать за 5–10 лет до менопаузы, при этом КМР существенно повышается в типичном возрасте менопаузы (~51 год) [15]. Изменения функционального состояния оси гипофиз–яичники с гормональными колебаниями, влияющими на чувствительность к инсулину, наблюдаются уже в пременопаузе [11] и могут стартовать за 5–10 лет до наступления менопаузы [16]. Наряду с гормональными изменениями отмечена трансформация тесно связанных с ними метаболических и гемодинамических показателей [8]. При средней длительности 2–8 лет до последнего менструального цикла, МП связан с увеличением клинического и субклинического сердечно-сосудистого риска [17], включая функциональные и структурные показатели субклинического атеросклероза [18].
Из компонентов МетС АГ является ведущим фактором риска ССЗ и сердечно-сосудистой смертности, при этом наиболее модифицируемым [19]. Ее распространенность непропорционально сильно затрагивает женщин в постменопаузе; показатели контроля остаются субоптимальными, составляя около 50% среди женщин среднего возраста [2]. Значимый вклад в этом направлении вносит дисгликемия. Уже предиабет ассоциирован со значительным риском, наличием и прогрессированием ССЗ [20], при этом распространенность СД 2 в постменопаузе наиболее сильно связана с уровнями АД [21], а центральным звеном патогенеза, ускоряющим этот путь, служит ИР [20]. Выделяют пременопаузальный и постменопаузальный МетС, последний по своим характеристикам отличается только относительной гиперандрогенией [22]. Соответственно, крайне важно уточнить оптимальный период для профилактических мер.
Из суррогатных показателей ИР особое внимание привлекает триглицерид-глюкозный индекс (TyG) [23]. Отсутствие его общепринятых референсных значений определяет необходимость поиска простых индикаторов МетС, ассоциированных с TyG и параметрами перименопаузы, для определения «точки» профилактического вмешательства. Патогенетическая идеология МетС в качестве клинических характеристик ИР рассматривает АГ, дислипидемию, дисгликемию и АО [24]. Поскольку для МетС характерно именно АО с более высокой общей и абдоминальной жировой тканью и более низкой безжировой массой тела [25], полагают, что ОТ является лучшим антропометрическим показателем висцерального жира и оптимальным предиктором метаболических нарушений гормональной траектории перименопаузы [26]. Подобные исследования носят пилотный характер, малочисленны и фрагментарны.
Цель – изучить взаимосвязи ОТ с индексом TyG, характеристиками МетС и гормональной хронологии перименопаузы в когорте женщин с различными уровнями АД.
Материалы и методы
В одноцентровое одномоментное исследование в рамках профилактического осмотра включены 88 женщин 35–59 лет: из них 30 нормотензивных, 58 имели АГ. Критерии исключения: нарушения углеводного обмена и другие эндокринные заболевания; ранее диагностированные ишемическая болезнь сердца, хроническая сердечная недостаточность; перенесенные острые сердечно-сосудистые заболевания; нарушения ритма и проводимости; менопаузальная гормональная терапия; курение; сопутствующие заболевания в стадии обострения.
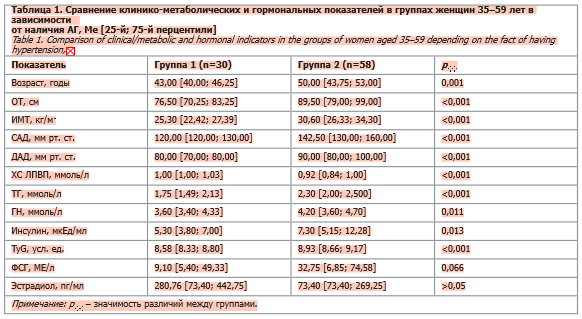
Тридцать условно здоровых женщин без АГ в возрасте 43,00 [40,00; 46,25] года без наследственной отягощенности по ССЗ и дисгликемии составили группу 1. В группу 2 были отнесены 58 женщин в возрасте 50,00 [43,75; 53,00] года с длительностью АГ 3,21 [1,00; 5,00] года, не получающие регулярную антигипертензивную терапию, с наследственной отягощенностью по ССЗ в 75% случаев. Пациентки с АГ, кроме гипотензивной, никакую другую терапию не получали.
Обследованные женщины имели различное функциональное состояние яичников: 43% были в постменопаузе, длительность постменопаузы (ДлПМ) составила 1,64 [0,00; 2,00] года; при этом в группе 1 менопауза зафиксирована у 6 (20,0%) женщин, в группе 2 – у 32 (55,2%). Часть женщин находились в перименопаузе, включая позднюю пременопаузу и раннюю постменопаузу, что характеризуется повышением уровней фолликулостимулирующего гормона (ФСГ) >25 МЕ/л [27].
Определяли маркеры МетС: ОТ, ИМТ, уровни АД – систолического (САД) и диастолического (ДАД); показатели гликемии натощак (ГН) глюкозооксидазным методом; ХС ЛПВП и ТГ ферментативным калориметрическим методом; инсулина, ФСГ и Е2 иммуноферментным методом на анализаторе IMMULITE 2000XPi. Индекс TyG рассчитывали по формуле: индекс TyG = Ln [ТГ (мг/дл) × ГН (мг/дл) / 2], где Ln – логарифм [28].
Статистическая обработка данных выполнена с помощью программ SPSS (версия 23). Определяли базовые статистики: медиану (Ме), интерквартильный диапазон [25-й; 75-й перцентили]. Оценка значимости межгрупповых различий величин проводилась с помощью U-критерия Манна–Уитни. Для сравнения долей использовался критерий χ2 Пирсона. Для выявления зависимостей и прогностических факторов использовали корреляционный анализ (ранговая корреляция Спирмена, partial correlation). В процедурах статистического анализа критический уровень значимости для отклонения нулевой статистической гипотезы (р) принимался ≤0,05. Статистический анализ частично проведен в рамках бюджетной темы FWNR-2024-0002. Исследование выполнено с соблюдением этических принципов проведения научных медицинских исследований с участием человека, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации.
Результаты
Сравнительный анализ двух групп женщин (табл. 1) отражает статистически значимые различия большинства параметров. Женщины группы 2 были старше, кроме маркирующих группу уровней АД имели более высокие показатели ОТ, ИМТ, ТГ и ГН и более низкие ХС ЛПВП. В группе 1 параметры ОТ, ИМТ и липидные показатели полностью не укладывались в референсные пределы. Уровни ГН в обеих группах находились в референсном диапазоне, хотя в группе 2 они были выше (p=0,011), чем у женщин без АГ. Уровни инсулина и TyG также при наличии АГ превышали значения соответствующих показателей у нормотензивных женщин (см. табл. 1).
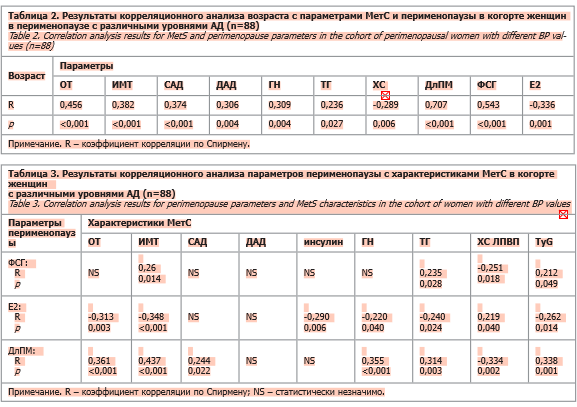
Группы статистически не различались по параметрам функционального состояния оси гипофиз–яичники, что объяснимо большой вариабельностью уровней ФСГ и Е2 в зависимости от периода МП [29]. С учетом более старшего возраста женщин группы 2 и разных стадий перименопаузального континуума, при сравнении групп по уровню ФСГ выше или ниже 25 МЕ/л (30 и 52% в группах 1 и 2 соответственно) было выявлено их статистическое различие (критерий Пирсона χ2=3,781; p=0,052). Ассоциации возраста со всеми параметрами МетС и перименопаузы (табл. 2), особенно тесные с ФСГ и ДлПМ, послужили дополнительным основанием для проведения partial correlation c целью нивелирования влияния возраста.
Ассоциации ДлПМ, находящейся под интенсивным влиянием возраста (R=0,707; p<0,001), с параметрами МетС были менее сильными (табл. 3) в сравнении с возрастом (см. табл. 2), отражая дополнительное влияние ДлПМ как параметра репродуктивного старения к процессу хронологического старения. Уровни ФСГ и Е2 коррелировали с маркерами МетС полностью возрастзависимо (см. табл. 3). Ассоциации ДлПМ с ФСГ и с TyG были стабильнее, сохраняясь при коррекции по возрасту (рис. 1). Корреляция ДлПМ с уровнями гормонов вела себя по-разному: с ФСГ (R=0,622; p<0,001; Rрс=0,273; р=0,014) была слабее, чем с возрастом (R=0,700; p<0,001), и наоборот, уровни Е2 сильнее коррелировали с ДлПМ (R=-0,508; p<0,001), чем с возрастом (R=-0,336; p=0,001). После нивелирования влияния возраста из параметров МП с характеристиками МетС сохраняла связь только ДлПМ с TyG (см. рис. 1).
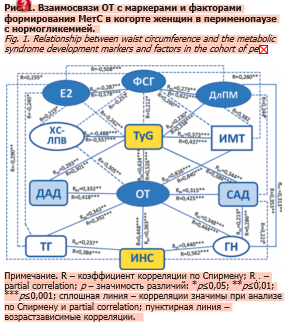 В центре корреляционного комплекса наибольшее число статистически значимых и более тесных связей по Спирмену и partial correlation сформировали индекс TyG и ОТ с остальными параметрами МетС и перименопаузы (см. рис. 1). Ассоциации САД и ДАД с ОТ практически равнозначны по силе таковым с TyG, в последнем варианте сильнее у САД. Все ассоциации параметров МП, гормональных и ДлПМ, полностью возрастзависимы, исключение отмечено только у корреляции TyG с ДлПМ. Маркер висцерального ожирения, ОТ, полностью возрастзависимо коррелирует с Е2 и ДлПМ, сохраняя ассоциации при коррекции по возрасту с большинством остальных параметров МетС, кроме ХС ЛПВП; не выявлено прямых связей ОТ с ФСГ, однако наличие стабильной ассоциации ОТ с TyG, который коррелирует с гормональными (Е2 и ФСГ) и временными (ДлПМ) параметрами перименопаузы, позволяет предполагать опосредованный характер связи ОТ и ФСГ (см. рис. 1).
В центре корреляционного комплекса наибольшее число статистически значимых и более тесных связей по Спирмену и partial correlation сформировали индекс TyG и ОТ с остальными параметрами МетС и перименопаузы (см. рис. 1). Ассоциации САД и ДАД с ОТ практически равнозначны по силе таковым с TyG, в последнем варианте сильнее у САД. Все ассоциации параметров МП, гормональных и ДлПМ, полностью возрастзависимы, исключение отмечено только у корреляции TyG с ДлПМ. Маркер висцерального ожирения, ОТ, полностью возрастзависимо коррелирует с Е2 и ДлПМ, сохраняя ассоциации при коррекции по возрасту с большинством остальных параметров МетС, кроме ХС ЛПВП; не выявлено прямых связей ОТ с ФСГ, однако наличие стабильной ассоциации ОТ с TyG, который коррелирует с гормональными (Е2 и ФСГ) и временными (ДлПМ) параметрами перименопаузы, позволяет предполагать опосредованный характер связи ОТ и ФСГ (см. рис. 1).
Обсуждение
Возрастной диапазон перименопаузальной когорты женщин был выбран с учетом следующих характеристик: хронологии репродуктивного старения женщин [30], возможности появления метаболических изменений уже в пременопаузе [8] и возрастного физиологического диапазона менопаузы [31]. Статистически значимое влияние возраста на исследуемые показатели (см. табл. 2) отражает хронологическое старение в перименопаузе. Значительные изменения баланса половых гормонов у женщин на протяжении жизни играют важную роль в гендерных различиях метаболических нарушений; защитную роль традиционно отводят эстрогенам [32]. Траектории уровней E2 и ФСГ в течение МП неоднородны под влиянием ИМТ и этнической принадлежности [33], что объясняет отсутствие статистических различий между группами по уровням Е2 и ФСГ (см. табл. 1), а также резкое ослабление их взаимной корреляции (см. рис. 1) в исследуемой когорте женщин при нивелировании влияния возраста (Rpc=-0,287; p=0,009), в отличие от анализа по Спирмену (R=-0,578; p<0,001).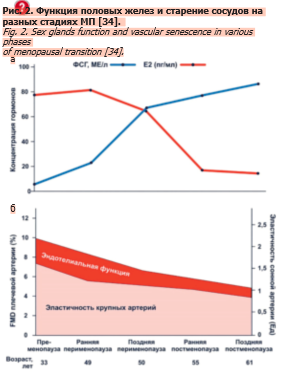 Одновременное разнонаправленное изменение уровней Е2 и гонадотропина на разных стадиях МП тесно связано со старением сосудов (рис. 2), оцененным по снижению функции эндотелия с помощью поток-опосредованной дилатации (flow-mediated dilation, FMD) плечевой артерии и эластичности сонной артерии, выявленному уже в пременопаузе [34]. Воздействие эндогенных эстрогенов в репродуктивном возрасте обеспечивает женщинам защиту от ССЗ; с потерей эстрогенов постменопауза связана с увеличением ИР, АО, дислипидемией и эндотелиальной дисфункцией [8].
Одновременное разнонаправленное изменение уровней Е2 и гонадотропина на разных стадиях МП тесно связано со старением сосудов (рис. 2), оцененным по снижению функции эндотелия с помощью поток-опосредованной дилатации (flow-mediated dilation, FMD) плечевой артерии и эластичности сонной артерии, выявленному уже в пременопаузе [34]. Воздействие эндогенных эстрогенов в репродуктивном возрасте обеспечивает женщинам защиту от ССЗ; с потерей эстрогенов постменопауза связана с увеличением ИР, АО, дислипидемией и эндотелиальной дисфункцией [8].
Ассоциации ИР, оцененной по индексу TyG, со всеми параметрами перименопаузы и МетС (см. рис. 1), характеризуют ее как центральное патогенетическое звено формирования менопаузального фенотипа кластера. МП связан с повышением ИР в совокупности с маркерами МетС: АО, дисгликемией, дислипидемией и АГ [8]. Накапливаются доказательства экстрагонадных функций ФСГ после обнаружения экспрессии его рецепторов в кровеносных сосудах, жировой ткани, печени, остеокластах, нейронах гиппокампа и коры [35]. Дополнительные биологические функции гормонов гипофиза, в том числе и ФСГ, при их действии на неклассические органы определены новой концепцией «атипичной оси гормон гипофиза – ткань-мишень»; смысл концепции – наличие у гормонов гипофиза дополнительных биологических функций [36]. В нашем исследовании уровни ФСГ, наряду с Е2 и ДлПМ, через статистически значимые связи, разные по характеру, но однонаправленные по смыслу, оказывают возрастзависимое влияние (см. табл. 3, рис. 1) на формирование дислипидемии (прямая связь Е2 с ХС ЛПВП и обратная с ТГ; прямая связь ФСГ с ТГ и обратная с ХС ЛПВП) и гликемии (прямая связь ДлПМ с ГН), важные компоненты КМР. Указанный комплекс ассоциаций предполагает совместное влияние репродуктивного и хронологического старения на старение сосудов, что согласуется с мнением K.L. Moreau (см. рис. 2) [34]. Подчеркивается роль ожирения в сердечно-сосудистом старении [17].
Дефицит эстрогенов сам по себе не может полностью объяснить постменопаузальную дислипидемию [37]. Влияние ФСГ на липидный спектр начинается задолго до менопаузы, уже в пременопаузе, когда уровни Е2 относительно стабильны [38]. Новый ФСГ-обусловленный механизм постменопаузальной дислипидемии объясняют эффектом гонадотропина на липидный метаболизм в печени [36].
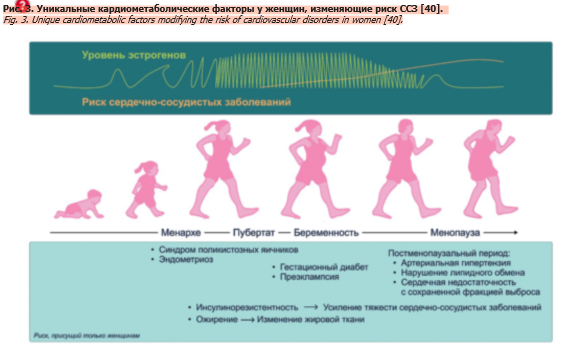
Влияние ФСГ, который первым фиксирует снижение репродуктивного потенциала женщины, на целый комплекс параметров МетС (см. рис. 1), основу КМР, ориентирует внимание на МП для поиска точки профилактического отсчета. Современные руководящие принципы по первичной профилактике ССЗ подчеркивают значимость специфических для женщин факторов риска на протяжении всего жизненного цикла женщины: гормональной контрацепции, гипертензивных расстройств беременности и менопаузы, – создающих дополнительный уровень риска [39]. Эти уникальные факторы КМР связаны с динамикой репродуктивного потенциала: от особенностей пубертата к осложнениям течения беременности (дисгликемии и преэклампсии) и далее к менопаузе и постменопаузе с уже сформировавшимися ССЗ; при этом авторы, определяя ИР и перераспределение жировой ткани в качестве специфических факторов КМР, ответственным за подобную динамику традиционно указывают уровень Е2 (рис. 3) [40].
Нами выявлены стабильные ассоциации ДлПМ с ФСГ по Спирмену и partial correlation (см. рис. 1) при полностью возрастзависимой связи Е2 с ДлПМ, что согласуется с формированием выраженного эстрогендефицита в поздней постменопаузе. Несмотря на чрезвычайную вариабельность уровней ФСГ, их количественные ориентиры, в отличие от Е2, внесены в систему стадирования репродуктивного старения у женщин STRAW+10: начиная с позднего фертильного периода (>25 МЕ/л), с тенденцией к повышению в ранней фазе МП и сохранением высоких показателей в поздней перименопаузе [27]. Эти данные не согласуются с классической точкой зрения, объясняющей механизмы метаболических и гемодинамических изменений во время МП дефицитом эстрогена, характерным для поздней постменопаузы [41]. Подобное противоречие имеет принципиальное значение для клинической практики, поскольку ориентация на связь дебюта КМЗ с поздней постменопаузой нередко сдвигает акценты с профилактического подхода на ургентную помощь. Риск развития МетС увеличивается с годами после менопаузы, но полное влияние ДлПМ остается неясным [31]. Именно ДлПМ оказалась наиболее важным фактором риска МетС по результатам турецкого поперечного исследования, при этом риск повышался при ее длительности более 5 лет [12]; в цитируемой работе не анализировались показатели функционального состояния оси гипофиз–яичники.
Также обращает на себя внимание частично возрастзависимая связь уровней ФСГ с индексом TyG (см. рис. 1), который стабильно коррелирует с ДлПМ и уровнями инсулина (R=0,550; р<0,001), сохраняя эту связь при коррекции по возрасту (Rрс=0,409; р<0,001). Изменения функционального состояния оси гипофиз–яичники с гормональными колебаниями, влияющими на чувствительность к инсулину (обратную сторону ИР), наблюдаются уже в пременопаузе [11]. Обосновано мнение о гиперинсулинемии/ИР как предшественниках СД 2 и критических базовых компонентах МетС и КМР [42].
Графическая интерпретация корреляционного анализа (см. рис. 1) обнаруживает два своеобразных «центра притяжения», ОТ и TyG, во взаимодействии с изучаемыми параметрами. Индекс TyG практически равнозначно коррелирует с ОТ (см. рис. 1) и уровнями инсулина (R=0,508; p<0,001; Rрс=0,409; p<0,001), который имеет схожую зависимость с уровнями ГН (см. рис. 1). Эти два маркера ИР: TyG, суррогатный биохимический показатель, и ОТ, клинический параметр, привлекают к себе пристальное внимание в прогнозе формирования менопаузального МетС на протяжении МП. Отметим, что ассоциации ОТ с уровнями АД несколько сильнее аналогичных с индексом TyG, отражая самостоятельную роль АО в патогенезе АГ [43], особенно в перименопаузе [44]. Использование для антропометрической оценки в период МП только ИМТ нередко скрывает АО, поскольку противоположные изменения состава тела в этот период с уменьшением безжировой массы и увеличением жировой нередко приводят к незначительным изменениям массы тела в ответ на саму менопаузу [45], при этом ОТ значительно увеличивается в различных этнических группах [46]. Подчеркивают, что АО, определяемое по ОТ, является маркером риска ССЗ, не зависящим от ИМТ [47]. С наступлением менопаузы ИР и связанные с ней метаболические нарушения: дислипидемия, нарастание массы тела и дисгликемия – имеют тенденцию к резкому нарастанию [46]. В анализируемой когорте перименопаузальных женщин ОТ, при стабильных корреляциях с индексом TyG и уровнями ТГ, образует возрастзависимые ассоциации с ХС ЛПВП и ДлПМ (см. рис. 1). Все три параметра перименопаузы, ДлПМ, Е2 и ФСГ, оказывают возрастзависимое влияние на липидные параметры (см. табл. 3), являющиеся маркерами МетС (см. рис. 1).
Фенотип ожирения принципиально важен для КМР; простым маркером абдоминального жироотложения служит ОТ [25]. В качестве первого варианта МетС описан фенотип гипертриглицеридемической талии (ГТГОТ), расцененный как интегративное зеркало признаков синдрома [48]. Этот фенотип ассоциирован с женским полом, поскольку менопауза способствует перераспределению висцерального жира [49], тесно связанного с АГ, объединяя их через ИР в рамках МетС [50]. Выявленные нами ассоциации ОТ с индексом TyG, уровнями АД и ТГ (см. рис. 1), согласуясь с фенотипом ГТГОТ [48], могут отражать его участие в формировании фенотипа АГ в перименопаузе с учетом влияния параметров МП на маркеры МетС (см. табл. 3). Ожирение вызывает нейрогормональную активацию и активацию ренин-ангиотензин-альдостероновой и симпатической нервной систем, что наряду с гиперлептинемией и другими гомеостатическими отклонениями способствует задержке натрия и развитию АГ [43]. Увеличение массы тела во время МП хорошо документировано, однако его основные причины и механизмы детально не изучены [51]. К инициации ожирения в перименопаузе причастны гормональные изменения: гипоэстрогенемия, гипергонадотропинемия, относительная гиперандрогенемия, дефицит гормона роста, резистентность к лептину, хронический стресс через гипоталамо-гипофизарно-надпочечниковую ось [25].
На риск последующих КМЗ влияет целый ряд факторов репродуктивного периода: возраст менархе, гестационные проблемы (диабет, гипертония); предшествующие гестации модифицируемые факторы риска образа жизни с формированием ожирения; после беременности персистирующая ИР, хроническое субклиническое воспаление, дислипидемия, эндотелиальная дисфункция [1, 8, 40]. Комплекс этих событий еще в репродуктивном периоде создает условия для сосудистого повреждения с дальнейшим прогрессированием в рамках МП (см. рис. 3) [40] до КМЗ, пик которых наступает в постменопаузе [51]. Соответствуя концепции «атипичной оси гормон гипофиза – ткань-мишень» [36], присутствие рецепторов ФСГ в висцеральной жировой ткани отражает участие ФСГ в постменопаузальном АО и может способствовать провоспалительной среде [52].
Выявленные ассоциации ОТ, отрицательные с уровнями Е2 и положительные с ДлПМ (см. табл. 3) при отсутствии корреляций с ФСГ, отражают этапность формирования АО в процессе перименопаузы, привлекая внимание к ранним его этапам с учетом четких связей с увеличением риска развития сердечно-сосудистого-почечно-метаболического синдрома [51]. ОТ является лучшим антропометрическим показателем висцеральной жировой ткани и предиктором метаболических нарушений: СД 2 и дислипидемии [53], и может служить первым тревожным сигналом, побуждающим к регулярному биохимическому скринингу липидных и гликемических параметров [54].
Американская кардиологическая ассоциация в 2020 г. впервые выделяет МП как специфичное для пола событие, серьезно влияющее на будущее кардиометаболическое здоровье [30]. Перименопауза, будучи критической для здоровья и качества жизни женщин переходной фазой [55], одновременно предоставляет возможности для вмешательства в образ жизни, чтобы противодействовать влиянию гормональных изменений и старения на кардиометаболический профиль [56]. Консенсусное заявление Европейского общества кардиологов (2025) обращает особое внимание клиницистов на подходы к профилактике избыточного набора массы тела и поддержанию здоровой массы тела с раннего детства и на протяжении всей взрослой жизни [57].
В современной стратегии снижения массы тела начальными методами лечения остаются изменение образа жизни и фармакологические вмешательства с особым акцентом на контроль КМР [57].
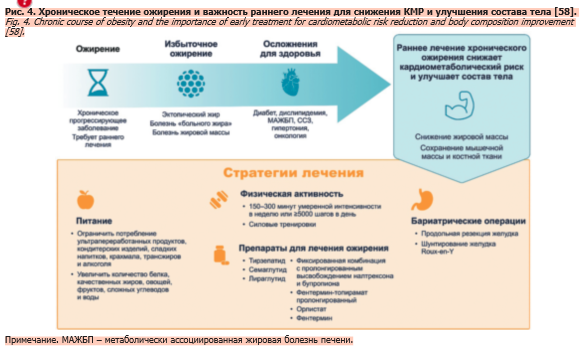
Хроническое течение ожирения, его локализация и степень, необходимость максимального снижения жировой массы тела при сохранении безжировой подчеркивают важность раннего начала и длительности лечения на протяжении жизни для уменьшения КМР [58]. Независимым предиктором висцерального ожирения оказался малоподвижный образ жизни [59], определяющий основные принципы питания и физической активности (рис. 4) [58]. Для оптимизации состава тела важен комплексный подход: богатая белком диета, тренировки с отягощениями и фармакотерапия нового поколения с помощью инкретиновых препаратов [60]; сохранение мышечной массы может смягчить повторный набор жировой ткани после прекращения фармакотерапии [58].
В актуальной фармакотерапии ожирения по эффективности и влиянию на факторы КМР лидируют инкретиновые препараты: семаглутид, агонист рецепторов глюкагоноподобного пептида-1 (ГПП-1), и тирзепатид, двойной агонист рецепторов ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП). Препараты агонистов рецепторов ГПП-1 являются не просто регуляторами метаболизма, способствующими значительному снижению массы тела, они приводят к уменьшению уровней С-реактивного белка, высокочувствительного маркера общего воспаления [61]. Агонисты рецепторов ГПП-1 и двойные полипептиды ГИП/ГПП-1 оказывают положительное влияние на большинство компонентов «кардиометаболического континуума», подтвержденное результатами исследований сердечно-сосудистых исходов (cardiovascular outcome trial, CVOT) (рис. 5), помогая снизить потребность в полипрагмазии [62]. Эти препараты продемонстрировали улучшение массы и состава тела, а также параметров, связанных с метаболизмом глюкозы, гипертонией, дислипидемией (снижение уровня ТГ и повышение уровня ХС ЛПВП) и стеатозом печени, связанным с метаболической дисфункцией. Кроме того, семаглутид 2,4 мг в подкожной форме продемонстрировал снижение сердечно-сосудистой смертности, нефатального инфаркта миокарда или инсульта, а также симптомов сердечной недостаточности, в то время как тирзепатид продемонстрировал снижение сердечно-сосудистой смертности и уменьшение симптомов сердечной недостаточности у пациентов с ожирением и сердечной недостаточностью [63].
Агонисты рецепторов ГПП-1 уже известны своей эффективностью в лечении СД 2, ожирения и кардиопротекции у пациентов с СД 2, в то время как двойные агонисты рецепторов ГИП/ГПП-1, по-видимому, обладают потенциалом превзойти их при тех же показаниях. Тирзепатид рассматривают как новую кардиометаболическую терапевтическую перспективу, поскольку этот многофункциональный монофармакологический препарат способен значительно снижать уровень глюкозы, улучшать чувствительность к инсулину, снижать массу тела и корректировать дислипидемию, благоприятно влияя на липидный профиль (рис. 6) [64].
Учитывая высокую распространенность ожирения и СД 2 среди населения Российской Федерации и крайне негативное их влияние на продолжительность и качество жизни, вопрос доступа к терапии тирзепатидом является критическим для российских пациентов, при этом единственный препарат, содержащий тирзепатид (Мунджаро®), официально в России и странах Евразийского экономического союза (ЕАЭС) не зарегистрирован и в страны ЕАЭС не поставляется. Это подтолкнуло отечественные фармацевтические компании к разработке собственных дженериков препарата тирзепатид для обеспечения доступа пациентов к наиболее современной терапии. Компанией ГЕРОФАРМ тирзепатид под торговым наименованием Седжаро® был зарегистрирован в 2025 г. Комплекс проведенных исследований с использованием ортогональных методов показал, что препараты Седжаро и Мунджаро структурно идентичны, сопоставимы по профилю примесей и биологически эквивалентны [65]. Функциональная и метаболическая эквивалентность препаратов Седжаро и Мунджаро достоверно подтверждена при исследовании в двухклеточных тестах, отражающих фармакологически релевантные механизмы действия препарата – активацию рецепторов ГПП-1 (рис. 7) и ГИП (рис. 8) [65].
Заключение
Новые данные о влиянии ФСГ на ключевые звенья патогенеза МетС, подчеркивая роль МП в качестве ключевого периода КМР [66], расширяют его патогенез за пределы снижения уровней гормонов яичников к изменению функционального состояния оси гипофиз–яичники. При этом хроническое воспаление, тесно связанное с дисфункцией эндотелия, определяют как важный маркер старения [34], основы которого закладываются в молодые годы. Женщины более склонны к ожирению, а с возрастом наблюдаются половые различия в фенотипах и исходах КМЗ [67]. Метаболические и клинические факторы, вторичные по отношению к менопаузе, такие как дислипидемия, ИР, перераспределение жира и системная гипертензия, способствуют ускоренному риску сердечно-сосудистого старения и развития заболеваний. Конечным результатом сложного взаимодействия между факторами риска сердечно-сосудистых заболеваний и их усилением в период перименопаузы является, по-видимому, ускоренный атерогенез [17].
Критическими предикторами КМЗ являются ИР и гиперинсулинемия [68] в тесной связи с формированием АО. Клиническим маркером последнего и жизненно важным показателем для улучшения распознавания риска для здоровья служит ОТ [63], увеличение которой рассматривают как биомаркер старения [69]. Хроническое течение ожирения со склонностью к рецидивам определяет важность раннего лечения для улучшения состава тела и снижения КМР [58], при этом свою эффективность доказали инкретиновые препараты, особенно семаглутид и тирзепатид. Появление этих новых препаратов представляет собой смену парадигмы в фармакологическом лечении ожирения, поскольку они обеспечивают более выраженное снижение массы тела и улучшение в отношении сопутствующих КМЗ [63].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. Д.С. Руяткин – обсуждение идеи, набор материала, участие в статистическом анализе, поиск и анализ данных литературы, участие в написании статьи; Л.А. Руяткина – обсуждение идеи, участие в наборе материала и статистическом анализе, анализ данных литературы, написание статьи; Л.В. Щербакова – идея варианта статистического анализа и участие в нем.
Contribution of the authors. D.S. Ruyatkin – discussion of the idea, collection of material, participation in statistical analysis, search and analysis of literature data, participation in writing the article; L.A. Ruyatkina – discussion of the idea, participation in the collection of material and statistical analysis, analysis of literature data, writing an article; L.V. Shcherbakova – the idea of a variant of statistical analysis and participation in it.
Информация об авторах
Information about the authors
Руяткин Дмитрий Сергеевич – канд. мед. наук, доц., ФГБОУ ВО НГМУ. E-mail: dr79@mail.ru; ORCID: 0000-0003-3431-5943
Dmitry S. Ruyatkin – Cand. Sci. (Med.), Assoc. Prof., Novosibirsk State Medical University. E-mail: dr79@mail.ru; ORCID: 0000-0003-3431-5943
Руяткина Людмила Александровна – д-р мед. наук, проф., ФГБОУ ВО НГМУ. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Lyudmila A. Ruyatkina – Dr. Sci. (Med.), Full Prof., Prof., Novosibirsk State Medical University. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Щербакова Лилия Валерьевна – cт. науч. сотр. НИИ терапии и профилактической медицины – филиала ФГБНУ ФИЦ «ИЦИГ СО РАН». E-mail: 9584792@mail.ru; ORCID: 0000-0001-9270-9188
Liliya V. Shcherbakova – Senior Res. Officer, Research Institute of Therapy and Preventive Medicine – a branch of the Federal Research Center Institute of Cytology and Genetics. E-mail: 9584792@mail.ru; ORCID: 0000-0001-9270-9188
Поступила в редакцию: 03.10.2025
Поступила после рецензирования: 08.10.2025
Принята к публикации: 09.10.2025
Received: 03.10.2025
Revised: 08.10.2025
Accepted: 09.10.2025
Клинический разбор в общей медицине №11 2025
За горизонтом менопаузы: поиск точки клинического дебюта кардиометаболического риска
Номера страниц в выпуске:96-106
Аннотация
Критическая роль инсулинорезистентности (ИР), тесно связанной с абдоминальным ожирением (АО), в инициации и прогрессировании кардиометаболического риска (КМР) в перименопаузе определяет необходимость изучения ассоциаций окружности талии (ОТ), клинического маркера АО, с параметрами менопаузального метаболического синдрома (МетС).
Цель. Изучить взаимосвязи ОТ с триглицерид-глюкозным индексом (TyG), характеристиками МетС и гормональной хронологии перименопаузы в когорте женщин с различными уровнями артериального давления (АД).
Материалы и методы. Из обследованных 88 женщин (возраст – 35–59 лет) 58 имели гипертензию, 30 женщин были нормотензивными. Проводилось определение значений ОТ, АД, уровней триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП), инсулина, фолликулостимулирующего гормона (ФСГ), эстрадиола (Е2), глюкозы, индекса TyG, длительности постменопаузы (ДлПМ). Оценивали (SPSS, версия 23) медиану [25-й; 75-й перцентили]; межгрупповые различия по критерию Манна–Уитни; сравнение долей по критерию χ2 Пирсона; проводили корреляционные анализы по Спирмену (R) и partial correlation (Rрс) для нивелирования влияния возраста.
Результаты. Выявлены статистически значимые ассоциации ОТ: отрицательные – с уровнями Е2 и ХС ЛПВП, положительные –
с ДлПМ, индексом TyG, уровнями глюкозы, ТГ, инсулина, значениями АД, при отсутствии связей с ФСГ. Одновременно ОТ коррелирует по Спирмену с индексом TyG (R=0,526; p<0,001), который возрастзависимо коррелирует с ФСГ (R=0,212; p<0,05) и возрастнезависимо – с Е2 (R=0,252; p<0,01) и ДлПМ (R=0,338; p<0,001). Уровни ФСГ и Е2 коррелировали с маркерами МетС полностью возрастзависимо. Ассоциации ДлПМ с ФСГ и TyG были стабильнее, сохраняясь при коррекции по возрасту.
Заключение. Корреляции параметров перименопаузы уточняют их влияние на компоненты МетС с дополнительным эффектом ДлПМ как параметра репродуктивного старения к процессу хронологического старения. Комплекс ассоциаций ОТ, отражая значимость антропометрического показателя как предиктора метаболических нарушений, уточняет факторы формирования АО в процессе перименопаузы, привлекая внимание к ранней ее стадии для своевременных профилактических вмешательств.
Ключевые слова: перименопауза, инсулинорезистентность, индекс TyG, абдоминальное ожирение, окружность талии, метаболический синдром, кардиометаболический риск, инкретиновые аналоги.
Для цитирования: Руяткин Д.С., Руяткина Л.А., Щербакова Л.В. За горизонтом менопаузы: поиск точки клинического дебюта кардиометаболического риска. Клинический разбор в общей медицине. 2025; 6 (11): 96–106. DOI: 10.47407/kr2025.6.11.00717
Критическая роль инсулинорезистентности (ИР), тесно связанной с абдоминальным ожирением (АО), в инициации и прогрессировании кардиометаболического риска (КМР) в перименопаузе определяет необходимость изучения ассоциаций окружности талии (ОТ), клинического маркера АО, с параметрами менопаузального метаболического синдрома (МетС).
Цель. Изучить взаимосвязи ОТ с триглицерид-глюкозным индексом (TyG), характеристиками МетС и гормональной хронологии перименопаузы в когорте женщин с различными уровнями артериального давления (АД).
Материалы и методы. Из обследованных 88 женщин (возраст – 35–59 лет) 58 имели гипертензию, 30 женщин были нормотензивными. Проводилось определение значений ОТ, АД, уровней триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП), инсулина, фолликулостимулирующего гормона (ФСГ), эстрадиола (Е2), глюкозы, индекса TyG, длительности постменопаузы (ДлПМ). Оценивали (SPSS, версия 23) медиану [25-й; 75-й перцентили]; межгрупповые различия по критерию Манна–Уитни; сравнение долей по критерию χ2 Пирсона; проводили корреляционные анализы по Спирмену (R) и partial correlation (Rрс) для нивелирования влияния возраста.
Результаты. Выявлены статистически значимые ассоциации ОТ: отрицательные – с уровнями Е2 и ХС ЛПВП, положительные –
с ДлПМ, индексом TyG, уровнями глюкозы, ТГ, инсулина, значениями АД, при отсутствии связей с ФСГ. Одновременно ОТ коррелирует по Спирмену с индексом TyG (R=0,526; p<0,001), который возрастзависимо коррелирует с ФСГ (R=0,212; p<0,05) и возрастнезависимо – с Е2 (R=0,252; p<0,01) и ДлПМ (R=0,338; p<0,001). Уровни ФСГ и Е2 коррелировали с маркерами МетС полностью возрастзависимо. Ассоциации ДлПМ с ФСГ и TyG были стабильнее, сохраняясь при коррекции по возрасту.
Заключение. Корреляции параметров перименопаузы уточняют их влияние на компоненты МетС с дополнительным эффектом ДлПМ как параметра репродуктивного старения к процессу хронологического старения. Комплекс ассоциаций ОТ, отражая значимость антропометрического показателя как предиктора метаболических нарушений, уточняет факторы формирования АО в процессе перименопаузы, привлекая внимание к ранней ее стадии для своевременных профилактических вмешательств.
Ключевые слова: перименопауза, инсулинорезистентность, индекс TyG, абдоминальное ожирение, окружность талии, метаболический синдром, кардиометаболический риск, инкретиновые аналоги.
Для цитирования: Руяткин Д.С., Руяткина Л.А., Щербакова Л.В. За горизонтом менопаузы: поиск точки клинического дебюта кардиометаболического риска. Клинический разбор в общей медицине. 2025; 6 (11): 96–106. DOI: 10.47407/kr2025.6.11.00717
Beyond the menopause horizon: searching for the clinical onset of cardiometabolic risk
Dmitry S. Ruyatkin1, Lyudmila A. Ruyatkina1, Liliya V. Shcherbakova21 Novosibirsk State Medical University, Novosibirsk, Russia;
2 Institute of Internal and Preventive Medicine – a branch of the Institute of Cytology and Genetics, Novosibirsk, Russia
larut@list.ru
Abstract
The critical role of insulin resistance (IR), closely associated with abdominal obesity (AO), in the initiation and progression of cardiometabolic risk (CMR) during perimenopause necessitates studying the associations of waist circumference (WC), a clinical marker of AO, with parameters of menopausal metabolic syndrome (MetS).
Aim. To study the relationships between waist circumference, the TyG index, MetS characteristics, and the hormonal chronology of perimenopause in a cohort of women with different blood pressure (BP) levels.
Materials and methods. Of the 88 women aged 35–59 years, 58 had hypertension and 30 were normotensive. The following parameters were determined: WC, blood pressure, triglycerides (TG), HDL-C, insulin, follicle-stimulating hormone (FSH), estradiol, glucose, TyG index, and postmenopausal duration (PMD). The following parameters were assessed (SPSS, version 23): median [25th; 75th percentiles]; intergroup differences using the Mann-Whitney test; comparison of proportions using the Pearson χ2 test; Spearman correlation (R) and partial correlation (Rрс) analyses were performed to adjust for the influence of age.
Results. Statistically significant associations of WC were identified: negative with estradiol and HDL-C levels, positive with PMD, TyG, glucose, TG, blood pressure, and insulin levels, with no associations with FSH. WC also showed a Spearman correlation with the TyG index (R=0.526; p<0.001), which correlated with age-dependent FSH (R=0.212; p<0.05) and independently with age-dependent estradiol (R=0.252; p<0.01) and PMD (R=0.338; p<0.001). FSH and estradiol levels correlated with MetS markers completely in an age-dependent manner. The associations of PMD with FSH and TyG were more stable, persisting after age adjustment.
Conclusions. Correlations of perimenopausal parameters clarify their influence on MetS components, with the additional effect of PMD as a parameter of reproductive aging in addition to chronological aging. The OT association complex, reflecting the importance of anthropometric indicators as predictors of metabolic disorders, clarifies the factors that shape OT during perimenopause, drawing attention to its early stages for timely preventive interventions.
Keywords: perimenopause, insulin resistance, TyG index, abdominal obesity, waist circumference, metabolic syndrome, cardiometabolic risk, incretin analogs.
For citation: Ruyatkin D.S., Ruyatkina L.A., Shcherbakova L.V. Beyond the menopause horizon: searching for the clinical onset of cardiometabolic risk. Clinical review for general practice. 2025; 6 (11): 96–106 (In Russ.). DOI: 10.47407/kr2025.6.11.00717
Введение
Треть жизни женщины – период постменопаузы. Это процесс [1], сопровождающийся резким ростом метаболического синдрома (МетС) с риском кардиометаболических заболеваний (КМЗ): сахарного диабета 2-го типа (СД 2), сердечно-сосудистых заболеваний (ССЗ) и общей смертности [2, 3]. МетС представляет собой платформу факторов риска КМЗ: артериальной гипертонии (АГ), инсулинорезистентности (ИР), проатерогенной дислипидемии (повышение уровня триглицеридов, ТГ, и снижение уровня холестерина липопротеидов высокой плотности, ХС ЛПВП), абдоминального ожирения (АО) и дисгликемии, связывая их в общую патологию [4]. Наличие уникального дополнительного фактора риска для женщин, менопаузы, определяет менопаузальный фенотип МетС. Хотя ССЗ часто считаются «болезнью мужчин», на самом деле это «катастрофа женщин» [5] со значительным увеличением смертности по этой причине за последние 60 лет. Несмотря на некоторый прогресс в контроле артериального давления (АД) и липидного профиля, общее кардиометаболическое здоровье населения ухудшилось со значительным ростом распространенности МетС при лидирующей роли ожирения [6].
Отдельные компоненты МетС у женщин и мужчин одинаковы, однако важно, как и когда эти компоненты проявляются [7]. У женщин компоненты МетС прогностически более значимы для кардиометаболического риска (КМР) в сравнении с мужчинами [3] с особыми закономерностями. Его формирование имеет свою траекторию, тесно связанную с изменением функционального состояния оси гипофиз–яичники: от пременопаузы к собственно менопаузе (менопаузальный переход, МП) и постменопаузе [8]. Период, включающий МП и раннюю постменопаузу, обозначают термином «перименопауза»; она признана ключевым периодом КМР [9] вследствие значительных метаболических и сердечно-сосудистых изменений в тесной связи с формированием менопаузального МетС на фоне репродуктивного старения. Более высокая распространенность МетС у женщин в постменопаузе (до 70% по сравнению с 14–45% в пременопаузе) может быть обусловлена в большей степени изменениями во время МП, чем собственно постменопаузой, что важно для оценки наступления КМР относительно менопаузы [10].
В патофизиологии МетС центральным звеном остается ИР с менопаузой как потенциальным фактором риска ее развития независимо от возраста [1]. Снижение уровня эстрадиола (Е2) считают основным фактором риска КМЗ у женщин в менопаузе [11]. Однако ИР и связанные с ней метаболические нарушения: дислипидемия, нарастание массы тела (оцененное по индексу массы тела, ИМТ, и окружности талии, ОТ) и дисгликемия – отмечаются уже в пременопаузе [12] с тенденцией к резкому нарастанию с наступлением менопаузы [13].
Менопауза устанавливается ретроспективно, после 12 месяцев аменореи [5]; возрастной диапазон физиологической менопаузы определен как 45–55 лет при среднем возрасте 51,3 года [14]. Пременопауза может наступать за 5–10 лет до менопаузы, при этом КМР существенно повышается в типичном возрасте менопаузы (~51 год) [15]. Изменения функционального состояния оси гипофиз–яичники с гормональными колебаниями, влияющими на чувствительность к инсулину, наблюдаются уже в пременопаузе [11] и могут стартовать за 5–10 лет до наступления менопаузы [16]. Наряду с гормональными изменениями отмечена трансформация тесно связанных с ними метаболических и гемодинамических показателей [8]. При средней длительности 2–8 лет до последнего менструального цикла, МП связан с увеличением клинического и субклинического сердечно-сосудистого риска [17], включая функциональные и структурные показатели субклинического атеросклероза [18].
Из компонентов МетС АГ является ведущим фактором риска ССЗ и сердечно-сосудистой смертности, при этом наиболее модифицируемым [19]. Ее распространенность непропорционально сильно затрагивает женщин в постменопаузе; показатели контроля остаются субоптимальными, составляя около 50% среди женщин среднего возраста [2]. Значимый вклад в этом направлении вносит дисгликемия. Уже предиабет ассоциирован со значительным риском, наличием и прогрессированием ССЗ [20], при этом распространенность СД 2 в постменопаузе наиболее сильно связана с уровнями АД [21], а центральным звеном патогенеза, ускоряющим этот путь, служит ИР [20]. Выделяют пременопаузальный и постменопаузальный МетС, последний по своим характеристикам отличается только относительной гиперандрогенией [22]. Соответственно, крайне важно уточнить оптимальный период для профилактических мер.
Из суррогатных показателей ИР особое внимание привлекает триглицерид-глюкозный индекс (TyG) [23]. Отсутствие его общепринятых референсных значений определяет необходимость поиска простых индикаторов МетС, ассоциированных с TyG и параметрами перименопаузы, для определения «точки» профилактического вмешательства. Патогенетическая идеология МетС в качестве клинических характеристик ИР рассматривает АГ, дислипидемию, дисгликемию и АО [24]. Поскольку для МетС характерно именно АО с более высокой общей и абдоминальной жировой тканью и более низкой безжировой массой тела [25], полагают, что ОТ является лучшим антропометрическим показателем висцерального жира и оптимальным предиктором метаболических нарушений гормональной траектории перименопаузы [26]. Подобные исследования носят пилотный характер, малочисленны и фрагментарны.
Цель – изучить взаимосвязи ОТ с индексом TyG, характеристиками МетС и гормональной хронологии перименопаузы в когорте женщин с различными уровнями АД.
Материалы и методы
В одноцентровое одномоментное исследование в рамках профилактического осмотра включены 88 женщин 35–59 лет: из них 30 нормотензивных, 58 имели АГ. Критерии исключения: нарушения углеводного обмена и другие эндокринные заболевания; ранее диагностированные ишемическая болезнь сердца, хроническая сердечная недостаточность; перенесенные острые сердечно-сосудистые заболевания; нарушения ритма и проводимости; менопаузальная гормональная терапия; курение; сопутствующие заболевания в стадии обострения.


Тридцать условно здоровых женщин без АГ в возрасте 43,00 [40,00; 46,25] года без наследственной отягощенности по ССЗ и дисгликемии составили группу 1. В группу 2 были отнесены 58 женщин в возрасте 50,00 [43,75; 53,00] года с длительностью АГ 3,21 [1,00; 5,00] года, не получающие регулярную антигипертензивную терапию, с наследственной отягощенностью по ССЗ в 75% случаев. Пациентки с АГ, кроме гипотензивной, никакую другую терапию не получали.
Обследованные женщины имели различное функциональное состояние яичников: 43% были в постменопаузе, длительность постменопаузы (ДлПМ) составила 1,64 [0,00; 2,00] года; при этом в группе 1 менопауза зафиксирована у 6 (20,0%) женщин, в группе 2 – у 32 (55,2%). Часть женщин находились в перименопаузе, включая позднюю пременопаузу и раннюю постменопаузу, что характеризуется повышением уровней фолликулостимулирующего гормона (ФСГ) >25 МЕ/л [27].
Определяли маркеры МетС: ОТ, ИМТ, уровни АД – систолического (САД) и диастолического (ДАД); показатели гликемии натощак (ГН) глюкозооксидазным методом; ХС ЛПВП и ТГ ферментативным калориметрическим методом; инсулина, ФСГ и Е2 иммуноферментным методом на анализаторе IMMULITE 2000XPi. Индекс TyG рассчитывали по формуле: индекс TyG = Ln [ТГ (мг/дл) × ГН (мг/дл) / 2], где Ln – логарифм [28].
Статистическая обработка данных выполнена с помощью программ SPSS (версия 23). Определяли базовые статистики: медиану (Ме), интерквартильный диапазон [25-й; 75-й перцентили]. Оценка значимости межгрупповых различий величин проводилась с помощью U-критерия Манна–Уитни. Для сравнения долей использовался критерий χ2 Пирсона. Для выявления зависимостей и прогностических факторов использовали корреляционный анализ (ранговая корреляция Спирмена, partial correlation). В процедурах статистического анализа критический уровень значимости для отклонения нулевой статистической гипотезы (р) принимался ≤0,05. Статистический анализ частично проведен в рамках бюджетной темы FWNR-2024-0002. Исследование выполнено с соблюдением этических принципов проведения научных медицинских исследований с участием человека, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации.
Результаты
Сравнительный анализ двух групп женщин (табл. 1) отражает статистически значимые различия большинства параметров. Женщины группы 2 были старше, кроме маркирующих группу уровней АД имели более высокие показатели ОТ, ИМТ, ТГ и ГН и более низкие ХС ЛПВП. В группе 1 параметры ОТ, ИМТ и липидные показатели полностью не укладывались в референсные пределы. Уровни ГН в обеих группах находились в референсном диапазоне, хотя в группе 2 они были выше (p=0,011), чем у женщин без АГ. Уровни инсулина и TyG также при наличии АГ превышали значения соответствующих показателей у нормотензивных женщин (см. табл. 1).
Группы статистически не различались по параметрам функционального состояния оси гипофиз–яичники, что объяснимо большой вариабельностью уровней ФСГ и Е2 в зависимости от периода МП [29]. С учетом более старшего возраста женщин группы 2 и разных стадий перименопаузального континуума, при сравнении групп по уровню ФСГ выше или ниже 25 МЕ/л (30 и 52% в группах 1 и 2 соответственно) было выявлено их статистическое различие (критерий Пирсона χ2=3,781; p=0,052). Ассоциации возраста со всеми параметрами МетС и перименопаузы (табл. 2), особенно тесные с ФСГ и ДлПМ, послужили дополнительным основанием для проведения partial correlation c целью нивелирования влияния возраста.
Ассоциации ДлПМ, находящейся под интенсивным влиянием возраста (R=0,707; p<0,001), с параметрами МетС были менее сильными (табл. 3) в сравнении с возрастом (см. табл. 2), отражая дополнительное влияние ДлПМ как параметра репродуктивного старения к процессу хронологического старения. Уровни ФСГ и Е2 коррелировали с маркерами МетС полностью возрастзависимо (см. табл. 3). Ассоциации ДлПМ с ФСГ и с TyG были стабильнее, сохраняясь при коррекции по возрасту (рис. 1). Корреляция ДлПМ с уровнями гормонов вела себя по-разному: с ФСГ (R=0,622; p<0,001; Rрс=0,273; р=0,014) была слабее, чем с возрастом (R=0,700; p<0,001), и наоборот, уровни Е2 сильнее коррелировали с ДлПМ (R=-0,508; p<0,001), чем с возрастом (R=-0,336; p=0,001). После нивелирования влияния возраста из параметров МП с характеристиками МетС сохраняла связь только ДлПМ с TyG (см. рис. 1).
 В центре корреляционного комплекса наибольшее число статистически значимых и более тесных связей по Спирмену и partial correlation сформировали индекс TyG и ОТ с остальными параметрами МетС и перименопаузы (см. рис. 1). Ассоциации САД и ДАД с ОТ практически равнозначны по силе таковым с TyG, в последнем варианте сильнее у САД. Все ассоциации параметров МП, гормональных и ДлПМ, полностью возрастзависимы, исключение отмечено только у корреляции TyG с ДлПМ. Маркер висцерального ожирения, ОТ, полностью возрастзависимо коррелирует с Е2 и ДлПМ, сохраняя ассоциации при коррекции по возрасту с большинством остальных параметров МетС, кроме ХС ЛПВП; не выявлено прямых связей ОТ с ФСГ, однако наличие стабильной ассоциации ОТ с TyG, который коррелирует с гормональными (Е2 и ФСГ) и временными (ДлПМ) параметрами перименопаузы, позволяет предполагать опосредованный характер связи ОТ и ФСГ (см. рис. 1).
В центре корреляционного комплекса наибольшее число статистически значимых и более тесных связей по Спирмену и partial correlation сформировали индекс TyG и ОТ с остальными параметрами МетС и перименопаузы (см. рис. 1). Ассоциации САД и ДАД с ОТ практически равнозначны по силе таковым с TyG, в последнем варианте сильнее у САД. Все ассоциации параметров МП, гормональных и ДлПМ, полностью возрастзависимы, исключение отмечено только у корреляции TyG с ДлПМ. Маркер висцерального ожирения, ОТ, полностью возрастзависимо коррелирует с Е2 и ДлПМ, сохраняя ассоциации при коррекции по возрасту с большинством остальных параметров МетС, кроме ХС ЛПВП; не выявлено прямых связей ОТ с ФСГ, однако наличие стабильной ассоциации ОТ с TyG, который коррелирует с гормональными (Е2 и ФСГ) и временными (ДлПМ) параметрами перименопаузы, позволяет предполагать опосредованный характер связи ОТ и ФСГ (см. рис. 1).Обсуждение
Возрастной диапазон перименопаузальной когорты женщин был выбран с учетом следующих характеристик: хронологии репродуктивного старения женщин [30], возможности появления метаболических изменений уже в пременопаузе [8] и возрастного физиологического диапазона менопаузы [31]. Статистически значимое влияние возраста на исследуемые показатели (см. табл. 2) отражает хронологическое старение в перименопаузе. Значительные изменения баланса половых гормонов у женщин на протяжении жизни играют важную роль в гендерных различиях метаболических нарушений; защитную роль традиционно отводят эстрогенам [32]. Траектории уровней E2 и ФСГ в течение МП неоднородны под влиянием ИМТ и этнической принадлежности [33], что объясняет отсутствие статистических различий между группами по уровням Е2 и ФСГ (см. табл. 1), а также резкое ослабление их взаимной корреляции (см. рис. 1) в исследуемой когорте женщин при нивелировании влияния возраста (Rpc=-0,287; p=0,009), в отличие от анализа по Спирмену (R=-0,578; p<0,001).
 Одновременное разнонаправленное изменение уровней Е2 и гонадотропина на разных стадиях МП тесно связано со старением сосудов (рис. 2), оцененным по снижению функции эндотелия с помощью поток-опосредованной дилатации (flow-mediated dilation, FMD) плечевой артерии и эластичности сонной артерии, выявленному уже в пременопаузе [34]. Воздействие эндогенных эстрогенов в репродуктивном возрасте обеспечивает женщинам защиту от ССЗ; с потерей эстрогенов постменопауза связана с увеличением ИР, АО, дислипидемией и эндотелиальной дисфункцией [8].
Одновременное разнонаправленное изменение уровней Е2 и гонадотропина на разных стадиях МП тесно связано со старением сосудов (рис. 2), оцененным по снижению функции эндотелия с помощью поток-опосредованной дилатации (flow-mediated dilation, FMD) плечевой артерии и эластичности сонной артерии, выявленному уже в пременопаузе [34]. Воздействие эндогенных эстрогенов в репродуктивном возрасте обеспечивает женщинам защиту от ССЗ; с потерей эстрогенов постменопауза связана с увеличением ИР, АО, дислипидемией и эндотелиальной дисфункцией [8].Ассоциации ИР, оцененной по индексу TyG, со всеми параметрами перименопаузы и МетС (см. рис. 1), характеризуют ее как центральное патогенетическое звено формирования менопаузального фенотипа кластера. МП связан с повышением ИР в совокупности с маркерами МетС: АО, дисгликемией, дислипидемией и АГ [8]. Накапливаются доказательства экстрагонадных функций ФСГ после обнаружения экспрессии его рецепторов в кровеносных сосудах, жировой ткани, печени, остеокластах, нейронах гиппокампа и коры [35]. Дополнительные биологические функции гормонов гипофиза, в том числе и ФСГ, при их действии на неклассические органы определены новой концепцией «атипичной оси гормон гипофиза – ткань-мишень»; смысл концепции – наличие у гормонов гипофиза дополнительных биологических функций [36]. В нашем исследовании уровни ФСГ, наряду с Е2 и ДлПМ, через статистически значимые связи, разные по характеру, но однонаправленные по смыслу, оказывают возрастзависимое влияние (см. табл. 3, рис. 1) на формирование дислипидемии (прямая связь Е2 с ХС ЛПВП и обратная с ТГ; прямая связь ФСГ с ТГ и обратная с ХС ЛПВП) и гликемии (прямая связь ДлПМ с ГН), важные компоненты КМР. Указанный комплекс ассоциаций предполагает совместное влияние репродуктивного и хронологического старения на старение сосудов, что согласуется с мнением K.L. Moreau (см. рис. 2) [34]. Подчеркивается роль ожирения в сердечно-сосудистом старении [17].
Дефицит эстрогенов сам по себе не может полностью объяснить постменопаузальную дислипидемию [37]. Влияние ФСГ на липидный спектр начинается задолго до менопаузы, уже в пременопаузе, когда уровни Е2 относительно стабильны [38]. Новый ФСГ-обусловленный механизм постменопаузальной дислипидемии объясняют эффектом гонадотропина на липидный метаболизм в печени [36].

Влияние ФСГ, который первым фиксирует снижение репродуктивного потенциала женщины, на целый комплекс параметров МетС (см. рис. 1), основу КМР, ориентирует внимание на МП для поиска точки профилактического отсчета. Современные руководящие принципы по первичной профилактике ССЗ подчеркивают значимость специфических для женщин факторов риска на протяжении всего жизненного цикла женщины: гормональной контрацепции, гипертензивных расстройств беременности и менопаузы, – создающих дополнительный уровень риска [39]. Эти уникальные факторы КМР связаны с динамикой репродуктивного потенциала: от особенностей пубертата к осложнениям течения беременности (дисгликемии и преэклампсии) и далее к менопаузе и постменопаузе с уже сформировавшимися ССЗ; при этом авторы, определяя ИР и перераспределение жировой ткани в качестве специфических факторов КМР, ответственным за подобную динамику традиционно указывают уровень Е2 (рис. 3) [40].
Нами выявлены стабильные ассоциации ДлПМ с ФСГ по Спирмену и partial correlation (см. рис. 1) при полностью возрастзависимой связи Е2 с ДлПМ, что согласуется с формированием выраженного эстрогендефицита в поздней постменопаузе. Несмотря на чрезвычайную вариабельность уровней ФСГ, их количественные ориентиры, в отличие от Е2, внесены в систему стадирования репродуктивного старения у женщин STRAW+10: начиная с позднего фертильного периода (>25 МЕ/л), с тенденцией к повышению в ранней фазе МП и сохранением высоких показателей в поздней перименопаузе [27]. Эти данные не согласуются с классической точкой зрения, объясняющей механизмы метаболических и гемодинамических изменений во время МП дефицитом эстрогена, характерным для поздней постменопаузы [41]. Подобное противоречие имеет принципиальное значение для клинической практики, поскольку ориентация на связь дебюта КМЗ с поздней постменопаузой нередко сдвигает акценты с профилактического подхода на ургентную помощь. Риск развития МетС увеличивается с годами после менопаузы, но полное влияние ДлПМ остается неясным [31]. Именно ДлПМ оказалась наиболее важным фактором риска МетС по результатам турецкого поперечного исследования, при этом риск повышался при ее длительности более 5 лет [12]; в цитируемой работе не анализировались показатели функционального состояния оси гипофиз–яичники.
Также обращает на себя внимание частично возрастзависимая связь уровней ФСГ с индексом TyG (см. рис. 1), который стабильно коррелирует с ДлПМ и уровнями инсулина (R=0,550; р<0,001), сохраняя эту связь при коррекции по возрасту (Rрс=0,409; р<0,001). Изменения функционального состояния оси гипофиз–яичники с гормональными колебаниями, влияющими на чувствительность к инсулину (обратную сторону ИР), наблюдаются уже в пременопаузе [11]. Обосновано мнение о гиперинсулинемии/ИР как предшественниках СД 2 и критических базовых компонентах МетС и КМР [42].
Графическая интерпретация корреляционного анализа (см. рис. 1) обнаруживает два своеобразных «центра притяжения», ОТ и TyG, во взаимодействии с изучаемыми параметрами. Индекс TyG практически равнозначно коррелирует с ОТ (см. рис. 1) и уровнями инсулина (R=0,508; p<0,001; Rрс=0,409; p<0,001), который имеет схожую зависимость с уровнями ГН (см. рис. 1). Эти два маркера ИР: TyG, суррогатный биохимический показатель, и ОТ, клинический параметр, привлекают к себе пристальное внимание в прогнозе формирования менопаузального МетС на протяжении МП. Отметим, что ассоциации ОТ с уровнями АД несколько сильнее аналогичных с индексом TyG, отражая самостоятельную роль АО в патогенезе АГ [43], особенно в перименопаузе [44]. Использование для антропометрической оценки в период МП только ИМТ нередко скрывает АО, поскольку противоположные изменения состава тела в этот период с уменьшением безжировой массы и увеличением жировой нередко приводят к незначительным изменениям массы тела в ответ на саму менопаузу [45], при этом ОТ значительно увеличивается в различных этнических группах [46]. Подчеркивают, что АО, определяемое по ОТ, является маркером риска ССЗ, не зависящим от ИМТ [47]. С наступлением менопаузы ИР и связанные с ней метаболические нарушения: дислипидемия, нарастание массы тела и дисгликемия – имеют тенденцию к резкому нарастанию [46]. В анализируемой когорте перименопаузальных женщин ОТ, при стабильных корреляциях с индексом TyG и уровнями ТГ, образует возрастзависимые ассоциации с ХС ЛПВП и ДлПМ (см. рис. 1). Все три параметра перименопаузы, ДлПМ, Е2 и ФСГ, оказывают возрастзависимое влияние на липидные параметры (см. табл. 3), являющиеся маркерами МетС (см. рис. 1).
Фенотип ожирения принципиально важен для КМР; простым маркером абдоминального жироотложения служит ОТ [25]. В качестве первого варианта МетС описан фенотип гипертриглицеридемической талии (ГТГОТ), расцененный как интегративное зеркало признаков синдрома [48]. Этот фенотип ассоциирован с женским полом, поскольку менопауза способствует перераспределению висцерального жира [49], тесно связанного с АГ, объединяя их через ИР в рамках МетС [50]. Выявленные нами ассоциации ОТ с индексом TyG, уровнями АД и ТГ (см. рис. 1), согласуясь с фенотипом ГТГОТ [48], могут отражать его участие в формировании фенотипа АГ в перименопаузе с учетом влияния параметров МП на маркеры МетС (см. табл. 3). Ожирение вызывает нейрогормональную активацию и активацию ренин-ангиотензин-альдостероновой и симпатической нервной систем, что наряду с гиперлептинемией и другими гомеостатическими отклонениями способствует задержке натрия и развитию АГ [43]. Увеличение массы тела во время МП хорошо документировано, однако его основные причины и механизмы детально не изучены [51]. К инициации ожирения в перименопаузе причастны гормональные изменения: гипоэстрогенемия, гипергонадотропинемия, относительная гиперандрогенемия, дефицит гормона роста, резистентность к лептину, хронический стресс через гипоталамо-гипофизарно-надпочечниковую ось [25].
На риск последующих КМЗ влияет целый ряд факторов репродуктивного периода: возраст менархе, гестационные проблемы (диабет, гипертония); предшествующие гестации модифицируемые факторы риска образа жизни с формированием ожирения; после беременности персистирующая ИР, хроническое субклиническое воспаление, дислипидемия, эндотелиальная дисфункция [1, 8, 40]. Комплекс этих событий еще в репродуктивном периоде создает условия для сосудистого повреждения с дальнейшим прогрессированием в рамках МП (см. рис. 3) [40] до КМЗ, пик которых наступает в постменопаузе [51]. Соответствуя концепции «атипичной оси гормон гипофиза – ткань-мишень» [36], присутствие рецепторов ФСГ в висцеральной жировой ткани отражает участие ФСГ в постменопаузальном АО и может способствовать провоспалительной среде [52].
Выявленные ассоциации ОТ, отрицательные с уровнями Е2 и положительные с ДлПМ (см. табл. 3) при отсутствии корреляций с ФСГ, отражают этапность формирования АО в процессе перименопаузы, привлекая внимание к ранним его этапам с учетом четких связей с увеличением риска развития сердечно-сосудистого-почечно-метаболического синдрома [51]. ОТ является лучшим антропометрическим показателем висцеральной жировой ткани и предиктором метаболических нарушений: СД 2 и дислипидемии [53], и может служить первым тревожным сигналом, побуждающим к регулярному биохимическому скринингу липидных и гликемических параметров [54].

Американская кардиологическая ассоциация в 2020 г. впервые выделяет МП как специфичное для пола событие, серьезно влияющее на будущее кардиометаболическое здоровье [30]. Перименопауза, будучи критической для здоровья и качества жизни женщин переходной фазой [55], одновременно предоставляет возможности для вмешательства в образ жизни, чтобы противодействовать влиянию гормональных изменений и старения на кардиометаболический профиль [56]. Консенсусное заявление Европейского общества кардиологов (2025) обращает особое внимание клиницистов на подходы к профилактике избыточного набора массы тела и поддержанию здоровой массы тела с раннего детства и на протяжении всей взрослой жизни [57].
В современной стратегии снижения массы тела начальными методами лечения остаются изменение образа жизни и фармакологические вмешательства с особым акцентом на контроль КМР [57].
Хроническое течение ожирения, его локализация и степень, необходимость максимального снижения жировой массы тела при сохранении безжировой подчеркивают важность раннего начала и длительности лечения на протяжении жизни для уменьшения КМР [58]. Независимым предиктором висцерального ожирения оказался малоподвижный образ жизни [59], определяющий основные принципы питания и физической активности (рис. 4) [58]. Для оптимизации состава тела важен комплексный подход: богатая белком диета, тренировки с отягощениями и фармакотерапия нового поколения с помощью инкретиновых препаратов [60]; сохранение мышечной массы может смягчить повторный набор жировой ткани после прекращения фармакотерапии [58].
В актуальной фармакотерапии ожирения по эффективности и влиянию на факторы КМР лидируют инкретиновые препараты: семаглутид, агонист рецепторов глюкагоноподобного пептида-1 (ГПП-1), и тирзепатид, двойной агонист рецепторов ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП). Препараты агонистов рецепторов ГПП-1 являются не просто регуляторами метаболизма, способствующими значительному снижению массы тела, они приводят к уменьшению уровней С-реактивного белка, высокочувствительного маркера общего воспаления [61]. Агонисты рецепторов ГПП-1 и двойные полипептиды ГИП/ГПП-1 оказывают положительное влияние на большинство компонентов «кардиометаболического континуума», подтвержденное результатами исследований сердечно-сосудистых исходов (cardiovascular outcome trial, CVOT) (рис. 5), помогая снизить потребность в полипрагмазии [62]. Эти препараты продемонстрировали улучшение массы и состава тела, а также параметров, связанных с метаболизмом глюкозы, гипертонией, дислипидемией (снижение уровня ТГ и повышение уровня ХС ЛПВП) и стеатозом печени, связанным с метаболической дисфункцией. Кроме того, семаглутид 2,4 мг в подкожной форме продемонстрировал снижение сердечно-сосудистой смертности, нефатального инфаркта миокарда или инсульта, а также симптомов сердечной недостаточности, в то время как тирзепатид продемонстрировал снижение сердечно-сосудистой смертности и уменьшение симптомов сердечной недостаточности у пациентов с ожирением и сердечной недостаточностью [63].
Агонисты рецепторов ГПП-1 уже известны своей эффективностью в лечении СД 2, ожирения и кардиопротекции у пациентов с СД 2, в то время как двойные агонисты рецепторов ГИП/ГПП-1, по-видимому, обладают потенциалом превзойти их при тех же показаниях. Тирзепатид рассматривают как новую кардиометаболическую терапевтическую перспективу, поскольку этот многофункциональный монофармакологический препарат способен значительно снижать уровень глюкозы, улучшать чувствительность к инсулину, снижать массу тела и корректировать дислипидемию, благоприятно влияя на липидный профиль (рис. 6) [64].

Учитывая высокую распространенность ожирения и СД 2 среди населения Российской Федерации и крайне негативное их влияние на продолжительность и качество жизни, вопрос доступа к терапии тирзепатидом является критическим для российских пациентов, при этом единственный препарат, содержащий тирзепатид (Мунджаро®), официально в России и странах Евразийского экономического союза (ЕАЭС) не зарегистрирован и в страны ЕАЭС не поставляется. Это подтолкнуло отечественные фармацевтические компании к разработке собственных дженериков препарата тирзепатид для обеспечения доступа пациентов к наиболее современной терапии. Компанией ГЕРОФАРМ тирзепатид под торговым наименованием Седжаро® был зарегистрирован в 2025 г. Комплекс проведенных исследований с использованием ортогональных методов показал, что препараты Седжаро и Мунджаро структурно идентичны, сопоставимы по профилю примесей и биологически эквивалентны [65]. Функциональная и метаболическая эквивалентность препаратов Седжаро и Мунджаро достоверно подтверждена при исследовании в двухклеточных тестах, отражающих фармакологически релевантные механизмы действия препарата – активацию рецепторов ГПП-1 (рис. 7) и ГИП (рис. 8) [65].
Заключение
Новые данные о влиянии ФСГ на ключевые звенья патогенеза МетС, подчеркивая роль МП в качестве ключевого периода КМР [66], расширяют его патогенез за пределы снижения уровней гормонов яичников к изменению функционального состояния оси гипофиз–яичники. При этом хроническое воспаление, тесно связанное с дисфункцией эндотелия, определяют как важный маркер старения [34], основы которого закладываются в молодые годы. Женщины более склонны к ожирению, а с возрастом наблюдаются половые различия в фенотипах и исходах КМЗ [67]. Метаболические и клинические факторы, вторичные по отношению к менопаузе, такие как дислипидемия, ИР, перераспределение жира и системная гипертензия, способствуют ускоренному риску сердечно-сосудистого старения и развития заболеваний. Конечным результатом сложного взаимодействия между факторами риска сердечно-сосудистых заболеваний и их усилением в период перименопаузы является, по-видимому, ускоренный атерогенез [17].
Критическими предикторами КМЗ являются ИР и гиперинсулинемия [68] в тесной связи с формированием АО. Клиническим маркером последнего и жизненно важным показателем для улучшения распознавания риска для здоровья служит ОТ [63], увеличение которой рассматривают как биомаркер старения [69]. Хроническое течение ожирения со склонностью к рецидивам определяет важность раннего лечения для улучшения состава тела и снижения КМР [58], при этом свою эффективность доказали инкретиновые препараты, особенно семаглутид и тирзепатид. Появление этих новых препаратов представляет собой смену парадигмы в фармакологическом лечении ожирения, поскольку они обеспечивают более выраженное снижение массы тела и улучшение в отношении сопутствующих КМЗ [63].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. Д.С. Руяткин – обсуждение идеи, набор материала, участие в статистическом анализе, поиск и анализ данных литературы, участие в написании статьи; Л.А. Руяткина – обсуждение идеи, участие в наборе материала и статистическом анализе, анализ данных литературы, написание статьи; Л.В. Щербакова – идея варианта статистического анализа и участие в нем.
Contribution of the authors. D.S. Ruyatkin – discussion of the idea, collection of material, participation in statistical analysis, search and analysis of literature data, participation in writing the article; L.A. Ruyatkina – discussion of the idea, participation in the collection of material and statistical analysis, analysis of literature data, writing an article; L.V. Shcherbakova – the idea of a variant of statistical analysis and participation in it.
Информация об авторах
Information about the authors
Руяткин Дмитрий Сергеевич – канд. мед. наук, доц., ФГБОУ ВО НГМУ. E-mail: dr79@mail.ru; ORCID: 0000-0003-3431-5943
Dmitry S. Ruyatkin – Cand. Sci. (Med.), Assoc. Prof., Novosibirsk State Medical University. E-mail: dr79@mail.ru; ORCID: 0000-0003-3431-5943
Руяткина Людмила Александровна – д-р мед. наук, проф., ФГБОУ ВО НГМУ. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Lyudmila A. Ruyatkina – Dr. Sci. (Med.), Full Prof., Prof., Novosibirsk State Medical University. E-mail: larut@list.ru; ORCID: 0000-0002-6762-5238
Щербакова Лилия Валерьевна – cт. науч. сотр. НИИ терапии и профилактической медицины – филиала ФГБНУ ФИЦ «ИЦИГ СО РАН». E-mail: 9584792@mail.ru; ORCID: 0000-0001-9270-9188
Liliya V. Shcherbakova – Senior Res. Officer, Research Institute of Therapy and Preventive Medicine – a branch of the Federal Research Center Institute of Cytology and Genetics. E-mail: 9584792@mail.ru; ORCID: 0000-0001-9270-9188
Поступила в редакцию: 03.10.2025
Поступила после рецензирования: 08.10.2025
Принята к публикации: 09.10.2025
Received: 03.10.2025
Revised: 08.10.2025
Accepted: 09.10.2025
Список исп. литературыСкрыть список1. Clayton GL, Soares AG, Kilpi F et al. Cardiovascular health in the menopause transition: a longitudinal study of up to 3892 women with up to four repeated measures of risk factors. BMC Med 2022;20(1):299. DOI: 10.1186/s12916-022-02454-6
2. Uddenberg ER, Safwan N, Saadedine M et al. Menopause transition and cardiovascular disease risk. Maturitas 2024;185:107974. DOI: 10.1016/j.maturitas.2024.107974
3. Meloni A, Cadeddu C, Cugusi L et al. Gender Differences and Cardiometabolic Risk: The Importance of the Risk Factors. Int J Mol Sci 2023;24(2):1588. DOI: 10.3390/ijms24021588
4. Wang Y, Che Z, Huo Z et al. Metabolic Syndrome Evolution and Cardio-Kidney-Metabolic Multimorbidity: Implications for Targeted Prevention. JACC Adv 2025(6 Pt 2):101778. DOI: 10.1016/j.jacadv.2025. 101778
5. Orhan Ý, Koçak HS, Kaplan E. Determination of cardiometabolic risk in pre- and post-menopausal women. BMC Cardiovasc Disord 2025;25(1):399. DOI: 10.1186/s12872-025-04850-1
6. Liu J, Hao L, Lavie CJ. A Narrative Review of Cardiometabolic Profiles among U.S. Adults: Temporal Trends and Implications. Curr Cardiol Rep 2025;27(1):36. DOI: 10.1007/s11886-024-02179-3
7. Roa-Díaz ZM, Raguindin PF, Bano A et al. Menopause and cardiometabolic diseases: What we (don't) know and why it matters. Maturitas 2021, 152:48-56. DOI: 10.1016/j.maturitas.2021.06.01
8. Nappi RE, Chedraui P, Lambrinoudaki I, Simoncini T. Menopause: a cardiometabolic transition. Lancet Diabetes Endocrinol 2022;10(6):442-56. DOI: 10.1016/S2213-8587(22)00076-6
9. Peters BA, Lin J, Qi Q et al. Menopause Is Associated with an Altered Gut Microbiome and Estrobolome, with Implications for Adverse Cardiometabolic Risk in the Hispanic Community Health Study/Study of Latinos. mSystems 2022;7(3):e0027322. DOI: 10.1128/msystems.00273-22
10. Gurka MJ, Vishnu A, Santen RJ, DeBoer MD. Progression of Metabolic Syndrome Severity During the Menopausal Transition. J Am Heart Assoc 2016;5(8):e003609. DOI: 10.1161/JAHA.116.003609
11. Ciarambino T, Crispino P, Guarisco G, Giordano M. Gender Differences in Insulin Resistance: New Knowledge and Perspectives. Curr Issues Mol Biol 2023;45(10):7845-61. DOI: 10.3390/cimb45100496
12. Erdoðan K, Sanlier N. Metabolic Syndrome and Menopause: The Impact of Menopause Duration on Risk Factors and Components. Int J Womens Health 2024;16:1249-56. DOI: 10.2147/IJWH.S460645
13. De Paoli M, Zakharia A, Werstuck GH. The Role of Estrogen in Insulin Resistance: A Review of Clinical and Preclinical Data. The American Journal of Pathology. Am J Pathol 2021;191(9):1490-8. DOI: 10.1016/j.ajpath.2021.05.011
14. Stefanska A, Bergmann K, Sypniewska G. Metabolic Syndrome and Menopause: Pathophysiology, Clinical and Diagnostic Significance. Adv Clin Chem 2015;72:1-75. DOI: 10.1016/bs.acc.2015.07.001
15. Lee EJ, Keller-Ross ML. Menopause and its effects on autonomic regulation of blood pressure: Insights and perspectives. Auton Neurosci 2025;260:103295. DOI: 10.1016/j.autneu.2025.103295
16. Maas AHEM, Rosano G, Cifkova R et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J 2021;42(10):967-84. DOI: 10.1093/eurheartj/ehaa1044
17. Nair AR, Pillai AJ, Nair N. Cardiovascular Changes in Menopause. Curr Cardiol Rev 2021;17(4):e230421187681. DOI: 10.2174/1573403X 16666201106141811
18. Lambrinoudaki I, Armeni E. Understanding of and clinical approach to cardiometabolic transition at the menopause. Climacteric 2024;27(1):68-74. DOI: 10.1080/13697137.2023.2202809
19. Stanciu S, Rusu E, Miricescu D et al. Links between Metabolic Syndrome and Hypertension: The Relationship with the Current Antidiabetic Drugs. Metabolites 2023;13(1):87. DOI: 10.3390/metabo 13010087
20. Rao X, Xin Z, Yu Q et al. Triglyceride-glucose-body mass index and the incidence of cardiovascular diseases: a meta-analysis of cohort studies. Cardiovasc Diabetol 2025;24(1):34. DOI: 10.1186/s12933-025-02584-0
21. Li Q, Wang X, Ni Y et al. Epidemiological characteristics and risk factors of T2DM in Chinese premenopausal and postmenopausal women. Lipids Health Dis 2019;18(1):155. DOI: 10.1186/s12944-019-1091-7
22. Mumusoglu S, Yildiz BO. Metabolic Syndrome During Menopause. Curr Vasc Pharmacol 2019;17(6):595-603. DOI: 10.2174/157016111 6666180904094149
23. Liao J, Wang L, Duan L et al. Association between estimated glucose disposal rate and cardiovascular diseases in patients with diabetes or prediabetes: a cross-sectional study. Cardiovasc Diabetol 2025;24(1):13. DOI: 10.1186/s12933-024-02570-y
24. Tahapary DL, Pratisthita LB, Fitri NA et al. Challenges in the diagnosis of insulin resistance: Focusing on the role of HOMA-IR and Tryglyceride/glucose index. Diabetes Metab Syndr 2022;16(8):102581. DOI: 10.1016/j.dsx.2022.102581
25. Porada D, Gołacki J, Matyjaszek-Matuszek B. Obesity in perimenopause - current treatment options based on pathogenetic factors. Endokrynol Pol 2023;74(6). DOI: 10.5603/ep.96679
26. Harraqui K, Oudghiri DE, Hannoun Z et al. Frequency of Metabolic Syndrome and Study of Anthropometric, Clinical and Biological Characteristics in Peri- and Postmenopausal Women in the City of Ksar El Kebir (Northern Morocco). Int J Environ Res Public Health 2022;19(10):6109. DOI: 10.3390/ijerph19106109
27. Harlow SD, Gass M, Hall JE et al. Executive summary of the Stages of Reproductive Aging Workshop +10: addressing the unfinished agenda of staging reproductive aging. Climacteric 2012;15(2):105-14. DOI: 10.3109/13697137.2011.650656
28. Руяткина Л.А., Руяткин Д.С., Исхакова И.С. Возможности и варианты суррогатной оценки инсулинорезистентности. Ожирение и метаболизм. 2019;16(1):27-33. DOI: 10.14341/omet10082
Ruyatkina L.A., Ruyatkin D.S., Iskhakova I.S. Opportunities and options for surrogate assessment of insulin resistance. Obesity and Metabolism 2019;16(1):27-33. DOI: 10.14341/omet10082 (in Russian).
29. Ruyatkina LA, Ruyatkin DS, Shcherbakova LV. Hormonal-metabolic trajectory of menopausal transition in a normoglycemic cohort of women with different blood pressure levels. Med Res Arch 2024;12(1). DOI: 10.18103/mra.v12i1.4972
30. El Khoudary SR, Aggarwal B, Beckie TM et al. American Heart Association Prevention Science Committee of the Council on Epidemiology and Prevention; and Council on Cardiovascular and Stroke Nursing. Menopause Transition and Cardiovascular Disease Risk: Implications for Timing of Early Prevention: A Scientific Statement From the American Heart Association. Circulation 2020;142(25):e506-e532. DOI: 10.1161/CIR.0000000000000912
31. Jeong HG, Park H. Metabolic Disorders in Menopause. Metabolites 2022;12(10):954. DOI: 10.3390/metabo12100954
32. Santilli F, D’Ardes D, Guagnano MT, Davi G. Metabolic Syndrome: Sex-Related Cardiovascular Risk and Therapeutic Approach. Curr Med Chem 2017;24(24):2602-27. DOI: 10.2174/0929867324666170710121145
33. Tepper PG, Randolph JF Jr, McConnell DS et al. Trajectory clustering of estradiol and follicle-stimulating hormone during the menopausal transition among women in the Study of Women's Health across the Nation (SWAN). J Clin Endocrinol Metab 2012;97(8):2872-80. DOI: 10.1210/jc.2012-1422
34. Moreau KL. Intersection between gonadal function and vascular aging in women. J Appl Physiol (1985) 2018;125(6):1881-7. DOI: 10.1152/japplphysiol.00117.2018
35. Cheng Y, Zhu H, Ren J et al. Follicle-stimulating hormone orchestrates glucose-stimulated insulin secretion of pancreatic islets. Nat Commun 2023;14(1):6991. DOI: 10.1038/s41467-023-42801-6
36. Xu C, He Z, Song Y et al. Atypical pituitary hormone-target tissue axis. Front Med 2023;17(1):1-17. DOI: 10.1007/s11684-022-0973-7
37. Song Y, Wang ES, Xing LL et al. Follicle-Stimulating Hormone Induces Postmenopausal Dyslipidemia Through Inhibiting Hepatic Cholesterol Metabolism. J Clin Endocrinol Metab 2016;101(1):254-63. DOI: 10.1210/jc.2015-2724
38. Guo Y, Zhao M, Bo T et al. Blocking FSH inhibits hepatic cholesterol biosynthesis and reduces serum cholesterol. Cell Res 2019;29(2):151-66. DOI: 10.1038/s41422-018-0123-6
39. Shahid I, Avenatti E, Titus A et al. Primary Prevention of Cardiovascular Disease in Women. Methodist Debakey Cardiovasc J 2024;20(2):94-106. DOI: 10.14797/mdcvj.1313
40. Hetherington K, Thomas J, Nicholls SJ et al. Unique cardiometabolic factors in women that contribute to modified cardiovascular disease risk. Eur J Pharmacol 2024;984:177031. DOI: 10.1016/j.ejphar. 2024.177031
41. Wu B, Fan B, Qu Y et al. Trajectories of Blood Lipids Profile in Midlife Women: Does Menopause Matter? J Am Heart Assoc 2023;12(22):e030388. DOI: 10.1161/JAHA.123.030388
42. Garcia-Carretero R, Vazquez-Gomez O, Gil-Prieto R, Gil-de-Miguel A. Insulin resistance is a cardiovascular risk factor in hypertensive adults without type 2 diabetes mellitus. Wien Klin Wochenschr 2024;136(3-4):101-9. DOI: 10.1007/s00508-023-02278-1
43. Welsh A, Hammad M, Piña IL, Kulinski J. Obesity and cardiovascular health. Eur J Prev Cardiol 2024;31(8):1026-35. DOI: 10.1093/eurjpc/ zwae025
44. Lazaridis A, Malliora A, Gkaliagkousi E. The Particularities of Arterial Hypertension in Female Sex: From Pathophysiology to Therapeutic Management. J Clin Med 2025;14(9):3137. DOI: 10.3390/jcm14093137
45. Liu X, Xu J, Wei D, Chen Y. Associations of Serum Follicle-Stimulating Hormone and Luteinizing Hormone Levels with Fat and Lean Mass during Menopausal Transition. Obes Facts 2023;16(2):184-93. DOI: 10.1159/000528317
46. Fenton A. Weight, Shape, and Body Composition Changes at Menopause. J Midlife Health 2021;12(3):187-92. DOI: 10.4103/jmh. jmh_123_21
47. Powell-Wiley TM, Poirier P, Burke LE et al. American Heart Association Council on Lifestyle and Cardiometabolic Health; Council on Cardiovascular and Stroke Nursing; Council on Clinical Cardiology; Council on Epidemiology and Prevention; and Stroke Council. Obesity and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation 2021;143(21):e984-e1010. DOI: 10.1161/CIR.0000000000000973
48. de Cuevillas B, Alvarez-Alvarez I, Riezu-Boj JI et al. The hypertriglyceridemic-waist phenotype as a valuable and integrative mirror of metabolic syndrome traits. Sci Rep 2021;11(1):21859. DOI: 10.1038/s41598-021-01343-x
49. Fenton A, Smart C, Goldschmidt L et al. Fat mass, weight and body shape changes at menopause – causes and consequences: a narrative review. Climacteric 2023;26(4):381-7. DOI: 10.1080/13697137.2023. 2178892
50. Golubeva JA, Sheptulina AF, Elkina AY et al. Which Comes First, Nonalcoholic Fatty Liver Disease or Arterial Hypertension? Biomedicines 2023;11(9):2465. DOI: 10.3390/biomedicines11092465
51. Ayesh H, Nasser SA, Ferdinand KC, Carranza Leon BG. Sex-Specific Factors Influencing Obesity in Women: Bridging the Gap Between Science and Clinical Practice. Circ Res 2025;136(6):594-605. DOI: 10.1161/CIRCRESAHA.124.325535
52. Mao L, Wang L, Bennett S et al. Effects of follicle-stimulating hormone on fat metabolism and cognitive impairment in women during menopause. Front Physiol 2022;13:1043237. DOI: 10.3389/fphys. 2022.1043237
53. Seto H, Toki H, Kitora S et al. Seasonal variations of the prevalence of metabolic syndrome and its markers using big-data of health check-ups. Environ Health Prev Med 2024;29:2. DOI: 10.1265/ehpm.23-00216
54. Ahuja M, Sharma JB, Perumal V et al. A Survey on Relation of Menopause to Metabolic Syndrome - SAFOMS STUDY (South Asian Federation of Menopause Societies) – Interim Analysis. J Midlife Health 2023;14(4):291-8. DOI: 10.4103/jmh.jmh_17_24
55. Aleksejeva S, Meija L, Zolovs M, Ciprovica I. Plasma Lipid Profile Among Perimenopausal Latvian Women in Relation to Dietary Habits. Nutrients 2025;17(2):243. DOI: 10.3390/nu17020243
56. Karaflou M, Goulis DG. Body composition analysis: A snapshot across the perimenopause. Maturitas 2024;180:107898. DOI: 10.1016/j.maturitas.2023.107898
57. Koskinas KC, Van Craenenbroeck EM, Antoniades C et al. Obesity and cardiovascular disease: an ESC clinical consensus statement. Eur J Prev Cardiol 2025;32(3):184-220. DOI: 10.1093/eurjpc/zwae279
58. Christensen S, Nelson C. Chronicity of obesity and the importance of early treatment to reduce cardiometabolic risk and improve body composition. Obes Pillars 2025;15:100175. DOI: 10.1016/j.obpill.2025. 100175
59. Chagas CL, da Silva NF, Rodrigues IG et al. Different factors modulate visceral and subcutaneous fat accumulation in adults: a single-center study in Brazil. Front Nutr 2025;12:1524389. DOI: 10.3389/fnut.2025. 1524389
60. Grosicki GJ, Dhurandhar NV, Unick JL et al. Sculpting Success: The Importance of Diet and Physical Activity to Support Skeletal Muscle Health during Weight Loss with New Generation Anti-Obesity Medications. Curr Dev Nutr 2024;8(11):104486. DOI: 10.1016/j.cdnut.2024.104486
61. Jamal N, Hollabaugh W, Scott L, Takkouche S. Unravelling the ties that bind: The intersection of obesity, osteoarthritis, and inflammatory pathways with emphasis on glucagon-like peptide-1 agonists. Clin Obes 2025;15(1):e12700. DOI: 10.1111/cob.12700
62. Muzurović EM, Volčanšek Š, Tomšić KZ et al. Glucagon-Like Peptide-1 Receptor Agonists and Dual Glucose-Dependent Insulinotropic Polypeptide/Glucagon-Like Peptide-1 Receptor Agonists in the Treatment of Obesity/Metabolic Syndrome, Prediabetes/Diabetes and Non-Alcoholic Fatty Liver Disease-Current Evidence. J Cardiovasc Pharmacol Ther 2022;27:10742484221146371. DOI: 10.1177/1074248 4221146371
63. Chartrand DJ, Murphy-Després A et al. Overweight, Obesity, and CVD Risk: a Focus on Visceral/Ectopic Fat. Curr Atheroscler Rep 2022;24(4):185-95. DOI: 10.1007/s11883-022-00996-x
64. Fisman EZ, Tenenbaum A. The dual glucose-dependent insulinotropic polypeptide (GIP) and glucagon-like peptide-1 (GLP-1) receptor agonist tirzepatide: a novel cardiometabolic therapeutic prospect. Cardiovasc Diabetol 2021;20(1):225. DOI: 10.1186/s12933-021-01412-5
65. Луговик И.А., Бабина А.В., Арутюнян С.С. и др. Первый дженерик тирзепатида GP30931: физико-химическое и биологическое сходство с референтным лекарственным средством. Разработка и регистрация лекарственных средств. 2025;14(2):54-74. DOI: 10.33380/2305-2066-2025-14-2-2084
Lugovik I.A., Babina A.V., Arutyunyan S.S. et al. The first generic tirzepatide GP30931: physicochemical and biological similarity to the reference drug. Drug development & Registration 2025;14(2):54-74. DOI: 10.33380/2305-2066-2025-14-2-2084 (in Russian).
66. Rahmani Y, Derby CA, Santoro N et al. Menopause Is Associated with an Altered Gut Microbiome and Estrobolome, with Implications for Adverse Cardiometabolic Risk in the Hispanic Community Health Study/Study of Latinos. mSystems 2022;7(3):e0027322. DOI: 10.1128/msystems.00273-22
67. McClements L, Kautzky-Willer A, Kararigas G et al. The role of sex differences in cardiovascular, metabolic, and immune functions in health and disease: a review for “Sex Differences in Health Awareness Day”. Biol Sex Differ 2025;16(1):33. DOI: 10.1186/s13293-025-00714-7
68. Wu C, Ke Y, Nianogo RA. Trends in hyperinsulinemia and insulin resistance among nondiabetic US adults, NHANES, 1999–2018. J Clin Med 2025;14(9):3215. DOI: 10.3390/jcm14093215
69. Furrer R, Handschin C. Biomarkers of aging: from molecules and surrogates to physiology and function. Physiol Rev 2025;105(3):1609-94. DOI: 10.1152/physrev.00045.2024

