Клинический разбор в общей медицине №11 2025
Far Eastern State Medical University, Khabarovsk, Russia
typ50@rambler.ru
Abstract
Relevance. Premature ovarian failure is a condition characterized by loss of ovarian function in women under 40 years of age, occurring against the background of dysfunction or depletion of ovarian follicles, which leads to oligo/amenorrhea, hypergonadotropic hypogonadism and infertility.
Objective. To study the global prevalence of premature ovarian failure, to consider the problems and prospects of this pathology.
Materials and methods. To write this review, a search was conducted for domestic and foreign publications in Russian and international search systems (PubMed, eLibrary, etc.) over the past 10 years. The review included articles from peer-reviewed literature.
Results. The review presents data on the difficulties in verifying the diagnosis of premature ovarian failure due to the combination of this pathology with infertility, with long-term negative health consequences, including an increase in cardiovascular diseases (arterial hypertension), a decrease in bone mineral density (osteoporosis), etc. The etiological factors and pathogenesis of the origin of premature ovarian failure are presented. Modern methods for its diagnosis and correction are substantiated.
Conclusions. Numerous scientific publications confirm the influence of environmental factors on premature ovarian failure and ovarian aging, which is of great importance in the context of public and clinical health. Identification of risk factors will help to develop targeted and strategic plans for prevention and treatment. Moreover, this knowledge can contribute to the promotion of reproductive health and minimization of exposure to harmful environmental factors.
Keywords: premature ovarian failure, infertility, cardiovascular diseases, osteoporosis, hormone replacement therapy, estrogens.
For citation: Pestrikova T.Yu., Yurasova T.I. Premature ovarian failure: problems and prospects (literature review). Clinical review for general practice. 2025; 6 (11): 124–130 (In Russ.). DOI: 10.47407/kr2025.6.11.00722
Преждевременная недостаточность яичников (ПНЯ) – это состояние, характеризующееся потерей функции яичников у женщин в возрасте до 40 лет [1]. ПНЯ возникает на фоне дисфункции или истощения фолликулов яичников, что приводит к олиго-/аменорее, гипергонадотропному гипогонадизму и бесплодию [2]. По данным Европейского общества репродукции и эмбриологии (ESHRE), диагностические критерии ПНЯ включают олиго-/аменорею в течение не менее 4 мес и уровень фолликулостимулирующего гормона (ФСГ) >25 МЕ/л в 2 случаях с интервалом не менее 4 нед в возрасте до 40 лет [3]. Оценка овариального резерва по биохимическим показателям, таким как количество антральных фолликулов и уровень антимюллерова гормона (АМГ) в сыворотке крови [4], не является обязательной для постановки диагноза, но может быть информативной при планировании беременности [5].
Эпидемиология
По данным разных авторов, общая глобальная распространенность ПНЯ среди женщин составила 3,5–3,7% [2, 6–8], а по некоторым данным – 2–4% [9]. Это зависит от этнической принадлежности женщины, условий внешней среды, этиологии заболевания и других факторов. Это заболевание гетерогенной этиологии. ПНЯ встречается до 10% в структуре различных форм аменореи. Среди женщин с первичной аменореей частота ПНЯ составляет 10–28%, со вторичной – 4–18% [10].
Согласно ряду исследований, распространенность ПНЯ среди женщин с ятрогенной этиологией составляет 11,2%, за ней следуют аутоиммунные заболевания (10,5%). Распространенность ПНЯ по регионам мира составляет 11,3%, при этом самый высокий показатель был зафиксирован в Северной Америке, за ней следует Южная Америка (5,4%). Распространенность ПНЯ в развивающихся странах равняется 5,3%, что выше, чем в развитых странах (3,1%). За последние 20 лет распространенность ПНЯ имеет тенденцию к росту (p>0,05) [7, 11].
По данным метаанализа 2019 г., распространенность ПНЯ и ранней менопаузы среди европейской популяции женщин прогрессивно растет и к настоящему времени достигает 3,7 и 12,2% соответственно [12].
Распространенность ПНЯ в зависимости от возраста:
• до 20 лет – 1:10 000;
• к 30 годам – 1:1000;
• к 35 годам – 1:250;
• к 40 годам – 1:100 [13, 14].
Этиология и патогенез
Хотя более половины случаев ПНЯ являются идиопатическими, генетические факторы играют ключевую роль во всех случаях с известными причинами, составляя примерно 20–25% от общего числа [15].
Первое место занимает наследственность: если у матери была данная проблема, то с высокой долей вероятности она возникнет и у ее дочери. Этот фактор вызван нарушением в половой Х-хромосоме. Именно в ней находится большинство генов, отвечающих за функционирование репродуктивной системы. При хромосомных аномалиях ПНЯ запрограммирована генетически [16].
На втором месте среди причин появления ПНЯ – негативное влияние факторов во время внутриутробного развития, когда у девочки идет закладка фолликулов (части яичника). Прием беременной женщиной антибиотиков и других препаратов, которые не рекомендуются при беременности, перенесенное простудное заболевание – все это накладывает отпечаток на репродуктивное здоровье девочки.
На третьем месте – оперативное вмешательство, например удаление яичника или его части (резекция яичника), операция по удалению кисты, образования или эндометриоидного очага на яичнике. После удаления одного яичника второй работает усиленно, но этого бывает недостаточно, впоследствии развивается ПНЯ [17].
На четвертом месте – аутоиммунные заболевания.
В организме вырабатываются антитела, которые разрушают яичники.
Большинство причин ПНЯ остаются неопределенными, однако, по оценкам, от 4 до 30% случаев имеют аутоиммунное происхождение. Поскольку яичники являются частой мишенью для аутоиммунных атак, всегда следует рассматривать аутоиммунную этиологию ПНЯ, особенно при наличии антиооцитарных антител, аутоиммунных заболеваний или лимфоцитарного оофорита в биопсии. ПНЯ может встречаться изолированно, но часто ассоциируется с другими аутоиммунными заболеваниями. Наиболее часто встречаются сопутствующие заболевания щитовидной железы, такие как гипотиреоз, тиреоидит Хашимото и болезнь Грейвса. Аутоиммунные заболевания надпочечников являются вторыми по частоте заболеваниями, связанными с ПНЯ. Среди женщин с сахарным диабетом ПНЯ развивается примерно у 2,5%. Кроме того, аутоиммунно-обусловленная ПНЯ может также быть частью аутоиммунного полигландулярного синдрома – состояния, при котором аутоиммунная активность вызывает специфическое поражение эндокринных органов. В своем наиболее частом проявлении (тип 3) аутоиммунный полигландулярный синдром связан с антителами к щитовидной железе типа Хашимото и имеет распространенность 10–40% [18].
Провоцирующими факторами могут стать перенесенные ранее инфекции, стрессы, экология и др. Также пагубно влияют на женскую репродуктивную систему алкоголь и курение [19].
Поддерживать функцию яичников очень важно для женщины. Контролировать данный процесс нужно с молодости. Строгая диета, малая масса тела, отказ от пищи – все это приводит к разрушению нормальной работы яичников, происходят их разрушение и снижение функции.
На 7-й неделе внутриутробного развития в организме девочки формируются яичники. В них в зависимости от генетики закладывается определенное количество яйцеклеток, обычно около 1 млн. Их число со временем сокращается, так как новые яйцеклетки после формирования резерва уже не образуются, а уже существующие выделяются в овуляции и постепенно отмирают. Этот естественный процесс приводит к тому, что к 45 годам их количество снижается. Поэтому данный возраст считают окончанием репродуктивного периода. Как только запас яйцеклеток иссякает, яичники перестают вырабатывать женские половые гормоны, ежемесячные менструации прекращаются и наступает климакс (менопауза) [20, 21].
Следовательно, ПНЯ развивается в связи со значительным снижением количества яйцеклеток до наступления или во время репродуктивного периода. Это может произойти из-за генетических нарушений, воздействия на яичники вредных факторов в течение жизни (токсины, алкоголь), операций и аутоиммунных заболеваний [14].
Таким образом, все вредные вещества, которые воздействуют на репродуктивную систему, напрямую обладают цитотоксическим действием, т.е. они разрушают клетки. В связи с этим количество яйцеклеток снижается гораздо раньше, а функция яичников ухудшается, следовательно, синтезируется меньше эстрогенов. Все это приводит к развитию ПНЯ [22].
Согласно исследованию 2023 г., опубликованному в журнале «Cell», такие факторы, как окислительный стресс (ОС), дисфункция митохондрий, хроническое воспаление и укорочение теломер, в совокупности способствуют старению яичников, напрямую влияя на женскую фертильность. Среди этих факторов митохондриальная дисфункция играет ключевую роль. К основным характеристикам старения яичников относятся снижение количества и качества ооцитов, колебания уровня гормонов и снижение функции гранулезных клеток. Исследования показали, что митохондрии влияют на фертильность, регулируя энергетический метаболизм клеток, усиливая ОС, вызывая повреждение митохондриальной ДНК и влияя на физиологическую функцию гранулезных клеток яичников, постепенно снижая овариальный резерв. Происходит снижение активности митохондрий на выработку энергии в ооцитах и гранулезных клетках, накопление активных форм кислорода (АФК) и концентрацию ионов кальция, что способствует процессу старения яичников [23].
Нормальные уровни АФК играют важную роль в регуляции роста фолликулов, ангиогенеза и синтеза половых гормонов в ткани яичников. Однако нарушение баланса между АФК и антиоксидантами может вызвать серьезные последствия ОС, а также снизить количество и качество ооцитов. Поэтому, по мнению ряда исследователей, существует взаимосвязь между ОС и ПНЯ, ученые выделяют потенциальные механизмы и методы, с помощью которых антиоксиданты могут улучшить ПНЯ посредством контроля уровня ОС. Было обнаружено, что ОС может опосредовать изменения в генетическом материале, сигнальных путях, факторах транскрипции и микросреде яичников, что приводит к аномальному апоптозу гранулезных клеток яичников и аномальному мейозу, а также снижению митохондриальной ДНК и другим изменениям, тем самым ускоряя процесс старения яичников. Однако мезенхимальные стволовые клетки, биологические ферменты и другие антиоксиданты могут замедлить развитие заболевания ПНЯ за счет снижения уровня АФК [11].
Патофизиологию ПНЯ сегодня рассматривают как некий континуум, представляющий собой постепенное угасание функции яичников.
Тем не менее этиологию ПНЯ не удается идентифицировать даже после полного обследования почти в 80% случаев [24].
Классификация
В настоящее время классификация ПНЯ представлена следующими формами:
• идиопатическая;
• аутоиммунная, включая аутоиммунный полигландулярный синдром (autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy – APECED) вследствие мутации гена AIRE;
• дефекты Х-хромосомы: синдром Шерешевского–Тернера, синдром ломкой Х-хромосомы (премутация гена FMR1 – это состояние, когда число CGG-повторов находится в пределах 55–200);
• моногенные мутации;
• ятрогенная: оперативное удаление яичников, химиотерапия, лучевая терапия;
• вирусные инфекции (краснуха, опоясывающий герпес, или herpes zoster, цитомегаловирусная инфекция) [25].
Кроме этого, выделяют моногенные мутации/синдромы:
• галактоземия – рецессивный тип наследования;
• блефарофимоз (blepharophimosis-ptosis-epicanthus inversus syndrome – BPES) – доминантный тип наследования, сцепленный с Х-хромосомой;
• псевдогипопаратиреоз (РНР, тип 1а) – отцовский импринтинг;
• лейкодистрофия (EIF2B) – аутосомно-рецессивный тип наследования.
К изолированным дефектам развития ПНЯ относятся:
• мутация гена-рецептора ФСГ (рецессивный тип наследования);
• мутация гена-рецептора лютеинизирующего гормона – ЛГ (рецессивный тип наследования) [8].
Выделяют типы наследования:
• мутация гена ингибина A;
• мутация гена фактора транскрипции forkhead (F0XL2), ассоциированная с BPES (доминантный тип наследования, сцепленный с Х-хромосомой) [20].
При идиопатическом, аутоиммунном и генетически обусловленном происхождении ПНЯ выделяют семейные и спорадические формы. Семейные формы составляют 4–31% случаев ПНЯ. Почти 50% случаев первичной аменореи – результат аномалий кариотипа; при манифестации ПНЯ в возрасте 30–39 лет по типу вторичной аменореи аномалии кариотипа исключительно редки [19]. Большинство женщин с кариотипом 46,XX и спонтанной ПНЯ имеют нормальный пубертат, менархе и не имеют каких-либо отклонений физического развития.
Несмотря на значительные успехи в области молекулярной биологии, до настоящего времени окончательно не установлены ведущие механизмы, приводящие к нефизиологическому снижению овариального резерва. По данным зарубежных и отечественных авторов, на долю сочетанных молекулярно-генетических и эпигенетических нарушений в структуре причин ПНЯ приходится от 25 до 63%. ПНЯ рассматривают как олигогенную патологию, хотя до настоящего времени ведущие гены-кандидаты четко не определены, их идентификация позволит разработать предикторы диагностики преждевременного старения яичников. Следует отметить, что в последние годы обсуждается роль не только генов, регулирующих внутриутробный и постнатальный фолликуло- и стероидогенез, скорость апоптоза примордиальных фолликулов, но и генов, вовлеченных в процессы репарации ДНК и механизмы мейотического деления (гены BRCA1/2) [26].
Клинические проявления
Триада, в которую входят аменорея, повышенный уровень ФСГ и дефицит эстрогенов, связана с долгосрочными негативными последствиями для здоровья, включая увеличение сердечно-сосудистых заболеваний (артериальной гипертензии), снижение минеральной плотности костной ткани (остеопороз), значительное снижение фертильности (бесплодие), психологический стресс, вульвовагинальную атрофию/генитоуринарный менопаузальный синдром, изменение частоты мочеиспускания, диспареунию, низкое либидо, неврологические эффекты, когнитивные нарушения, гипотиреоз, надпочечниковую недостаточность, синдром дефицита андрогенов, нарушение сна, упадок сил и общее сокращение продолжительности жизни [24, 27, 28]. В дальнейшем повышается риск развития сахарного диабета, ожирения [29, 30].
Первым проявлением патологии является нарушение менструального цикла (МЦ). На первом этапе задержки могут быть до 1–2 нед, а затем до 2–3 мес или полугода вплоть до полного прекращения месячных. На втором этапе синдрома появляются те же симптомы, что и при климактерическом синдроме, т.е. появляются приливы. Приливы выражаются в резком ощущении жара в области лица, шеи и груди в течение нескольких минут. Приливы могут появляться в любое время, в том числе и ночью, при этом возникают потливость, плохой сон, мигрень, раздражительность, тревожность и нарушение либидо [31, 32].
В дальнейшем появляются урогенитальные расстройства. При снижении эстрогенов истощается слизистая оболочка влагалища и мочевого пузыря, возникает ощущение сухости, повышается риск развития воспалительных явлений (кольпита, цистита, уретрита).
Во время полового акта возникают дискомфорт, ощущение сухости. Также из-за снижения уровня эстрогенов появляются морщины, снижается эластичность кожи, ногти истончаются, слоятся, волосы становятся тоньше, усиливается их выпадение [33].
Ряд авторов выделяют несколько стадий развития ПНЯ:
• I стадия – проявляются вегетативные и психоэмоциональные расстройства: приливы, плохой сон, депрессия, раздражительность, плаксивость, снижение либидо;
• II стадия – присоединяются обменные нарушения: прибавка массы тела, ожирение;
• III стадия – возникают сердечно-сосудистая патология, остеопороз, сахарный диабет [16].
При ПНЯ существенным образом страдает психосексуальное здоровье пациенток [34, 35].
К 40 годам встречается нарушение центральных и периферических компонентов сексуальной реакции, гипоактивное расстройство сексуального желания, а также развитие генитоуринарного менопаузального синдрома [36].
Более низкий, чем у здоровых сверстниц, уровень андрогенов хотя и не является самостоятельной причиной сексуальной дисфункции, однако усугубляет такие симптомы, как слабое сексуальное возбуждение, уменьшение количества естественной вагинальной смазки и диспареуния, у пациенток с ПНЯ [37, 38].
У женщины с ПНЯ в 2,8 раза выше риски сексуальной дисфункции (любых ее проявлений), чем у женщин с сохраненным ритмом менструации. Сексуальная дисфункция является одной из важнейших причин психоэмоциональных нарушений у женщин с ПНЯ. После постановки диагноза у пациенток данной группы также наблюдаются высокая частота депрессии, низкий уровень удовлетворенности жизни, формируются низкая самооценка и неуверенность в себе [39].
Одними из самых ранних проявлений ПНЯ являются потеря фертильности и связанные с этим психоэмоциональные нарушения: стресс, депрессия и заниженная самооценка [37].
Примечательно, что как минимум у 50% женщин после развития овариальной недостаточности в яичниках сохраняются фолликулы [2].
Вероятность того, что женщина при ПНЯ сможет забеременеть, все же есть, но небольшая. Так как ПНЯ – длительный процесс снижения репродуктивной функции, временами МЦ может возобновляться без какого-либо медицинского вмешательства. В этот период может произойти зачатие. Однако в дальнейшем возникает сложность в вынашивании ребенка [14].
При ультразвуковом исследовании (УЗИ) органов малого таза фолликулы с равной вероятностью обнаруживались у пациенток как менее, так и более чем через
6 лет после постановки диагноза ПНЯ [5].
Согласно данным литературы, единичные овуляторные циклы могут встречаться у женщин с ПНЯ с частотой до 25%, и от 5 до 10% пациенток могут забеременеть и в последующем родить ребенка. Большинство случаев спонтанных беременностей при этом регистрируются в течение 1 года после постановки диагноза [39].

Диагностика и дифференциальная диагностика
Преждевременное старение яичников во всех его формах незаметно развивается как бессимптомный процесс, ведущий к полной потере функции яичников, и в настоящее время диагностика ПНЯ проводится на относительно поздних стадиях. Надо учитывать, что использование средств гормональной контрацепции у девушек может маскировать это состояние в течение длительного времени [22].
Первичную диагностику осуществляет врач акушер-гинеколог. Он собирает жалобы, изучает историю болезни (анамнез). Для установления причины ПНЯ необходим анализ следующих анамнестических данных:
• ранее проведенные операции на яичниках, химиотерапия или лучевая терапия;
• симптомы анорексии, потери массы тела, неопределенной боли в животе, слабости, утомляемости, тяги к соли или повышенной пигментации кожи, которые предполагают наличие первичной недостаточности надпочечников;
• личный или семейный анамнез аутоиммунных заболеваний (аутоиммунный оофорит может возникать как часть полиэндокринного аутоиммунного синдрома);
• семейная история ПНЯ, т.к. примерно 10% случаев ПНЯ являются семейными;
• наличие в семейном анамнезе лиц с синдромом ломкой Х-хромосомы, умственной отсталости, задержки развития, паркинсонизма, сильного тремора, атаксии или деменции, поскольку примерно 6% случаев ПНЯ связаны с премутацией FMR1;
• глухота, поскольку семейная аутосомно-рецессивная спонтанная ПНЯ может быть связана с глухотой как часть синдрома Перро [16, 20].
Все это позволяет заподозрить ПНЯ. Пациентки с ПНЯ выглядят, как правило, старше своих лет: у них появляются преждевременные морщины, волосы становятся тонкими, безжизненными, тусклыми, ногти – ломкими.
Женщины с ПНЯ и нормальным кариотипом 46,XX в большинстве случаев имеют абсолютно физиологический пубертат и регулярный МЦ до момента появления первых признаков ПНЯ. Нарушение МЦ при ПНЯ является наиболее частым симптомом, но определенных строго патогномоничных характеристик нарушений МЦ, указывающих на возможность развития ПНЯ в будущем у женщин с кариотипом 46,XX, не существует. Варианты нарушений МЦ при ПНЯ варьируют в диапазоне от спонтанной аменореи до длительной олигоменореи [20].
Верификация ПНЯ основана, в первую очередь, на клинических проявлениях и уровне ФСГ (табл. 1):
• оккультная стадия – скрытая недостаточность яичников (снижение овариального резерва: необъяснимое бесплодие и нормальный базальный уровень ФСГ в сыворотке крови);
• биохимическая стадия – биохимическая недостаточность яичников: необъяснимое бесплодие и повышенный базальный уровень ФСГ в сыворотке крови;
• манифестная стадия – явная недостаточность яичников: нерегулярные МЦ и повышенный базальный уровень ФСГ в сыворотке крови; аменорея, постоянное бесплодие и полное истощение примордиальных фолликулов [40, 41].
Нормальные значения ФСГ могут быть неистинными для тех женщин с ПНЯ, у которых периодически восстанавливается функция яичников, поскольку ФСГ может снижаться до нормы для репродуктивного периода во время овуляторных циклов и увеличиваться до значений постменопаузального диапазона при олиго- или аменорее.
Подтверждение оккультной формы ПНЯ, которую также называют сниженным овариальным резервом при бесплодии, требует измерения не только уровня ФСГ и эстрадиола на 3-й день МЦ, но и концентрации АМГ и подсчета числа антральных фолликулов (при трансвагинальном УЗИ). ФСГ, измеренный на 3-й день цикла, >10–15 МЕ/л при одновременном уровне эстрадиола в сыворотке ≥80 пг/мл (294 пмоль/л) свидетельствует о более низкой фертильности и оккультной ПНЯ (см. табл. 1) [42].
При повышении уровня эстрадиола >100 пг/мл, измеренного одновременно с ФСГ, последний может находиться в диапазоне низких значений даже у женщин с аменореей из-за спонтанного развития какого-то единственного фолликула, что может ввести в заблуждение и диагноз ПНЯ не будет установлен [20].
Поскольку АМГ вырабатывается только в небольших фолликулах яичников, уровень этого гормона в крови используется для диагностики сниженного овариального резерва. Нормальный уровень составляет от 1,5 до 4,0 нг/мл. Очень низкий уровень указывает на сниженный овариальный резерв. Репродуктивные эндокринологи используют уровень АМГ для прогнозирования того, какие женщины могут плохо реагировать на препараты для лечения бесплодия и в целом для каких пар лечение бесплодия менее эффективно. Анализ крови на АМГ можно проводить в любой момент МЦ. Новые, более чувствительные тесты на АМГ могут помочь врачам диагностировать раннюю менопаузу.
Присутствие приливов и/или сухости во влагалище указывает на ПНЯ, поскольку данные симптомы не характерны для женщин с иными заболеваниями, сопровождающимися нарушением МЦ. Отсутствие этих симптомов не исключает диагноза ПНЯ из-за возможности временного спонтанного восстановления функции яичников у женщин с ПНЯ. Прогестероновая проба не заменяет лабораторного обследования, поскольку периодическая выработка эстрадиола может привести к кровотечению отмены после приема прогестерона, что не исключает диагноз ПНЯ [16].
Кариотипирование следует проводить как часть базового обследования всех женщин с ПНЯ. В целом у пациенток, у которых до развития ПНЯ было нормальное половое созревание, аномальный кариотип объясняет нарушение в небольшом проценте случаев. У женщин с аномалиями Х-хромосомы ПНЯ развивается после рождения здоровых детей. Генетическое консультирование и тестирование на премутацию FMR1 показано женщинам с семейным анамнезом первичной недостаточности яичников или при наличии умственной отсталости, тремора или атаксии. Кариотип определяется, если возраст женщины с подтвержденной недостаточностью яичников или дисфункцией яичников моложе 35 лет или при подозрении на премутацию FMR1 [43].
Если кариотип нормальный или есть подозрение на аутоиммунную причину, проводятся анализы на сывороточные антитела к надпочечникам и антитела к
21-гидроксилазе (аутоантитела к надпочечникам); табл. 2 [44].
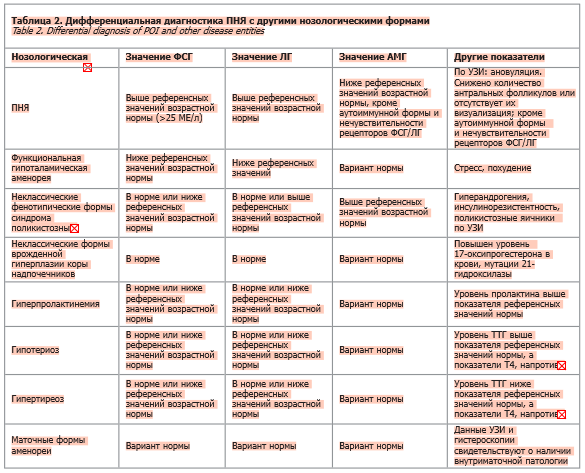
Тесты на антиовариальные антитела не рекомендуются из-за недостаточной точности тестирования.
Если подозревается аутоиммунная причина, также проводятся анализы для проверки на аутоиммунный гипотиреоз; они включают измерение уровня тиреотропного гормона (ТТГ), тироксина (Т4), а также антител к тиреопероксидазе и тиреоглобулину (см. табл. 2) [6].
При подозрении на недостаточность надпочечников подтвердить диагноз можно с помощью измерения утреннего уровня кортизола или теста стимуляции адренокортикотропного гормона [16, 19, 20].
В отдельных ситуациях необходимо в объем обследования включить определение хорионического гонадотропина, пролактина, ЛГ.
Необходимо провести другие анализы на предмет аутоиммунной дисфункции, в том числе общий анализ крови с лейкоцитарной формулой, определением скорости оседания эритроцитов, а также измерением антинуклеарных антител и ревматоидного фактора. Биопсия яичников для выявления аутоиммунного оофорита не рекомендуется.
Минеральная плотность костной ткани измеряется, если у женщины есть симптомы или признаки дефицита эстрогена.
Оценка минеральной плотности костной ткани с помощью двухэнергетической рентгеновской абсорбциометрии необходима женщинам с ПНЯ, так как ПНЯ является причиной развития остеопороза. У женщин с ПНЯ чаще возникают остеопоротические переломы [45].
К рутинным методам обследования относится УЗИ органов малого таза.
Современные аспекты лечебных мероприятий
Дальнейшее ведение женщин с диагнозом ПНЯ происходит с учетом широкого спектра важных аспектов здоровья, включающих эмоциональное здоровье, фертильность, сексуальную функцию, здоровье костей, сердечно-сосудистой системы и риск развития недостаточности надпочечников, а также, что наиболее важно, терапия должна включать психосоциальную поддержку женщин, столкнувшихся с этим тяжелым диагнозом.
В качестве первой линии лечения рекомендуется заместительная гормональная терапия (ЗГТ) с помощью половых стероидов (эстрогены можно назначать перорально или трансдермально), которая оказывает благотворное влияние как на контроль симптомов, так и на минимизацию долгосрочных побочных эффектов, связанных с этим состоянием. Комбинированные гормональные контрацептивы предотвращают овуляцию и беременность более надежно, чем ЗГТ эстрогенами; несмотря на лишь незначительные шансы на спонтанную беременность у женщин с ПНЯ, это имеет решающее значение для тех, кто считает предотвращение беременности приоритетом. Лечение всех женщин с ПНЯ должно продолжаться до достижения среднего возраста естественной менопаузы (50–51 год) [1, 46]. Наконец, учитывая трудности, с которыми могут столкнуться молодые женщины, справляясь с физическими, репродуктивными и социальными последствиями первичной недостаточности яичников, крайне важно комплексное лонгитюдное ведение этого состояния [47].
ЗГТ показана для восстановления нормального уровня половых гормонов до пременопаузального уровня и профилактики хронических заболеваний, таких как остеопороз и сердечно-сосудистые заболевания [46].
Помимо ЗГТ для профилактики остеопороза рекомендуются физические упражнения, здоровое питание, прием препаратов кальция и витамина D, отказ от курения.
Женщинам с Y-хромосомой требуется двусторонняя овариэктомия путем лапаротомии или лапароскопии, поскольку у них повышен риск развития рака зародышевых клеток яичников [47].
Несмотря на то, что ЗГТ улучшает симптоматику и долгосрочные последствия для здоровья, она не может лечить бесплодие, которое было описано как наиболее разрушительный аспект заболевания.
Вспомогательные репродуктивные технологии дают надежду женщинам с ПНЯ иметь собственного ребенка. Компенсация гормонального дефицита важна для устранения неприятных ощущений, связанных с ПНЯ, а также для снижения риска развития поздних эффектов. Из-за истощения фолликулов в яичниках донорство яйцеклеток является единственным шансом на беременность. Выяснение генетической и молекулярной основы ПНЯ имеет важное значение. Благодаря этому повышается вероятность прогнозирования возраста, в котором у женщин с риском развития ПНЯ наступит преждевременная менопауза. Женщинам, имеющим определенные нарушения, приводящие к ПНЯ, может быть предложен вариант криоконсервации ооцитов с последующим размораживанием и использованием во вспомогательных репродуктивных технологиях в соответствующем возрасте [22].
Для женщин, желающих забеременеть, одним из вариантов является экстракорпоральное оплодотворение донорских ооцитов с добавлением экзогенных эстрогенов и прогестагенов, которые позволяют эндометрию поддерживать перенесенный эмбрион. Возраст донора ооцитов важнее возраста реципиента. Этот метод довольно успешен, но даже без него некоторые женщины с диагностированной ПНЯ беременеют. Доказано, что ни один метод лечения не повышает частоту овуляции или не восстанавливает фертильность у женщин с первичной недостаточностью яичников. Однако в настоящее время изучается возможность восстановления фертильности [48, 49].
Примечательно, что по крайней мере у 50% женщин после развития недостаточности яичников в них остаются фолликулы [2], которые можно реактивировать для получения компетентных ооцитов, что подтверждается активацией спящих фолликулов in vitro.
В ряде публикаций обсуждаются механизмы и клинические данные, относящиеся к новым терапевтическим стратегиям с использованием фрагментации яичников, стволовых клеток или богатой тромбоцитами плазмы для восстановления функции яичников у женщин старшего возраста (>38 лет). Методы реактивации фолликулов демонстрируют многообещающие экспериментальные результаты и были успешными в некоторых случаях, когда была установлена ПНЯ. Помимо этого, обсуждается вопрос о том, как новые знания о биологических механизмах, регулирующих динамику фолликулов и компетентность ооцитов, могут помочь в устранении повреждений яичников, поскольку ни один метод не влияет на качество ооцитов. Дополнительные исследования должны быть направлены на увеличение количества и улучшение качества фолликулов. Наконец, существует небольшая, но важная группа женщин, у которых нет остаточных фолликулов и которым требуется получение ооцитов из стволовых клеток [50–53].
Понимание влияния факторов окружающей среды на ПНЯ и старение яичников крайне важно в контексте общественного и клинического здравоохранения. Выявляя факторы риска, медицинские работники могут разрабатывать целенаправленные и стратегические планы профилактики и вмешательства. Более того, эти знания могут способствовать укреплению репродуктивного здоровья и минимизации воздействия вредных факторов окружающей среды [14, 54].
Вклад авторов: Т.Ю. Пестрикова – концепция и дизайн исследования, написание текста; Т.И. Юрасова – сбор и обработка материала.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Authors' contributions: T.Yu. Pestrikova – study concept and design, writing the text; T.I. Yurasova – material collection, material processing.
Conflict of interests. The authors declare that there is not conflict of interests.
Funding. The work was carried out without sponsorship.
Информация об авторах
Information about the authors
Пестрикова Татьяна Юрьевна – д-р мед. наук, проф., зав. каф. акушерства и гинекологии ФГБОУ ВО ДВГМУ. E-mail: typ50@rambler.ru; ORCID: 0000-0003-0219-3400
Tatyana Yu. Pestrikova – Dr. Sci. (Med.), Professor, Far Eastern State Medical University. E-mail: typ50@rambler.ru; ORCID: 0000-0003-0219-3400
Юрасова Татьяна Игоревна – аспирант, каф. акушерства и гинекологии ФГБОУ ВО ДВГМУ. E-mail: Pro100Tata@ yandex.ru; ORCID: 0000-0003-0187-9937
Tatyana I. Yurasova – postgraduate student, Far Eastern State Medical University. Е-mail: Pro100Tata@yandex.ru; ORCID: 0000-0003-0187-9937
Поступила в редакцию: 21.08.2025
Поступила после рецензирования: 29.08.2025
Принята к публикации: 04.09.2025
Received: 21.08.2025
Revised: 29.08.2025
Accepted: 04.09.2025
Клинический разбор в общей медицине №11 2025
Преждевременная недостаточность яичников: проблемы и перспективы (обзор литературы)
Номера страниц в выпуске:124-130
Аннотация
Актуальность. Преждевременная недостаточность яичников (ПНЯ) – это состояние, характеризующееся потерей функции яичников у женщин в возрасте до 40 лет, возникающее на фоне дисфункции или истощения фолликулов яичников, что приводит к олиго-/аменорее, гипергонадотропному гипогонадизму и бесплодию.
Цель. Изучить глобальную распространенность ПНЯ, рассмотреть проблемы и перспективы данной патологии.
Материалы и методы. Для написания данного обзора был осуществлен поиск отечественных и зарубежных публикаций в российских и международных системах поиска (PubMed, eLibrary и пр.) за последние 10 лет. В обзор включены статьи из рецензируемой литературы.
Результаты. В обзоре представлены данные о трудностях верификации диагноза ПНЯ, обусловленных сочетанием данной патологии с бесплодием, долгосрочными негативными последствиями для здоровья, включая увеличение сердечно-сосудистых заболеваний (артериальной гипертензии), снижение минеральной плотности костной ткани (остеопороз) и т.д. Представлены этиологические факторы и патогенез происхождения ПНЯ. Обоснованы современные методы ее диагностики и коррекции.
Выводы. Многочисленные научные публикации подтверждают наличие влияния факторов окружающей среды на преждевременную овариальную недостаточность и старение яичников, что крайне важно в контексте общественного и клинического здравоохранения. Выявление факторов риска поможет разработке целенаправленных и стратегических планов профилактики и лечения. Более того, эти знания могут способствовать укреплению репродуктивного здоровья и минимизации воздействия вредных факторов окружающей среды.
Ключевые слова: преждевременная недостаточность яичников, бесплодие, сердечно-сосудистые заболевания, остеопороз, заместительная гормональная терапия, эстрогены.
Для цитирования: Пестрикова Т.Ю., Юрасова Т.И. Преждевременная недостаточность яичников: проблемы и перспективы (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (11): 124–130. DOI: 10.47407/kr2025.6.11.00722
Актуальность. Преждевременная недостаточность яичников (ПНЯ) – это состояние, характеризующееся потерей функции яичников у женщин в возрасте до 40 лет, возникающее на фоне дисфункции или истощения фолликулов яичников, что приводит к олиго-/аменорее, гипергонадотропному гипогонадизму и бесплодию.
Цель. Изучить глобальную распространенность ПНЯ, рассмотреть проблемы и перспективы данной патологии.
Материалы и методы. Для написания данного обзора был осуществлен поиск отечественных и зарубежных публикаций в российских и международных системах поиска (PubMed, eLibrary и пр.) за последние 10 лет. В обзор включены статьи из рецензируемой литературы.
Результаты. В обзоре представлены данные о трудностях верификации диагноза ПНЯ, обусловленных сочетанием данной патологии с бесплодием, долгосрочными негативными последствиями для здоровья, включая увеличение сердечно-сосудистых заболеваний (артериальной гипертензии), снижение минеральной плотности костной ткани (остеопороз) и т.д. Представлены этиологические факторы и патогенез происхождения ПНЯ. Обоснованы современные методы ее диагностики и коррекции.
Выводы. Многочисленные научные публикации подтверждают наличие влияния факторов окружающей среды на преждевременную овариальную недостаточность и старение яичников, что крайне важно в контексте общественного и клинического здравоохранения. Выявление факторов риска поможет разработке целенаправленных и стратегических планов профилактики и лечения. Более того, эти знания могут способствовать укреплению репродуктивного здоровья и минимизации воздействия вредных факторов окружающей среды.
Ключевые слова: преждевременная недостаточность яичников, бесплодие, сердечно-сосудистые заболевания, остеопороз, заместительная гормональная терапия, эстрогены.
Для цитирования: Пестрикова Т.Ю., Юрасова Т.И. Преждевременная недостаточность яичников: проблемы и перспективы (обзор литературы). Клинический разбор в общей медицине. 2025; 6 (11): 124–130. DOI: 10.47407/kr2025.6.11.00722
Premature ovarian failure: problems and prospects (literature review)
Tatyana Yu. Pestrikova, Tatyana I. YurasovaFar Eastern State Medical University, Khabarovsk, Russia
typ50@rambler.ru
Abstract
Relevance. Premature ovarian failure is a condition characterized by loss of ovarian function in women under 40 years of age, occurring against the background of dysfunction or depletion of ovarian follicles, which leads to oligo/amenorrhea, hypergonadotropic hypogonadism and infertility.
Objective. To study the global prevalence of premature ovarian failure, to consider the problems and prospects of this pathology.
Materials and methods. To write this review, a search was conducted for domestic and foreign publications in Russian and international search systems (PubMed, eLibrary, etc.) over the past 10 years. The review included articles from peer-reviewed literature.
Results. The review presents data on the difficulties in verifying the diagnosis of premature ovarian failure due to the combination of this pathology with infertility, with long-term negative health consequences, including an increase in cardiovascular diseases (arterial hypertension), a decrease in bone mineral density (osteoporosis), etc. The etiological factors and pathogenesis of the origin of premature ovarian failure are presented. Modern methods for its diagnosis and correction are substantiated.
Conclusions. Numerous scientific publications confirm the influence of environmental factors on premature ovarian failure and ovarian aging, which is of great importance in the context of public and clinical health. Identification of risk factors will help to develop targeted and strategic plans for prevention and treatment. Moreover, this knowledge can contribute to the promotion of reproductive health and minimization of exposure to harmful environmental factors.
Keywords: premature ovarian failure, infertility, cardiovascular diseases, osteoporosis, hormone replacement therapy, estrogens.
For citation: Pestrikova T.Yu., Yurasova T.I. Premature ovarian failure: problems and prospects (literature review). Clinical review for general practice. 2025; 6 (11): 124–130 (In Russ.). DOI: 10.47407/kr2025.6.11.00722
Преждевременная недостаточность яичников (ПНЯ) – это состояние, характеризующееся потерей функции яичников у женщин в возрасте до 40 лет [1]. ПНЯ возникает на фоне дисфункции или истощения фолликулов яичников, что приводит к олиго-/аменорее, гипергонадотропному гипогонадизму и бесплодию [2]. По данным Европейского общества репродукции и эмбриологии (ESHRE), диагностические критерии ПНЯ включают олиго-/аменорею в течение не менее 4 мес и уровень фолликулостимулирующего гормона (ФСГ) >25 МЕ/л в 2 случаях с интервалом не менее 4 нед в возрасте до 40 лет [3]. Оценка овариального резерва по биохимическим показателям, таким как количество антральных фолликулов и уровень антимюллерова гормона (АМГ) в сыворотке крови [4], не является обязательной для постановки диагноза, но может быть информативной при планировании беременности [5].
Эпидемиология
По данным разных авторов, общая глобальная распространенность ПНЯ среди женщин составила 3,5–3,7% [2, 6–8], а по некоторым данным – 2–4% [9]. Это зависит от этнической принадлежности женщины, условий внешней среды, этиологии заболевания и других факторов. Это заболевание гетерогенной этиологии. ПНЯ встречается до 10% в структуре различных форм аменореи. Среди женщин с первичной аменореей частота ПНЯ составляет 10–28%, со вторичной – 4–18% [10].
Согласно ряду исследований, распространенность ПНЯ среди женщин с ятрогенной этиологией составляет 11,2%, за ней следуют аутоиммунные заболевания (10,5%). Распространенность ПНЯ по регионам мира составляет 11,3%, при этом самый высокий показатель был зафиксирован в Северной Америке, за ней следует Южная Америка (5,4%). Распространенность ПНЯ в развивающихся странах равняется 5,3%, что выше, чем в развитых странах (3,1%). За последние 20 лет распространенность ПНЯ имеет тенденцию к росту (p>0,05) [7, 11].
По данным метаанализа 2019 г., распространенность ПНЯ и ранней менопаузы среди европейской популяции женщин прогрессивно растет и к настоящему времени достигает 3,7 и 12,2% соответственно [12].
Распространенность ПНЯ в зависимости от возраста:
• до 20 лет – 1:10 000;
• к 30 годам – 1:1000;
• к 35 годам – 1:250;
• к 40 годам – 1:100 [13, 14].
Этиология и патогенез
Хотя более половины случаев ПНЯ являются идиопатическими, генетические факторы играют ключевую роль во всех случаях с известными причинами, составляя примерно 20–25% от общего числа [15].
Первое место занимает наследственность: если у матери была данная проблема, то с высокой долей вероятности она возникнет и у ее дочери. Этот фактор вызван нарушением в половой Х-хромосоме. Именно в ней находится большинство генов, отвечающих за функционирование репродуктивной системы. При хромосомных аномалиях ПНЯ запрограммирована генетически [16].
На втором месте среди причин появления ПНЯ – негативное влияние факторов во время внутриутробного развития, когда у девочки идет закладка фолликулов (части яичника). Прием беременной женщиной антибиотиков и других препаратов, которые не рекомендуются при беременности, перенесенное простудное заболевание – все это накладывает отпечаток на репродуктивное здоровье девочки.
На третьем месте – оперативное вмешательство, например удаление яичника или его части (резекция яичника), операция по удалению кисты, образования или эндометриоидного очага на яичнике. После удаления одного яичника второй работает усиленно, но этого бывает недостаточно, впоследствии развивается ПНЯ [17].
На четвертом месте – аутоиммунные заболевания.
В организме вырабатываются антитела, которые разрушают яичники.
Большинство причин ПНЯ остаются неопределенными, однако, по оценкам, от 4 до 30% случаев имеют аутоиммунное происхождение. Поскольку яичники являются частой мишенью для аутоиммунных атак, всегда следует рассматривать аутоиммунную этиологию ПНЯ, особенно при наличии антиооцитарных антител, аутоиммунных заболеваний или лимфоцитарного оофорита в биопсии. ПНЯ может встречаться изолированно, но часто ассоциируется с другими аутоиммунными заболеваниями. Наиболее часто встречаются сопутствующие заболевания щитовидной железы, такие как гипотиреоз, тиреоидит Хашимото и болезнь Грейвса. Аутоиммунные заболевания надпочечников являются вторыми по частоте заболеваниями, связанными с ПНЯ. Среди женщин с сахарным диабетом ПНЯ развивается примерно у 2,5%. Кроме того, аутоиммунно-обусловленная ПНЯ может также быть частью аутоиммунного полигландулярного синдрома – состояния, при котором аутоиммунная активность вызывает специфическое поражение эндокринных органов. В своем наиболее частом проявлении (тип 3) аутоиммунный полигландулярный синдром связан с антителами к щитовидной железе типа Хашимото и имеет распространенность 10–40% [18].
Провоцирующими факторами могут стать перенесенные ранее инфекции, стрессы, экология и др. Также пагубно влияют на женскую репродуктивную систему алкоголь и курение [19].
Поддерживать функцию яичников очень важно для женщины. Контролировать данный процесс нужно с молодости. Строгая диета, малая масса тела, отказ от пищи – все это приводит к разрушению нормальной работы яичников, происходят их разрушение и снижение функции.
На 7-й неделе внутриутробного развития в организме девочки формируются яичники. В них в зависимости от генетики закладывается определенное количество яйцеклеток, обычно около 1 млн. Их число со временем сокращается, так как новые яйцеклетки после формирования резерва уже не образуются, а уже существующие выделяются в овуляции и постепенно отмирают. Этот естественный процесс приводит к тому, что к 45 годам их количество снижается. Поэтому данный возраст считают окончанием репродуктивного периода. Как только запас яйцеклеток иссякает, яичники перестают вырабатывать женские половые гормоны, ежемесячные менструации прекращаются и наступает климакс (менопауза) [20, 21].
Следовательно, ПНЯ развивается в связи со значительным снижением количества яйцеклеток до наступления или во время репродуктивного периода. Это может произойти из-за генетических нарушений, воздействия на яичники вредных факторов в течение жизни (токсины, алкоголь), операций и аутоиммунных заболеваний [14].
Таким образом, все вредные вещества, которые воздействуют на репродуктивную систему, напрямую обладают цитотоксическим действием, т.е. они разрушают клетки. В связи с этим количество яйцеклеток снижается гораздо раньше, а функция яичников ухудшается, следовательно, синтезируется меньше эстрогенов. Все это приводит к развитию ПНЯ [22].
Согласно исследованию 2023 г., опубликованному в журнале «Cell», такие факторы, как окислительный стресс (ОС), дисфункция митохондрий, хроническое воспаление и укорочение теломер, в совокупности способствуют старению яичников, напрямую влияя на женскую фертильность. Среди этих факторов митохондриальная дисфункция играет ключевую роль. К основным характеристикам старения яичников относятся снижение количества и качества ооцитов, колебания уровня гормонов и снижение функции гранулезных клеток. Исследования показали, что митохондрии влияют на фертильность, регулируя энергетический метаболизм клеток, усиливая ОС, вызывая повреждение митохондриальной ДНК и влияя на физиологическую функцию гранулезных клеток яичников, постепенно снижая овариальный резерв. Происходит снижение активности митохондрий на выработку энергии в ооцитах и гранулезных клетках, накопление активных форм кислорода (АФК) и концентрацию ионов кальция, что способствует процессу старения яичников [23].
Нормальные уровни АФК играют важную роль в регуляции роста фолликулов, ангиогенеза и синтеза половых гормонов в ткани яичников. Однако нарушение баланса между АФК и антиоксидантами может вызвать серьезные последствия ОС, а также снизить количество и качество ооцитов. Поэтому, по мнению ряда исследователей, существует взаимосвязь между ОС и ПНЯ, ученые выделяют потенциальные механизмы и методы, с помощью которых антиоксиданты могут улучшить ПНЯ посредством контроля уровня ОС. Было обнаружено, что ОС может опосредовать изменения в генетическом материале, сигнальных путях, факторах транскрипции и микросреде яичников, что приводит к аномальному апоптозу гранулезных клеток яичников и аномальному мейозу, а также снижению митохондриальной ДНК и другим изменениям, тем самым ускоряя процесс старения яичников. Однако мезенхимальные стволовые клетки, биологические ферменты и другие антиоксиданты могут замедлить развитие заболевания ПНЯ за счет снижения уровня АФК [11].
Патофизиологию ПНЯ сегодня рассматривают как некий континуум, представляющий собой постепенное угасание функции яичников.
Тем не менее этиологию ПНЯ не удается идентифицировать даже после полного обследования почти в 80% случаев [24].
Классификация
В настоящее время классификация ПНЯ представлена следующими формами:
• идиопатическая;
• аутоиммунная, включая аутоиммунный полигландулярный синдром (autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy – APECED) вследствие мутации гена AIRE;
• дефекты Х-хромосомы: синдром Шерешевского–Тернера, синдром ломкой Х-хромосомы (премутация гена FMR1 – это состояние, когда число CGG-повторов находится в пределах 55–200);
• моногенные мутации;
• ятрогенная: оперативное удаление яичников, химиотерапия, лучевая терапия;
• вирусные инфекции (краснуха, опоясывающий герпес, или herpes zoster, цитомегаловирусная инфекция) [25].
Кроме этого, выделяют моногенные мутации/синдромы:
• галактоземия – рецессивный тип наследования;
• блефарофимоз (blepharophimosis-ptosis-epicanthus inversus syndrome – BPES) – доминантный тип наследования, сцепленный с Х-хромосомой;
• псевдогипопаратиреоз (РНР, тип 1а) – отцовский импринтинг;
• лейкодистрофия (EIF2B) – аутосомно-рецессивный тип наследования.
К изолированным дефектам развития ПНЯ относятся:
• мутация гена-рецептора ФСГ (рецессивный тип наследования);
• мутация гена-рецептора лютеинизирующего гормона – ЛГ (рецессивный тип наследования) [8].
Выделяют типы наследования:
• мутация гена ингибина A;
• мутация гена фактора транскрипции forkhead (F0XL2), ассоциированная с BPES (доминантный тип наследования, сцепленный с Х-хромосомой) [20].
При идиопатическом, аутоиммунном и генетически обусловленном происхождении ПНЯ выделяют семейные и спорадические формы. Семейные формы составляют 4–31% случаев ПНЯ. Почти 50% случаев первичной аменореи – результат аномалий кариотипа; при манифестации ПНЯ в возрасте 30–39 лет по типу вторичной аменореи аномалии кариотипа исключительно редки [19]. Большинство женщин с кариотипом 46,XX и спонтанной ПНЯ имеют нормальный пубертат, менархе и не имеют каких-либо отклонений физического развития.
Несмотря на значительные успехи в области молекулярной биологии, до настоящего времени окончательно не установлены ведущие механизмы, приводящие к нефизиологическому снижению овариального резерва. По данным зарубежных и отечественных авторов, на долю сочетанных молекулярно-генетических и эпигенетических нарушений в структуре причин ПНЯ приходится от 25 до 63%. ПНЯ рассматривают как олигогенную патологию, хотя до настоящего времени ведущие гены-кандидаты четко не определены, их идентификация позволит разработать предикторы диагностики преждевременного старения яичников. Следует отметить, что в последние годы обсуждается роль не только генов, регулирующих внутриутробный и постнатальный фолликуло- и стероидогенез, скорость апоптоза примордиальных фолликулов, но и генов, вовлеченных в процессы репарации ДНК и механизмы мейотического деления (гены BRCA1/2) [26].
Клинические проявления
Триада, в которую входят аменорея, повышенный уровень ФСГ и дефицит эстрогенов, связана с долгосрочными негативными последствиями для здоровья, включая увеличение сердечно-сосудистых заболеваний (артериальной гипертензии), снижение минеральной плотности костной ткани (остеопороз), значительное снижение фертильности (бесплодие), психологический стресс, вульвовагинальную атрофию/генитоуринарный менопаузальный синдром, изменение частоты мочеиспускания, диспареунию, низкое либидо, неврологические эффекты, когнитивные нарушения, гипотиреоз, надпочечниковую недостаточность, синдром дефицита андрогенов, нарушение сна, упадок сил и общее сокращение продолжительности жизни [24, 27, 28]. В дальнейшем повышается риск развития сахарного диабета, ожирения [29, 30].
Первым проявлением патологии является нарушение менструального цикла (МЦ). На первом этапе задержки могут быть до 1–2 нед, а затем до 2–3 мес или полугода вплоть до полного прекращения месячных. На втором этапе синдрома появляются те же симптомы, что и при климактерическом синдроме, т.е. появляются приливы. Приливы выражаются в резком ощущении жара в области лица, шеи и груди в течение нескольких минут. Приливы могут появляться в любое время, в том числе и ночью, при этом возникают потливость, плохой сон, мигрень, раздражительность, тревожность и нарушение либидо [31, 32].
В дальнейшем появляются урогенитальные расстройства. При снижении эстрогенов истощается слизистая оболочка влагалища и мочевого пузыря, возникает ощущение сухости, повышается риск развития воспалительных явлений (кольпита, цистита, уретрита).
Во время полового акта возникают дискомфорт, ощущение сухости. Также из-за снижения уровня эстрогенов появляются морщины, снижается эластичность кожи, ногти истончаются, слоятся, волосы становятся тоньше, усиливается их выпадение [33].
Ряд авторов выделяют несколько стадий развития ПНЯ:
• I стадия – проявляются вегетативные и психоэмоциональные расстройства: приливы, плохой сон, депрессия, раздражительность, плаксивость, снижение либидо;
• II стадия – присоединяются обменные нарушения: прибавка массы тела, ожирение;
• III стадия – возникают сердечно-сосудистая патология, остеопороз, сахарный диабет [16].
При ПНЯ существенным образом страдает психосексуальное здоровье пациенток [34, 35].
К 40 годам встречается нарушение центральных и периферических компонентов сексуальной реакции, гипоактивное расстройство сексуального желания, а также развитие генитоуринарного менопаузального синдрома [36].
Более низкий, чем у здоровых сверстниц, уровень андрогенов хотя и не является самостоятельной причиной сексуальной дисфункции, однако усугубляет такие симптомы, как слабое сексуальное возбуждение, уменьшение количества естественной вагинальной смазки и диспареуния, у пациенток с ПНЯ [37, 38].
У женщины с ПНЯ в 2,8 раза выше риски сексуальной дисфункции (любых ее проявлений), чем у женщин с сохраненным ритмом менструации. Сексуальная дисфункция является одной из важнейших причин психоэмоциональных нарушений у женщин с ПНЯ. После постановки диагноза у пациенток данной группы также наблюдаются высокая частота депрессии, низкий уровень удовлетворенности жизни, формируются низкая самооценка и неуверенность в себе [39].
Одними из самых ранних проявлений ПНЯ являются потеря фертильности и связанные с этим психоэмоциональные нарушения: стресс, депрессия и заниженная самооценка [37].
Примечательно, что как минимум у 50% женщин после развития овариальной недостаточности в яичниках сохраняются фолликулы [2].
Вероятность того, что женщина при ПНЯ сможет забеременеть, все же есть, но небольшая. Так как ПНЯ – длительный процесс снижения репродуктивной функции, временами МЦ может возобновляться без какого-либо медицинского вмешательства. В этот период может произойти зачатие. Однако в дальнейшем возникает сложность в вынашивании ребенка [14].
При ультразвуковом исследовании (УЗИ) органов малого таза фолликулы с равной вероятностью обнаруживались у пациенток как менее, так и более чем через
6 лет после постановки диагноза ПНЯ [5].
Согласно данным литературы, единичные овуляторные циклы могут встречаться у женщин с ПНЯ с частотой до 25%, и от 5 до 10% пациенток могут забеременеть и в последующем родить ребенка. Большинство случаев спонтанных беременностей при этом регистрируются в течение 1 года после постановки диагноза [39].

Диагностика и дифференциальная диагностика
Преждевременное старение яичников во всех его формах незаметно развивается как бессимптомный процесс, ведущий к полной потере функции яичников, и в настоящее время диагностика ПНЯ проводится на относительно поздних стадиях. Надо учитывать, что использование средств гормональной контрацепции у девушек может маскировать это состояние в течение длительного времени [22].
Первичную диагностику осуществляет врач акушер-гинеколог. Он собирает жалобы, изучает историю болезни (анамнез). Для установления причины ПНЯ необходим анализ следующих анамнестических данных:
• ранее проведенные операции на яичниках, химиотерапия или лучевая терапия;
• симптомы анорексии, потери массы тела, неопределенной боли в животе, слабости, утомляемости, тяги к соли или повышенной пигментации кожи, которые предполагают наличие первичной недостаточности надпочечников;
• личный или семейный анамнез аутоиммунных заболеваний (аутоиммунный оофорит может возникать как часть полиэндокринного аутоиммунного синдрома);
• семейная история ПНЯ, т.к. примерно 10% случаев ПНЯ являются семейными;
• наличие в семейном анамнезе лиц с синдромом ломкой Х-хромосомы, умственной отсталости, задержки развития, паркинсонизма, сильного тремора, атаксии или деменции, поскольку примерно 6% случаев ПНЯ связаны с премутацией FMR1;
• глухота, поскольку семейная аутосомно-рецессивная спонтанная ПНЯ может быть связана с глухотой как часть синдрома Перро [16, 20].
Все это позволяет заподозрить ПНЯ. Пациентки с ПНЯ выглядят, как правило, старше своих лет: у них появляются преждевременные морщины, волосы становятся тонкими, безжизненными, тусклыми, ногти – ломкими.
Женщины с ПНЯ и нормальным кариотипом 46,XX в большинстве случаев имеют абсолютно физиологический пубертат и регулярный МЦ до момента появления первых признаков ПНЯ. Нарушение МЦ при ПНЯ является наиболее частым симптомом, но определенных строго патогномоничных характеристик нарушений МЦ, указывающих на возможность развития ПНЯ в будущем у женщин с кариотипом 46,XX, не существует. Варианты нарушений МЦ при ПНЯ варьируют в диапазоне от спонтанной аменореи до длительной олигоменореи [20].
Верификация ПНЯ основана, в первую очередь, на клинических проявлениях и уровне ФСГ (табл. 1):
• оккультная стадия – скрытая недостаточность яичников (снижение овариального резерва: необъяснимое бесплодие и нормальный базальный уровень ФСГ в сыворотке крови);
• биохимическая стадия – биохимическая недостаточность яичников: необъяснимое бесплодие и повышенный базальный уровень ФСГ в сыворотке крови;
• манифестная стадия – явная недостаточность яичников: нерегулярные МЦ и повышенный базальный уровень ФСГ в сыворотке крови; аменорея, постоянное бесплодие и полное истощение примордиальных фолликулов [40, 41].
Нормальные значения ФСГ могут быть неистинными для тех женщин с ПНЯ, у которых периодически восстанавливается функция яичников, поскольку ФСГ может снижаться до нормы для репродуктивного периода во время овуляторных циклов и увеличиваться до значений постменопаузального диапазона при олиго- или аменорее.
Подтверждение оккультной формы ПНЯ, которую также называют сниженным овариальным резервом при бесплодии, требует измерения не только уровня ФСГ и эстрадиола на 3-й день МЦ, но и концентрации АМГ и подсчета числа антральных фолликулов (при трансвагинальном УЗИ). ФСГ, измеренный на 3-й день цикла, >10–15 МЕ/л при одновременном уровне эстрадиола в сыворотке ≥80 пг/мл (294 пмоль/л) свидетельствует о более низкой фертильности и оккультной ПНЯ (см. табл. 1) [42].
При повышении уровня эстрадиола >100 пг/мл, измеренного одновременно с ФСГ, последний может находиться в диапазоне низких значений даже у женщин с аменореей из-за спонтанного развития какого-то единственного фолликула, что может ввести в заблуждение и диагноз ПНЯ не будет установлен [20].
Поскольку АМГ вырабатывается только в небольших фолликулах яичников, уровень этого гормона в крови используется для диагностики сниженного овариального резерва. Нормальный уровень составляет от 1,5 до 4,0 нг/мл. Очень низкий уровень указывает на сниженный овариальный резерв. Репродуктивные эндокринологи используют уровень АМГ для прогнозирования того, какие женщины могут плохо реагировать на препараты для лечения бесплодия и в целом для каких пар лечение бесплодия менее эффективно. Анализ крови на АМГ можно проводить в любой момент МЦ. Новые, более чувствительные тесты на АМГ могут помочь врачам диагностировать раннюю менопаузу.
Присутствие приливов и/или сухости во влагалище указывает на ПНЯ, поскольку данные симптомы не характерны для женщин с иными заболеваниями, сопровождающимися нарушением МЦ. Отсутствие этих симптомов не исключает диагноза ПНЯ из-за возможности временного спонтанного восстановления функции яичников у женщин с ПНЯ. Прогестероновая проба не заменяет лабораторного обследования, поскольку периодическая выработка эстрадиола может привести к кровотечению отмены после приема прогестерона, что не исключает диагноз ПНЯ [16].
Кариотипирование следует проводить как часть базового обследования всех женщин с ПНЯ. В целом у пациенток, у которых до развития ПНЯ было нормальное половое созревание, аномальный кариотип объясняет нарушение в небольшом проценте случаев. У женщин с аномалиями Х-хромосомы ПНЯ развивается после рождения здоровых детей. Генетическое консультирование и тестирование на премутацию FMR1 показано женщинам с семейным анамнезом первичной недостаточности яичников или при наличии умственной отсталости, тремора или атаксии. Кариотип определяется, если возраст женщины с подтвержденной недостаточностью яичников или дисфункцией яичников моложе 35 лет или при подозрении на премутацию FMR1 [43].
Если кариотип нормальный или есть подозрение на аутоиммунную причину, проводятся анализы на сывороточные антитела к надпочечникам и антитела к
21-гидроксилазе (аутоантитела к надпочечникам); табл. 2 [44].

Тесты на антиовариальные антитела не рекомендуются из-за недостаточной точности тестирования.
Если подозревается аутоиммунная причина, также проводятся анализы для проверки на аутоиммунный гипотиреоз; они включают измерение уровня тиреотропного гормона (ТТГ), тироксина (Т4), а также антител к тиреопероксидазе и тиреоглобулину (см. табл. 2) [6].
При подозрении на недостаточность надпочечников подтвердить диагноз можно с помощью измерения утреннего уровня кортизола или теста стимуляции адренокортикотропного гормона [16, 19, 20].
В отдельных ситуациях необходимо в объем обследования включить определение хорионического гонадотропина, пролактина, ЛГ.
Необходимо провести другие анализы на предмет аутоиммунной дисфункции, в том числе общий анализ крови с лейкоцитарной формулой, определением скорости оседания эритроцитов, а также измерением антинуклеарных антител и ревматоидного фактора. Биопсия яичников для выявления аутоиммунного оофорита не рекомендуется.
Минеральная плотность костной ткани измеряется, если у женщины есть симптомы или признаки дефицита эстрогена.
Оценка минеральной плотности костной ткани с помощью двухэнергетической рентгеновской абсорбциометрии необходима женщинам с ПНЯ, так как ПНЯ является причиной развития остеопороза. У женщин с ПНЯ чаще возникают остеопоротические переломы [45].
К рутинным методам обследования относится УЗИ органов малого таза.
Современные аспекты лечебных мероприятий
Дальнейшее ведение женщин с диагнозом ПНЯ происходит с учетом широкого спектра важных аспектов здоровья, включающих эмоциональное здоровье, фертильность, сексуальную функцию, здоровье костей, сердечно-сосудистой системы и риск развития недостаточности надпочечников, а также, что наиболее важно, терапия должна включать психосоциальную поддержку женщин, столкнувшихся с этим тяжелым диагнозом.
В качестве первой линии лечения рекомендуется заместительная гормональная терапия (ЗГТ) с помощью половых стероидов (эстрогены можно назначать перорально или трансдермально), которая оказывает благотворное влияние как на контроль симптомов, так и на минимизацию долгосрочных побочных эффектов, связанных с этим состоянием. Комбинированные гормональные контрацептивы предотвращают овуляцию и беременность более надежно, чем ЗГТ эстрогенами; несмотря на лишь незначительные шансы на спонтанную беременность у женщин с ПНЯ, это имеет решающее значение для тех, кто считает предотвращение беременности приоритетом. Лечение всех женщин с ПНЯ должно продолжаться до достижения среднего возраста естественной менопаузы (50–51 год) [1, 46]. Наконец, учитывая трудности, с которыми могут столкнуться молодые женщины, справляясь с физическими, репродуктивными и социальными последствиями первичной недостаточности яичников, крайне важно комплексное лонгитюдное ведение этого состояния [47].
ЗГТ показана для восстановления нормального уровня половых гормонов до пременопаузального уровня и профилактики хронических заболеваний, таких как остеопороз и сердечно-сосудистые заболевания [46].
Помимо ЗГТ для профилактики остеопороза рекомендуются физические упражнения, здоровое питание, прием препаратов кальция и витамина D, отказ от курения.
Женщинам с Y-хромосомой требуется двусторонняя овариэктомия путем лапаротомии или лапароскопии, поскольку у них повышен риск развития рака зародышевых клеток яичников [47].
Несмотря на то, что ЗГТ улучшает симптоматику и долгосрочные последствия для здоровья, она не может лечить бесплодие, которое было описано как наиболее разрушительный аспект заболевания.
Вспомогательные репродуктивные технологии дают надежду женщинам с ПНЯ иметь собственного ребенка. Компенсация гормонального дефицита важна для устранения неприятных ощущений, связанных с ПНЯ, а также для снижения риска развития поздних эффектов. Из-за истощения фолликулов в яичниках донорство яйцеклеток является единственным шансом на беременность. Выяснение генетической и молекулярной основы ПНЯ имеет важное значение. Благодаря этому повышается вероятность прогнозирования возраста, в котором у женщин с риском развития ПНЯ наступит преждевременная менопауза. Женщинам, имеющим определенные нарушения, приводящие к ПНЯ, может быть предложен вариант криоконсервации ооцитов с последующим размораживанием и использованием во вспомогательных репродуктивных технологиях в соответствующем возрасте [22].
Для женщин, желающих забеременеть, одним из вариантов является экстракорпоральное оплодотворение донорских ооцитов с добавлением экзогенных эстрогенов и прогестагенов, которые позволяют эндометрию поддерживать перенесенный эмбрион. Возраст донора ооцитов важнее возраста реципиента. Этот метод довольно успешен, но даже без него некоторые женщины с диагностированной ПНЯ беременеют. Доказано, что ни один метод лечения не повышает частоту овуляции или не восстанавливает фертильность у женщин с первичной недостаточностью яичников. Однако в настоящее время изучается возможность восстановления фертильности [48, 49].
Примечательно, что по крайней мере у 50% женщин после развития недостаточности яичников в них остаются фолликулы [2], которые можно реактивировать для получения компетентных ооцитов, что подтверждается активацией спящих фолликулов in vitro.
В ряде публикаций обсуждаются механизмы и клинические данные, относящиеся к новым терапевтическим стратегиям с использованием фрагментации яичников, стволовых клеток или богатой тромбоцитами плазмы для восстановления функции яичников у женщин старшего возраста (>38 лет). Методы реактивации фолликулов демонстрируют многообещающие экспериментальные результаты и были успешными в некоторых случаях, когда была установлена ПНЯ. Помимо этого, обсуждается вопрос о том, как новые знания о биологических механизмах, регулирующих динамику фолликулов и компетентность ооцитов, могут помочь в устранении повреждений яичников, поскольку ни один метод не влияет на качество ооцитов. Дополнительные исследования должны быть направлены на увеличение количества и улучшение качества фолликулов. Наконец, существует небольшая, но важная группа женщин, у которых нет остаточных фолликулов и которым требуется получение ооцитов из стволовых клеток [50–53].
Понимание влияния факторов окружающей среды на ПНЯ и старение яичников крайне важно в контексте общественного и клинического здравоохранения. Выявляя факторы риска, медицинские работники могут разрабатывать целенаправленные и стратегические планы профилактики и вмешательства. Более того, эти знания могут способствовать укреплению репродуктивного здоровья и минимизации воздействия вредных факторов окружающей среды [14, 54].
Вклад авторов: Т.Ю. Пестрикова – концепция и дизайн исследования, написание текста; Т.И. Юрасова – сбор и обработка материала.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Authors' contributions: T.Yu. Pestrikova – study concept and design, writing the text; T.I. Yurasova – material collection, material processing.
Conflict of interests. The authors declare that there is not conflict of interests.
Funding. The work was carried out without sponsorship.
Информация об авторах
Information about the authors
Пестрикова Татьяна Юрьевна – д-р мед. наук, проф., зав. каф. акушерства и гинекологии ФГБОУ ВО ДВГМУ. E-mail: typ50@rambler.ru; ORCID: 0000-0003-0219-3400
Tatyana Yu. Pestrikova – Dr. Sci. (Med.), Professor, Far Eastern State Medical University. E-mail: typ50@rambler.ru; ORCID: 0000-0003-0219-3400
Юрасова Татьяна Игоревна – аспирант, каф. акушерства и гинекологии ФГБОУ ВО ДВГМУ. E-mail: Pro100Tata@ yandex.ru; ORCID: 0000-0003-0187-9937
Tatyana I. Yurasova – postgraduate student, Far Eastern State Medical University. Е-mail: Pro100Tata@yandex.ru; ORCID: 0000-0003-0187-9937
Поступила в редакцию: 21.08.2025
Поступила после рецензирования: 29.08.2025
Принята к публикации: 04.09.2025
Received: 21.08.2025
Revised: 29.08.2025
Accepted: 04.09.2025
Список исп. литературыСкрыть список1. Hamoda H, Sharma A. Premature ovarian insufficiency, early menopause, and induced menopause. Best Pract Res Clin Endocrinol Metab 2024;38(1):101823. DOI: 10.1016/j.beem.2023.101823
2. Moustaki M, Kontogeorgi A, Tsangkalova G et al. Biological therapies for premature ovarian insufficiency: what is the evidence? Front Reprod Health 2023;(5):1194575. DOI: 10.3389/frph.2023.1194575
3. European IVF-monitoring Consortium (EIM), European Society of Human Reproduction and Embryology (ESHRE), Calhaz Jorge C, De Geyter C, Kupka MS et al. Assisted reproductive technology in Europe, 2013: results generated from European registers by ESHRE. Hum Reprod 2017;32(10):1957-73.
4. Pastuszek E, Lukaszuk A, Kunicki M et al. New AMH assay allows rapid point of care measurements of ovarian reserve. Gynecol Endocrinol 2017;33(8):638-43. DOI: 10.1080/09513590.2017.1306735
5. Lambrinoudaki I, Paschou SA, Lumsden MA et al. Premature ovarian insufficiency: a toolkit for the primary care physician. Maturitas 2021;(147):53-63. DOI: 10.1016/j.maturitas.2020.11.004
6. Kirshenbaum M, Orvieto R. Premature ovarian insufficiency (POI) and autoimmunity-an update appraisal. J Assist Reprod Genet 2019;36(11):2207-15.
7. Li M, Zhu Y, Wei J et al. The global prevalence of premature ovarian insufficiency: a systematic review and meta-analysis. Climacteric. 2023 Apr;26(2):95-102. DOI: 10.1080/13697137.2022.2153033. Epub 2022 Dec 15. PMID: 36519275.
8. Rudnicka E, Kruszewska J, Klicka K et al. Premature ovarian insufficiency – aetiopathology, epidemiology, and diagnostic evaluation. Menopausal Rev 2018;17(3):105-8. DOI: 10.5114/pm.2018.78550
9. Mishra GD, Davies MC, Hillman S et al. Optimising health after early menopause. Lancet 2024;403(10430):958-68. DOI: 10.1016/S0140-6736(23)02800-3
10. Салимова М.Д., Наделяева Я.Г. Преждевременная недостаточность яичников в популяционной выборке женщин Прибайкальского региона: распространенность и возрастные особенности. Acta biomedica scientifica. 2020;5(6):37-41. DOI: 10.29413/ABS. 2020-5.6.4
Salimova M.D., Nadelyaeva Ya.G. Premature ovarian failure in a population sample of women from the Baikal region: prevalence and age characteristics. Acta biomedica scientifica. 2020;5(6):37-41. DOI: 10.29413/ABS.2020-5.6.4 (in Russian).
11. Shi YQ, Zhu XT, Zhang SN et al. Premature ovarian insufficiency: a review on the role of oxidative stress and the application of antioxidants. Front Endocrinol (Lausanne) 2023;(14):1172481. DOI: 10.3389/fendo. 2023.1172481
12. Golezar S, Ramezani Tehrani F, Khazaei S et al. The global prevalence of primary ovarian insufficiency and early menopause: a meta-analysis. Climacteric 2019;22(4):403-11.
13. Петров Ю.А., Блесманович А.Е., Алехина А.Г. Преждевременная овариальная недостаточность (обзор литературы). Таврический медико-биологический вестник. 2018;21(2-2):207-12.
Petrov Yu.A., Blesmanovich A.E., Alekhina A.G. Premature ovarian failure (literature review). Tavrichesky Medical and Biological Bulletin. 2018; 21(2-2):207-12 (in Russian).
14. Evangelinakis N, Geladari EV, Geladari CV et al. The influence of environmental factors on premature ovarian insufficiency and ovarian aging. Maturitas 2024;(179):107871. DOI: 10.1016/j.maturitas.2023. 107871
15. Nie L, Wang X, Wang S et al. Genetic insights into the complexity of premature ovarian insufficiency. Reprod Biol Endocrinol 2024;(22):94. DOI: 10.1186/s12958-024-01254-2
16. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. Гинекологическая эндокринология. 6-е издание. М.: МЕДпресс-информ, 2017.
Serov V.N., Prilepskaya V.N., Ovsyannikova T.V. Gynecological endocrinology. 6th edition. Moscow: MEDpress-inform, 2017 (in Russian).
17. Руководство по репродуктивной медицине. Под ред. Б. Карра, Р. Блэкуэлла, Р. Азиза. М.: Практика, 2015.
Manual of Reproductive Medicine. Edited by B. Carr, R. Blackwell, R. Aziz. Moscow: Praktika, 2015 (in Russian).
18. Szeliga A, Calik-Ksepka A, Maciejewska-Jeske M et al. Autoimmune Diseases in Patients with Premature Ovarian Insufficiency-Our Current State of Knowledge. Int J Mol Sci 2021;22(5):2594. DOI: 10.3390/ijms22052594
19. Радзинский В.Е., Хамошина М.Б., Раеская О.А. и др. Очерки эндокринной гинекологии. Под ред. В.Е. Радзинского. М.: Редакция журнала StatusPraesens, 2023.
Radzinsky V.E., Khamoshina M.B., Raeskaya O.A. et al. Essays on endocrine gynecology. Ed. by V.E. Radzinsky. Moscow: Editorial office of the journal StatusPraesens, 2023 (in Russian).
20. Фон Вольфф M., Штуге П. Гинекологическая эндокринология и репродуктивная медицина. Пер. с нем. под общ. ред. Е.Н. Андреевой. М.: МЕДпресс-информ, 2018.
Von Wolff M., Stuge P. Gynecological endocrinology and reproductive medicine /; translated from German under the general editorship of E.N. Andreeva. Moscow: MEDpress-inform, 2018 (in Russian).
21. Пестрикова Т.Ю., Юрасова Е.А., Юрасов И.В. Репродуктивное здоровье: монография. М.: РУСАЙНС, 2025.
Pestrikova T.Yu., Yurasova E.A., Yurasov I.V. Reproductive health: monograph. Moscow: RUSAINS, 2025 (in Russian).
22. Адамян Л.В., Сибирская Е.В., Щерина А.В. Патогенетические аспекты преждевременной недостаточности яичников. Проблемы репродукции. 2021;27(1):6-12.
Adamyan L.V., Sibirskaya E.V., Shcherina A.V. Pathogenetic aspects of premature ovarian failure. Russian Journal of Human Reproduction. 2021;27(1):6-12. DOI: 10.17116/repro2021270116 (in Russian).
23. Zhang X, Zhang L, Xiang W. The impact of mitochondrial dysfunction on ovarian aging. J Transl Med 2025;23(1):211. DOI: 10.1186/s12967-025-06223-w
24. Webber L, Davies M, Anderson R et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod 2016;31(5):926-37. DOI: 10.1093/humrep/dew027
25. Pinkerton JV, Goje O. Premature Menopause; Premature Ovarian Failure; Premature Ovarian Insufficiency; Hypergonadotropic Hypogonadism. MSD Manual. 2019.
26. Рштуни С.Д., Чернуха Г.Е., Донников А.Е. и др. Частота преждевременной недостаточности яичников и ранней менопаузы у носительниц патогенных вариантов BRCA1. Гинекология. 2022;24(5):374-9. DOI: 10.26442/20795696.2022.5.201688
Rshtuni S.D., Chernukha G.E., Donnikov A.E. et al. Frequency of premature ovarian failure and early menopause in carriers of pathogenic BRCA1 variants. Gynecology 2022;24(5):374-9. DOI: 10.26442/20795696.2022.5.201688 (in Russian).
27. Armeni E, Paschou SA, Goulis DG, Lambrinoudaki I. Hormone therapy regimens for managing the menopause and premature ovarian insufficiency. Best Pract Res Clin Endocrinol Metab 2021;35(6):101561. DOI: 10.1016/j.beem.2021.101561
28. Bachelot A, Nicolas C, Gricourt S et al. Poor Compliance to Hormone Therapy and Decreased Bone Mineral Density in Women with Premature Ovarian Insufficiency. PLoS One 2016;11(12):e0164638. DOI: 10.1371/journal.pone.0164638
29. Hurtado MD, Saadedine M, Kapoor E et al. Weight Gain in Midlife Women. Curr Obes Rep 2024;13(2):352-63.
30. Saadedine M, Faubion SS, Grach SL et al. Association between obesity and female sexual dysfunction: a review. Sex Med Rev 2024;12(2):154-63.
31. Kapoor E. Primary ovarian insufficiency: a toolkit for the busy clinician. Menopause 2024;31(1):65-7.
32. Faubion SS, Ghaith S, Kling JM et al. Migraine and sleep quality: does the association change in midlife women? Menopause 2023;30(4):376-82.
33. Балан В.Е., Тихомирова Е.В., Журавель А.С. и др. Новые тенденции в современной менопаузальной гормональной терапии. Гинекология. 2021;23(1):33-6. DOI: 10.26442/20795696.2021.1.200635
Balan V.E., Tikhomirova E.V., Zhuravel A.S. et al. New trends in modern menopausal hormone therapy. Gynecology. 2021;23(1):33-6. DOI: 10.26442/20795696.2021.1.200635 (in Russian).
34. Колпакова Т.Г., Кочергина М.С., Аверкова В.Г. и др. Психическое здоровье и сексуальная функция у женщин с преждевременной овариальной недостаточностью. Акушерство и гинекология. 2024;(11):34-9. DOI: 10.18565/aig.2024.188
Kolpakova T.G., Kochergina M.S., Averkova V.G. et al. Mental health and sexual function in women with premature ovarian failure. Obstetrics and Gynecology. 2024;(11):34-9. DOI: 10.18565/aig.2024.188 (in Russian).
35. Panay N, Anderson RA, Nappi RE et al. Premature ovarian insufficiency: an International Menopause Society White Paper. Climacteric 2020;23(5):426-46. DOI: 10.1080/13697137.2020.1804547
36. Nappi RE, Cucinella L, Martini E et al. Sexuality in premature ovarian insufficiency. Climacteric 2019;(22):289-95. DOI: 10.1080/13697137.2019.1575356
37. Аверкова В.Г., Юренева С.В. Оценка качества жизни пациенток с преждевременной недостаточностью яичников, принимающих заместительную гормональную терапию. Акушерство и гинекология. 2023;(5):50-8. DOI: 10.18565/aig.2023.16
Averkova V.G., Yureneva S.V. Assessment of the quality of life of patients with premature ovarian failure taking hormone replacement therapy. Obstetrics and Gynecology. 2023;(5):50-8. DOI: 10.18565/aig.2023.16 (in Russian).
38. Maciejewska-Jeske M, Szeliga A, Mięczekalski B. Consequences of premature ovarian failure for women's sexual health. Menopausal Rev 2018;17(3):127-30. DOI: 10.5114/pm.2018.78557
39. Аверкова В.Г., Донников А.Е. Преждевременная недостаточность яичников: последствия для здоровья и стратегии заместительной гормональной терапии. Доктор.Ру. 2023;22(5):49-53. DOI: 10.31550/1727-2378-2023-22-5-49-53
Averkova V.G., Donnikov A.E. Premature ovarian failure: health consequences and hormone replacement therapy strategies. Doctor.Ru. 2023;22(5):49-53. DOI: 10.31550/1727-2378-2023-22-5-49-53 (in Russian).
40. Марченко Л.А., Машаева Р.И. Клинико-лабораторные критерии оккультной формы преждевременной недостаточности яичников. Гинекология. 2018;20(6):73-6. DOI: 10.26442/20795696.2018.6.180069
Marchenko L.A., Mashaeva R.I. Clinical and laboratory criteria of the occult form of premature ovarian failure. Gynecology. 2018;20(6):73-6. DOI: 10.26442/20795696.2018.6.180069 (in Russian).
41. Rahman R, Panay N. Diagnosis and management of premature ovarian insufficiency. Best Pract Res Clin Endocrinol Metab 2021;35(6):101600. DOI: 10.1016/j.beem.2021.101600
42. ESHRE, ASRM, CREWHIRL and IMS Guideline Group on POI; Panay N, Anderson RA, Bennie A et al. Evidence-based guideline: premature ovarian insufficiency. Climacteric 2024;27(6):510-20. DOI: 10.1080/13697137.2024.2423213
43. Кумыкова З.Х., Батырова З.К., Уварова Е.В. Преждевременная недостаточность яичников в раннем репродуктивном возрасте: современные аспекты диагностики и ведения. Репродуктивное здоровье детей и подростков. 2019;15(4):53-60. DOI: 10.24411/1816-2134-2019-14006
Kumykova Z.Kh., Batyrova Z.K., Uvarova E.V. Premature ovarian failure in early reproductive age: modern aspects of diagnosis and management. Reproductive health of children and adolescents. 2019;15(4):53-60. DOI: 10.24411/1816-2134-2019-14006 (in Russian).
44. Нуралиева Н.Ф., Юкина М.Ю., Трошина Е.А. и др. Аутоантитела к 21-гидроксилазе как диагностический маркер первичной надпочечниковой недостаточности аутоиммунного генеза, в том числе на потенциальной и латентной стадиях. Альманах клинической медицины. 2020;48(7):445-58. DOI: 10.18786/2072-0505-2020-48-023
Nuralieva N.F., Yukina M.Yu., Troshina E.A. et al. Autoantibodies to 21-hydroxylase as a diagnostic marker of primary adrenal insufficiency of autoimmune genesis, including at potential and latent stages. Almanac of Clinical Medicine. 2020;48(7):445-58. DOI: 10.18786/2072-0505-2020-48-023 (in Russian).
45. Хайдарова Ф., Фахрутдинова С. Особенности минеральной плотности костной ткани при преждевременной недостаточности яичников. Вестник врача. 2018;1(3):42-7.
Khaidarova F., Fakhrutdinova S. Features of bone mineral density in premature ovarian failure. Doctor's Bulletin. 2018;1(3):42-7 (in Russian).
46. Nash Z, Davies M. Premature ovarian insufficiency. BMJ 2024;(384):e077469. DOI: 10.1136/bmj-2023-077469
47. Committee Opinion No. 698: Hormone Therapy in Primary Ovarian Insufficiency. Obstet Gynecol 2017;129(5):e134-e141. DOI: 10.1097/AOG.0000000000002044
48. Hsu CC, Hsu L, Hsu I et al. Live birth in woman with premature ovarian insufficiency receiving ovarian administration of platelet-rich plasma (PRP) in combination with gonadotropin: a case report. Front Endocrinol (Lausanne) 2020;(11):50. DOI: 10.3389/fendo.2020.00050
49. Cakiroglu Y, Saltik A, Yuceturk A et al. Effects of intraovarian injection of autologous platelet rich plasma on ovarian reserve and IVF outcome parameters in women with primary ovarian insufficiency. Aging 2020;12(11):10211-22. DOI: 10.18632/aging.103403
50. Pellicer N, Cozzolino M, Diaz-García C et al. Ovarian rescue in women with premature ovarian insufficiency: facts and fiction. Reprod Biomed Online 2023;46(3):543-65. DOI: 10.1016/j.rbmo.2022.12.011
51. Sheshpari S, Shahnazi M, Mobarak H et al. Ovarian function and reproductive outcome after ovarian tissue transplantation: a systematic review. J Transl Med 2019;(17):396. DOI: 10.1186/s12967-019-02149-2
52. Tsiligiannis S, Panay N, Stevenson JC. Premature Ovarian Insufficiency and Long-Term Health Consequences. Curr Vasc Pharmacol 2019;17(6):604-9. DOI: 10.2174/1570161117666190122101611
53. Laven JSE, Louwers YV. Can we predict menopause and premature ovarian insufficiency? Fertil Steril 2024;121(5):737-41. DOI: 10.1016/j.fertnstert.2024.02.029
54. Stuenkel CA, Gompel A, Davis SR et al. Approach to the patient with new-onset secondary amenorrhea: Is this primary ovarian insufficiency? J Clin Endocrinol Metab 2022;107(3):825-35. DOI: 10.1210/clinem/dgab766
30 декабря 2025
Количество просмотров: 67

