Клинический разбор в общей медицине №12 2025
1 Lopatkin Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Radiological Centre, Moscow, Russia;
2 Bayer, Moscow, Russia
kirandja@ya.ru
Abstract
The population of patients with metastatic hormone-sensitive prostate cancer (mHSPC) is an extremely heterogeneous patient cohort. The disease course prognosis depends on many clinical factors, including the disease manifestation stage. The paper provides a clinical case of the long-term multimodal treatment of a patient with metachronous mHSPC and the relapse after previous radical prostatectomy with the extended pelvic lymphadenectomy. Considering high volume of metastatic lesions, the patient was offered the therapy intensifying tactics: darolutamide combined with docetaxel and drug androgen deprivation therapy (ADT). The patient completed all 6 chemotherapy cycles and continued treatment using the darolutamide + ADT regimen until disease progression or development of unacceptable toxicity. During the entire follow-up period the patient noted no adverse events associated with darolutamide therapy. A significant clinical effect, a decrease in the contrast agent accumulation index in the previously metabolically active metastatic foci, as well as a biochemical response to reduce the level of prostate-specific antigen to undetectable values are observed.
Keywords: metastatic hormone-sensitive prostate cancer, ARASENS, darolutamide, docetaxel, androgen deprivation therapy.
For citation: Nyushko K.M., Novichkov N.D. Strategy to intensify treatment of patients with metastatic hormone-sensitive prostate cancer: successful experience of using the triplet therapy regimen exemplified by the case reporty. Clinical review for general practice. 2025; 6 (12): 17–21 (In Russ.). DOI: 10.47407/kr2025.6.12.00726
Введение
Рак предстательной железы (РПЖ) в настоящее время является наиболее часто диагностируемым злокачественным новообразованием у мужской части населения Российской Федерации. Согласно официальной статистике за 2024 г. выявлено 59 405 новых эпизодов данного заболевания [1]. Уровень 5-летней общей выживаемости при локализованной форме патологии близок к 100%, тогда как при опухолевых процессах, характеризующихся местной экстенсивностью роста и наличием отдаленных метастазов, он значительно ухудшается, достигая лишь порядка 30–34% [2].
Диагноз РПЖ верифицируется преимущественно у пациентов с локализованными и местно-распространенными формами болезни, когда приоритетной стратегией лечения становится хирургическое вмешательство или лучевая терапия, направленные на получение радикально-долговременного исхода [3]. Тем не менее у значительного числа пациентов (около 15–20%) РПЖ определяется сразу в виде синхронного или de novo метастатического варианта заболевания [1, 3]. К категории пациентов с метастатическим течением РПЖ также относятся пациенты, перенесшие радикальное лечение, у которых впоследствии развивается прогрессия заболевания, проявляющаяся биохимическим и клиническими признаками рецидива (у 18–22%). Данную когорту пациентов принято относить к синхронному или рецидиву метастатического РПЖ (мРПЖ) [4].
мРПЖ характеризуется сохраненной чувствительностью к лечению, направленному на подавление выработки андрогенов, включая билатеральную орхиэктомию или медикаментозную андроген-депривационную терапию (АДТ), и традиционно классифицируется как гормоночувствительная форма метастатического рака предстательной железы (мГЧРПЖ) [5, 6]. У преобладающего числа пациентов данная патология спустя период от двух до трех лет эволюционирует в резистентную к кастрации метастатическую форму заболевания (мКРРПЖ), отличающуюся негативным прогностическим профилем и значительным сокращением показателя медианной общей выживаемости [7].
Это обстоятельство подчеркивает важность выбора терапевтического подхода уже на этапе 1-й линии терапии, которое будет направлено не только на увеличение продолжительности жизни пациентов, но и увеличивать период времени до прогрессирования в мКРРПЖ, а также минимизировать риски нежелательных побочных эффектов [8]. Выбор оптимальных схем терапии при лечении пациентов с мГЧРПЖ базируется на данных доказательной медицины, полученных в ходе крупных международных мультицентровых рандомизированных клинических исследований III фазы [2]. Среди стандартных комбинаторных схем применяются следующие методы:
– двухкомпонентные комбинации, состоящие из блокаторов ферментов синтеза андрогенов (абиратерон в комбинации с кортикостероидами) или селективных антиандрогенов II поколения (апалутамид, энзалутамид) [2, 8–12];
– трехкомпонентные режимы, предполагающие добавление к цитостатической химиотерапии (доцетаксел) одного из перечисленных препаратов – даролутамида (иАР II поколения) или абиратерона на фоне продолжающейся адъювантной терапии (АДТ) [8, 9].
Следует отметить, что комбинирование доцетаксела с одной лишь АДТ оправдано только при наличии четких противопоказаний к современным трехкомпонентным схемам, поскольку такие подходы уступают по показателям эффективности и безопасности трехкомпонентным режимам [7, 12]. Монотерапия АДТ должна применяться строго в случаях категоричных противопоказаний к указанным выше комбинациям или добровольного отказа пациента от предложенной мультимодальной терапии [3, 8, 12].
 Описанное клиническое наблюдение иллюстрирует клинические возможности интенсификации терапии у пациента с мГЧРПЖ в виде назначения триплетной схемы с применением ингибитора андрогеновых рецепторов II поколения – даролутамида и цитостатика – доцетаксела на фоне продолжающейся АДТ.
Описанное клиническое наблюдение иллюстрирует клинические возможности интенсификации терапии у пациента с мГЧРПЖ в виде назначения триплетной схемы с применением ингибитора андрогеновых рецепторов II поколения – даролутамида и цитостатика – доцетаксела на фоне продолжающейся АДТ.
Клинический случай
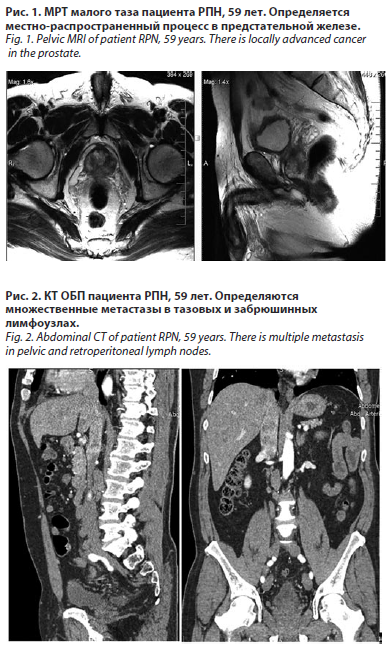
Пациент РПН, на момент установления диагноза 59 лет. С подозрением на РПЖ на основе повышения уровня простатспецифического антигена (ПСА) до 119,4 нг/мл в сентябре 2020 г. была проведена трансректальная мультифокальная биопсия предстательной железы, которая подтвердила наличие аденокарциномы с градиентом дифференцировки по шкале Глисона 4+5=9 баллов. Данные мультипараметрической магнитно-резонансной томографии (МП-МРТ), а также компьютерной томографии органов грудной и брюшной полости (КТ ОБП) свидетельствовали о наличии локального экстракапсулярного распространения первичной опухоли (рис. 1). Компьютерная томография органов грудной клетки, брюшной полости установила наличие метастазов в регионарных лимфоузлах размерами до 2,5 см (рис. 2).
По данным остеосцинтиграфии от сентября 2017 г. данных, подтверждающих наличие метастатического поражения костей, не определялось.
Исходя из полученных данных проведенной диагностики, клинико-морфологическим консилиумом выставлена финальная классификация РПЖ по системе TNM (cT3bN1M1а, метастазы в тазовых, забрюшинных лимфоузлах). Сопутствующий анамнез пациента не отягощен. Прием других лекарственных препаратов на постоянной основе отрицает.
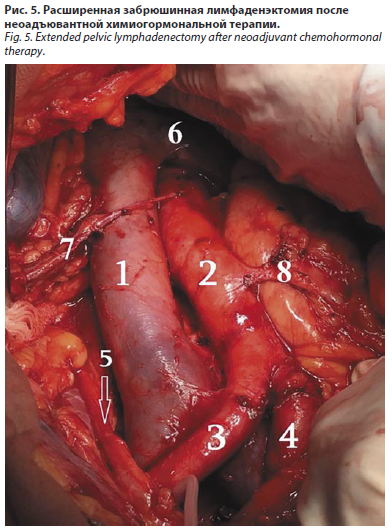
С учетом молодого возраста пациента, удовлетворительного соматического статуса и отсутствия костных очагов поражения, больному предложено принять участие во внутреннем протоколе клинического исследования, согласно которому в рамках экспериментального подхода на первом этапе пациент получил 6 курсов комбинированной химиогормональной терапии с использованием антагонистов рилизинг-гормона лютеинизирующего гормона – ЛГРГ (дегареликс) в комбинации с доцетакселом в дозе 75 мг/м2 внутривенно капельно каждые 3 нед. Больной информирован о стандартных опциях и подходах к терапии заболевания и подписал информированное согласие. Пациент получил 6 курсов комбинированной химиогормональной терапии, на фоне которой отмечена выраженная положительная динамика: регресс метастазов в тазовых и забрюшинных лимфоузлах, уменьшение размеров опухоли в предстательной железе, редукция уровня ПСА до 0,4 нг/мл. На втором этапе мультимодальной терапии, предложенной в рамках внутреннего исследовательского протокола, больному рекомендовано проведение хирургического лечения в объеме радикальной простатэктомии, расширенной тазовой и парааортальной лимфаденэктомии, больной информирован о стандартных опциях терапии и подписал информированное согласие (рис. 3–5).
 По результатам планового морфологического исследования у пациента подтверждено наличие аденокарциномы предстательной железы с метастазами в 8 из 64 удаленных лимфоузлов, с наличием лекарственного патоморфоза 2-й степени. В рамках дизайна внутреннего исследовательского протокола больной оставлен под строгим динамическим наблюдением без дополнительной адъювантной системной лекарственной терапии после операции, рекомендован контроль ПСА ежемесячно, больной подписал информированное согласие. Через месяц после операции уровень ПСА составил 0,003 нг/мл. Больной наблюдался, регулярно контролируя уровень ПСА. Через 2 года при ежемесячном контроле уровень ПСА составил 0,02 нг/мл. В июле 2023 г. (через 3 года после проведенного комплексного лечения) уровень ПСА составлял 0,01 нг/мл, проведенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) с простат-специфическим мембранным антигеном (ПСМА) не выявила очагов повышенного накопления радиофармпрепарата (РФП).
По результатам планового морфологического исследования у пациента подтверждено наличие аденокарциномы предстательной железы с метастазами в 8 из 64 удаленных лимфоузлов, с наличием лекарственного патоморфоза 2-й степени. В рамках дизайна внутреннего исследовательского протокола больной оставлен под строгим динамическим наблюдением без дополнительной адъювантной системной лекарственной терапии после операции, рекомендован контроль ПСА ежемесячно, больной подписал информированное согласие. Через месяц после операции уровень ПСА составил 0,003 нг/мл. Больной наблюдался, регулярно контролируя уровень ПСА. Через 2 года при ежемесячном контроле уровень ПСА составил 0,02 нг/мл. В июле 2023 г. (через 3 года после проведенного комплексного лечения) уровень ПСА составлял 0,01 нг/мл, проведенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) с простат-специфическим мембранным антигеном (ПСМА) не выявила очагов повышенного накопления радиофармпрепарата (РФП).
Несмотря на рекомендации о целесообразности продолжения тщательного динамического контроля показателей ПСА и необходимости регулярного проведения контрольного радиологического обследования в объеме ПЭТ-КТ, пациент выпал из-под наблюдения по семейным обстоятельствам. В декабре 2024 г. (через 1,5 года после последнего контрольного обследования в условиях клиники) больной отметил подъем уровня ПСА до 15,4 нг/мл. Рекомендовано проведение ПЭТ-КТ с ПСМА, которое обнаружило прогрессирование заболевания в виде наличия множественных метастатические очагов в костях, медиастинальных лимфоузлах, легких с высоким индексом накопления РФП до SUV 14. Таким образом, у больного выявлен мГЧРПЖ большого объем метастатического поражения, прогрессия заболевания после комбинированного мультимодального лечения.
С учетом гистологической дифференцировки РПЖ, высокого объема метастатического поражения, отсутствию противопоказаний к назначению химиотерапии, а также длительных сроках (4,5 года), прошедших с момента отмены неоадъювантной химиотерапии с применением доцетаксела, пациенту рекомендована комбинированная системная схема лечения, включающая андрогенную депривацию (АДТ) посредством аналога гонадотропин-релизинг гормона (ЛГРГ) лейпрорелин ацетата, проводимую одновременно с приемом ингибитора андрогеновых рецепторов II поколения – даролутамида (600 мг 2 раза в сутки), а также противоопухолевого агента таксанового ряда – доцетаксела (внутривенно в дозе 75 мг/м2 площади поверхности тела каждые три недели до 6 инъекций). Больной начал получать комбинированную терапию триплетом (АДТ + доцетаксел + даролутамид) с января 2025 г.
Мониторинг проводимого лечения для контроля клинического эффекта проводился ежемесячно путем измерения сывороточного уровня ПСА и других лабораторных показателей. Методы визуального контроля выполнялись каждые три месяца.
 Лечение больной переносил удовлетворительно. Через пять месяцев после начала комбинированного лечения уровень общего ПСА снизился до <0,01 нг/мл, что является предиктором достижения максимального терапевтического эффекта от проводимого лечения. Показатель индекса поглощения РФП (по данным ПЭТ-КТ с ПСМА) в ранее выявленных метаболических очагах постепенно уменьшался и достиг SUV 2,2 спустя 9 мес после старта терапии. Последующие данные контрольного МП-МРТ позволили исключить рецидив первичного опухолевого очага в ложе предстательной железы и в зоне операции, а повторно проведенные КТ-исследования, а также ПЭТ-КТ с ПСМА подтвердили существенное сокращение объемов ранее выявленных метастазов в костях, медиастинальных лимфоузлах и легких.
Лечение больной переносил удовлетворительно. Через пять месяцев после начала комбинированного лечения уровень общего ПСА снизился до <0,01 нг/мл, что является предиктором достижения максимального терапевтического эффекта от проводимого лечения. Показатель индекса поглощения РФП (по данным ПЭТ-КТ с ПСМА) в ранее выявленных метаболических очагах постепенно уменьшался и достиг SUV 2,2 спустя 9 мес после старта терапии. Последующие данные контрольного МП-МРТ позволили исключить рецидив первичного опухолевого очага в ложе предстательной железы и в зоне операции, а повторно проведенные КТ-исследования, а также ПЭТ-КТ с ПСМА подтвердили существенное сокращение объемов ранее выявленных метастазов в костях, медиастинальных лимфоузлах и легких.
По состоянию на сегодняшний день период наблюдения и активной комбинированной терапии (6 курсов доцетаксела с последующим применением даролутамида) составляет 11 мес с момента начала системного комбинированного лечения. Пациент завершил все 6 циклов химиотерапии и продолжил лечение по схеме даролутамид + АДТ до прогрессирования заболевания или развития неприемлемой токсичности. На всем периоде наблюдения пациентом не было отмечено нежелательных явлений, ассоциированных с лечением даролутамидом. Пациент отмечает отсутствие отрицательной динамики по показателям качества жизни, отсутствие болевого синдрома, удовлетворительную переносимость проводимой терапии.
Обсуждение
Результаты многоцентровых международных исследований свидетельствуют о преимуществе комбинированной трехкомпонентной стратегии лечения, состоящей из максимальной андрогенной депривации совместно с химиотерапевтическим агентом и современным селективным ингибитором андрогеновых рецепторов II поколения, относительно традиционной двухкомпонентной терапии (доцетаксел + АДТ). Так, недавние проспективные испытания продемонстрировали преимущество тройной терапии перед стандартной двухкомпонентой схемой по следующим критериям: время до прогрессирования заболевания, оценка динамики снижения уровня ПСА, медиана общей выживаемости и другие целевые показатели.
Полученные данные позволяют говорить о хороших результатах применения трехкомпонентной терапии у пациента с мГЧРПЖ в рутинной практике. У пациента зарегистрирован значимый биохимический ответ в виде редукции уровня ПСА ≥90% и менее 0,2 нг/мл, что говорит о прогностически достижимом максимальном терапевтическом эффекте. Настоящий клинический случай представляет особый интерес благодаря достижению как глубокого биохимического, так и полноценного радиологического ответа (минимизация накопления контрастного препарата в ранее метаболически активных очагах при повторных визуализационных методах диагностики). Также важно подчеркнуть высокие темпы нормализации биохимического (уровень ПСА) и радиологического показателей. Такой эффект обусловлен различными механизмами действия препаратов, применяемых в комбинации. Регулярный мониторинг позволяет адекватно оценивать динамику проводимого лечения и при необходимости оперативно корректировать тактику лечения.
Заключение
Описанный клинический случай иллюстрирует успешный опыт использования интенсификации терапии пациента с мГЧРПЖ с применением тройной комбинации (даролутамид + доцетаксел + АДТ). На фоне проводимого лечения отмечены полный биохимический и радиологический ответы. После завершения 6 циклов доцетаксела, пациент переведен на двухкомпонентную схему даролутамид + АДТ до прогрессирования заболевания в мКРРПЖ или непереносимой токсичности. На фоне проводимого лечения отмечен благоприятный профиль безопасности. Нежелательные явления, ассоциируемые с даролутамидом, отмечены не были. Пациент отмечает сохранение показателей привычного образа и качества жизни.
Конфликт интересов. Публикация подготовлена при научной поддержке компании АО «Байер».
Conflict of interests. The publication was prepared with the scientific support
of Bayer.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Нюшко Кирилл Михайлович – д-р мед. наук, проф., вед. науч. сотр. отделения онкоурологии, НИИ Урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала ФГБУ «НМИЦ радиологии». E-mail: kirandja@ya.ru
Kirill M. Nyushko – Dr. Sci. (Med.), Full Prof., Lopatkin Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Radiological Centre. E-mail: kirandja@ya.ru
Новичков Никита Дмитриевич – канд. мед. наук, руководитель медицинской поддержки группы «Онкология», АО «Bayer»
Nikita D. Novichkov – Cand. Sci. (Med.), Bayer, Moscow
Поступила в редакцию: 17.12.2025
Поступила после рецензирования: 18.12.2025
Принята к публикации: 18.12.2025
Received: 17.12.2025
Revised: 18.12.2025
Accepted: 18.12.2025
Клинический разбор в общей медицине №12 2025
Стратегия интенсификации лечения пациентов с гормоночувствительной формой метастатического рака предстательной железы: успешный опыт применения триплетной схемы терапии на примере клинического случая
Номера страниц в выпуске:17-21
Аннотация
Популяция больных гормоночувствительной формой метастатического рака предстательной железы (мГЧРПЖ) – крайне неоднородная когорта пациентов. Прогноз течения заболевания зависит от множества клинических факторов, в том числе от этапа манифестации заболевания. В публикации представлен клинический случай длительного мультимодального лечения пациента с метахронным мГЧРПЖ и рецидивом после ранее проведенной радикальной простатэктомии с расширенной тазовой лимфаденэктомией. С учетом высокого объема метастатического поражения, пациенту была предложена тактика интенсификации терапии – даролутамид в комбинации с доцетакселом и медикаментозная андроген-депривационная терапия (АДТ). Пациент завершил все 6 циклов химиотерапии и продолжил лечение по схеме даролутамид + АДТ до прогрессирования заболевания или развития неприемлемой токсичности. На всем периоде наблюдения пациентом не было отмечено нежелательных явлений, ассоциированных с лечением даролутамидом. Отмечается значимый клинический эффект, снижение показателя индекса накопления контрастного препарата в ранее метаболически активных метастатических очагах, а также биохимический ответ по снижению уровня простатспецифического антигена до неопределяемых значений.
Ключевые слова: метастатический гормоночувствительный рак предстательной железы, ARASENS, даролутамид, доцетаксел, андрогендепривационная терапия.
Для цитирования: Нюшко К.М., Новичков Н.Д. Стратегия интенсификации лечения пациентов с гормоночувствительной формой метастатического рака предстательной железы: успешный опыт применения триплетной схемы терапии на примере клинического случая. Клинический разбор в общей медицине. 2025; 6 (12): 17–21. DOI: 10.47407/kr2025.6.12.00726
Популяция больных гормоночувствительной формой метастатического рака предстательной железы (мГЧРПЖ) – крайне неоднородная когорта пациентов. Прогноз течения заболевания зависит от множества клинических факторов, в том числе от этапа манифестации заболевания. В публикации представлен клинический случай длительного мультимодального лечения пациента с метахронным мГЧРПЖ и рецидивом после ранее проведенной радикальной простатэктомии с расширенной тазовой лимфаденэктомией. С учетом высокого объема метастатического поражения, пациенту была предложена тактика интенсификации терапии – даролутамид в комбинации с доцетакселом и медикаментозная андроген-депривационная терапия (АДТ). Пациент завершил все 6 циклов химиотерапии и продолжил лечение по схеме даролутамид + АДТ до прогрессирования заболевания или развития неприемлемой токсичности. На всем периоде наблюдения пациентом не было отмечено нежелательных явлений, ассоциированных с лечением даролутамидом. Отмечается значимый клинический эффект, снижение показателя индекса накопления контрастного препарата в ранее метаболически активных метастатических очагах, а также биохимический ответ по снижению уровня простатспецифического антигена до неопределяемых значений.
Ключевые слова: метастатический гормоночувствительный рак предстательной железы, ARASENS, даролутамид, доцетаксел, андрогендепривационная терапия.
Для цитирования: Нюшко К.М., Новичков Н.Д. Стратегия интенсификации лечения пациентов с гормоночувствительной формой метастатического рака предстательной железы: успешный опыт применения триплетной схемы терапии на примере клинического случая. Клинический разбор в общей медицине. 2025; 6 (12): 17–21. DOI: 10.47407/kr2025.6.12.00726
Strategy to intensify treatment of patients with metastatic hormone-sensitive prostate cancer: successful experience of using the triplet therapy regimen exemplified by the case report
Kirill M. Nyushko1, Nikita D. Novichkov21 Lopatkin Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Radiological Centre, Moscow, Russia;
2 Bayer, Moscow, Russia
kirandja@ya.ru
Abstract
The population of patients with metastatic hormone-sensitive prostate cancer (mHSPC) is an extremely heterogeneous patient cohort. The disease course prognosis depends on many clinical factors, including the disease manifestation stage. The paper provides a clinical case of the long-term multimodal treatment of a patient with metachronous mHSPC and the relapse after previous radical prostatectomy with the extended pelvic lymphadenectomy. Considering high volume of metastatic lesions, the patient was offered the therapy intensifying tactics: darolutamide combined with docetaxel and drug androgen deprivation therapy (ADT). The patient completed all 6 chemotherapy cycles and continued treatment using the darolutamide + ADT regimen until disease progression or development of unacceptable toxicity. During the entire follow-up period the patient noted no adverse events associated with darolutamide therapy. A significant clinical effect, a decrease in the contrast agent accumulation index in the previously metabolically active metastatic foci, as well as a biochemical response to reduce the level of prostate-specific antigen to undetectable values are observed.
Keywords: metastatic hormone-sensitive prostate cancer, ARASENS, darolutamide, docetaxel, androgen deprivation therapy.
For citation: Nyushko K.M., Novichkov N.D. Strategy to intensify treatment of patients with metastatic hormone-sensitive prostate cancer: successful experience of using the triplet therapy regimen exemplified by the case reporty. Clinical review for general practice. 2025; 6 (12): 17–21 (In Russ.). DOI: 10.47407/kr2025.6.12.00726
Введение
Рак предстательной железы (РПЖ) в настоящее время является наиболее часто диагностируемым злокачественным новообразованием у мужской части населения Российской Федерации. Согласно официальной статистике за 2024 г. выявлено 59 405 новых эпизодов данного заболевания [1]. Уровень 5-летней общей выживаемости при локализованной форме патологии близок к 100%, тогда как при опухолевых процессах, характеризующихся местной экстенсивностью роста и наличием отдаленных метастазов, он значительно ухудшается, достигая лишь порядка 30–34% [2].
Диагноз РПЖ верифицируется преимущественно у пациентов с локализованными и местно-распространенными формами болезни, когда приоритетной стратегией лечения становится хирургическое вмешательство или лучевая терапия, направленные на получение радикально-долговременного исхода [3]. Тем не менее у значительного числа пациентов (около 15–20%) РПЖ определяется сразу в виде синхронного или de novo метастатического варианта заболевания [1, 3]. К категории пациентов с метастатическим течением РПЖ также относятся пациенты, перенесшие радикальное лечение, у которых впоследствии развивается прогрессия заболевания, проявляющаяся биохимическим и клиническими признаками рецидива (у 18–22%). Данную когорту пациентов принято относить к синхронному или рецидиву метастатического РПЖ (мРПЖ) [4].
мРПЖ характеризуется сохраненной чувствительностью к лечению, направленному на подавление выработки андрогенов, включая билатеральную орхиэктомию или медикаментозную андроген-депривационную терапию (АДТ), и традиционно классифицируется как гормоночувствительная форма метастатического рака предстательной железы (мГЧРПЖ) [5, 6]. У преобладающего числа пациентов данная патология спустя период от двух до трех лет эволюционирует в резистентную к кастрации метастатическую форму заболевания (мКРРПЖ), отличающуюся негативным прогностическим профилем и значительным сокращением показателя медианной общей выживаемости [7].
Это обстоятельство подчеркивает важность выбора терапевтического подхода уже на этапе 1-й линии терапии, которое будет направлено не только на увеличение продолжительности жизни пациентов, но и увеличивать период времени до прогрессирования в мКРРПЖ, а также минимизировать риски нежелательных побочных эффектов [8]. Выбор оптимальных схем терапии при лечении пациентов с мГЧРПЖ базируется на данных доказательной медицины, полученных в ходе крупных международных мультицентровых рандомизированных клинических исследований III фазы [2]. Среди стандартных комбинаторных схем применяются следующие методы:
– двухкомпонентные комбинации, состоящие из блокаторов ферментов синтеза андрогенов (абиратерон в комбинации с кортикостероидами) или селективных антиандрогенов II поколения (апалутамид, энзалутамид) [2, 8–12];
– трехкомпонентные режимы, предполагающие добавление к цитостатической химиотерапии (доцетаксел) одного из перечисленных препаратов – даролутамида (иАР II поколения) или абиратерона на фоне продолжающейся адъювантной терапии (АДТ) [8, 9].
Следует отметить, что комбинирование доцетаксела с одной лишь АДТ оправдано только при наличии четких противопоказаний к современным трехкомпонентным схемам, поскольку такие подходы уступают по показателям эффективности и безопасности трехкомпонентным режимам [7, 12]. Монотерапия АДТ должна применяться строго в случаях категоричных противопоказаний к указанным выше комбинациям или добровольного отказа пациента от предложенной мультимодальной терапии [3, 8, 12].
 Описанное клиническое наблюдение иллюстрирует клинические возможности интенсификации терапии у пациента с мГЧРПЖ в виде назначения триплетной схемы с применением ингибитора андрогеновых рецепторов II поколения – даролутамида и цитостатика – доцетаксела на фоне продолжающейся АДТ.
Описанное клиническое наблюдение иллюстрирует клинические возможности интенсификации терапии у пациента с мГЧРПЖ в виде назначения триплетной схемы с применением ингибитора андрогеновых рецепторов II поколения – даролутамида и цитостатика – доцетаксела на фоне продолжающейся АДТ.Клинический случай
Пациент РПН, на момент установления диагноза 59 лет. С подозрением на РПЖ на основе повышения уровня простатспецифического антигена (ПСА) до 119,4 нг/мл в сентябре 2020 г. была проведена трансректальная мультифокальная биопсия предстательной железы, которая подтвердила наличие аденокарциномы с градиентом дифференцировки по шкале Глисона 4+5=9 баллов. Данные мультипараметрической магнитно-резонансной томографии (МП-МРТ), а также компьютерной томографии органов грудной и брюшной полости (КТ ОБП) свидетельствовали о наличии локального экстракапсулярного распространения первичной опухоли (рис. 1). Компьютерная томография органов грудной клетки, брюшной полости установила наличие метастазов в регионарных лимфоузлах размерами до 2,5 см (рис. 2).
По данным остеосцинтиграфии от сентября 2017 г. данных, подтверждающих наличие метастатического поражения костей, не определялось.
Исходя из полученных данных проведенной диагностики, клинико-морфологическим консилиумом выставлена финальная классификация РПЖ по системе TNM (cT3bN1M1а, метастазы в тазовых, забрюшинных лимфоузлах). Сопутствующий анамнез пациента не отягощен. Прием других лекарственных препаратов на постоянной основе отрицает.
С учетом молодого возраста пациента, удовлетворительного соматического статуса и отсутствия костных очагов поражения, больному предложено принять участие во внутреннем протоколе клинического исследования, согласно которому в рамках экспериментального подхода на первом этапе пациент получил 6 курсов комбинированной химиогормональной терапии с использованием антагонистов рилизинг-гормона лютеинизирующего гормона – ЛГРГ (дегареликс) в комбинации с доцетакселом в дозе 75 мг/м2 внутривенно капельно каждые 3 нед. Больной информирован о стандартных опциях и подходах к терапии заболевания и подписал информированное согласие. Пациент получил 6 курсов комбинированной химиогормональной терапии, на фоне которой отмечена выраженная положительная динамика: регресс метастазов в тазовых и забрюшинных лимфоузлах, уменьшение размеров опухоли в предстательной железе, редукция уровня ПСА до 0,4 нг/мл. На втором этапе мультимодальной терапии, предложенной в рамках внутреннего исследовательского протокола, больному рекомендовано проведение хирургического лечения в объеме радикальной простатэктомии, расширенной тазовой и парааортальной лимфаденэктомии, больной информирован о стандартных опциях терапии и подписал информированное согласие (рис. 3–5).
 По результатам планового морфологического исследования у пациента подтверждено наличие аденокарциномы предстательной железы с метастазами в 8 из 64 удаленных лимфоузлов, с наличием лекарственного патоморфоза 2-й степени. В рамках дизайна внутреннего исследовательского протокола больной оставлен под строгим динамическим наблюдением без дополнительной адъювантной системной лекарственной терапии после операции, рекомендован контроль ПСА ежемесячно, больной подписал информированное согласие. Через месяц после операции уровень ПСА составил 0,003 нг/мл. Больной наблюдался, регулярно контролируя уровень ПСА. Через 2 года при ежемесячном контроле уровень ПСА составил 0,02 нг/мл. В июле 2023 г. (через 3 года после проведенного комплексного лечения) уровень ПСА составлял 0,01 нг/мл, проведенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) с простат-специфическим мембранным антигеном (ПСМА) не выявила очагов повышенного накопления радиофармпрепарата (РФП).
По результатам планового морфологического исследования у пациента подтверждено наличие аденокарциномы предстательной железы с метастазами в 8 из 64 удаленных лимфоузлов, с наличием лекарственного патоморфоза 2-й степени. В рамках дизайна внутреннего исследовательского протокола больной оставлен под строгим динамическим наблюдением без дополнительной адъювантной системной лекарственной терапии после операции, рекомендован контроль ПСА ежемесячно, больной подписал информированное согласие. Через месяц после операции уровень ПСА составил 0,003 нг/мл. Больной наблюдался, регулярно контролируя уровень ПСА. Через 2 года при ежемесячном контроле уровень ПСА составил 0,02 нг/мл. В июле 2023 г. (через 3 года после проведенного комплексного лечения) уровень ПСА составлял 0,01 нг/мл, проведенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) с простат-специфическим мембранным антигеном (ПСМА) не выявила очагов повышенного накопления радиофармпрепарата (РФП). Несмотря на рекомендации о целесообразности продолжения тщательного динамического контроля показателей ПСА и необходимости регулярного проведения контрольного радиологического обследования в объеме ПЭТ-КТ, пациент выпал из-под наблюдения по семейным обстоятельствам. В декабре 2024 г. (через 1,5 года после последнего контрольного обследования в условиях клиники) больной отметил подъем уровня ПСА до 15,4 нг/мл. Рекомендовано проведение ПЭТ-КТ с ПСМА, которое обнаружило прогрессирование заболевания в виде наличия множественных метастатические очагов в костях, медиастинальных лимфоузлах, легких с высоким индексом накопления РФП до SUV 14. Таким образом, у больного выявлен мГЧРПЖ большого объем метастатического поражения, прогрессия заболевания после комбинированного мультимодального лечения.
С учетом гистологической дифференцировки РПЖ, высокого объема метастатического поражения, отсутствию противопоказаний к назначению химиотерапии, а также длительных сроках (4,5 года), прошедших с момента отмены неоадъювантной химиотерапии с применением доцетаксела, пациенту рекомендована комбинированная системная схема лечения, включающая андрогенную депривацию (АДТ) посредством аналога гонадотропин-релизинг гормона (ЛГРГ) лейпрорелин ацетата, проводимую одновременно с приемом ингибитора андрогеновых рецепторов II поколения – даролутамида (600 мг 2 раза в сутки), а также противоопухолевого агента таксанового ряда – доцетаксела (внутривенно в дозе 75 мг/м2 площади поверхности тела каждые три недели до 6 инъекций). Больной начал получать комбинированную терапию триплетом (АДТ + доцетаксел + даролутамид) с января 2025 г.
Мониторинг проводимого лечения для контроля клинического эффекта проводился ежемесячно путем измерения сывороточного уровня ПСА и других лабораторных показателей. Методы визуального контроля выполнялись каждые три месяца.
 Лечение больной переносил удовлетворительно. Через пять месяцев после начала комбинированного лечения уровень общего ПСА снизился до <0,01 нг/мл, что является предиктором достижения максимального терапевтического эффекта от проводимого лечения. Показатель индекса поглощения РФП (по данным ПЭТ-КТ с ПСМА) в ранее выявленных метаболических очагах постепенно уменьшался и достиг SUV 2,2 спустя 9 мес после старта терапии. Последующие данные контрольного МП-МРТ позволили исключить рецидив первичного опухолевого очага в ложе предстательной железы и в зоне операции, а повторно проведенные КТ-исследования, а также ПЭТ-КТ с ПСМА подтвердили существенное сокращение объемов ранее выявленных метастазов в костях, медиастинальных лимфоузлах и легких.
Лечение больной переносил удовлетворительно. Через пять месяцев после начала комбинированного лечения уровень общего ПСА снизился до <0,01 нг/мл, что является предиктором достижения максимального терапевтического эффекта от проводимого лечения. Показатель индекса поглощения РФП (по данным ПЭТ-КТ с ПСМА) в ранее выявленных метаболических очагах постепенно уменьшался и достиг SUV 2,2 спустя 9 мес после старта терапии. Последующие данные контрольного МП-МРТ позволили исключить рецидив первичного опухолевого очага в ложе предстательной железы и в зоне операции, а повторно проведенные КТ-исследования, а также ПЭТ-КТ с ПСМА подтвердили существенное сокращение объемов ранее выявленных метастазов в костях, медиастинальных лимфоузлах и легких.По состоянию на сегодняшний день период наблюдения и активной комбинированной терапии (6 курсов доцетаксела с последующим применением даролутамида) составляет 11 мес с момента начала системного комбинированного лечения. Пациент завершил все 6 циклов химиотерапии и продолжил лечение по схеме даролутамид + АДТ до прогрессирования заболевания или развития неприемлемой токсичности. На всем периоде наблюдения пациентом не было отмечено нежелательных явлений, ассоциированных с лечением даролутамидом. Пациент отмечает отсутствие отрицательной динамики по показателям качества жизни, отсутствие болевого синдрома, удовлетворительную переносимость проводимой терапии.
Обсуждение
Результаты многоцентровых международных исследований свидетельствуют о преимуществе комбинированной трехкомпонентной стратегии лечения, состоящей из максимальной андрогенной депривации совместно с химиотерапевтическим агентом и современным селективным ингибитором андрогеновых рецепторов II поколения, относительно традиционной двухкомпонентной терапии (доцетаксел + АДТ). Так, недавние проспективные испытания продемонстрировали преимущество тройной терапии перед стандартной двухкомпонентой схемой по следующим критериям: время до прогрессирования заболевания, оценка динамики снижения уровня ПСА, медиана общей выживаемости и другие целевые показатели.
Полученные данные позволяют говорить о хороших результатах применения трехкомпонентной терапии у пациента с мГЧРПЖ в рутинной практике. У пациента зарегистрирован значимый биохимический ответ в виде редукции уровня ПСА ≥90% и менее 0,2 нг/мл, что говорит о прогностически достижимом максимальном терапевтическом эффекте. Настоящий клинический случай представляет особый интерес благодаря достижению как глубокого биохимического, так и полноценного радиологического ответа (минимизация накопления контрастного препарата в ранее метаболически активных очагах при повторных визуализационных методах диагностики). Также важно подчеркнуть высокие темпы нормализации биохимического (уровень ПСА) и радиологического показателей. Такой эффект обусловлен различными механизмами действия препаратов, применяемых в комбинации. Регулярный мониторинг позволяет адекватно оценивать динамику проводимого лечения и при необходимости оперативно корректировать тактику лечения.
Заключение
Описанный клинический случай иллюстрирует успешный опыт использования интенсификации терапии пациента с мГЧРПЖ с применением тройной комбинации (даролутамид + доцетаксел + АДТ). На фоне проводимого лечения отмечены полный биохимический и радиологический ответы. После завершения 6 циклов доцетаксела, пациент переведен на двухкомпонентную схему даролутамид + АДТ до прогрессирования заболевания в мКРРПЖ или непереносимой токсичности. На фоне проводимого лечения отмечен благоприятный профиль безопасности. Нежелательные явления, ассоциируемые с даролутамидом, отмечены не были. Пациент отмечает сохранение показателей привычного образа и качества жизни.
Конфликт интересов. Публикация подготовлена при научной поддержке компании АО «Байер».
Conflict of interests. The publication was prepared with the scientific support
of Bayer.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Нюшко Кирилл Михайлович – д-р мед. наук, проф., вед. науч. сотр. отделения онкоурологии, НИИ Урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала ФГБУ «НМИЦ радиологии». E-mail: kirandja@ya.ru
Kirill M. Nyushko – Dr. Sci. (Med.), Full Prof., Lopatkin Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Radiological Centre. E-mail: kirandja@ya.ru
Новичков Никита Дмитриевич – канд. мед. наук, руководитель медицинской поддержки группы «Онкология», АО «Bayer»
Nikita D. Novichkov – Cand. Sci. (Med.), Bayer, Moscow
Поступила в редакцию: 17.12.2025
Поступила после рецензирования: 18.12.2025
Принята к публикации: 18.12.2025
Received: 17.12.2025
Revised: 18.12.2025
Accepted: 18.12.2025
Список исп. литературыСкрыть список1. Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2025 году. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024.
Kaprin A.D., Starinsky V.V., Shakhzadova A.O. The state of oncological care for the Russian population in 2025. Moscow: Herzen Moscow Institute of Medical Sciences – branch of National Medical Research Radiological Centre, 2024 (in Russian).
2. Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA: a cancer journal for clinicians 2023;73(1):17-48.
3. Рак предстательной железы. Клинические рекомендации Минздрава России. М., 2021. URL: https://cr.minzdrav.gov.ru/view-cr/12_3? ysclid=mhsutk8ewi139696312 (дата обращения: 10.11.2025).
Prostate cancer. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2021. URL: https://cr.minzdrav.gov.ru/view-cr/12_3?ysclid=mhsutk8ewi139696312 (дата обращения: 10.11.2025). (in Russian).
4. Harris WP, Mostaghel EA, Nelson PS, Montgomery B. Androgen deprivation therapy: progress in understanding mechanisms of resistance and optimizing androgen depletion. Nature Clinical Practice Urology 2009;6:76-85.
5. Leith A., Ribbands A., Kim J et al. Impact of next-generation hormonal agents on treatment patterns among patients with metastatic hormone-sensitive prostate cancer: a real-world study from the United States, five European countries and Japan. BMC Urology 2022;22(1):33.
6. Aly M, Leval A, Schain F et al. Survival in patients diagnosed with castration-resistant prostate cancer: a population-based observational study in Sweden. Scandinavian J Urol 2020;54(2):115-21.
7. Резолюция по итогам Совета экспертов на тему «Современные подходы к лекарственной терапии пациентов с метастатическим гормоночувствительным раком предстательной железы». Онкоурология. 2023;19(1):178-4.
Resolution on the results of the Expert Council on the topic "Modern approaches to drug therapy in patients with metastatic hormone-sensitive prostate cancer". Oncourology. 2023;19(1):178-4 (in Russian).
8. Носов Д.А., Волкова М.И., Гладков О.А. и др. Рак предстательной железы. В кн.: Практические рекомендации RUSSCO, часть 1.2. Злокачественные опухоли. 2024;14(3s2). М., 2024.
Nosov D.A., Volkova M.I., Gladkov O.A. et al. Prostate cancer. In: RUSSCO Practical Recommendations, part 1.2. Malignant tumors. 2024;14(3s2). Moscow, 2024 (in Russian).
9. NCCN Clinical Practice Guidelines in Oncology. Prostate Cancer. Version 2.2026. National Comprehensive Cancer Network. 2022. URL: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (дата обращения: 10.11.2025).
10. Parker C et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020;31(9):1119-34.
11. Fizazi K, Gillessen S. Updated treatment recommendations for prostate cancer from the ESMO Clinical Practice Guideline considering treatment intensification and use of novel systemic agents. Ann Oncol 2023;34(6):1-7.
12. Cornford P et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. 2024. URL: https://d56bochluxqnz.cloudfront.net/ documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP-SIOG-Guidelines-on-Prostate-Cancer-2024_2024-04-09-132035_ypmy_ 2024-04-16-122605_lqpk.pdf (дата обращения: 17.12.2025).

