Клинический разбор в общей медицине №12 2025
1 European Medical Center, Moscow, Russia;
2 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
3 Kazan State Medical University, Kazan, Russia
lefortovo@hotmail.com
Abstract
Cervical cancer (CC) is still a major social and health-care problems. Mortality from CC keeps high during many years and we don’t have always the possibility to diminish it by treatment amenably to official guidelines. Accordingly, actual official recommendations in our country and aboard the radiotherapy of CC consists of two phases. In general, we realize firstly external beam irradiation of primary tumor and zones of regional metastasing, and after that, we must do the brachytherapy boost to gross tumor volume in the primary. However, the second phase impossible to realize in a part of patients. Unfortunately, there is no recommendations what to do the best with the situation in existing guidelines. We demonstrate two successful cases, which we forced to care only by external beam irradiation when brachytherapy is impossible, that is unimodal. Only the external beam irradiation was image guided and adaptive (IGAEBRT) implemented accordingly to target movements and to clinical course. IGAEBRT, realized on advanced technological equipment may be successful in the treatment of some cases of IIIC1 and IVA stages of CC. Today we see the conditions to upgrade principles of radiotherapy of CC. In the goal to improve the results we have to rise discussion about perfection the guidelines in the question.
Keywords: cervix uteri, radiotherapy, brachytherapy, cervix cancer, guidelines, standards, image guided adaptive external beam radiation therapy.
For citation: Salim N., Loyko I.E., Zvereva D.P., Stolbovoy A.V., Ryzhkin S.A. Two cases of forced external beam radiotherapy of the cancer of cervix uteri when brachytherapy is impossible. Clinical review for general practice. 2025; 6 (12): 22–30 (In Russ.). DOI: 10.47407/kr2025.6.12.00p4548
Введение
Рак шейки матки (РШМ) остается одной из важных медицинских и социальных проблем. На протяжении многих лет от РШМ сохраняется высокая смертность, и ее не всегда удается уменьшить стандартными методами лечения. Выполнение обязательных клинических рекомендаций в нередких случаях невозможно или нецелесообразно из-за индивидуальных особенностей пациенток. Долгое время считалось, что альтернативы сочетанному лучевому (химиолучевому) лечению нет. Однако прогресс в радиотерапии принципиально позволяет успешно применить радикальную дистанционную радиотерапию РШМ при невозможности использовать брахитерапию. Наши наблюдения показывают, что иногда только таким методом можно спасти жизнь при РШМ.
Наш опыт
Наблюдение 1. Женщина 38 лет обратилась с жалобами на кровотечение из влагалища, слабость, узкое влагалище и астению. Выделение крови из влагалища продолжается около 1 мес. Из анамнеза также известно, что 14 лет назад у пациентки была выявлена ВИЧ-инфекция 4а стадии, в связи с чем получает антиретровирусные препараты (дарунавир, ритонавир, ламивутидин, тенофовир). Три года назад перенесла подкожную мастэктомию справа по поводу рака молочной железы pT1 Nmic M0 BRCA-ассоциированную и получила
4 курса химиотерапии по АС-схеме, находится в процессе эндокринной терапии тамоксифеном. Ремиссия. Полгода назад перенесла тяжелую форму COVID-19 c потерей 5 кг массы тела и развитием астенического синдрома. Один месяц назад госпитализировалась с кровотечением из половых путей, была проведена эмболизация маточных артерий. При гистологическом исследовании материала из шейки матки выявлен ороговевающий плоскоклеточный рак р16(+) с интраэпителиальным поражением высокой степени.
При поступлении в отделение общее состояние удовлетворительное, нормального питания. Органы грудной клетки и живота без патологических признаков. При гинекологическом осмотре зеркало S входит постепенно на полную длину, но не открывается – циркулярное сужение влагалища до дистальных фрагментов. Шейка отдельно не дифференцируется, опухоль распространяется циркулярно, но больше с 7 до 2 часов циферблата, вовлекая шейку, влагалище и параметрии циркулярно. В самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Паховые лимфоузлы не пальпируются с обеих сторон.
На представленной магнитно-резонансной томографии (МРТ) органов малого таза, сделанной за 1 мес до обращения, видна циркулярная опухоль, тотально выполняющая шейку матки, c признаками инвазивного распространения на заднебоковые отделы нижней трети тела матки и на нижнюю треть влагалища, с нечеткими, бугристыми контурами, с нарушением целостности кольца и цервикальной стромы, с распространением в параметрий справа и более выражено слева. Прилегает к задней стенке мочевого пузыря, инвазируя ее слева, признаков прорастания миометрия нет. Прилегает к передней стенке нижне- и среднеампулярного отделов прямой кишки, прорастая справа. Признаки прорастания нижней трети левого мочеточника; мочеточник расширен на видимом протяжении до 8–10 мм. Размеры опухоли 77×65×110 мм.
Диагноз. Первично множественный метахронный рак. 1. Рак правой молочной железы Т1 N0 M0 (pT1 Nmic M0) BRCA «+»; два с половиной года после комплексного лечения: подкожная мастэктомия справа, 4 курса по АС-схеме. В процессе терапии тамоксифеном. Клиническая ремиссия. 2. Рак шейки матки с инвазивным распространением на нижнюю треть тела матки, нижнюю треть влагалища; в параметрий справа и больше слева; на серозную поверхность передней стенки нижне- и среднеампулярного отделов прямой кишки справа; с поражением нижней трети левого мочеточника. Уретероэктазия слева. Гематометра. T4a N0 M0 (FIGO IVa).
Сопутствующие заболевания: ВИЧ-инфекция, стадия 4А, фаза ремиссии. Множественная миома матки. Астенический синдром после тяжелого COVID-19. ECOG/ Zubrod 0-1.
Больной по жизненным показаниям необходимо химиолучевое лечение РШМ. Брахитерапия невозможна по анатомическим обстоятельствам. Принято решение проводить дистанционную лучевую терапию по радикальной программе. Предварительно устранена стриктура левого мочеточника методом стентирования.
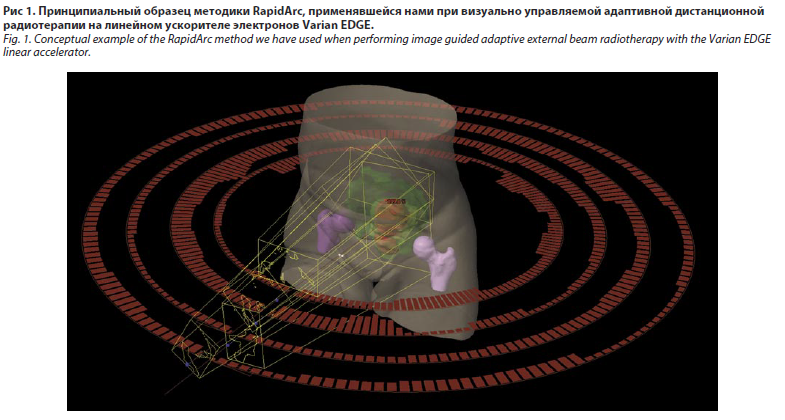
На линейном ускорителе электронов Varian EDGE проведена визуально управляемая адаптивная (аналогично image-guided adaptive brachytherapy, IGABT) стереотаксическая фракционная лучевая терапия (SFRT) по методике RapidArc с применением технологии IGRT на 6D-радиотерапевтическом столе (on line). Образец методики представлен на рис. 1. Адаптивное дистанционное облучение по радикальной программе проведено в режиме классического фракционирования по 1,8 Гр и состояло из четырех этапов.
Для обеспечения адаптивности в процессе лучевого лечения выполнены четыре этапных компьютерных томографий (КТ), две МРТ и позитронно-эмиссионная томография (ПЭТ)-КТ для диагностики динамики процесса и уточнения синтопии мишени и критических органов, четыре КТ-симуляции (4 топометрии с последующим переоконтуриванием мишени и критических структур) на томографе Philips Big Bore Brilliance в положении больной на животе с применением фиксирующего приспособления Belly Board.
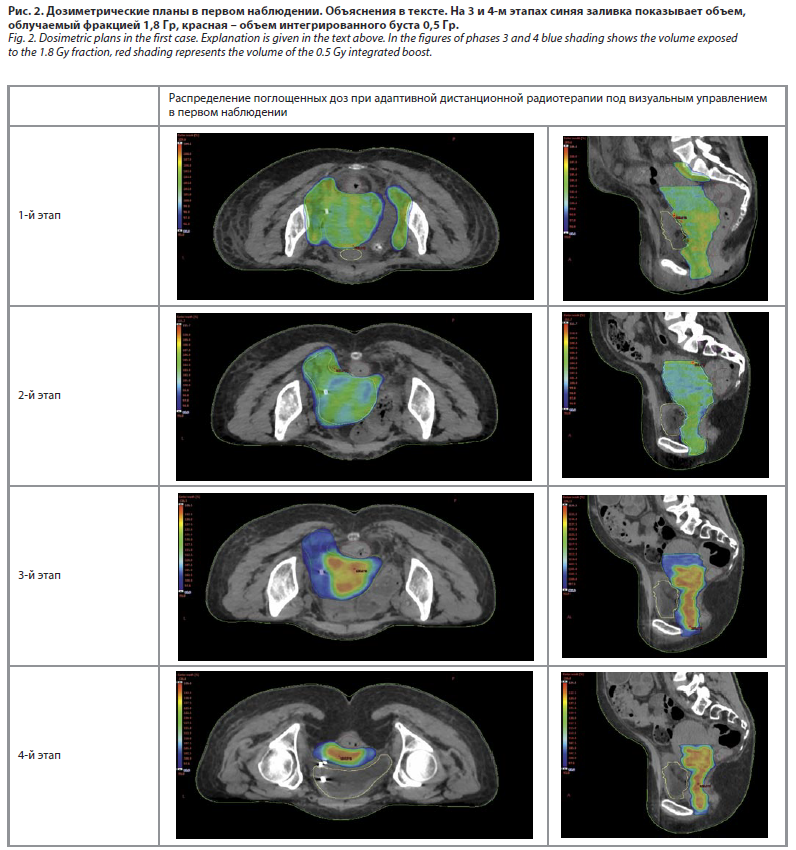
На 1-м этапе облучены матка с опухолью шейки, влагалище, параметрий с двух сторон, пораженные опухолью участки мочевого пузыря, прямой кишки, юкставезикальный отдел левого мочеточника, левая маточно-крестцовая связка и тазовая брюшина, а также регионарные лимфатические узлы таза (общие подвздошные, внутренние и наружные подвздошные, запирательные) – 25 фракций до суммарной очаговой дозы (СОД) – 45,0 Гр. План облучения представлен на рис. 2.
Был проведен 1 курс химиотерапии карбоплатином, но далее химиотерапию пришлось отменить в связи с нарастанием почечной недостаточности и анемического синдрома.
На 2-м этапе облучался объем без регионарных лимфатических узлов с учетом изменившейся синтопии органов и первичной опухоли, т.е. адаптивно, после выполнения новой топометрии и нового дозиметрического планирования – 5 фракций, СОД – 9,0 Гр до СОД двух этапов 54,0 Гр. План облучения этого и других этапов представлен на рис. 2.
На 3-м этапе адаптивно, соответственно изменившейся топографии, облучены опухоль шейки матки со всеми особенностями GTV с включением ее субклинического распространения на тело матки, влагалище, параметрий с двух сторон, левая маточно-крестцовая связка и тазовая брюшина – 7 фракций до СОД – 12,6 Гр (СОД трех этапов – 66,6 Гр) с синхронным интегрированным бустом 0,5 Гр с 33-й фракции на опухоль шейки матки согласно ее метаболическому объему по ПЭТ-КТ – 5 фракций (СОД в объеме буста дополнительно 11,5 Гр) до достижения общей СОД трех этапов 69,1 Гр. После 3-й фракции этого этапа выполнена контрольная МРТ.
На 4-м заключительном этапе вновь адаптивно согласно МРТ и ПЭТ/КТ и после новой КТ-симуляции облучены шейка матки с опухолью, верхняя и средняя трети влагалища и параметрий с двух сторон. Сделано 5 фракций (СОД – 9,0 Гр) до СОД от четырех этапов в этом объеме 75,6 Гр с синхронным интегрированным бустом 0,5 Гр на шейку матки и метаболический объем опухоли по ПЭТ-КТ локально. Дополнительно СОД в объеме буста составил 11,5 Гр (СОД всех этапов в GTV 80,6 Гр).
Лечение проводилось без перерывов. Пациентка перенесла его на фоне болевого синдрома в гипогастрии, протрагированного кровотечения из половых путей и анемии, требовавшей заместительных гемотрансфузий.
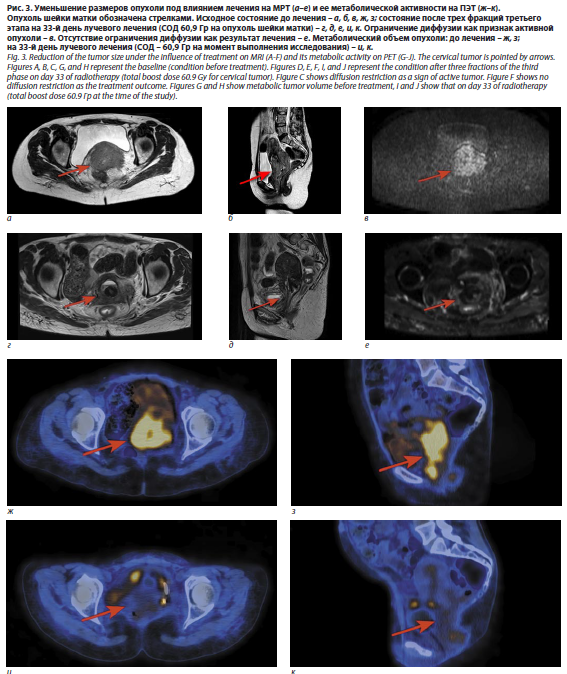
На промежуточной МРТ малого таза, выполненной в процессе третьего этапа, картина выраженного положительного ответа (рис. 3). На месте ранее определявшейся опухоли шейки матки выявляются фиброзные изменения без очагов ограничения диффузии по МРТ и снижение патологического метаболического объема и активности по ПЭТ.
Осмотр гинеколога через 5 нед после окончания лечения. Гинекологическое зеркало S входит почти на полную длину, открывается, но в самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Осмотр безболезненный, шейка доступна осмотру, коническая, гладкая, несколько изменена рубцами, кровоточит при взятии материала для цитологического исследования. Матка нормальных размеров, минимально подвижна, безболезненна при пальпации, правые и левые придатки не определяются пальпаторно, их проекция безболезненная. Паховые лимфоузлы не пальпируются с обеих сторон. Трансвагинальное ультразвуковое исследование (УЗИ): без эхо-патологии. Цитологическое исследование соскоба шейки матки методом жидкостной цитологии (PAP smear) не обнаружило опухолевых клеток.
Осмотр гинеколога через 2 года и 7 мес после лечения. Зеркало S входит на полную длину и открывается, но в самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Осмотр в целом безболезненный, шейка матки стала доступна визуальному осмотру (положительная динамика за последние 7 мес), конической формы, с гладкой поверхностью, несколько изменена рубцами, кровоточит при заборе материала на цитологию. Матка нормальных размеров, минимально подвижна, безболезненна при пальпации, правые и левые придатки не определяются пальпаторно, их проекция безболезненная. Паховые лимфоузлы не пальпируются с обеих сторон. Параметрии, паракольпос, своды влагалища, стенки таза с обеих сторон свободны. Ректовагинальная перегородка не изменена.
На контрольном ПЭТ-КТ через 2 года и 7 мес после лечения патологического гиперметаболизма в шейке матки и в других местах тела не обнаружено. Через 3 года и 6 мес субъективно и физикально без патологической динамики.
Наблюдение 2. Женщина 46 лет обратилась с жалобами на кровотечение из половых путей вне менструации. При осмотре наружные половые органы и влагалище без патологических признаков. Шейка матки бочкообразная размером около 4,0 см, плотная, определяются пришеечные инфильтраты. Матка увеличена до 10–12 нед, подвижна, в области придатков образований не определяется. Гистологическое исследование материала из цервикального канала выявило плоскоклеточный неороговевающий рак.
На МРТ картина злокачественного новообразования шейки матки 68 мм в наибольшем измерении с распространением на нижнюю треть тела матки, парацервикальную клетчатку с неравномерной инвазией больше справа и на передний свод влагалища. Мочеточники не вовлечены.
По данным ПЭТ-КТ картина гиперметаболического опухолевого образования шейки матки; два метастатически измененных лимфатических узла (правые общий и внутренний подвздошный) с низкой метаболической активностью. Опухоль имеет размеры 59,4×53×82,4 мм, полностью охватывает своды влагалища.
Диагноз: плоскоклеточный неороговевающий рак шейки матки, правосторонний параметральный вариант, с вовлечением нижней трети тела матки, с метастазами в правые общий и внутренний подвздошные лимфатические узлы, стадия T2bN1M0 (FIGO IIIC1).
Хирургическое лечение при данной стадии не показано. На консилиуме обсужден с больной курс сочетанной лучевой терапии с одновременной химиотерапией. Несмотря на разъяснение всех вариантов лечения и их последствий, больная от инвазивного компонента отказалась. На этапе подписания информированного согласия на лучевое лечение она настояла на проведении лечения только дистанционным методом по радикальной программе.
Проведен курс адаптивной химиолучевой терапии на линейном ускорителе электронов Varian EDGE по технологии RapidArc с использованием методики IGRT. Облучение проводилось в 5 этапов в режиме классического фракционирования с синхронным интегрированным бустом на опухоль шейки матки. КТ-топометрия и последующее облучение выполнены в положении тела пациентки на животе на устройстве Belly Board. Адаптивность проводилась по тем же принципам, которые описаны в первом случае. Мы снова старались дистанционным облучением максимально соответствовать классической онкогинекологической методике IGABT – второго этапа стандартной сочетанной лучевой терапии.
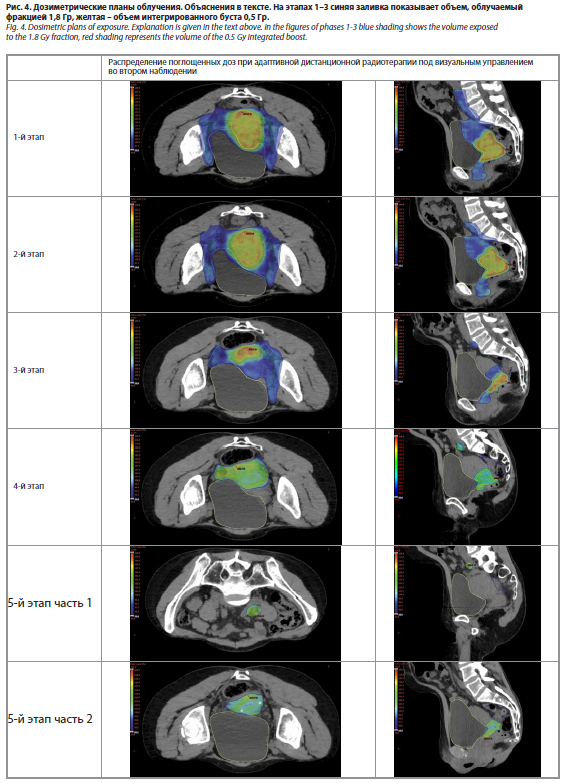
На 1-м этапе облучались матка, параметрии справа и слева, влагалище, парааортальные лимфатические узлы, узлы таза справа и слева общие, внутренние и наружные подвздошные, а также запирательные и пресакральные. Осуществлено 25 фракций по 1,8 Гр до СОД 45,0 Гр, с одновременным интегрированным бустом 0,5 Гр на опухоль шейки матки до СОД в этом месте 57,5 Гр. Дозиметрические планы всех этапов представлены на рис. 4.
На 2-м этапе облучался тот же объем, но без пара-аортальных лимфоузлов и адаптивно к изменившейся топографии злокачественного роста и критических органов согласно контрольной МРТ. РОД 1,8 Гр 5 фракций до СОД 54,0 Гр с одновременным интегрированным бустом 0,5 Гр на область опухоли шейки матки в режиме до СОД в зоне буста 69,0 Гр.
На 3-м этапе после очередной оценки динамики процесса и изменения синтопии мишени и критических органов облучались справа (зона высокого риска) GTV первичного очага, параметрии, верхняя и средняя трети влагалища, внутренние и наружные подвздошные лимфатические узлы. Осуществлены три фракции по 1,8 Гр до СОД 59,4 Гр с одновременным интегрированным бустом 0,5 Гр на опухоль шейки матки до СОД в зоне буста 75,9 Гр.
Промежуточная контрольная МРТ малого таза после третьего этапа химиолучевой терапии: МР-признаков персистирования опухоли в полости таза нет, постлучевые изменения. Контрольное ПЭТ-КТ в процессе химиолучевой терапии (перед 4-м этапом облучения): не выявлено очагов патологической метаболической активности, характерной для 18FDG-позитивного неопластического процесса.
На 4-м этапе лучевого лечения адаптивно облучались опухоль шейки матки и локально метастазы в общем и внутреннем подвздошных лимфатических узлах справа. Доза на опухоль шейки матки с учетом предыдущих планов – 81,3 Гр, на пораженные лимфоузлы – 64,8 Гр.
При контрольном осмотре на этом этапе лечения у больной был выявлен умеренный цистит и вагинальный кандидоз.
Пятый этап лучевого лечения состоял из двух планов. По первому – облучалась опухоль шейки матки тремя фракциями по 1,8 Гр до СОД 86,7 Гр. Объем облучения вновь корректирован согласно новым МРТ и ПЭТ-КТ. Проведена новая КТ-топометрия с внутривенным контрастированием и новое оконтуривание объемов мишени и критических органов. Второй план 5-го этапа лучевого лечения состоял в локальном дооблучении двух выше описанных метастатических лимфатических узлов таза (правые общий и внутренний подвздошные) тремя фракциями по 1,8 Гр до СОД 70,2 Гр.
Химиотерапевтический компонент был представлен пятью курсами еженедельного введения карбоплатина (AUC 1,5).
Пациентка перенесла лечение относительно удовлетворительно, наблюдались явления химиолучевого цистита II степени.
Через 9 мес после окончания лечения на МРТ сохраняется картина полного ответа на лечение, макропризнаков рецидивной опухолевой ткани нет, постлучевые изменения шейки матки. На ПЭТ-КТ в то же время не выявлено очагов патологической метаболической активности, характерной для 18FDG-позитивного неопластического процесса. Полный ответ заболевания на проведенное химиолучевое лечение. Данных, подтверждающих прогрессирование, не выявлено.
Гинекологический осмотр через 9 мес после лечения. Влагалище длиной 7 см, в куполе синехии разделены зеркалом и пальпаторно. Фрагментарно визуализирована шейка матки, маленькая, гладкая, без дефектов слизистой. Параметрии свободны с обеих сторон. Стенка таза свободная. Матка нормальных размеров, подвижна, безболезненна при пальпации. По данным гинекологического осмотра – норма, без клинических признаков поражения параметриев, постлучевые изменения влагалища по типу нежного слипчивого процесса. Трансвагинальное УЗИ: шейка матки длиной 22 мм, по толще передней губы несколько гиперэхогенных включений – следствие лучевой терапии. Матка размерами 41×38×45 мм, по задней стенке интерстициальный миоматозный узел 16×11 мм, полость матки расширена в нижней трети до 2,2 мм однородным анэхогенным содержимым, эндометрий 1 мм, однородный, яичники 18×10 мм, гомогенные, без фолликулов, свободной жидкости в малом тазу нет. Через 3 года субъективно и физикально без патологической динамики.
Максимальные дозы в 2 см3 стенок дозолимитирующих органов представлены в таблице.
Допустимые пределы доз согласно протоколу RTOG 0126 для мочевого пузыря V15%<80 Гр, для прямой кишки V15%<75 Гр.
Обсуждение
Мы описали два случая вынужденного нестандартного лечения РШМ, когда в силу невозможности выполнить брахитерапевтический этап нам пришлось модифицировать официальные рекомендации. Это было единственной возможностью спасти жизни пациенток. Оба случая могут считаться успешными, несмотря на то что были отягощены. Первый представил собой IVa стадию РШМ (FIGO), был вторым раком в жизни пациентки, протекал на фоне ВИЧ-инфекции 4а стадии и астенического синдрома после тяжелого COVID-19. Кроме того, облучение у нее проводилось после эмболизации маточных артерий, что делает опухоль менее радиочувствительной. Второе наблюдение представляет распространенную стадию РШМ (IIIC1) с метастазами в тазовые лимфатические узлы. Пациентки наблюдаются почти 3 и 3,5 года в состоянии клинической ремиссии и без осложнений. В обоих случаях мы построили свою модель облучения на основе международных рекомендаций по адаптивной брахитерапии РШМ (IGABT) [1], а также последних (2023) ESGO/ESTRO/ ESP Guidelines [2].
Проводя только дистанционную радиотерапию по радикальной программе, т.е. унимодально, облучение адаптировалось к изменениям положения мишени и динамике ответа опухоли в процессе лечения. При этом использовалась методика IGRT в реальном времени. Таким образом, нашу методику можно назвать, употребляя по аналогии международные признанные обозначения, Image Guided Adaptive External Beam Radiation Therapy – IGAEBRT.
Основной контингент больных РШМ представлен лицами с заболеваниями от IA2 до IVB стадий. Главный лечебный фактор у них – ионизирующее излучение. Согласно клинической рекомендации ID:537 Минздрава России [3], лучевой компонент лечения основной массы больных РШМ состоит из дистанционного и брахитерапевтического этапов. Аналогичная тактика изложена в «Стандартах лучевой терапии» [4] и в клинических алгоритмах National Comprehensive Cancer Network (США) [5]. Однако издавна специалисты-онкогинекологи указывали на то, что стандартную официальную программу не удается осуществить довольно большому числу пациенток. В основном это случается из-за невозможности проведения внутриполостного/внутритканевого этапа облучения.
Обычно внутриполостной этап лучевого лечения не удается провести из-за невозможности ввести эндостат в закрытый после дистанционного этапа остаточной опухолью цервикальный канал. Бывает также обратная ситуация, когда после хорошего регресса опухоли на первом этапе химиолучевого лечения вместо цервикального канала получается большая полость, в которой нельзя однообразно и стабильно расположить эндостат с источником излучения. При описании таких наблюдений невозможность ввести или фиксировать эндостат наблюдалась у 59% больных [6]. Тогда больные попадают в критическое положение, угрожающее смертью от неизлеченного рака. Часть больных отказывается от брахитерапии или не переносит ее.
Есть и другие обстоятельства, препятствующие осуществлению внутриполостного/внутритканевого этапа. Например, в некоторых учреждениях, которым приходится лечить больных с раком шейки матки, нет реальной возможности проводить брахитерапию или проводить ее правильно. Учитывая трудности, с которыми сталкивается на практике радиотерапевт на брахитерапевтическом этапе лучевого лечения РШМ, некоторые врачи в борьбе за жизнь больной давно старались обойти считавшиеся незыблемыми указания путем замены его на продолжающееся дистанционное облучение.
По-видимому, первая попытка самостоятельного дистанционного лучевого лечения РШМ принадлежит F. Baclesse в 1938 г. У него был облучатель с энергией всего 200 кВ, но он вылечил этим способом 9 человек из 63 (цит. по Acta Unio Internationalis Contra Cancrum, 1993) [7]. В 1954 г. H.-L. Kottmeier в статье «Современные направления в лечении рака шейки матки» [8] ссылается на работу F. Baclesse 1950 г. [9] о лечении только внешнем облучением. Автор говорит о том, что достижение удовлетворительных результатов требует индивидуального подхода и метод F. Baclesse показан определенным больным, и у них он «может быть лучше применения радия».
J. Castro и соавт. [10] в 1970 г. представили результаты дистанционного лучевого лечения 108 больных РШМ в University of Texas M.D. Anderson Hospital и в Tumor Institute of Houston. В их серии наблюдений «большинство из 84 больных со стадией III или IV не подходили для дополнительного лечения радием из-за распространенности болезни. Несколько больных от такого лечения отказались. Было 24 больных с менее продвинутой болезнью, которым внутриполостной радий не применялся, потому что: a) узкие своды влагалища,
б) культя шейки слишком коротка, чтобы принять радиевые источники, в) латерализованная тазовая болезнь (стадия III), эффективность лечения которой радием сомнительна».
Одним из решающих факторов, определяющих неуспех лучевого лечения РШМ, считается неадекватное подведение дозы излучения по краям опухоли от брахитерапевтического компонента [11–13].
P. Ferreira и соавт. (1999) [14] поддерживают известное положение о необходимости сочетанной лучевой терапии, но сразу оговариваются: не всем больным можно провести брахитерапевтический этап облучения и тогда надо проводить дистанционное облучение по радикальной программе. У авторов под наблюдением с 1980 по 1997 г. было 1234 больных с РШМ, леченных ионизирующим излучением. Из них в исследование вошли 186 пациенток со стадией IIIB (хотя всего таких больных было 228). Брахитерапию не удалось провести у 109 из этих больных. Причины: большая остаточная опухоль, узкое влагалище, опухолевая язва во влагалище, прорастание в соседние органы, полость матки не подходит для установки аппликатора, непереносимость брахитерапии. Среди других причин были: тазовые абсцессы, психические заболевания, сопутствующие болезни и др., но обращает на себя внимание среди них личное решение больной.
Индийский коллектив авторов (E. Saibishkumar и соавт., 2005) [15] продемонстрировал возможность дистанционной лучевой терапии у больных с РШМ. Они описали результаты этого лечения у 146 человек из общего числа пролеченных 1069. Большинство больных – 124 пациентки имели стадию IIIB.
S. Killic и соавт. (2015) [16] обобщили результаты дистанционного лучевого лечения рака шейки матки тринадцати радиотерапевтических учреждений. Вместо брахитерапии использовались протонный буст, трехмерная конформная лучевая терапия (3DCRT), облучение с модуляцией интенсивности пучков (IMRT) и стереотаксическая лучевая терапия (SBRT). Локальный контроль был достигнут в 75–100% случаев. Максимальная частота токсичности более II степени составила в одном исследовании 17%, в другом – 25%. В других случаях этот показатель чаще всего был равен нулю, но мог достигать 2, 4, 7, 8 и 14%. В своей статье под названием «Небрахитерапевтические альтернативы в радиотерапии рака шейки матки: почему нет?» авторы дают ответ: «Да». Выводы S. Kilic и соавт.: чтобы заменить брахитерапию бустерным облучением методами IMRT или SBRT, они обязательно должны соответствовать определенным жестким требованиям. Они касаются точности определения облучаемых объемов, оптимизации дозиметрических планов, адаптивному облучению с повторными визуализациями и др. Несоблюдение этих условий приведет к неправильному представлению об IMRT и SBRT и снижению их эффективности.
Для достижения хорошего местного контроля шейка матки должна получить не менее 70 Гр, но осложнения со стороны прямой кишки и мочевого пузыря после 60 Гр стремительно нарастают. Неспособность подвести требуемые дозы дистанционно из-за осложнений в прежние времена приводила к плохим результатам лечения и поддерживала мнение, что при радиотерапии РШМ без внутриполостной брахитерапии не обойтись.
Современная аппаратура позволяет добиваться такого дозного распределения, которого мы ждем от внутриполостной брахитерапии, но с минимумом осложнений [17]. Теперь на еще более современной аппаратуре мы это можем делать при помощи методики RapidArc [18].
Оказалось, чтобы сохранить жизнь больным с РШМ, надо затратить нетрадиционный ресурс. Очень трудоемко в радиотерапевтическом отделении многократно перепланировать лучевое лечение и применять on-line IGRT. К сожалению, представленная нами методика пока не везде может быть осуществлена, и мы пока не должны отказываться от сочетанной программы радиотерапии. Однако сегодня нельзя не видеть, что исторически сложившиеся понятия не должны быть догматичными, хотя бы потому, что это препятствие на пути прогресса. Видимо, пора направить приоритеты в организации здравоохранения хотя бы в онкогинекологии на решение онкологических и организационных вопросов, затраты на это вряд ли будут велики, а человеческая жизнь не имеет цены.
Заключение
Требования к двухэтапному сочетанному лучевому лечению РШМ, заложенные в руководства несколько десятилетий назад, в условиях современной радиотерапии и онкологии не должны иметь свойства догмы.
У части больных особенности болезни диктуют лечение по модифицированным рекомендациям. Методика IGAEBRT, выполненная на современном методическом уровне, может быть успешной. В наше время сложились условия для внесения обновлений в принципы лучевого лечения РШМ. Это будет способствовать улучшению результатов лечения РШМ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. Авторы внесли равный вклад в разработку концепции статьи, подготовку и обсуждение черновика, анализ литературных данных и финальную проверку рукописи.
Author’s contribution. All authors contribute equally to the conception of the article, preparing and talk over the draft, literature review and final control of the manuscript.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Ислим (Салим) Нидаль – канд. мед. наук, зав. Центром лучевой терапии Европейского медицинского центра; ассистент каф. радиотерапии и радиологии, ФГБОУ ДПО РМАНПО. E-mail:
salnidal@yahoo.com; ORCID: 0000-0003-2630-4961
Salim (Islim) Nidal – Cand. Sci. (Med.), European Medical Center Russian, Medical Academy of Continuous Professional Education.
E-mail: nsalim@emcmos.ru; ORCID: 0000-0003-2630-4961
Лойко Илья Евгеньевич – врач-радиотерапевт Европейского медицинского центра. E-mail: iloyko@emsmos.ru; ORCID: 0000-0002-6909-8558
Ilya Loiko – Radiotherapist, European Medical Center. E-mail: iloyko@emcmos.ru; ORCID: 0000-0002-6909-8558
Зверева Дарья Павловна – врач-радиотерапевт Европейского медицинского центра. E-mail: dzvereva@emcmcos.ru; ORCID: 0009-0009-8357-8011
Darya Zvereva – Radiotherapist, European Medical Center. E-mail: dzvereva@emcmos.ru; ORCID: 0009-0009-8357-8011
Столбовой Александр Викторович – д-р мед. наук, проф. каф. радиотерапии и радиологии, ФГБОУ ДПО РМАНПО; врач-радиотерапевт Европейского медицинского центра. E-mail: lefortovo@hotmail.com; ORCID: 0009-0000-4961-4810
Alexander V. Stolbovoy – Dr. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education; Radiotherapist, European Medical Center. E-mail: lefortovo@hotmail.com; ORCID: 0009-0000-4961-4810
Рыжкин Сергей Александрович – зав. каф., ФГБОУ ДПО РМАНПО; ФГБОУ ВО «Казанский ГМУ». E-mail: rsa777@inbox.ru; ORCID: 0000-0003-2595-353X
Sergey A. Ryzhkin – Head of the Department, Russian Medical Academy of Continuous Professional Education; Kazan State Medical University. E-mail: rsa777@inbox.ru; ORCID: 0000-0003-2595-353X
Поступила в редакцию: 10.04.2025
Поступила после рецензирования: 17.04.2025
Принята к публикации: 15.05.2025
Received: 10.04.2025
Revised: 17.04.2025
Accepted: 15.05.2025
Клинический разбор в общей медицине №12 2025
Два клинических случая радикальной дистанционной радиотерапии рака шейки матки при невозможности использовать брахитерапию
Номера страниц в выпуске:22-30
Аннотация
Рак шейки матки (РШМ) остается одной из важных медицинских и социальных проблем. На протяжении многих лет от РШМ сохраняется высокая смертность, и ее не всегда удается уменьшить стандартными методами лечения. В целом радиотерапия лежит в основе лечения РШМ. Согласно действующим у нас в стране и за рубежом официальным рекомендациям радиотерапия РШМ должна проводиться в два этапа. Сначала проводится дистанционное облучение первичного очага и зон регионарного метастазирования, а затем подводится брахитерапевтический буст на основной объем опухоли в первичном очаге. Однако давно известно, что брахитерапевтический этап не удается провести у значительной части больных и это ставит в трудное положение как саму больную, так и медицинское учреждение. К сожалению, в существующих отечественных и зарубежных стандартах нет указаний на выход из такой ситуации. Мы приводим два успешных наблюдения, когда при невыполнимости брахитерапии нам удалось успешно провести радиотерапию по радикальной программе дистанционным облучением, т.е. унимодально. В обоих случаях применена методика Image Guided Adaptive External Beam Radiation Therapy (IGAEBRT). Дистанционное облучение проводилось адаптивно к изменениям положения мишени и динамике процесса. Примененная нами методика IGAEBRT, выполненная на высоком современном методическом уровне, может быть успешной.
В наше время сложились условия для внесения обновлений в принципы лучевого лечения РШМ. В целях улучшения результатов лечения РШМ необходимо развернуть дискуссию по совершенствованию и ограничению строгости официальных стандартов и рекомендаций по лучевому лечению РШМ.
Ключевые слова: рак шейки матки, радиотерапия, брахитерапия, рекомендации, стандарты, адаптивное облучение.
Для цитирования: Салим (Ислим) Н., Лойко И.Е., Зверева Д.П., Столбовой А.В., Рыжкин С.А. Два клинических случая радикальной дистанционной радиотерапии рака шейки матки при невозможности использовать брахитерапию. Клинический разбор в общей медицине. 2025; 6 (12): 22–30. DOI: 10.47407/kr2025.6.12.00p4548
Рак шейки матки (РШМ) остается одной из важных медицинских и социальных проблем. На протяжении многих лет от РШМ сохраняется высокая смертность, и ее не всегда удается уменьшить стандартными методами лечения. В целом радиотерапия лежит в основе лечения РШМ. Согласно действующим у нас в стране и за рубежом официальным рекомендациям радиотерапия РШМ должна проводиться в два этапа. Сначала проводится дистанционное облучение первичного очага и зон регионарного метастазирования, а затем подводится брахитерапевтический буст на основной объем опухоли в первичном очаге. Однако давно известно, что брахитерапевтический этап не удается провести у значительной части больных и это ставит в трудное положение как саму больную, так и медицинское учреждение. К сожалению, в существующих отечественных и зарубежных стандартах нет указаний на выход из такой ситуации. Мы приводим два успешных наблюдения, когда при невыполнимости брахитерапии нам удалось успешно провести радиотерапию по радикальной программе дистанционным облучением, т.е. унимодально. В обоих случаях применена методика Image Guided Adaptive External Beam Radiation Therapy (IGAEBRT). Дистанционное облучение проводилось адаптивно к изменениям положения мишени и динамике процесса. Примененная нами методика IGAEBRT, выполненная на высоком современном методическом уровне, может быть успешной.
В наше время сложились условия для внесения обновлений в принципы лучевого лечения РШМ. В целях улучшения результатов лечения РШМ необходимо развернуть дискуссию по совершенствованию и ограничению строгости официальных стандартов и рекомендаций по лучевому лечению РШМ.
Ключевые слова: рак шейки матки, радиотерапия, брахитерапия, рекомендации, стандарты, адаптивное облучение.
Для цитирования: Салим (Ислим) Н., Лойко И.Е., Зверева Д.П., Столбовой А.В., Рыжкин С.А. Два клинических случая радикальной дистанционной радиотерапии рака шейки матки при невозможности использовать брахитерапию. Клинический разбор в общей медицине. 2025; 6 (12): 22–30. DOI: 10.47407/kr2025.6.12.00p4548
Two cases of forced external beam radiotherapy of the cancer of cervix uteri when brachytherapy is impossible
Nidal Salim1,2, Ilya E. Loyko1, Daria P. Zvereva1, Alexander V. Stolbovoy1,2, Sergey A. Ryzhkin2,31 European Medical Center, Moscow, Russia;
2 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
3 Kazan State Medical University, Kazan, Russia
lefortovo@hotmail.com
Abstract
Cervical cancer (CC) is still a major social and health-care problems. Mortality from CC keeps high during many years and we don’t have always the possibility to diminish it by treatment amenably to official guidelines. Accordingly, actual official recommendations in our country and aboard the radiotherapy of CC consists of two phases. In general, we realize firstly external beam irradiation of primary tumor and zones of regional metastasing, and after that, we must do the brachytherapy boost to gross tumor volume in the primary. However, the second phase impossible to realize in a part of patients. Unfortunately, there is no recommendations what to do the best with the situation in existing guidelines. We demonstrate two successful cases, which we forced to care only by external beam irradiation when brachytherapy is impossible, that is unimodal. Only the external beam irradiation was image guided and adaptive (IGAEBRT) implemented accordingly to target movements and to clinical course. IGAEBRT, realized on advanced technological equipment may be successful in the treatment of some cases of IIIC1 and IVA stages of CC. Today we see the conditions to upgrade principles of radiotherapy of CC. In the goal to improve the results we have to rise discussion about perfection the guidelines in the question.
Keywords: cervix uteri, radiotherapy, brachytherapy, cervix cancer, guidelines, standards, image guided adaptive external beam radiation therapy.
For citation: Salim N., Loyko I.E., Zvereva D.P., Stolbovoy A.V., Ryzhkin S.A. Two cases of forced external beam radiotherapy of the cancer of cervix uteri when brachytherapy is impossible. Clinical review for general practice. 2025; 6 (12): 22–30 (In Russ.). DOI: 10.47407/kr2025.6.12.00p4548
Введение
Рак шейки матки (РШМ) остается одной из важных медицинских и социальных проблем. На протяжении многих лет от РШМ сохраняется высокая смертность, и ее не всегда удается уменьшить стандартными методами лечения. Выполнение обязательных клинических рекомендаций в нередких случаях невозможно или нецелесообразно из-за индивидуальных особенностей пациенток. Долгое время считалось, что альтернативы сочетанному лучевому (химиолучевому) лечению нет. Однако прогресс в радиотерапии принципиально позволяет успешно применить радикальную дистанционную радиотерапию РШМ при невозможности использовать брахитерапию. Наши наблюдения показывают, что иногда только таким методом можно спасти жизнь при РШМ.
Наш опыт
Наблюдение 1. Женщина 38 лет обратилась с жалобами на кровотечение из влагалища, слабость, узкое влагалище и астению. Выделение крови из влагалища продолжается около 1 мес. Из анамнеза также известно, что 14 лет назад у пациентки была выявлена ВИЧ-инфекция 4а стадии, в связи с чем получает антиретровирусные препараты (дарунавир, ритонавир, ламивутидин, тенофовир). Три года назад перенесла подкожную мастэктомию справа по поводу рака молочной железы pT1 Nmic M0 BRCA-ассоциированную и получила
4 курса химиотерапии по АС-схеме, находится в процессе эндокринной терапии тамоксифеном. Ремиссия. Полгода назад перенесла тяжелую форму COVID-19 c потерей 5 кг массы тела и развитием астенического синдрома. Один месяц назад госпитализировалась с кровотечением из половых путей, была проведена эмболизация маточных артерий. При гистологическом исследовании материала из шейки матки выявлен ороговевающий плоскоклеточный рак р16(+) с интраэпителиальным поражением высокой степени.
При поступлении в отделение общее состояние удовлетворительное, нормального питания. Органы грудной клетки и живота без патологических признаков. При гинекологическом осмотре зеркало S входит постепенно на полную длину, но не открывается – циркулярное сужение влагалища до дистальных фрагментов. Шейка отдельно не дифференцируется, опухоль распространяется циркулярно, но больше с 7 до 2 часов циферблата, вовлекая шейку, влагалище и параметрии циркулярно. В самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Паховые лимфоузлы не пальпируются с обеих сторон.


На представленной магнитно-резонансной томографии (МРТ) органов малого таза, сделанной за 1 мес до обращения, видна циркулярная опухоль, тотально выполняющая шейку матки, c признаками инвазивного распространения на заднебоковые отделы нижней трети тела матки и на нижнюю треть влагалища, с нечеткими, бугристыми контурами, с нарушением целостности кольца и цервикальной стромы, с распространением в параметрий справа и более выражено слева. Прилегает к задней стенке мочевого пузыря, инвазируя ее слева, признаков прорастания миометрия нет. Прилегает к передней стенке нижне- и среднеампулярного отделов прямой кишки, прорастая справа. Признаки прорастания нижней трети левого мочеточника; мочеточник расширен на видимом протяжении до 8–10 мм. Размеры опухоли 77×65×110 мм.
Диагноз. Первично множественный метахронный рак. 1. Рак правой молочной железы Т1 N0 M0 (pT1 Nmic M0) BRCA «+»; два с половиной года после комплексного лечения: подкожная мастэктомия справа, 4 курса по АС-схеме. В процессе терапии тамоксифеном. Клиническая ремиссия. 2. Рак шейки матки с инвазивным распространением на нижнюю треть тела матки, нижнюю треть влагалища; в параметрий справа и больше слева; на серозную поверхность передней стенки нижне- и среднеампулярного отделов прямой кишки справа; с поражением нижней трети левого мочеточника. Уретероэктазия слева. Гематометра. T4a N0 M0 (FIGO IVa).
Сопутствующие заболевания: ВИЧ-инфекция, стадия 4А, фаза ремиссии. Множественная миома матки. Астенический синдром после тяжелого COVID-19. ECOG/ Zubrod 0-1.
Больной по жизненным показаниям необходимо химиолучевое лечение РШМ. Брахитерапия невозможна по анатомическим обстоятельствам. Принято решение проводить дистанционную лучевую терапию по радикальной программе. Предварительно устранена стриктура левого мочеточника методом стентирования.
На линейном ускорителе электронов Varian EDGE проведена визуально управляемая адаптивная (аналогично image-guided adaptive brachytherapy, IGABT) стереотаксическая фракционная лучевая терапия (SFRT) по методике RapidArc с применением технологии IGRT на 6D-радиотерапевтическом столе (on line). Образец методики представлен на рис. 1. Адаптивное дистанционное облучение по радикальной программе проведено в режиме классического фракционирования по 1,8 Гр и состояло из четырех этапов.
Для обеспечения адаптивности в процессе лучевого лечения выполнены четыре этапных компьютерных томографий (КТ), две МРТ и позитронно-эмиссионная томография (ПЭТ)-КТ для диагностики динамики процесса и уточнения синтопии мишени и критических органов, четыре КТ-симуляции (4 топометрии с последующим переоконтуриванием мишени и критических структур) на томографе Philips Big Bore Brilliance в положении больной на животе с применением фиксирующего приспособления Belly Board.

На 1-м этапе облучены матка с опухолью шейки, влагалище, параметрий с двух сторон, пораженные опухолью участки мочевого пузыря, прямой кишки, юкставезикальный отдел левого мочеточника, левая маточно-крестцовая связка и тазовая брюшина, а также регионарные лимфатические узлы таза (общие подвздошные, внутренние и наружные подвздошные, запирательные) – 25 фракций до суммарной очаговой дозы (СОД) – 45,0 Гр. План облучения представлен на рис. 2.
Был проведен 1 курс химиотерапии карбоплатином, но далее химиотерапию пришлось отменить в связи с нарастанием почечной недостаточности и анемического синдрома.
На 2-м этапе облучался объем без регионарных лимфатических узлов с учетом изменившейся синтопии органов и первичной опухоли, т.е. адаптивно, после выполнения новой топометрии и нового дозиметрического планирования – 5 фракций, СОД – 9,0 Гр до СОД двух этапов 54,0 Гр. План облучения этого и других этапов представлен на рис. 2.
На 3-м этапе адаптивно, соответственно изменившейся топографии, облучены опухоль шейки матки со всеми особенностями GTV с включением ее субклинического распространения на тело матки, влагалище, параметрий с двух сторон, левая маточно-крестцовая связка и тазовая брюшина – 7 фракций до СОД – 12,6 Гр (СОД трех этапов – 66,6 Гр) с синхронным интегрированным бустом 0,5 Гр с 33-й фракции на опухоль шейки матки согласно ее метаболическому объему по ПЭТ-КТ – 5 фракций (СОД в объеме буста дополнительно 11,5 Гр) до достижения общей СОД трех этапов 69,1 Гр. После 3-й фракции этого этапа выполнена контрольная МРТ.
На 4-м заключительном этапе вновь адаптивно согласно МРТ и ПЭТ/КТ и после новой КТ-симуляции облучены шейка матки с опухолью, верхняя и средняя трети влагалища и параметрий с двух сторон. Сделано 5 фракций (СОД – 9,0 Гр) до СОД от четырех этапов в этом объеме 75,6 Гр с синхронным интегрированным бустом 0,5 Гр на шейку матки и метаболический объем опухоли по ПЭТ-КТ локально. Дополнительно СОД в объеме буста составил 11,5 Гр (СОД всех этапов в GTV 80,6 Гр).
Лечение проводилось без перерывов. Пациентка перенесла его на фоне болевого синдрома в гипогастрии, протрагированного кровотечения из половых путей и анемии, требовавшей заместительных гемотрансфузий.
На промежуточной МРТ малого таза, выполненной в процессе третьего этапа, картина выраженного положительного ответа (рис. 3). На месте ранее определявшейся опухоли шейки матки выявляются фиброзные изменения без очагов ограничения диффузии по МРТ и снижение патологического метаболического объема и активности по ПЭТ.
Осмотр гинеколога через 5 нед после окончания лечения. Гинекологическое зеркало S входит почти на полную длину, открывается, но в самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Осмотр безболезненный, шейка доступна осмотру, коническая, гладкая, несколько изменена рубцами, кровоточит при взятии материала для цитологического исследования. Матка нормальных размеров, минимально подвижна, безболезненна при пальпации, правые и левые придатки не определяются пальпаторно, их проекция безболезненная. Паховые лимфоузлы не пальпируются с обеих сторон. Трансвагинальное ультразвуковое исследование (УЗИ): без эхо-патологии. Цитологическое исследование соскоба шейки матки методом жидкостной цитологии (PAP smear) не обнаружило опухолевых клеток.
Осмотр гинеколога через 2 года и 7 мес после лечения. Зеркало S входит на полную длину и открывается, но в самом куполе влагалища боковые синехии, сужающие влагалище по типу песочных часов прямо перед шейкой. Осмотр в целом безболезненный, шейка матки стала доступна визуальному осмотру (положительная динамика за последние 7 мес), конической формы, с гладкой поверхностью, несколько изменена рубцами, кровоточит при заборе материала на цитологию. Матка нормальных размеров, минимально подвижна, безболезненна при пальпации, правые и левые придатки не определяются пальпаторно, их проекция безболезненная. Паховые лимфоузлы не пальпируются с обеих сторон. Параметрии, паракольпос, своды влагалища, стенки таза с обеих сторон свободны. Ректовагинальная перегородка не изменена.
На контрольном ПЭТ-КТ через 2 года и 7 мес после лечения патологического гиперметаболизма в шейке матки и в других местах тела не обнаружено. Через 3 года и 6 мес субъективно и физикально без патологической динамики.
Наблюдение 2. Женщина 46 лет обратилась с жалобами на кровотечение из половых путей вне менструации. При осмотре наружные половые органы и влагалище без патологических признаков. Шейка матки бочкообразная размером около 4,0 см, плотная, определяются пришеечные инфильтраты. Матка увеличена до 10–12 нед, подвижна, в области придатков образований не определяется. Гистологическое исследование материала из цервикального канала выявило плоскоклеточный неороговевающий рак.
На МРТ картина злокачественного новообразования шейки матки 68 мм в наибольшем измерении с распространением на нижнюю треть тела матки, парацервикальную клетчатку с неравномерной инвазией больше справа и на передний свод влагалища. Мочеточники не вовлечены.
По данным ПЭТ-КТ картина гиперметаболического опухолевого образования шейки матки; два метастатически измененных лимфатических узла (правые общий и внутренний подвздошный) с низкой метаболической активностью. Опухоль имеет размеры 59,4×53×82,4 мм, полностью охватывает своды влагалища.
Диагноз: плоскоклеточный неороговевающий рак шейки матки, правосторонний параметральный вариант, с вовлечением нижней трети тела матки, с метастазами в правые общий и внутренний подвздошные лимфатические узлы, стадия T2bN1M0 (FIGO IIIC1).
Хирургическое лечение при данной стадии не показано. На консилиуме обсужден с больной курс сочетанной лучевой терапии с одновременной химиотерапией. Несмотря на разъяснение всех вариантов лечения и их последствий, больная от инвазивного компонента отказалась. На этапе подписания информированного согласия на лучевое лечение она настояла на проведении лечения только дистанционным методом по радикальной программе.

Проведен курс адаптивной химиолучевой терапии на линейном ускорителе электронов Varian EDGE по технологии RapidArc с использованием методики IGRT. Облучение проводилось в 5 этапов в режиме классического фракционирования с синхронным интегрированным бустом на опухоль шейки матки. КТ-топометрия и последующее облучение выполнены в положении тела пациентки на животе на устройстве Belly Board. Адаптивность проводилась по тем же принципам, которые описаны в первом случае. Мы снова старались дистанционным облучением максимально соответствовать классической онкогинекологической методике IGABT – второго этапа стандартной сочетанной лучевой терапии.
На 1-м этапе облучались матка, параметрии справа и слева, влагалище, парааортальные лимфатические узлы, узлы таза справа и слева общие, внутренние и наружные подвздошные, а также запирательные и пресакральные. Осуществлено 25 фракций по 1,8 Гр до СОД 45,0 Гр, с одновременным интегрированным бустом 0,5 Гр на опухоль шейки матки до СОД в этом месте 57,5 Гр. Дозиметрические планы всех этапов представлены на рис. 4.
На 2-м этапе облучался тот же объем, но без пара-аортальных лимфоузлов и адаптивно к изменившейся топографии злокачественного роста и критических органов согласно контрольной МРТ. РОД 1,8 Гр 5 фракций до СОД 54,0 Гр с одновременным интегрированным бустом 0,5 Гр на область опухоли шейки матки в режиме до СОД в зоне буста 69,0 Гр.
На 3-м этапе после очередной оценки динамики процесса и изменения синтопии мишени и критических органов облучались справа (зона высокого риска) GTV первичного очага, параметрии, верхняя и средняя трети влагалища, внутренние и наружные подвздошные лимфатические узлы. Осуществлены три фракции по 1,8 Гр до СОД 59,4 Гр с одновременным интегрированным бустом 0,5 Гр на опухоль шейки матки до СОД в зоне буста 75,9 Гр.
Промежуточная контрольная МРТ малого таза после третьего этапа химиолучевой терапии: МР-признаков персистирования опухоли в полости таза нет, постлучевые изменения. Контрольное ПЭТ-КТ в процессе химиолучевой терапии (перед 4-м этапом облучения): не выявлено очагов патологической метаболической активности, характерной для 18FDG-позитивного неопластического процесса.
На 4-м этапе лучевого лечения адаптивно облучались опухоль шейки матки и локально метастазы в общем и внутреннем подвздошных лимфатических узлах справа. Доза на опухоль шейки матки с учетом предыдущих планов – 81,3 Гр, на пораженные лимфоузлы – 64,8 Гр.
При контрольном осмотре на этом этапе лечения у больной был выявлен умеренный цистит и вагинальный кандидоз.
Пятый этап лучевого лечения состоял из двух планов. По первому – облучалась опухоль шейки матки тремя фракциями по 1,8 Гр до СОД 86,7 Гр. Объем облучения вновь корректирован согласно новым МРТ и ПЭТ-КТ. Проведена новая КТ-топометрия с внутривенным контрастированием и новое оконтуривание объемов мишени и критических органов. Второй план 5-го этапа лучевого лечения состоял в локальном дооблучении двух выше описанных метастатических лимфатических узлов таза (правые общий и внутренний подвздошные) тремя фракциями по 1,8 Гр до СОД 70,2 Гр.
Химиотерапевтический компонент был представлен пятью курсами еженедельного введения карбоплатина (AUC 1,5).
Пациентка перенесла лечение относительно удовлетворительно, наблюдались явления химиолучевого цистита II степени.
Через 9 мес после окончания лечения на МРТ сохраняется картина полного ответа на лечение, макропризнаков рецидивной опухолевой ткани нет, постлучевые изменения шейки матки. На ПЭТ-КТ в то же время не выявлено очагов патологической метаболической активности, характерной для 18FDG-позитивного неопластического процесса. Полный ответ заболевания на проведенное химиолучевое лечение. Данных, подтверждающих прогрессирование, не выявлено.
Гинекологический осмотр через 9 мес после лечения. Влагалище длиной 7 см, в куполе синехии разделены зеркалом и пальпаторно. Фрагментарно визуализирована шейка матки, маленькая, гладкая, без дефектов слизистой. Параметрии свободны с обеих сторон. Стенка таза свободная. Матка нормальных размеров, подвижна, безболезненна при пальпации. По данным гинекологического осмотра – норма, без клинических признаков поражения параметриев, постлучевые изменения влагалища по типу нежного слипчивого процесса. Трансвагинальное УЗИ: шейка матки длиной 22 мм, по толще передней губы несколько гиперэхогенных включений – следствие лучевой терапии. Матка размерами 41×38×45 мм, по задней стенке интерстициальный миоматозный узел 16×11 мм, полость матки расширена в нижней трети до 2,2 мм однородным анэхогенным содержимым, эндометрий 1 мм, однородный, яичники 18×10 мм, гомогенные, без фолликулов, свободной жидкости в малом тазу нет. Через 3 года субъективно и физикально без патологической динамики.
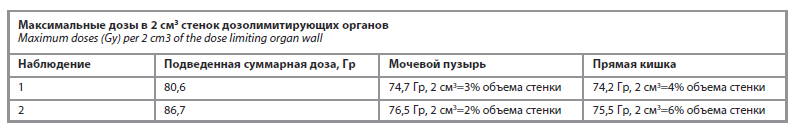
Максимальные дозы в 2 см3 стенок дозолимитирующих органов представлены в таблице.
Допустимые пределы доз согласно протоколу RTOG 0126 для мочевого пузыря V15%<80 Гр, для прямой кишки V15%<75 Гр.
Обсуждение
Мы описали два случая вынужденного нестандартного лечения РШМ, когда в силу невозможности выполнить брахитерапевтический этап нам пришлось модифицировать официальные рекомендации. Это было единственной возможностью спасти жизни пациенток. Оба случая могут считаться успешными, несмотря на то что были отягощены. Первый представил собой IVa стадию РШМ (FIGO), был вторым раком в жизни пациентки, протекал на фоне ВИЧ-инфекции 4а стадии и астенического синдрома после тяжелого COVID-19. Кроме того, облучение у нее проводилось после эмболизации маточных артерий, что делает опухоль менее радиочувствительной. Второе наблюдение представляет распространенную стадию РШМ (IIIC1) с метастазами в тазовые лимфатические узлы. Пациентки наблюдаются почти 3 и 3,5 года в состоянии клинической ремиссии и без осложнений. В обоих случаях мы построили свою модель облучения на основе международных рекомендаций по адаптивной брахитерапии РШМ (IGABT) [1], а также последних (2023) ESGO/ESTRO/ ESP Guidelines [2].

Проводя только дистанционную радиотерапию по радикальной программе, т.е. унимодально, облучение адаптировалось к изменениям положения мишени и динамике ответа опухоли в процессе лечения. При этом использовалась методика IGRT в реальном времени. Таким образом, нашу методику можно назвать, употребляя по аналогии международные признанные обозначения, Image Guided Adaptive External Beam Radiation Therapy – IGAEBRT.
Основной контингент больных РШМ представлен лицами с заболеваниями от IA2 до IVB стадий. Главный лечебный фактор у них – ионизирующее излучение. Согласно клинической рекомендации ID:537 Минздрава России [3], лучевой компонент лечения основной массы больных РШМ состоит из дистанционного и брахитерапевтического этапов. Аналогичная тактика изложена в «Стандартах лучевой терапии» [4] и в клинических алгоритмах National Comprehensive Cancer Network (США) [5]. Однако издавна специалисты-онкогинекологи указывали на то, что стандартную официальную программу не удается осуществить довольно большому числу пациенток. В основном это случается из-за невозможности проведения внутриполостного/внутритканевого этапа облучения.
Обычно внутриполостной этап лучевого лечения не удается провести из-за невозможности ввести эндостат в закрытый после дистанционного этапа остаточной опухолью цервикальный канал. Бывает также обратная ситуация, когда после хорошего регресса опухоли на первом этапе химиолучевого лечения вместо цервикального канала получается большая полость, в которой нельзя однообразно и стабильно расположить эндостат с источником излучения. При описании таких наблюдений невозможность ввести или фиксировать эндостат наблюдалась у 59% больных [6]. Тогда больные попадают в критическое положение, угрожающее смертью от неизлеченного рака. Часть больных отказывается от брахитерапии или не переносит ее.
Есть и другие обстоятельства, препятствующие осуществлению внутриполостного/внутритканевого этапа. Например, в некоторых учреждениях, которым приходится лечить больных с раком шейки матки, нет реальной возможности проводить брахитерапию или проводить ее правильно. Учитывая трудности, с которыми сталкивается на практике радиотерапевт на брахитерапевтическом этапе лучевого лечения РШМ, некоторые врачи в борьбе за жизнь больной давно старались обойти считавшиеся незыблемыми указания путем замены его на продолжающееся дистанционное облучение.
По-видимому, первая попытка самостоятельного дистанционного лучевого лечения РШМ принадлежит F. Baclesse в 1938 г. У него был облучатель с энергией всего 200 кВ, но он вылечил этим способом 9 человек из 63 (цит. по Acta Unio Internationalis Contra Cancrum, 1993) [7]. В 1954 г. H.-L. Kottmeier в статье «Современные направления в лечении рака шейки матки» [8] ссылается на работу F. Baclesse 1950 г. [9] о лечении только внешнем облучением. Автор говорит о том, что достижение удовлетворительных результатов требует индивидуального подхода и метод F. Baclesse показан определенным больным, и у них он «может быть лучше применения радия».
J. Castro и соавт. [10] в 1970 г. представили результаты дистанционного лучевого лечения 108 больных РШМ в University of Texas M.D. Anderson Hospital и в Tumor Institute of Houston. В их серии наблюдений «большинство из 84 больных со стадией III или IV не подходили для дополнительного лечения радием из-за распространенности болезни. Несколько больных от такого лечения отказались. Было 24 больных с менее продвинутой болезнью, которым внутриполостной радий не применялся, потому что: a) узкие своды влагалища,
б) культя шейки слишком коротка, чтобы принять радиевые источники, в) латерализованная тазовая болезнь (стадия III), эффективность лечения которой радием сомнительна».
Одним из решающих факторов, определяющих неуспех лучевого лечения РШМ, считается неадекватное подведение дозы излучения по краям опухоли от брахитерапевтического компонента [11–13].
P. Ferreira и соавт. (1999) [14] поддерживают известное положение о необходимости сочетанной лучевой терапии, но сразу оговариваются: не всем больным можно провести брахитерапевтический этап облучения и тогда надо проводить дистанционное облучение по радикальной программе. У авторов под наблюдением с 1980 по 1997 г. было 1234 больных с РШМ, леченных ионизирующим излучением. Из них в исследование вошли 186 пациенток со стадией IIIB (хотя всего таких больных было 228). Брахитерапию не удалось провести у 109 из этих больных. Причины: большая остаточная опухоль, узкое влагалище, опухолевая язва во влагалище, прорастание в соседние органы, полость матки не подходит для установки аппликатора, непереносимость брахитерапии. Среди других причин были: тазовые абсцессы, психические заболевания, сопутствующие болезни и др., но обращает на себя внимание среди них личное решение больной.
Индийский коллектив авторов (E. Saibishkumar и соавт., 2005) [15] продемонстрировал возможность дистанционной лучевой терапии у больных с РШМ. Они описали результаты этого лечения у 146 человек из общего числа пролеченных 1069. Большинство больных – 124 пациентки имели стадию IIIB.
S. Killic и соавт. (2015) [16] обобщили результаты дистанционного лучевого лечения рака шейки матки тринадцати радиотерапевтических учреждений. Вместо брахитерапии использовались протонный буст, трехмерная конформная лучевая терапия (3DCRT), облучение с модуляцией интенсивности пучков (IMRT) и стереотаксическая лучевая терапия (SBRT). Локальный контроль был достигнут в 75–100% случаев. Максимальная частота токсичности более II степени составила в одном исследовании 17%, в другом – 25%. В других случаях этот показатель чаще всего был равен нулю, но мог достигать 2, 4, 7, 8 и 14%. В своей статье под названием «Небрахитерапевтические альтернативы в радиотерапии рака шейки матки: почему нет?» авторы дают ответ: «Да». Выводы S. Kilic и соавт.: чтобы заменить брахитерапию бустерным облучением методами IMRT или SBRT, они обязательно должны соответствовать определенным жестким требованиям. Они касаются точности определения облучаемых объемов, оптимизации дозиметрических планов, адаптивному облучению с повторными визуализациями и др. Несоблюдение этих условий приведет к неправильному представлению об IMRT и SBRT и снижению их эффективности.
Для достижения хорошего местного контроля шейка матки должна получить не менее 70 Гр, но осложнения со стороны прямой кишки и мочевого пузыря после 60 Гр стремительно нарастают. Неспособность подвести требуемые дозы дистанционно из-за осложнений в прежние времена приводила к плохим результатам лечения и поддерживала мнение, что при радиотерапии РШМ без внутриполостной брахитерапии не обойтись.
Современная аппаратура позволяет добиваться такого дозного распределения, которого мы ждем от внутриполостной брахитерапии, но с минимумом осложнений [17]. Теперь на еще более современной аппаратуре мы это можем делать при помощи методики RapidArc [18].
Оказалось, чтобы сохранить жизнь больным с РШМ, надо затратить нетрадиционный ресурс. Очень трудоемко в радиотерапевтическом отделении многократно перепланировать лучевое лечение и применять on-line IGRT. К сожалению, представленная нами методика пока не везде может быть осуществлена, и мы пока не должны отказываться от сочетанной программы радиотерапии. Однако сегодня нельзя не видеть, что исторически сложившиеся понятия не должны быть догматичными, хотя бы потому, что это препятствие на пути прогресса. Видимо, пора направить приоритеты в организации здравоохранения хотя бы в онкогинекологии на решение онкологических и организационных вопросов, затраты на это вряд ли будут велики, а человеческая жизнь не имеет цены.
Заключение
Требования к двухэтапному сочетанному лучевому лечению РШМ, заложенные в руководства несколько десятилетий назад, в условиях современной радиотерапии и онкологии не должны иметь свойства догмы.
У части больных особенности болезни диктуют лечение по модифицированным рекомендациям. Методика IGAEBRT, выполненная на современном методическом уровне, может быть успешной. В наше время сложились условия для внесения обновлений в принципы лучевого лечения РШМ. Это будет способствовать улучшению результатов лечения РШМ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Вклад авторов. Авторы внесли равный вклад в разработку концепции статьи, подготовку и обсуждение черновика, анализ литературных данных и финальную проверку рукописи.
Author’s contribution. All authors contribute equally to the conception of the article, preparing and talk over the draft, literature review and final control of the manuscript.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Ислим (Салим) Нидаль – канд. мед. наук, зав. Центром лучевой терапии Европейского медицинского центра; ассистент каф. радиотерапии и радиологии, ФГБОУ ДПО РМАНПО. E-mail:
salnidal@yahoo.com; ORCID: 0000-0003-2630-4961
Salim (Islim) Nidal – Cand. Sci. (Med.), European Medical Center Russian, Medical Academy of Continuous Professional Education.
E-mail: nsalim@emcmos.ru; ORCID: 0000-0003-2630-4961
Лойко Илья Евгеньевич – врач-радиотерапевт Европейского медицинского центра. E-mail: iloyko@emsmos.ru; ORCID: 0000-0002-6909-8558
Ilya Loiko – Radiotherapist, European Medical Center. E-mail: iloyko@emcmos.ru; ORCID: 0000-0002-6909-8558
Зверева Дарья Павловна – врач-радиотерапевт Европейского медицинского центра. E-mail: dzvereva@emcmcos.ru; ORCID: 0009-0009-8357-8011
Darya Zvereva – Radiotherapist, European Medical Center. E-mail: dzvereva@emcmos.ru; ORCID: 0009-0009-8357-8011
Столбовой Александр Викторович – д-р мед. наук, проф. каф. радиотерапии и радиологии, ФГБОУ ДПО РМАНПО; врач-радиотерапевт Европейского медицинского центра. E-mail: lefortovo@hotmail.com; ORCID: 0009-0000-4961-4810
Alexander V. Stolbovoy – Dr. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education; Radiotherapist, European Medical Center. E-mail: lefortovo@hotmail.com; ORCID: 0009-0000-4961-4810
Рыжкин Сергей Александрович – зав. каф., ФГБОУ ДПО РМАНПО; ФГБОУ ВО «Казанский ГМУ». E-mail: rsa777@inbox.ru; ORCID: 0000-0003-2595-353X
Sergey A. Ryzhkin – Head of the Department, Russian Medical Academy of Continuous Professional Education; Kazan State Medical University. E-mail: rsa777@inbox.ru; ORCID: 0000-0003-2595-353X
Поступила в редакцию: 10.04.2025
Поступила после рецензирования: 17.04.2025
Принята к публикации: 15.05.2025
Received: 10.04.2025
Revised: 17.04.2025
Accepted: 15.05.2025
Список исп. литературыСкрыть список1. ICRU Report 89, Prescribing, Recording, and Reporting Brachytherapy for Cancer of the Cervix. J ICRU 2013;13(1-2):NP. DOI: 10.1093/jicru/ndw027. PMID: 27335496.
2. Cibula D, Raspollini M, Planchamp F et al. ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer. Update 2023. Int J Gynecol Cancer 2023;33(5):649-66. DOI: 10.1136/ijgc-2023-004429. PMID: 37127326; PMCID: PMC10176411.
3. Рак шейки матки. Клиническая рекомендация ID:537. Минздрава России. URL: https://cr.minzdrav.gov.ru/schema/537_1 (дата обращения: 24.03.2024)
Cervical cancer. Clinical Recommendation ID:537. Ministry of Health of Russia. URL: https://cr.minzdrav.gov.ru/schema/537_1 (date of access: 03/24/2024) (in Russian).
4. Бойко А.В., Демидова Л.В., Дунаева Е.А., Дубовецкая О.В. Рак шейки матки. В кн.: Стандарты лучевой терапии. Под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. М.: ГЭОТАР-Медиа, 2019.
Boyko A.V., Demidova L.V., Dunaeva E.A., Dubovitskaya O.V. Cervical cancer. In: Standards of radiation therapy. Ed. A.D. Kaprin, A.A. Kostin, E.V. Khmelevsky. Moscow, GEOTAR-Media, 2019 (in Russian).
5. NCCN Guidelines Version 1.2024 Cervical Cancer. URL: https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf (date of access 24.03.2024).
6. Barraclough LR. External beam boost for cancer of the cervix uteri when intracavitary therapy cannot be performed. Int J Radiation Oncology Biol Phys 2008;71(3):772-8. DOI: 10.1016/j.ijrobp.2007.10.066
7. Acta Unio Internationalis contra Cancrum. 1939;IV(1-2). Numero consacre a la Semaine Internationale contre le Cancer et a le Reunion Internationale pour la Commemoration de la Decouverte de Radium, des Electrons, des Rayons-X et des Ondes Hertziennes. Hermann & Cie, Paris.
8. Kottmeier H-L. Modern Trends in the treatment of cancer of the cervix. Acta Radiologica 1954;41(Supl. 116):405-14. DOI: 10.3109/000169 25409177214
9. Baclesse F. Roentgen therapy alone in the treatment of advanced cervico-uterine cancer, including extensive postoperative recurrences. Am J Roentgenol 1950;63:252-4.
10. Castro J, Issa P, Fletcher G. Carcinoma of the cervix treated by external irradiation alone. Radiology 1970;95(163-6). DOI: 10.1148/95.1.163. PMID: 4984677
11. Landoni F, Maneo A, Colombo A et al. Randomised stady of radical surgery versus radiotherapy for stage Ib-IIa cervical cancer. Lancet 1997;350(9077):535-40.
12. Cengiz M, Gurdalli S, Genc M et al. Comment on «Correlation between the treated volume, the GTV and the CTV at the time of brachytherapy and histopathologic finding in 33 patients with operable cervix carcinoma». Radiotherapy and Oncology 2005;75:367-8.
13. Cengiz M, Gurdalli S, Selek U et al. Effect of bladder distension on dose distribution of intracavitary brachytherapy for cervical cancer: tree-dimentional computed tomography plan evaluation. Int J Rad Oncol Boil Phys 2008;70(2):464-8.
14. Ferreira P, Braga-Filho A, Barletta A, Ilha L. Radiation therapy alone in stage III-B cancer of the uterine cervix--a 17-year old experience in southern Brazil. Int J Radiat Oncol Biol Phys 1999;45(2):441-6. DOI: 10.1016/s0360-3016(99)00178-9
15. Saibishkumar E, Patel F, Sharma S et al. Results of external-beam radiotherapy alone in invasive cancer of the uterine cervix: a retrospective analysis. Clin Oncol (R Coll Radiol) 2006;18(46-51). DOI: 10.1016/j.clon.2005.10.004. PMID: 16477919
16. Kilic S, Cracchiolo B, Mahmoud O. Non-brachytherapy alternatives in cervical cancer radiotherapy: Why not? Applied radiation oncology 2015;(12):10-7.
17. Matsuura K, Tanimoto H, Fujita K et al. Early clinical outcomes of 3D-conformal radiotherapy using accelerated hyperfractionation without intracavitary brachytherapy for cervical cancer. Gynecol Oncol 2007;104(1):11-4. DOI: 10.1016/j.ygyno.2006.06.033
18. Salim N, Tumanova K, Stolbovoy A et al. Adaptive VMAT Radiotherapy to Avoid Brachytherapy in Cervical Cancer Treatment. International Journal of Radiation Oncology, Biology, Physics 2022;114(3) Suppl. 2583:e262. DOI: 10.1016/j.ijrobp.2022.07.1255

