Клинический разбор в общей медицине №12 2025
1 Lomonosov Moscow State University, Moscow, Russia;
2 Branch Office of «Hadassah Medical Ltd», Moscow, Russia
Ana12@ya.ru
Abstract
Background. Romiplostim is a medicinal product belonging to the group of thrombopoietin receptor agonists that has shown its efficacy and safety in treatment of immune thrombocytopenia. The number of studies focused on the efficacy of this group of drugs in patients with chemotherapy-induced thrombocytopenia is still limited.
Aim. To assess the efficacy of romiplostim therapy for thrombocytopenia in patients with solid tumors receiving antitumor drug therapy
Methods. A retrospective cohort study involved 35 patients (17 patients in the group treated with romiplostim and 18 patients in the control group) with solid neoplasms and platelet counts below 100×109/L, who received antitumor drug therapy. The platelet counts in the complete blood counts reported before and 4–8 days after the beginning of follow-up were taken into account. Primary endpoint: achieving the platelet counts above 100×109/L in 4–8 days. Secondary endpoints: platelet concentrate transfusion, reduction of the antitumor drug therapy dose and/or moving the date of the start of the antitumor drug therapy cycle, chemotherapy regimen change. Fischer’s exact test and Mann–Whitney U-test were used.
Results. In the control group, there were more patients, who achieved the counts above 100×109/L in 4–8 days, than in the group treated with romiplostim (50.00% vs 29.41%). After 4–8 days, the average platelet count value for the group treated with romiplostim was 93.11×109/L, and that reported for the control group was 128.89×109/L. The treatment regimen adjustment (moving the date of the start of the cycle and/or chemotherapy dose reduction) was needed almost twice more often by the control group, than by the group of patients receiving romiplostim (72.22% vs 41.18%). The platelet concentrate transfusion was necessary for 2 (11.8%) patients in the group treated with romiplostim and 2 (11.1%) patients in the control group. The chemotherapy regimen was changed in 1 (5.88%) patient in the romiplostim group and 2 (11.11%) patients in the control group.
Conclusion. The study showed no efficacy in adjustment of chemotherapy-induced thrombocytopenia relative to the standard within 4–8 days after the beginning of follow-up. Further research is required to determine the efficacy of romiplostim in certain chemotherapy regimens and tumor types.
Keywords: romiplostim, chemotherapy-induced thrombocytopenia, solid tumors, hematological toxicity.
For citation: Vaskovskaia A.K., Tarnovsky R.V. Efficacy of romiplostim therapy for hematological toxicity in patients with solid tumors. Clinical review for general practice. 2025; 6 (12): 44–48 (In Russ.). DOI: 10.47407/kr2025.6.12.00729
Гематологическая токсичность является одним из наиболее частых осложнений в терапии солидных опухолей. На сегодня достигнуты большие успехи в коррекции анемического синдрома и нейтропении, однако лечение вторичной тромбоцитопении остается одной из самых больших проблем ввиду отсутствия эффективной и безопасной терапии этого осложнения.
Тромбоцитопения характеризуется снижением количества тромбоцитов в клиническом анализе крови менее 150×109/л. В зависимости от режима химиотерапии встречаемость тромбоцитопении среди онкологических пациентов составляет от 21,9% до 64,2% [1]. У таких пациентов выше риск кровотечений и смерти [2, 3].
Патогенез связан с прямым повреждением мегакариоцитов химиотерапевтическими препаратами, что приводит к нарушению тромбоцитопоэза и активации апоптоза [4]. Дополнительным фактором ухудшения кроветворения являются метастазы в костный мозг [5].
Одними из основных подходов при возникновении ассоциированной с химиотерапией тромбоцитопенией являются перенос курса химиотерапии, редукция доз, смена режима химиотерапии или отмена терапии, что приводит к худшим результатам беспрогрессивной и общей выживаемости [6]. В редких случаях может использоваться трансфузия концентрата тромбоцитов, которая может восполнить уровень тромбоцитов до необходимого. К преимуществам метода можно отнести доказанную эффективность и скорость ответа. Основными минусами данного метода являются краткосрочность достигнутого эффекта, фармакоэкономическая составляющая, риски гемотрансфузионных осложнений, дефицит гемокомпонентов в станциях переливания крови [7]. Агонисты тромбопоэтиновых рецепторов – относительно новая группа лекарственных средств, доказавшая свою
безопасность и эффективность у пациентов с иммунной тромбоцитопенией. К препаратам данной группы относятся: элтромбопаг, аватромбопаг, ромиплостим [7].
Ромиплостим – гибридный белок, состоящий из Fc-фрагмента IgG1 и последовательности 14 аминокислот. Действуя на тромбопоэтиновые рецепторы мегакариоцита в костном мозге, он индуцирует митоз, созревание мегакариоцитов, продукцию тромбоцитов и увеличение их количества в периферической крови [8].
У здоровых добровольцев количество тромбоцитов при подкожном введении увеличивалось через 4–9 дней, достигая максимума на 12–16-й день [9]. После подкожного введения пациентам с иммунной тромбоцитопенией, получающих данное лечение еженедельно в дозах от 3 до 15 мкг/кг, максимальная концентрация ромиплостима в сыворотке крови достигалась приблизительно через 7–50 ч, а период полувыведения составлял приблизительно от 1 до 34 дней (в среднем 3,5 дня) [10]. Предполагается, что активность ромиплостима характеризуется насыщением рецепторов тромбоцитов и мегакариоцитов, а не концентрацией ромиплостима в сыворотке крови.
Агонисты рецептора тромбопоэтина не одобрены в качестве терапии тромбоцитопении, индуцированной противоопухолевой лекарственной терапией, из-за отсутствия крупных исследований по их применению. Согласно рандомизированному клиническому исследованию II фазы 85% пациентов с тромбоцитопенией, индуцированной химиотерапией, достигли уровня тромбоцитов 100×109/л за три недели еженедельного применения ромиплостима [11]. Ретроспективное когортное исследование доказало, что ромиплостим был эффективен (количество тромбоцитов ≥75×109/л и рост количества тромбоцитов на 30×109/л и более от исходного уровня) в коррекции тромбоцитопении, индуцированной химиотерапией, у 85% пациентов с солидными и гематологическими опухолями [12]. Наше исследование поможет оценить эффективность терапии тромбоцитопении ромиплостимом у пациентов с солидными опухолями при применении противоопухолевой терапии.
Материалы и методы
Методология исследования. Одноцентровое ретроспективное когортное исследование. Участвуют пациенты с декабря 2021 г. по март 2025 г. Критерии включения: пациенты старше 18 лет с верифицированным солидным новообразованием, верифицированной гематологической токсичностью в виде тромбоцитопении (тромбоциты менее 100×109/л). Во время начала исследования пациент получал противоопухолевое лекарственное лечение. Из исследования были исключены пациенты с трансфузиями концентрата тромбоцитов за 1–5 дней до применения ромиплостима, с применением других агонистов тромбопоэтиновых рецепторов, с верифицированной гематологической опухолью или верифицированной иммунной тромбоцитопенией.
В исследовании участвует 2 группы: с применением ромиплостима и группа с применением стандартов коррекции тромбоцитопении (переливание концентрата тромбоцитов, редукция доз, смена режима химиотерапии, перенос даты химиотерапии, отмена химиотерапии). Стандарты коррекции тромбоцитопении возможны в отношении группы с применением ромиплостима.
Сбор данных. Сбор обезличенных данных производился в Excel из электронных медицинских карт в программе qMS. Производился сбор данных о возрасте, поле, заболевании, тромбоцитопении: количество тромбоцитов в клиническом анализе за 2 дня/за 1 день перед/в день применения ромиплостима, количество тромбоцитов в клиническом анализе крови с 4 по 14-й дни после применения ромиплостима. Оценка тромбоцитопении проводилась при помощи Common Terminology Criteria for Adverse Events Version 5.0 (CTCAE v5.0): grade 1 – нижняя граница нормы – 75×109/л, grade 2 – 75×109/л – 50×109/л, grade 3 – 50×109/л – 25×109/л, grade 4 – <25×109/л. Результаты анализа крови допускались из разных лабораторий. День сдачи клинического анализа крови зависел от назначения лечащего врача.
Схемы химиотерапии были определены с использованием иерархической структуры наиболее высокого ассоциированного риска развития тромбоцитопении, основанной на обзоре литературы [1, 13]. Схемы лечения на основе гемцитабина включали все схемы, содержащие гемцитабин, за ними следовали схемы на основе препаратов платины (которые не включали гемцитабин), затем схемы на основе антрациклина, таксана и все другие схемы. Например, схема гемцитабин + цисплатин будет классифицироваться как основанная на гемцитабине. Также учитывались пациенты, получающие лучевую терапию. Производился сбор данных о дозе и дне введения ромиплостима в зависимости от цикла химиотерапии. Диагностика костных метастазов проводилась посредством компьютерной томографии, магнитно-резонансной томографии или биопсии костного мозга.
Статистический анализ. Первичной конечной точкой выступало достижение уровня тромбоцитов >100×109/л после введения с 4 по 8-й дни после применения ромиплостима.
Вторичными конечными точками стали переливание концентрата тромбоцитов, редукция доз противоопухолевой лекарственной терапии (отмена одного или нескольких препаратов из схемы химиотерапии засчитывалась как редукция доз) и/или перенос даты начала цикла противоопухолевой лекарственной терапии, смена режима химиотерапии.
Размеры групп были максимально возможными.
Для обработки данных будут использоваться программы Excel и SPSS.
Некоторые характеристики будут обобщены с использованием описательной статистики (средние значения, стандартные отклонения для непрерывных переменных, таких как возраст, и проценты для категориальных переменных, таких как пол, диагноз, протокол лечения).
Для проверки нормальности распределения использовался критерий Шапиро–Уилка.
Использовался точный критерий Фишера, чтобы определить, существует ли существенная связь между применением ромиплостима и достижением уровня тромбоцитов более 100×109/л. Также данный критерий использовался для определения различий в группах для вторичных конечных точек. Для выявления различий между значениями тромбоцитов через 4–8 дней будет использован U-критерий Манна–Уитни.
Описательная статистика использовалась для обобщения вторичных конечных точек.
Результаты
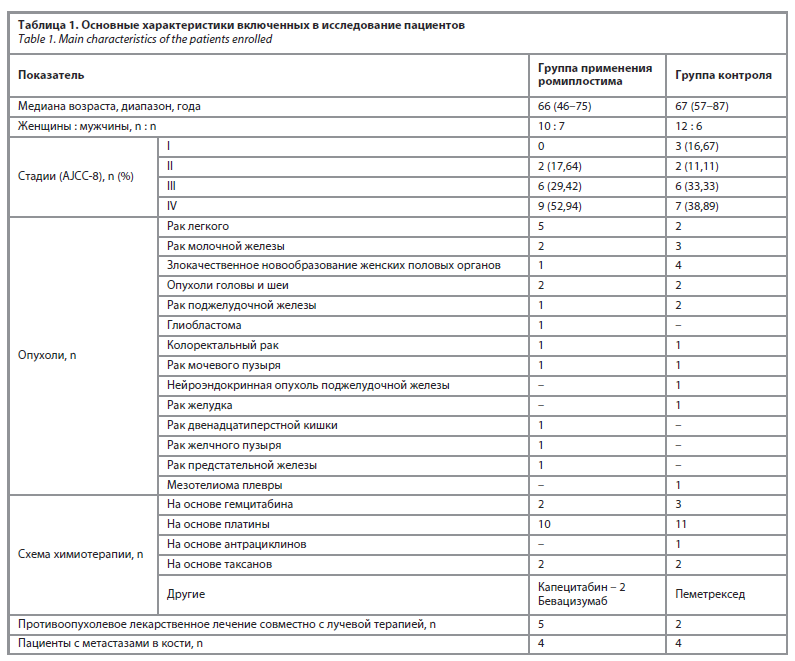
В исследование включены 35 пациентов (табл. 1). Медиана возраста в группе применения ромиплостима и контрольной группе составила 66 и 67 лет соответственно. В обеих группах преобладали женщины. Наблюдался широкий спектр злокачественных новообразований, наиболее распространенными из которых были рак легкого, рак молочной железы и злокачественные новообразования женских половых органов. У большинства на момент постановки диагноза была выявлена IV стадия (AJCC-8). 55,56% и 61,11% в группе с применением ромиплостима и контрольной группе соответственно получали препараты платины в основе лекарственной терапии.
Большинство пациентов получали ромиплостим однократно, 14 пациентов получали ромиплостим в дозе 250 мкг, 2 пациента – 150 мкг, 1 пациент – 75 мкг. Доза и время введения ромиплостима зависели от решения врача. У 7 пациентов цикл химиотерапии назначался за 1–2 дня до введения ромиплостима и в течение двух дней после, 3 из 17 получили ромиплостим двукратно с интервалом в неделю.
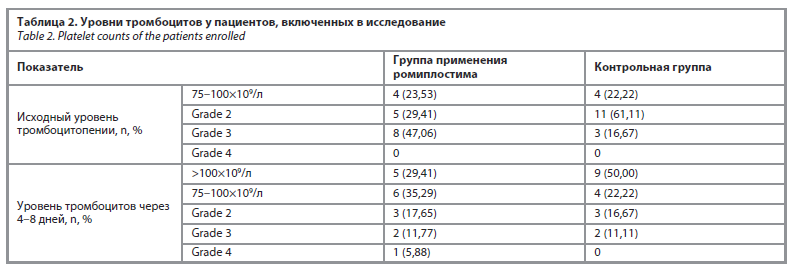
 Исходный уровень тромбоцитопении (табл. 2) был grade 1 – grade 3 в обеих группах. Около половины пациентов в группе применения ромиплостима имели grade 3 уровень тромбоцитопении, у 11 (61,11%) пациентов из контрольной группы был grade 2 уровень тромбоцитопении.
Исходный уровень тромбоцитопении (табл. 2) был grade 1 – grade 3 в обеих группах. Около половины пациентов в группе применения ромиплостима имели grade 3 уровень тромбоцитопении, у 11 (61,11%) пациентов из контрольной группы был grade 2 уровень тромбоцитопении.
В контрольной группе больше пациентов достигло уровня более 100×109/л за 4–8 дней, чем в группе применения ромиплостима (50,00% vs 29,41%). Значимых различий в достижении уровня тромбоцитов более 100×109/л за 4–8 дней между группой с введением ромиплостима и контрольной группой не выявлено (p=0,3053).
Через 4–8 дней наблюдения в обеих группах большинство достигло уровня тромбоцитов 75–100×109/л: 6 (35,29%) пациентов в группе применения ромиплостима, 4 (22,22%) пациента в контрольной группе.
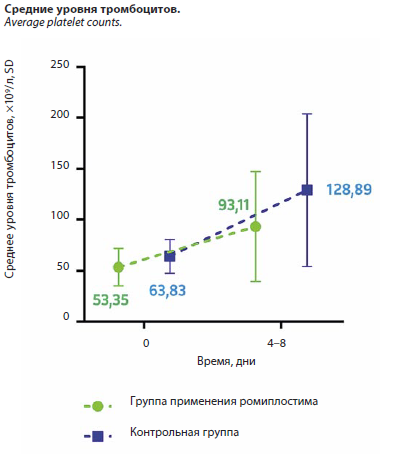
В начале исследования группы не имели статистически значимых различий по уровню тромбоцитов (см. рисунок). Средний уровень тромбоцитов в группе ромиплостима составил 53,35×109/л, в контрольной группе – 63,83×109/л. Через 4–8 дней средняя уровня тромбоцитов в группе применения ромиплостима составила 93,11×109/л тромбоцитов, в контрольной – 128,89×109/л тромбоцитов. Существует статистически значимое различие между исходным уровнем тромбоцитов и уровнем тромбоцитов через 4–8 дней в обеих группах (p<0,05). U-критерий Манна–Уитни (U=116, p>0,05) не показал значимые различия между группой применения ромиплостима и контрольной группой через 4–8 дней.
Трансфузии концентрата тромбоцитов потребовались 2 (11,8%) пациентам в группе применения ромиплостима и 2 (11,1%) пациентам в контрольной группе.
Перенос даты начала цикла противоопухолевой лекарственной терапии и/или редукция доз химиотерапии потребовались 7 (41,18%) пациентам из группы применения ромиплостима, 13 (72,22%) пациентам в контрольной группе (p=0,0922).
Смена режима химиотерапии произошла у 1 (5,88%) пациента в группе применения ромиплостима и у 2 (11,11%) пациентов в контрольной группе.
Только 1 из 3 пациентов, которые получали ромиплостим двукратно, достиг уровня тромбоцитов более 100×109/л после первой дозы. После второй дозы данный пациент достиг уровня 263×109/л, 2 из 3 пациентов после второй дозы не достигли уровня тромбоцитов более 100×109/л.
Обсуждение
Наше ретроспективное когортное исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Полученные результаты не согласуются с исследованиями Soff [11] и Al-Samkari [12], где средняя и медиана уровня тромбоцитов соответственно после первого применения была больше 100×109/л. Такие результаты возможны в связи с включением в нашу выборку пациентов с панцитопенией, применением субоптимальных доз ромиплостима. Также в наше исследование были включены пациенты с предикторами отсутствия ответа на терапию: инвазией в костный мозг, предшествующим облучением органов малого таза и воздействием темозоломида [12].
Наблюдение, что коррекция схемы лечения (перенос даты начала цикла и/или снижение дозы химиотерапии) потребовалась почти в два раза чаще в контрольной группе по сравнению с группой ромиплостима, указывает на потенциальную роль этого препарата в поддержании дозовой интенсивности терапии. В будущих исследованиях следует не только оценить влияние снижения частоты задержек лечения на прогноз пациентов.
Расширяя выборку пациентов, мы сможем выявить типы рака, для которых ромиплостим будет наиболее эффективен. Возможно, ромиплостим будет иметь преимущество в коррекции тромбоцитопении у пациентов с вовлечением печени в опухолевый процесс. Поскольку тромбопоэтин синтезируется преимущественно в печени, ее поражение при онкологическом заболевании может приводить к дефициту тромбопоэтина и развитию тромбоцитопении [14]. В таком случае предиктором ответа на ромиплостим может стать сниженный уровень тромбопоэтина в сыворотке крови.
В будущих исследованиях следует определить эффективную дозу, оптимальную стратегию применения ромиплостима – для профилактики или коррекции тромбоцитопении, индуцированной химиотерапией.
Заключение
Исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Необходимы дальнейшие исследования для определения эффективности ромиплостима в определенных режимах химиотерапии и видах опухолей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Васьковская Анна Константиновна – студентка, ФГБОУ ВО «МГУ им. Ломоносова». E-mail: Ana12@ya.ru
Anna K. Vaskovskaia – Student, Lomonosov Moscow State University. E-mail: Ana12@ya.ru
Тарновский Радион Валерьевич – врач-гематолог, ФК ОО «Хадасса Медикал Лтд»
Radion V. Tarnovsky – Physician-hematologist, Branch Office of «Hadassah Medical Ltd»
Поступила в редакцию: 16.06.2025
Поступила после рецензирования: 26.06.2025
Принята к публикации: 09.10.2025
Received: 16.06.2025
Revised: 26.06.2025
Accepted: 09.10.2025
Клинический разбор в общей медицине №12 2025
Эффективность терапии гематологической токсичности ромиплостимом у пациентов с солидными опухолями
Номера страниц в выпуске:44-48
Аннотация
Актуальность. Ромиплостим – лекарственное средство из группы агонистов тромбопоэтиновых рецепторов, продемонстрировавшее свою эффективность и безопасность в лечении иммунной тромбоцитопении. Количество исследований, посвященных оценке эффективности препаратов данной группы у пациентов с тромбоцитопенией, индуцированной химиотерапией, остается ограниченным.
Цель. Оценить эффективность терапии тромбоцитопении ромиплостимом у пациентов с солидными опухолями, получающих лекарственную противоопухолевую терапию.
Материалы и методы. Ретроспективное когортное исследование включало 35 пациентов (17 пациентов – в группе применения
ромиплостима и 18 пациентов – в контрольной группе) с солидными новообразованиями и уровнем тромбоцитов менее 100×109/л, получающих противоопухолевую лекарственную терапию. Учитывался уровень тромбоцитов в клиническом анализе крови до и через
4–8 дней после начала наблюдения. Первичная конечная точка: достижение уровня тромбоцитов более 100×109/л через 4–8 дней. Вторичные конечные точки: переливание концентрата тромбоцитов, снижение дозы противоопухолевой лекарственной терапии и/или перенос даты начала цикла противоопухолевой лекарственной терапии, смена режима химиотерапии. Использовались точный критерий Фишера и U-критерий Манна–Уитни.
Результаты. В контрольной группе больше пациентов достигло уровня более 100×109/л за 4–8 дней, чем в группе применения ромиплостима (50,00% vs 29,41%). Через 4–8 дней средняя в группе применения ромиплостима составила 93,11×109/л тромбоцитов, в контрольной – 128,89×109/л тромбоцитов. Коррекция схемы лечения (перенос даты начала цикла и/или снижение дозы химиотерапии) потребовалась почти в два раза чаще в контрольной группе, чем в группе пациентов, получавших ромиплостим (72,22% vs 41,18%). Трансфузии концентрата тромбоцитов потребовались 2 (11,8%) пациентам в группе применения ромиплостима и 2 (11,1%) пациентам в контрольной группе. Смена режима химиотерапии произошла у 1 (5,88%) пациента в группе ромиплостима и у 2 (11,11%) пациентов в контрольной группе.
Заключение. Исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Необходимы дальнейшие исследования для определения эффективности ромиплостима в определенных режимах химиотерапии и видах опухолей.
Ключевые слова: ромиплостим, тромбоцитопения, индуцированная химиотерапией, солидные опухоли, гематологическая токсичность.
Для цитирования: Васьковская А.К., Тарновский Р.В. Эффективность терапии гематологической токсичности ромиплостимом у пациентов с солидными опухолями. Клинический разбор в общей медицине. 2025; 6 (12): 44–48. DOI: 10.47407/kr2025.6.12.00729
Актуальность. Ромиплостим – лекарственное средство из группы агонистов тромбопоэтиновых рецепторов, продемонстрировавшее свою эффективность и безопасность в лечении иммунной тромбоцитопении. Количество исследований, посвященных оценке эффективности препаратов данной группы у пациентов с тромбоцитопенией, индуцированной химиотерапией, остается ограниченным.
Цель. Оценить эффективность терапии тромбоцитопении ромиплостимом у пациентов с солидными опухолями, получающих лекарственную противоопухолевую терапию.
Материалы и методы. Ретроспективное когортное исследование включало 35 пациентов (17 пациентов – в группе применения
ромиплостима и 18 пациентов – в контрольной группе) с солидными новообразованиями и уровнем тромбоцитов менее 100×109/л, получающих противоопухолевую лекарственную терапию. Учитывался уровень тромбоцитов в клиническом анализе крови до и через
4–8 дней после начала наблюдения. Первичная конечная точка: достижение уровня тромбоцитов более 100×109/л через 4–8 дней. Вторичные конечные точки: переливание концентрата тромбоцитов, снижение дозы противоопухолевой лекарственной терапии и/или перенос даты начала цикла противоопухолевой лекарственной терапии, смена режима химиотерапии. Использовались точный критерий Фишера и U-критерий Манна–Уитни.
Результаты. В контрольной группе больше пациентов достигло уровня более 100×109/л за 4–8 дней, чем в группе применения ромиплостима (50,00% vs 29,41%). Через 4–8 дней средняя в группе применения ромиплостима составила 93,11×109/л тромбоцитов, в контрольной – 128,89×109/л тромбоцитов. Коррекция схемы лечения (перенос даты начала цикла и/или снижение дозы химиотерапии) потребовалась почти в два раза чаще в контрольной группе, чем в группе пациентов, получавших ромиплостим (72,22% vs 41,18%). Трансфузии концентрата тромбоцитов потребовались 2 (11,8%) пациентам в группе применения ромиплостима и 2 (11,1%) пациентам в контрольной группе. Смена режима химиотерапии произошла у 1 (5,88%) пациента в группе ромиплостима и у 2 (11,11%) пациентов в контрольной группе.
Заключение. Исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Необходимы дальнейшие исследования для определения эффективности ромиплостима в определенных режимах химиотерапии и видах опухолей.
Ключевые слова: ромиплостим, тромбоцитопения, индуцированная химиотерапией, солидные опухоли, гематологическая токсичность.
Для цитирования: Васьковская А.К., Тарновский Р.В. Эффективность терапии гематологической токсичности ромиплостимом у пациентов с солидными опухолями. Клинический разбор в общей медицине. 2025; 6 (12): 44–48. DOI: 10.47407/kr2025.6.12.00729
Efficacy of romiplostim therapy for hematological toxicity in patients with solid tumors
Anna K. Vaskovskaia1, Radion V. Tarnovsky21 Lomonosov Moscow State University, Moscow, Russia;
2 Branch Office of «Hadassah Medical Ltd», Moscow, Russia
Ana12@ya.ru
Abstract
Background. Romiplostim is a medicinal product belonging to the group of thrombopoietin receptor agonists that has shown its efficacy and safety in treatment of immune thrombocytopenia. The number of studies focused on the efficacy of this group of drugs in patients with chemotherapy-induced thrombocytopenia is still limited.
Aim. To assess the efficacy of romiplostim therapy for thrombocytopenia in patients with solid tumors receiving antitumor drug therapy
Methods. A retrospective cohort study involved 35 patients (17 patients in the group treated with romiplostim and 18 patients in the control group) with solid neoplasms and platelet counts below 100×109/L, who received antitumor drug therapy. The platelet counts in the complete blood counts reported before and 4–8 days after the beginning of follow-up were taken into account. Primary endpoint: achieving the platelet counts above 100×109/L in 4–8 days. Secondary endpoints: platelet concentrate transfusion, reduction of the antitumor drug therapy dose and/or moving the date of the start of the antitumor drug therapy cycle, chemotherapy regimen change. Fischer’s exact test and Mann–Whitney U-test were used.
Results. In the control group, there were more patients, who achieved the counts above 100×109/L in 4–8 days, than in the group treated with romiplostim (50.00% vs 29.41%). After 4–8 days, the average platelet count value for the group treated with romiplostim was 93.11×109/L, and that reported for the control group was 128.89×109/L. The treatment regimen adjustment (moving the date of the start of the cycle and/or chemotherapy dose reduction) was needed almost twice more often by the control group, than by the group of patients receiving romiplostim (72.22% vs 41.18%). The platelet concentrate transfusion was necessary for 2 (11.8%) patients in the group treated with romiplostim and 2 (11.1%) patients in the control group. The chemotherapy regimen was changed in 1 (5.88%) patient in the romiplostim group and 2 (11.11%) patients in the control group.
Conclusion. The study showed no efficacy in adjustment of chemotherapy-induced thrombocytopenia relative to the standard within 4–8 days after the beginning of follow-up. Further research is required to determine the efficacy of romiplostim in certain chemotherapy regimens and tumor types.
Keywords: romiplostim, chemotherapy-induced thrombocytopenia, solid tumors, hematological toxicity.
For citation: Vaskovskaia A.K., Tarnovsky R.V. Efficacy of romiplostim therapy for hematological toxicity in patients with solid tumors. Clinical review for general practice. 2025; 6 (12): 44–48 (In Russ.). DOI: 10.47407/kr2025.6.12.00729
Гематологическая токсичность является одним из наиболее частых осложнений в терапии солидных опухолей. На сегодня достигнуты большие успехи в коррекции анемического синдрома и нейтропении, однако лечение вторичной тромбоцитопении остается одной из самых больших проблем ввиду отсутствия эффективной и безопасной терапии этого осложнения.
Тромбоцитопения характеризуется снижением количества тромбоцитов в клиническом анализе крови менее 150×109/л. В зависимости от режима химиотерапии встречаемость тромбоцитопении среди онкологических пациентов составляет от 21,9% до 64,2% [1]. У таких пациентов выше риск кровотечений и смерти [2, 3].
Патогенез связан с прямым повреждением мегакариоцитов химиотерапевтическими препаратами, что приводит к нарушению тромбоцитопоэза и активации апоптоза [4]. Дополнительным фактором ухудшения кроветворения являются метастазы в костный мозг [5].
Одними из основных подходов при возникновении ассоциированной с химиотерапией тромбоцитопенией являются перенос курса химиотерапии, редукция доз, смена режима химиотерапии или отмена терапии, что приводит к худшим результатам беспрогрессивной и общей выживаемости [6]. В редких случаях может использоваться трансфузия концентрата тромбоцитов, которая может восполнить уровень тромбоцитов до необходимого. К преимуществам метода можно отнести доказанную эффективность и скорость ответа. Основными минусами данного метода являются краткосрочность достигнутого эффекта, фармакоэкономическая составляющая, риски гемотрансфузионных осложнений, дефицит гемокомпонентов в станциях переливания крови [7]. Агонисты тромбопоэтиновых рецепторов – относительно новая группа лекарственных средств, доказавшая свою
безопасность и эффективность у пациентов с иммунной тромбоцитопенией. К препаратам данной группы относятся: элтромбопаг, аватромбопаг, ромиплостим [7].
Ромиплостим – гибридный белок, состоящий из Fc-фрагмента IgG1 и последовательности 14 аминокислот. Действуя на тромбопоэтиновые рецепторы мегакариоцита в костном мозге, он индуцирует митоз, созревание мегакариоцитов, продукцию тромбоцитов и увеличение их количества в периферической крови [8].
У здоровых добровольцев количество тромбоцитов при подкожном введении увеличивалось через 4–9 дней, достигая максимума на 12–16-й день [9]. После подкожного введения пациентам с иммунной тромбоцитопенией, получающих данное лечение еженедельно в дозах от 3 до 15 мкг/кг, максимальная концентрация ромиплостима в сыворотке крови достигалась приблизительно через 7–50 ч, а период полувыведения составлял приблизительно от 1 до 34 дней (в среднем 3,5 дня) [10]. Предполагается, что активность ромиплостима характеризуется насыщением рецепторов тромбоцитов и мегакариоцитов, а не концентрацией ромиплостима в сыворотке крови.
Агонисты рецептора тромбопоэтина не одобрены в качестве терапии тромбоцитопении, индуцированной противоопухолевой лекарственной терапией, из-за отсутствия крупных исследований по их применению. Согласно рандомизированному клиническому исследованию II фазы 85% пациентов с тромбоцитопенией, индуцированной химиотерапией, достигли уровня тромбоцитов 100×109/л за три недели еженедельного применения ромиплостима [11]. Ретроспективное когортное исследование доказало, что ромиплостим был эффективен (количество тромбоцитов ≥75×109/л и рост количества тромбоцитов на 30×109/л и более от исходного уровня) в коррекции тромбоцитопении, индуцированной химиотерапией, у 85% пациентов с солидными и гематологическими опухолями [12]. Наше исследование поможет оценить эффективность терапии тромбоцитопении ромиплостимом у пациентов с солидными опухолями при применении противоопухолевой терапии.
Материалы и методы
Методология исследования. Одноцентровое ретроспективное когортное исследование. Участвуют пациенты с декабря 2021 г. по март 2025 г. Критерии включения: пациенты старше 18 лет с верифицированным солидным новообразованием, верифицированной гематологической токсичностью в виде тромбоцитопении (тромбоциты менее 100×109/л). Во время начала исследования пациент получал противоопухолевое лекарственное лечение. Из исследования были исключены пациенты с трансфузиями концентрата тромбоцитов за 1–5 дней до применения ромиплостима, с применением других агонистов тромбопоэтиновых рецепторов, с верифицированной гематологической опухолью или верифицированной иммунной тромбоцитопенией.
В исследовании участвует 2 группы: с применением ромиплостима и группа с применением стандартов коррекции тромбоцитопении (переливание концентрата тромбоцитов, редукция доз, смена режима химиотерапии, перенос даты химиотерапии, отмена химиотерапии). Стандарты коррекции тромбоцитопении возможны в отношении группы с применением ромиплостима.
Сбор данных. Сбор обезличенных данных производился в Excel из электронных медицинских карт в программе qMS. Производился сбор данных о возрасте, поле, заболевании, тромбоцитопении: количество тромбоцитов в клиническом анализе за 2 дня/за 1 день перед/в день применения ромиплостима, количество тромбоцитов в клиническом анализе крови с 4 по 14-й дни после применения ромиплостима. Оценка тромбоцитопении проводилась при помощи Common Terminology Criteria for Adverse Events Version 5.0 (CTCAE v5.0): grade 1 – нижняя граница нормы – 75×109/л, grade 2 – 75×109/л – 50×109/л, grade 3 – 50×109/л – 25×109/л, grade 4 – <25×109/л. Результаты анализа крови допускались из разных лабораторий. День сдачи клинического анализа крови зависел от назначения лечащего врача.
Схемы химиотерапии были определены с использованием иерархической структуры наиболее высокого ассоциированного риска развития тромбоцитопении, основанной на обзоре литературы [1, 13]. Схемы лечения на основе гемцитабина включали все схемы, содержащие гемцитабин, за ними следовали схемы на основе препаратов платины (которые не включали гемцитабин), затем схемы на основе антрациклина, таксана и все другие схемы. Например, схема гемцитабин + цисплатин будет классифицироваться как основанная на гемцитабине. Также учитывались пациенты, получающие лучевую терапию. Производился сбор данных о дозе и дне введения ромиплостима в зависимости от цикла химиотерапии. Диагностика костных метастазов проводилась посредством компьютерной томографии, магнитно-резонансной томографии или биопсии костного мозга.
Статистический анализ. Первичной конечной точкой выступало достижение уровня тромбоцитов >100×109/л после введения с 4 по 8-й дни после применения ромиплостима.
Вторичными конечными точками стали переливание концентрата тромбоцитов, редукция доз противоопухолевой лекарственной терапии (отмена одного или нескольких препаратов из схемы химиотерапии засчитывалась как редукция доз) и/или перенос даты начала цикла противоопухолевой лекарственной терапии, смена режима химиотерапии.
Размеры групп были максимально возможными.
Для обработки данных будут использоваться программы Excel и SPSS.


Некоторые характеристики будут обобщены с использованием описательной статистики (средние значения, стандартные отклонения для непрерывных переменных, таких как возраст, и проценты для категориальных переменных, таких как пол, диагноз, протокол лечения).
Для проверки нормальности распределения использовался критерий Шапиро–Уилка.
Использовался точный критерий Фишера, чтобы определить, существует ли существенная связь между применением ромиплостима и достижением уровня тромбоцитов более 100×109/л. Также данный критерий использовался для определения различий в группах для вторичных конечных точек. Для выявления различий между значениями тромбоцитов через 4–8 дней будет использован U-критерий Манна–Уитни.
Описательная статистика использовалась для обобщения вторичных конечных точек.
Результаты
В исследование включены 35 пациентов (табл. 1). Медиана возраста в группе применения ромиплостима и контрольной группе составила 66 и 67 лет соответственно. В обеих группах преобладали женщины. Наблюдался широкий спектр злокачественных новообразований, наиболее распространенными из которых были рак легкого, рак молочной железы и злокачественные новообразования женских половых органов. У большинства на момент постановки диагноза была выявлена IV стадия (AJCC-8). 55,56% и 61,11% в группе с применением ромиплостима и контрольной группе соответственно получали препараты платины в основе лекарственной терапии.
Большинство пациентов получали ромиплостим однократно, 14 пациентов получали ромиплостим в дозе 250 мкг, 2 пациента – 150 мкг, 1 пациент – 75 мкг. Доза и время введения ромиплостима зависели от решения врача. У 7 пациентов цикл химиотерапии назначался за 1–2 дня до введения ромиплостима и в течение двух дней после, 3 из 17 получили ромиплостим двукратно с интервалом в неделю.
 Исходный уровень тромбоцитопении (табл. 2) был grade 1 – grade 3 в обеих группах. Около половины пациентов в группе применения ромиплостима имели grade 3 уровень тромбоцитопении, у 11 (61,11%) пациентов из контрольной группы был grade 2 уровень тромбоцитопении.
Исходный уровень тромбоцитопении (табл. 2) был grade 1 – grade 3 в обеих группах. Около половины пациентов в группе применения ромиплостима имели grade 3 уровень тромбоцитопении, у 11 (61,11%) пациентов из контрольной группы был grade 2 уровень тромбоцитопении.В контрольной группе больше пациентов достигло уровня более 100×109/л за 4–8 дней, чем в группе применения ромиплостима (50,00% vs 29,41%). Значимых различий в достижении уровня тромбоцитов более 100×109/л за 4–8 дней между группой с введением ромиплостима и контрольной группой не выявлено (p=0,3053).
Через 4–8 дней наблюдения в обеих группах большинство достигло уровня тромбоцитов 75–100×109/л: 6 (35,29%) пациентов в группе применения ромиплостима, 4 (22,22%) пациента в контрольной группе.
В начале исследования группы не имели статистически значимых различий по уровню тромбоцитов (см. рисунок). Средний уровень тромбоцитов в группе ромиплостима составил 53,35×109/л, в контрольной группе – 63,83×109/л. Через 4–8 дней средняя уровня тромбоцитов в группе применения ромиплостима составила 93,11×109/л тромбоцитов, в контрольной – 128,89×109/л тромбоцитов. Существует статистически значимое различие между исходным уровнем тромбоцитов и уровнем тромбоцитов через 4–8 дней в обеих группах (p<0,05). U-критерий Манна–Уитни (U=116, p>0,05) не показал значимые различия между группой применения ромиплостима и контрольной группой через 4–8 дней.
Трансфузии концентрата тромбоцитов потребовались 2 (11,8%) пациентам в группе применения ромиплостима и 2 (11,1%) пациентам в контрольной группе.
Перенос даты начала цикла противоопухолевой лекарственной терапии и/или редукция доз химиотерапии потребовались 7 (41,18%) пациентам из группы применения ромиплостима, 13 (72,22%) пациентам в контрольной группе (p=0,0922).
Смена режима химиотерапии произошла у 1 (5,88%) пациента в группе применения ромиплостима и у 2 (11,11%) пациентов в контрольной группе.
Только 1 из 3 пациентов, которые получали ромиплостим двукратно, достиг уровня тромбоцитов более 100×109/л после первой дозы. После второй дозы данный пациент достиг уровня 263×109/л, 2 из 3 пациентов после второй дозы не достигли уровня тромбоцитов более 100×109/л.
Обсуждение
Наше ретроспективное когортное исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Полученные результаты не согласуются с исследованиями Soff [11] и Al-Samkari [12], где средняя и медиана уровня тромбоцитов соответственно после первого применения была больше 100×109/л. Такие результаты возможны в связи с включением в нашу выборку пациентов с панцитопенией, применением субоптимальных доз ромиплостима. Также в наше исследование были включены пациенты с предикторами отсутствия ответа на терапию: инвазией в костный мозг, предшествующим облучением органов малого таза и воздействием темозоломида [12].
Наблюдение, что коррекция схемы лечения (перенос даты начала цикла и/или снижение дозы химиотерапии) потребовалась почти в два раза чаще в контрольной группе по сравнению с группой ромиплостима, указывает на потенциальную роль этого препарата в поддержании дозовой интенсивности терапии. В будущих исследованиях следует не только оценить влияние снижения частоты задержек лечения на прогноз пациентов.
Расширяя выборку пациентов, мы сможем выявить типы рака, для которых ромиплостим будет наиболее эффективен. Возможно, ромиплостим будет иметь преимущество в коррекции тромбоцитопении у пациентов с вовлечением печени в опухолевый процесс. Поскольку тромбопоэтин синтезируется преимущественно в печени, ее поражение при онкологическом заболевании может приводить к дефициту тромбопоэтина и развитию тромбоцитопении [14]. В таком случае предиктором ответа на ромиплостим может стать сниженный уровень тромбопоэтина в сыворотке крови.
В будущих исследованиях следует определить эффективную дозу, оптимальную стратегию применения ромиплостима – для профилактики или коррекции тромбоцитопении, индуцированной химиотерапией.
Заключение
Исследование продемонстрировало отсутствие эффективности в коррекции тромбоцитопении, индуцированной химиотерапией, в сравнении со стандартом через 4–8 дней от начала наблюдения. Необходимы дальнейшие исследования для определения эффективности ромиплостима в определенных режимах химиотерапии и видах опухолей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Васьковская Анна Константиновна – студентка, ФГБОУ ВО «МГУ им. Ломоносова». E-mail: Ana12@ya.ru
Anna K. Vaskovskaia – Student, Lomonosov Moscow State University. E-mail: Ana12@ya.ru
Тарновский Радион Валерьевич – врач-гематолог, ФК ОО «Хадасса Медикал Лтд»
Radion V. Tarnovsky – Physician-hematologist, Branch Office of «Hadassah Medical Ltd»
Поступила в редакцию: 16.06.2025
Поступила после рецензирования: 26.06.2025
Принята к публикации: 09.10.2025
Received: 16.06.2025
Revised: 26.06.2025
Accepted: 09.10.2025
Список исп. литературыСкрыть список1. Wu, Ying et al. Anemia and thrombocytopenia in patients undergoing chemotherapy for solid tumors: a descriptive study of a large outpatient oncology practice database, 2000–2007. Clin Therapeut 2009;31(Pt 2):2416-32. DOI: 10.1016/j.clinthera.2009.11.020
2. Shaw JL, Nielson CM, Park JK et al. The incidence of thrombocytopenia in adult patients receiving chemotherapy for solid tumors or hematologic malignancies. Eur J Haematol 2021;106(5):662-72. DOI: 10.1111/ejh.13595. PMID: 33544940; PMCID: PMC8248430.
3. Patell R, Hsu C, Shi M et al. Impact of mild thrombocytopenia on bleeding and recurrent thrombosis in cancer. Haematologica 2024;109(6):1849-56. DOI: 10.3324/haematol.2023.284192. PMID: 37855029; PMCID: PMC11141682.
4. Zeuner A, Signore M, Martinetti D et al. Chemotherapy-induced thrombocytopenia derives from the selective death of megakaryocyte progenitors and can be rescued by stem cell factor. Cancer Res 2007;67(10):4767-73. DOI: 10.1158/0008-5472.CAN-06-4303. PMID: 17510405.
5. Liebman HA. Thrombocytopenia in cancer patients. Thromb Res 2014;133(Suppl 2):S63-9. DOI: 10.1016/S0049-3848(14)50011-4. PMID: 24862148.
6. Nielson, Carrie M et al. Relative Dose Intensity of Chemotherapy and Survival in Patients with Advanced Stage Solid Tumor Cancer: A Systematic Review and Meta-Analysis. Oncologist 2021;26(9):e1609-e1618. DOI: 10.1002/onco.13822
7. Gao A, Zhang L, Zhong D. Chemotherapy-induced thrombocytopenia: literature review. Discov Oncol 2023;14(1):10. DOI: 10.1007/s12672-023-00616-3. PMID: 36695938; PMCID: PMC9877263.
8. Currao M, Balduini CL, Balduini A. High doses of romiplostim induce proliferation and reduce proplatelet formation by human megakaryocytes. PLoS One 2013;8(1):e54723. DOI: 10.1371/journal.pone.0054723. PMID: 23359807; PMCID: PMC3554640.
9. Bussel, James et al. Mechanisms and therapeutic prospects of thrombopoietin receptor agonists. Seminars in Hematology 2019;56(4):262-78. DOI: 10.1053/j.seminhematol.2019.09.001
10. Bussel, James B et al. A Review of Romiplostim Mechanism of Action and Clinical Applicability. Drug Design, Development and Therapy 2021;15:2243-68. DOI: 10.2147/DDDT.S299591
11. Soff GA, Miao Y, Bendheim G et al. Romiplostim Treatment of Chemotherapy-Induced Thrombocytopenia. J Clin Oncol 2019;37(31): 2892-8. DOI: 10.1200/JCO.18.01931. PMID: 31545663; PMCID: PMC6823892.
12. Al-Samkari H, Parnes AD, Goodarzi K et al. A multicenter study of romiplostim for chemotherapy-induced thrombocytopenia in solid tumors and hematologic malignancies. Haematologica 2021;106(4):1148-57. DOI: 10.3324/haematol.2020.251900. PMID: 32499239; PMCID: PMC8018116.
13. Hitron A, Steinke D, Sutphin S et al. Incidence and risk factors of clinically significant chemotherapy-induced thrombocytopenia in patients with solid tumors. J Oncol Pharm Pract 2011;17(4):312-9. DOI: 10.1177/1078155210380293. PMID: 20823048.
14. Kuter DJ. Biology and chemistry of thrombopoietic agents. Semin Hematol 2010;47(3):243-8. DOI: 10.1053/j.seminhematol.2010.02.005. PMID: 20620435; PMCID: PMC2904343.
31 декабря 2025
Количество просмотров: 4


