Клинический разбор в общей медицине №12 2025
Nazife E. Kalafatova, Leila A. Zopunian, Dzhuliia G. Kapsuzian, Lilya O. Ametova
Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University, Simferopol, Russia
ametova-lilya@bk.ru
Abstract
Introduction. Treatment methods for multiple myeloma are diverse, but achieving remission is problematic. Thalidomide analogues and proteosome inhibitors are of interest in the treatment of the disease, but their use is limited due to the risk of a wide range of side effects.
Aim. A comparative study of the side effects and efficacy of therapy with thalidomide analogues and proteosome inhibitors in patients with MM.
Materials and methods. A retrospective analysis of the data of 34 patients diagnosed with multiple myeloma who were treated from 2020 to 2024 at the Department of Hematology and Chemotherapy of the Crimean Republican Oncological Clinical Dispensary named after V.M. Efetov and the Semashko Republican Clinical Hospital was carried out.
Results. The combination of lenalidomide and dexamethasone is highly effective, but has a worse safety profile, including bone damage and anemia. The use of a proteosome inhibitor has a more favorable safety profile against a background of moderate efficacy.
Conclusion. Neurotoxicity is the main problem of drug therapy with both lenalidomide and bortezomib. Thalidomide derivatives are more promising in the treatment of myeloma, however, they require improvement in order to increase their safety for the body.
Keywords: drug therapy, multiple myeloma, lenalidomide, bortezomib, side effects.
For citation: Kaliberdenko V.B., Konishcheva V.S., Emirveli S.M., Stepannikova A.R., Kalafatova N.E., Zopunian L.A., Kapsuzian D.G., Ametova L.O. Comparison of the efficacy and safety of therapy for multiple myeloma with the inclusion of thalidomide analogues and proteosome inhibitors. Clinical review for general practice. 2025; 6 (12): 50–55 (In Russ.). DOI: 10.47407/kr2025.6.12.00730
Введение
Множественная миелома (ММ) остается одной из наиболее актуальных проблем онкогематологии, которая по данным эпидемиологических исследований составляет примерно 13% среди гемобластозов [1, 2]. Современные методы борьбы с ММ достаточно результативны, однако до сих пор не существует такого лечения, которое способно полностью избавить пациента от данного недуга. Благодаря современным подходам к лечению ММ, средняя выживаемость больных в последние годы увеличилась с 3 до 7 лет [2–6].
Первые успехи в лечении ММ связаны с синтезом в 1953 г. в России сарколизина, и в том же году в Англии его левовращающего изомера, названного мелфаланом [7]. Многочисленными исследованиями была продемонстрирована способность мелфалана индуцировать ремиссии у 30% больных с ММ. Впоследствии было установлено, что сочетание мелфалана с преднизолоном позволяет значительно улучшить результаты терапии [4, 6]. В течение длительного времени это сочетание препаратов остается основой терапии ММ и используется на сегодняшний день.
Современные методы терапии предполагают начало лечения ММ в ранней фазе, так как на данном этапе клетки опухоли наиболее чувствительны к химиотерапевтическим препаратам, благодаря чему удается достигнуть длительной ремиссии заболевания с минимализацией побочных эффектов (ПЭ), в связи с чем ранняя диагностика помогает своевременно начать лечение. Однако проблемой остаются несекретирующие формы ММ, которые чаще всего диагностируются в III стадии болезни [7–11].
За последние 15 лет совершен значительный прорыв в лечении ММ, который обусловлен разработкой и внедрением в практику новых лекарственных средств и схем лечения, применением высокодозной химиотерапии и аутотрансплантации гемопоэтичексих стволовых клеток (аутоТГСК). В 1999 г. была открыта новая группа препаратов, действие которых заключалось в селективном ингибировании протеосом. Мишенями данных препаратов является 26S протеосома и иммунопротеосома. Основной функцией 26S протеосомы является регуляция клеточного цикла и процессов апоптоза, в то время как иммунопротеосома является аналогом 26S протеосомы для лимфоидных и гемопоэтических клеток и отвечает за поддержание антигенного репертуара главного комплекса гистосовместимости I типа. В уничтожении миеломных клеток важнейшую роль играет ингибирование активности именно 26S протеосомы с последующей инактивацией NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) – транскрипционного фактора, который способствует пролиферации злокачественных клеток, снижает их чувствительность к апоптозу и индуцирует развитие лекарственной резистентности [11–14]. Таким образом, ингибиторы протеосом (ИП) повысили эффективность лечения и снизили количество ПЭ от проводимой терапии, однако полностью избежать их возникновения до сих пор не удалось. Наиболее часто встречаемыми ПЭ на фоне применения ИП являются гастроинтестициальные (преимущественно тошнота, рвота, реже – диарея, запор) и гематологические (преходящие тромбоцитопения, лейкопения, анемия) симптомы, астения и периферическая нейропатия. Установлено, что возникновение ПЭ носит дозозависимый характер, но, кроме этого, стоит учитывать, что при внутривенном введении профиль токсичности, в частности нейротоксичности, ИП гораздо выше, чем при подкожном введении, а эффективность при обоих способах введения препарата остается одинаковой [15].
Было определено, что в сочетании с дексаметазоном бортезомиб показывает аддитивность антионкогенного эффекта, а сочетание с мелфаланом обладало синергизмом [12, 14].
Также одним из новых классов фармакологических препаратов для лечения ММ являются иммуномодулирующие имидные препараты, которые также называют «модуляторами цереблона», так как цереблон является белком, на который направлено действие препаратов этой фармакологической группы. К представителям имидовых иммуномодуляторов относят талидомид и его производные: леналидомид и помалидомид [7, 16]. Ввиду своей токсичности, талидомид был запрещен для использования, поэтому на данный момент применяются лишь его аналоги, которые обладают более выраженным иммуномодулирующим и тумороцидным эффектом, а также вызывают меньшее число ПЭ. Как известно, причиной запрета применения талидомида был выраженный тератогенный эффект, что привело к развитию, так называемой, талидомидовой трагедии в середине ХХ в.: на свет появилось около 10 тыс. новорожденных с врожденными аномалиями развития опорно-двигательного аппарата. Причиной этому, как было выяснено вскоре, является способность талидомида нарушать процессы ангиогенеза путем ингибирования фактора роста сосудистого эндотелия VEGF и основного фактора роста фибробластов bFGF, стимулирующих ангиогенез, а также его способность встраиваться в структуру ДНК, содержащую наибольшее количество G-C связей, приводя к нарушению репликации, что также угнетает рост и развитие организма плода [17, 18]. Однако, несмотря на запрет, талидомид продолжал вызывать к себе интерес. В 1994 г. профессором Дж. М. Фолькманом впервые была выдвинута теория об антионкогенном действии талидомида посредством блокирования процессов неоангиогенеза ткани опухоли. Таким образом, механизмы, лежащие в основе тератогенного эффекта, нашли применение в лечении злокачественных новообразований. В данном аспекте было выявлено также иммуномодулирующее свойство талидомида – путем активации Т-лимфоцитов с последующим увеличением секреции интерлейкина-2 и интерферона-γ, повышение активности естественных киллеров и последующее непосредственное уничтожение ими опухолевых клеток [7, 16, 18].
В 2007 г. в практику внедрено первое производное талидомида – леналидомид, в 2013 г. – одобрен помалидомид. Несмотря на более усовершенствованную химическую структуру, применение производных талидомида также влечет за собой развитие целого ряда ПЭ, включающего в себя нейротоксичность, анемию, лейкопению, нефротоксичность, развитие остеопороза и патологических переломов, а также в редких случаях – вторичного иммунодефицита с присоединением оппортунистических инфекций [1, 3, 8, 7, 16, 18, 19].
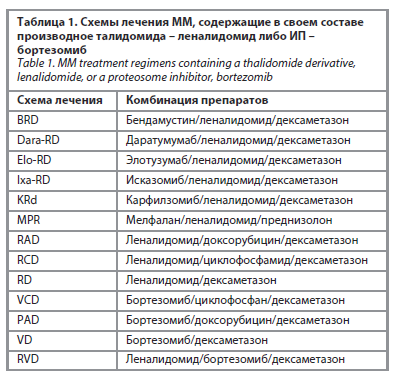 ИП могут применяться как в монорежиме терапии, так и в комбинации с другими препаратами. Бортезомиб является главным представителем данной группы препаратов и основой схем терапии, представленных в табл. 1 [16]. Аналоги талидомида могут применяться при резистентных формах ММ, при рецидивах заболевания, а также в качестве поддерживающей терапии после аутоТГСК. Как и ИП, имидовые иммуномодуляторы могут быть использованы как в качестве монотерапии, так и в комбинации с другими препаратами [20]. Таким образом, леналидомид является основой для множества схем терапии ММ, что отражено в табл. 1 [16].
ИП могут применяться как в монорежиме терапии, так и в комбинации с другими препаратами. Бортезомиб является главным представителем данной группы препаратов и основой схем терапии, представленных в табл. 1 [16]. Аналоги талидомида могут применяться при резистентных формах ММ, при рецидивах заболевания, а также в качестве поддерживающей терапии после аутоТГСК. Как и ИП, имидовые иммуномодуляторы могут быть использованы как в качестве монотерапии, так и в комбинации с другими препаратами [20]. Таким образом, леналидомид является основой для множества схем терапии ММ, что отражено в табл. 1 [16].
Установлено, что производные талидомида и дексаметазон обладают выраженным синергизмом, благодаря чему взаимно усиливают фармакологические эффекты друг друга примерно на 30–40%, что также влияет на степень развития ПЭ на фоне приема данных средств [20, 21]. Дексаметазон, являясь типичным глюкокортикостероидом, усиливает резорбцию кальция из костной ткани, снижая ее прочность. Также известен дополнительный механизм действия аналогов талидомида, который заключается в понижении уровня катепсина К и поверхностных молекул адгезии, в результате чего происходит нарушение адгезии опухолевых клеток к строме костного мозга и торможению остеокластогенеза вместе с последующим ремоделированием костной ткани [17, 18, 20]. Суммарно данные механизмы могут усиливать остеодеструктивные явления, которые и так ярко выражены при ММ.
Таким образом, на данный момент наиболее актуальными для лечения ММ являются ИП (бортезомиб) и иммуномодуляторы (леналидомид, помалидомид). Однако применение данных групп препаратов не является полностью безопасными в виду их токсичности, что может значительно ухудшать состояние пациентов и влиять на дальнейший прогноз.
Цели – проведение у больных с ММ сравнительной характеристики эффективности лечения на основе схем комбинации дексаметазона с ИП и с аналогом талидомида, а также исследование ПЭ проведенных схем терапии.
Материалы и методы
С 2020 по 2024 г. на базе отделения гематологии и химиотерапии ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М. Ефетова» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко» ретроспективно исследована медицинская документация (персональные данные были исключены, учитывались только данные по полу, возрасту и дате обращения) 34 пациентов с ММ, у которых диагностирована III стадия заболевания, согласно классификации ISS, а также пациентов, не претендовавших на аутоТГСК и не получавших ранее ни одну из терапевтических опций. Средний возраст обследованных составил 66±13,314 года, медиана возраста больных составила 68 лет (разброс 65–79 лет). Число женщин составило 41,1% (n=15), мужчин – 59,9% (n=19).
С целью уточнения диагноза ММ использовались диагностические критерии клинических рекомендаций [7]. Больные были распределены на две группы в зависимости от получаемого лечения, пациенты в 1-й группе (18 больных – группа А) получали в качестве терапии аналог талидомида – леналидомид в комбинации с дексаметазоном – протокол RD, а во 2-й группе (16 больных – группа Б) получали ИП – бортезомиб и дексаметазон, согласно протоколу VD. Также была отобрана группа сравнения (n=54) – пациенты также с III стадией заболевания, не получающих ни одну из терапевтических схем и находящихся на наблюдении в указанных медицинских организация.
Каждому пациенту было проведено 8 циклов химиотерапии, эффективность оценивалась после 3, 5 и 8 курсов терапии согласно критериям Российских клинических рекомендаций по диагностике и лечению ММ [16].
Для лечения ММ в группе А применялась следующая схема – леналидомид 25 мг per os в течение 21 дня с перерывом на 7 дней и последующим возобновлением лечения; дексаметазон 40 мг per os в течение первых 4 циклов – дни 1–4, 9–12, 17–20, далее – только дни
1–4. В группе В: Велкейд (бортезомиб) – 1,3 мг/м2 внутривенно струйно в 1, 4, 8, 11-й дни, Дексаметазон – 20 мг per os в 1, 2, 4, 5, 8, 9, 11, 12-й дни каждого 21-дневного цикла.
С использованием метода Каплана–Майера проводился расчет общей выживаемости, определяемой как промежуток времени, прошедший с момента включения пациентов в исследование до даты их смерти или последнего визита. Для оценки различий в выживаемости между группами использовался лонг-ранг тест, считая различия значимыми при p<0,05. Токсичность бортезомиба и леналидомида оценивалась в соответствии с критериями Всемирной организации здравоохранения [7].
Результаты исследования
При исследовании эффективности комбинации леналидомида и дексаметазона, согласно протоколу RD, были получены следующие результаты: общий ответ на терапию получен у 15 пациентов, из них у 5 больных достигнут полный ответ, у 6 – строгий полный ответ, у 4 – очень хороший частичный ответ, у 2 – частичный ответ. Медиана времени до достижения общего ответа составила 65 дней (табл. 2). Продолжительность ремиссии колебалась от 6 мес до 2 лет. Медиана выживаемости в данной группе составила 4,5 года (разброс 2,1–5,9 года). Несмотря на достигнутые результаты, 26,3% пациентов столкнулись с рецидивами заболевания. Показатель смертности составил 5%, что указывает на относительно низкую смертность в этой группе пациентов. Кроме этого, по итогам исследования выяснилось, что уровень М-компонента у всех пациентов снизился в среднем на 45% от исходного значения в течение первых 3 мес лечения. Оценка костной ткани показала, что 16 пациентов достигли стабильности, а у 2 пациентов зафиксировали улучшение через 6 мес терапии. Общее состояние пациентов улучшилось уже после первого месяца лечения, что проявилось снижением утомляемости, улучшением аппетита и нормализацией пищеварения. Согласно лабораторным исследованиям, уровень креатинина также снизился в среднем на 20% за первые 3 мес (p<0,01). Полученные данные позволяют сделать вывод о значительной эффективности лечения ММ леналидомидом в группе А: количество рецидивов за период наблюдения составило 27,7% (5 случаев), что в 2,5 раза ниже количества рецидивов в группе пациентов, получающих опцию лечения, содержащую бортезомиб (62,5%), p<0,05.
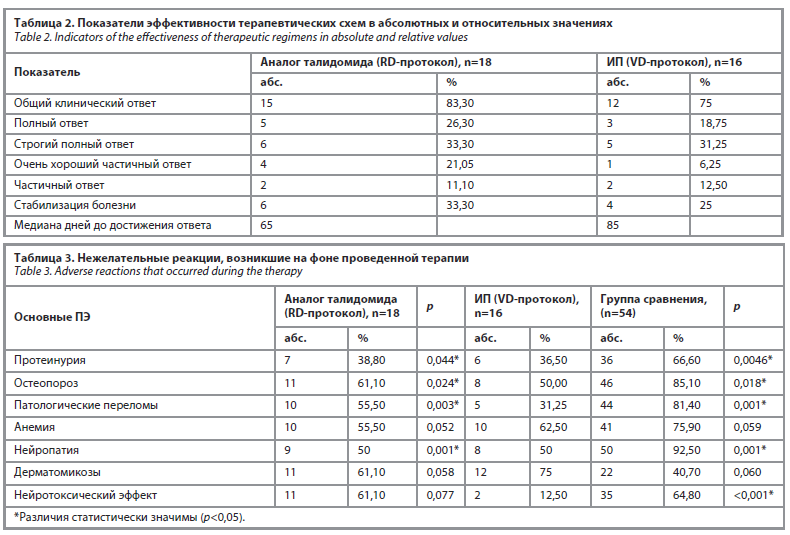
При анализе результатов использования бортезомиба в качестве индукционной терапии (VD-протокол) общий клинический ответ достигнут у большинства пациентов – у 12 из 16 (80%). При этом полный ответ и строгий полный ответ отмечены у 3 и 5 пациентов соответственно, очень хороший частичный ответ – у 1, частичный ответ – у 2, а у 4 (20%) больных наблюдалась стабилизация болезни, что указывает на эффективность применения данной комбинации в качестве индукционной терапии. Медиана времени до достижения полного ответа составила 85 дней. За время наблюдения (от 3 до 10 мес) у 2 пациентов наступило прогрессирование заболевания, что указывает на необходимость решения вопроса о целесообразности проведения поддерживающей терапии. При этом медиана общей выживаемости данной группы составила 2,3 года, а длительность ремиссий составляла в среднем 3 мес.
В ходе исследования в группе А были обнаружены следующие ПЭ: у 7 (38,9%) больных была выявлена протеинурия, у 11 (61,1%) остеопороз, патологические переломы наблюдались в 10 (55,5%) случаях, анемический синдром развился у 10 (55,5%) пациентов, периферические нейропатии и парезы у 9, дерматомикозы – в 11 случаях, а также наблюдался нейротоксический эффект у 11 больных. Также стоит отметить, что у большей части исследуемых отмечалось 2 и более ПЭ одновременно, что особо ухудшало общее состояние и дальнейший прогноз.
В группе Б обследованных больных протеинурия встречалась в 6 (37,5%) случаях, поражения костей в виде остеопороза наблюдались у 8 (50%), множественные патологические переломы диагностированы у 5 (31,25%) и анемический синдром наблюдался в 10 (62,5%) случаях, поражение периферической нервной системы встречались в 8 случаях и микозы кожи были у 12 больных, нейротоксический эффект наблюдался у 2 больных (табл. 3).
Обсуждение
На фоне применения леналидомида отмечались нарушения со стороны компонентов центральной нервной системы – преимущественно экстрапирамидные и мозжечковые симптомы, проявляющиеся нарушением походки и равновесия тела, головокружениями, нарушением режима сна. Парезы имели спастический характер. Периферические нейропатии проявлялись выраженным болевым синдромом, который усиливался на протяжении всего периода применения леналидомида. Однако, несмотря на выраженность неврологических нарушений, все исследуемые пациенты смогли пройти полный курс терапии. Стоит отметить, что после завершения 8-го цикла терапии по протоколу RD неврологическая симптоматика сохранялась у 11 пациентов, в то время как у остальных исследуемых данные симптомы подверглись обратному развитию в среднем спустя 9 мес после завершения лечения.
Также для ПЭ аналогов талидомида характерно развитие нефропатии, которая в нашем случае проявлялась протеинурией, что, вероятнее всего, связано с фармакокинетическими особенностями препарата. Леналидомид и другие производные талидомида экскретируются преимущественно мочевыделительной системой и, по некоторым данным, вызывают нарушение процессов фильтрации, в результате чего может возникнуть протеинурия. Также стоит отметить, что протеинурия могла возникнуть в следствие миеломной нефропатии, а аналоги талидомида лишь усугубляют данный процесс. На данный момент обратимость почечного повреждения при ММ не изучена, поэтому не представляется возможным точно дифференцировать причины развития данного ПЭ.
Как было сказано ранее, аналоги талидомида способны влиять на клетки микроокружения опухоли и тормозить процессы инвазии клеток ММ в здоровую костную ткань, посредством торможения процессов остеокластогенеза, однако без последующей активации ремоделирования кости, что повышает ее хрупкость и, соответственно, риск развития таких остеодеструктивных явлений, как патологические переломы. Повреждение опорно-двигательного аппарата также является следствием развития ММ. Среди пациентов, не получавших противоопухолевую терапию (n=54), только у 30% больных отмечались повреждения костной ткани, в то время как данное явление было обнаружено у всех исследуемых группы А, что указывает на связь развития остеодеструктивных процессов с применением леналидомида в комбинации с дексаметазоном.
Также среди ПЭ в группе А была обнаружена анемия средней и тяжелой степени. На данный момент недостаточно сведений о гематотоксичности аналогов талидомида, однако в литературе встречаются данные о гипоплазии красного костного мозга без увеличения количества миеломных клеток на фоне приема данных препаратов. Анемический синдром возникает у больных ММ вследствие замещения красного костного мозга опухолевой тканью, поэтому мы проанализировали частоту возникновения данного синдрома у пациентов, не получавших лекарственную терапию, – всего у 4 пациентов из 54 было обнаружено развитие анемии легкой и средней степени тяжести. Среди исследуемой группы, получавшей леналидомид, анемия возникла более чем у 50% больных, что говорит о связи развития данного ПЭ и приема производных талидомида.
Кроме того, на фоне применения производных талидомида отмечалось развитие дерматомикозов с преимущественной локализацией в естественных складках, а также на коже спины. Вероятнее всего, появление дерматомикозов ассоциировано с нейтропенией, возникшей на фоне приема леналидомида. Нейтропения является одним из компонентов гематотоксического воздействия леналидомида, не коррелирует с противоопухолевым эффектом и концентрацией препарата в крови и чаще возникает у пациентов с исходно низким уровнем нейтрофилов.
При анализе нефропатии на фоне применения протокола VD были выявлены несколько форм протеинурии: IgA-секретирующая и протеинурия Бенс–Джонса, что является признаком почечного повреждения в результате ММ и не является следствием применения бортезомиба.
Также в результате применения бортезомиба возникали поражения нервной системы, которые проявлялись в виде периферических нейропатий (люмбалгия, торакалгия) и парезов, которые приобретали спастический характер, а также вегетативной дисфункцией, пирамидными и мозжечковыми нарушениями. Данные проявления могли проявляться как по отдельности, так и в комбинации, однако в целом неврологические симптомы имели нестойкий характер. Нейротоксичность, вероятно, напрямую связана с ингибированием активности 26S протеосомы и последующим нарушением работы убиквитинзависимой системы, что оказывает негативное влияние на метаболическую активность нейронов. Подтверждением данной теории является развитие таких дегенеративных заболеваний нервной системы, как болезнь Альцгеймера и хорея Гентингтона, в результате нарушения работы убиквитинзависимой системы деградации белков. Подтверждением также является факт, что под воздействием бортезомиба в задних ганглиях и в задних рогах спинного мозга происходит полимеризация белка тубулина, в результате чего нарушается аксональный транспорт. В последующем в аксонах снижается концентрация никотинамидадениндинуклеотида (НАД+), что в дальнейшем приводит к дегенерации аксонов, а также к нарушению функциональной активности митохондрий, в результате чего повышается чувствительность к капсаициновым рецепторам, что ведет к возникновению парестезий [10].
На фоне проведения терапии в группе Б дерматомикозы чаще локализовались в области ногтевых пластин, естественных складок и спины. Грибковые поражения кожи ассоциированы с развитием нейтропении, причиной которой явилось влияние как бортезомиба, так и дексаметазона.
Также гематотоксичность на фоне применения протокола VD проявлялась анемией легкой и средней степени. Анемия имела преходящий характер и легко поддавалась купированию.
У пациентов группы Б очаги остеопороза и остеолиза чаще всего локализовались в позвонках и трубчатых костях. Развитие повреждения костной ткани в данном случае является, вероятно, результатом роста очага ММ, так как данных о способности ИП индуцировать костные повреждения на данный момент не существует. Также участвовать в развитии данного ПЭ мог дексаметазон, усугубляя резорбцию костной ткани и остеопоротические процессы, что повышает риск развития переломов.
Выводы
В результате исследования было установлено, что при использовании аналога талидомида – леналидомида, удалось достичь лучших показателей (средняя выживаемость составила 4,5 года) и большего срока ремиссии (средний срок ремиссии составил 6 мес) по сравнению с терапией ИП – бортезомибом, на фоне которого средняя выживаемость составила 2,3 года, а средний срок ремиссии составил 3 мес. Однако на фоне применения леналидомида отмечалось большое число ПЭ.
Главной проблемой как для аналогов талидомида, так и для ИП, является развитие выраженной нейротоксичности, которая, в частности для леналидомида, чаще всего является необратимой и включает в себя поражение как центральной, так и периферической нервной системы.
Аналоги талидомида являются более высокоэффективными препаратами, однако ИП – более безопасными. Особенно актуальны производные талидомида, в случае рефрактерных и рецидивирующих форм ММ, однако для снижения токсичности данной группы препаратов необходимо совершенствовать их химическую структуру, в том числе с целью изменения способа элиминации, во избежание повреждения функции почек.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that they have no conflict of interest.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Калиберденко Виталий Борисович – канд. мед. наук, доц. каф. внутренней медицины №2, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: vit_boris@mail.ru; ORCID: 0000-0003-1693-3190; Scopus Author ID: 57211323024
Vitaly B. Kaliberdenko – Cand. Sci. (Med.), Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: vit_boris@mail.ru; ORCID: 0000-0003-1693-3190
Конищева Валерия Сергеевна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: konishcheva.lera@inbox.ru
Valeria S. Konishcheva – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: konishcheva.lera@inbox.ru
Эмирвели Сабрие Муратовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: sabrieemirveli@mail.ru
Sabrie M. Emirveli – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: sabrieemirveli@mail.ru
Степанникова Анастасия Романовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail:anastasia.stt. 336@gmail.com
Anastasia R. Stepannikova – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: anastasia.stt.336@gmail.com
Калафатова Назифе Эдемовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: nazife_kalafatova@mail.ru
Nazife E. Kalafatova – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: nazife_kalafatova@mail.ru
Зопунян Лейла Артуровна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Leyla.zopunyan.99@mail.ru
Leila A. Zopunian – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: Leyla.zopunyan.99@mail.ru
Капсузян Джулия Геворговна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: Kapsuzyan98@mail.ru
Dzhuliia G. Kapsuzian – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: Kapsuzyan98@mail.ru
Аметова Лиля Османовна – врач-ординатор, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: ametova-lilya@bk.ru; ORCID: 0000-0003-1496-4954; eLibrary SPIN-код: 5630-9650
Lilya O. Ametova – Medical Resident, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: ametova-lilya@bk.ru; ORCID: 0000-0003-1496-4954; eLibrary SPIN-code: 5630-9650
Поступила в редакцию: 17.09.2025
Поступила после рецензирования: 26.09.2025
Принята к публикации: 02.10.2025
Received: 17.09.2025
Revised: 26.09.2025
Accepted: 02.10.2025
Клинический разбор в общей медицине №12 2025
Сравнение эффективности и безопасности терапии множественной миеломы с включением аналогов талидомида и ингибиторов протеосом
Номера страниц в выпуске:50-55
Аннотация
Введение. Методы лечения множественной миеломы разнообразны, но достижение ремиссии проблематично. Аналоги талидомида и ингибиторы протеосом представляют интерес в терапии заболевания, однако их применение ограниченно в связи с риском возникновения целого спектра побочных эффектов.
Цель. Сравнительное исследование побочных эффектов и эффективности терапии аналогами талидомида и ингибиторами протеосом у пациентов с множественной миеломой.
Материалы и методы. Проведен ретроспективный анализ данных 34 пациентов с диагнозом множественная миелома, лечившихся с 2020 по 2024 г. на базе отделения гематологии и химиотерапии ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М. Ефетова» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко».
Результаты. Комбинация леналидомида и дексаметазона высокоэффективна, но имеет худший профиль безопасности, включая повреждение костной ткани и анемию. Применение ингибитора протеосом обладает более благоприятным профилем безопасности на фоне умеренной эффективности.
Заключение. Нейротоксичность – главная проблема лекарственной терапии как леналидомидом, так и бортезомибом. Производные талидомида являются более перспективными в лечении миеломы, однако требуют усовершенствования с целью увеличения их безопасности для организма.
Ключевые слова: лекарственная терапия, множественная миелома, леналидомид, бортезомиб, побочные эффекты.
Для цитирования: Калиберденко В.Б., Конищева В.С., Эмирвели С.М., Степанникова А.Р., Калафатова Н.Э., Зопунян Л.А., Капсузян Д.Г., Аметова Л.О. Сравнение эффективности и безопасности терапии множественной миеломы с включением аналогов талидомида и ингибиторов протеосом. Клинический разбор в общей медицине. 2025; 6 (12): 50–55. DOI: 10.47407/kr2025.6.12.00730
Введение. Методы лечения множественной миеломы разнообразны, но достижение ремиссии проблематично. Аналоги талидомида и ингибиторы протеосом представляют интерес в терапии заболевания, однако их применение ограниченно в связи с риском возникновения целого спектра побочных эффектов.
Цель. Сравнительное исследование побочных эффектов и эффективности терапии аналогами талидомида и ингибиторами протеосом у пациентов с множественной миеломой.
Материалы и методы. Проведен ретроспективный анализ данных 34 пациентов с диагнозом множественная миелома, лечившихся с 2020 по 2024 г. на базе отделения гематологии и химиотерапии ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М. Ефетова» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко».
Результаты. Комбинация леналидомида и дексаметазона высокоэффективна, но имеет худший профиль безопасности, включая повреждение костной ткани и анемию. Применение ингибитора протеосом обладает более благоприятным профилем безопасности на фоне умеренной эффективности.
Заключение. Нейротоксичность – главная проблема лекарственной терапии как леналидомидом, так и бортезомибом. Производные талидомида являются более перспективными в лечении миеломы, однако требуют усовершенствования с целью увеличения их безопасности для организма.
Ключевые слова: лекарственная терапия, множественная миелома, леналидомид, бортезомиб, побочные эффекты.
Для цитирования: Калиберденко В.Б., Конищева В.С., Эмирвели С.М., Степанникова А.Р., Калафатова Н.Э., Зопунян Л.А., Капсузян Д.Г., Аметова Л.О. Сравнение эффективности и безопасности терапии множественной миеломы с включением аналогов талидомида и ингибиторов протеосом. Клинический разбор в общей медицине. 2025; 6 (12): 50–55. DOI: 10.47407/kr2025.6.12.00730
Comparison of the efficacy and safety of therapy for multiple myeloma with the inclusion of thalidomide analogues and proteosome inhibitors
Vitalii B. Kaliberdenko, Valeria S. Konishcheva, Sabrie M. Emirveli, Anastasia R. Stepannikova,Nazife E. Kalafatova, Leila A. Zopunian, Dzhuliia G. Kapsuzian, Lilya O. Ametova
Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University, Simferopol, Russia
ametova-lilya@bk.ru
Abstract
Introduction. Treatment methods for multiple myeloma are diverse, but achieving remission is problematic. Thalidomide analogues and proteosome inhibitors are of interest in the treatment of the disease, but their use is limited due to the risk of a wide range of side effects.
Aim. A comparative study of the side effects and efficacy of therapy with thalidomide analogues and proteosome inhibitors in patients with MM.
Materials and methods. A retrospective analysis of the data of 34 patients diagnosed with multiple myeloma who were treated from 2020 to 2024 at the Department of Hematology and Chemotherapy of the Crimean Republican Oncological Clinical Dispensary named after V.M. Efetov and the Semashko Republican Clinical Hospital was carried out.
Results. The combination of lenalidomide and dexamethasone is highly effective, but has a worse safety profile, including bone damage and anemia. The use of a proteosome inhibitor has a more favorable safety profile against a background of moderate efficacy.
Conclusion. Neurotoxicity is the main problem of drug therapy with both lenalidomide and bortezomib. Thalidomide derivatives are more promising in the treatment of myeloma, however, they require improvement in order to increase their safety for the body.
Keywords: drug therapy, multiple myeloma, lenalidomide, bortezomib, side effects.
For citation: Kaliberdenko V.B., Konishcheva V.S., Emirveli S.M., Stepannikova A.R., Kalafatova N.E., Zopunian L.A., Kapsuzian D.G., Ametova L.O. Comparison of the efficacy and safety of therapy for multiple myeloma with the inclusion of thalidomide analogues and proteosome inhibitors. Clinical review for general practice. 2025; 6 (12): 50–55 (In Russ.). DOI: 10.47407/kr2025.6.12.00730
Введение
Множественная миелома (ММ) остается одной из наиболее актуальных проблем онкогематологии, которая по данным эпидемиологических исследований составляет примерно 13% среди гемобластозов [1, 2]. Современные методы борьбы с ММ достаточно результативны, однако до сих пор не существует такого лечения, которое способно полностью избавить пациента от данного недуга. Благодаря современным подходам к лечению ММ, средняя выживаемость больных в последние годы увеличилась с 3 до 7 лет [2–6].
Первые успехи в лечении ММ связаны с синтезом в 1953 г. в России сарколизина, и в том же году в Англии его левовращающего изомера, названного мелфаланом [7]. Многочисленными исследованиями была продемонстрирована способность мелфалана индуцировать ремиссии у 30% больных с ММ. Впоследствии было установлено, что сочетание мелфалана с преднизолоном позволяет значительно улучшить результаты терапии [4, 6]. В течение длительного времени это сочетание препаратов остается основой терапии ММ и используется на сегодняшний день.
Современные методы терапии предполагают начало лечения ММ в ранней фазе, так как на данном этапе клетки опухоли наиболее чувствительны к химиотерапевтическим препаратам, благодаря чему удается достигнуть длительной ремиссии заболевания с минимализацией побочных эффектов (ПЭ), в связи с чем ранняя диагностика помогает своевременно начать лечение. Однако проблемой остаются несекретирующие формы ММ, которые чаще всего диагностируются в III стадии болезни [7–11].
За последние 15 лет совершен значительный прорыв в лечении ММ, который обусловлен разработкой и внедрением в практику новых лекарственных средств и схем лечения, применением высокодозной химиотерапии и аутотрансплантации гемопоэтичексих стволовых клеток (аутоТГСК). В 1999 г. была открыта новая группа препаратов, действие которых заключалось в селективном ингибировании протеосом. Мишенями данных препаратов является 26S протеосома и иммунопротеосома. Основной функцией 26S протеосомы является регуляция клеточного цикла и процессов апоптоза, в то время как иммунопротеосома является аналогом 26S протеосомы для лимфоидных и гемопоэтических клеток и отвечает за поддержание антигенного репертуара главного комплекса гистосовместимости I типа. В уничтожении миеломных клеток важнейшую роль играет ингибирование активности именно 26S протеосомы с последующей инактивацией NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) – транскрипционного фактора, который способствует пролиферации злокачественных клеток, снижает их чувствительность к апоптозу и индуцирует развитие лекарственной резистентности [11–14]. Таким образом, ингибиторы протеосом (ИП) повысили эффективность лечения и снизили количество ПЭ от проводимой терапии, однако полностью избежать их возникновения до сих пор не удалось. Наиболее часто встречаемыми ПЭ на фоне применения ИП являются гастроинтестициальные (преимущественно тошнота, рвота, реже – диарея, запор) и гематологические (преходящие тромбоцитопения, лейкопения, анемия) симптомы, астения и периферическая нейропатия. Установлено, что возникновение ПЭ носит дозозависимый характер, но, кроме этого, стоит учитывать, что при внутривенном введении профиль токсичности, в частности нейротоксичности, ИП гораздо выше, чем при подкожном введении, а эффективность при обоих способах введения препарата остается одинаковой [15].
Было определено, что в сочетании с дексаметазоном бортезомиб показывает аддитивность антионкогенного эффекта, а сочетание с мелфаланом обладало синергизмом [12, 14].
Также одним из новых классов фармакологических препаратов для лечения ММ являются иммуномодулирующие имидные препараты, которые также называют «модуляторами цереблона», так как цереблон является белком, на который направлено действие препаратов этой фармакологической группы. К представителям имидовых иммуномодуляторов относят талидомид и его производные: леналидомид и помалидомид [7, 16]. Ввиду своей токсичности, талидомид был запрещен для использования, поэтому на данный момент применяются лишь его аналоги, которые обладают более выраженным иммуномодулирующим и тумороцидным эффектом, а также вызывают меньшее число ПЭ. Как известно, причиной запрета применения талидомида был выраженный тератогенный эффект, что привело к развитию, так называемой, талидомидовой трагедии в середине ХХ в.: на свет появилось около 10 тыс. новорожденных с врожденными аномалиями развития опорно-двигательного аппарата. Причиной этому, как было выяснено вскоре, является способность талидомида нарушать процессы ангиогенеза путем ингибирования фактора роста сосудистого эндотелия VEGF и основного фактора роста фибробластов bFGF, стимулирующих ангиогенез, а также его способность встраиваться в структуру ДНК, содержащую наибольшее количество G-C связей, приводя к нарушению репликации, что также угнетает рост и развитие организма плода [17, 18]. Однако, несмотря на запрет, талидомид продолжал вызывать к себе интерес. В 1994 г. профессором Дж. М. Фолькманом впервые была выдвинута теория об антионкогенном действии талидомида посредством блокирования процессов неоангиогенеза ткани опухоли. Таким образом, механизмы, лежащие в основе тератогенного эффекта, нашли применение в лечении злокачественных новообразований. В данном аспекте было выявлено также иммуномодулирующее свойство талидомида – путем активации Т-лимфоцитов с последующим увеличением секреции интерлейкина-2 и интерферона-γ, повышение активности естественных киллеров и последующее непосредственное уничтожение ими опухолевых клеток [7, 16, 18].
В 2007 г. в практику внедрено первое производное талидомида – леналидомид, в 2013 г. – одобрен помалидомид. Несмотря на более усовершенствованную химическую структуру, применение производных талидомида также влечет за собой развитие целого ряда ПЭ, включающего в себя нейротоксичность, анемию, лейкопению, нефротоксичность, развитие остеопороза и патологических переломов, а также в редких случаях – вторичного иммунодефицита с присоединением оппортунистических инфекций [1, 3, 8, 7, 16, 18, 19].
 ИП могут применяться как в монорежиме терапии, так и в комбинации с другими препаратами. Бортезомиб является главным представителем данной группы препаратов и основой схем терапии, представленных в табл. 1 [16]. Аналоги талидомида могут применяться при резистентных формах ММ, при рецидивах заболевания, а также в качестве поддерживающей терапии после аутоТГСК. Как и ИП, имидовые иммуномодуляторы могут быть использованы как в качестве монотерапии, так и в комбинации с другими препаратами [20]. Таким образом, леналидомид является основой для множества схем терапии ММ, что отражено в табл. 1 [16].
ИП могут применяться как в монорежиме терапии, так и в комбинации с другими препаратами. Бортезомиб является главным представителем данной группы препаратов и основой схем терапии, представленных в табл. 1 [16]. Аналоги талидомида могут применяться при резистентных формах ММ, при рецидивах заболевания, а также в качестве поддерживающей терапии после аутоТГСК. Как и ИП, имидовые иммуномодуляторы могут быть использованы как в качестве монотерапии, так и в комбинации с другими препаратами [20]. Таким образом, леналидомид является основой для множества схем терапии ММ, что отражено в табл. 1 [16].Установлено, что производные талидомида и дексаметазон обладают выраженным синергизмом, благодаря чему взаимно усиливают фармакологические эффекты друг друга примерно на 30–40%, что также влияет на степень развития ПЭ на фоне приема данных средств [20, 21]. Дексаметазон, являясь типичным глюкокортикостероидом, усиливает резорбцию кальция из костной ткани, снижая ее прочность. Также известен дополнительный механизм действия аналогов талидомида, который заключается в понижении уровня катепсина К и поверхностных молекул адгезии, в результате чего происходит нарушение адгезии опухолевых клеток к строме костного мозга и торможению остеокластогенеза вместе с последующим ремоделированием костной ткани [17, 18, 20]. Суммарно данные механизмы могут усиливать остеодеструктивные явления, которые и так ярко выражены при ММ.
Таким образом, на данный момент наиболее актуальными для лечения ММ являются ИП (бортезомиб) и иммуномодуляторы (леналидомид, помалидомид). Однако применение данных групп препаратов не является полностью безопасными в виду их токсичности, что может значительно ухудшать состояние пациентов и влиять на дальнейший прогноз.
Цели – проведение у больных с ММ сравнительной характеристики эффективности лечения на основе схем комбинации дексаметазона с ИП и с аналогом талидомида, а также исследование ПЭ проведенных схем терапии.
Материалы и методы
С 2020 по 2024 г. на базе отделения гематологии и химиотерапии ГБУЗ РК «Крымский республиканский онкологический клинический диспансер имени В.М. Ефетова» и ГБУЗ РК «Республиканская клиническая больница им. Н.А. Семашко» ретроспективно исследована медицинская документация (персональные данные были исключены, учитывались только данные по полу, возрасту и дате обращения) 34 пациентов с ММ, у которых диагностирована III стадия заболевания, согласно классификации ISS, а также пациентов, не претендовавших на аутоТГСК и не получавших ранее ни одну из терапевтических опций. Средний возраст обследованных составил 66±13,314 года, медиана возраста больных составила 68 лет (разброс 65–79 лет). Число женщин составило 41,1% (n=15), мужчин – 59,9% (n=19).
С целью уточнения диагноза ММ использовались диагностические критерии клинических рекомендаций [7]. Больные были распределены на две группы в зависимости от получаемого лечения, пациенты в 1-й группе (18 больных – группа А) получали в качестве терапии аналог талидомида – леналидомид в комбинации с дексаметазоном – протокол RD, а во 2-й группе (16 больных – группа Б) получали ИП – бортезомиб и дексаметазон, согласно протоколу VD. Также была отобрана группа сравнения (n=54) – пациенты также с III стадией заболевания, не получающих ни одну из терапевтических схем и находящихся на наблюдении в указанных медицинских организация.
Каждому пациенту было проведено 8 циклов химиотерапии, эффективность оценивалась после 3, 5 и 8 курсов терапии согласно критериям Российских клинических рекомендаций по диагностике и лечению ММ [16].
Для лечения ММ в группе А применялась следующая схема – леналидомид 25 мг per os в течение 21 дня с перерывом на 7 дней и последующим возобновлением лечения; дексаметазон 40 мг per os в течение первых 4 циклов – дни 1–4, 9–12, 17–20, далее – только дни
1–4. В группе В: Велкейд (бортезомиб) – 1,3 мг/м2 внутривенно струйно в 1, 4, 8, 11-й дни, Дексаметазон – 20 мг per os в 1, 2, 4, 5, 8, 9, 11, 12-й дни каждого 21-дневного цикла.
С использованием метода Каплана–Майера проводился расчет общей выживаемости, определяемой как промежуток времени, прошедший с момента включения пациентов в исследование до даты их смерти или последнего визита. Для оценки различий в выживаемости между группами использовался лонг-ранг тест, считая различия значимыми при p<0,05. Токсичность бортезомиба и леналидомида оценивалась в соответствии с критериями Всемирной организации здравоохранения [7].
Результаты исследования
При исследовании эффективности комбинации леналидомида и дексаметазона, согласно протоколу RD, были получены следующие результаты: общий ответ на терапию получен у 15 пациентов, из них у 5 больных достигнут полный ответ, у 6 – строгий полный ответ, у 4 – очень хороший частичный ответ, у 2 – частичный ответ. Медиана времени до достижения общего ответа составила 65 дней (табл. 2). Продолжительность ремиссии колебалась от 6 мес до 2 лет. Медиана выживаемости в данной группе составила 4,5 года (разброс 2,1–5,9 года). Несмотря на достигнутые результаты, 26,3% пациентов столкнулись с рецидивами заболевания. Показатель смертности составил 5%, что указывает на относительно низкую смертность в этой группе пациентов. Кроме этого, по итогам исследования выяснилось, что уровень М-компонента у всех пациентов снизился в среднем на 45% от исходного значения в течение первых 3 мес лечения. Оценка костной ткани показала, что 16 пациентов достигли стабильности, а у 2 пациентов зафиксировали улучшение через 6 мес терапии. Общее состояние пациентов улучшилось уже после первого месяца лечения, что проявилось снижением утомляемости, улучшением аппетита и нормализацией пищеварения. Согласно лабораторным исследованиям, уровень креатинина также снизился в среднем на 20% за первые 3 мес (p<0,01). Полученные данные позволяют сделать вывод о значительной эффективности лечения ММ леналидомидом в группе А: количество рецидивов за период наблюдения составило 27,7% (5 случаев), что в 2,5 раза ниже количества рецидивов в группе пациентов, получающих опцию лечения, содержащую бортезомиб (62,5%), p<0,05.

При анализе результатов использования бортезомиба в качестве индукционной терапии (VD-протокол) общий клинический ответ достигнут у большинства пациентов – у 12 из 16 (80%). При этом полный ответ и строгий полный ответ отмечены у 3 и 5 пациентов соответственно, очень хороший частичный ответ – у 1, частичный ответ – у 2, а у 4 (20%) больных наблюдалась стабилизация болезни, что указывает на эффективность применения данной комбинации в качестве индукционной терапии. Медиана времени до достижения полного ответа составила 85 дней. За время наблюдения (от 3 до 10 мес) у 2 пациентов наступило прогрессирование заболевания, что указывает на необходимость решения вопроса о целесообразности проведения поддерживающей терапии. При этом медиана общей выживаемости данной группы составила 2,3 года, а длительность ремиссий составляла в среднем 3 мес.
В ходе исследования в группе А были обнаружены следующие ПЭ: у 7 (38,9%) больных была выявлена протеинурия, у 11 (61,1%) остеопороз, патологические переломы наблюдались в 10 (55,5%) случаях, анемический синдром развился у 10 (55,5%) пациентов, периферические нейропатии и парезы у 9, дерматомикозы – в 11 случаях, а также наблюдался нейротоксический эффект у 11 больных. Также стоит отметить, что у большей части исследуемых отмечалось 2 и более ПЭ одновременно, что особо ухудшало общее состояние и дальнейший прогноз.
В группе Б обследованных больных протеинурия встречалась в 6 (37,5%) случаях, поражения костей в виде остеопороза наблюдались у 8 (50%), множественные патологические переломы диагностированы у 5 (31,25%) и анемический синдром наблюдался в 10 (62,5%) случаях, поражение периферической нервной системы встречались в 8 случаях и микозы кожи были у 12 больных, нейротоксический эффект наблюдался у 2 больных (табл. 3).
Обсуждение
На фоне применения леналидомида отмечались нарушения со стороны компонентов центральной нервной системы – преимущественно экстрапирамидные и мозжечковые симптомы, проявляющиеся нарушением походки и равновесия тела, головокружениями, нарушением режима сна. Парезы имели спастический характер. Периферические нейропатии проявлялись выраженным болевым синдромом, который усиливался на протяжении всего периода применения леналидомида. Однако, несмотря на выраженность неврологических нарушений, все исследуемые пациенты смогли пройти полный курс терапии. Стоит отметить, что после завершения 8-го цикла терапии по протоколу RD неврологическая симптоматика сохранялась у 11 пациентов, в то время как у остальных исследуемых данные симптомы подверглись обратному развитию в среднем спустя 9 мес после завершения лечения.
Также для ПЭ аналогов талидомида характерно развитие нефропатии, которая в нашем случае проявлялась протеинурией, что, вероятнее всего, связано с фармакокинетическими особенностями препарата. Леналидомид и другие производные талидомида экскретируются преимущественно мочевыделительной системой и, по некоторым данным, вызывают нарушение процессов фильтрации, в результате чего может возникнуть протеинурия. Также стоит отметить, что протеинурия могла возникнуть в следствие миеломной нефропатии, а аналоги талидомида лишь усугубляют данный процесс. На данный момент обратимость почечного повреждения при ММ не изучена, поэтому не представляется возможным точно дифференцировать причины развития данного ПЭ.
Как было сказано ранее, аналоги талидомида способны влиять на клетки микроокружения опухоли и тормозить процессы инвазии клеток ММ в здоровую костную ткань, посредством торможения процессов остеокластогенеза, однако без последующей активации ремоделирования кости, что повышает ее хрупкость и, соответственно, риск развития таких остеодеструктивных явлений, как патологические переломы. Повреждение опорно-двигательного аппарата также является следствием развития ММ. Среди пациентов, не получавших противоопухолевую терапию (n=54), только у 30% больных отмечались повреждения костной ткани, в то время как данное явление было обнаружено у всех исследуемых группы А, что указывает на связь развития остеодеструктивных процессов с применением леналидомида в комбинации с дексаметазоном.
Также среди ПЭ в группе А была обнаружена анемия средней и тяжелой степени. На данный момент недостаточно сведений о гематотоксичности аналогов талидомида, однако в литературе встречаются данные о гипоплазии красного костного мозга без увеличения количества миеломных клеток на фоне приема данных препаратов. Анемический синдром возникает у больных ММ вследствие замещения красного костного мозга опухолевой тканью, поэтому мы проанализировали частоту возникновения данного синдрома у пациентов, не получавших лекарственную терапию, – всего у 4 пациентов из 54 было обнаружено развитие анемии легкой и средней степени тяжести. Среди исследуемой группы, получавшей леналидомид, анемия возникла более чем у 50% больных, что говорит о связи развития данного ПЭ и приема производных талидомида.
Кроме того, на фоне применения производных талидомида отмечалось развитие дерматомикозов с преимущественной локализацией в естественных складках, а также на коже спины. Вероятнее всего, появление дерматомикозов ассоциировано с нейтропенией, возникшей на фоне приема леналидомида. Нейтропения является одним из компонентов гематотоксического воздействия леналидомида, не коррелирует с противоопухолевым эффектом и концентрацией препарата в крови и чаще возникает у пациентов с исходно низким уровнем нейтрофилов.
При анализе нефропатии на фоне применения протокола VD были выявлены несколько форм протеинурии: IgA-секретирующая и протеинурия Бенс–Джонса, что является признаком почечного повреждения в результате ММ и не является следствием применения бортезомиба.
Также в результате применения бортезомиба возникали поражения нервной системы, которые проявлялись в виде периферических нейропатий (люмбалгия, торакалгия) и парезов, которые приобретали спастический характер, а также вегетативной дисфункцией, пирамидными и мозжечковыми нарушениями. Данные проявления могли проявляться как по отдельности, так и в комбинации, однако в целом неврологические симптомы имели нестойкий характер. Нейротоксичность, вероятно, напрямую связана с ингибированием активности 26S протеосомы и последующим нарушением работы убиквитинзависимой системы, что оказывает негативное влияние на метаболическую активность нейронов. Подтверждением данной теории является развитие таких дегенеративных заболеваний нервной системы, как болезнь Альцгеймера и хорея Гентингтона, в результате нарушения работы убиквитинзависимой системы деградации белков. Подтверждением также является факт, что под воздействием бортезомиба в задних ганглиях и в задних рогах спинного мозга происходит полимеризация белка тубулина, в результате чего нарушается аксональный транспорт. В последующем в аксонах снижается концентрация никотинамидадениндинуклеотида (НАД+), что в дальнейшем приводит к дегенерации аксонов, а также к нарушению функциональной активности митохондрий, в результате чего повышается чувствительность к капсаициновым рецепторам, что ведет к возникновению парестезий [10].
На фоне проведения терапии в группе Б дерматомикозы чаще локализовались в области ногтевых пластин, естественных складок и спины. Грибковые поражения кожи ассоциированы с развитием нейтропении, причиной которой явилось влияние как бортезомиба, так и дексаметазона.
Также гематотоксичность на фоне применения протокола VD проявлялась анемией легкой и средней степени. Анемия имела преходящий характер и легко поддавалась купированию.
У пациентов группы Б очаги остеопороза и остеолиза чаще всего локализовались в позвонках и трубчатых костях. Развитие повреждения костной ткани в данном случае является, вероятно, результатом роста очага ММ, так как данных о способности ИП индуцировать костные повреждения на данный момент не существует. Также участвовать в развитии данного ПЭ мог дексаметазон, усугубляя резорбцию костной ткани и остеопоротические процессы, что повышает риск развития переломов.
Выводы
В результате исследования было установлено, что при использовании аналога талидомида – леналидомида, удалось достичь лучших показателей (средняя выживаемость составила 4,5 года) и большего срока ремиссии (средний срок ремиссии составил 6 мес) по сравнению с терапией ИП – бортезомибом, на фоне которого средняя выживаемость составила 2,3 года, а средний срок ремиссии составил 3 мес. Однако на фоне применения леналидомида отмечалось большое число ПЭ.
Главной проблемой как для аналогов талидомида, так и для ИП, является развитие выраженной нейротоксичности, которая, в частности для леналидомида, чаще всего является необратимой и включает в себя поражение как центральной, так и периферической нервной системы.
Аналоги талидомида являются более высокоэффективными препаратами, однако ИП – более безопасными. Особенно актуальны производные талидомида, в случае рефрактерных и рецидивирующих форм ММ, однако для снижения токсичности данной группы препаратов необходимо совершенствовать их химическую структуру, в том числе с целью изменения способа элиминации, во избежание повреждения функции почек.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that they have no conflict of interest.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Калиберденко Виталий Борисович – канд. мед. наук, доц. каф. внутренней медицины №2, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: vit_boris@mail.ru; ORCID: 0000-0003-1693-3190; Scopus Author ID: 57211323024
Vitaly B. Kaliberdenko – Cand. Sci. (Med.), Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: vit_boris@mail.ru; ORCID: 0000-0003-1693-3190
Конищева Валерия Сергеевна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: konishcheva.lera@inbox.ru
Valeria S. Konishcheva – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: konishcheva.lera@inbox.ru
Эмирвели Сабрие Муратовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: sabrieemirveli@mail.ru
Sabrie M. Emirveli – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: sabrieemirveli@mail.ru
Степанникова Анастасия Романовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail:anastasia.stt. 336@gmail.com
Anastasia R. Stepannikova – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: anastasia.stt.336@gmail.com
Калафатова Назифе Эдемовна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: nazife_kalafatova@mail.ru
Nazife E. Kalafatova – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: nazife_kalafatova@mail.ru
Зопунян Лейла Артуровна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». Leyla.zopunyan.99@mail.ru
Leila A. Zopunian – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: Leyla.zopunyan.99@mail.ru
Капсузян Джулия Геворговна – студентка 6-го курса, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: Kapsuzyan98@mail.ru
Dzhuliia G. Kapsuzian – Student, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: Kapsuzyan98@mail.ru
Аметова Лиля Османовна – врач-ординатор, СП «Ордена Трудового Красного Знамени Медицинский институт им. С.И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского». E-mail: ametova-lilya@bk.ru; ORCID: 0000-0003-1496-4954; eLibrary SPIN-код: 5630-9650
Lilya O. Ametova – Medical Resident, Georgievsky Order of the Red Banner Medical Institute (structural division), Vernadsky Crimean Federal University. E-mail: ametova-lilya@bk.ru; ORCID: 0000-0003-1496-4954; eLibrary SPIN-code: 5630-9650
Поступила в редакцию: 17.09.2025
Поступила после рецензирования: 26.09.2025
Принята к публикации: 02.10.2025
Received: 17.09.2025
Revised: 26.09.2025
Accepted: 02.10.2025
Список исп. литературыСкрыть список1. Silberstein J, Tuchman S, Grant SJ. What Is Multiple Myeloma? JAMA 2022;327(5):497. DOI: 10.1001/jama.2021.25306
2. Rodriguez-Otero P, Paiva B, San-Miguel JF. Roadmap to cure multiple myeloma. Cancer Treat Rev 2021 Nov;100:102284. DOI: 10.1016/j.ctrv.2021.102284
3. Goel U, Usmani S, Kumar S. Current approaches to management of newly diagnosed multiple myeloma. Am J Hematol 2022;97(Suppl.1): S3-S25. DOI: 10.1002/ajh.26512.
4. Monteith BE, Sandhu I, Lee AS. Management of Multiple Myeloma: A Review for General Practitioners in Oncology. Curr Oncol 2023;30(5):4382-4401. DOI: 10.3390/curroncol30050334
5. Rajkumar SV, Kumar S. Multiple myeloma current treatment algorithms. Blood Cancer J 2020;10(9):94. DOI: 10.1038/s41408-020-00359-2
6. Bansal R, Rakshit S, Kumar S. Extramedullary disease in multiple myeloma. Blood Cancer J 2021;11(9):161. DOI: 10.1038/s41408-021-00527-y
7. Поспелова Т.И., Скворцова Н.В., Нечунаева И.Н. Результаты лечения множественной миеломы бортезомибом. Онкогематология. 2009;(2):35-41. DOI: 10.17650/1818-8346-2009-0-2-35-41
Pospelova T.I., Skvortzova N.V., Nechunaeva I.N. Results of multiple myeloma treatment with bortezomib. Oncohematology. 2009;(2):35-41. DOI: 10.17650/1818-8346-2009-0-2-35-41 (in Russian).
8. Clarke SE, Fuller KA, Erber WN. Chromosomal defects in multiple myeloma. Blood Rev 2024;64:101168. DOI: 10.1016/j.blre.2024.101168
9. Alagpulinsa DA, Szalat RE, Poznansky MC, Shmookler Reis RJ. Genomic Instability in Multiple Myeloma. Trends Cancer 2020;6(10):858-73. DOI: 10.1016/j.trecan.2020.05.006
10. Leung N, Rajkumar SV. Multiple myeloma with acute light chain cast nephropathy. Blood Cancer J 2023;13(1):46. DOI: 10.1038/s41408-023-00806-w
11. Padala SA, Barsouk A, Barsouk A et al. Epidemiology, Staging, and Management of Multiple Myeloma. Med Sci (Basel) 2021;9(1):3. DOI: 10.3390/medsci9010003
12. Tan CRC, Abdul-Majeed S, Cael B, Barta SK. Clinical Pharmacokinetics and Pharmacodynamics of Bortezomib. Clin Pharmacokinet 2019;58(2):157-68. DOI: 10.1007/s40262-018-0679-9
13. Mateos MV, Sonneveld P, Hungria V et al. Daratumumab, Bortezomib, and Dexamethasone Versus Bortezomib and Dexamethasone in Patients With Previously Treated Multiple Myeloma: Three-year Follow-up of CASTOR. Clin Lymphoma Myeloma Leuk 2020;20(8):509-18. DOI: 10.1016/j.clml.2019.09.623
14. Snavely AR, Heo K, Petrova V et al. Bortezomib-induced neurotoxicity in human neurons is the consequence of nicotinamide adenine dinucleotide depletion. Dis Model Mech 2022;15(12):dmm049358. DOI: 10.1242/dmm.049358
15. de Arriba de la Fuente F, Durán MS, Álvarez MÁ et al. Subcutaneous bortezomib in newly diagnosed patients with multiple myeloma nontransplant eligible: Retrospective evaluation. Semin Hematol 2018;55(4):189-96. DOI: 10.1053/j.seminhematol.2017.09.002
16. Менделеева Л.П., Вотякова О.М., Рехтина И.Г. Множественная миелома. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Под ред. И.В. Поддубной, В.Г. Савченко. М., 2018.
Mendeleeva L.P., Votyakova O.M., Rekhtina I.G. Multiple myeloma. Russian clinical guidelines for the diagnosis and treatment of malignant lymphoproliferative diseases. Ed. I.V. Poddubnaya, V.G. Savchenko. Moscow, 2018 (in Russian).
17. Voorhees PM, Kaufman JL, Laubach J et al. Daratumumab, lenalidomide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial. Blood 2020;136(8):936-45. DOI: 10.1182/blood.2020005288
18. Facon T, Kumar SK, Plesner T et al. Daratumumab, lenalidomide, and dexamethasone versus lenalidomide and dexamethasone alone in newly diagnosed multiple myeloma (MAIA): overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol 2021;22(11):1582-96. DOI: 10.1016/S1470-2045(21)00466-6
19. Wang B, Duan J, Zhou L. The paradoxical pharmacological mechanisms of lenalidomide and bortezomib in the treatment of multiple myeloma. Anticancer Drugs 2021;32(3):227-32. DOI: 10.1097/CAD. 0000000000001041
20. Kesireddy M, Holstein SA. The era of lenalidomide maintenance therapy in multiple myeloma: settings for achieving best outcomes. Expert Rev Clin Pharmacol 2022;15(1):19-31. DOI: 10.1080/17512433. 2022.2032656
21. Ng Liet Hing M, Khot A. Lenalidomide maintenance in Myeloma – a goldilocks problem? Leuk Lymphoma 2023;64(10):1611-4. DOI: 10.1080/10428194.2023.2255325


