Клинический разбор в общей медицине №12 2025
Sofya V. Novosad3, Igor A. Utyashev3
1 Moscow City Oncology Hospital No. 62, Istra, Russia;
2 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
3 Branch Office of «Hadassah Medical Ltd», Moscow, Russia;
velichko.arkady@gmail.com
Abstract
Checkpoint inhibitors have revolutionized clinical practice since their introduction, but only 30–60% of patients demonstrate a clinical response to therapy with these drugs. One of the key factors influencing the effectiveness of immunotherapy may be the patient's metabolic status. In this paper, we investigate the relationship between metabolic parameters and response to immunotherapy in solid tumors in a sample of 53 patients treated with checkpoint inhibitors. The analysis revealed that the visceral fat index (VFI) is a statistically reliable predictor in this context. We have shown that the presence of VFI>195.17 reduces the patient's chances of achieving disease control with checkpoint inhibitors by 5.6 times.
Keywords: immunotherapy, CTLA-4, PD-1, melanoma, carcinoma, non-small-cell lung, intra-abdominal fat, immunometabolism.
For citation: Velichko A.Y., Smolyankina P.Y., Selivanov G.A., Vilkov S.A., Novosad S.V., Utyashev I.A. Impact of metabolic disorders on efficiency of antitumor immunotherapy. Clinical review for general practice. 2025; 6 (12): 56–61 (In Russ.). DOI: 10.47407/kr2025.6.12.00731
Введение
Ингибиторы контрольных точек (ИКТ) как один из методов иммунотерапии рака всего за 13 лет после своего появления совершили прорыв в клинической практике лечения онкологических заболеваний. Число пациентов, страдающих различным спектром онкологических заболеваний и принимающих иммунотерапевтические препараты в виде стандартной терапии, неуклонно растет [1]. Ключевым преимуществом иммунотерапии является косвенное воздействие на опухоль, что отличает ее от конвенциональных методов противоопухолевой терапии, при которых зачастую развивается резистентность и прогрессирование.
Медиана общей выживаемости при неоперабельной меланоме IV стадии до внедрения иммунотерапии с помощью ИКТ составляла всего 6–9 мес [2]. После одобрения препаратов из группы ИКТ, например комбинации анти-CTLA-4 и анти-PD-1 моноклональных антител ипилимумаба и ниволумаба, по данным анализа долгосрочных наблюдений, продолжительность жизни возросла до 6 лет [3]. Ответ на иммунотерапию наблюдают у 30–60% больных меланомой [4, 5], аналогичные данные об эффективности были получены по немелкоклеточному раку легких (НМРЛ) и многим другим онкологическим заболеваниям [6], что свидетельствует о важнейшей роли иммунной системы в патогенезе и лечении практически всех типов и стадий рака.
Несмотря на беспрецедентное улучшение показателей, не у всех пациентов наблюдается стойкая ремиссия, примерно у половины продолжается прогрессия заболевания, возникает первичная или приобретенная резистентность и рецидивы [3]. В процессе поиска решений по преодолению резистентности к противоопухолевой иммунотерапии предпринимались попытки улучшить терапевтическую эффективность путем комбинирования ИКТ с химиотерапевтическими агентами, лучевой и химиолучевой, а также таргетной терапией [7, 8]. Однако среди исследований таких стратегий нет однородности, а результаты характеризуются высоким риском нежелательных побочных реакций [9].
Интерес вызывают работы о влиянии метаболических показателей на исход заболевания. World Cancer Research Fund (WCRF) еще в 2007 г. предоставил отчет, подтверждающий роль ожирения в повышение риска развития аденокарциномы пищевода, рака поджелудочной железы, толстого кишечника, эндометрия почек [10]. С тех пор проведено множество исследований с противоречивыми данными.
С одной стороны, была продемонстрирована ассоциация повышения индекса массы тела (ИМТ) на 5 кг/м2 и возрастающим риском развития различных злокачественных новообразований, в том числе меланомы [11]. Повышенный показатель ИМТ коррелирует со сниженной активностью процессов аутофагии, подавляющих развитие и рост опухоли [12]. С другой стороны, имеются данные об отсутствии статистически значимых различий и даже опубликованы работы о положительном влиянии ожирения на общую выживаемость, ознаменованные как «парадокс ожирения» [13].
Индекс висцерального жира (Visceral Fat Index – VFI) также потенциально является важным прогностическим фактором. Висцеральная жировая ткань – сложно устроенный динамический орган. Он выполняет спектр функций, среди которых ключевыми являются метаболическая и эндокринная. В ее состав входят жировые ассоциированные лимфоидные кластеры (FALC), выполняющие иммунонадзор за серозными полостями [14], и в случае локализации воспаления рядом с висцеральными клетками изменяется экспрессия адипокинов [15]. Также висцеральный жир играет ключевую роль в развитии метавоспаления, обнаружение которого может служить доклиническим маркером прогрессирования рака легких [16].
Совместное рассмотрение метаболических особенностей пациента и его иммунитета является передним краем иммунологии. Оценка метаболического статуса пациента может стать важным предиктивным методом, так как данный статус оказывает влияние на иммунную систему, опосредующую эффект иммунотерапии. А широкое внедрение в клиническую практику препаратов, корректирующих метаболические нарушения, может способствовать синергии в достижении противоопухолевого ответа.
Учитывая неоднородность опубликованных данных, нами было принято решение о проведении пилотного исследования иммунометаболизма в контексте онкологических заболеваний.
Целью данной работы является поиск и оценка взаимосвязи между метаболическими факторами и ответом на иммунотерапию при солидных опухолях. Для достижения цели необходимо выполнить ряд задач.
1. Определить клинически релевантные и доступные методы характеризации метаболического статуса пациента.
2. Выявить статистические взаимосвязи между выбранными характеристиками и эффективностью иммунотерапии.
При рассмотрении новейшего подхода в какой-либо области науки, на наш взгляд, стоит воспользоваться самой широкой оптикой. Руководствуясь таким подходом, мы считаем, что исследование корректно начать с рассмотрения ряда онкологических заболеваний в общей совокупности, совершив попытку найти общие закономерности патогенеза и фармакологических эффектов терапии. Следовательно, мы прибегли к рассмотрению ряда солидных опухолей совместно, не разделяя анализ на индивидуальные патологии.
Материалы и методы
Дизайн исследования. Для ретроспективного исследования выбрано 53 пациента, прошедших лечение в «Hadassah Medical Moscow». Протокол исследования рассмотрен и одобрен локальным этическим комитетом и соответствовал Хельсинской декларации 2013 г.
Из медицинских карт извлечены данные, характеризующие онкологический процесс, общее состояние здоровья и метаболические параметры пациентов. В основе исследования лежит поиск взаимосвязи выбранных метаболических характеристик и последующего ответа на иммунотерапию (Overall Response Rate – ORR), оцененного по шкале iRECIST, при уравновешенных прочих показателях.
В исследуемую выборку вошли пациенты мужского и женского пола старше 18 лет. Исключений по клинической стадии и распространенности опухолевого процесса не проводилось – исследованы все группы пациентов с меланомой и НМРЛ, получавшие ИКТ в любой линии. Все пациенты проходили лечение как минимум одним препаратом из фармакологической группы ИКТ:
• PD1 (ниволумаб, пембролизумаб, пролголимаб);
• PD-L1 (атезолизумаб, дурвалумаб);
• CTLA-4 (ипилимумаб);
• комбинацией PD1- и CTLA-4-агентов (ипилимумаб + ниволумаб, нурулимаб + пролголимаб);
• комбинациями химиопрепаратов с иммунотерапевтическими агентами (например, карбоплатин + пеметрексед + пембролизумаб).
Метаболические параметры. Для оценки наличия или отсутствия у пациента метаболических отклонений использованы следующие показатели:
• ИМТ;
• VFI;
• индекс поясничной мышцы (psoas muscle index – PMI);
• наличие или отсутствие метаболического синдрома.
ИМТ, несмотря на свою неточность, является наиболее клинически доступным методом оценки антропометрических характеристик метаболического состояния тела человека. Нерепрезентативным данный показатель становится при отклонении параметров мышечной или костной массы от популяционной нормы, а также его описательная ценность уменьшается при наличии у пациента других антропометрических особенностей (малый или большой рост, отсутствие конечностей, грубые пороки развития и пр.).
Расчет ИМТ, кг/м2:
ИМТ = m/h, (1)
где m – масса тела, кг, h – рост, м.
VFI характеризует содержание наиболее эндокринно активной жировой ткани в теле человека – висцерального жира. Метод также является доступным для выполнения в клинической практике, так как для расчета требует данных о половой принадлежности, возрасте, массе тела, росте и окружностях бедра и талии пациента. Авторами, предложившими данную методику, определение окружности талии и бедра выполнялось при помощи сантиметровой ленты [17]. В нашем исследовании данные параметры получены из КТ-изображений. Окружность бедра (ОБ) определена на срезе нижней конечности, непосредственно под нижней ягодичной складкой. Показатель окружности талии (ОТ) фиксирован на середине расстояния между нижней парой ребер и верхними точками крыльев подвздошных костей. Дальнейший расчет проводился по (2) и (3), в зависимости от половой принадлежности пациента.
Индекс висцерального жира у женщин (VFIf):
VFIf = 2,15×ОТ - 3,63×ОБ +1,46×возраст + 6,22×ИМТ - 92,713, (2)
где ОТ – окружность талии, см; ОБ – окружность бедра, см; ИМТ вычислен по (1).
Индекс висцерального жира у мужчин (VFIm):
VFIm=6×ОТ - 4,41×ОБ + 1,19×возраст - 213,65, (3)
где ОТ – окружность талии, см; ОБ – окружность бедра, см.
PMI является индексом, характеризующим содержания скелетной мускулатуры в теле человека. Данный параметр был предложен в качестве простого и быстрого метода оценки саркопении и доказал свою предиктивную ценность в ряде патологий [18]. Данные о площади поясничной мышцы (ППМ) были вычислены по КТ-изображениям как сумма площадей левой и правой поясничной мышцы на уровне третьего поясничного позвонка (L3), см2. Дальнейший расчет производился по (4).
Индекс поясничной мышцы (PMI)
PMI = ППМ/h, (4)
где ППМ – суммарная площадь левой и правой поясничной мышцы на уровне L3, см2, h – рост, м.
Метаболический синдром – наднозологическое понятие, характеризующее повышенный риск развития сердечно-сосудистых заболеваний и сахарного диабета 2-го типа. Эти состояния в некоторой степени взаимосвязаны, имеют общие ключевые медиаторы, механизмы и совместно потенцируют прогрессию ряда прочих заболеваний, а также танатогенез. Центральным столпом метаболического синдрома является системная дисфункция метаболизма, что может оказывать существенное влияние на иммунную систему. Клинические критерии, определяющие метаболический синдром, являются предметом обсуждения. Различные инициативные группы исследователей предлагают собственные критерии. Для нашего исследования метаболический синдром определен согласно критериям National Heart, Lung and Blood Institute (NHLBI) [19]:
• ОТ у мужчин >94 см и у женщин >80 см;
• уровень триглицеридов >1,7 ммоль/л;
• уровень липопротеинов высокой плотности
<1,0 ммоль/л у мужчин и <1,3 ммоль/л у женщин;
• артериальное давление (АД) при офисном измерении: систолическое АД>140 мм рт. ст., диастолическое АД>90 мм рт. ст.
• нарушение гликемии натощак, толерантности к глюкозе или сахарный диабет. Соответственно, показатель глюкозы в венозной плазме >6,1 ммоль натощак или >7,8 ммоль/л через 2 ч после проведения перорального глюкозотолерантного теста.
Прием пациентом гиполипидемической, антигипертензивной и сахароснижающей терапии (за исключением ингибиторов SGLT2), согласно рекомендациям NHLBI, должен быть расценен как нарушение соответствующего показателя.
Наличие не менее трех указанных признаков расценивалось как свидетельство наличия метаболического синдрома.
Статистический анализ. Для описания категориальных переменных использовались абсолютные значения. Количественные переменные представлялись в зависимости от типа распределения: при нормальном распределении данные выражались в виде среднего значения и стандартного отклонения (M±SD), при отклонении от нормального распределения – в виде медианы и межквартильного размаха (Me [IQR]).
Проверка нормальности распределения количественных показателей осуществлялась с помощью критерия Шапиро–Уилка. Если распределение данных соответствовало нормальному, для сравнения между группами применялся t-критерий Стьюдента для независимых выборок. Если данные не соответствовали нормальному распределению, использовался критерий Манна–Уитни.
Для анализа категориальных переменных применялся критерий χ² (хи-квадрат). В случае если в таблице сопряженности ожидалось менее пяти наблюдений в одной из ячеек, использовался точный критерий Фишера. Критический уровень значимости при всех статистических тестах был принят на уровне p<0,05. Для обработки данных и проведения статистического анализа использовался программный пакет IBM SPSS Statistics версии 23.0.
Модель логистической регрессии была также выполнена с использованием IBM SPSS Statistics версии 23.0. Для проверки устойчивости результатов применен бутстреп-анализ с 1000 повторениями, что позволило уточнить доверительные интервалы для коэффициентов.
Значимыми считались предикторы с уровнем значимости p<0,05. Для интерпретации результатов рассчитывалось отношение шансов (OR) с 95% доверительным интервалом (ДИ).
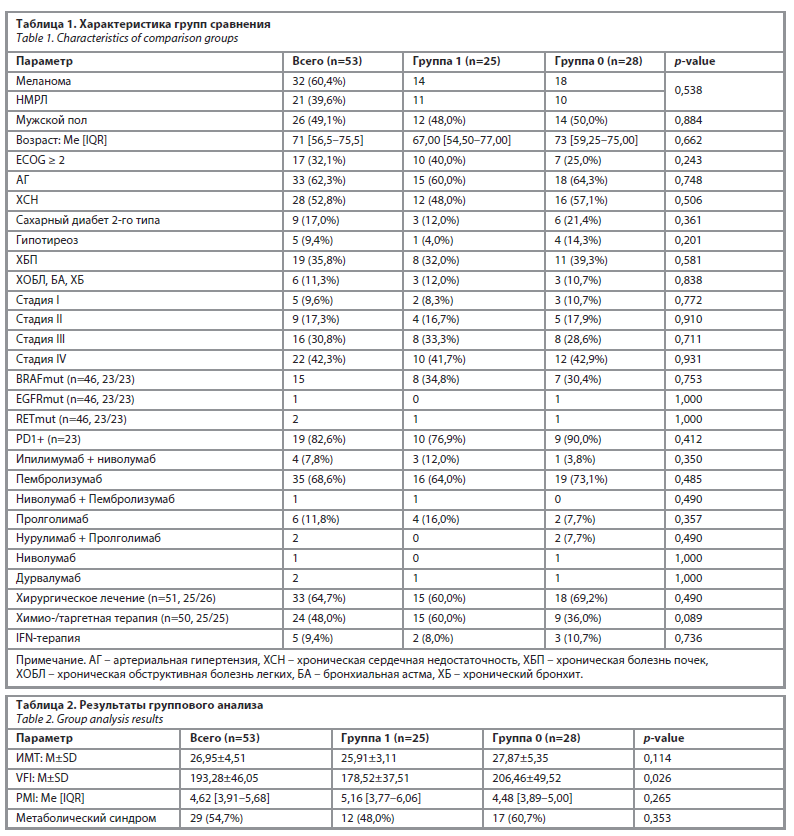
Характеристика выборки пациентов. Выборка из 53 пациентов состояла из 32 человек, получающих иммунотерапию по поводу меланомы, и 21 человека – по поводу НМЛР. В группу 1 определены пациенты, у которых на фоне иммунотерапии зафиксирован клинический ответ по шкале iRECIST: стабилизация, частичный или полный ответ. В группу 0 вошли пациенты с прогрессией заболевания, определенной в результате контрольного исследования (табл. 1).
Группы являются статистически сбалансированными по возрасту, полу, характеристикам онкологического процесса, сопутствующим заболеваниям. Дополнительно зафиксировано наличие или отсутствие IFN-терапии меланомы в анамнезе пациента, так как этот показатель может иметь значение при проведении последующей иммунотерапии. По этому параметру группы также являются сбалансированными.
Результаты
Результаты статистического анализа групп 1 (группа, показавшая контроль над заболеванием на фоне иммунотерапии) и 0 (группа с прогрессией заболевания) приведены в табл. 2.
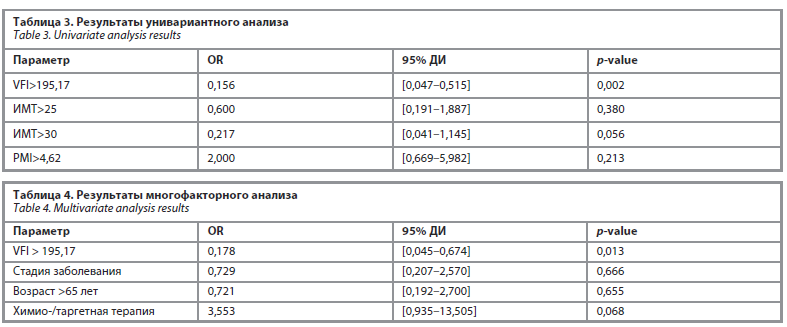
Также проведен унивариантный анализ для выделенных антропометрических показателей (табл. 3). На основании статистической значимости полученного соотношения шансов (OR), был выполнен многофакторный анализ для VFI с клинически значимыми кофакторами (табл. 4).
ИМТ. В результате анализа мы не обнаружили статистически значимой корреляции ИМТ и клинического ответа на иммунотерапию. Однако стоит отметить, что при ИМТ>30 наблюдается некоторая тенденция к сниженному ответу на иммунотерапию.
VFI. VFI>197,15 в данной генеральной выборке является медианой, и выбрано как значение отсечения. Мы обнаружили статистически значимую корреляцию между повышенным показателем VFI и отсутствием ответа на иммунотерапию.
Отношение шансов для VFI>195,17 составило 0,178 (95% ДИ 0,045–0,674) и является статистически значимым. Также стоит отметить, что у пациентов с VFI больше данного значения клинический ответ по шкале iRECIST наблюдался в 5,6 раза реже (1/0,178=5,6), чем у пациентов с VFI<195,17.
PMI. Согласно нашим расчетам, PMI не является прогностическим показателем при инициации иммунотерапии. Статистической тенденции в пользу данного индекса также не наблюдается.
Обсуждение
В нашем исследовании была подтверждена первоначальная гипотеза о влиянии эндокринно активной ткани – висцерального жира – на клинический ответ при иммунотерапии. Такой результат согласуется с литературными данными и является обоснованным с точки зрения фундаментальных биохимических процессов.
Нами было показано, что VFI является перспективным инструментом для прогнозирования ответа на иммунотерапию опухолей. Корреляция между повышенным содержанием висцерального жира, оцененным при помощи индекса VFI, и ответом на лечение оказалась статистически значимой. Также по результатам многофакторного анализа выявлено, что пациенты со значением данного индекса более 195,17 имели в 5,6 раза меньшую вероятность развития клинического ответа при терапии ИКТ.
Такой результат выделяет расчет VFI как один из самых перспективных методов предикции ответа на иммунотерапию. В случае подтверждения наших выводов в последующих исследованиях на более крупной выборке данный метод может стать мощным инструментом для принятия онкологами более обоснованного решения о клинической тактике для конкретного пациента, что согласуется с принципами персонифицированной медицины.
Последствием применения такого предиктивного метода станет не только экономия материальных средств в системе здравоохранения, но и заблаговременный переход к наиболее эффективным методам лечения для данного больного, что приведет к лучшим исходам в терапии онкологических заболеваний.
Наше исследование также дает основу для фундаментальных исследований в области иммунологии, эндокринологии и онкологии. Возможным представляется предположить, что за однородностью взаимосвязи между содержанием висцерального жира и эффективностью иммунотерапии широким спектром препаратов меланомы и группы заболеваний, объединенных термином «НМРЛ», скрываются фундаментальные механизмы, еще не описанные в научной литературе.
Полученные нами данные являются вдохновляющим, однако стоит упомянуть об уязвимых моментах этого исследования. Так, выборка из 53 пациентов явилась достаточной для получения статистически значимых результатов, однако не может служить основанием для немедленной трансляции метода в клиническую практику. Несмотря на удовлетворительно сбалансированные группы сравнения, стоит отметить, что в группе с клиническим ответом (группа 1) химио- или таргетный препарат получали 60%, когда в группе с прогрессией заболевания (группа 0) только 36%. Данное различие не было статистически значимым (p=0,089), однако этот аспект все же может быть поводом для критики нашего исследования. В продолжении исследования нами будет набрана бóльшая выборка, более корректно уравновешенная в том числе и по данному признаку.
ИМТ, как простой и удобный в применении показатель, показал свою эффективность в клинической практике. Мы не исключаем возможность, что в последующем, при масштабировании нашего исследования, корреляция повышенного ИМТ и сниженного ответа при иммунотерапии опухолей будет статистически подтверждена. Однако даже в таком случае ИМТ останется показателем, заслуживающим определенной критики. Этот индекс сравнительно надежен в своей описательной функции для большей части популяции, однако существуют группы людей, применение данного метода в которых является неоправданным и чревато ложными результатами. Так, у лиц с существенно развитой скелетной мускулатурой ИМТ имеет повышенные значения.
В современной практике термины «ИМТ» и «ожирение» тесно связаны, поскольку диагноз «ожирение» устанавливается на основании значения ИМТ. Однако стоит отметить, что в своей сути ИМТ характеризует удельный вес, приходящийся на квадратный метр тела. Этот индекс способен оценить содержание жировой ткани в теле человека только косвенно, поэтому не может быть применен в каждом конкретном клиническом случае с высокой итоговой долей корректно принятых клинических решений.
Несмотря на перспективность ИМТ как метода прогнозирования ответа на иммунотерапию, данный метод представляется подходящим только для первичной и приблизительной оценки, но не методом принятия финального решения о терапевтической тактике из-за неточности показаний при оценке лиц, антропометрические показатели которых выходят за границы популяционной нормы.
PMI не показал эффективности в прогнозировании ответа на иммунотерапию. Согласно статистическим результатам, данный индекс также не представляется перспективным в случае анализа на большей выборке пациентов. Такие данные могут свидетельствовать о незначительном или малом влиянии саркопении или выраженно развитой скелетной мускулатуры на звенья функционирования иммунной системы, вовлеченные в реализацию фармакологического эффекта ИКТ.
Заключение
В результате пилотного исследования были выполнены поставленные задачи и достигнута цель. Нами было продемонстрировано, что повышенное содержание висцерального жира, оцененное при помощи индекса VFI, коррелирует с худшим клиническим ответом на ИКТ при онкологических заболеваниях. Учитывая перспективность данного предиктивного метода и его возможность дать пациентам существенную клиническую выгоду, нами будут продолжены исследования в данном направлении.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Величко Аркадий Яковлевич – ординатор, ГБУЗ «МГОБ №62 ДЗМ». E-mail: velichko.arkady@gmail.com; ORCID: 0000-0003-3686-0072; Scopus Author ID: 57218142638
Arkady Ya. Velichko – resident-physician, Moscow City Oncology Hospital No. 62. E-mail: velichko.arkady@gmail.com; ORCID: 0000-0003-3686-0072; Scopus Author ID: 57218142638
Смолянкина Полина Юрьевна – студентка 5-го курса, медицинский институт, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: 1032210223@pfur.ru; ORCID: 0009-0001-5098-885X
Polina Yu. Smolyankina – Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1032210223@pfur.ru; ORCID: 0009-0001-5098-885X
Селиванов Глеб Александрович – студент 5-го курса, медицинский институт, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: 1032216380@pfur.ru; ORCID: 0009-0002-6051-8779
Gleb A. Selivanov – Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1032216380@pfur.ru; ORCID: 0009-0002-6051-8779
Вилков Сергей Анатольевич – зав. отд-нием лучевой диагностики, рентгенолог, ФК ОО «Хадасса Медикал Лтд». E-mail: s.vilkov@hadassah.moscow
Sergey A. Vilkov – Head of the Department of Radiation Diagnostics, Radiologist, Branch Office of «Hadassah Medical Ltd». E-mail: s.vilkov@hadassah.moscow
Новосад Софья Владимировна – канд. мед. наук, врач-эндокринолог, ФК ОО «Хадасса Медикал Лтд». E-mail: sophia.novosad@gmail.com; ORCID: 0009-0008-0933-3801
Sofya V. Novosad – Cand. Sci. (Med.), Endocrinologist, Branch Office of «Hadassah Medical Ltd». E-mail: sophia.novosad@gmail.com; ORCID: 0009-0008-0933-3801
Утяшев Игорь Аглямович – канд. мед наук, дир. департамента клинических исследований, врач-онколог, лидер группы по меланоме, опухолям кожи и саркомам Института онкологии Hadassah Medical Moscow (ГК Медскан), ФК ОО «Хадасса Медикал Лтд». E-mail: dr.utyashev@gmail.com; ORCID: 0000-0003-0002-4814; Scopus Author ID: 25226057400
Igor A. Utyashev – Cand. Sci. (Med.), Director of the Clinical Research Department, Oncologist, Leader of the melanoma, skin tumors and sarcoma group at the Hadassah Medical Moscow Institute of Oncology; Branch Office of «Hadassah Medical Ltd».
E-mail: dr.utyashev@gmail.com; ORCID: 0000-0003-0002-4814; Scopus Author ID: 25226057400
Поступила в редакцию: 17.06.2025
Поступила после рецензирования: 30.06.2025
Принята к публикации: 17.07.2025
Received: 17.06.2025
Revised: 30.06.2025
Accepted: 17.07.2025
Клинический разбор в общей медицине №12 2025
Влияние метаболических нарушений на эффективность противоопухолевой иммунотерапии
Номера страниц в выпуске:56-61
Аннотация
Появление ингибиторов контрольных точек произвело революцию в клинической онкологии, однако только 30–60% пациентов демонстрирует клинический ответ на терапию этими препаратами. Одним из ключевых факторов, влияющих на эффективность противоопухолевой иммунотерапии, может быть метаболический статус пациента. В данной работе мы исследуем взаимосвязь метаболических
параметров и ответа на иммунотерапию при солидных опухолях на выборке из 53 человек, получивших терапию ингибиторами контрольных точек. Проведенный анализ выявил, что индекс висцерального жира (VFI) является статистически надежным предиктивным показателем в данном контексте. Нами показано, что наличие VFI>195,17 сокращает шансы пациента получить контроль над заболеванием при лечении ингибиторами контрольных точек в 5,6 раза.
Ключевые слова: иммунотерапия, CTLA-4, PD-1, меланома, немелкоклеточный рак легкого, висцеральное ожирение, иммунометаболизм.
Для цитирования: Величко А.Я., Смолянкина П.Ю., Селиванов Г.А., Вилков С.А., Новосад С.В., Утяшев И.А. Влияние метаболических нарушений на эффективность противоопухолевой иммунотерапии. Клинический разбор в общей медицине. 2025; 6 (12): 56–61. DOI: 10.47407/kr2025.6.12.00731
Появление ингибиторов контрольных точек произвело революцию в клинической онкологии, однако только 30–60% пациентов демонстрирует клинический ответ на терапию этими препаратами. Одним из ключевых факторов, влияющих на эффективность противоопухолевой иммунотерапии, может быть метаболический статус пациента. В данной работе мы исследуем взаимосвязь метаболических
параметров и ответа на иммунотерапию при солидных опухолях на выборке из 53 человек, получивших терапию ингибиторами контрольных точек. Проведенный анализ выявил, что индекс висцерального жира (VFI) является статистически надежным предиктивным показателем в данном контексте. Нами показано, что наличие VFI>195,17 сокращает шансы пациента получить контроль над заболеванием при лечении ингибиторами контрольных точек в 5,6 раза.
Ключевые слова: иммунотерапия, CTLA-4, PD-1, меланома, немелкоклеточный рак легкого, висцеральное ожирение, иммунометаболизм.
Для цитирования: Величко А.Я., Смолянкина П.Ю., Селиванов Г.А., Вилков С.А., Новосад С.В., Утяшев И.А. Влияние метаболических нарушений на эффективность противоопухолевой иммунотерапии. Клинический разбор в общей медицине. 2025; 6 (12): 56–61. DOI: 10.47407/kr2025.6.12.00731
Impact of metabolic disorders on efficiency of antitumor immunotherapy
Arkady Ya. Velichko1, Polina Yu. Smolyankina2, Gleb A. Selivanov2, Sergey A. Vilkov3,Sofya V. Novosad3, Igor A. Utyashev3
1 Moscow City Oncology Hospital No. 62, Istra, Russia;
2 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
3 Branch Office of «Hadassah Medical Ltd», Moscow, Russia;
velichko.arkady@gmail.com
Abstract
Checkpoint inhibitors have revolutionized clinical practice since their introduction, but only 30–60% of patients demonstrate a clinical response to therapy with these drugs. One of the key factors influencing the effectiveness of immunotherapy may be the patient's metabolic status. In this paper, we investigate the relationship between metabolic parameters and response to immunotherapy in solid tumors in a sample of 53 patients treated with checkpoint inhibitors. The analysis revealed that the visceral fat index (VFI) is a statistically reliable predictor in this context. We have shown that the presence of VFI>195.17 reduces the patient's chances of achieving disease control with checkpoint inhibitors by 5.6 times.
Keywords: immunotherapy, CTLA-4, PD-1, melanoma, carcinoma, non-small-cell lung, intra-abdominal fat, immunometabolism.
For citation: Velichko A.Y., Smolyankina P.Y., Selivanov G.A., Vilkov S.A., Novosad S.V., Utyashev I.A. Impact of metabolic disorders on efficiency of antitumor immunotherapy. Clinical review for general practice. 2025; 6 (12): 56–61 (In Russ.). DOI: 10.47407/kr2025.6.12.00731
Введение
Ингибиторы контрольных точек (ИКТ) как один из методов иммунотерапии рака всего за 13 лет после своего появления совершили прорыв в клинической практике лечения онкологических заболеваний. Число пациентов, страдающих различным спектром онкологических заболеваний и принимающих иммунотерапевтические препараты в виде стандартной терапии, неуклонно растет [1]. Ключевым преимуществом иммунотерапии является косвенное воздействие на опухоль, что отличает ее от конвенциональных методов противоопухолевой терапии, при которых зачастую развивается резистентность и прогрессирование.
Медиана общей выживаемости при неоперабельной меланоме IV стадии до внедрения иммунотерапии с помощью ИКТ составляла всего 6–9 мес [2]. После одобрения препаратов из группы ИКТ, например комбинации анти-CTLA-4 и анти-PD-1 моноклональных антител ипилимумаба и ниволумаба, по данным анализа долгосрочных наблюдений, продолжительность жизни возросла до 6 лет [3]. Ответ на иммунотерапию наблюдают у 30–60% больных меланомой [4, 5], аналогичные данные об эффективности были получены по немелкоклеточному раку легких (НМРЛ) и многим другим онкологическим заболеваниям [6], что свидетельствует о важнейшей роли иммунной системы в патогенезе и лечении практически всех типов и стадий рака.
Несмотря на беспрецедентное улучшение показателей, не у всех пациентов наблюдается стойкая ремиссия, примерно у половины продолжается прогрессия заболевания, возникает первичная или приобретенная резистентность и рецидивы [3]. В процессе поиска решений по преодолению резистентности к противоопухолевой иммунотерапии предпринимались попытки улучшить терапевтическую эффективность путем комбинирования ИКТ с химиотерапевтическими агентами, лучевой и химиолучевой, а также таргетной терапией [7, 8]. Однако среди исследований таких стратегий нет однородности, а результаты характеризуются высоким риском нежелательных побочных реакций [9].
Интерес вызывают работы о влиянии метаболических показателей на исход заболевания. World Cancer Research Fund (WCRF) еще в 2007 г. предоставил отчет, подтверждающий роль ожирения в повышение риска развития аденокарциномы пищевода, рака поджелудочной железы, толстого кишечника, эндометрия почек [10]. С тех пор проведено множество исследований с противоречивыми данными.
С одной стороны, была продемонстрирована ассоциация повышения индекса массы тела (ИМТ) на 5 кг/м2 и возрастающим риском развития различных злокачественных новообразований, в том числе меланомы [11]. Повышенный показатель ИМТ коррелирует со сниженной активностью процессов аутофагии, подавляющих развитие и рост опухоли [12]. С другой стороны, имеются данные об отсутствии статистически значимых различий и даже опубликованы работы о положительном влиянии ожирения на общую выживаемость, ознаменованные как «парадокс ожирения» [13].
Индекс висцерального жира (Visceral Fat Index – VFI) также потенциально является важным прогностическим фактором. Висцеральная жировая ткань – сложно устроенный динамический орган. Он выполняет спектр функций, среди которых ключевыми являются метаболическая и эндокринная. В ее состав входят жировые ассоциированные лимфоидные кластеры (FALC), выполняющие иммунонадзор за серозными полостями [14], и в случае локализации воспаления рядом с висцеральными клетками изменяется экспрессия адипокинов [15]. Также висцеральный жир играет ключевую роль в развитии метавоспаления, обнаружение которого может служить доклиническим маркером прогрессирования рака легких [16].
Совместное рассмотрение метаболических особенностей пациента и его иммунитета является передним краем иммунологии. Оценка метаболического статуса пациента может стать важным предиктивным методом, так как данный статус оказывает влияние на иммунную систему, опосредующую эффект иммунотерапии. А широкое внедрение в клиническую практику препаратов, корректирующих метаболические нарушения, может способствовать синергии в достижении противоопухолевого ответа.
Учитывая неоднородность опубликованных данных, нами было принято решение о проведении пилотного исследования иммунометаболизма в контексте онкологических заболеваний.
Целью данной работы является поиск и оценка взаимосвязи между метаболическими факторами и ответом на иммунотерапию при солидных опухолях. Для достижения цели необходимо выполнить ряд задач.
1. Определить клинически релевантные и доступные методы характеризации метаболического статуса пациента.
2. Выявить статистические взаимосвязи между выбранными характеристиками и эффективностью иммунотерапии.
При рассмотрении новейшего подхода в какой-либо области науки, на наш взгляд, стоит воспользоваться самой широкой оптикой. Руководствуясь таким подходом, мы считаем, что исследование корректно начать с рассмотрения ряда онкологических заболеваний в общей совокупности, совершив попытку найти общие закономерности патогенеза и фармакологических эффектов терапии. Следовательно, мы прибегли к рассмотрению ряда солидных опухолей совместно, не разделяя анализ на индивидуальные патологии.
Материалы и методы
Дизайн исследования. Для ретроспективного исследования выбрано 53 пациента, прошедших лечение в «Hadassah Medical Moscow». Протокол исследования рассмотрен и одобрен локальным этическим комитетом и соответствовал Хельсинской декларации 2013 г.
Из медицинских карт извлечены данные, характеризующие онкологический процесс, общее состояние здоровья и метаболические параметры пациентов. В основе исследования лежит поиск взаимосвязи выбранных метаболических характеристик и последующего ответа на иммунотерапию (Overall Response Rate – ORR), оцененного по шкале iRECIST, при уравновешенных прочих показателях.
В исследуемую выборку вошли пациенты мужского и женского пола старше 18 лет. Исключений по клинической стадии и распространенности опухолевого процесса не проводилось – исследованы все группы пациентов с меланомой и НМРЛ, получавшие ИКТ в любой линии. Все пациенты проходили лечение как минимум одним препаратом из фармакологической группы ИКТ:
• PD1 (ниволумаб, пембролизумаб, пролголимаб);
• PD-L1 (атезолизумаб, дурвалумаб);
• CTLA-4 (ипилимумаб);
• комбинацией PD1- и CTLA-4-агентов (ипилимумаб + ниволумаб, нурулимаб + пролголимаб);
• комбинациями химиопрепаратов с иммунотерапевтическими агентами (например, карбоплатин + пеметрексед + пембролизумаб).
Метаболические параметры. Для оценки наличия или отсутствия у пациента метаболических отклонений использованы следующие показатели:
• ИМТ;
• VFI;
• индекс поясничной мышцы (psoas muscle index – PMI);
• наличие или отсутствие метаболического синдрома.
ИМТ, несмотря на свою неточность, является наиболее клинически доступным методом оценки антропометрических характеристик метаболического состояния тела человека. Нерепрезентативным данный показатель становится при отклонении параметров мышечной или костной массы от популяционной нормы, а также его описательная ценность уменьшается при наличии у пациента других антропометрических особенностей (малый или большой рост, отсутствие конечностей, грубые пороки развития и пр.).
Расчет ИМТ, кг/м2:
ИМТ = m/h, (1)
где m – масса тела, кг, h – рост, м.
VFI характеризует содержание наиболее эндокринно активной жировой ткани в теле человека – висцерального жира. Метод также является доступным для выполнения в клинической практике, так как для расчета требует данных о половой принадлежности, возрасте, массе тела, росте и окружностях бедра и талии пациента. Авторами, предложившими данную методику, определение окружности талии и бедра выполнялось при помощи сантиметровой ленты [17]. В нашем исследовании данные параметры получены из КТ-изображений. Окружность бедра (ОБ) определена на срезе нижней конечности, непосредственно под нижней ягодичной складкой. Показатель окружности талии (ОТ) фиксирован на середине расстояния между нижней парой ребер и верхними точками крыльев подвздошных костей. Дальнейший расчет проводился по (2) и (3), в зависимости от половой принадлежности пациента.
Индекс висцерального жира у женщин (VFIf):
VFIf = 2,15×ОТ - 3,63×ОБ +1,46×возраст + 6,22×ИМТ - 92,713, (2)
где ОТ – окружность талии, см; ОБ – окружность бедра, см; ИМТ вычислен по (1).
Индекс висцерального жира у мужчин (VFIm):
VFIm=6×ОТ - 4,41×ОБ + 1,19×возраст - 213,65, (3)
где ОТ – окружность талии, см; ОБ – окружность бедра, см.
PMI является индексом, характеризующим содержания скелетной мускулатуры в теле человека. Данный параметр был предложен в качестве простого и быстрого метода оценки саркопении и доказал свою предиктивную ценность в ряде патологий [18]. Данные о площади поясничной мышцы (ППМ) были вычислены по КТ-изображениям как сумма площадей левой и правой поясничной мышцы на уровне третьего поясничного позвонка (L3), см2. Дальнейший расчет производился по (4).
Индекс поясничной мышцы (PMI)
PMI = ППМ/h, (4)
где ППМ – суммарная площадь левой и правой поясничной мышцы на уровне L3, см2, h – рост, м.
Метаболический синдром – наднозологическое понятие, характеризующее повышенный риск развития сердечно-сосудистых заболеваний и сахарного диабета 2-го типа. Эти состояния в некоторой степени взаимосвязаны, имеют общие ключевые медиаторы, механизмы и совместно потенцируют прогрессию ряда прочих заболеваний, а также танатогенез. Центральным столпом метаболического синдрома является системная дисфункция метаболизма, что может оказывать существенное влияние на иммунную систему. Клинические критерии, определяющие метаболический синдром, являются предметом обсуждения. Различные инициативные группы исследователей предлагают собственные критерии. Для нашего исследования метаболический синдром определен согласно критериям National Heart, Lung and Blood Institute (NHLBI) [19]:
• ОТ у мужчин >94 см и у женщин >80 см;
• уровень триглицеридов >1,7 ммоль/л;
• уровень липопротеинов высокой плотности
<1,0 ммоль/л у мужчин и <1,3 ммоль/л у женщин;
• артериальное давление (АД) при офисном измерении: систолическое АД>140 мм рт. ст., диастолическое АД>90 мм рт. ст.
• нарушение гликемии натощак, толерантности к глюкозе или сахарный диабет. Соответственно, показатель глюкозы в венозной плазме >6,1 ммоль натощак или >7,8 ммоль/л через 2 ч после проведения перорального глюкозотолерантного теста.
Прием пациентом гиполипидемической, антигипертензивной и сахароснижающей терапии (за исключением ингибиторов SGLT2), согласно рекомендациям NHLBI, должен быть расценен как нарушение соответствующего показателя.
Наличие не менее трех указанных признаков расценивалось как свидетельство наличия метаболического синдрома.
Статистический анализ. Для описания категориальных переменных использовались абсолютные значения. Количественные переменные представлялись в зависимости от типа распределения: при нормальном распределении данные выражались в виде среднего значения и стандартного отклонения (M±SD), при отклонении от нормального распределения – в виде медианы и межквартильного размаха (Me [IQR]).
Проверка нормальности распределения количественных показателей осуществлялась с помощью критерия Шапиро–Уилка. Если распределение данных соответствовало нормальному, для сравнения между группами применялся t-критерий Стьюдента для независимых выборок. Если данные не соответствовали нормальному распределению, использовался критерий Манна–Уитни.
Для анализа категориальных переменных применялся критерий χ² (хи-квадрат). В случае если в таблице сопряженности ожидалось менее пяти наблюдений в одной из ячеек, использовался точный критерий Фишера. Критический уровень значимости при всех статистических тестах был принят на уровне p<0,05. Для обработки данных и проведения статистического анализа использовался программный пакет IBM SPSS Statistics версии 23.0.

Модель логистической регрессии была также выполнена с использованием IBM SPSS Statistics версии 23.0. Для проверки устойчивости результатов применен бутстреп-анализ с 1000 повторениями, что позволило уточнить доверительные интервалы для коэффициентов.
Значимыми считались предикторы с уровнем значимости p<0,05. Для интерпретации результатов рассчитывалось отношение шансов (OR) с 95% доверительным интервалом (ДИ).
Характеристика выборки пациентов. Выборка из 53 пациентов состояла из 32 человек, получающих иммунотерапию по поводу меланомы, и 21 человека – по поводу НМЛР. В группу 1 определены пациенты, у которых на фоне иммунотерапии зафиксирован клинический ответ по шкале iRECIST: стабилизация, частичный или полный ответ. В группу 0 вошли пациенты с прогрессией заболевания, определенной в результате контрольного исследования (табл. 1).

Группы являются статистически сбалансированными по возрасту, полу, характеристикам онкологического процесса, сопутствующим заболеваниям. Дополнительно зафиксировано наличие или отсутствие IFN-терапии меланомы в анамнезе пациента, так как этот показатель может иметь значение при проведении последующей иммунотерапии. По этому параметру группы также являются сбалансированными.
Результаты
Результаты статистического анализа групп 1 (группа, показавшая контроль над заболеванием на фоне иммунотерапии) и 0 (группа с прогрессией заболевания) приведены в табл. 2.
Также проведен унивариантный анализ для выделенных антропометрических показателей (табл. 3). На основании статистической значимости полученного соотношения шансов (OR), был выполнен многофакторный анализ для VFI с клинически значимыми кофакторами (табл. 4).
ИМТ. В результате анализа мы не обнаружили статистически значимой корреляции ИМТ и клинического ответа на иммунотерапию. Однако стоит отметить, что при ИМТ>30 наблюдается некоторая тенденция к сниженному ответу на иммунотерапию.
VFI. VFI>197,15 в данной генеральной выборке является медианой, и выбрано как значение отсечения. Мы обнаружили статистически значимую корреляцию между повышенным показателем VFI и отсутствием ответа на иммунотерапию.
Отношение шансов для VFI>195,17 составило 0,178 (95% ДИ 0,045–0,674) и является статистически значимым. Также стоит отметить, что у пациентов с VFI больше данного значения клинический ответ по шкале iRECIST наблюдался в 5,6 раза реже (1/0,178=5,6), чем у пациентов с VFI<195,17.
PMI. Согласно нашим расчетам, PMI не является прогностическим показателем при инициации иммунотерапии. Статистической тенденции в пользу данного индекса также не наблюдается.
Обсуждение
В нашем исследовании была подтверждена первоначальная гипотеза о влиянии эндокринно активной ткани – висцерального жира – на клинический ответ при иммунотерапии. Такой результат согласуется с литературными данными и является обоснованным с точки зрения фундаментальных биохимических процессов.
Нами было показано, что VFI является перспективным инструментом для прогнозирования ответа на иммунотерапию опухолей. Корреляция между повышенным содержанием висцерального жира, оцененным при помощи индекса VFI, и ответом на лечение оказалась статистически значимой. Также по результатам многофакторного анализа выявлено, что пациенты со значением данного индекса более 195,17 имели в 5,6 раза меньшую вероятность развития клинического ответа при терапии ИКТ.
Такой результат выделяет расчет VFI как один из самых перспективных методов предикции ответа на иммунотерапию. В случае подтверждения наших выводов в последующих исследованиях на более крупной выборке данный метод может стать мощным инструментом для принятия онкологами более обоснованного решения о клинической тактике для конкретного пациента, что согласуется с принципами персонифицированной медицины.
Последствием применения такого предиктивного метода станет не только экономия материальных средств в системе здравоохранения, но и заблаговременный переход к наиболее эффективным методам лечения для данного больного, что приведет к лучшим исходам в терапии онкологических заболеваний.
Наше исследование также дает основу для фундаментальных исследований в области иммунологии, эндокринологии и онкологии. Возможным представляется предположить, что за однородностью взаимосвязи между содержанием висцерального жира и эффективностью иммунотерапии широким спектром препаратов меланомы и группы заболеваний, объединенных термином «НМРЛ», скрываются фундаментальные механизмы, еще не описанные в научной литературе.
Полученные нами данные являются вдохновляющим, однако стоит упомянуть об уязвимых моментах этого исследования. Так, выборка из 53 пациентов явилась достаточной для получения статистически значимых результатов, однако не может служить основанием для немедленной трансляции метода в клиническую практику. Несмотря на удовлетворительно сбалансированные группы сравнения, стоит отметить, что в группе с клиническим ответом (группа 1) химио- или таргетный препарат получали 60%, когда в группе с прогрессией заболевания (группа 0) только 36%. Данное различие не было статистически значимым (p=0,089), однако этот аспект все же может быть поводом для критики нашего исследования. В продолжении исследования нами будет набрана бóльшая выборка, более корректно уравновешенная в том числе и по данному признаку.
ИМТ, как простой и удобный в применении показатель, показал свою эффективность в клинической практике. Мы не исключаем возможность, что в последующем, при масштабировании нашего исследования, корреляция повышенного ИМТ и сниженного ответа при иммунотерапии опухолей будет статистически подтверждена. Однако даже в таком случае ИМТ останется показателем, заслуживающим определенной критики. Этот индекс сравнительно надежен в своей описательной функции для большей части популяции, однако существуют группы людей, применение данного метода в которых является неоправданным и чревато ложными результатами. Так, у лиц с существенно развитой скелетной мускулатурой ИМТ имеет повышенные значения.
В современной практике термины «ИМТ» и «ожирение» тесно связаны, поскольку диагноз «ожирение» устанавливается на основании значения ИМТ. Однако стоит отметить, что в своей сути ИМТ характеризует удельный вес, приходящийся на квадратный метр тела. Этот индекс способен оценить содержание жировой ткани в теле человека только косвенно, поэтому не может быть применен в каждом конкретном клиническом случае с высокой итоговой долей корректно принятых клинических решений.
Несмотря на перспективность ИМТ как метода прогнозирования ответа на иммунотерапию, данный метод представляется подходящим только для первичной и приблизительной оценки, но не методом принятия финального решения о терапевтической тактике из-за неточности показаний при оценке лиц, антропометрические показатели которых выходят за границы популяционной нормы.
PMI не показал эффективности в прогнозировании ответа на иммунотерапию. Согласно статистическим результатам, данный индекс также не представляется перспективным в случае анализа на большей выборке пациентов. Такие данные могут свидетельствовать о незначительном или малом влиянии саркопении или выраженно развитой скелетной мускулатуры на звенья функционирования иммунной системы, вовлеченные в реализацию фармакологического эффекта ИКТ.
Заключение
В результате пилотного исследования были выполнены поставленные задачи и достигнута цель. Нами было продемонстрировано, что повышенное содержание висцерального жира, оцененное при помощи индекса VFI, коррелирует с худшим клиническим ответом на ИКТ при онкологических заболеваниях. Учитывая перспективность данного предиктивного метода и его возможность дать пациентам существенную клиническую выгоду, нами будут продолжены исследования в данном направлении.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Величко Аркадий Яковлевич – ординатор, ГБУЗ «МГОБ №62 ДЗМ». E-mail: velichko.arkady@gmail.com; ORCID: 0000-0003-3686-0072; Scopus Author ID: 57218142638
Arkady Ya. Velichko – resident-physician, Moscow City Oncology Hospital No. 62. E-mail: velichko.arkady@gmail.com; ORCID: 0000-0003-3686-0072; Scopus Author ID: 57218142638
Смолянкина Полина Юрьевна – студентка 5-го курса, медицинский институт, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: 1032210223@pfur.ru; ORCID: 0009-0001-5098-885X
Polina Yu. Smolyankina – Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1032210223@pfur.ru; ORCID: 0009-0001-5098-885X
Селиванов Глеб Александрович – студент 5-го курса, медицинский институт, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: 1032216380@pfur.ru; ORCID: 0009-0002-6051-8779
Gleb A. Selivanov – Student, Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: 1032216380@pfur.ru; ORCID: 0009-0002-6051-8779
Вилков Сергей Анатольевич – зав. отд-нием лучевой диагностики, рентгенолог, ФК ОО «Хадасса Медикал Лтд». E-mail: s.vilkov@hadassah.moscow
Sergey A. Vilkov – Head of the Department of Radiation Diagnostics, Radiologist, Branch Office of «Hadassah Medical Ltd». E-mail: s.vilkov@hadassah.moscow
Новосад Софья Владимировна – канд. мед. наук, врач-эндокринолог, ФК ОО «Хадасса Медикал Лтд». E-mail: sophia.novosad@gmail.com; ORCID: 0009-0008-0933-3801
Sofya V. Novosad – Cand. Sci. (Med.), Endocrinologist, Branch Office of «Hadassah Medical Ltd». E-mail: sophia.novosad@gmail.com; ORCID: 0009-0008-0933-3801
Утяшев Игорь Аглямович – канд. мед наук, дир. департамента клинических исследований, врач-онколог, лидер группы по меланоме, опухолям кожи и саркомам Института онкологии Hadassah Medical Moscow (ГК Медскан), ФК ОО «Хадасса Медикал Лтд». E-mail: dr.utyashev@gmail.com; ORCID: 0000-0003-0002-4814; Scopus Author ID: 25226057400
Igor A. Utyashev – Cand. Sci. (Med.), Director of the Clinical Research Department, Oncologist, Leader of the melanoma, skin tumors and sarcoma group at the Hadassah Medical Moscow Institute of Oncology; Branch Office of «Hadassah Medical Ltd».
E-mail: dr.utyashev@gmail.com; ORCID: 0000-0003-0002-4814; Scopus Author ID: 25226057400
Поступила в редакцию: 17.06.2025
Поступила после рецензирования: 30.06.2025
Принята к публикации: 17.07.2025
Received: 17.06.2025
Revised: 30.06.2025
Accepted: 17.07.2025
Список исп. литературыСкрыть список1. Mellman I, Chen DS, Powles T, Turley SJ. The cancer-immunity cycle: Indication, genotype, and immunotype. Immunity 2023;56(10):2188-205.
2. Bedikian AY, Millward M, Pehamberger H et al. Oblimersen Melanoma Study Group. Bcl-2 antisense (oblimersen sodium) plus dacarbazine in patients with advanced melanoma: the Oblimersen Melanoma Study Group. J Clin Oncol 2006;24(29):4738-45.
3. Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell 2017;168(4):707-23.
4. Wolchok JD, Chiarion-Sileni V, Gonzalez R et al. Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. J Clin Oncol 2022;40(2):127-37.
5. Mooradian MJ, Sullivan RJ. Immunotherapy in Melanoma: Recent Advancements and Future Directions. Cancers (Basel). 2023;15(16):4176.
6. Saravia J, Raynor JL, Chapman NM et al. Signaling networks in immunometabolism. Cell Res 2020;30:328-42.
7. Tang J, Shalabi A, Hubbard-Lucey VM. Comprehensive analysis of the clinical immuno-oncology landscape. Ann Oncol 2018;29(1):84-91.
8. Sanmamed MF, Chen L. A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization. Cell 2018;175(2):313-26.
9. Larkin J, Minor D, D'Angelo S et al. Overall Survival in Patients With Advanced Melanoma Who Received Nivolumab Versus Investigator's Choice Chemotherapy in CheckMate 037: A Randomized, Controlled, Open-Label Phase III Trial. J Clin Oncol 2018;36(4):383-90.
10. World Cancer Research Fund / American Institute for Cancer Research. Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective. Washington DC: AICR, 2007.
11. Renehan AG, Tyson M, Egger M et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008;371(9612):569-78.
12. Martinez-Useros J, Garcia-Foncillas J. Obesity and colorectal cancer: molecular features of adipose tissue. J Transl Med 2016;14:21.
13. Donnelly D, Bajaj S, Yu J et al. The complex relationship between body mass index and response to immune checkpoint inhibition in metastatic melanoma patients. J Immunother Cancer 2019;7(1):222.
14. Daley AD, Bénézech C. Fat-associated lymphoid clusters: Supporting visceral adipose tissue B cell function in immunity and metabolism. Immunol Rev 2024;324(1):78-94.
15. Batra A, Siegmund B. The role of visceral fat. Dig Dis 2012;30(1):70-4.
16. Nøst TH, Alcala K, Urbarova I et al. Systemic inflammation markers and cancer incidence in the UK Biobank. Eur J Epidemiol 2021;36(8):841-8.
17. Samouda H, Dutour A, Chaumoitre K et al. VAT=TAAT-SAAT: innovative anthropometric model to predict visceral adipose tissue without resort to CT-Scan or DXA. Obesity (Silver Spring) 2013;21(1):E41-50.
18. Rodge GA, Goenka U, Jajodia S et al. Psoas Muscle Index: A Simple and Reliable Method of Sarcopenia Assessment on Computed Tomography Scan in Chronic Liver Disease and its Impact on Mortality. J Clin Exp Hepatol 2023;13(2):196-202.
19. Alberti KG, Eckel RH, Grundy SM et al; International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; International Association for the Study of Obesity. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009;120(16):1640-5.


