Клинический разбор в общей медицине №12 2025
1 Karaganda Medical University, Karaganda, Republic of Kazakhstan;
2 LLP "Student Polyclinic No. 1", Republic of Kazakhstan;
3 Polyclinic No. 3, Karaganda, Republic of Kazakhstan
lezhninv.a.21@gmail.com
Abstract
This review explores the synergistic potential of two cutting-edge technologies–photon-counting computed tomography (PCCT) and radiomics – in addressing current challenges in precision oncology. The physical advantages of PCCT, which provide unprecedented image quality and quantitative accuracy, are discussed as an ideal foundation for radiomic analysis. Radiomics, acting as a "virtual biopsy," enables the extraction of high-dimensional features from images for non-invasive assessment of tumor heterogeneity and its microenvironment. The application of this approach for developing predictive models of response to immune checkpoint inhibitor therapy, differentiating pseudoprogression from true progression, and monitoring treatment is examined. Key challenges hindering the widespread clinical adoption of radiomics, including issues of standardization, reproducibility, and model validation, are systematized. In conclusion, it is emphasized that overcoming these challenges through international initiatives and integration with multi-omics data is key to realizing the full potential of PCCT-based radiomics in personalized oncology.
Keywords: Precision Medicine, Immunotherapy, Tomography, X-Ray Computed, Radiomics, Biomarkers, Tumor, Disease Progression.
For citation: Lezhnin V.A., Lezhnina A.A. Synergy of photon-counting computed tomography, radiomics and immunotherapy in precision oncology. Clinical review for general practice. 2025; 6 (12): 62–64 (In Russ.). DOI: 10.47407/kr2025.6.12.00732
Введение. Новые горизонты прецизионной онкологии
Современная онкология переживает значительный сдвиг от универсальных протоколов химиотерапии к персонализированным методам лечения, где ведущую роль играет иммунотерапия [1]. Эта парадигма диктует необходимость адаптации терапевтических стратегий к индивидуальным особенностям опухоли для максимизации эффективности и минимизации токсичности [2]. Однако ингибиторы контрольных точек иммунитета демонстрируют устойчивый клинический ответ лишь у 15–30% пациентов. Это подчеркивает критическую потребность в надежных и неинвазивных прогностических биомаркерах для отбора пациентов и мониторинга терапии в реальном времени. Традиционные тканевые биомаркеры ограничены своей инвазивностью и неспособностью охватить всю гетерогенность опухоли [3]. Решением может стать конвергенция передовых технологий визуализации, таких как фотон-счетная компьютерная томография (ФСКТ), и количественного анализа изображений – радиомики [4]. ФСКТ представляет собой технологический прорыв, предлагая изображения сверхвысокого разрешения и внутренние спектральные возможности. Радиомика извлекает из медицинских изображений скрытые количественные данные, обеспечивая неинвазивную характеристику фенотипа опухоли и ее микроокружения. Сочетание этих технологий обещает создать новое поколение биомаркеров для персонализированной иммунотерапии.
Фотон-счетная компьютерная томография: превосходное качество данных для количественного анализа
В отличие от традиционных энергоинтегрирующих детекторов, которые преобразуют рентгеновские лучи в свет, а затем в электричество, детекторы ФСКТ напрямую преобразуют рентгеновские фотоны в электрические сигналы. Этот одноступенчатый процесс устраняет электронный шум и позволяет не только подсчитывать каждый фотон, но и измерять его энергетический уровень [5]. Такой подход обеспечивает ряд фундаментальных преимуществ.
– Сверхвысокое пространственное разрешение. Отсутствие светоотражающих перегородок позволяет достигать исключительной детализации анатомических структур без увеличения дозы облучения.
– Устранение электронного шума. Прямое преобразование сигнала значительно улучшает соотношение контраст/шум, что особенно важно при низкодозовых исследованиях [6].
– Внутренняя спектральная информация. ФСКТ изначально регистрирует энергетический спектр для каждого вокселя, что позволяет генерировать количественные карты (например, карты йода, эффективного атомного номера) в рамках одного сканирования. Это обеспечивает возможность функциональной оценки перфузии тканей, васкуляризации опухоли и помогает уменьшать артефакты от металлических имплантатов.
Превосходное качество, высокая точность и спектральная насыщенность данных, получаемых с помощью ФСКТ, создают идеальную основу для радиомики. Уменьшение шумов и артефактов означает, что извлекаемые радиомические признаки являются более стабильными, воспроизводимыми и биологически значимыми по сравнению с признаками, полученными из изображений стандартной КТ [7].
Радиомика: от изображений к количественным биомаркерам
Радиомика – это процесс высокопроизводительного извлечения большого числа количественных признаков из медицинских изображений с целью создания предиктивных моделей. Этот подход, часто называемый «виртуальной биопсией», позволяет неинвазивно оценивать характеристики опухоли, которые неразличимы при визуальном анализе. Рабочий процесс радиомики включает несколько ключевых этапов: получение изображений, сегментацию интересующей области (опухоли), извлечение признаков и построение прогностической модели с использованием методов машинного обучения [8]. Извлекаемые признаки классифицируются на несколько категорий:
– статистические (первого порядка): описывают распределение интенсивностей вокселей (среднее, энтропия, асимметрия) [9];
– морфологические: характеризуют форму, объем и компактность опухоли;
– текстурные (второго и высших порядков): оценивают пространственные взаимоотношения вокселей, количественно характеризуя гетерогенность опухоли (контраст, корреляция и др.).
Биологическая значимость этих признаков заключается в их способности отражать внутриопухолевую гетерогенность, ангиогенез, клеточный состав и инфильтрацию иммунных клеток [10]. Таким образом, радиомика позволяет получить комплексное представление обо всей опухоли, преодолевая ограничения традиционной биопсии, связанные с ошибкой выборки.
Применение радиомики для прогнозирования ответа на иммунотерапию
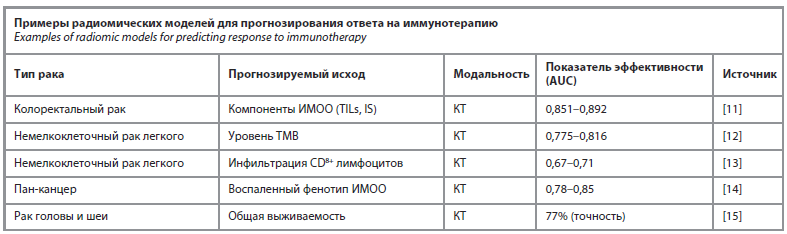
Несмотря на успехи ингибиторов контрольных точек (например, блокаторов PD-1/PD-L1), их эффективность ограничена механизмами резистентности и иммуносупрессивным микроокружением опухоли (ИМОО). Существующие биомаркеры, такие как экспрессия PD-L1 и мутационная нагрузка опухоли (TMB), не всегда точно прогнозируют ответ. Радиомика предлагает неинвазивное решение для оценки иммунного фенотипа опухоли. Многочисленные исследования продемонстрировали способность радиомических моделей, построенных на данных КТ, с высокой точностью прогнозировать ключевые иммунные характеристики и ответ на лечение (см. таблицу).
Особое значение радиомика приобретает в решении проблемы псевдопрогрессии – временного увеличения опухоли из-за инфильтрации иммунных клеток, которое можно ошибочно принять за истинное прогрессирование. Анализируя текстурные изменения, а не только размер, радиомика помогает отличить эти два состояния, предотвращая преждевременное прекращение эффективной терапии [16]. Способность динамически и неинвазивно отслеживать изменения во всей опухоли делает радиомику мощным инструментом для персонализированного ведения пациентов на иммунотерапии.
Вызовы и будущие направления
Несмотря на значительный потенциал, широкому клиническому внедрению радиомики препятствует ряд фундаментальных проблем.
• Стандартизация и воспроизводимость. Вариабельность в протоколах сканирования, методах сегментации опухоли и алгоритмах извлечения признаков приводит к низкой воспроизводимости результатов между различными центрами.
• Надежность моделей. Многие исследования проводятся на малых выборках, что повышает риск переобучения моделей и снижает их обобщающую способность на новых данных.
• Интерпретируемость. Модели глубокого обучения часто воспринимаются как «черный ящик», что затрудняет их принятие в клинической практике, где требуется понимание механизма принятия решения.
Решение этих взаимосвязанных проблем требует комплексного подхода. Международные инициативы, такие как Image Biomarker Standardization Initiative (IBSI) и Quantitative Imaging Biomarkers Alliance (QIBA), работают над созданием единых стандартов для сбора данных и анализа [17]. Будущие исследования должны быть сосредоточены на проведении крупномасштабных многоцентровых проспективных исследований для валидации моделей. Ключевую роль в этом процессе играет развитие технологий. Переход на ФСКТ способен значительно снизить вариабельность на этапе получения данных, обеспечивая более стабильную основу для радиомического анализа [18]. Параллельно, разработка методов объяснимого искусственного интеллекта (Explainable Artificial Intelligence, XAI) и интеграция радиомики с другими мультиомиксными данными (геномикой, протеомикой) позволят создавать более надежные и биологически интерпретируемые модели.
Заключение
Синергия фотон-счетной КТ и радиомики открывает новую эру в прецизионной онкологии. ФСКТ предоставляет количественные данные беспрецедентного качества, а радиомика трансформирует их в клинически значимые биомаркеры, функционируя как неинвазивная «виртуальная биопсия» [19]. Этот тандем обладает огромным потенциалом для прогнозирования ответа на иммунотерапию, оптимизации терапевтических стратегий и персонализации лечения рака [20]. Однако для полной реализации этого потенциала необходимо преодолеть существующие проблемы, связанные со стандартизацией, воспроизводимостью и валидацией. Успех зависит от скоординированных усилий научного сообщества, направленных на проведение строгих методологических исследований, внедрение единых стандартов и развитие более совершенных и интерпретируемых моделей искусственного интеллекта [21]. Только так радиомика сможет стать неотъемлемой частью клинической практики и произвести революцию в лечении онкологических заболеваний.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Лежнин Владислав Анатольевич – резидент 1-го курса по радиологии, Карагандинский медицинский университет, ТОО «Студенческая поликлиника №1», Караганда. E-mail: lezhninv.a.21@gmail.com; ORCID: 0009-0005-0992-5004
Vladislav A. Lezhnin – First-Year Radiology Resident, Department of Radiology, Karaganda Medical University, LLP "Student Polyclinic No. 1". E-mail: lezhninv.a.21@gmail.com; ORCID: 0009-0005-0992-5004
Лежнина Алёна Александровна – врач-педиатр, Поликлиника №3, Караганда. E-mail: Patsyura0694@mail.ru
Alena A. Lezhnina – Pediatrician, Polyclinic No. 3 of Karaganda.
E-mail: Patsyura0694@mail.ru
Поступила в редакцию: 10.06.2025
Поступила после рецензирования: 16.06.2025
Принята к публикации: 16.06.2025
Received: 10.06.2025
Revised: 16.06.2025
Accepted: 16.06.2025
Клинический разбор в общей медицине №12 2025
Синергия фотон-счетной компьютерной томографии, радиомики и иммунотерапии в прецизионной онкологии
Номера страниц в выпуске:62-64
Аннотация
В статье представлен обзор синергетического потенциала двух передовых технологий – фотон-счетной компьютерной томографии (ФСКТ) и радиомики – для решения актуальных задач прецизионной онкологии. Рассмотрены физические преимущества ФСКТ, обеспечивающие беспрецедентное качество и количественную точность изображений, что создает идеальную основу для радиомического анализа. Радиомика, выступая в роли «виртуальной биопсии», позволяет извлекать из изображений высокоразмерные признаки для неинвазивной оценки гетерогенности опухоли и ее микроокружения. Обсуждается применение этого подхода для разработки предиктивных моделей ответа на иммунотерапию ингибиторами контрольных точек, дифференциации псевдопрогрессии от истинного прогрессирования и мониторинга лечения. Систематизированы ключевые проблемы, сдерживающие широкое клиническое внедрение радиомики, включая вопросы стандартизации, воспроизводимости и валидации моделей. В заключение подчеркивается, что решение этих задач через международные инициативы и интеграцию с мультиомиксными данными является ключом к реализации потенциала ФСКТ-радиомики в персонализированной онкологии.
Ключевые слова: прецизионная онкология, иммунотерапия, фотон-счетная компьютерная томография, радиомика, биомаркеры, псевдопрогрессия, ингибиторы контрольных точек.
Для цитирования: Лежнин В.А., Лежнина А.А. Синергия фотон-счетной компьютерной томографии, радиомики и иммунотерапии в прецизионной онкологии. Клинический разбор в общей медицине. 2025; 6 (12): 62–64. DOI: 10.47407/kr2025.6.12.00732
В статье представлен обзор синергетического потенциала двух передовых технологий – фотон-счетной компьютерной томографии (ФСКТ) и радиомики – для решения актуальных задач прецизионной онкологии. Рассмотрены физические преимущества ФСКТ, обеспечивающие беспрецедентное качество и количественную точность изображений, что создает идеальную основу для радиомического анализа. Радиомика, выступая в роли «виртуальной биопсии», позволяет извлекать из изображений высокоразмерные признаки для неинвазивной оценки гетерогенности опухоли и ее микроокружения. Обсуждается применение этого подхода для разработки предиктивных моделей ответа на иммунотерапию ингибиторами контрольных точек, дифференциации псевдопрогрессии от истинного прогрессирования и мониторинга лечения. Систематизированы ключевые проблемы, сдерживающие широкое клиническое внедрение радиомики, включая вопросы стандартизации, воспроизводимости и валидации моделей. В заключение подчеркивается, что решение этих задач через международные инициативы и интеграцию с мультиомиксными данными является ключом к реализации потенциала ФСКТ-радиомики в персонализированной онкологии.
Ключевые слова: прецизионная онкология, иммунотерапия, фотон-счетная компьютерная томография, радиомика, биомаркеры, псевдопрогрессия, ингибиторы контрольных точек.
Для цитирования: Лежнин В.А., Лежнина А.А. Синергия фотон-счетной компьютерной томографии, радиомики и иммунотерапии в прецизионной онкологии. Клинический разбор в общей медицине. 2025; 6 (12): 62–64. DOI: 10.47407/kr2025.6.12.00732
Synergy of photon-counting computed tomography, radiomics and immunotherapy in precision oncology
Vladislav A. Lezhnin1,2, Alena A. Lezhnina31 Karaganda Medical University, Karaganda, Republic of Kazakhstan;
2 LLP "Student Polyclinic No. 1", Republic of Kazakhstan;
3 Polyclinic No. 3, Karaganda, Republic of Kazakhstan
lezhninv.a.21@gmail.com
Abstract
This review explores the synergistic potential of two cutting-edge technologies–photon-counting computed tomography (PCCT) and radiomics – in addressing current challenges in precision oncology. The physical advantages of PCCT, which provide unprecedented image quality and quantitative accuracy, are discussed as an ideal foundation for radiomic analysis. Radiomics, acting as a "virtual biopsy," enables the extraction of high-dimensional features from images for non-invasive assessment of tumor heterogeneity and its microenvironment. The application of this approach for developing predictive models of response to immune checkpoint inhibitor therapy, differentiating pseudoprogression from true progression, and monitoring treatment is examined. Key challenges hindering the widespread clinical adoption of radiomics, including issues of standardization, reproducibility, and model validation, are systematized. In conclusion, it is emphasized that overcoming these challenges through international initiatives and integration with multi-omics data is key to realizing the full potential of PCCT-based radiomics in personalized oncology.
Keywords: Precision Medicine, Immunotherapy, Tomography, X-Ray Computed, Radiomics, Biomarkers, Tumor, Disease Progression.
For citation: Lezhnin V.A., Lezhnina A.A. Synergy of photon-counting computed tomography, radiomics and immunotherapy in precision oncology. Clinical review for general practice. 2025; 6 (12): 62–64 (In Russ.). DOI: 10.47407/kr2025.6.12.00732
Введение. Новые горизонты прецизионной онкологии
Современная онкология переживает значительный сдвиг от универсальных протоколов химиотерапии к персонализированным методам лечения, где ведущую роль играет иммунотерапия [1]. Эта парадигма диктует необходимость адаптации терапевтических стратегий к индивидуальным особенностям опухоли для максимизации эффективности и минимизации токсичности [2]. Однако ингибиторы контрольных точек иммунитета демонстрируют устойчивый клинический ответ лишь у 15–30% пациентов. Это подчеркивает критическую потребность в надежных и неинвазивных прогностических биомаркерах для отбора пациентов и мониторинга терапии в реальном времени. Традиционные тканевые биомаркеры ограничены своей инвазивностью и неспособностью охватить всю гетерогенность опухоли [3]. Решением может стать конвергенция передовых технологий визуализации, таких как фотон-счетная компьютерная томография (ФСКТ), и количественного анализа изображений – радиомики [4]. ФСКТ представляет собой технологический прорыв, предлагая изображения сверхвысокого разрешения и внутренние спектральные возможности. Радиомика извлекает из медицинских изображений скрытые количественные данные, обеспечивая неинвазивную характеристику фенотипа опухоли и ее микроокружения. Сочетание этих технологий обещает создать новое поколение биомаркеров для персонализированной иммунотерапии.
Фотон-счетная компьютерная томография: превосходное качество данных для количественного анализа
В отличие от традиционных энергоинтегрирующих детекторов, которые преобразуют рентгеновские лучи в свет, а затем в электричество, детекторы ФСКТ напрямую преобразуют рентгеновские фотоны в электрические сигналы. Этот одноступенчатый процесс устраняет электронный шум и позволяет не только подсчитывать каждый фотон, но и измерять его энергетический уровень [5]. Такой подход обеспечивает ряд фундаментальных преимуществ.
– Сверхвысокое пространственное разрешение. Отсутствие светоотражающих перегородок позволяет достигать исключительной детализации анатомических структур без увеличения дозы облучения.
– Устранение электронного шума. Прямое преобразование сигнала значительно улучшает соотношение контраст/шум, что особенно важно при низкодозовых исследованиях [6].
– Внутренняя спектральная информация. ФСКТ изначально регистрирует энергетический спектр для каждого вокселя, что позволяет генерировать количественные карты (например, карты йода, эффективного атомного номера) в рамках одного сканирования. Это обеспечивает возможность функциональной оценки перфузии тканей, васкуляризации опухоли и помогает уменьшать артефакты от металлических имплантатов.
Превосходное качество, высокая точность и спектральная насыщенность данных, получаемых с помощью ФСКТ, создают идеальную основу для радиомики. Уменьшение шумов и артефактов означает, что извлекаемые радиомические признаки являются более стабильными, воспроизводимыми и биологически значимыми по сравнению с признаками, полученными из изображений стандартной КТ [7].
Радиомика: от изображений к количественным биомаркерам
Радиомика – это процесс высокопроизводительного извлечения большого числа количественных признаков из медицинских изображений с целью создания предиктивных моделей. Этот подход, часто называемый «виртуальной биопсией», позволяет неинвазивно оценивать характеристики опухоли, которые неразличимы при визуальном анализе. Рабочий процесс радиомики включает несколько ключевых этапов: получение изображений, сегментацию интересующей области (опухоли), извлечение признаков и построение прогностической модели с использованием методов машинного обучения [8]. Извлекаемые признаки классифицируются на несколько категорий:
– статистические (первого порядка): описывают распределение интенсивностей вокселей (среднее, энтропия, асимметрия) [9];
– морфологические: характеризуют форму, объем и компактность опухоли;
– текстурные (второго и высших порядков): оценивают пространственные взаимоотношения вокселей, количественно характеризуя гетерогенность опухоли (контраст, корреляция и др.).
Биологическая значимость этих признаков заключается в их способности отражать внутриопухолевую гетерогенность, ангиогенез, клеточный состав и инфильтрацию иммунных клеток [10]. Таким образом, радиомика позволяет получить комплексное представление обо всей опухоли, преодолевая ограничения традиционной биопсии, связанные с ошибкой выборки.
Применение радиомики для прогнозирования ответа на иммунотерапию

Несмотря на успехи ингибиторов контрольных точек (например, блокаторов PD-1/PD-L1), их эффективность ограничена механизмами резистентности и иммуносупрессивным микроокружением опухоли (ИМОО). Существующие биомаркеры, такие как экспрессия PD-L1 и мутационная нагрузка опухоли (TMB), не всегда точно прогнозируют ответ. Радиомика предлагает неинвазивное решение для оценки иммунного фенотипа опухоли. Многочисленные исследования продемонстрировали способность радиомических моделей, построенных на данных КТ, с высокой точностью прогнозировать ключевые иммунные характеристики и ответ на лечение (см. таблицу).
Особое значение радиомика приобретает в решении проблемы псевдопрогрессии – временного увеличения опухоли из-за инфильтрации иммунных клеток, которое можно ошибочно принять за истинное прогрессирование. Анализируя текстурные изменения, а не только размер, радиомика помогает отличить эти два состояния, предотвращая преждевременное прекращение эффективной терапии [16]. Способность динамически и неинвазивно отслеживать изменения во всей опухоли делает радиомику мощным инструментом для персонализированного ведения пациентов на иммунотерапии.
Вызовы и будущие направления
Несмотря на значительный потенциал, широкому клиническому внедрению радиомики препятствует ряд фундаментальных проблем.
• Стандартизация и воспроизводимость. Вариабельность в протоколах сканирования, методах сегментации опухоли и алгоритмах извлечения признаков приводит к низкой воспроизводимости результатов между различными центрами.
• Надежность моделей. Многие исследования проводятся на малых выборках, что повышает риск переобучения моделей и снижает их обобщающую способность на новых данных.
• Интерпретируемость. Модели глубокого обучения часто воспринимаются как «черный ящик», что затрудняет их принятие в клинической практике, где требуется понимание механизма принятия решения.
Решение этих взаимосвязанных проблем требует комплексного подхода. Международные инициативы, такие как Image Biomarker Standardization Initiative (IBSI) и Quantitative Imaging Biomarkers Alliance (QIBA), работают над созданием единых стандартов для сбора данных и анализа [17]. Будущие исследования должны быть сосредоточены на проведении крупномасштабных многоцентровых проспективных исследований для валидации моделей. Ключевую роль в этом процессе играет развитие технологий. Переход на ФСКТ способен значительно снизить вариабельность на этапе получения данных, обеспечивая более стабильную основу для радиомического анализа [18]. Параллельно, разработка методов объяснимого искусственного интеллекта (Explainable Artificial Intelligence, XAI) и интеграция радиомики с другими мультиомиксными данными (геномикой, протеомикой) позволят создавать более надежные и биологически интерпретируемые модели.
Заключение
Синергия фотон-счетной КТ и радиомики открывает новую эру в прецизионной онкологии. ФСКТ предоставляет количественные данные беспрецедентного качества, а радиомика трансформирует их в клинически значимые биомаркеры, функционируя как неинвазивная «виртуальная биопсия» [19]. Этот тандем обладает огромным потенциалом для прогнозирования ответа на иммунотерапию, оптимизации терапевтических стратегий и персонализации лечения рака [20]. Однако для полной реализации этого потенциала необходимо преодолеть существующие проблемы, связанные со стандартизацией, воспроизводимостью и валидацией. Успех зависит от скоординированных усилий научного сообщества, направленных на проведение строгих методологических исследований, внедрение единых стандартов и развитие более совершенных и интерпретируемых моделей искусственного интеллекта [21]. Только так радиомика сможет стать неотъемлемой частью клинической практики и произвести революцию в лечении онкологических заболеваний.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Лежнин Владислав Анатольевич – резидент 1-го курса по радиологии, Карагандинский медицинский университет, ТОО «Студенческая поликлиника №1», Караганда. E-mail: lezhninv.a.21@gmail.com; ORCID: 0009-0005-0992-5004
Vladislav A. Lezhnin – First-Year Radiology Resident, Department of Radiology, Karaganda Medical University, LLP "Student Polyclinic No. 1". E-mail: lezhninv.a.21@gmail.com; ORCID: 0009-0005-0992-5004
Лежнина Алёна Александровна – врач-педиатр, Поликлиника №3, Караганда. E-mail: Patsyura0694@mail.ru
Alena A. Lezhnina – Pediatrician, Polyclinic No. 3 of Karaganda.
E-mail: Patsyura0694@mail.ru
Поступила в редакцию: 10.06.2025
Поступила после рецензирования: 16.06.2025
Принята к публикации: 16.06.2025
Received: 10.06.2025
Revised: 16.06.2025
Accepted: 16.06.2025
Список исп. литературыСкрыть список1. Galon J, Bruni D. Approaches to treat immune hot, altered and cold tumours with combination immunotherapies. Nat Rev Drug Discov 2019;18(3):197-218. DOI: 10.1038/s41573-018-0007-y
2. Haslam A, Prasad V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Netw Open 2019;2(5): e192535. DOI: 10.1001/jamanetworkopen.2019.2535
3. Lambin P, Leijenaar RTH, Deist TM et al. Radiomics: the bridge between medical imaging and personalized medicine. Nat Rev Clin Oncol 2017;14(12):749-62. DOI: 10.1038/nrclinonc.2017.89
4. Willemink MJ, Persson M, Pourmorteza A et al. Photon-counting CT: Technical Principles and Clinical Prospects. Radiology 2018;289(2):293-12. DOI: 10.1148/radiol.2018172656
5. Gillies RJ, Kinahan PE, Hricak H. Radiomics: Images Are More than Pictures, They Are Data. Radiology 2016;278(2):563-77. DOI: 10.1148/radiol.2015151169
6. Lu C, Wang H, Chen Y et al. Photon-counting CT in cancer radiotherapy: technological advances and clinical benefits. Front Oncol 2024;14:12086776. DOI: 10.3389/fonc.2024.1208677
7. van Griethuysen JJM, Fedorov A, Parmar C et al. Computational Radiomics System to Decode the Radiographic Phenotype. Cancer Res 2017;77(21):e104–e107. DOI: 10.1158/0008-5472.CAN-17-0339
8. Sollini M, Cozzi L, Antunovic L et al. Radiomics in immuno-oncology: a guide for clinicians. Theranostics 2021;11(15):7470-85. DOI: 10.7150/thno.57213
9. Park JE, Kim D, Kim HS et al. Computed tomography-based deep learning radiomics model for preoperative prediction of tumor immune microenvironment in colorectal cancer. World J Gastrointest Oncol 2025;17(5):106103. DOI: 10.4251/wjgo.v17.i5.106103
10. Peng Y, Li W, Wu G et al. CT radiomics-based model for predicting TMB and immunotherapy efficacy in NSCLC. Sci Rep 2024;14(1):3789. DOI: 10.1038/s41598-024-54449-x
11. Sun R, Limkin EJ, Vakalopoulou M et al. A radiomics approach to assess tumour-infiltrating CD8 cells and response to anti-PD-1 or anti-PD-L1 immunotherapy: an imaging biomarker, retrospective multicohort study. Lancet Oncol 2018;19(9):1180-91. DOI: 10.1016/S1470-2045(18)30413-3
12. Trebeschi S, Drago SG, Gidaro A et al. A radiomics signature for dynamic monitoring of tumor inflamed microenvironment and immunotherapy response prediction. J Immunother Cancer 2025;13(1):e009140. DOI: 10.1136/jitc-2024-009140
13. Leger S, Zwanenburg A, Pilz G et al. A comparative study of machine learning methods for time-to-event survival data for radiomics risk modelling. Sci Rep 2017;7(1):13206. DOI: 10.1038/s41598-017-13448-3
14. Zwanenburg A, Vallières M, Abdalah MA et al. The Image Biomarker Standardization Initiative (IBSI): standardizing radiomics features computation. Radiology 2020;295(2):328-38. DOI: 10.1148/radiol.2020191145
15. Riley RD, Ensor J, Kahan BC et al. External validation of a clinical prediction model: simulation-based sample size calculations were more reliable than rules-of-thumb. J Clin Epidemiol 2021;135:90-103. DOI: 10.1016/j.jclinepi.2021.02.011
16. Collins GS, Reitsma JB, Altman DG et al. Transparent Reporting of a multivariable prediction model for Individual Prognosis Or Diagnosis (TRIPOD): the TRIPOD statement. Ann Intern Med 2015;162(1):55-63. DOI: 10.7326/M14-0697
17. Nie D, Zhang H, Adeli E et al. Explainable AI in medical imaging: advances and challenges. IEEE Trans Med Imaging 2023;42(6):1524-39. DOI: 10.1109/TMI.2023.3245678
18. Chen M, Li J, Xu W et al. Integrative multi-omics in precision oncology: applications and challenges. Nat Rev Clin Oncol 2023;20(2):124-40. DOI: 10.1038/s41571-022-00693-1
19. Rizzo S, Botta F, Raimondi S et al. Radiomics and immunotherapy: a new frontier for prediction and monitoring. Eur Radiol Exp 2022;6:53. DOI: 10.1186/s41747-022-00294-7
20. Langlotz CP, Allen B, Erickson BJ et al. A roadmap for foundational research on artificial intelligence in medical imaging. Radiology 2019;291(3):781-91. DOI: 10.1148/radiol.2019191243
21. Kumar V, Gu Y, Basu S et al. Radiomics: the process and the challenges. Magn Reson Imaging 2012;30(9):1234-48. DOI: 10.1016/j.mri. 2012.06.010
31 декабря 2025
Количество просмотров: 13


