Клинический разбор в общей медицине №12 2025
Roman E. Orekhov1, Irina A. Mullina5, Rina Yu. Mitrelis2
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Avtsyn Scientific Research Institute of Human Morphology, State Scientific Center of the Russian Federation – Petrovsky Russian Scientific Center of Surgery, Moscow, Russia;
3 City Clinical Hospital No. 31 named after Academician G.M. Savelyeva, Moscow, Russia;
4 Lapino Clinical Hospital, Mother and Child Group, Moscow Region, Russia;
5 Semashko Russian Railways-Medicine Clinical Hospital, Moscow, Russia
omekan@mail.ru
Abstract
Aim. To assess efficacy and safety of using bovhyaluronidase azoximer (BA) 3000 IU for therapy of chronic endometritis (CE) in patients with the uterine factor infertility.
Methods. The data of the open-label independent comparative randomized clinical trial involving 160 women with CE and infertility were analyzed. Patients were divided into two cohorts, 80 individuals each, depending on the presence (I+) or absence (I-) of a proven/significant intrauterine infection. All the participants were through the physical therapy (PT) course; patients with the proven/significant causative contagium present in the uterine cavity received antimicrobial therapy (АМТ). Patients were further randomized within the cohorts at a ratio of 1:1 to receive or not receive BA.
Results. The decrease in the CD138+ plasma cell counts was reported for all groups, but basic therapy supplementation with BA ensured the significantly high therapy efficacy: in the I+ cohort, there were no CD138+ plasma cells in 77.5% of patients vs. 2.5% in the control group (p<0.001), while in the I- cohort there were no CD138+ plasma cells in 30% vs. 0% (p<0.001). The combination therapy involving the use of BA significantly decreased the dysmenorrhea severity, improved the CE hysteroscopic and morphological patterns. This is suggested by the significantly decreased intensity of lymphoid infiltration and focal fibrosis of the endometrial stroma, regulation of the immunohostochemistry marker (CD138, CD20, CD56, VEGF, tumor necrosis factor α, MUC1) expression, and the increased blood flow based on the Doppler data (p<0.001). No adverse events, including allergy associated with the use of BA, were recorded during the trial.
Conclusion. High efficacy and safety of bovhyaluronidase azoximer in combination therapy of CE were determined.
Keywords: chronic endometritis, combination therapy, CD138+, bovhyaluronidase azoximer, pelvic inflammatory disease.
For citation: Radzinsky V.E., Orazov M.R., Mikhaleva L.M, Silantyeva E.S., Orekhov R.E., Mullina I.A., Mitrelis R.Yu. Efficacy and safety of bovhyaluronidase azoximer in treatment of chronic endometritis: the Life Cradle open-label comparative randomized controlled trial results. Clinical review for general practice. 2025; 6 (12): 119–134 (In Russ.). DOI: 10.47407/kr2025.6.12.00740
Введение
Хронический эндометрит (ХЭ) представляет собой клинико-морфологический синдром, характеризующийся развитием множественных вторичных морфофункциональных изменений эндометрия в результате персистирующего аномального воспаления. Ключевыми морфологическими детерминантами ХЭ являются нарушения циклической биотрансформации и рецептивности [1].
Установлена высокая распространенность ХЭ у пациенток репродуктивного возраста [2]. Его клиническое и социальное значение не может быть переоценено, так как данное заболевание ассоциировано с бесплодием маточного происхождения, привычным невынашиванием и неблагоприятными исходами беременности, повторными неудачами имплантации при экстракорпоральном оплодотворении (ЭКО) [3–7]. Высокая частота ХЭ – от 45 до 70% – отмечена у женщин с привычным невынашиванием беременности [1]. ХЭ выявляется у 14–40% женщин с бесплодием и повторными неудачами имплантации [5, 6, 8, 9]. Установлена связь ХЭ с неблагоприятными исходами беременности, включая преждевременные роды, преэклампсию и осложнения у новорожденных [4–6, 10]. В ходе ЭКО также установлена высокая распространенность ХЭ – 30% [11]. Исследования демонстрируют, что у 57,8% пациенток с тремя и более потерями беременности диагноз ХЭ верифицируется при гистероскопии и иммуногистохимическом (ИГХ) исследовании [12]. После терапии ХЭ частота наступления клинической беременности увеличивается в 3,64 раза, а успешного ее течения – в 5,33 раза по сравнению с нелеченым или рецидивирующим заболеванием [12].
Основной причиной ХЭ считается нарушение микробиома эндометрия, вызванное такими патогенами, как Escherichia coli, Enterococcus faecalis, Streptococcus, Staphylococcus, Mycoplasma/Ureaplasma [13–17]. Развитие ХЭ, как и любых воспалительных заболеваний органов малого таза (ВЗОМТ), происходит в результате восходящей урогенитальной инфекции бактериальной или вирусной природы [1, 2]. В последние годы обсуждается роль не только инфекционных, но и неинфекционных факторов, включая иммунные нарушения и локальный дисбиоз [13–15, 18]. Лечение ХЭ при доказанном/потенциально значимом инфекте может включать антибактериальную терапию, эффективность которой подтверждена в ряде исследований, однако существует нерешенная проблема антибиотикорезистентности [4, 19, 20]. Установлена высокая эффективность антибактериальной терапии, которая достигает 60–94% [4, 19, 20], однако рост антибиотикорезистентности на фоне необоснованного использования антимикробных средств требует индивидуализации терапии и поиска новых подходов (иммуномодуляторы, регенеративные методы и физические факторы) [16, 19–22]. Несмотря на успехи в понимании патогенеза и терапии, вопросы оптимизации тактики ведения пациенток с ХЭ остаются нерешенными [13, 14, 16].
В связи с этим исследовательский интерес представляет бовгиалуронидаза азоксимер (препарат Лонгидаза®) – конъюгат гиалуронидазы с азоксимера бромидом. Препарат обладает противовоспалительным, иммуномодулирующим и выраженным противофиброзным действием, а также разрушает биопленки микроорганизмов, повышая эффективность и биодоступность антибактериальной терапии [23].
Представляет научный интерес расширенная оценка эффективности и безопасности бовгиалуронидазы азоксимера в клиническом исследовании высокого уровня доказательности, предусматривающем комплексную диагностику ХЭ согласно актуальным подходам.
Материалы и методы
Выполнено открытое независимое сравнительное рандомизированное клиническое исследование с целью оценки клинико-морфологической эффективности и безопасности использования бовгиалуронидазы азоксимера (3000 МЕ) в комплексной терапии ХЭ у пациенток, страдающих бесплодием маточного происхождения.
Критерии отбора пациенток. В исследование включали пациенток в возрасте 18–45 лет на момент подписания информированного согласия с диагнозами «Женское бесплодие маточного происхождения» (код по МКБ N97.2) в сочетании с двумя и более неудачами имплантации в анамнезе и «Хронический эндометрит» (код по МКБ N71).
Дополнительными анамнестическими критериями отбора пациенток были:
• указания на неэффективность предшествующей антимикробной терапии в связи с ВЗОМТ и/или ХЭ (2 и более курсов антибиотикотерапии);
• указания на отсутствие предшествующей антимикробной терапии в течение 180 дней до предполагаемой даты начала исследуемого лечения.
Пациентки не подлежали включению в исследование при наличии хотя бы одного из следующих критериев:
• гнойный воспалительный процесс в органах малого таза;
• наличие инфекций, передаваемых половым путем;
• ВИЧ-инфекция;
• наличие внутриматочных пролиферативных болезней по данным гистероскопии;
• онкологические заболевания;
• оперативные вмешательства органов малого таза, перенесенные в течение 3 мес до включения в исследование;
• фактический прием или показания к приему препаратов гормональной терапии, фуросемида, бензодиазепина, фенитоина, адреналина.
Скрининговый период (период до назначения исследуемой терапии) предусматривал сбор акушерско-гинекологического, фармакотерапевтического, хирургического анамнеза, сбор и оценку жалоб, включая оценку выраженности дисменореи по 10-балльной Визуально-аналоговой шкале (ВАШ), гинекологический осмотр, ультразвуковое исследование (УЗИ) матки с допплерографией, гистероскопию с Пайпель-биопсией эндометрия на 7–11 и 19–21-й дни менструального цикла и последующим патоморфологическим и ИГХ исследованием биоптатов эндометрия, а также исследование микрофлоры матки (тест Фемофлор).
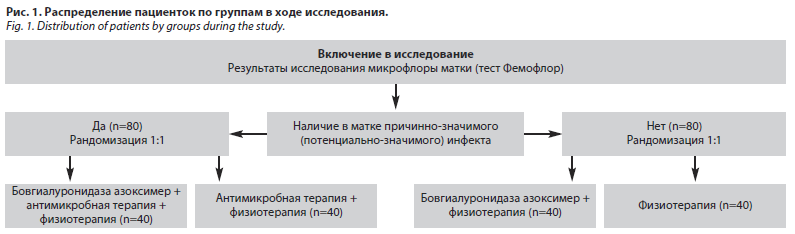
Ход исследования. После завершения скринингового периода осуществлялась рандомизация пациенток методом случайных чисел в формате фиксированной рандомизации с размером блока 4 и стратификацией по факту наличия доказанного или причинно-значимого инфекта в полости матки с формированием 2 когорт по данному признаку. В каждой когорте путем рандомизации были сформированы по одной группе экспериментального лечения и одной контрольной группе, всего сформировано четыре группы в соотношении 1:1:1:1 (рис. 1).
Все пациентки получали следующую базисную терапию:
• пациентки изучаемой когорты с наличием причинно-значимого инфекта в полости матки как этиологического фактора воспалительного процесса в эндометрии в качестве базисной терапии получали антимикробную терапию с использованием группы тетрациклинов в комбинации с 5-нитроимидазолов в стандартной схеме, в сочетании с физиотерапией (интерференционные токи/электрофорез с гальваническими токами №20–30);
• пациентки изучаемой когорты без причинно-значимого инфекта как этиологического фактора воспалительного процесса в эндометрии в качестве базисной терапии получали только физиотерапию (интерференционные токи/электрофорез с гальваническими токами №20–30).
В каждой из когорт пациенткам основных групп в дополнение к базисной терапии была назначена исследуемая терапия: лиофилизат бовгиалуронидазы азоксимера для приготовления раствора для инъекций в дозе 3000 МЕ внутримышечно по 1 инъекции 1 раз в три дня в течение 28 дней (всего 10 инъекций).
Таким образом, в исследовании было сформировано 4 группы женщин, получавших:
1) антимикробную терапию, физиотерапию и бовгиалуронидазы азоксимер (АМТ+ФТ+БА);
2) антимикробную терапию и физиотерапию (АМТ+ФТ);
3) физиотерапию и бовгиалуронидазы азоксимер (ФТ+БА);
4) исключительно физиотерапию (ФТ).
По завершении исследуемой терапии в срок от 30 до 44 дней от даты ее начала осуществлялось повторное обследование пациенток с выполнением гинекологического осмотра, оценкой жалоб, включая оценку выраженности дисменореи по ВАШ и записей Дневника пациентки (в первую фазу менструального цикла), УЗИ органов малого таза с допплерометрией, гистероскопии с Пайпель-биопсией эндометрия на 7–11 и 19–21-й дни менструального цикла и последующим патоморфологическим и ИГХ исследованиями биоптатов.
Для ИГХ-анализа эндометрия использовали антитела к CD138, CD56 и CD20, а также к молекулам MUC1, HOXA-10, TGF-β, VEGF и фактора некроза опухоли (ФНО)-α производства DAKO.
Электронные системы исследования. Распределение пациенток по группам и последующая регистрация медицинских данных осуществлялись на электронной ИРК-платформе в системе Visual Stat Expert версии 2.0 (ООО «Кейстат»). Рандомизационные коды были сгенерированы с использованием программного обеспечения The R Project for Statistical Computing (https://www.r-project.org) версии ≥ 4.3.2, пакет blockrand.
Конечные точки исследования. Первичная конечная точка исследования: изменение числа плазматических клеток CD138+ в эндометрии в пролиферативной фазе менструального цикла после лечения по сравнению с исходным уровнем.
В качестве вторичных конечных точек были использованы:
• По результатам ИГХ окрашивания биоптатов эндометрия:
– изменение числа клеток CD138+ в эндометрии (секреторная фаза);
– изменение числа клеток CD56+ и CD20+ в эндометрии (пролиферативная и секреторная фазы);
– изменение уровня экспрессии MUC1 в эндометрии (секреторная фаза);
– изменение уровня экспрессии HOXA-10, TGF-β, VEGF, ФНО-α в эндометрии (пролиферативная и секреторная фазы);
– динамика экспрессии клеток CD138+ по сравнению с исходными данными.
• По результатам гистероскопии: признаки гиперемии эндометрия, отека стромы, обнаруженные участки гипертрофированной слизистой, микрополипы.
• По результатам патоморфологического исследования биоптатов эндометрия: признаки отека стромы, лимфоидной инфильтрации, очагового фиброза стромы.
• По результатам УЗИ: неоднородная структура эндометрия, с повышенной эхогенностью, М-эхо.
• По результатам допплерометрии субэндометриальных сосудов (маточной, дуговой, радиальной, базальной, спиральной артерий): изменение максимальной скорости кровотока, индекса резистентности, индекса пульсации.
• Оценка выраженности дисменореи по ВАШ.
• Время купирования дисменореи.
Все изменения параметров оценивали после лечения по сравнению с исходным уровнем.
Критерии оценки безопасности были следующими:
– общая частота нежелательных явлений;
– частота нежелательных явлений, связанных с использованием исследуемого продукта (нежелательные лекарственные реакции, НЛР);
– переносимость исследуемого продукта, частота НЛР, развитие которых потребовало отмены исследуемого препарата.
Статистический анализ проводили с использованием программного обеспечения R (https://www.r-project.org) версии 4.5.2.
По количественным показателям группы сравнивали при помощи t-критерия Стьюдента либо U-критерия Манна–Уитни в зависимости от результатов проверки нормальности распределения данных посредством критерия Шапиро–Уилка. Для внутригрупповых сравнений количественных показателей до и после лечения использовали парный t-критерий Стьюдента или критерий знаковых рангов Уилкоксона.
Для категориальных показателей сравнение групп проводили при помощи критерия хи-квадрат Пирсона (χ2), в случае бинарных переменных применяли поправку Йетса. Если в любой из ячеек таблицы сопряженности ожидаемые частоты были меньше 5, вместо χ2 использовали точный критерий Фишера. Внутригрупповое сравнение по категориальным показателям проводили с использованием критерия Мак–Немара или Мадански (в зависимости от количества уровней оцениваемых показателей).
Для анализа времени до наступления события использовали метод Каплана–Мейера, рассчитывали медиану времени до события и 95% доверительный интервал (ДИ). Используя модель пропорциональных рисков Кокса оценивали отношение шансов и 95% ДИ. Значимость различий между группами оценивали с помощью лог-ранк теста.
Результаты и их обсуждение
По итогам скрининговых обследований предусмотренное протоколом лечение и наблюдение прошли 160 пациенток – по 40 пациенток в каждой группе. Все пациентки завершили участие в исследовании в соответствии с протоколом, а их данные были включены в статистический анализ эффективности и безопасности. Комплаентность пациенток к процедурам исследования (соблюдение графика процедур, соответствие лечения назначенному по протоколу) составила 100% в обеих когортах.
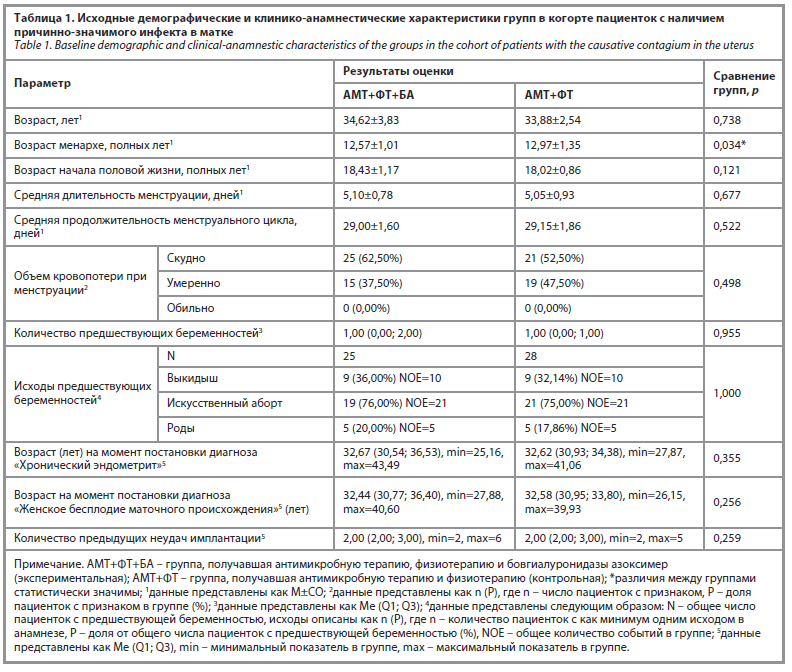
Исходные характеристики пациенток когорты с причинно-значимым инфектом в полости матки представлены в табл. 1.
При базовом физикальном осмотре наружных половых органов отклонения у пациенток не выявлялись. Какие-либо специфические жалобы у пациенток отсутствовали, за исключением дисменореи, которая была характерна для половины исследуемой популяции (55% основной и 52,5% контрольной групп). Одновременно пациентки с дисменореей отмечали слабо выраженный или умеренный характер боли при менструациях.
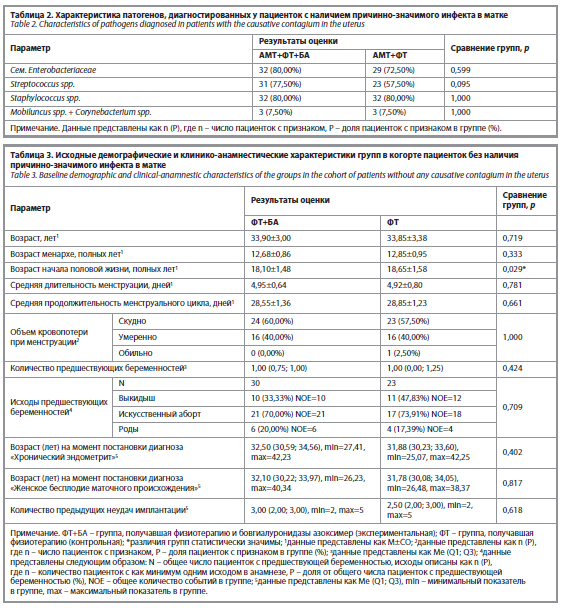
По результатам теста Фемофлор у пациенток была выявлена смешанная бактериальная флора с преобладанием энтеробактерий, стрептококков и стафилококков (табл. 2).
Исходные характеристики пациенток когорты без причинно-значимого инфекта в полости матки представлены в табл. 3.
Среди клинически значимых сопутствующих (хронических) заболеваний у 1 пациентки основной группы отмечены диспептические расстройства, не связанные
с приемом каких-либо лекарственных препаратов; по 1 пациентке контрольной группы имели хронический гастрит (n=1) и хронический панкреатит (n=1). Установлена высокая частота встречаемости дисменореи – 72,5 и 67,5% пациенток основной и контрольной групп соответственно.
Анализ первичной конечной точки
При анализе динамики числа CD138+ позитивных клеток по данным ИГХ исследования, установили, что во всех группах наблюдалась морфологическая эффективность после проведенного курса лечения.
В когорте с наличием причинно-значимого инфекта в полости матки морфологическая эффективность с полноценной элиминацией CD138+ плазматических клеток в пролиферативную фазу цикла была достоверно выше у пациенток, получивших комплексную терапию с использованием бовгиалуронидазы азоксимера (77,5% против 2,5% в группе контроля, p<0,001). Аналогичная закономерность по данному параметру наблюдалась в когорте без наличия причинно-значимого инфекта в полости матки (30% против 0%, p<0,001).
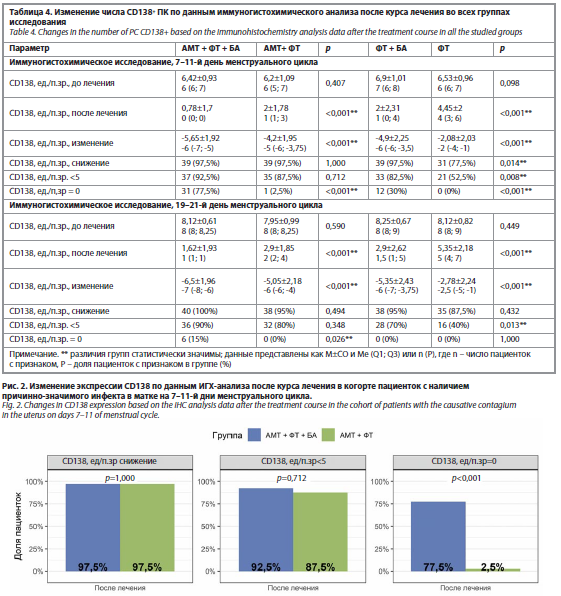
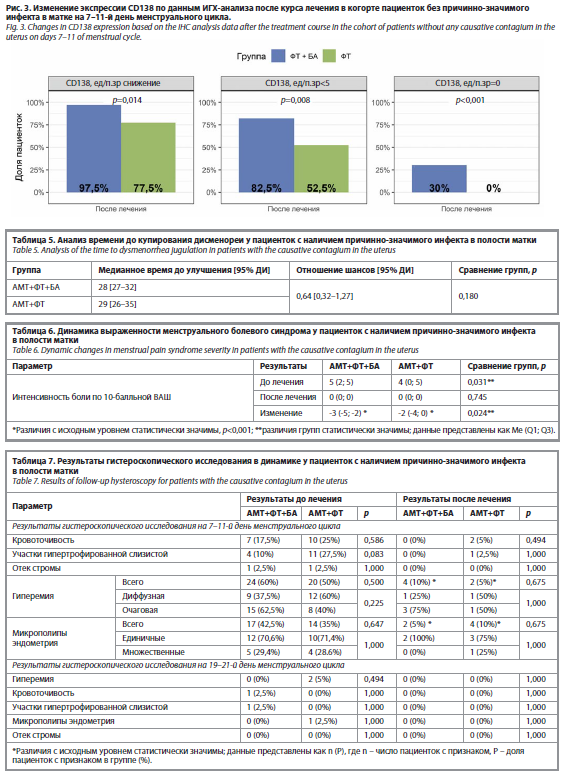
В целом снижение количества плазматических клеток CD138+ на фоне бовгиалуронидазы азоксимера было более выраженным у участниц без наличия инфекта и достигало статистически значимой разницы с группой контроля (97,5% против 77,5% соответственно, p=0,014). Также в группе ФТ+БА была выше морфологическая эффективность (достигших целевого уровня CD138<5 ед/п.зр: 82,5% против 52,5% в группе ФТ, p=0,008). Достигнутые показатели эффективности сохранялись и в секреторную фазу цикла в обеих когортах (табл. 4, рис. 2 и 3).
Оценка эффективности по вторичным конечным точкам у пациенток когорты с наличием причинно-значимого инфекта в полости матки
Динамика интенсивности болевого синдрома и частоты жалоб на дисменорею у пациенток изучаемой когорты. После лечения пациентки изучаемых когорт значимо реже сообщали о дисменорее, чем до него. При этом болевые ощущения во время менструации у пациенток снижались от цикла к циклу. Медианное время до улучшения профиля менструаций на основании данных дневников составило 4 нед без существенной разницы между группами (табл. 5).
Позитивная динамика наблюдалась и по результатам оценки выраженности дисменореи по ВАШ. Если до лечения выраженная боль была зарегистрирована значимо больше в основной группе (p=0,031), то следует констатировать, что и обе схемы терапии привели к полному купированию болевого синдрома. Однако было установлено более выраженное снижение интенсивности боли в группе АМТ+ФТ+БА по сравнению с АТМ+ФТ (медиана -3 и -2 балла соответственно, p=0,024); табл. 6.
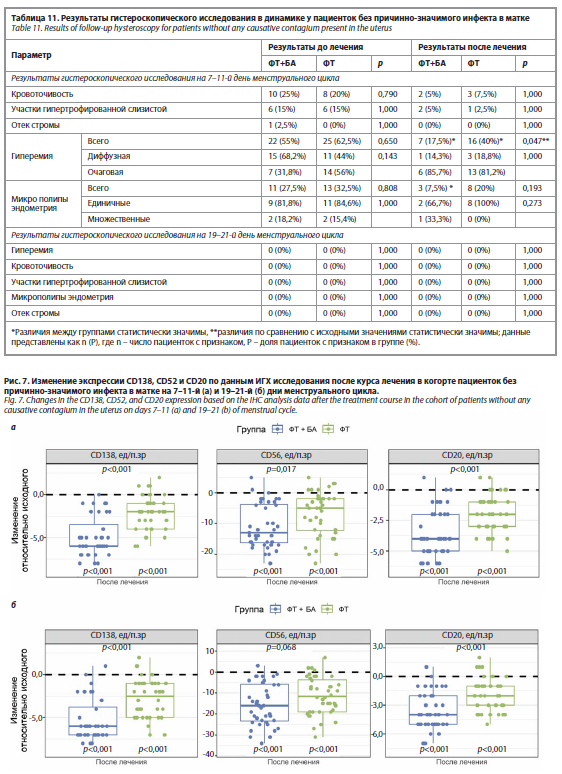
Оценка результатов гистероскопического исследования после терапии. При базовом обследовании до лечения частота признаков воспаления эндометрия (гиперемия, кровоточивость, гипертрофия слизистой, микрополипы, отек стромы) была сопоставима между группами в обе фазы менструального цикла. После курса терапии у всех женщин в пролиферативную фазу отмечено значимое снижение числа патологических находок (р<0,05). В группе АМТ+ФТ+БА наблюдалось более выраженное уменьшение интенсивности гиперемии, кровоточивости и регресс микрополипов. При этом аналогичные показатели гистероскопии в секреторную фазу цикла значимо не изменились в динамике. Не установлено статистически значимых межгрупповых различий после лечения ни на 7–11-й, ни на 19–21-й дни менструального цикла (табл. 7).
Оценка результатов морфологического исследования после терапии. Патоморфологическое исследование образцов эндометрия, полученных при гистероскопии до начала терапии, показало сопоставимую частоту воспалительных изменений в обеих группах: отек стромы выявлялся у 7,5% пациенток, лимфоидная инфильтрация – в 85% случаев, а очаговый фиброз стромы регистрировался примерно у каждой 5-й женщины. После курса терапии отмечено уменьшение выраженности морфологических признаков воспаления в обеих группах, однако динамика была более интенсивной у пациенток, получавших комбинированную терапию с использованием бовгиалуронидазы азоксимера. Как в пролиферативную, так и в секреторную фазы цикла регрессировал отек стромы в обеих группах, частота лимфоидной инфильтрации снизилась до 10% в основной группе и до 15–17,5% в контрольной. Во всех случаях отмечены значимые внутригрупповые изменения, хотя межгрупповые различия после лечения не достигли существенной разницы.
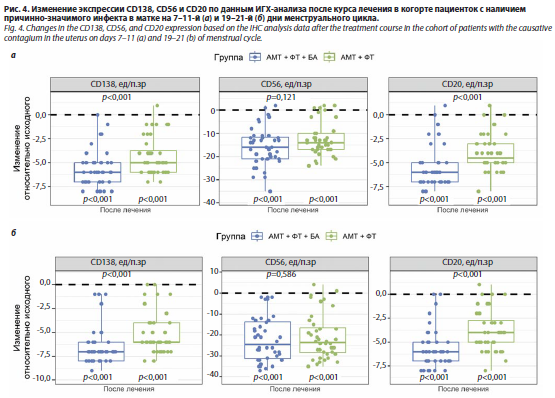
Оценка результатов ИГХ исследования после терапии. До начала лечения показатели ИГХ профиля в обеих группах были сопоставимыми. Экспрессия маркеров CD138, CD56 и CD20, а также молекул MUC1, HOXA-10, TGF-β, VEGF и ФНО-α не имела статистически значимых различий между пациентками двух групп как в пролиферативную, так и в секреторную фазу цикла. После лечения по результатам ИГХ исследования в основной группе зафиксирована статистически значимо более выраженная положительная динамика по сравнению с группой АМТ+ФТ: достоверное снижение количества плазмоцитов (CD138) и В-лимфоцитов (CD20) было более значительным в основной группе (p<0,001, по сравнению с контролем). Снижение количества NK-клеток (CD56) также было более выраженным в группе получавшей лиофилизат бовгиалуронидазы азоксимера (p<0,05); рис. 4. В секреторную фазу цикла в группе АМТ+ФТ+БА отмечено статистически значимое повышение экспрессии MUC1 (p<0,001). Кроме того, в основной группе зарегистрировано более значимое снижение экспрессии VEGF (на 7–11-й день) и ФНО-α (в обе фазы цикла), что указывает на более эффективное подавление локального воспаления.
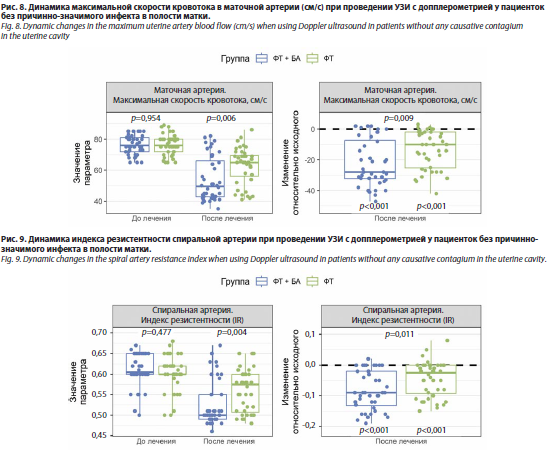
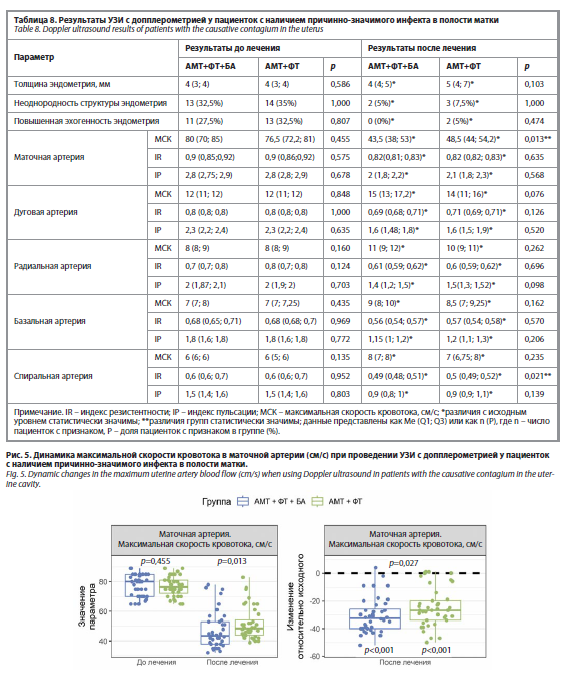
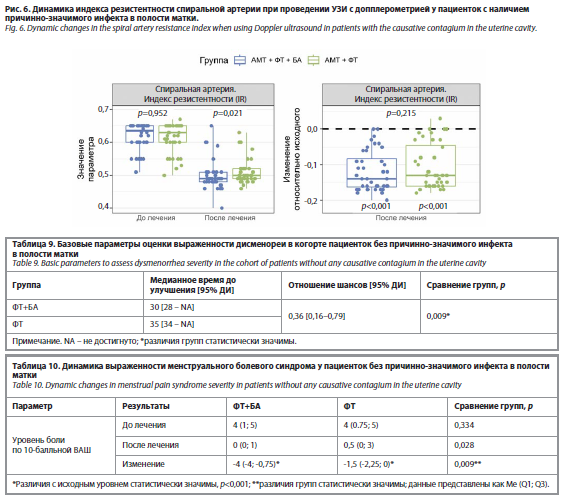
Оценка результатов УЗИ после терапии. Результаты УЗИ показали положительную динамику в обеих группах после лечения. Достоверно снизилась частота таких ультразвуковых признаков, как неоднородная структура и повышенная эхогенность эндометрия, однако статистически значимых межгрупповых различий по анализируемым параметрам выявлено не было. Анализ параметров допплерометрии маточных артерий выявил статистически значимое улучшение показателей перфузии эндометрия после лечения в обеих группах. При этом в группе АМТ+ФТ+БА зафиксировано более выраженное, по сравнению с группой АМТ+ФТ, статистически значимое снижение максимальной скорости кровотока в маточной артерии (p=0,013) и индекса резистентности в спиральных артериях (p=0,021) (табл. 8, рис. 5 и 6).
Оценка эффективности по вторичным конечным точкам у пациенток когорты без причинно-значимого инфекта в полости матки
Динамика интенсивности болевого синдрома и частоты жалоб на дисменорею у пациенток изучаемой когорты. На фоне курса лекарственной терапии все пациентки без причинно-значимого инфекта в полости матки отметили уменьшение выраженности дисменореи. При этом болевые ощущения во время менструации у пациенток снижались от цикла к циклу. Медианное время до улучшения профиля менструаций на основании данных дневников составило 30 дней у женщин в основной группе и 35 дней у участниц контрольной группы (отношение шансов 0,36, 95% ДИ 0,16–0,79). Таким образом, разница значений между группами оказалась достоверной (р<0,009), что говорит о более быстрой регуляции менструального цикла на фоне использования бовгиалуронидазы азоксимера в сочетании с физиотерапией (табл. 9).
Пациентки с дисменореей отмечали слабо выраженный или умеренный характер интенсивности боли при менструациях. Позитивная динамика наблюдалась и по результатам оценки выраженности менструальных болей по ВАШ, при этом значительно более существенное снижение боли было установлено в группе ФТ+БА по сравнению с АТМ+ФТ – медиана составила -4 балла по сравнению с -1,5 в группе ФТ (p=0,009) (табл. 10).
Оценка результатов гистероскопического исследования после терапии. При базовом гистероскопическом обследовании основные патологические находки (кровоточивость, участки гипертрофии, отек стромы, микрополипы) визуализировались исключительно в пролиферативную фазу менструального цикла. После лечения в обеих группах отмечена положительная динамика, выражавшаяся в снижении частоты встречаемости всех гистероскопических признаков. При этом в основной группе значительнее снизилась частота таких гистероскопических признаков, как гиперемия в пролиферативную фазу менструального цикла (с 55% до 17,5%), по сравнению с контрольной группой (с 62,5% до 40%), различие между группами после лечения стало статистически значимым (p=0,047) (табл. 11).
Оценка результатов морфологического исследования после терапии. По данным патоморфологического исследования исходно в группе ФТ+БА достоверно чаще регистрировался очаговый фиброз стромы (42,5% против 15%, p=0,013), однако после терапии этот показатель в группе ФТ+БА снизился до 12,5%, и межгрупповые различия нивелировались. На фоне проведенного лечения в основной группе наблюдалось статистически значимое снижение частоты лимфоидной инфильтрации (с 87,5 до 22,5%) по сравнению с контрольной группой (с 87,5 до 55%, p=0,005) в пролиферативную фазу цикла. Также было выявлено статистически значимое уменьшение лимфоидной инфильтрации в секреторную фазу цикла у пациенток экспериментальной группы (с 90 до 22,5%) по сравнению с участницами контрольной группы (с 87,5 до 52,5%, p=0,010).
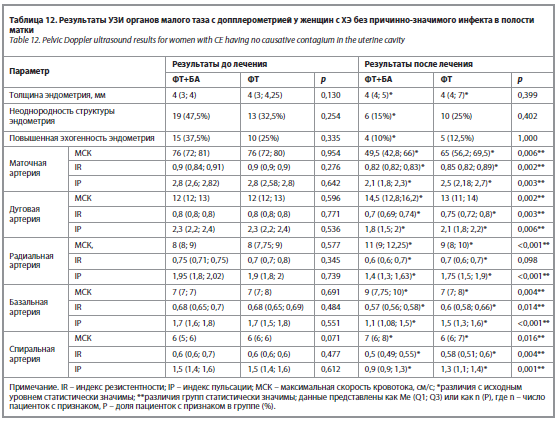
Оценка результатов ИГХ после терапии. На фоне лечения в группе, получавшей бовгиалуронидазы азоксимер, в пролиферативную фазу менструального цикла зафиксировано более выраженное снижение: количества плазмоцитов CD138 (p<0,001);
NK-клеток CD56 (p<0,001); В-лимфоцитов CD20 (p<0,001); рис. 7; экспрессии провоспалительного цитокина VEGF (p<0,001) – по сравнению с женщинами контрольной группы. В секреторную фазу цикла в основной группе отмечено: более значимое снижение CD138, CD56 и CD20 (p<0,001); увеличение экспрессии MUC1 (p<0,001); более выраженное снижение экспрессии VEGF (p<0,001) – по сравнению с результатами контрольной группы.
Оценка результатов УЗИ после терапии. Результаты УЗИ органов малого таза с допплерометрией у пациенток с ХЭ без инфекта выявили статистически значимое улучшение параметров маточного кровотока в экспериментальной группе на фоне терапии. В то время как ультразвуковые параметры эндометрия (толщина, неоднородность структуры, эхогенность) сопоставимо улучшились в обеих группах, анализ гемодинамики показал существенные различия. В группе ФТ+БА установлено достоверное: снижение индексов резистентности и пульсации в маточной (p=0,002; p=0,003), дуговой (p=0,003; p=0,006), базальной (p=0,014; p<0,001) и спиральной (p=0,004; p=0,001) артериях; более значимое увеличение максимальной систолической скорости в дуговых (p=0,002), радиальных (p<0,001), базальных (p=0,004) и спиральных (p=0,016) артериях – по сравнению с группой ФТ (табл. 12, рис. 8 и 9).
Результаты оценки безопасности
Во всех четырех группах не зафиксировано нежелательных явлений, связанных с исследуемым препаратом, включая серьезные. Однако в ходе исследования у двух пациенток были зарегистрированы головные боли, не связанные с приемом препарата.
Обсуждение результатов
Таким образом, результаты динамической оценки включенных в исследование пациенток валидны для использования согласно поставленной исследовательской цели оценки эффективности и безопасности бовгиалуронидазы азоксимера для лечения ХЭ у пациенток, страдающих бесплодием маточного происхождения. Одновременно выполненное исследование представляет собой методологически уникальный для исследуемого препарата комплексный подход к оценке его эффективности, который позволяет оценить не только специфичные для ХЭ диагностические параметры, но и характеристики, ассоциированные с имплантационной состоятельностью эндометрия.
При анализе динамики числа CD138+ клеток по данным ИГХ исследования (первичная конечная точка) установили, что во всех группах наблюдалось улучшение после проведенного курса лечения. При этом дополнение базисной терапии лиофилизатом бовгиалуронидазы азоксимера приводило как к статистически достоверному, так и клинически значимому усилению эффективности в обеих когортах. Ранее В.Е. Локшин и соавт. (2023 г.) также продемонстрировали, что подавляющее воздействие на экспрессию клеток CD138+ по результатам использования терапевтических схем с включением бовгиалуронидазы азоксимера регистрировалось значительно чаще, чем без бовгиалуронидазы азоксимера [11]. В настоящем исследовании доля женщин когорты с наличием причинно-значимого инфекта в полости матки, в эндометрии которых по результатам лечения не регистрировались плазматические клетки, достигла 77,5% в основной и 2,5% в контрольной группах соответственно (p<0,001). Эффективность лечения в целом в когорте с отсутствием причинно-значимого инфекта в полости матки, получавшей в качестве базисного лечения только физиотерапию, было значимо ниже. Тем не менее и в этой когорте терапия лиофилизатом бовгиалуронидазы азоксимера позволила добиться клинически значимого снижения числа плазматических клеток до менее 5 в поле зрения (ключевой диагностический критерий) у 70% пациенток, тогда как в контрольной группе данный параметр был зарегистрирован у 40% (p<0,001).
Бовгиалуронидаза азоксимер представляет собой тестикулярную гиалуронидазу, отличительной особенностью которой, по сравнению с тканевыми гиалуронидазами, является способность метаболизировать низкомолекулярную гиалуроновую кислоту, накапливающуюся в очагах хронического воспаления и ответственную за запуск каскада провоспалительных реакций [23–26]. Это приводит к более выраженному снижению уровней провоспалительных цитокинов и пролиферации иммунокомпетентных клеток (в том числе В-лимфоцитов и NK-клеток), что убедительно продемонстрировали результаты ИГХ-анализа биоптатов эндометрия. Так, в обеих когортах добавление бовгиалуронидазы азоксимера к базисной терапии характеризовалось достоверно более низкой степенью экспрессии CD20 и CD56. Также было достигнуто значимое снижение экспрессии ФНО-α.
Снижение концентрации низкомолекулярной гиалуроновой кислоты также влияет на активность процессов фиброзообразования, предотвращая активацию фибробластов и фибробласт-миофибробластный переход. Это ведет к снижению продукции компонентов межклеточного матрикса и уменьшению степени выраженности фиброзирования [24, 27], что соотносится с данными уменьшения индекса резистентности спиральных артерий, полученными в ходе допплерометрического исследования.
В свою очередь, уменьшение выраженности лимфоидной инфильтрации ткани сопровождается снижением уровня ее васкуляризации за счет уменьшения рекрутинга мононуклеаров и соответствующего замедления ангиогенеза в связи со снижением продукции стимулирующих его факторов [23, 24]. В подтверждение этого тезиса в рамках настоящего исследования было показано достоверное более выраженное снижение экспрессии VEGF в группах с бовгиалуронидазы азоксимером.
Таким образом, полученный клинический результат в группах с включением лиофилизата бовгиалуронидазы азоксимера в терапевтическую схему лечения ХЭ опосредован положительным влиянием исследуемого препарата на гуморальный иммунитет и выраженными противовоспалительными и противофиброзными свойствами.
Важным аспектом терапевтического вмешательства при ХЭ является этиотропная антибиотикотерапия, однако ее эффективность в настоящее время неоднозначна [4, 19, 20]. Известно, что воздействие антибиотиков способно провоцировать формирование биопленок. Примечательно, что данный процесс регулируется, прямо или косвенно, сигнальной системой c-di-GMP. Это делает c-di-GMP ключевым регулятором, который управляет переходом бактерий от планктонного к биопленочному образу жизни, что, в свою очередь, определяет характер инфекции – острой или хронической [28]. Включение в терапию методов, разрушающих биопленки, способствует увеличению эффективности антибактериальной терапии. Доказано, что бовгиалуронидаза азоксимер повышает биодоступность антимикробной терапии: благодаря проявлению гиалуронидазной активности фермент разрушает гиалуроновую кислоту, входящую в состав матрикса и оболочки биопленки [26, 29]. Это в, свою очередь, увеличивает эффективность антимикробных средств в ситуации антибиотикорезистентности и повышает шанс на достижение искомого клинического эффекта, что и было продемонстрировано в настоящем исследовании.
Заключение
На основании результатов проведенного исследования было установлено, что на фоне комплексной терапии ХЭ с использованием лиофилизата бовгиалуронидазы азоксимера в дозе 3000 МЕ по схеме 1 раз в 3 дня в течение 1 мес происходит:
• значимое снижение выраженности дисменореи с купированием боли уже в первом цикле после завершения лечения;
• значительное улучшение циркуляции кровеносных сосудов матки (по данным УЗИ с допплерографией);
• снижение, по данным гистероскопии, числа патологических находок, характерных для ХЭ, до 4 раз по сравнению с уровнем до лечения;
• редукция воспалительных морфологических признаков ХЭ вплоть до их полного купирования;
• выраженное снижение маркеров ХЭ, ассоциированных с патологическим лимфоцитарным ответом, в том числе способность приводить к исчезновению плазматических клеток у 2/3 пациенток на фоне приема антимикробных средств в сочетании с физиотерапией, у 1/3 пациенток – при лечении в сочетании с физиотерапией.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., дир. НИИМЧ им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского»; зав. патологоанатомическим отделением ГБУЗ «ГКБ № 31 им. акад. Г.М. Савельевой ДЗМ». E-mail: mikhalevalm@yandex.ru; ORCID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Prof., Dir. Avtsyn Scientific Research Institute of Human Morphology; City Clinical Hospital No. 31 named after Academician G.M. Savelyeva.
E-mail: mikhalevalm@ yandex.ru; ORCID: 0000-0003-2052-914X
Силантьева Елена Сергеевна – д-р мед. наук, зам. глав. врача, Клинический госпиталь «Лапино» ГК «Мать и Дитя». E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Elena S. Silantyeva – Dr. Sci. (Med.), Deputy Chief doctor, Lapino Clinical Hospital, Mother and Child Group.
E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Орехов Роман Евгеньевич – канд. мед наук, доц. каф. акушерства и гинекологии с курсом перинатологии, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: romanorekhovv@ya.ru
Roman E. Orekhov – Cand. Sci. (Med.), Assoc. Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: romanorekhovv@ya.ru
Муллина Ирина Александровна – канд. мед. наук, акушер-гинеколог гинекологического отделения, ЧУЗ «КБ «РЖД-Медицина» им. Н.А. Семашко». E-mail: 211irina2111@gmail.com
Irina A. Mullina – Cand. Sci. (Med.), obstetrician-gynecologist, Semashko Russian Railways-Medicine Clinical Hospital.
E-mail: 211irina2111@gmail.com
Митрелис Рина Юрьевна – аспирант каф. НИИМЧ им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии
им. акад. Б.В. Петровского». E-mail: abelyarrin@yandexl.ru
Rina Yu. Mitrelis – Graduate Student, Avtsyn Scientific Research Institute of Human Morphology. E-mail: abelyarrin@yandexl.ru
Поступила в редакцию: 29.11.2025
Поступила после рецензирования: 03.12.2025
Принята к публикации: 04.12.2025
Received: 29.11.2025
Revised: 03.12.2025
Accepted: 04.12.2025
Клинический разбор в общей медицине №12 2025
Эффективность и безопасность бовгиалуронидазы азоксимера в терапии хронического эндометрита: результаты открытого сравнительного рандомизированного контролируемого исследования Life Cradle
Номера страниц в выпуске:119-134
Аннотация
Цель. Оценить эффективность и безопасность использования бовгиалуронидазы азоксимера (БА) 3000 МЕ в терапии хронического эндометрита (ХЭ) у пациенток с бесплодием маточного происхождения.
Материалы и методы. Проанализированы данные открытого независимого сравнительного рандомизированного клинического исследования с участием 160 женщин с ХЭ и бесплодием. В зависимости от наличия (И+) или отсутствия (И-) внутриматочной доказанной/значимой инфекции пациентки были разделены на две когорты по 80 человек. Все участницы получали курс физиотерапии (ФТ), пациентки с наличием доказанного/значимого инфекта в полости матки получали антимикробную терапию (АМТ). Дополнительно внутри когорт пациентки были рандомизированы в соотношении 1:1 для получения или неполучения БА.
Результаты. Во всех группах отмечено снижение числа плазматических клеток CD138+, однако добавление БА к базисной терапии обеспечило достоверно высокую эффективность терапии: в когорте И+ плазматические клетки CD138+ отсутствовали у 77,5% пациенток против 2,5% в контрольной группе (p<0,001), в когорте И- – у 30% против 0% (p<0,001). Комплексная терапия с использованием БА значимо снижает выраженность дисменореи, улучшает гистероскопическую и морфологическую картину ХЭ. На это указывают достоверное снижение интенсивности лимфоидной инфильтрации и очагового фиброза стромы эндометрия, регуляция уровня экспрессии иммуногистохимических маркеров (CD138, CD20, CD56, VEGF, фактора некроза опухоли α, MUC1) и повышение маточного кровотока по данным допплерометрии (p<0,001). Нежелательные явления, в том числе и аллергические реакции, связанные с использованием БА, в ходе исследования не зарегистрированы.
Заключение. Установлена высокая эффективность и безопасность бовгиалуронидазы азоксимера в комплексной терапии ХЭ.
Ключевые слова: хронический эндометрит, комплексная терапия, CD138+, бовгиалуронидаза азоксимер, воспалительные заболевания органов малого таза.
Для цитирования: Радзинский В.Е., Оразов М.Р., Михалева Л.М., Силантьева Е.С., Орехов Р.Е., Муллина И.А., Митрелис Р.Ю. Эффективность и безопасность бовгиалуронидазы азоксимера в терапии хронического эндометрита: результаты открытого сравнительного рандомизированного контролируемого исследования Life Cradle. Клинический разбор в общей медицине. 2025; 6 (12): 119–134. DOI: 10.47407/kr2025.6.12.00740
Цель. Оценить эффективность и безопасность использования бовгиалуронидазы азоксимера (БА) 3000 МЕ в терапии хронического эндометрита (ХЭ) у пациенток с бесплодием маточного происхождения.
Материалы и методы. Проанализированы данные открытого независимого сравнительного рандомизированного клинического исследования с участием 160 женщин с ХЭ и бесплодием. В зависимости от наличия (И+) или отсутствия (И-) внутриматочной доказанной/значимой инфекции пациентки были разделены на две когорты по 80 человек. Все участницы получали курс физиотерапии (ФТ), пациентки с наличием доказанного/значимого инфекта в полости матки получали антимикробную терапию (АМТ). Дополнительно внутри когорт пациентки были рандомизированы в соотношении 1:1 для получения или неполучения БА.
Результаты. Во всех группах отмечено снижение числа плазматических клеток CD138+, однако добавление БА к базисной терапии обеспечило достоверно высокую эффективность терапии: в когорте И+ плазматические клетки CD138+ отсутствовали у 77,5% пациенток против 2,5% в контрольной группе (p<0,001), в когорте И- – у 30% против 0% (p<0,001). Комплексная терапия с использованием БА значимо снижает выраженность дисменореи, улучшает гистероскопическую и морфологическую картину ХЭ. На это указывают достоверное снижение интенсивности лимфоидной инфильтрации и очагового фиброза стромы эндометрия, регуляция уровня экспрессии иммуногистохимических маркеров (CD138, CD20, CD56, VEGF, фактора некроза опухоли α, MUC1) и повышение маточного кровотока по данным допплерометрии (p<0,001). Нежелательные явления, в том числе и аллергические реакции, связанные с использованием БА, в ходе исследования не зарегистрированы.
Заключение. Установлена высокая эффективность и безопасность бовгиалуронидазы азоксимера в комплексной терапии ХЭ.
Ключевые слова: хронический эндометрит, комплексная терапия, CD138+, бовгиалуронидаза азоксимер, воспалительные заболевания органов малого таза.
Для цитирования: Радзинский В.Е., Оразов М.Р., Михалева Л.М., Силантьева Е.С., Орехов Р.Е., Муллина И.А., Митрелис Р.Ю. Эффективность и безопасность бовгиалуронидазы азоксимера в терапии хронического эндометрита: результаты открытого сравнительного рандомизированного контролируемого исследования Life Cradle. Клинический разбор в общей медицине. 2025; 6 (12): 119–134. DOI: 10.47407/kr2025.6.12.00740
Efficacy and safety of bovhyaluronidase azoximer in treatment of chronic endometritis: the Life Cradle open-label comparative randomized controlled trial results
Viktor E. Radzinsky1, Mekan R. Orazov1, Lyudmila M. Mikhaleva2,3, Elena S. Silantyeva4,Roman E. Orekhov1, Irina A. Mullina5, Rina Yu. Mitrelis2
1 Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Avtsyn Scientific Research Institute of Human Morphology, State Scientific Center of the Russian Federation – Petrovsky Russian Scientific Center of Surgery, Moscow, Russia;
3 City Clinical Hospital No. 31 named after Academician G.M. Savelyeva, Moscow, Russia;
4 Lapino Clinical Hospital, Mother and Child Group, Moscow Region, Russia;
5 Semashko Russian Railways-Medicine Clinical Hospital, Moscow, Russia
omekan@mail.ru
Abstract
Aim. To assess efficacy and safety of using bovhyaluronidase azoximer (BA) 3000 IU for therapy of chronic endometritis (CE) in patients with the uterine factor infertility.
Methods. The data of the open-label independent comparative randomized clinical trial involving 160 women with CE and infertility were analyzed. Patients were divided into two cohorts, 80 individuals each, depending on the presence (I+) or absence (I-) of a proven/significant intrauterine infection. All the participants were through the physical therapy (PT) course; patients with the proven/significant causative contagium present in the uterine cavity received antimicrobial therapy (АМТ). Patients were further randomized within the cohorts at a ratio of 1:1 to receive or not receive BA.
Results. The decrease in the CD138+ plasma cell counts was reported for all groups, but basic therapy supplementation with BA ensured the significantly high therapy efficacy: in the I+ cohort, there were no CD138+ plasma cells in 77.5% of patients vs. 2.5% in the control group (p<0.001), while in the I- cohort there were no CD138+ plasma cells in 30% vs. 0% (p<0.001). The combination therapy involving the use of BA significantly decreased the dysmenorrhea severity, improved the CE hysteroscopic and morphological patterns. This is suggested by the significantly decreased intensity of lymphoid infiltration and focal fibrosis of the endometrial stroma, regulation of the immunohostochemistry marker (CD138, CD20, CD56, VEGF, tumor necrosis factor α, MUC1) expression, and the increased blood flow based on the Doppler data (p<0.001). No adverse events, including allergy associated with the use of BA, were recorded during the trial.
Conclusion. High efficacy and safety of bovhyaluronidase azoximer in combination therapy of CE were determined.
Keywords: chronic endometritis, combination therapy, CD138+, bovhyaluronidase azoximer, pelvic inflammatory disease.
For citation: Radzinsky V.E., Orazov M.R., Mikhaleva L.M, Silantyeva E.S., Orekhov R.E., Mullina I.A., Mitrelis R.Yu. Efficacy and safety of bovhyaluronidase azoximer in treatment of chronic endometritis: the Life Cradle open-label comparative randomized controlled trial results. Clinical review for general practice. 2025; 6 (12): 119–134 (In Russ.). DOI: 10.47407/kr2025.6.12.00740
Введение
Хронический эндометрит (ХЭ) представляет собой клинико-морфологический синдром, характеризующийся развитием множественных вторичных морфофункциональных изменений эндометрия в результате персистирующего аномального воспаления. Ключевыми морфологическими детерминантами ХЭ являются нарушения циклической биотрансформации и рецептивности [1].
Установлена высокая распространенность ХЭ у пациенток репродуктивного возраста [2]. Его клиническое и социальное значение не может быть переоценено, так как данное заболевание ассоциировано с бесплодием маточного происхождения, привычным невынашиванием и неблагоприятными исходами беременности, повторными неудачами имплантации при экстракорпоральном оплодотворении (ЭКО) [3–7]. Высокая частота ХЭ – от 45 до 70% – отмечена у женщин с привычным невынашиванием беременности [1]. ХЭ выявляется у 14–40% женщин с бесплодием и повторными неудачами имплантации [5, 6, 8, 9]. Установлена связь ХЭ с неблагоприятными исходами беременности, включая преждевременные роды, преэклампсию и осложнения у новорожденных [4–6, 10]. В ходе ЭКО также установлена высокая распространенность ХЭ – 30% [11]. Исследования демонстрируют, что у 57,8% пациенток с тремя и более потерями беременности диагноз ХЭ верифицируется при гистероскопии и иммуногистохимическом (ИГХ) исследовании [12]. После терапии ХЭ частота наступления клинической беременности увеличивается в 3,64 раза, а успешного ее течения – в 5,33 раза по сравнению с нелеченым или рецидивирующим заболеванием [12].
Основной причиной ХЭ считается нарушение микробиома эндометрия, вызванное такими патогенами, как Escherichia coli, Enterococcus faecalis, Streptococcus, Staphylococcus, Mycoplasma/Ureaplasma [13–17]. Развитие ХЭ, как и любых воспалительных заболеваний органов малого таза (ВЗОМТ), происходит в результате восходящей урогенитальной инфекции бактериальной или вирусной природы [1, 2]. В последние годы обсуждается роль не только инфекционных, но и неинфекционных факторов, включая иммунные нарушения и локальный дисбиоз [13–15, 18]. Лечение ХЭ при доказанном/потенциально значимом инфекте может включать антибактериальную терапию, эффективность которой подтверждена в ряде исследований, однако существует нерешенная проблема антибиотикорезистентности [4, 19, 20]. Установлена высокая эффективность антибактериальной терапии, которая достигает 60–94% [4, 19, 20], однако рост антибиотикорезистентности на фоне необоснованного использования антимикробных средств требует индивидуализации терапии и поиска новых подходов (иммуномодуляторы, регенеративные методы и физические факторы) [16, 19–22]. Несмотря на успехи в понимании патогенеза и терапии, вопросы оптимизации тактики ведения пациенток с ХЭ остаются нерешенными [13, 14, 16].
В связи с этим исследовательский интерес представляет бовгиалуронидаза азоксимер (препарат Лонгидаза®) – конъюгат гиалуронидазы с азоксимера бромидом. Препарат обладает противовоспалительным, иммуномодулирующим и выраженным противофиброзным действием, а также разрушает биопленки микроорганизмов, повышая эффективность и биодоступность антибактериальной терапии [23].
Представляет научный интерес расширенная оценка эффективности и безопасности бовгиалуронидазы азоксимера в клиническом исследовании высокого уровня доказательности, предусматривающем комплексную диагностику ХЭ согласно актуальным подходам.
Материалы и методы
Выполнено открытое независимое сравнительное рандомизированное клиническое исследование с целью оценки клинико-морфологической эффективности и безопасности использования бовгиалуронидазы азоксимера (3000 МЕ) в комплексной терапии ХЭ у пациенток, страдающих бесплодием маточного происхождения.

Критерии отбора пациенток. В исследование включали пациенток в возрасте 18–45 лет на момент подписания информированного согласия с диагнозами «Женское бесплодие маточного происхождения» (код по МКБ N97.2) в сочетании с двумя и более неудачами имплантации в анамнезе и «Хронический эндометрит» (код по МКБ N71).
Дополнительными анамнестическими критериями отбора пациенток были:
• указания на неэффективность предшествующей антимикробной терапии в связи с ВЗОМТ и/или ХЭ (2 и более курсов антибиотикотерапии);
• указания на отсутствие предшествующей антимикробной терапии в течение 180 дней до предполагаемой даты начала исследуемого лечения.
Пациентки не подлежали включению в исследование при наличии хотя бы одного из следующих критериев:
• гнойный воспалительный процесс в органах малого таза;
• наличие инфекций, передаваемых половым путем;
• ВИЧ-инфекция;
• наличие внутриматочных пролиферативных болезней по данным гистероскопии;
• онкологические заболевания;
• оперативные вмешательства органов малого таза, перенесенные в течение 3 мес до включения в исследование;
• фактический прием или показания к приему препаратов гормональной терапии, фуросемида, бензодиазепина, фенитоина, адреналина.
Скрининговый период (период до назначения исследуемой терапии) предусматривал сбор акушерско-гинекологического, фармакотерапевтического, хирургического анамнеза, сбор и оценку жалоб, включая оценку выраженности дисменореи по 10-балльной Визуально-аналоговой шкале (ВАШ), гинекологический осмотр, ультразвуковое исследование (УЗИ) матки с допплерографией, гистероскопию с Пайпель-биопсией эндометрия на 7–11 и 19–21-й дни менструального цикла и последующим патоморфологическим и ИГХ исследованием биоптатов эндометрия, а также исследование микрофлоры матки (тест Фемофлор).
Ход исследования. После завершения скринингового периода осуществлялась рандомизация пациенток методом случайных чисел в формате фиксированной рандомизации с размером блока 4 и стратификацией по факту наличия доказанного или причинно-значимого инфекта в полости матки с формированием 2 когорт по данному признаку. В каждой когорте путем рандомизации были сформированы по одной группе экспериментального лечения и одной контрольной группе, всего сформировано четыре группы в соотношении 1:1:1:1 (рис. 1).
Все пациентки получали следующую базисную терапию:
• пациентки изучаемой когорты с наличием причинно-значимого инфекта в полости матки как этиологического фактора воспалительного процесса в эндометрии в качестве базисной терапии получали антимикробную терапию с использованием группы тетрациклинов в комбинации с 5-нитроимидазолов в стандартной схеме, в сочетании с физиотерапией (интерференционные токи/электрофорез с гальваническими токами №20–30);
• пациентки изучаемой когорты без причинно-значимого инфекта как этиологического фактора воспалительного процесса в эндометрии в качестве базисной терапии получали только физиотерапию (интерференционные токи/электрофорез с гальваническими токами №20–30).
В каждой из когорт пациенткам основных групп в дополнение к базисной терапии была назначена исследуемая терапия: лиофилизат бовгиалуронидазы азоксимера для приготовления раствора для инъекций в дозе 3000 МЕ внутримышечно по 1 инъекции 1 раз в три дня в течение 28 дней (всего 10 инъекций).
Таким образом, в исследовании было сформировано 4 группы женщин, получавших:
1) антимикробную терапию, физиотерапию и бовгиалуронидазы азоксимер (АМТ+ФТ+БА);
2) антимикробную терапию и физиотерапию (АМТ+ФТ);
3) физиотерапию и бовгиалуронидазы азоксимер (ФТ+БА);
4) исключительно физиотерапию (ФТ).
По завершении исследуемой терапии в срок от 30 до 44 дней от даты ее начала осуществлялось повторное обследование пациенток с выполнением гинекологического осмотра, оценкой жалоб, включая оценку выраженности дисменореи по ВАШ и записей Дневника пациентки (в первую фазу менструального цикла), УЗИ органов малого таза с допплерометрией, гистероскопии с Пайпель-биопсией эндометрия на 7–11 и 19–21-й дни менструального цикла и последующим патоморфологическим и ИГХ исследованиями биоптатов.
Для ИГХ-анализа эндометрия использовали антитела к CD138, CD56 и CD20, а также к молекулам MUC1, HOXA-10, TGF-β, VEGF и фактора некроза опухоли (ФНО)-α производства DAKO.
Электронные системы исследования. Распределение пациенток по группам и последующая регистрация медицинских данных осуществлялись на электронной ИРК-платформе в системе Visual Stat Expert версии 2.0 (ООО «Кейстат»). Рандомизационные коды были сгенерированы с использованием программного обеспечения The R Project for Statistical Computing (https://www.r-project.org) версии ≥ 4.3.2, пакет blockrand.
Конечные точки исследования. Первичная конечная точка исследования: изменение числа плазматических клеток CD138+ в эндометрии в пролиферативной фазе менструального цикла после лечения по сравнению с исходным уровнем.
В качестве вторичных конечных точек были использованы:
• По результатам ИГХ окрашивания биоптатов эндометрия:
– изменение числа клеток CD138+ в эндометрии (секреторная фаза);
– изменение числа клеток CD56+ и CD20+ в эндометрии (пролиферативная и секреторная фазы);
– изменение уровня экспрессии MUC1 в эндометрии (секреторная фаза);
– изменение уровня экспрессии HOXA-10, TGF-β, VEGF, ФНО-α в эндометрии (пролиферативная и секреторная фазы);
– динамика экспрессии клеток CD138+ по сравнению с исходными данными.
• По результатам гистероскопии: признаки гиперемии эндометрия, отека стромы, обнаруженные участки гипертрофированной слизистой, микрополипы.
• По результатам патоморфологического исследования биоптатов эндометрия: признаки отека стромы, лимфоидной инфильтрации, очагового фиброза стромы.
• По результатам УЗИ: неоднородная структура эндометрия, с повышенной эхогенностью, М-эхо.
• По результатам допплерометрии субэндометриальных сосудов (маточной, дуговой, радиальной, базальной, спиральной артерий): изменение максимальной скорости кровотока, индекса резистентности, индекса пульсации.
• Оценка выраженности дисменореи по ВАШ.
• Время купирования дисменореи.
Все изменения параметров оценивали после лечения по сравнению с исходным уровнем.
Критерии оценки безопасности были следующими:
– общая частота нежелательных явлений;
– частота нежелательных явлений, связанных с использованием исследуемого продукта (нежелательные лекарственные реакции, НЛР);
– переносимость исследуемого продукта, частота НЛР, развитие которых потребовало отмены исследуемого препарата.
Статистический анализ проводили с использованием программного обеспечения R (https://www.r-project.org) версии 4.5.2.
По количественным показателям группы сравнивали при помощи t-критерия Стьюдента либо U-критерия Манна–Уитни в зависимости от результатов проверки нормальности распределения данных посредством критерия Шапиро–Уилка. Для внутригрупповых сравнений количественных показателей до и после лечения использовали парный t-критерий Стьюдента или критерий знаковых рангов Уилкоксона.
Для категориальных показателей сравнение групп проводили при помощи критерия хи-квадрат Пирсона (χ2), в случае бинарных переменных применяли поправку Йетса. Если в любой из ячеек таблицы сопряженности ожидаемые частоты были меньше 5, вместо χ2 использовали точный критерий Фишера. Внутригрупповое сравнение по категориальным показателям проводили с использованием критерия Мак–Немара или Мадански (в зависимости от количества уровней оцениваемых показателей).
Для анализа времени до наступления события использовали метод Каплана–Мейера, рассчитывали медиану времени до события и 95% доверительный интервал (ДИ). Используя модель пропорциональных рисков Кокса оценивали отношение шансов и 95% ДИ. Значимость различий между группами оценивали с помощью лог-ранк теста.
Результаты и их обсуждение
По итогам скрининговых обследований предусмотренное протоколом лечение и наблюдение прошли 160 пациенток – по 40 пациенток в каждой группе. Все пациентки завершили участие в исследовании в соответствии с протоколом, а их данные были включены в статистический анализ эффективности и безопасности. Комплаентность пациенток к процедурам исследования (соблюдение графика процедур, соответствие лечения назначенному по протоколу) составила 100% в обеих когортах.
Исходные характеристики пациенток когорты с причинно-значимым инфектом в полости матки представлены в табл. 1.
При базовом физикальном осмотре наружных половых органов отклонения у пациенток не выявлялись. Какие-либо специфические жалобы у пациенток отсутствовали, за исключением дисменореи, которая была характерна для половины исследуемой популяции (55% основной и 52,5% контрольной групп). Одновременно пациентки с дисменореей отмечали слабо выраженный или умеренный характер боли при менструациях.
По результатам теста Фемофлор у пациенток была выявлена смешанная бактериальная флора с преобладанием энтеробактерий, стрептококков и стафилококков (табл. 2).
Исходные характеристики пациенток когорты без причинно-значимого инфекта в полости матки представлены в табл. 3.

Среди клинически значимых сопутствующих (хронических) заболеваний у 1 пациентки основной группы отмечены диспептические расстройства, не связанные
с приемом каких-либо лекарственных препаратов; по 1 пациентке контрольной группы имели хронический гастрит (n=1) и хронический панкреатит (n=1). Установлена высокая частота встречаемости дисменореи – 72,5 и 67,5% пациенток основной и контрольной групп соответственно.
Анализ первичной конечной точки

При анализе динамики числа CD138+ позитивных клеток по данным ИГХ исследования, установили, что во всех группах наблюдалась морфологическая эффективность после проведенного курса лечения.
В когорте с наличием причинно-значимого инфекта в полости матки морфологическая эффективность с полноценной элиминацией CD138+ плазматических клеток в пролиферативную фазу цикла была достоверно выше у пациенток, получивших комплексную терапию с использованием бовгиалуронидазы азоксимера (77,5% против 2,5% в группе контроля, p<0,001). Аналогичная закономерность по данному параметру наблюдалась в когорте без наличия причинно-значимого инфекта в полости матки (30% против 0%, p<0,001).
В целом снижение количества плазматических клеток CD138+ на фоне бовгиалуронидазы азоксимера было более выраженным у участниц без наличия инфекта и достигало статистически значимой разницы с группой контроля (97,5% против 77,5% соответственно, p=0,014). Также в группе ФТ+БА была выше морфологическая эффективность (достигших целевого уровня CD138<5 ед/п.зр: 82,5% против 52,5% в группе ФТ, p=0,008). Достигнутые показатели эффективности сохранялись и в секреторную фазу цикла в обеих когортах (табл. 4, рис. 2 и 3).
Оценка эффективности по вторичным конечным точкам у пациенток когорты с наличием причинно-значимого инфекта в полости матки

Динамика интенсивности болевого синдрома и частоты жалоб на дисменорею у пациенток изучаемой когорты. После лечения пациентки изучаемых когорт значимо реже сообщали о дисменорее, чем до него. При этом болевые ощущения во время менструации у пациенток снижались от цикла к циклу. Медианное время до улучшения профиля менструаций на основании данных дневников составило 4 нед без существенной разницы между группами (табл. 5).
Позитивная динамика наблюдалась и по результатам оценки выраженности дисменореи по ВАШ. Если до лечения выраженная боль была зарегистрирована значимо больше в основной группе (p=0,031), то следует констатировать, что и обе схемы терапии привели к полному купированию болевого синдрома. Однако было установлено более выраженное снижение интенсивности боли в группе АМТ+ФТ+БА по сравнению с АТМ+ФТ (медиана -3 и -2 балла соответственно, p=0,024); табл. 6.

Оценка результатов гистероскопического исследования после терапии. При базовом обследовании до лечения частота признаков воспаления эндометрия (гиперемия, кровоточивость, гипертрофия слизистой, микрополипы, отек стромы) была сопоставима между группами в обе фазы менструального цикла. После курса терапии у всех женщин в пролиферативную фазу отмечено значимое снижение числа патологических находок (р<0,05). В группе АМТ+ФТ+БА наблюдалось более выраженное уменьшение интенсивности гиперемии, кровоточивости и регресс микрополипов. При этом аналогичные показатели гистероскопии в секреторную фазу цикла значимо не изменились в динамике. Не установлено статистически значимых межгрупповых различий после лечения ни на 7–11-й, ни на 19–21-й дни менструального цикла (табл. 7).
Оценка результатов морфологического исследования после терапии. Патоморфологическое исследование образцов эндометрия, полученных при гистероскопии до начала терапии, показало сопоставимую частоту воспалительных изменений в обеих группах: отек стромы выявлялся у 7,5% пациенток, лимфоидная инфильтрация – в 85% случаев, а очаговый фиброз стромы регистрировался примерно у каждой 5-й женщины. После курса терапии отмечено уменьшение выраженности морфологических признаков воспаления в обеих группах, однако динамика была более интенсивной у пациенток, получавших комбинированную терапию с использованием бовгиалуронидазы азоксимера. Как в пролиферативную, так и в секреторную фазы цикла регрессировал отек стромы в обеих группах, частота лимфоидной инфильтрации снизилась до 10% в основной группе и до 15–17,5% в контрольной. Во всех случаях отмечены значимые внутригрупповые изменения, хотя межгрупповые различия после лечения не достигли существенной разницы.


Оценка результатов ИГХ исследования после терапии. До начала лечения показатели ИГХ профиля в обеих группах были сопоставимыми. Экспрессия маркеров CD138, CD56 и CD20, а также молекул MUC1, HOXA-10, TGF-β, VEGF и ФНО-α не имела статистически значимых различий между пациентками двух групп как в пролиферативную, так и в секреторную фазу цикла. После лечения по результатам ИГХ исследования в основной группе зафиксирована статистически значимо более выраженная положительная динамика по сравнению с группой АМТ+ФТ: достоверное снижение количества плазмоцитов (CD138) и В-лимфоцитов (CD20) было более значительным в основной группе (p<0,001, по сравнению с контролем). Снижение количества NK-клеток (CD56) также было более выраженным в группе получавшей лиофилизат бовгиалуронидазы азоксимера (p<0,05); рис. 4. В секреторную фазу цикла в группе АМТ+ФТ+БА отмечено статистически значимое повышение экспрессии MUC1 (p<0,001). Кроме того, в основной группе зарегистрировано более значимое снижение экспрессии VEGF (на 7–11-й день) и ФНО-α (в обе фазы цикла), что указывает на более эффективное подавление локального воспаления.
Оценка результатов УЗИ после терапии. Результаты УЗИ показали положительную динамику в обеих группах после лечения. Достоверно снизилась частота таких ультразвуковых признаков, как неоднородная структура и повышенная эхогенность эндометрия, однако статистически значимых межгрупповых различий по анализируемым параметрам выявлено не было. Анализ параметров допплерометрии маточных артерий выявил статистически значимое улучшение показателей перфузии эндометрия после лечения в обеих группах. При этом в группе АМТ+ФТ+БА зафиксировано более выраженное, по сравнению с группой АМТ+ФТ, статистически значимое снижение максимальной скорости кровотока в маточной артерии (p=0,013) и индекса резистентности в спиральных артериях (p=0,021) (табл. 8, рис. 5 и 6).
Оценка эффективности по вторичным конечным точкам у пациенток когорты без причинно-значимого инфекта в полости матки

Динамика интенсивности болевого синдрома и частоты жалоб на дисменорею у пациенток изучаемой когорты. На фоне курса лекарственной терапии все пациентки без причинно-значимого инфекта в полости матки отметили уменьшение выраженности дисменореи. При этом болевые ощущения во время менструации у пациенток снижались от цикла к циклу. Медианное время до улучшения профиля менструаций на основании данных дневников составило 30 дней у женщин в основной группе и 35 дней у участниц контрольной группы (отношение шансов 0,36, 95% ДИ 0,16–0,79). Таким образом, разница значений между группами оказалась достоверной (р<0,009), что говорит о более быстрой регуляции менструального цикла на фоне использования бовгиалуронидазы азоксимера в сочетании с физиотерапией (табл. 9).
Пациентки с дисменореей отмечали слабо выраженный или умеренный характер интенсивности боли при менструациях. Позитивная динамика наблюдалась и по результатам оценки выраженности менструальных болей по ВАШ, при этом значительно более существенное снижение боли было установлено в группе ФТ+БА по сравнению с АТМ+ФТ – медиана составила -4 балла по сравнению с -1,5 в группе ФТ (p=0,009) (табл. 10).

Оценка результатов гистероскопического исследования после терапии. При базовом гистероскопическом обследовании основные патологические находки (кровоточивость, участки гипертрофии, отек стромы, микрополипы) визуализировались исключительно в пролиферативную фазу менструального цикла. После лечения в обеих группах отмечена положительная динамика, выражавшаяся в снижении частоты встречаемости всех гистероскопических признаков. При этом в основной группе значительнее снизилась частота таких гистероскопических признаков, как гиперемия в пролиферативную фазу менструального цикла (с 55% до 17,5%), по сравнению с контрольной группой (с 62,5% до 40%), различие между группами после лечения стало статистически значимым (p=0,047) (табл. 11).
Оценка результатов морфологического исследования после терапии. По данным патоморфологического исследования исходно в группе ФТ+БА достоверно чаще регистрировался очаговый фиброз стромы (42,5% против 15%, p=0,013), однако после терапии этот показатель в группе ФТ+БА снизился до 12,5%, и межгрупповые различия нивелировались. На фоне проведенного лечения в основной группе наблюдалось статистически значимое снижение частоты лимфоидной инфильтрации (с 87,5 до 22,5%) по сравнению с контрольной группой (с 87,5 до 55%, p=0,005) в пролиферативную фазу цикла. Также было выявлено статистически значимое уменьшение лимфоидной инфильтрации в секреторную фазу цикла у пациенток экспериментальной группы (с 90 до 22,5%) по сравнению с участницами контрольной группы (с 87,5 до 52,5%, p=0,010).


Оценка результатов ИГХ после терапии. На фоне лечения в группе, получавшей бовгиалуронидазы азоксимер, в пролиферативную фазу менструального цикла зафиксировано более выраженное снижение: количества плазмоцитов CD138 (p<0,001);
NK-клеток CD56 (p<0,001); В-лимфоцитов CD20 (p<0,001); рис. 7; экспрессии провоспалительного цитокина VEGF (p<0,001) – по сравнению с женщинами контрольной группы. В секреторную фазу цикла в основной группе отмечено: более значимое снижение CD138, CD56 и CD20 (p<0,001); увеличение экспрессии MUC1 (p<0,001); более выраженное снижение экспрессии VEGF (p<0,001) – по сравнению с результатами контрольной группы.
Оценка результатов УЗИ после терапии. Результаты УЗИ органов малого таза с допплерометрией у пациенток с ХЭ без инфекта выявили статистически значимое улучшение параметров маточного кровотока в экспериментальной группе на фоне терапии. В то время как ультразвуковые параметры эндометрия (толщина, неоднородность структуры, эхогенность) сопоставимо улучшились в обеих группах, анализ гемодинамики показал существенные различия. В группе ФТ+БА установлено достоверное: снижение индексов резистентности и пульсации в маточной (p=0,002; p=0,003), дуговой (p=0,003; p=0,006), базальной (p=0,014; p<0,001) и спиральной (p=0,004; p=0,001) артериях; более значимое увеличение максимальной систолической скорости в дуговых (p=0,002), радиальных (p<0,001), базальных (p=0,004) и спиральных (p=0,016) артериях – по сравнению с группой ФТ (табл. 12, рис. 8 и 9).
Результаты оценки безопасности
Во всех четырех группах не зафиксировано нежелательных явлений, связанных с исследуемым препаратом, включая серьезные. Однако в ходе исследования у двух пациенток были зарегистрированы головные боли, не связанные с приемом препарата.
Обсуждение результатов
Таким образом, результаты динамической оценки включенных в исследование пациенток валидны для использования согласно поставленной исследовательской цели оценки эффективности и безопасности бовгиалуронидазы азоксимера для лечения ХЭ у пациенток, страдающих бесплодием маточного происхождения. Одновременно выполненное исследование представляет собой методологически уникальный для исследуемого препарата комплексный подход к оценке его эффективности, который позволяет оценить не только специфичные для ХЭ диагностические параметры, но и характеристики, ассоциированные с имплантационной состоятельностью эндометрия.
При анализе динамики числа CD138+ клеток по данным ИГХ исследования (первичная конечная точка) установили, что во всех группах наблюдалось улучшение после проведенного курса лечения. При этом дополнение базисной терапии лиофилизатом бовгиалуронидазы азоксимера приводило как к статистически достоверному, так и клинически значимому усилению эффективности в обеих когортах. Ранее В.Е. Локшин и соавт. (2023 г.) также продемонстрировали, что подавляющее воздействие на экспрессию клеток CD138+ по результатам использования терапевтических схем с включением бовгиалуронидазы азоксимера регистрировалось значительно чаще, чем без бовгиалуронидазы азоксимера [11]. В настоящем исследовании доля женщин когорты с наличием причинно-значимого инфекта в полости матки, в эндометрии которых по результатам лечения не регистрировались плазматические клетки, достигла 77,5% в основной и 2,5% в контрольной группах соответственно (p<0,001). Эффективность лечения в целом в когорте с отсутствием причинно-значимого инфекта в полости матки, получавшей в качестве базисного лечения только физиотерапию, было значимо ниже. Тем не менее и в этой когорте терапия лиофилизатом бовгиалуронидазы азоксимера позволила добиться клинически значимого снижения числа плазматических клеток до менее 5 в поле зрения (ключевой диагностический критерий) у 70% пациенток, тогда как в контрольной группе данный параметр был зарегистрирован у 40% (p<0,001).
Бовгиалуронидаза азоксимер представляет собой тестикулярную гиалуронидазу, отличительной особенностью которой, по сравнению с тканевыми гиалуронидазами, является способность метаболизировать низкомолекулярную гиалуроновую кислоту, накапливающуюся в очагах хронического воспаления и ответственную за запуск каскада провоспалительных реакций [23–26]. Это приводит к более выраженному снижению уровней провоспалительных цитокинов и пролиферации иммунокомпетентных клеток (в том числе В-лимфоцитов и NK-клеток), что убедительно продемонстрировали результаты ИГХ-анализа биоптатов эндометрия. Так, в обеих когортах добавление бовгиалуронидазы азоксимера к базисной терапии характеризовалось достоверно более низкой степенью экспрессии CD20 и CD56. Также было достигнуто значимое снижение экспрессии ФНО-α.
Снижение концентрации низкомолекулярной гиалуроновой кислоты также влияет на активность процессов фиброзообразования, предотвращая активацию фибробластов и фибробласт-миофибробластный переход. Это ведет к снижению продукции компонентов межклеточного матрикса и уменьшению степени выраженности фиброзирования [24, 27], что соотносится с данными уменьшения индекса резистентности спиральных артерий, полученными в ходе допплерометрического исследования.
В свою очередь, уменьшение выраженности лимфоидной инфильтрации ткани сопровождается снижением уровня ее васкуляризации за счет уменьшения рекрутинга мононуклеаров и соответствующего замедления ангиогенеза в связи со снижением продукции стимулирующих его факторов [23, 24]. В подтверждение этого тезиса в рамках настоящего исследования было показано достоверное более выраженное снижение экспрессии VEGF в группах с бовгиалуронидазы азоксимером.
Таким образом, полученный клинический результат в группах с включением лиофилизата бовгиалуронидазы азоксимера в терапевтическую схему лечения ХЭ опосредован положительным влиянием исследуемого препарата на гуморальный иммунитет и выраженными противовоспалительными и противофиброзными свойствами.
Важным аспектом терапевтического вмешательства при ХЭ является этиотропная антибиотикотерапия, однако ее эффективность в настоящее время неоднозначна [4, 19, 20]. Известно, что воздействие антибиотиков способно провоцировать формирование биопленок. Примечательно, что данный процесс регулируется, прямо или косвенно, сигнальной системой c-di-GMP. Это делает c-di-GMP ключевым регулятором, который управляет переходом бактерий от планктонного к биопленочному образу жизни, что, в свою очередь, определяет характер инфекции – острой или хронической [28]. Включение в терапию методов, разрушающих биопленки, способствует увеличению эффективности антибактериальной терапии. Доказано, что бовгиалуронидаза азоксимер повышает биодоступность антимикробной терапии: благодаря проявлению гиалуронидазной активности фермент разрушает гиалуроновую кислоту, входящую в состав матрикса и оболочки биопленки [26, 29]. Это в, свою очередь, увеличивает эффективность антимикробных средств в ситуации антибиотикорезистентности и повышает шанс на достижение искомого клинического эффекта, что и было продемонстрировано в настоящем исследовании.
Заключение
На основании результатов проведенного исследования было установлено, что на фоне комплексной терапии ХЭ с использованием лиофилизата бовгиалуронидазы азоксимера в дозе 3000 МЕ по схеме 1 раз в 3 дня в течение 1 мес происходит:
• значимое снижение выраженности дисменореи с купированием боли уже в первом цикле после завершения лечения;
• значительное улучшение циркуляции кровеносных сосудов матки (по данным УЗИ с допплерографией);
• снижение, по данным гистероскопии, числа патологических находок, характерных для ХЭ, до 4 раз по сравнению с уровнем до лечения;
• редукция воспалительных морфологических признаков ХЭ вплоть до их полного купирования;
• выраженное снижение маркеров ХЭ, ассоциированных с патологическим лимфоцитарным ответом, в том числе способность приводить к исчезновению плазматических клеток у 2/3 пациенток на фоне приема антимикробных средств в сочетании с физиотерапией, у 1/3 пациенток – при лечении в сочетании с физиотерапией.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Список литературы доступен на сайте журнала https://klin-razbor.ru/
The list of references is available on the journal‘s website https://klin-razbor.ru/
Информация об авторах
Information about the authors
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, академик РАН, д-р мед. наук, проф., зав. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы».
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: radzinsky@mail.ru; ORCID: 0000-0002-7428-0469
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Михалева Людмила Михайловна – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., дир. НИИМЧ им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского»; зав. патологоанатомическим отделением ГБУЗ «ГКБ № 31 им. акад. Г.М. Савельевой ДЗМ». E-mail: mikhalevalm@yandex.ru; ORCID: 0000-0003-2052-914X
Lyudmila M. Mikhaleva – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Prof., Dir. Avtsyn Scientific Research Institute of Human Morphology; City Clinical Hospital No. 31 named after Academician G.M. Savelyeva.
E-mail: mikhalevalm@ yandex.ru; ORCID: 0000-0003-2052-914X
Силантьева Елена Сергеевна – д-р мед. наук, зам. глав. врача, Клинический госпиталь «Лапино» ГК «Мать и Дитя». E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Elena S. Silantyeva – Dr. Sci. (Med.), Deputy Chief doctor, Lapino Clinical Hospital, Mother and Child Group.
E-mail: essdoktor@yandex.ru; ORCID: 0000-0002-7667-3231
Орехов Роман Евгеньевич – канд. мед наук, доц. каф. акушерства и гинекологии с курсом перинатологии, ФГАОУ ВО «РУДН им. Патриса Лумумбы». E-mail: romanorekhovv@ya.ru
Roman E. Orekhov – Cand. Sci. (Med.), Assoc. Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: romanorekhovv@ya.ru
Муллина Ирина Александровна – канд. мед. наук, акушер-гинеколог гинекологического отделения, ЧУЗ «КБ «РЖД-Медицина» им. Н.А. Семашко». E-mail: 211irina2111@gmail.com
Irina A. Mullina – Cand. Sci. (Med.), obstetrician-gynecologist, Semashko Russian Railways-Medicine Clinical Hospital.
E-mail: 211irina2111@gmail.com
Митрелис Рина Юрьевна – аспирант каф. НИИМЧ им. акад. А.П. Авцына, ФГБНУ «Российский научный центр хирургии
им. акад. Б.В. Петровского». E-mail: abelyarrin@yandexl.ru
Rina Yu. Mitrelis – Graduate Student, Avtsyn Scientific Research Institute of Human Morphology. E-mail: abelyarrin@yandexl.ru
Поступила в редакцию: 29.11.2025
Поступила после рецензирования: 03.12.2025
Принята к публикации: 04.12.2025
Received: 29.11.2025
Revised: 03.12.2025
Accepted: 04.12.2025
Список исп. литературыСкрыть список1. Серебренникова К.Г., Арутюнян Н.А., Алехин А.И. Диагностика и клинические критерии хронического эндометрита. Гинекология. 2018;20(6):53-9. DOI: 10.26442/20795696.2018.6.180070
Serebrennikova K.G., Arutyunyan N.A., Alekhine A.I. Diagnostics and clinical criteria of chronic endometritis. Gynecology. 2018;20(6):53-9. DOI: 10.26442/20795696.2018.6.180070 (in Russian).
2. Воспалительные болезни женских тазовых органов. ID: 643. Клинические рекомендации Минздрава России. М.: Российское общество акушеров-гинекологов, 2024.
Inflammatory diseases of the female pelvic organs. ID: 643. Clinical guidelines. Ministry of Health of the Russian Federation. Moscow: Russian Society of Obstetricians and Gynecologists, 2024 (in Russian).
3. Прегравидарная подготовка. Клинический протокол Междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС). Версия 3.0. Коллектив авторов. М.: Редакция журнала StatusPraesens, 2023. ISBN: 978-5-907218-95-6
Pregravid preparation. Clinical protocol of the Interdisciplinary Association of Specialists in Reproductive Medicine (MARS). Version 3.0. The team of authors. M.: StatusPraesens, 2023. ISBN: 978-5-907218-95-6 (in Russian).
4. Cicinelli E, Cicinelli R, Vitagliano A. Antibiotic therapy for chronic endometritis and its reproductive implications: a step forward, with some uncertainties. Fertil Steril 2021;115(6):1445-6. DOI: 10.1016/j.fertnstert.2021.03.025
5. Lee H, Kim J, Choi D et al. P-319 Chronic endometritis prevalence, associated factors and pregnancy outcome among infertile women. Human Reprod 2024;39(Suppl. 1): deae108.684. DOI: 10.1093/humrep/deae108.684
6. Bouet PE, El Hachem H, Monceau E et al. Chronic endometritis in women with recurrent pregnancy loss and recurrent implantation failure: prevalence and role of office hysteroscopy and immunohistochemistry in diagnosis. Fertil Steril 2016;105(1):106-10. DOI: 10.1016/j.fertnstert.2015.09.025
7. Dhatt A, Rozon C, Gale J, Wu C. P-428 Fertility outcomes following treatment of chronic endometritis: a systematic review and meta-analysis. Human Reprod 2022;37(Suppl.1):deac107.405. DOI: 10.1093/humrep/deac107.405
8. Cicinelli E, Resta L, Loizzi V et al. Antibiotic therapy versus no treatment for chronic endometritis: a case-control study. Fertil Steril 2021;115(6):1541-8. DOI: 10.1016/j.fertnstert.2021.01.018
9. Di Pasqua A, Galimberti A, Capitanio E et al. P-322 Chronic endometritis in infertile patients: diagnosis, treatment and follow-up. Human Reprod 2025;40(Suppl.1):deaf097.630. DOI: 10.1093/humrep/ deaf097.630
10. Liu L, Yang H, Guo Y et al. The impact of chronic endometritis on endometrial fibrosis and reproductive prognosis in patients with moderate and severe intrauterine adhesions: a prospective cohort study. Fertil Steril 2019;111(5):1002-10.e2. DOI: 10.1016/j.fertnstert.2019.01. 006
11. Локшин В.Н., Куценко И.И., Боровиков И.О. и др. Хронический эндометрит и инфертильность – исходы экстракорпорального оплодотворения (систематический обзор и метаанализ). Кубанский научный медицинский вестник. 2023;30(5):15-40. DOI: 10.25207/1608-6228-2023-30-5-15-40
Lokshin V.N., Kutsenko I.I., Borovikov I.O. et al. Chronic endometritis and infertility – outcomes of in vitro fertilization (systematic review and meta-analysis). Kuban Scientific Medical Bulletin. 2023;30(5):15-40. DOI: 10.25207/1608-6228-2023-30-5-15-40 (in Russian).
12. McQueen DB, Perfetto CO, Hazard FK, Lathi RB. Pregnancy outcomes in women with chronic endometritis and recurrent pregnancy loss. Fertil Steril 2015;104(4):927-31. DOI: 10.1016/j.fertnstert.2015.06.044
13. Cicinelli E, Vitagliano A, Kumar A et al. Unified diagnostic criteria for chronic endometritis at fluid hysteroscopy: proposal and reliability evaluation through an international randomized-controlled observer study. Fertil Steril 2019;112(1):162-73.e2. DOI: 10.1016/ j.fertnstert.2019.03.004
14. Furui M, Ito A, Fukuda Y et al. Endometrial congestion is the only hysteroscopic finding indicative of chronic endometritis. Bashir MS, редактор. PLoS ONE 2024;19(6):e0303041. DOI: 10.1371/ journal.pone.0303041
15. Moreno I, Cicinelli E, Garcia-Grau I et al. The diagnosis of chronic endometritis in infertile asymptomatic women: a comparative study of histology, microbial cultures, hysteroscopy, and molecular microbiology. Am J Obstetrics Gynecol 2018;218(6):602.e1-602.e16. DOI: 10.1016/j.ajog.2018.02.012
16. Cicinelli E, Di Gennaro F, Gesario A et al. Increasing Antimicrobial Resistance to First-Line Therapies in Chronic Endometritis: A 2020–2024 Cross-Sectional Study. JCM 2025;14(14):4873. DOI: 10.3390/jcm14144873
17. Kitaya K, Takeuchi T, Mizuta S et al. Endometritis: new time, new concepts. Fertil Steril 2018;110(3):344-50. DOI: 10.1016/j.fertnstert. 2018.04.012
18. Yoneda E, Kim S, Tomita K et al. Evaluation of Lipopolysaccharide and Interleukin-6 as Useful Screening Tool for Chronic Endometritis. IJMS 2024;25(4):2017. DOI: 10.3390/ijms25042017
19. Liu Y, Zhao Z, Jiang X et al. Doxycycline vs levofloxacin combined with tinidazole for treating chronic endometritis: a randomized controlled trial. Am J Obstetrics Gynecol 2025;S0002937825005253. DOI: 10.1016/j.ajog.2025.07.045
20. Song D, He Y, Wang Y et al. Impact of antibiotic therapy on the rate of negative test results for chronic endometritis: a prospective randomized control trial. Fertil Steril 2021;115(6):1549-56. DOI: 10.1016/j.fertnstert.2020.12.019
21. Khalenko V, Obedkova KV, Tapilskaya NI et al. O-196 New Approaches to the Treatment of Chronic Endometritis: Evaluating the Effectiveness of Intrauterine Irrigations with PBMC, G-CSF, Stem Cells. Human Reprod 2025;40(Suppl.1):deaf097.196. DOI: 10.1093/humrep/deaf097. 196
22. Zhylkova E, Feskov O, Konoplya L et al. O-207 Administration of umbilical cord blood and placenta in the treatment of chronic endometritis in repeated implantation failures patients. Human Reprod 2025;40(Suppl.1):deaf097.207. DOI: 10.1093/humrep/deaf097.207
23. Wang, Xiaoyun Liu, Xiaojun Li et al. Exploring the Relationship between Hyaluronic Acid Size and Biological Activity: A Review. DOI: 10.2139/ssrn.5090479
24. Jiamin Lu, Zheng Zhao, Lingli Pan et al. Hyaluronidase: structure, mechanism of action, diseases and therapeutic targets. Molecular Biomedicine 2025;(6:50). DOI: 10.1186/s43556-025-00299-y
25. Ruppert SM, Hawn TR, Arrigoni A et al. Tissue integrity signals communicated by highmolecular weight hyaluronan and the resolution of inflammation. Stanford Immunology 2014. DOI: 10.1007/s12026-014-8495-2
26. Общая характеристика лекарственного препарата. Инструкция к применению препарата Лонгидаза. №009588 от 04.04.2025.
General characteristics of the medicinal product. Instructions for the use of the drug Longidase. No. 009588 dated 04/04/2025 (in Russian).
27. Tai Y, Woods EL, Dally J et al. Myofibroblasts: Function, Formation, and Scope of Molecular Therapies for Skin Fibrosis. Biomolecules 2021;11(8):1095. DOI: 10.3390/biom11081095
28. Тапильская Н.И., Копылова А.А., Будиловская О.В. и др. Оценка эффективности применения бовгиалуронидаза азоксимера в лечении хронического эндометрита у женщин с неудачами имплантации. Женская Клиника. 2020;(2):66-72.
Tapilskaya N.I., Kopylova A.A., Budilovskaya O.V. et al. Evaluation of the effectiveness of the use of bovgialuronidase azoximer in the treatment of chronic endometritis in women with implantation failures. Women's Clinic. 2020;(2):66-72. (in Russian).
29. Тризна Е.Ю., Байдамшина Д.Р., Каюмов А.Р. Влияние in vitro изолированного и сочетанного с антибактериальными средствами применения бовгиалуронидазы азоксимера на целостность бактериальной биопленки и жизнеспособность микроорганизмов. Экспериментальная и клиническая фармакология. 2020;83(2):38-44.
Trizna E.Yu., Baydamshina D.R., Kayumov A.R. The effect of in vitro isolated and combined with antibacterial agents of the use of bovgialuronidase azoximer on the integrity of bacterial biofilm and the viability of microorganisms. Experimental and clinical pharmacology. 2020;83(2):38-44 (in Russian).


