Клинический разбор в общей медицине №01 2020
1People’s Friendship University of Russia, Moscow, Russia;
2Bashlyaeva Children City Clinical Hospital, Moscow, Russia anait_tamrazova@mail.ru
Abstract
Mastocytosis is a heterogeneous group of neoplasms characterized by increased mast cells proliferation and accumulation in various organs and tissues. The paper introduces the newest mastocytosis classification and diagnosis principles. Each type of cutaneous mastocytosis is discussed separately, with the recommendations for the affected patients’ management. The paper reports the typical mastocytosis manifestations in a 1(1/2)-year-old infant.
Key words: mastocytosis, classification, diagnosis, case report.
For citation: Tamrazova O.B., Glukhova E.A. Cutaneous types of mastocytosis in paediatry. Case report of maculopapular cutaneous mastocytosis in an infant. Clinical review for general practice. 2020; 1: 60–66. DOI: 10.47407/kr2020.1.1.00009
Мастоцитоз (МЦ) – редкое заболевание, которое представляет собой разнообразную группу неопластических состояний, с характерной пролиферацией тучных клеток (ТК) в коже, а при некоторых формах (более типичных для взрослого возраста) и в костном мозге, лимфатических органах и других системах организма [1].
Первое описание типичных кожных проявлений МЦ опубликовано в 1869 г. Е. Nettleship и W. Tay, тогда ученые отнесли заболевание к хронической крапивнице, оставляющей после себя бурые пятна [2]. В 1878 г. A. Sangster предложил обозначение «пигментная крапивница» [3], а в 1953 г. R. Degos ввел термин «мастоцитоз». В течение многих лет МЦ считался исключительно заболеванием кожи, однако в 1949 г. впервые был описан случай системного МЦ [4].
В зависимости от распространенности процесса и объема вовлеченных тканей принято выделять кожный и системный МЦ [5]. В первом случае уровень поражений ограничивается только кожей, такая форма наиболее характерна для детей, в подавляющем большинстве случаев имеет доброкачественной течение, проходит к подростковому возрасту и является самой частой. Во втором случае вовлекаются внутренние органы (костный мозг, лимфатические узлы, селезенка, желудочно-кишечный тракт), такое состояние отмечается у взрослых пациентов и относится к группе орфанных заболеваний [6]. Частота встречаемости МЦ достигает 1:10 000, однако можно предположить более высокие значения показателя, ввиду недостаточной диагностики данной патологии [7].
Этиология. Несмотря на явную взаимосвязь с генетическими факторами, вопрос этиологии до конца не изучен.
В первую очередь остается непонятным транзиторный характер МЦ у детей при наличии мутации [8]. Развитие МЦ у взрослых связывают с наличием специфических мутаций генов, которые носят спорадический характер, но могут встречаться и семейные случаи заболевания [9].
Патогенез. Центральным звеном патогенеза МЦ является ТК, при дегрануляции которой происходит выброс большого количества медиаторов воспаления, цитокинов и продуктов жирового обмена [10]. В норме данная реакция относится к защитным механизмам, однако при МЦ носит гиперрегичекий характер. Отмечается как IgE-опосредованный, так и неиммунный механизм дегрануляции, триггерами в этом случае могут выступать фрагменты комплемента, цитокины, нейропептиды, биологически активные компоненты яда насекомых, а также ряд физических и химических факторов [11].
Нормальное развитие ТК требует взаимодействия между фактором роста ТК (stem cell factor, SCF) и рецепторами c-KIT, которые экспрессируются на мембране ТК и являются протоонкогенами. SCF стимулирует пролиферацию ТК и предотвращает преждевременный апоптоз. При МЦ выявлены мутации белка c-KIT, которые приводят к усилению эффекта при взаимодействии с SCF, как результат – гиперпролиферация ТК, увеличение длительности их жизни и чрезмерной дегрануляции. Помимо этого, взаимодействие фактора роста и протоонкогенов c-KIT, обнаруженных на мембране меланоцитов, приводит к стимуляции их пролиферации и избыточному синтезу меланина, что объясняет явление пигментации элементов МЦ [10].
У 90% взрослых с МЦ обнаружена специфическая мутация c-KIT D816V, тогда как дети с МЦ имеют идентичную мутацию c-KIT примерно в 35% случаев, у 40–50% детей выявляются другие мутации гена c-KIT, в остальных случаях не обнаружено генетических нарушений [12, 13].
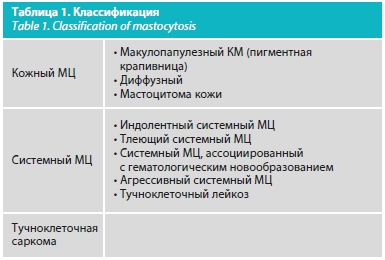 В современной классификации МЦ, принятой Всемирной организацией здравоохранения в 2016 г. (табл. 1), выделены 2 большие группы, принципиально различные по возрасту дебюта, объему поражений и прогнозам заболевания [14]. Кожный МЦ встречается чаще системного и представлен тремя клиническими формами: пятнисто-папулезный (более известный как пигментная крапивница), диффузный МЦ и мастоцитома. До классификации 2016 г. к кожной форме МЦ также относили telangiectasia macularis eruptiva perstans (TEMP, или телеангиэктазия пятнистая эруптивная персистирующая), для которой характерно помимо типичных красно-бурых пятен наличие телеангиэктазий на коже шеи, груди, плечах и верхней трети груди, встречается чаще у взрослых женщин [15]. На данный момент это состояние решено не выделять в отдельную клиническую форму, так как его связывают с индивидуальными особенностями васкуляризации кожи, которые не имеют клинического значения и прогностической важности. К системным МЦ относят: индолентный системный МЦ; тлеющий системный МЦ; системный МЦ, ассоциированный с гематологическим новообразованием; агрессивный системный МЦ; тучноклеточный лейкоз [12].
В современной классификации МЦ, принятой Всемирной организацией здравоохранения в 2016 г. (табл. 1), выделены 2 большие группы, принципиально различные по возрасту дебюта, объему поражений и прогнозам заболевания [14]. Кожный МЦ встречается чаще системного и представлен тремя клиническими формами: пятнисто-папулезный (более известный как пигментная крапивница), диффузный МЦ и мастоцитома. До классификации 2016 г. к кожной форме МЦ также относили telangiectasia macularis eruptiva perstans (TEMP, или телеангиэктазия пятнистая эруптивная персистирующая), для которой характерно помимо типичных красно-бурых пятен наличие телеангиэктазий на коже шеи, груди, плечах и верхней трети груди, встречается чаще у взрослых женщин [15]. На данный момент это состояние решено не выделять в отдельную клиническую форму, так как его связывают с индивидуальными особенностями васкуляризации кожи, которые не имеют клинического значения и прогностической важности. К системным МЦ относят: индолентный системный МЦ; тлеющий системный МЦ; системный МЦ, ассоциированный с гематологическим новообразованием; агрессивный системный МЦ; тучноклеточный лейкоз [12].
Основная задача дерматовенеролога диагностировать МЦ, а также дифференцировать кожный и системный МЦ между собой: при наличии признаков системного МЦ направить пациента на консультацию к гематологу для подтверждения диагноза и определения тактики лечения, при исключении явлений системных форм – динамическое наблюдение пациента и назначение симптоматической терапии по необходимости.
Диагностика. Для всех форм МЦ характерно наличие высыпаний (исключением является системный МЦ без поражения кожи). Для первичных элементов патогномоничным является положительный феномен Дарье–Унны, который заключается в высвобождении медиаторов воспаления из ТК при механическом раздражении (трение шпателем пятна или папулы в течение 10–20 с). При этом в течение 1 мин наблюдается образование волдыря (отек и покраснение элемента при отсутствии реакции окружающей здоровой кожи, что отличает данный феномен от явлений дермографизма) [12].
В ходе клинических исследований определено два пика заболеваемости: 55% случаев заболевания наблюдается в возрасте до 6 мес, 35% приходится на возраст 20–40 лет [16]. Как было отмечено раннее, для взрослого населения характерны системные формы, а для детей – кожные. Поэтому для пациентов в возрасте после 18 лет необходимо комплексное обследование, которое включает: определение уровня сывороточной триптазы в крови, костномозговую пункцию [определение реакции на триптазу и/или обнаружение KIT-мутации; иммунофенотипирование ТК (CD25+ и/или CD2+)], генетическое исследование клеток крови и пораженных органов на наличие KIT-мутации.
Критерием постановки диагноза «системный МЦ» является наличие 1 большого и 1 малого критерия или 3 малых критериев (табл. 2) [14].

В дерматологической практике всем пациентам, независимо от возраста, необходимо исследование крови для определения уровня сывороточной триптазы. У взрослого при уровне сывороточной триптазы >20 нг/мл требуется консультация гематолога для проведения диагностических процедур. У детей показатель обычно находится в пределах нормы, однако при выраженных кожных проявлениях может наблюдаться значительное повышение сывороточной триптазы с последующим снижением до референсных значений в течение 1–2 лет [12, 17–20]. Есть мнение, что у детей при уровне сывороточной триптазы >100 нг/мл необходимо проведение биопсии костного мозга [21].
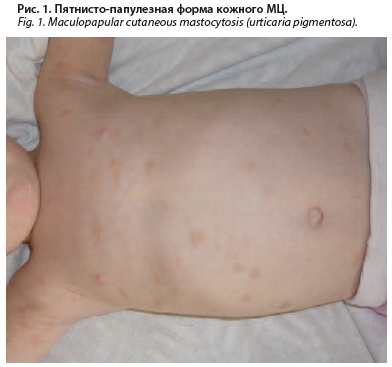 Пятнисто-папулезная форма кожного МЦ (ППКМ), более известная как «пигментная крапивница», имеет распространенный характер в виде пятен или папул округлых очертаний от желтого до красно-коричневого цвета. В зависимости от размеров элементов, их однородности и локализации принято выделять две группы: полиморфный и мономорфный ППКМ [12, 20] (рис. 1).
Пятнисто-папулезная форма кожного МЦ (ППКМ), более известная как «пигментная крапивница», имеет распространенный характер в виде пятен или папул округлых очертаний от желтого до красно-коричневого цвета. В зависимости от размеров элементов, их однородности и локализации принято выделять две группы: полиморфный и мономорфный ППКМ [12, 20] (рис. 1).
А) Полиморфный ППКМ. Чаще всего данное состояние наблюдается у детей, проявляется в первые 6 мес жизни или с рождения в виде пигментных папул [12, 22]. С течением времени они могут претерпевать изменения с развитием пузырей при сильном раздражении, бляшек в более позднем возрасте и пятен в исходе заболевания. Чаще элементы разрешаются полностью, реже – с развитием очагов атрофии, напоминающих анетодермию. Для полиморфного ППКМ характерен ассиметричный характер высыпаний с возможным вовлечением всех участков тела (кожи туловища, головы и конечностей, за исключением кожи лица). Данное состояние носит доброкачественный характер, в большинстве случаев самостоятельно разрешается к пубертату и не связано с развитием системного МЦ [12]. Уровень сывороточной триптазы в крови, как правило, в пределах нормы или незначительно повышен [12, 18–20]. Дети с полиморфным ППКМ нормально переносят вакцинацию, в редких случаях при распространенном процессе может наблюдаться аллергическая реакция [22].
Б) Мономорфный ППКМ. Зачастую мономорфный ППКМ, в отличие от полиморфного, дебютирует во взрослом возрасте с высыпаний на коже нижней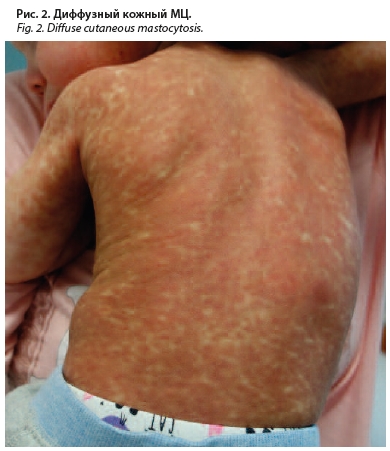 части живота и бедер, которые могут медленно распространяться на туловище, верхние и нижние конечности. Сыпь представлена округлыми гладкими папулами, размерами 2–5 мм, чуть возвышающимися над поверхностью здоровой кожи, цвет может варьировать от желтого до коричневого [23, 24].
части живота и бедер, которые могут медленно распространяться на туловище, верхние и нижние конечности. Сыпь представлена округлыми гладкими папулами, размерами 2–5 мм, чуть возвышающимися над поверхностью здоровой кожи, цвет может варьировать от желтого до коричневого [23, 24].
В 95% случаев у взрослого населения данное состояние ассоциировано с системным МЦ [23, 25]. В редких случаях клиническую картину мономорфного ППКМ можно встретить у детей, при этом определяется стойкое повышение уровня сывороточной триптазы в крови [20, 26]. Как правило, такие дети имеют тенденцию к хронизации процесса, а значит, требуют настороженности по поводу системных форм МЦ [12].
Диффузный кожный мастоцитоз (ДКМ) – редкое состояние, характеризующееся наличием крупных лихенифицированных зудящих очагов желто-коричневого, коричневого или красно-коричневого цвета неправильной формы с нечеткими границами (рис. 2). Первые высыпания локализуются в крупных складках, далее процесс может распространяться и приобретать генерализованный характер вплоть до развития эритродермии [27]. Механическое раздражение, укус насекомого или повышение температуры тела может привести к образованию крупных пузырей, заполненных серозным или геморрагическим содержимым, поэтому проведение пробы на наличие феномена Дарье–Унны нежелательно [28, 29]. Тенденция к эпидермолизу обычно снижается в первые 3–4 года от начала заболевания, которое зачастую приходится на первые месяцы жизни [12]. На ранних этапах отмечается повышенный уровень сывороточной триптазы (может быть >100 мг/л), со временем показатель снижается до нормальных значений. Как и полиморфный ППКМ, ДКМ имеет транзиторный характер с разрешением процесса к подростковому возрасту [12, 28, 30].
Мастоцитома. Самая распространенная и доброкачественная форма среди трех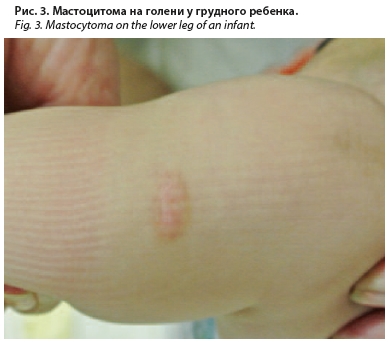 перечисленных, диагностируется в 65% случаев кожного МЦ [31]. В первые месяцы от рождения на коже ребенка появляется одиночная папула желтого, оранжевого или светло-коричневого цвета. Для нее характерны округлая или овальная форма, четкие границы, гладкая или морщинистая, как «апельсиновая корка», поверхность, также может наблюдаться образование везикулы в центре элемента при травматизации, расчесах или при проведении пробы на наличие феномена Дарье–Унны (рис. 3, 4). Папула со временем может увеличиваться до 2–5 см в диаметре, а затем спонтанно регрессировать. В редких случаях на коже могут встречаться несколько подобных элементов, тогда при наличии 4 и более папул принято классифицировать состояние как ППКМ [12].
перечисленных, диагностируется в 65% случаев кожного МЦ [31]. В первые месяцы от рождения на коже ребенка появляется одиночная папула желтого, оранжевого или светло-коричневого цвета. Для нее характерны округлая или овальная форма, четкие границы, гладкая или морщинистая, как «апельсиновая корка», поверхность, также может наблюдаться образование везикулы в центре элемента при травматизации, расчесах или при проведении пробы на наличие феномена Дарье–Унны (рис. 3, 4). Папула со временем может увеличиваться до 2–5 см в диаметре, а затем спонтанно регрессировать. В редких случаях на коже могут встречаться несколько подобных элементов, тогда при наличии 4 и более папул принято классифицировать состояние как ППКМ [12].
Лечение. ДКМ имеет благоприятный прогноз с самостоятельным разрешением, поэтому не требует серьезного лечения. Однако важным пунктом контроля кожных форм МЦ является исключение из жизни триггерных факторов дегрануляции ТК, под действием которых развивается отек, покраснение высыпаний вплоть до образований пузырей. К таким факторам относятся холод, тепло, механическое раздражение, лекарственные препараты, укусы насекомых и т.д. [23].
В том случае, если пациент с ППКМ или ДКМ страдает от зуда или когда действие внешних факторов неизбежно или состоялось, необходимо назначение симптоматической терапии. В первую очередь к ней относятся антигистаминные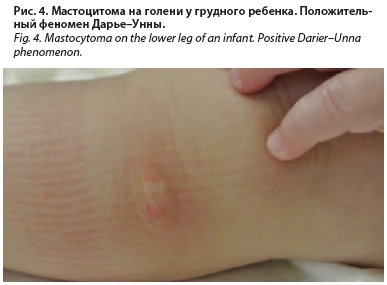 препараты II поколения, а при наличии проблем со сном – I поколения [32]. Также возможно назначение стабилизаторов мембран ТК (кетотифен, кромогликат натрия) или антидепрессантов с противозудным действием. Перечисленные группы препаратов рекомендованы к применению на длительный срок [33].
препараты II поколения, а при наличии проблем со сном – I поколения [32]. Также возможно назначение стабилизаторов мембран ТК (кетотифен, кромогликат натрия) или антидепрессантов с противозудным действием. Перечисленные группы препаратов рекомендованы к применению на длительный срок [33].
У пациентов с ДКМ или распространенным ППКМ не исключена массивная дегрануляция ТК с выбросом огромного количества медиаторов воспаления в кровоток с последующим развитием не только кожной симптоматики, но и системных проявлений в виде спазмов желудочно-кишечного тракта, диареи, одышки, головной боли и анафилактической реакции [28, 34, 35]. В таких случаях требуется назначение коротким курсом глюкокортикостероидов в виде инъекций [6, 36].
Назначение топических глюкокортикостероидов пациентам с мастоцитомой приводит к хорошим результатам, зачастую наблюдается полное разрешение бляшек [6, 37].
Из немедикаментозных методов лечения стоит выделить фототерапию: пациенты после пребывания на солнце отмечают уменьшение зуда, устойчивость к действию факторов внешней среды, а при ДКМ истончение лихенифицированных очагов [33]. Описаны положительные результаты со стороны кожных проявлений при применении ПУВА-терапии у взрослых пациентов с системными формами МЦ [38].
 Родители ребенка С. (возраст 1 год 6 мес) обратились в консультативно-диагностическое отделение ДГКБ им. З.А. Башляевой в октябре 2018 г. с жалобами на многочисленные высыпания на коже туловища и конечностей. Жалоб на зуд элементов, а также боли в животе и жидкий стул родители не предъявляли.
Родители ребенка С. (возраст 1 год 6 мес) обратились в консультативно-диагностическое отделение ДГКБ им. З.А. Башляевой в октябре 2018 г. с жалобами на многочисленные высыпания на коже туловища и конечностей. Жалоб на зуд элементов, а также боли в животе и жидкий стул родители не предъявляли.
Из анамнеза известно, что ребенок родился от 1-й беременности, самостоятельных родов на 40-й неделе. Ранний анамнез без особенностей. Семейный анамнез не отягощен.
С июля 2018 г. родители стали замечать появление пигментированных пятен на коже у мальчика, которые имели тенденцию к постепенному распространению, количество пятен постепенно увеличивалось. При трении элементов одеждой и на фоне лихорадки (при острой респираторной вирусной инфекции) некоторые пятна меняли цвет и становились розовыми и отечными. Самочувствие ребенка, по оценке матери, хорошее. Самостоятельно родители местно на пятна применяли цинковую пасту и увлажняющие кремы. Разными педиатрами по месту жительства ранее были выставлены следующие диагнозы: атопический дерматит неуточненный, позднее был заподозрен нейрофиброматоз. По поводу атопического дерматита была назначена терапия антигистаминными препаратами (капли Фенистил) и местно назначался 1% крем пимекролимуса без эффекта. Мальчик был проконсультирован у невропатолога, который не подтвердил диагноз нейрофиброматоз (болезнь Реклингхаузена).
 Status рraesens: состояние удовлетворительное. Нормального телосложения, нормального питания. Носовое дыхание свободное. Зев умеренно гиперемирован, без налетов. Миндалины увеличены до 1-й степени, наложения отсутствуют. В легких дыхание пуэрильное, проводится во всех отделах, хрипов нет. Тоны сердца громкие, ритм правильный, шумы отсутствуют. Язык влажный, не обложен. Живот не вздут, мягкий, доступен глубокой пальпации, болезненный в области эпигастрия. Печень у края реберной дуги. Селезенка не пальпируется. Стул оформленный до 1 раза в 2–3 суток, примеси отсутствуют. Мочеиспускание безболезненное. Симптом поколачивания отрицательный. Отеков нет. Сознание ясное. Менингеальные и очаговые симптомы отрицательны.
Status рraesens: состояние удовлетворительное. Нормального телосложения, нормального питания. Носовое дыхание свободное. Зев умеренно гиперемирован, без налетов. Миндалины увеличены до 1-й степени, наложения отсутствуют. В легких дыхание пуэрильное, проводится во всех отделах, хрипов нет. Тоны сердца громкие, ритм правильный, шумы отсутствуют. Язык влажный, не обложен. Живот не вздут, мягкий, доступен глубокой пальпации, болезненный в области эпигастрия. Печень у края реберной дуги. Селезенка не пальпируется. Стул оформленный до 1 раза в 2–3 суток, примеси отсутствуют. Мочеиспускание безболезненное. Симптом поколачивания отрицательный. Отеков нет. Сознание ясное. Менингеальные и очаговые симптомы отрицательны.
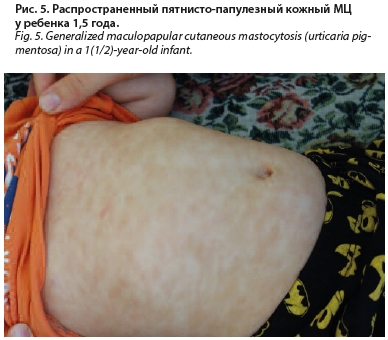
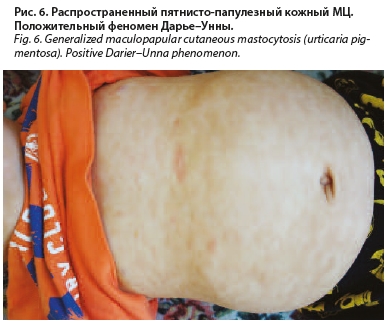
Status localis: патологический кожный процесс носит распространенный характер. Высыпания представлены многочисленными мономорфными пигментными пятнами розово-коричневого цвета размером от 5–10 мм в диаметре, расположенными на коже туловища, лица и конечностях (рис. 5). При проведении граттажа (растирания шпателем) элементов отмечается положительный симптом Дарье–Унны (рис. 6).
Заключение дерматовенеролога: МЦ (кожная пятнисто-папулезная форма). Рекомендовано проведение следующих исследований: общий анализ крови, биохимический анализ крови и мочи, определение уровня сывороточной триптазы в крови, медико-генетическое типирование, рентгенография позвоночника, ультразвуковая диагностика органов брюшной полости.
Результаты исследований: общий анализ крови, биохимический анализ крови и мочи – значения в референсных пределах. По данным ультразвукового исследования органов брюшной полости, рентгенографии позвоночника патологии не выявлено. Анализ уровня сывороточной триптазы в крови: 9,07 мкг/л (норма до 11 мкг/л). Медико-генетическое типирование не выявило мутации гена c-KIT.
Рекомендовано обязательное исключение воздействия триггерных факторов (купание в горячей воде, перегрев ребенка, инсоляции и механическое раздражение предметами одежды), а также ограничение приема или полный отказ от лекарственных препаратов: нестероидных противовоспалительных препаратов, кодеина (в средствах от кашля), неомицина, тиамина, рентгеноконтрастных йодсодержащих веществ, хлорахина и др. Максимальная защита репеллентами ребенка от укусов насекомых.
Назначена специфическая диета с максимальным исключением из рациона продуктов, способствующих высвобождению гистамина: малины, клубники и других ягод, редиски, шпината, пасленовых, сыров, газированных напитков, консервов и т.д.
При появлении отечных элементов рекомендовано местное применение коротким курсом метилпреднизолона ацепоната и антигистаминных препаратов перорально.
Динамическое наблюдение 1 раз в полгода у дерматолога.
Заключение. Кожные формы МЦ (пигментная крапивница) нередко встречаются в детской практике. Практически всегда диагностика педиатрами данного заболевания вызывает сложности и ошибки.
Высыпания при кожных формах МЦ выявляются в первые месяцы жизни ребенка, характеризуются благоприятным течением с самостоятельным разрешением к подростковому возрасту. Основной рекомендацией для пациентов с кожными формами является исключение триггерных факторов дегрануляции ТК, в распространенных случаях включает в себя прием антигистаминных препаратов и местное назначение кортикостероидных средств коротким курсом.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Тамразова Ольга Борисовна – д-р мед. наук, проф. каф. дерматовенерологии с курсом косметологии факультета непрерывного медицинского образования медицинского института ФГАОУ ВО РУДН; врач-консультант ГБУЗ «ДГКБ им. З.А. Башляевой». E-mail: anait_tamrazova@mail.ru
Olga B. Tamrazova – D. Sci. (Med.), Prof., People’s Friendship University of Russia, Bashlyaeva Children City Clinical Hospital. E-mail: anait_tamrazova@mail.ru
Глухова Евгения Александровна – врач-ординатор кафедры дерматовенерологии с курсом косметологии факультета непрерывного медицинского образования медицинского института ФГАОУ ВО РУДН
Evgeniya A. Glukhova – Medical Resident, People’s Friendship University of Russia
Статья поступила в редакцию / The article received: 24.06.2020
Статья принята к печати / The article approved for publication: 10.07.2020
Клинический разбор в общей медицине №01 2020
Кожные формы мастоцитоза в детской практике. Клиническое наблюдение пятнисто-папулезной формы мастоцитоза у грудного ребенка
Номера страниц в выпуске:60-66
Аннотация
Мастоцитоз (МЦ) – представляет собой группу гетерогенных неопластических состояний, характеризующихся повышенной пролиферацией и накоплением тучных клеток в различных органах и тканях. В данной статье представлены новейшая классификация МЦ и принципы диагностики. Отдельно рассмотрена каждая форма кожного МЦ с рекомендациями по ведению пациентов с данным состоянием. В статье приведен клинический пример типичного проявления МЦ у полуторагодовалого ребенка.
Ключевые слова: мастоцитоз, классификация, диагностика, клинический пример.
Для цитирования: Тамразова О.Б., Глухова Е.А. Кожные формы мастоцитоза в детской практике. Клиническое наблюдение пятнисто-папулезной формы мастоцитоза у грудного ребенка. Клинический разбор в общей медицине. 2020; 1: 60–66. DOI: 10.47407/ kr2020.1.1.00009
Мастоцитоз (МЦ) – представляет собой группу гетерогенных неопластических состояний, характеризующихся повышенной пролиферацией и накоплением тучных клеток в различных органах и тканях. В данной статье представлены новейшая классификация МЦ и принципы диагностики. Отдельно рассмотрена каждая форма кожного МЦ с рекомендациями по ведению пациентов с данным состоянием. В статье приведен клинический пример типичного проявления МЦ у полуторагодовалого ребенка.
Ключевые слова: мастоцитоз, классификация, диагностика, клинический пример.
Для цитирования: Тамразова О.Б., Глухова Е.А. Кожные формы мастоцитоза в детской практике. Клиническое наблюдение пятнисто-папулезной формы мастоцитоза у грудного ребенка. Клинический разбор в общей медицине. 2020; 1: 60–66. DOI: 10.47407/ kr2020.1.1.00009
Cutaneous types of mastocytosis in paediatry. Case report of maculopapular cutaneous mastocytosis in an infant
Olga B. Tamrazova1, Evgeniya A. Glukhova21People’s Friendship University of Russia, Moscow, Russia;
2Bashlyaeva Children City Clinical Hospital, Moscow, Russia anait_tamrazova@mail.ru
Abstract
Mastocytosis is a heterogeneous group of neoplasms characterized by increased mast cells proliferation and accumulation in various organs and tissues. The paper introduces the newest mastocytosis classification and diagnosis principles. Each type of cutaneous mastocytosis is discussed separately, with the recommendations for the affected patients’ management. The paper reports the typical mastocytosis manifestations in a 1(1/2)-year-old infant.
Key words: mastocytosis, classification, diagnosis, case report.
For citation: Tamrazova O.B., Glukhova E.A. Cutaneous types of mastocytosis in paediatry. Case report of maculopapular cutaneous mastocytosis in an infant. Clinical review for general practice. 2020; 1: 60–66. DOI: 10.47407/kr2020.1.1.00009
Мастоцитоз (МЦ) – редкое заболевание, которое представляет собой разнообразную группу неопластических состояний, с характерной пролиферацией тучных клеток (ТК) в коже, а при некоторых формах (более типичных для взрослого возраста) и в костном мозге, лимфатических органах и других системах организма [1].
Первое описание типичных кожных проявлений МЦ опубликовано в 1869 г. Е. Nettleship и W. Tay, тогда ученые отнесли заболевание к хронической крапивнице, оставляющей после себя бурые пятна [2]. В 1878 г. A. Sangster предложил обозначение «пигментная крапивница» [3], а в 1953 г. R. Degos ввел термин «мастоцитоз». В течение многих лет МЦ считался исключительно заболеванием кожи, однако в 1949 г. впервые был описан случай системного МЦ [4].
В зависимости от распространенности процесса и объема вовлеченных тканей принято выделять кожный и системный МЦ [5]. В первом случае уровень поражений ограничивается только кожей, такая форма наиболее характерна для детей, в подавляющем большинстве случаев имеет доброкачественной течение, проходит к подростковому возрасту и является самой частой. Во втором случае вовлекаются внутренние органы (костный мозг, лимфатические узлы, селезенка, желудочно-кишечный тракт), такое состояние отмечается у взрослых пациентов и относится к группе орфанных заболеваний [6]. Частота встречаемости МЦ достигает 1:10 000, однако можно предположить более высокие значения показателя, ввиду недостаточной диагностики данной патологии [7].
Этиология. Несмотря на явную взаимосвязь с генетическими факторами, вопрос этиологии до конца не изучен.
В первую очередь остается непонятным транзиторный характер МЦ у детей при наличии мутации [8]. Развитие МЦ у взрослых связывают с наличием специфических мутаций генов, которые носят спорадический характер, но могут встречаться и семейные случаи заболевания [9].
Патогенез. Центральным звеном патогенеза МЦ является ТК, при дегрануляции которой происходит выброс большого количества медиаторов воспаления, цитокинов и продуктов жирового обмена [10]. В норме данная реакция относится к защитным механизмам, однако при МЦ носит гиперрегичекий характер. Отмечается как IgE-опосредованный, так и неиммунный механизм дегрануляции, триггерами в этом случае могут выступать фрагменты комплемента, цитокины, нейропептиды, биологически активные компоненты яда насекомых, а также ряд физических и химических факторов [11].
Нормальное развитие ТК требует взаимодействия между фактором роста ТК (stem cell factor, SCF) и рецепторами c-KIT, которые экспрессируются на мембране ТК и являются протоонкогенами. SCF стимулирует пролиферацию ТК и предотвращает преждевременный апоптоз. При МЦ выявлены мутации белка c-KIT, которые приводят к усилению эффекта при взаимодействии с SCF, как результат – гиперпролиферация ТК, увеличение длительности их жизни и чрезмерной дегрануляции. Помимо этого, взаимодействие фактора роста и протоонкогенов c-KIT, обнаруженных на мембране меланоцитов, приводит к стимуляции их пролиферации и избыточному синтезу меланина, что объясняет явление пигментации элементов МЦ [10].
У 90% взрослых с МЦ обнаружена специфическая мутация c-KIT D816V, тогда как дети с МЦ имеют идентичную мутацию c-KIT примерно в 35% случаев, у 40–50% детей выявляются другие мутации гена c-KIT, в остальных случаях не обнаружено генетических нарушений [12, 13].
 В современной классификации МЦ, принятой Всемирной организацией здравоохранения в 2016 г. (табл. 1), выделены 2 большие группы, принципиально различные по возрасту дебюта, объему поражений и прогнозам заболевания [14]. Кожный МЦ встречается чаще системного и представлен тремя клиническими формами: пятнисто-папулезный (более известный как пигментная крапивница), диффузный МЦ и мастоцитома. До классификации 2016 г. к кожной форме МЦ также относили telangiectasia macularis eruptiva perstans (TEMP, или телеангиэктазия пятнистая эруптивная персистирующая), для которой характерно помимо типичных красно-бурых пятен наличие телеангиэктазий на коже шеи, груди, плечах и верхней трети груди, встречается чаще у взрослых женщин [15]. На данный момент это состояние решено не выделять в отдельную клиническую форму, так как его связывают с индивидуальными особенностями васкуляризации кожи, которые не имеют клинического значения и прогностической важности. К системным МЦ относят: индолентный системный МЦ; тлеющий системный МЦ; системный МЦ, ассоциированный с гематологическим новообразованием; агрессивный системный МЦ; тучноклеточный лейкоз [12].
В современной классификации МЦ, принятой Всемирной организацией здравоохранения в 2016 г. (табл. 1), выделены 2 большие группы, принципиально различные по возрасту дебюта, объему поражений и прогнозам заболевания [14]. Кожный МЦ встречается чаще системного и представлен тремя клиническими формами: пятнисто-папулезный (более известный как пигментная крапивница), диффузный МЦ и мастоцитома. До классификации 2016 г. к кожной форме МЦ также относили telangiectasia macularis eruptiva perstans (TEMP, или телеангиэктазия пятнистая эруптивная персистирующая), для которой характерно помимо типичных красно-бурых пятен наличие телеангиэктазий на коже шеи, груди, плечах и верхней трети груди, встречается чаще у взрослых женщин [15]. На данный момент это состояние решено не выделять в отдельную клиническую форму, так как его связывают с индивидуальными особенностями васкуляризации кожи, которые не имеют клинического значения и прогностической важности. К системным МЦ относят: индолентный системный МЦ; тлеющий системный МЦ; системный МЦ, ассоциированный с гематологическим новообразованием; агрессивный системный МЦ; тучноклеточный лейкоз [12].Основная задача дерматовенеролога диагностировать МЦ, а также дифференцировать кожный и системный МЦ между собой: при наличии признаков системного МЦ направить пациента на консультацию к гематологу для подтверждения диагноза и определения тактики лечения, при исключении явлений системных форм – динамическое наблюдение пациента и назначение симптоматической терапии по необходимости.
Диагностика. Для всех форм МЦ характерно наличие высыпаний (исключением является системный МЦ без поражения кожи). Для первичных элементов патогномоничным является положительный феномен Дарье–Унны, который заключается в высвобождении медиаторов воспаления из ТК при механическом раздражении (трение шпателем пятна или папулы в течение 10–20 с). При этом в течение 1 мин наблюдается образование волдыря (отек и покраснение элемента при отсутствии реакции окружающей здоровой кожи, что отличает данный феномен от явлений дермографизма) [12].
В ходе клинических исследований определено два пика заболеваемости: 55% случаев заболевания наблюдается в возрасте до 6 мес, 35% приходится на возраст 20–40 лет [16]. Как было отмечено раннее, для взрослого населения характерны системные формы, а для детей – кожные. Поэтому для пациентов в возрасте после 18 лет необходимо комплексное обследование, которое включает: определение уровня сывороточной триптазы в крови, костномозговую пункцию [определение реакции на триптазу и/или обнаружение KIT-мутации; иммунофенотипирование ТК (CD25+ и/или CD2+)], генетическое исследование клеток крови и пораженных органов на наличие KIT-мутации.
Критерием постановки диагноза «системный МЦ» является наличие 1 большого и 1 малого критерия или 3 малых критериев (табл. 2) [14].

В дерматологической практике всем пациентам, независимо от возраста, необходимо исследование крови для определения уровня сывороточной триптазы. У взрослого при уровне сывороточной триптазы >20 нг/мл требуется консультация гематолога для проведения диагностических процедур. У детей показатель обычно находится в пределах нормы, однако при выраженных кожных проявлениях может наблюдаться значительное повышение сывороточной триптазы с последующим снижением до референсных значений в течение 1–2 лет [12, 17–20]. Есть мнение, что у детей при уровне сывороточной триптазы >100 нг/мл необходимо проведение биопсии костного мозга [21].
Клинические формы кожного МЦ
 Пятнисто-папулезная форма кожного МЦ (ППКМ), более известная как «пигментная крапивница», имеет распространенный характер в виде пятен или папул округлых очертаний от желтого до красно-коричневого цвета. В зависимости от размеров элементов, их однородности и локализации принято выделять две группы: полиморфный и мономорфный ППКМ [12, 20] (рис. 1).
Пятнисто-папулезная форма кожного МЦ (ППКМ), более известная как «пигментная крапивница», имеет распространенный характер в виде пятен или папул округлых очертаний от желтого до красно-коричневого цвета. В зависимости от размеров элементов, их однородности и локализации принято выделять две группы: полиморфный и мономорфный ППКМ [12, 20] (рис. 1).А) Полиморфный ППКМ. Чаще всего данное состояние наблюдается у детей, проявляется в первые 6 мес жизни или с рождения в виде пигментных папул [12, 22]. С течением времени они могут претерпевать изменения с развитием пузырей при сильном раздражении, бляшек в более позднем возрасте и пятен в исходе заболевания. Чаще элементы разрешаются полностью, реже – с развитием очагов атрофии, напоминающих анетодермию. Для полиморфного ППКМ характерен ассиметричный характер высыпаний с возможным вовлечением всех участков тела (кожи туловища, головы и конечностей, за исключением кожи лица). Данное состояние носит доброкачественный характер, в большинстве случаев самостоятельно разрешается к пубертату и не связано с развитием системного МЦ [12]. Уровень сывороточной триптазы в крови, как правило, в пределах нормы или незначительно повышен [12, 18–20]. Дети с полиморфным ППКМ нормально переносят вакцинацию, в редких случаях при распространенном процессе может наблюдаться аллергическая реакция [22].
Б) Мономорфный ППКМ. Зачастую мономорфный ППКМ, в отличие от полиморфного, дебютирует во взрослом возрасте с высыпаний на коже нижней
 части живота и бедер, которые могут медленно распространяться на туловище, верхние и нижние конечности. Сыпь представлена округлыми гладкими папулами, размерами 2–5 мм, чуть возвышающимися над поверхностью здоровой кожи, цвет может варьировать от желтого до коричневого [23, 24].
части живота и бедер, которые могут медленно распространяться на туловище, верхние и нижние конечности. Сыпь представлена округлыми гладкими папулами, размерами 2–5 мм, чуть возвышающимися над поверхностью здоровой кожи, цвет может варьировать от желтого до коричневого [23, 24]. В 95% случаев у взрослого населения данное состояние ассоциировано с системным МЦ [23, 25]. В редких случаях клиническую картину мономорфного ППКМ можно встретить у детей, при этом определяется стойкое повышение уровня сывороточной триптазы в крови [20, 26]. Как правило, такие дети имеют тенденцию к хронизации процесса, а значит, требуют настороженности по поводу системных форм МЦ [12].
Диффузный кожный мастоцитоз (ДКМ) – редкое состояние, характеризующееся наличием крупных лихенифицированных зудящих очагов желто-коричневого, коричневого или красно-коричневого цвета неправильной формы с нечеткими границами (рис. 2). Первые высыпания локализуются в крупных складках, далее процесс может распространяться и приобретать генерализованный характер вплоть до развития эритродермии [27]. Механическое раздражение, укус насекомого или повышение температуры тела может привести к образованию крупных пузырей, заполненных серозным или геморрагическим содержимым, поэтому проведение пробы на наличие феномена Дарье–Унны нежелательно [28, 29]. Тенденция к эпидермолизу обычно снижается в первые 3–4 года от начала заболевания, которое зачастую приходится на первые месяцы жизни [12]. На ранних этапах отмечается повышенный уровень сывороточной триптазы (может быть >100 мг/л), со временем показатель снижается до нормальных значений. Как и полиморфный ППКМ, ДКМ имеет транзиторный характер с разрешением процесса к подростковому возрасту [12, 28, 30].
Мастоцитома. Самая распространенная и доброкачественная форма среди трех
 перечисленных, диагностируется в 65% случаев кожного МЦ [31]. В первые месяцы от рождения на коже ребенка появляется одиночная папула желтого, оранжевого или светло-коричневого цвета. Для нее характерны округлая или овальная форма, четкие границы, гладкая или морщинистая, как «апельсиновая корка», поверхность, также может наблюдаться образование везикулы в центре элемента при травматизации, расчесах или при проведении пробы на наличие феномена Дарье–Унны (рис. 3, 4). Папула со временем может увеличиваться до 2–5 см в диаметре, а затем спонтанно регрессировать. В редких случаях на коже могут встречаться несколько подобных элементов, тогда при наличии 4 и более папул принято классифицировать состояние как ППКМ [12].
перечисленных, диагностируется в 65% случаев кожного МЦ [31]. В первые месяцы от рождения на коже ребенка появляется одиночная папула желтого, оранжевого или светло-коричневого цвета. Для нее характерны округлая или овальная форма, четкие границы, гладкая или морщинистая, как «апельсиновая корка», поверхность, также может наблюдаться образование везикулы в центре элемента при травматизации, расчесах или при проведении пробы на наличие феномена Дарье–Унны (рис. 3, 4). Папула со временем может увеличиваться до 2–5 см в диаметре, а затем спонтанно регрессировать. В редких случаях на коже могут встречаться несколько подобных элементов, тогда при наличии 4 и более папул принято классифицировать состояние как ППКМ [12].Лечение. ДКМ имеет благоприятный прогноз с самостоятельным разрешением, поэтому не требует серьезного лечения. Однако важным пунктом контроля кожных форм МЦ является исключение из жизни триггерных факторов дегрануляции ТК, под действием которых развивается отек, покраснение высыпаний вплоть до образований пузырей. К таким факторам относятся холод, тепло, механическое раздражение, лекарственные препараты, укусы насекомых и т.д. [23].
В том случае, если пациент с ППКМ или ДКМ страдает от зуда или когда действие внешних факторов неизбежно или состоялось, необходимо назначение симптоматической терапии. В первую очередь к ней относятся антигистаминные
 препараты II поколения, а при наличии проблем со сном – I поколения [32]. Также возможно назначение стабилизаторов мембран ТК (кетотифен, кромогликат натрия) или антидепрессантов с противозудным действием. Перечисленные группы препаратов рекомендованы к применению на длительный срок [33].
препараты II поколения, а при наличии проблем со сном – I поколения [32]. Также возможно назначение стабилизаторов мембран ТК (кетотифен, кромогликат натрия) или антидепрессантов с противозудным действием. Перечисленные группы препаратов рекомендованы к применению на длительный срок [33].У пациентов с ДКМ или распространенным ППКМ не исключена массивная дегрануляция ТК с выбросом огромного количества медиаторов воспаления в кровоток с последующим развитием не только кожной симптоматики, но и системных проявлений в виде спазмов желудочно-кишечного тракта, диареи, одышки, головной боли и анафилактической реакции [28, 34, 35]. В таких случаях требуется назначение коротким курсом глюкокортикостероидов в виде инъекций [6, 36].
Назначение топических глюкокортикостероидов пациентам с мастоцитомой приводит к хорошим результатам, зачастую наблюдается полное разрешение бляшек [6, 37].
Из немедикаментозных методов лечения стоит выделить фототерапию: пациенты после пребывания на солнце отмечают уменьшение зуда, устойчивость к действию факторов внешней среды, а при ДКМ истончение лихенифицированных очагов [33]. Описаны положительные результаты со стороны кожных проявлений при применении ПУВА-терапии у взрослых пациентов с системными формами МЦ [38].
Собственные наблюдения
 Родители ребенка С. (возраст 1 год 6 мес) обратились в консультативно-диагностическое отделение ДГКБ им. З.А. Башляевой в октябре 2018 г. с жалобами на многочисленные высыпания на коже туловища и конечностей. Жалоб на зуд элементов, а также боли в животе и жидкий стул родители не предъявляли.
Родители ребенка С. (возраст 1 год 6 мес) обратились в консультативно-диагностическое отделение ДГКБ им. З.А. Башляевой в октябре 2018 г. с жалобами на многочисленные высыпания на коже туловища и конечностей. Жалоб на зуд элементов, а также боли в животе и жидкий стул родители не предъявляли.Из анамнеза известно, что ребенок родился от 1-й беременности, самостоятельных родов на 40-й неделе. Ранний анамнез без особенностей. Семейный анамнез не отягощен.
С июля 2018 г. родители стали замечать появление пигментированных пятен на коже у мальчика, которые имели тенденцию к постепенному распространению, количество пятен постепенно увеличивалось. При трении элементов одеждой и на фоне лихорадки (при острой респираторной вирусной инфекции) некоторые пятна меняли цвет и становились розовыми и отечными. Самочувствие ребенка, по оценке матери, хорошее. Самостоятельно родители местно на пятна применяли цинковую пасту и увлажняющие кремы. Разными педиатрами по месту жительства ранее были выставлены следующие диагнозы: атопический дерматит неуточненный, позднее был заподозрен нейрофиброматоз. По поводу атопического дерматита была назначена терапия антигистаминными препаратами (капли Фенистил) и местно назначался 1% крем пимекролимуса без эффекта. Мальчик был проконсультирован у невропатолога, который не подтвердил диагноз нейрофиброматоз (болезнь Реклингхаузена).
 Status рraesens: состояние удовлетворительное. Нормального телосложения, нормального питания. Носовое дыхание свободное. Зев умеренно гиперемирован, без налетов. Миндалины увеличены до 1-й степени, наложения отсутствуют. В легких дыхание пуэрильное, проводится во всех отделах, хрипов нет. Тоны сердца громкие, ритм правильный, шумы отсутствуют. Язык влажный, не обложен. Живот не вздут, мягкий, доступен глубокой пальпации, болезненный в области эпигастрия. Печень у края реберной дуги. Селезенка не пальпируется. Стул оформленный до 1 раза в 2–3 суток, примеси отсутствуют. Мочеиспускание безболезненное. Симптом поколачивания отрицательный. Отеков нет. Сознание ясное. Менингеальные и очаговые симптомы отрицательны.
Status рraesens: состояние удовлетворительное. Нормального телосложения, нормального питания. Носовое дыхание свободное. Зев умеренно гиперемирован, без налетов. Миндалины увеличены до 1-й степени, наложения отсутствуют. В легких дыхание пуэрильное, проводится во всех отделах, хрипов нет. Тоны сердца громкие, ритм правильный, шумы отсутствуют. Язык влажный, не обложен. Живот не вздут, мягкий, доступен глубокой пальпации, болезненный в области эпигастрия. Печень у края реберной дуги. Селезенка не пальпируется. Стул оформленный до 1 раза в 2–3 суток, примеси отсутствуют. Мочеиспускание безболезненное. Симптом поколачивания отрицательный. Отеков нет. Сознание ясное. Менингеальные и очаговые симптомы отрицательны.Status localis: патологический кожный процесс носит распространенный характер. Высыпания представлены многочисленными мономорфными пигментными пятнами розово-коричневого цвета размером от 5–10 мм в диаметре, расположенными на коже туловища, лица и конечностях (рис. 5). При проведении граттажа (растирания шпателем) элементов отмечается положительный симптом Дарье–Унны (рис. 6).
Заключение дерматовенеролога: МЦ (кожная пятнисто-папулезная форма). Рекомендовано проведение следующих исследований: общий анализ крови, биохимический анализ крови и мочи, определение уровня сывороточной триптазы в крови, медико-генетическое типирование, рентгенография позвоночника, ультразвуковая диагностика органов брюшной полости.
Результаты исследований: общий анализ крови, биохимический анализ крови и мочи – значения в референсных пределах. По данным ультразвукового исследования органов брюшной полости, рентгенографии позвоночника патологии не выявлено. Анализ уровня сывороточной триптазы в крови: 9,07 мкг/л (норма до 11 мкг/л). Медико-генетическое типирование не выявило мутации гена c-KIT.
Рекомендовано обязательное исключение воздействия триггерных факторов (купание в горячей воде, перегрев ребенка, инсоляции и механическое раздражение предметами одежды), а также ограничение приема или полный отказ от лекарственных препаратов: нестероидных противовоспалительных препаратов, кодеина (в средствах от кашля), неомицина, тиамина, рентгеноконтрастных йодсодержащих веществ, хлорахина и др. Максимальная защита репеллентами ребенка от укусов насекомых.
Назначена специфическая диета с максимальным исключением из рациона продуктов, способствующих высвобождению гистамина: малины, клубники и других ягод, редиски, шпината, пасленовых, сыров, газированных напитков, консервов и т.д.
При появлении отечных элементов рекомендовано местное применение коротким курсом метилпреднизолона ацепоната и антигистаминных препаратов перорально.
Динамическое наблюдение 1 раз в полгода у дерматолога.
Заключение. Кожные формы МЦ (пигментная крапивница) нередко встречаются в детской практике. Практически всегда диагностика педиатрами данного заболевания вызывает сложности и ошибки.
Высыпания при кожных формах МЦ выявляются в первые месяцы жизни ребенка, характеризуются благоприятным течением с самостоятельным разрешением к подростковому возрасту. Основной рекомендацией для пациентов с кожными формами является исключение триггерных факторов дегрануляции ТК, в распространенных случаях включает в себя прием антигистаминных препаратов и местное назначение кортикостероидных средств коротким курсом.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Тамразова Ольга Борисовна – д-р мед. наук, проф. каф. дерматовенерологии с курсом косметологии факультета непрерывного медицинского образования медицинского института ФГАОУ ВО РУДН; врач-консультант ГБУЗ «ДГКБ им. З.А. Башляевой». E-mail: anait_tamrazova@mail.ru
Olga B. Tamrazova – D. Sci. (Med.), Prof., People’s Friendship University of Russia, Bashlyaeva Children City Clinical Hospital. E-mail: anait_tamrazova@mail.ru
Глухова Евгения Александровна – врач-ординатор кафедры дерматовенерологии с курсом косметологии факультета непрерывного медицинского образования медицинского института ФГАОУ ВО РУДН
Evgeniya A. Glukhova – Medical Resident, People’s Friendship University of Russia
Статья поступила в редакцию / The article received: 24.06.2020
Статья принята к печати / The article approved for publication: 10.07.2020
Список исп. литературыСкрыть список1. Arock M, Valent P. Pathogenesis, classification and treatment of mastocytosis: state of the art in 2010 and future perspectives. Expert Rev Hematol 2010; 3: 497–516.
2. Nettelship E, Tay W. Rare forms of urticarial. BMJ; 1869; 2: 323–30.
3. Sangster A. An anomalous mottled rash, accompanied by pruritus, factitious urticaria and pigmentation, ‘urticaria pigmentosa’ (?). Trans Clin Soc London 1878; 11: 161–3.
4. Ellis JM. Urticaria pigmentosa. A report of a case with autopsy. AMA Arch Pathol 1949; 48: 426–9.
5. Tamay Z, Ozceker D. Current approach to cutaneous mastocytosis in childhood. Turk Pediatri Ars 2016; 51 (3): 123–7.
6. Le M, Miedzybrodzki B, Olynych T et al. Natural history and treatment of cutaneous and systemic mastocytosis. Postgrad Med 2017; 129 (8): 896–901.
7. Brockow K. Epidemiology, prognosis, and risk factors in mastocytosis. Immunol Allergy Clin North Am 2014; 34 (2): 283–95.
8. Потапенко В.Г., Скорюкова К.А. Мастоцитоз у детей и взрослых. Результаты анализа Российской группы пациентов. Клиническая патофизиология. 2017; 23 (3); 54–60.
[Potapenko V.G., Skoriukova K.A. Mastotsitoz u detei i vzroslykh. Rezul'taty analiza Rossiiskoi gruppy patsientov. Klinicheskaia patofiziologiia. 2017; 23 (3); 54–60 (in Russian).]
9. Wilson T, Maric I, Simakova O et al. Clonal analysis of NRAS activating mutations in KIT-D816V systemic mastocytosis. Haematologica 2011; 96 (3): 459–63.
10. Carter MC, Metcalfe DD. Paediatric mastocytosis. Arch Dis Child 2002; 86 (5): 315–19.
11. Цибулькина В.Н., Цибулькин Н.А. Патофизиология тучных клеток при мастоцитозе: значение в клинике и диагностике. Практическая медицина. 2016; 9 (101): 7–11.
[Tsibul'kina V.N., Tsibul'kin N.A. Patofiziologiia tuchnykh kletok pri mastotsitoze: znachenie v klinike i diagnostike. Prakticheskaia meditsina. 2016; 9 (101): 7–11 (in Russian).]
12. Hartmann K, Escribano L, Grattan C et al. Сutaneous manifestations in mastocytosis: consensus report of the European Competence Network on Mastocytosis, the American Academy of Allergy, Asthma & Immunology, and the European Academy of Allergology and Clinical Immunology. J Allergy Clin Immunol 2016; 137 (1): 35–45.
13. Méni C, Bruneau J, Georgin-Lavialle S et al. Paediatric mastocytosis: a systematic review of 1747 cases. Br J Dermatol 2015; 172 (3): 642–51.
14. Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127 (20): 2391–405.
15. Marrouche N, Grattan C. TMEP or not TMEP: that is the question.
J Am Acad Dermatol 2014; 70 (3): 581–2.
16. Pardanani A., Teff eri A. Systemic mastocytosis in adults: a review on prognosis and treatment based on 342 Mayo Clinic patients and current literature. Curr Opin Hematol 2010; 17 (2): 125–32.
17. Valent P, Escribano L, Broesby-Olsen S et al. Proposed diagnostic algorithm for patients with suspected mastocytosis: a proposal of the European Competence Network on Mastocytosis. Allergy 2014; 69: 1267–74.
18. Uzzaman A, Maric I, Noel P et al. Pediatric-onset mastocytosis: a long term clinical follow-up and correlation with bone marrow histopathology. Pediatr Blood Cancer 2009; 53: 629–34.
19. Ben-Amitai D, Metzker A, Cohen HA. Pediatric cutaneous mastocytosis: a review of 180 patients. Isr Med Assoc J 2005; 7: 320–2.
20. Wiechers T, Rabenhorst A, Schick T et al. Large maculopapular cutaneous lesions are associated with favorable outcome in childhood-onset mastocytosis. J Allergy Clin Immunol 2015; 136 (6): 1581–90.
21. Castells M. Diagnosis and treatment of cutaneous mastocytosis in children: practical recommendations. Am J Clin Dermatol 2011; 12 (4): 259–70.
22. Torrelo A, Alvarez-Twose I, Escribano L. Childhood mastocytosis. Curr Opin Pediatr 2012; 24 (4): 480–6.
23. Bergström A, Rollman O, Emtestam L et al. Cutaneous mastocytosis – update and clinical guidelines. Lakartidningen 2018; Oct 22; 115.
24. Brockow K, Scott LM, Worobec AS et al. Regression of urticaria pigmentosa in adult patients with systemic mastocytosis: correlation with clinical patterns of disease. Arch Dermatol 2002; 138 (6):
785–90.
25. Broesby-Olsen S, Dybedal I, Gülen T et al. Multidisciplinary management of mastocytosis – Nordic expert group consensus. Acta Derm Venereol 2016; 96 (5): 602–12.
26. Lange M, Nedoszytko B, Gorska A et al. Mastocytosis in children and adults: clinical disease heterogeneity. Arch Med Sci 2012; 8: 533–41.
27. Болотная Л.А. Тучные клетки и мастоцитоз. Дерматологiя та венерологiя. 2016; 3 (73): 5–14.
[Bolotnaia L.A. Tuchnye kletki i mastotsitoz. Dermatologiia ta venerologiia. 2016; 3 (73): 5–14 (in Russian).]
28. Matito A, Azaña JM, Torrelo A, Alvarez-Twose I. Cutaneous Mastocytosis in Adults and Children: New Classification and Prognostic Factors. Immunol Allergy Clin North Am 2018; 38 (3): 351–63.
29. Alvarez-Twose I, Jara-Acevedo M, Morgado JM et al. Clinical, immunophenotypic, and molecular characteristics of well-differentiated systemic mastocytosis. J Allergy Clin Immunol 2016; 137 (1): 168–78.
30. Carter MC, Clayton ST, Komarow HD, et al. Assessment of clinical findings, tryptase levels, and bone marrow histopathology in the management of pediatric mastocytosis. J Allergy Clin Immunol 2015; 136 (6): 1673–9.
31. Middelkamp Hup MA, Heide R, Tank B et al. Comparison of mastocytosis with onset in children and adults. J Eur Acad Dermatol Venereol 2002; 16 (2): 115–20.
32. Barton J, Lavker RM, Schechter NM et al. Treatment of urticaria pigmentosa with corticosteroids. Arch Dermatol 1985; 121 (12): 1516–23.
33. Потапенко В.Г., Скорюкова К.А., Лисукова Е.В. и др. Мастоцитоз у детей: Характеристика группы 111 пациентов. Педиатрия. Журнал им. Г.Н. Сперанского. 2018; 97 (4): 135–40.
[Potapenko V.G., Skoriukova K.A., Lisukova E.V. et al. Mastotsitoz u detei: Kharakteristika gruppy 111 patsientov. Pediatriia. Zhurnal im. G.N. Speranskogo. 2018; 97 (4): 135–40 (in Russian).]
34. Berezowska S, Flaig MJ, Ruеff F et al. Adult-onset mastocytosis in the skin is highly suggestive of systemic mastocytosis. Mod Pathol 2014; 27 (1): 19–29.
35. Barnes M, Van L, DeLong L et al. Severity of cutaneous findings predict the presence of systemic symptoms in pediatric maculopapular cutaneous mastocytosis. Pediatr Dermatol 2014; 31 (3): 271–5.
36. Verma KK, Bhat R, Singh MK. Bullous mastocytosis treated with oral betamethasone therapy. Indian J Pediatr 2004; 71 (3): 261–3.
37. Patrizi A, Tabanelli M, Neri I et al. Topical corticosteroids versus “wait and see” in the management of solitary mastocytoma in pediatric patients: a long-term follow-up. Dermatol Ther 2015; 28 (2): 57–61.
38. Pyatilova P, Teplyuk N, Olisova O et al. Efficacy of PUVA in Russian patients with mastocytosis: a case series and review of literature. Int J Dermatol 2018; 57 (9): e59-e64. DOI: 10.1111/ijd.14103

