Клинический разбор в общей медицине №02 2020
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Consultative and Diagnostic Center of the private healthcare institution «Central clinical hospital «RZD-Medicine», Moscow, Russia *ela12@yandex.ru
Abstract
Sarcoidosis is a disease of an unknown etiology and is characterized by a wide range of clinical manifestations due to granulomatous damage
of the lungs and other organs. Hematologic disorders in sarcoidosis are represented by different variants of pancytopenia, while autoimmune thrombocytopenic purpura is rare. Hemorrhagic syndrome with critical thrombocytopenia in blood of a patient with systemic sarcoidosis (damage to the lungs, nervous system, skin) coincided with an episode of a viral infection with symptoms of COVID-19 and the detection of an increased titer of antibodies to SARS-CoV-2 in the blood. In our paper we described the clinical features of the disease, medical treatment. The issues
of managing patients with sarcoidosis during a pandemic time are discussed.
Key words: COVID-19, sarcoidosis, autoimmune thrombocytopenic purpura.
For citation: Ponomareva L.A., Panchenko L.A., Ponomarev A.B., Popova E.N., Putincev Yu.V. Generalized sarcoidosis and severe thrombocytopenic purpura: clinical observation and literature review. Clinical review for general practice. 2020; 2: 6–10. DOI: 10.47407/kr2020.1.2.00011
Саркоидоз относится к интерстициальным заболеваниям легких и характеризуется образованием эпителиоидно-клеточных гранулем в различных органах с преобладающим поражением органов дыхания. В зависимости от особенностей клинических проявлений выделяют острое и хроническое течение заболевания. Признаки острого течения саркоидоза хорошо известны: возникают артралгии, повышение температуры тела, изменения на коже в виде узловатой эритемы, сочетающиеся с увеличением внутригрудных лимфатических узлов [1]. Саркоидоз легких хронического течения отличается многообразием клинических проявлений, которые определяются не только поражением органов дыхания, но и нарушением функций почек, сердца, печени, неврологическими расстройствами, разнообразными изменениями со стороны формулы крови, включающими анемию, лейколимфопению, эозинофилию, тромбоцитопению и панцитопению вплоть до развития жизнеугрожающих состояний [2].
Согласно данным систематического обзора 2767 статей, приведенного в практическом руководстве по диагностике саркоидоза (American Thoracic Society – ATS),
у 22–57% больных при анализе формулы крови регистрируется лейкопения. Полный анализ клеток в материале периферической крови выявил анемию у 22% (95% доверительный интервал – ДИ 14–30%) пациентов, что сочеталось с обнаружением гранулем в костном мозге – до 38% (95% ДИ 13–64%). Полный подсчет клеток крови также выявил лимфопению – от 27%, в одном исследовании – до 55%. К вероятным причинам анемии и цитопении относят гранулематозное поражение костного мозга, но обсуждаются снижение уровня эритропоэтина вследствие саркоидной нефропатии, нарушение кроветворения по причине поражения печени и селезенки и лекарственно-индуцированные состояния, в особенности при назначении метотрексата [3].
В условиях пандемии COVID-19 больные саркоидозом подвергаются большому риску прогрессирования болезни за счет развития под влиянием вирусассоци-ированной тромботической микроангиопатии. Мы представляем клиническое наблюдение больной с тяжелым течением саркоидоза, очередное обострение заболевания у которой на момент начала пандемии проявилось тяжелой тромбоцитопенической пурпурой.
Больная Н., 27 лет, по данным анамнеза, росла и развивалась без особенностей, вакцинация проводилась соответственно возрасту. Социально благополучна. Замужем, детей нет. Из перенесенных заболеваний отмечает частые острые респираторные вирусные инфекции (ОРВИ), острые респираторные заболевания.
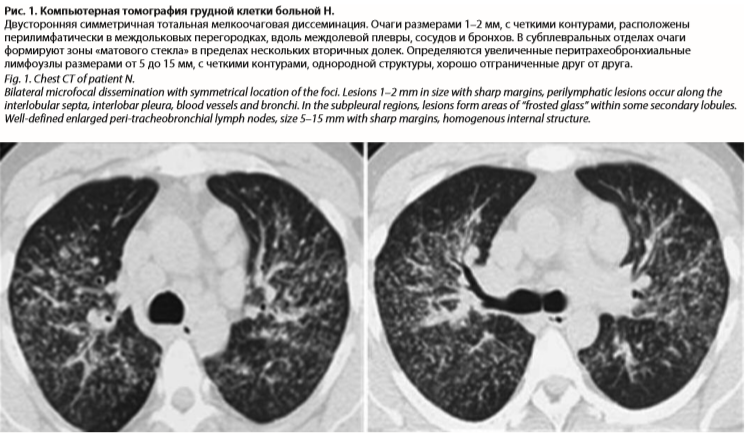
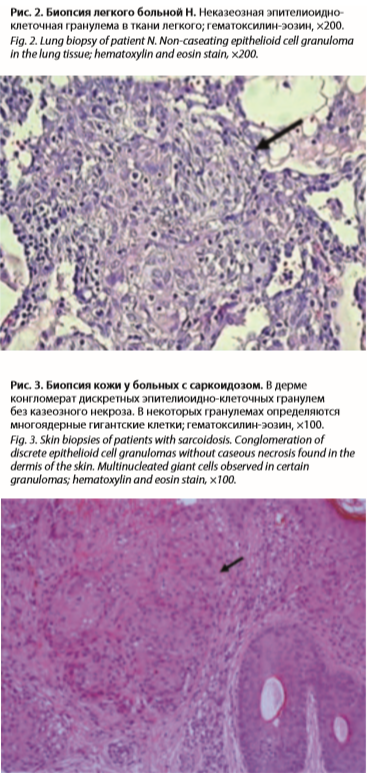
Считает себя больной с 24 лет, когда впервые отметила подъем температуры тела до фебрильных показателей, возникли изменения на коже по типу узловатой эритемы, снижение зрения, ощущение песка в глазах, кашель. При проведении мультиспиральной компьютерной томографии (МСКТ) в легких выявлены увеличение внутригрудных лимфатических узлов, усиление легочного рисунка, очаговые изменения с вовлечением верхних долей (рис. 1). Диагностирован подострый иридоциклит. Обследована на предмет туберкулеза – диаскин-тест отрицательный, микобактерии в посевах бронхоальвеолярной лаважной жидкости не обнаружены. Учитывая распространенность внутригрудных изменений, выраженность лимфаденопатии и лихорадку, для исключения онкопроцесса как причины легочной диссеминации в марте 2017 г. проведена торакоскопическая биопсия легкого, диагноз был морфологически верифицирован на основании общепринятого гистологического исследования. Выявлены неказеозные саркоидоподобные гранулемы (рис. 2). Была назначена терапия глюкокортикостероидами (ГКС) в дозе 16 мг/сут с хорошим эффектом, доза метипреда была снижена до 8 мг. С декабря 2018 г. вновь стала нарастать общая слабость, одышка, повысилась температура тела до фебрильных показателей, что сочеталось с узловатой эритемой, летучими болями в суставах, снижением массы тела. Вновь были назначены ГКС в режиме субмаксимальных доз (500 мг внутривенно капельно, общий курс 1500 мг) с хорошим эффектом. Состояние улучшилось, зарегистрирована положительная динамика внутригрудных и внелегочных проявлений.
 С сентября 2018 г. лечение было ограничено приемом пентоксифиллина и витамина Е. В середине февраля 2019 г. на протяжении недели отмечала повышение температуры тела до 37,5 °C, нарастающий птоз левого века и разлитую боль за левым глазом, слабость правой половины лица, приступы судорог в туловище и конечностях. Пациентка была обследована в специализированном неврологическом отделении, проводился дифференциальный диагноз с менингитом, в том числе микобактериальной природы, рассеянным склерозом.
С сентября 2018 г. лечение было ограничено приемом пентоксифиллина и витамина Е. В середине февраля 2019 г. на протяжении недели отмечала повышение температуры тела до 37,5 °C, нарастающий птоз левого века и разлитую боль за левым глазом, слабость правой половины лица, приступы судорог в туловище и конечностях. Пациентка была обследована в специализированном неврологическом отделении, проводился дифференциальный диагноз с менингитом, в том числе микобактериальной природы, рассеянным склерозом.
На основании полученных данных, включая специфические тесты на туберкулез, посевы спинномозговой жидкости, особенности неврологических расстройств (парез лицевого нерва, нарушения координации, полинейропатия), с учетом роста в сыворотке содержания ангиотензинпревращающего фермента (повышение до 2,5 раз выше нормы), состояние больной расценено как нейросаркоидоз, назначены ГКС в общей дозе 3000 мг, антиагреганты, пентоксифиллин. Общее состояние улучшилось, неврологические проявления разрешились, хотя и сохранились слабость, снижение зрения. В последующем получала поддерживающую дозу метипреда – 8 мг, общее состояние сохранялось стабильным вплоть до марта 2020 г.
31.03.2020 обратилась за медицинской помощью с жалобами на обильную геморрагическую сыпь на туловище, конечностях, слизистой оболочке языка (рис. 3), носовое кровотечение, подъем температуры тела до 37,2 °C, повышенную слабость, утомляемость, диарею, головокружения, плохой сон, снижение обоняния. В последующем у больной обнаружен повышенный титр (КП=2,15) антител к COVID-19. Со слов пациентки перед появлением вышеуказанных симптомов не исключает контакт с больным ОРВИ, у которого впоследствии диагностировали инфекцию, вызванную вирусом SARS-CoV-2. Состояние при поступлении средней тяжести, сознание ясное. Кожные покровы и видимые слизистые бледные, на коже рук, ног, туловища множественные геморрагии, экхимозы, на слизистой полости рта множественные геморрагии и подслизистые гематомы, склеры чистые, отеков нет. Доступные пальпации периферические лимфатические узлы не увеличены. Суставы не деформированы. Дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. Тоны сердца приглушены, ритмичные. Частота сердечных сокращений – 84 уд/мин. Артериальное давление – 90/60 мм рт. ст. Живот мягкий, безболезненный. Размеры печени и селезенки, по данным перкуссии, не увеличены. Поколачивание по пояснице безболезненно с обеих сторон. При проведении электрокардиографии обнаружены выраженные изменения миокарда левого желудочка, неполная блокада правой ножки пучка Гиса.
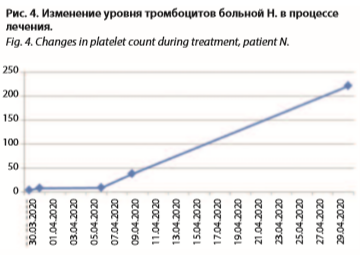
При поступлении в клиническом анализе крови выявлена изолированная выраженная тромбоцитопения до 8×109/л, биохимический анализ крови и общий анализ мочи без особенностей. Антинейтрофильные антитела и маркеры системных заболеваний обнаружены не были. Исследование антител к тромбоцитам показало повышенный результат – 1:80 (при норме 1:10). В результате введения «пульсовых» доз ГКС (2000 мг на курс) с назначением препарата в инициальной дозе 40 мг/сут и последующим медленным снижением до 12 мг/сут геморрагический синдром был купирован, в общем анализе крови зарегистрирован прирост тромбоцитов до 37×109/л, спустя три недели – 222×109/л (рис. 4).
В дальнейшем сохраняется стабильное состояние, на данный момент получает поддерживающие дозы ГКС.
Существует три механизма тромбоцитопении при саркоидозе. Первый механизм связывают с гиперспленизмом и спленомегалией. К спленомегалии относится 10% случаев ИТП [6]. В серии аутопсий гранулемы селезенки выявлены в 60% случаев [7]. Секвестрация в селезенке приводит к разрушению тромбоцитов. В некоторых случаях спленомегалия связана с гиперспленизмом, вторичным по отношению к портальной гипертензии и периферической панцитопении. Иногда спленомегалия сочетается с аутоиммунным компонентом, что приводит к разрушению тромбоцитов [2, 8].
 К аутоиммунной тромбоцитопении относят варианты заболевания с подтвержденным саркоидозом, когда количество тромбоцитов сохраняется менее 100, что не связано с побочным эффектом лекарственных препаратов, отсутствием спленомегалии/гиперсленизма [7].
К аутоиммунной тромбоцитопении относят варианты заболевания с подтвержденным саркоидозом, когда количество тромбоцитов сохраняется менее 100, что не связано с побочным эффектом лекарственных препаратов, отсутствием спленомегалии/гиперсленизма [7].
Гранулематозная инфильтрация костного мозга при саркоидозе как причина гематологических аномалий встречается редко и, как правило, не связана с тромбоцитопенией. В исследовании Access Research Group у 29 (3,9%) из 736 пациентов обнаружены гранулемы в костном мозге, но изменений в количестве клеток крови не зарегистрировано [9].
Обсуждаются также аутоиммунные нарушения, характеризующиеся повышением активности Т-хелперов и избыточным синтезом медиаторов повреждения. Имеются сообщения об аутоиммунной гемолитической анемии и идиопатической тромбоцитопенической пурпуре при саркоидозе. В 1985 г. Джеффри Лоуренс и Бернард Гринберг обнаружили повышение уровня IgG, ассоциированного с тромбоцитами, у пациента с тромбоцитопенией и саркоидозом и предположили, что повреждение тромбоцитов опосредовано появлением антител [10].
Особенность прогрессирования саркоидоза у нашей больной была представлена присоединением внелегочных поражений при отсутствии динамики со стороны легочного процесса. В дебюте клиническая картина соответствовала острому варианту саркоидоза, описанного С.Х. Лёфгреном в виде внутригрудной лимфаденопатии и узловатой эритемы. Следующий эпизод обострения болезни был представлен сочетанием кожных изменений с нейросаркоидозом, воспроизводящим клинику острого неврита, с поражением черепно-мозговых нервов. При этом взаимосвязь с потенциальными триггерами болезни отсутствовала. Развитие тромбоцитопении можно, с одной стороны, расценивать как проявление саркоидоза, но факт наличия у больной симптомов ОРВИ, хронологически совпавших с гематологическими сдвигами, и антитела к коронавирусной инфекции дают основание рассматривать вирус SARS-CoV-2 как триггер гематологических нарушений.
Обсуждаются следующие гипотезы влияния SARS-CoV-2 на тромбоцитарное звено. Во-первых, воздействие вируса на костный мозг, опосредованное через CD13-рецепторы, а также медиаторы в процессе развития «цитокинового шторма» индуцируют апоптоз клеток костного мозга. Во-вторых, усиление агрегации тромбоцитов в ответ на вирусное повреждение эндотелия легких с формированием микротромбов и развитием тромботической микроангиопатии [11]. Следует отметить, что у больной отсутствовала значимая динамика МСКТ-признаков саркоидоза легких за исключением нескольких участков «матового стекла», что может быть аргументом в пользу вирусиндуцированного генеза тромбоцитопении.
В настоящее время нет рекомендаций по лечению тромбоцитопении при саркоидозе. Хороший эффект в ответ на ГКС позволяет рекомендовать их как препарат выбора в режиме высоких доз в сочетании с внутривенным введением иммуноглобулина (intravenous immunoglobulin – IVIg) 1 г/кг в день в течение 3 дней и, при необходимости, переливания тромбоцитов.
Спленэктомию следует выполнять только пациентам, у которых тромбоцитопения не контролируется терапией стероидами или IVIg. Также имеются данные об эффективности ритуксимаба и аналогичных препаратов на основе моноклональных антител к CD20 [1].
В литературе описаны случаи тяжелой резистентной к терапии идиопатической тромбоцитопенической пурпуры, ассоциированной с саркоидозом, осложнившейся обильным кровотечением, и повлекшей смерть у 15% пациентов. Среди факторов, усугубляющих тяжесть геморрагического синдрома, следует учитывать позднее начало лечения либо недостаточные дозы препаратов. Учитывая риск жизнеугрожающих последствий у больных саркоидозом, при снижении тромбоцитов тромбоцитопенией менее чем 30×109/л обосновано назначение высоких доз стероидов, по показаниям – введение IVIg, при отсутствии эффекта – назначение моноклональных антител [7].
Таким образом, при тромбоцитопении у больных саркоидозом возможны тяжелые изменения со стороны системы крови. Тромбоцитопения при саркоидозе встречается редко, механизмы ее недостаточно расшифрованы, и обсуждаются, прежде всего, аутоиммунные нарушения. В период пандемии риск гематологических аномалий и геморрагического синдрома у больных саркоидозом возрастает. При этом стероиды остаются наиболее эффективным препаратом в рамках первой линии терапии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Пономарева Л.А. – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: liubaponomareva18@yandex.ru
L.A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: liubaponomareva18@yandex.ru
Панченко Людмила Александровна – д-р мед. наук, проф. каф. госпитальной терапии №1, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»
Lyudmila A. Panchenko – D. Sci. (Med.), Prof., Yevdokimov Moscow State University of Medicine and Dentistry
Пономарев Андрей Борисович – канд. мед. наук, доц. каф. патологической анатомии им. А.И. Струкова, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Andrei B. Ponomarev – Cand. Sci. (Med.), Associate Prof., Sechenov First Moscow State Medical University (Sechenov University)
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Путинцев Юрий Викторович – рук. консультативно-диагностического центра ЧУЗ ЦКБ «РЖД-Медицина». E-mail: y_putincev@mail.ru
Yury V. Putintsev – Chief of the consultative and diagnostic center of the private healthcare institution “Central clinical hospital “RZD-Medicine”. E-mail: y_putincev@mail.ru
Статья поступила в редакцию / The article received: 24.11.2020
Статья принята к печати / The article approved for publication: 27.11.2020
Клинический разбор в общей медицине №02 2020
Генерализованный саркоидоз и тяжелая тромбоцитопеническая пурпура: клиническое наблюдение и обзор литературы
Номера страниц в выпуске:6-10
Аннотация
Саркоидоз относится к заболеваниям с неуточненной природой и характеризуется широким спектром клинических проявлений,
обусловленных гранулематозным процессом в легких и других органов. Гематологические нарушения при саркоидозе представлены различными вариантами панцитопении, тогда как аутоиммунная тромбоцитопеническая пурпура встречается редко. Дебют геморрагического синдрома, возникшего на фоне критического снижения тромбоцитов в периферической крови у больной с системным саркоидозом легких хронического течения (поражение легких, нервной системы, кожи) совпал с эпизодом вирусной инфекции с патогномоничными для COVID-19 симптомами и обнаружением в крови повышенного титра антител к SARS-CoV-2. Описаны особенности клинической картины заболевания, лечение, обсуждаются вопросы ведения больных саркоидозом в период пандемии.
Ключевые слова: COVID-19, саркоидоз, аутоиммунная тромбоцитопеническая пурпура.
Для цитирования: Пономарева Л.А., Панченко Л.А., Пономарев А.Б., Попова Е.Н., Путинцев Ю.В. Генерализованный саркоидоз и тяжелая тромбоцитопеническая пурпура: клиническое наблюдение и обзор литературы. 2020; 2: 6–10. DOI: 10.47407/kr2020.1.2.00011
Саркоидоз относится к заболеваниям с неуточненной природой и характеризуется широким спектром клинических проявлений,
обусловленных гранулематозным процессом в легких и других органов. Гематологические нарушения при саркоидозе представлены различными вариантами панцитопении, тогда как аутоиммунная тромбоцитопеническая пурпура встречается редко. Дебют геморрагического синдрома, возникшего на фоне критического снижения тромбоцитов в периферической крови у больной с системным саркоидозом легких хронического течения (поражение легких, нервной системы, кожи) совпал с эпизодом вирусной инфекции с патогномоничными для COVID-19 симптомами и обнаружением в крови повышенного титра антител к SARS-CoV-2. Описаны особенности клинической картины заболевания, лечение, обсуждаются вопросы ведения больных саркоидозом в период пандемии.
Ключевые слова: COVID-19, саркоидоз, аутоиммунная тромбоцитопеническая пурпура.
Для цитирования: Пономарева Л.А., Панченко Л.А., Пономарев А.Б., Попова Е.Н., Путинцев Ю.В. Генерализованный саркоидоз и тяжелая тромбоцитопеническая пурпура: клиническое наблюдение и обзор литературы. 2020; 2: 6–10. DOI: 10.47407/kr2020.1.2.00011
Generalized sarcoidosis and severe thrombocytopenic purpura: clinical observation and literature review
L.A. Ponomareva1, L.A. Panchenko2, A.B. Ponomarev1, E.N. Popova1*, Yu.V. Putincev31 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Consultative and Diagnostic Center of the private healthcare institution «Central clinical hospital «RZD-Medicine», Moscow, Russia *ela12@yandex.ru
Abstract
Sarcoidosis is a disease of an unknown etiology and is characterized by a wide range of clinical manifestations due to granulomatous damage
of the lungs and other organs. Hematologic disorders in sarcoidosis are represented by different variants of pancytopenia, while autoimmune thrombocytopenic purpura is rare. Hemorrhagic syndrome with critical thrombocytopenia in blood of a patient with systemic sarcoidosis (damage to the lungs, nervous system, skin) coincided with an episode of a viral infection with symptoms of COVID-19 and the detection of an increased titer of antibodies to SARS-CoV-2 in the blood. In our paper we described the clinical features of the disease, medical treatment. The issues
of managing patients with sarcoidosis during a pandemic time are discussed.
Key words: COVID-19, sarcoidosis, autoimmune thrombocytopenic purpura.
For citation: Ponomareva L.A., Panchenko L.A., Ponomarev A.B., Popova E.N., Putincev Yu.V. Generalized sarcoidosis and severe thrombocytopenic purpura: clinical observation and literature review. Clinical review for general practice. 2020; 2: 6–10. DOI: 10.47407/kr2020.1.2.00011
Саркоидоз относится к интерстициальным заболеваниям легких и характеризуется образованием эпителиоидно-клеточных гранулем в различных органах с преобладающим поражением органов дыхания. В зависимости от особенностей клинических проявлений выделяют острое и хроническое течение заболевания. Признаки острого течения саркоидоза хорошо известны: возникают артралгии, повышение температуры тела, изменения на коже в виде узловатой эритемы, сочетающиеся с увеличением внутригрудных лимфатических узлов [1]. Саркоидоз легких хронического течения отличается многообразием клинических проявлений, которые определяются не только поражением органов дыхания, но и нарушением функций почек, сердца, печени, неврологическими расстройствами, разнообразными изменениями со стороны формулы крови, включающими анемию, лейколимфопению, эозинофилию, тромбоцитопению и панцитопению вплоть до развития жизнеугрожающих состояний [2].
Согласно данным систематического обзора 2767 статей, приведенного в практическом руководстве по диагностике саркоидоза (American Thoracic Society – ATS),
у 22–57% больных при анализе формулы крови регистрируется лейкопения. Полный анализ клеток в материале периферической крови выявил анемию у 22% (95% доверительный интервал – ДИ 14–30%) пациентов, что сочеталось с обнаружением гранулем в костном мозге – до 38% (95% ДИ 13–64%). Полный подсчет клеток крови также выявил лимфопению – от 27%, в одном исследовании – до 55%. К вероятным причинам анемии и цитопении относят гранулематозное поражение костного мозга, но обсуждаются снижение уровня эритропоэтина вследствие саркоидной нефропатии, нарушение кроветворения по причине поражения печени и селезенки и лекарственно-индуцированные состояния, в особенности при назначении метотрексата [3].
В условиях пандемии COVID-19 больные саркоидозом подвергаются большому риску прогрессирования болезни за счет развития под влиянием вирусассоци-ированной тромботической микроангиопатии. Мы представляем клиническое наблюдение больной с тяжелым течением саркоидоза, очередное обострение заболевания у которой на момент начала пандемии проявилось тяжелой тромбоцитопенической пурпурой.
Больная Н., 27 лет, по данным анамнеза, росла и развивалась без особенностей, вакцинация проводилась соответственно возрасту. Социально благополучна. Замужем, детей нет. Из перенесенных заболеваний отмечает частые острые респираторные вирусные инфекции (ОРВИ), острые респираторные заболевания.
Считает себя больной с 24 лет, когда впервые отметила подъем температуры тела до фебрильных показателей, возникли изменения на коже по типу узловатой эритемы, снижение зрения, ощущение песка в глазах, кашель. При проведении мультиспиральной компьютерной томографии (МСКТ) в легких выявлены увеличение внутригрудных лимфатических узлов, усиление легочного рисунка, очаговые изменения с вовлечением верхних долей (рис. 1). Диагностирован подострый иридоциклит. Обследована на предмет туберкулеза – диаскин-тест отрицательный, микобактерии в посевах бронхоальвеолярной лаважной жидкости не обнаружены. Учитывая распространенность внутригрудных изменений, выраженность лимфаденопатии и лихорадку, для исключения онкопроцесса как причины легочной диссеминации в марте 2017 г. проведена торакоскопическая биопсия легкого, диагноз был морфологически верифицирован на основании общепринятого гистологического исследования. Выявлены неказеозные саркоидоподобные гранулемы (рис. 2). Была назначена терапия глюкокортикостероидами (ГКС) в дозе 16 мг/сут с хорошим эффектом, доза метипреда была снижена до 8 мг. С декабря 2018 г. вновь стала нарастать общая слабость, одышка, повысилась температура тела до фебрильных показателей, что сочеталось с узловатой эритемой, летучими болями в суставах, снижением массы тела. Вновь были назначены ГКС в режиме субмаксимальных доз (500 мг внутривенно капельно, общий курс 1500 мг) с хорошим эффектом. Состояние улучшилось, зарегистрирована положительная динамика внутригрудных и внелегочных проявлений.

 С сентября 2018 г. лечение было ограничено приемом пентоксифиллина и витамина Е. В середине февраля 2019 г. на протяжении недели отмечала повышение температуры тела до 37,5 °C, нарастающий птоз левого века и разлитую боль за левым глазом, слабость правой половины лица, приступы судорог в туловище и конечностях. Пациентка была обследована в специализированном неврологическом отделении, проводился дифференциальный диагноз с менингитом, в том числе микобактериальной природы, рассеянным склерозом.
С сентября 2018 г. лечение было ограничено приемом пентоксифиллина и витамина Е. В середине февраля 2019 г. на протяжении недели отмечала повышение температуры тела до 37,5 °C, нарастающий птоз левого века и разлитую боль за левым глазом, слабость правой половины лица, приступы судорог в туловище и конечностях. Пациентка была обследована в специализированном неврологическом отделении, проводился дифференциальный диагноз с менингитом, в том числе микобактериальной природы, рассеянным склерозом. На основании полученных данных, включая специфические тесты на туберкулез, посевы спинномозговой жидкости, особенности неврологических расстройств (парез лицевого нерва, нарушения координации, полинейропатия), с учетом роста в сыворотке содержания ангиотензинпревращающего фермента (повышение до 2,5 раз выше нормы), состояние больной расценено как нейросаркоидоз, назначены ГКС в общей дозе 3000 мг, антиагреганты, пентоксифиллин. Общее состояние улучшилось, неврологические проявления разрешились, хотя и сохранились слабость, снижение зрения. В последующем получала поддерживающую дозу метипреда – 8 мг, общее состояние сохранялось стабильным вплоть до марта 2020 г.
31.03.2020 обратилась за медицинской помощью с жалобами на обильную геморрагическую сыпь на туловище, конечностях, слизистой оболочке языка (рис. 3), носовое кровотечение, подъем температуры тела до 37,2 °C, повышенную слабость, утомляемость, диарею, головокружения, плохой сон, снижение обоняния. В последующем у больной обнаружен повышенный титр (КП=2,15) антител к COVID-19. Со слов пациентки перед появлением вышеуказанных симптомов не исключает контакт с больным ОРВИ, у которого впоследствии диагностировали инфекцию, вызванную вирусом SARS-CoV-2. Состояние при поступлении средней тяжести, сознание ясное. Кожные покровы и видимые слизистые бледные, на коже рук, ног, туловища множественные геморрагии, экхимозы, на слизистой полости рта множественные геморрагии и подслизистые гематомы, склеры чистые, отеков нет. Доступные пальпации периферические лимфатические узлы не увеличены. Суставы не деформированы. Дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в минуту. Тоны сердца приглушены, ритмичные. Частота сердечных сокращений – 84 уд/мин. Артериальное давление – 90/60 мм рт. ст. Живот мягкий, безболезненный. Размеры печени и селезенки, по данным перкуссии, не увеличены. Поколачивание по пояснице безболезненно с обеих сторон. При проведении электрокардиографии обнаружены выраженные изменения миокарда левого желудочка, неполная блокада правой ножки пучка Гиса.
При поступлении в клиническом анализе крови выявлена изолированная выраженная тромбоцитопения до 8×109/л, биохимический анализ крови и общий анализ мочи без особенностей. Антинейтрофильные антитела и маркеры системных заболеваний обнаружены не были. Исследование антител к тромбоцитам показало повышенный результат – 1:80 (при норме 1:10). В результате введения «пульсовых» доз ГКС (2000 мг на курс) с назначением препарата в инициальной дозе 40 мг/сут и последующим медленным снижением до 12 мг/сут геморрагический синдром был купирован, в общем анализе крови зарегистрирован прирост тромбоцитов до 37×109/л, спустя три недели – 222×109/л (рис. 4).
В дальнейшем сохраняется стабильное состояние, на данный момент получает поддерживающие дозы ГКС.
Обсуждение
Описания критической тромбоцитопении, ассоциированной с саркоидозом, в литературе немногочисленны. Еще в 1960 г. опубликовано исследование 381 случая тромбоцитопении с подтвержденным в 5 случаях саркоидозом. А в серии из 324 случаев саркоидоза у 2% пациентов наблюдалась тромбоцитопения меньше 100×109/л [2, 4]. По данным французских исследователей G. Moulis и соавт., из 3771 случая иммунной тромбоцитопении (ИТП) саркоидоз составил 0,62% пациентов с ИТП и 3,47% – пациентов с вторичной ИТП [5].Существует три механизма тромбоцитопении при саркоидозе. Первый механизм связывают с гиперспленизмом и спленомегалией. К спленомегалии относится 10% случаев ИТП [6]. В серии аутопсий гранулемы селезенки выявлены в 60% случаев [7]. Секвестрация в селезенке приводит к разрушению тромбоцитов. В некоторых случаях спленомегалия связана с гиперспленизмом, вторичным по отношению к портальной гипертензии и периферической панцитопении. Иногда спленомегалия сочетается с аутоиммунным компонентом, что приводит к разрушению тромбоцитов [2, 8].
 К аутоиммунной тромбоцитопении относят варианты заболевания с подтвержденным саркоидозом, когда количество тромбоцитов сохраняется менее 100, что не связано с побочным эффектом лекарственных препаратов, отсутствием спленомегалии/гиперсленизма [7].
К аутоиммунной тромбоцитопении относят варианты заболевания с подтвержденным саркоидозом, когда количество тромбоцитов сохраняется менее 100, что не связано с побочным эффектом лекарственных препаратов, отсутствием спленомегалии/гиперсленизма [7].Гранулематозная инфильтрация костного мозга при саркоидозе как причина гематологических аномалий встречается редко и, как правило, не связана с тромбоцитопенией. В исследовании Access Research Group у 29 (3,9%) из 736 пациентов обнаружены гранулемы в костном мозге, но изменений в количестве клеток крови не зарегистрировано [9].
Обсуждаются также аутоиммунные нарушения, характеризующиеся повышением активности Т-хелперов и избыточным синтезом медиаторов повреждения. Имеются сообщения об аутоиммунной гемолитической анемии и идиопатической тромбоцитопенической пурпуре при саркоидозе. В 1985 г. Джеффри Лоуренс и Бернард Гринберг обнаружили повышение уровня IgG, ассоциированного с тромбоцитами, у пациента с тромбоцитопенией и саркоидозом и предположили, что повреждение тромбоцитов опосредовано появлением антител [10].
Особенность прогрессирования саркоидоза у нашей больной была представлена присоединением внелегочных поражений при отсутствии динамики со стороны легочного процесса. В дебюте клиническая картина соответствовала острому варианту саркоидоза, описанного С.Х. Лёфгреном в виде внутригрудной лимфаденопатии и узловатой эритемы. Следующий эпизод обострения болезни был представлен сочетанием кожных изменений с нейросаркоидозом, воспроизводящим клинику острого неврита, с поражением черепно-мозговых нервов. При этом взаимосвязь с потенциальными триггерами болезни отсутствовала. Развитие тромбоцитопении можно, с одной стороны, расценивать как проявление саркоидоза, но факт наличия у больной симптомов ОРВИ, хронологически совпавших с гематологическими сдвигами, и антитела к коронавирусной инфекции дают основание рассматривать вирус SARS-CoV-2 как триггер гематологических нарушений.
Обсуждаются следующие гипотезы влияния SARS-CoV-2 на тромбоцитарное звено. Во-первых, воздействие вируса на костный мозг, опосредованное через CD13-рецепторы, а также медиаторы в процессе развития «цитокинового шторма» индуцируют апоптоз клеток костного мозга. Во-вторых, усиление агрегации тромбоцитов в ответ на вирусное повреждение эндотелия легких с формированием микротромбов и развитием тромботической микроангиопатии [11]. Следует отметить, что у больной отсутствовала значимая динамика МСКТ-признаков саркоидоза легких за исключением нескольких участков «матового стекла», что может быть аргументом в пользу вирусиндуцированного генеза тромбоцитопении.
В настоящее время нет рекомендаций по лечению тромбоцитопении при саркоидозе. Хороший эффект в ответ на ГКС позволяет рекомендовать их как препарат выбора в режиме высоких доз в сочетании с внутривенным введением иммуноглобулина (intravenous immunoglobulin – IVIg) 1 г/кг в день в течение 3 дней и, при необходимости, переливания тромбоцитов.
Спленэктомию следует выполнять только пациентам, у которых тромбоцитопения не контролируется терапией стероидами или IVIg. Также имеются данные об эффективности ритуксимаба и аналогичных препаратов на основе моноклональных антител к CD20 [1].
В литературе описаны случаи тяжелой резистентной к терапии идиопатической тромбоцитопенической пурпуры, ассоциированной с саркоидозом, осложнившейся обильным кровотечением, и повлекшей смерть у 15% пациентов. Среди факторов, усугубляющих тяжесть геморрагического синдрома, следует учитывать позднее начало лечения либо недостаточные дозы препаратов. Учитывая риск жизнеугрожающих последствий у больных саркоидозом, при снижении тромбоцитов тромбоцитопенией менее чем 30×109/л обосновано назначение высоких доз стероидов, по показаниям – введение IVIg, при отсутствии эффекта – назначение моноклональных антител [7].
Таким образом, при тромбоцитопении у больных саркоидозом возможны тяжелые изменения со стороны системы крови. Тромбоцитопения при саркоидозе встречается редко, механизмы ее недостаточно расшифрованы, и обсуждаются, прежде всего, аутоиммунные нарушения. В период пандемии риск гематологических аномалий и геморрагического синдрома у больных саркоидозом возрастает. При этом стероиды остаются наиболее эффективным препаратом в рамках первой линии терапии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Пономарева Л.А. – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: liubaponomareva18@yandex.ru
L.A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: liubaponomareva18@yandex.ru
Панченко Людмила Александровна – д-р мед. наук, проф. каф. госпитальной терапии №1, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»
Lyudmila A. Panchenko – D. Sci. (Med.), Prof., Yevdokimov Moscow State University of Medicine and Dentistry
Пономарев Андрей Борисович – канд. мед. наук, доц. каф. патологической анатомии им. А.И. Струкова, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Andrei B. Ponomarev – Cand. Sci. (Med.), Associate Prof., Sechenov First Moscow State Medical University (Sechenov University)
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Путинцев Юрий Викторович – рук. консультативно-диагностического центра ЧУЗ ЦКБ «РЖД-Медицина». E-mail: y_putincev@mail.ru
Yury V. Putintsev – Chief of the consultative and diagnostic center of the private healthcare institution “Central clinical hospital “RZD-Medicine”. E-mail: y_putincev@mail.ru
Статья поступила в редакцию / The article received: 24.11.2020
Статья принята к печати / The article approved for publication: 27.11.2020
Список исп. литературыСкрыть список1. Baughman RP, Teirstein AS, Judson MA et al; Case Control Etiologic Study of Sarcoidosis (ACCESS) research group. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164 (10 pt. 1): 1885–9.
2. Kayar Y, Kayar NB, Unver N, Ekinci I. Sarcoidosis Presenting with Severe Thrombocytopenia. Int J Respir Pulm Med 2016; 3: 056. DOI: 10.23937/2378-3516/1410056
3. Пономарева Л.А., Гурова Д.В., Попова Е.Н. и др. Метотрексат – индуцированное поражение легких у больной ревматоидным артритом: клиническое наблюдение и обзор литературы. Терапевтический архив. 2021; 3.
[Ponomareva L.A., Gurova D.V., Popova E.N. et al. Metotreksat – indutsirovannoe porazhenie legkikh u bol'noi revmatoidnym artritom: klinicheskoe nabliudenie i obzor literatury. Terapevticheskii arkhiv. 2021; 3 (in Russian).]
4. Larner AJ, Dollery CT, Cox TM et al. Life threatening thrombocytopenia in sarcoidosis. BMJ 1990; 300 (6720): 317–9. DOI: 10.1136/bmj.300.6720.317
5. Moulis G, Palmaro A, Montastruc JL et al. Epidemiology of incident immune thrombocytopenia: a nationwide population-based study in France. Blood 2014; 124 (22): 3308–15. DOI: 10.1182/blood-2014-05-578336. PMID: 25305203.
6. Fordice J, Katras T, Jackson RE et al. Massive splenomegaly in sarcoidosis. South Med J 1992; 85 (7): 775–8. DOI: 10.1097/00007611-199207000-00028. PMID: 1631702.
7. Mahévas M, Chiche L, Uzunhan Y et al. Association of sarcoidosis and immune thrombocytopenia: presentation and outcome in a series of 20 patients. Medicine (Baltimore) 2011; 90 (4): 269–78. DOI: 10.1097/MD.0b013e31822618b3
8. Mahévas M, Le Page L, Salle V et al. Thrombocytopenia in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2006; 23 (3): 229–35. PMID: 18038923.
9. Judson MA, Costabel U, Drent M et al. The WASOG sarcoidosis organ assessment instrument: an update of a previous clinical tool. Sarcoidosis Vasc Diffuse Lung Dis 2014; 31: 19–27.
10. Lawrence HJ, Greenberg BR. Autoimmune thrombocytopenia in sarcoidosis. Am J Med 1985; 79 (6): 761–4. DOI: 10.1016/0002-9343(85)90528-5. PMID: 4073111.
11. Xu P, Zhou Q, Xu J. Mechanism of thrombocytopenia in COVID-19 patients. Ann Hematol 2020; 99 (6): 1205–8. DOI: 10.1007/s00277-020-04019-0
12. Crouser ED, Lozanski G, Fox CC et al. The CD4+ lymphopenic sarcoidosis phenotype is highly responsive to anti-tumor necrosis factor-alpha therapy. Chest 2010; 137: 1432–5.
13. Nagaharu K, Masuya M, Kawakami K, Katayama N. Successful Management of Immune Thrombocytopenia Presenting with Lethal Alveolar Hemorrhage. Case Rep Hematol 2019; 2019: 5170282. DOI: 10.1155/2019/5170282
14. Judson MA, Baughman RP, Teirstein AS et al. Defining organ involvement in sarcoidosis: the ACCESS proposed instrument. ACCESS Research Group. A Case Control Etiologic Study of Sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 1999; 16 (1): 75–86.
17 декабря 2020
Количество просмотров: 11062

