Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2012
Эффективность агомелатина при терапии атипичной депрессии №03 2012
Номера страниц в выпуске:25-30
Цель работы – определение эффективности агомелатина при терапии атипичной депрессии в зависимости от ее клинической типологии и варианта течения аффективного расстройства (биполярного, униполярного).
Резюме. Цель работы – определение эффективности агомелатина при терапии атипичной депрессии в зависимости от ее клинической типологии и варианта течения аффективного расстройства (биполярного, униполярного).
Материалы и методы: изучено 60 больных с атипичной депрессией и 60 пациентов с меланхолической депрессией при помощи клинической оценки, шкал ADDS, BDI, HDRS-17, LSEQ, GAF.
Результаты: агомелатин показал высокую эффективность при атипичной (88,3%) и меланхолической депрессии (83,3%). Скорость наступления первичного респонса (редукция баллов HDRS-17 на 25%) отражала быстроту формирования респонса/ремиссии. Препарат проявлял мультимодальное действие, достигая эффективности при атипичной депрессии и меланхолической депрессии, характеризующихся противоположной направленностью вегетативных симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), что, возможно, объясняется ресинхронизирующим механизмом действия препарата. Агомелатин показал высокую эффективность при атипичной депрессии в структуре различного стереотипа течения аффективного расстройства, что свидетельствует о возможности его использования как при лечении униполярной, так и биполярной депрессии.
Ключевые слова: атипичная депрессия, первичный респонс, циркадианный ритм, мелатонин, агомелатин.
Efficacy of agomelatine in the treatment of atypical depression
M.P.Marachev
The Serbsky National Research Centre for Social & Forensic Psychiatry
Summary. The aim of this article was to determine agomelatine efficacy in the treatment of atypical depression (AD), depending on its clinical typology and types of the course of affective disorders (bipolar, unipolar). Material and methods: studied 60 patients with AD and 30 patients with melancholic depression (MD) with clinical assessment scales ADDS, BDI, HDRS-17, LSEQ, GAF. Results: agomelatine showed high efficacyin the atypical (88,3%) and MD (83,3%). Speed of onset of primary response (reduction of HDRS-17 score of 25%) reflects the rapidity of the formation of response/remission. The drug showed a multimodal action, achieving efficacyin the AD and MD, characterized by the opposite orientation of vegetative symptoms (hypersomnia/insomnia, hyperphagia/gipofagiya), which may be due to resynchronization mechanism of drug action. Agomelatine showed high efficacy in atypical depression in the structure of both unipolar and bipolar affective disorder, so agomelatine can be used in the treatment of both unipolar and bipolar depression.
Key words: atypical depression, primary response, circadian rhythm, melatonin, agomelatine.
Появление и последующее развитие концепции атипичной депрессии (АД) тесно связано с антидепрессантами из группы ингибиторов моноаминоксидазы (ИМАО). В 1959 г. при поиске новых терапевтических мишеней для ИМАО E.West и P.Dally была выделена группа пациентов с отличными от классической депрессии симптомами, при лечении которых эффективность фенелзина превосходила трициклический антидепрессант – имипрамин [37]. С этого времени ИМАО стали рассматриваться как эталонные препараты для лечения АД, что было подтверждено большим количеством исследований, в том числе плацебо-контролируемых [16, 25, 26, 32]. Появление новых групп антидепрессантов (СИОЗС, СИОЗСН и др.) стимулировало проведение ряда исследований, направленных на изучение их эффективности при АД, которые несколько «пошатнули» первоначальные стандарты терапии. Первым препаратом из группы СИОЗС, который превысил плацебо по степени редукции атипичной симптоматики, был флуоксетин [23]. В другом сравнительном исследовании флуоксетина и фенелзина была выявлена сопоставимая динамика обратного развития симптомов АД при превосходстве флуоксетина по показателям переносимости терапии [22]. Обратимый ИМАО – моклобемид показал большую эффективность по сравнению с флуоксетином (67 и 55% респондеров соответственно) при терапии АД, но уступал при оценке результативности лечения сертралину [17, 30].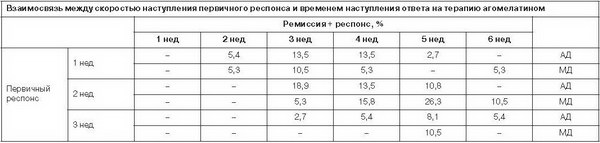
Единичные исследования проводились в отношении других групп антидепрессантов. Так, положительно зарекомендовал себя венлафаксин у лиц с АД в позднем возрасте – 73% респондеров [28] и гепирон (аналог буспирона) – 62% респондеров [18]. Другие антидепрессанты, такие как миртазапин, миансерин, эсциталопрам, дулоксетин и циталопрам, обнаружили хорошую эффективность в отношении депрессии с атипичными особенностями [14, 19, 21, 33, 34], но результаты этих исследований не могут рассматриваться как валидные, во-первых, из-за малых выборок и, во-вторых, из-за отсутствия сравнения с плацебо.
Современная психофармакотерапия АД во многом обусловлена имеющимися в настоящее время концептуальными представлениями об этом расстройстве.
В соответствии с одной точкой зрения АД представляет собой самостоятельную нозологическую категорию, характеризующуюся такими специфическими симптомами, как реактивность настроения (РН), гиперсомния, гиперфагия, свинцовый паралич, чувствительность к неприя-тию – ЧН [27]. По мнению других исследователей, симптомы АД в большей степени отражают реакцию гистрионных личностей в условиях стресса – истероидная дисфория [24, 36]. Третья, наиболее распространенная точка зрения, отводит АД прочное место в структуре биполярного спектра расстройств как промежуточного состояния между рекуррентным депрессивным расстройством (РДР) и биполярным аффективным расстройством (БАР) типа II [12]. Согласно представлениям F.Benazzi [13] АД является одним из ключевых предикторов БАР II, а инверсированные вегетативные симптомы – ИВС (гиперфагия, гиперсомния), по его мнению, относятся к специфическим диагностическим характеристикам данного расстройства.
Наличие симптомов, характерных для АД, в структуре аффективных расстройств с циклическим течением, таких как БАР, РДР [3], позволяет предположить связь патогенеза АД с дезинтеграцией биологических ритмов, в первую очередь циркадианных, что дает возможность рассматривать АД как модель для изучения нарушений, связанных с десинхронизацией ритмологических процессов [2], а поиск терапевтических стратегий осуществлять в соответствии с этой гипотезой.
Роль мелатонина в регуляции циркадианных ритмов, а следовательно, и патогенезе аффективных расстройств, установлена в результате многочисленных исследований [4, 8, 15]. По мнению некоторых авторов, экзацербация депрессивных нарушений сопровождается фазовым сдвигом пиковых концентраций мелатонина либо в сторону более раннего периода (характерно для БАР) [31], либо, напротив, более позднего (характерно для РДР) [10, 29]. Другие исследователи [35, 38, 39] считают, что патогенетическая основа развития депрессии связана с изменением амплитуды секреции гормона сна.
С учетом ключевой роли мелатонина в поддержании нормального функционирования циркадианных ритмов антидепрессант агомелатин (Вальдоксан), действующий как на серотонинергическую (антагонист НТ2С-рецепторов), так и на мелатонинергическую (агонист МТ1-, МТ2-рецепторов) системы и приводящий к ресинхронизации циркадианных процессов, можно рассматривать в качестве препарата первого выбора при терапии как типичной, так и АД.
Сегодня накоплен большой клинический опыт применения агомелатина при лечении депрессивных расстройств разной степени тяжести. Его клиническая эффективность была подтверждена в масштабных международных исследованиях и в российских наблюдательных программах при лечении больных, как с большим депрессивным расстройством, так и с БАР типа II, в том числе при тяжелой депрессии [5, 7, 9, 20].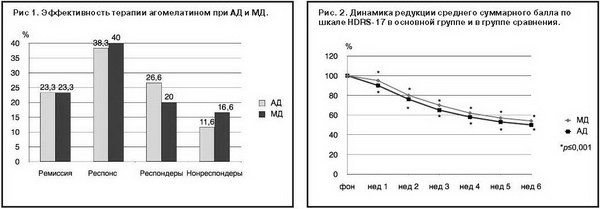 Имеются единичные работы, посвященные применению агомелатина для купирования симптомов АД. Так, в одном исследовании при сравнительном анализе трех классов антидепрессантов (СИОЗС, СИОЗСН, агомелатин) была установлена большая эффективность агомелатина в отношении атипичной симптоматики при сопоставимых показателях редукции суммарного балла по шкале HDRS-21 [11].
Имеются единичные работы, посвященные применению агомелатина для купирования симптомов АД. Так, в одном исследовании при сравнительном анализе трех классов антидепрессантов (СИОЗС, СИОЗСН, агомелатин) была установлена большая эффективность агомелатина в отношении атипичной симптоматики при сопоставимых показателях редукции суммарного балла по шкале HDRS-21 [11].
В другом исследовании агомелатин использовался в качестве монотерапии (n=56) при типичной и АД. Полученные данные показали почти равный процент респондеров к концу 6-й недели терапии (47,6 и 48,6% при АД и типичной депрессии соответственно), однако у пациентов с АД ответ на терапию наступал быстрее и уже на 2-й неделе лечения наблюдался в 42,9% случаях. Сходная ситуация отмечалась и с достижением ремиссии (редукция баллов по шкале HAMD-17≤7), которая наступала раньше при АД и на 2-й неделе терапии составила 38,1% в отличие от типичной депрессии (14,3%). Такая тенденция сохранялась вплоть до завершения терапии, постепенно нивелируясь, но сохраняя статистическую значимость: АД (47,6%), ТД (42,9%) [9].
Косвенным свидетельством успешного применения агомелатина для лечения АД может служить исследование ученых из Сибири, показавших, что наличие нетипичного для меланхолической депрессии (МД) суточного ритма является клиническим предиктором наиболее полного ответа на терапию [5]. Таким образом, агомелатин с его ресинхронизирующим «классическим» действием является перспективным антидепрессантом для лечения АД.
Цель работы – определение эффективности агомелатина при терапии АД (DSM-IV) в зависимости от ее клинической типологии и варианта течения аффективного расстройства (биполярного, униполярного).
Материалы и методы
Исследование было выполнено в отделении новых средств и методов терапии отдела пограничной психиатрии ГНЦССП им. В.П.Сербского на базе Московской городской клинической психиатрической больницы №12. В исследование включались больные, находящиеся на амбулаторном и стационарном лечении, в возрасте от 18 до 65 лет, с диагнозом «депрессивный эпизод» – ДЭ (диагнозы по Международной классификации болезней 10-го пересмотра: F31.3, F32, F32.1, F33.0, F33.1), в структуре которого выявлялись симптомы АД.
Критерии исключения: лица с психотическим уровнем нарушений, шизофренией, шизотипическими и бредовыми расстройствами, пациенты с тяжелыми соматическими заболеваниями в стадии обострения, злоупотребляющие психоактивными веществами, и беременные женщины.
Изученную выборку составили 60 больных с симптомами АД (основная группа) и 30 пациентов с МД (контрольная группа). Для 2 групп было отмечено превалирование лиц женского пола (АД – 86,6%, МД – 83,3%), однако пациенты с АД были моложе (38,3±13,2 против 44,3±7,3 в контрольной группе). Фоновые показатели уровня социального функционирования, оцениваемые по шкале общего функционирования (GAF), не различались между группами (59,2±7,3 при АД и 61,5±7,1 при МД).
Нозологическая принадлежность пациентов сравниваемых групп характеризовалась преобладанием в основной группе лиц с диагнозами: БАР – 20% и ДЭ – 55% (13,3 и 36,6% при МД соответственно), в то время как в контрольной группе депрессивное расстройство у половины пациентов формировалось в рамках РДР (по сравнению с 25% при АД).
Особенности клинической картины, динамика состояния больных оценивались с помощью клинико-психопатологического и психометрического методов с использованием следующих шкал: оценки АД (ADDS), шкалы депрессии Гамильтона (HDRS-17), самооценки депрессии Бека, самоопросника нарушений сна (LSEQ), шкал общего функционирования (GAF). Включенным в исследование пациентам проводилась монотерапия агомелатином в дозировке 25 мг/сут в течение 6 нед с возможностью (при отсутствии эффективности в течение первых 2 нед лечения) повышения дозы до 50 мг/сут. Статистический анализ осуществлялся лицензионными статистическими пакетами SPSS 20.0. Применялись двусторонние статистические критерии (уровень значимости не менее p≤0,05).
Включенным в исследование пациентам проводилась монотерапия агомелатином в дозировке 25 мг/сут в течение 6 нед с возможностью (при отсутствии эффективности в течение первых 2 нед лечения) повышения дозы до 50 мг/сут. Статистический анализ осуществлялся лицензионными статистическими пакетами SPSS 20.0. Применялись двусторонние статистические критерии (уровень значимости не менее p≤0,05).
Средний суммарный балл по шкале HDRS-17 был сопоставим в 2 группах и равнялся 22,4±4,0 балла при АД, 22,6±2,7 балла при МД. Аналогичная ситуация наблюдалась и в отношении среднего балла по шкале Бека (37,8±7,7 и 38,2±7,8 соответственно), что позволяло проводить сравнительную оценку психофармакотерапии в изученных группах.
Результаты и обсуждение
Эффективность проведенной терапии оценивалась по количеству пациентов, находящихся в ремиссии (балл по HDRS-17≤7), достигших респонса (редукция по шкале HDRS-17 от 7 баллов и до 50%), частичного респонса (редукция балла по HDRS-17≥25%, но менее 50%) и не ответивших на терапию нонреспондеров (редукция балла по HDRS-17≤25%). Процент больных, достигших ремиссии и респонса, не различался в сравниваемых группах, в то время как доля парциальных респондеров была несколько выше у пациентов с АД (26,6% против 20% в группе МД), а процент нонреспондеров, напротив, был выше в группе с МД (16,6% против 11,6% в группе АД). Полученные результаты не имели статистической значимости (рис. 1). Динамика обратного развития симптомов депрессии по шкале HDRS-17 также не выявила достоверных различий между сравниваемыми группами (p>0,05) на протяжении всего периода лечения. При этом уже на 1-й неделе терапии редукция среднего балла по шкале HDRS-17 была статистически значимой по сравнению с фоновыми показателями как при АД, так и при МД (p<0,001) (рис. 2).
Первичный респонс, являющийся одним из ключевых предикторов эффективности фармакотерапии [1] и оцениваемый как снижение баллов по шкале HDRS-17 на 25%, у 94,3% пациентов основной группы и у 84% – контрольной группы формировался уже в первые 3 нед лечения (рис. 3), свидетельствуя о раннем появлении терапевтического ответа, особенно у больных с АД.
По результатам предыдущих исследований [1, 40] было показано, что от скорости наступления первичного респонса прямо пропорционально зависят скорость формирования ответа на лечение и ремиссия. В нашем исследовании эта связь также была подтверждена. Так, при формировании первичного респонса на 1-й неделе лечения ответ на терапию развивался уже ко 2-й неделе в 2 группах (5,4% при АД, 5,3% при МД), достигая своего максимума к 3 и 4-й неделе (13,5% при АД, 10,5 и 5,3% при МД соответственно). Наличие первичного ответа на терапию на 2-й неделе сдвигало сроки достижения ремиссии и респонса к 3-й неделе лечения в 2 группах. При этом в основной группе процент пациентов, ответивших на терапию, был почти в 4 (18,9%) раза выше, чем в группе сравнения (5,3%). В целом в основной группе по сравнению с контрольной отмечалось более быстрое формирование полного ответа на терапию (см. таблицу).
Диссомнические нарушения (шкала LSEQ) редуцировались уже на 1-й неделе терапии в 2 группах. При этом у пациентов с АД более быстрые темпы обратного развития были характерны для таких показателей, как засыпание и качество сна, в то время как для лиц с МД – состояние после сна (p≤0,05). При оценке расстройств сна по шкале HDRS-17 (динамика инсомнии) статистически значимая редукция по сравнению с фоном наступала уже на 1-й неделе терапии (p≤0,001), в то время как по шкале ADDS (динамика гиперсомнии) достоверные различия выявлялись лишь на 2-й неделе лечения (p≤0,05).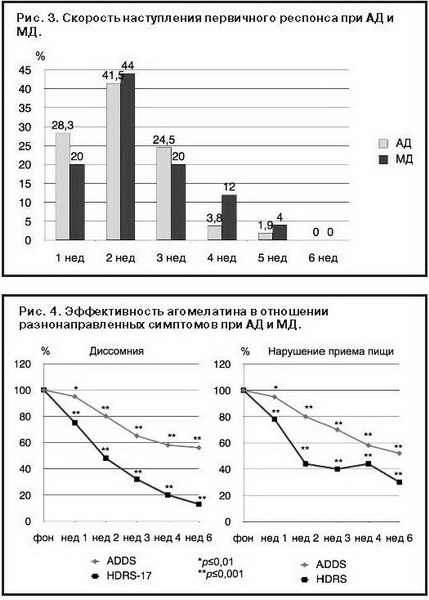 Таким образом, несмотря на противоположную направленность регистрируемых симптомов в фоновом обследовании (инсомния – в основной группе, гиперсомния – в контрольной), агомелатин проявлял мультимодальное действие, достигая эффективности и в том и другом случае. Аналогичная ситуация наблюдалась и при оценке расстройств приема пищи, при которой нормализация в процессе терапии агомелатином наблюдалась как в случае снижения аппетита при МД (HDRS-17), так и в случае его усиления при АД (ADDS) (рис. 4). Эта особенность действия препарата позволяет рассматривать его эффект как модулирующий, связанный с регуляцией вегетативных процессов в соответствии с требованиями ритма «сон–бодрствование» и обусловливающий адекватный выбор поведения с учетом актуализированной потребности.
Таким образом, несмотря на противоположную направленность регистрируемых симптомов в фоновом обследовании (инсомния – в основной группе, гиперсомния – в контрольной), агомелатин проявлял мультимодальное действие, достигая эффективности и в том и другом случае. Аналогичная ситуация наблюдалась и при оценке расстройств приема пищи, при которой нормализация в процессе терапии агомелатином наблюдалась как в случае снижения аппетита при МД (HDRS-17), так и в случае его усиления при АД (ADDS) (рис. 4). Эта особенность действия препарата позволяет рассматривать его эффект как модулирующий, связанный с регуляцией вегетативных процессов в соответствии с требованиями ритма «сон–бодрствование» и обусловливающий адекватный выбор поведения с учетом актуализированной потребности.
Представление о клинической гетерогенности АД позволило разработать ее клиническую типологию с выделением в зависимости от психопатологической дифференциации доминирующих в клинической картине расстройств трех вариантов: 1) с преобладанием РН (26,6%); 2) с преобладанием ИВС (41,6%); 3) с преобладанием ЧН (31,6%) [3].
В соответствии с выделенными вариантами АД были сформированы 3 терапевтические группы пациентов. Количество женщин преобладало во всех 3 сравниваемых выборках, в то время как возраст у пациентов с преобладанием ИВС был несколько ниже (33,5±11,7), чем в остальных группах (42,1±12,8 в группе РН, 41,2±13,6 – ЧН). Фоновые показатели уровня социального функционирования (GAF) не различались между группами (61±7,6 при РН, 59,7±6,6 при ИВС, 57,2±7,6 при ЧН), однако на уровне обозначения тенденции можно было отметить наихудшие показатели социально-трудовой адаптации у лиц с ЧН, промежуточное положение занимали пациенты с преобладанием ИВС, и наиболее социально адаптированными были больные с преобладанием РН.
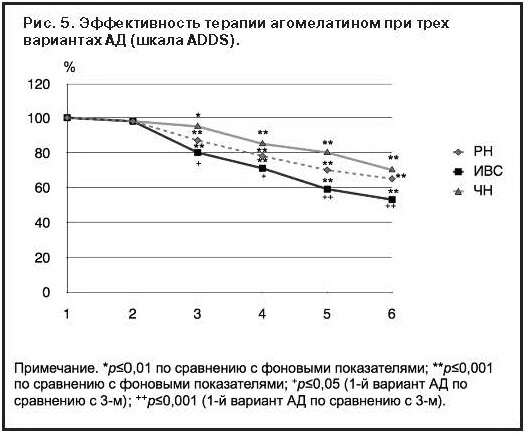
Эффективность терапии агомелатином наблюдалась уже на 3-й неделе терапии (р≤0,01) у пациентов всех 3 терапевтических групп, что подтверждалось статистически значимой по сравнению с фоновыми показателями редукцией общего балла по ADDS. При этом более быстрая динамика атипичных симптомов на всем протяжении лечения наблюдалась в группе с ИВС, статистическая достоверность (р<0,05) достигалась и в группе с ЧН, тогда как у пациентов с РН наблюдалась только тенденция (рис. 5).
Анализ динамики симптоматологического спектра АД, обусловливающего эффективность агомелатина, показал неравномерность обратного развития «ключевых» феноменов (ADDS). Так, на всем протяжении исследования лучше всего редуцировались гиперфагия (52,2%) и гиперсомния (53,8%), несколько хуже РН (59,2%) и свинцовый паралич (61,9%), а наиболее медленная положительная динамика отмечалась у показателя, отражающего ЧН (74%) (рис. 6).
Разработанная типология АД отражала различный стереотип развития аффективного расстройства с высоким уровнем биполярности при депрессии с преобладанием ИВС (36%) и с высоким уровнем монополярности для 2 и 3-го вариантов (43,7 и 31,5%). Это стало основанием для определения чувствительности к психофармакологическому воздействию агомелатином пациентов разных диагностических групп: ДЭ (55%), РДР (25%) и БАР (20%).
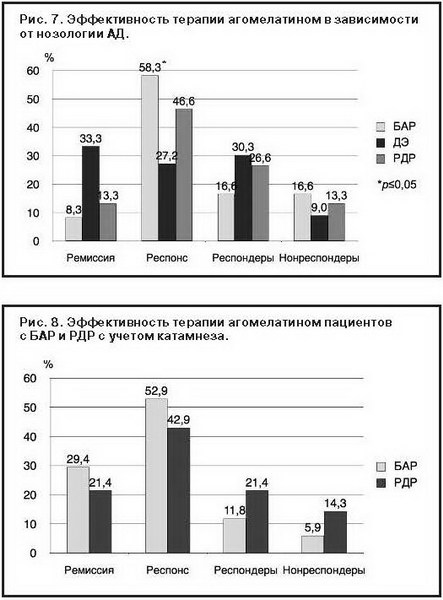
Анализ эффективности агомелатина в зависимости от нозологической принадлежности АД выявил только один статистически достоверный показатель (р<0,05) – частота формирования респонса (58,3%) в структуре БАР преобладала над таковым при ДЭ. Остальные данные не имели статистической достоверности и отражали только тенденцию в преобладании ремиссий у больных с диагнозом ДЭ (33,3%) по сравнению с РДР и БАР (13,3 и 8,3% соответственно), парциального респонса, формирующегося в структуре ДЭ (30,3%) и РДР (26,6%), по сравнению с БАР (16,6%), нонреспондеров среди больных с БАР (16,6%) и РДР (13,3%) по сравнению с ДЭ (9%) (рис. 7).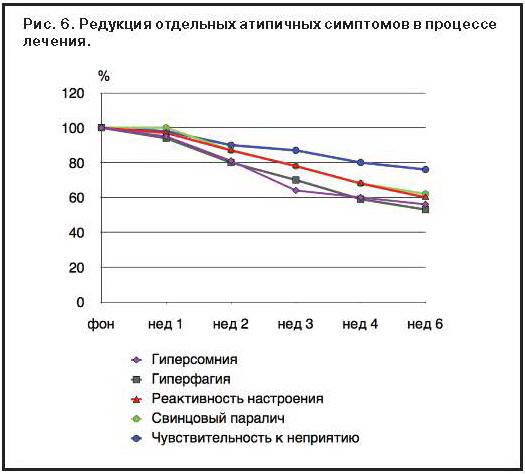
 Результаты 2-летнего катамнестического наблюдения лиц с ДЭ с атипичными чертами привели к изменению первоначального диагноза в 54,5% случаях на БАР (15,1%) и РДР (39,3%). С учетом этого перераспределения варианты ответа на терапию агомелатином существенно не изменились и не достигали статистической значимости
Результаты 2-летнего катамнестического наблюдения лиц с ДЭ с атипичными чертами привели к изменению первоначального диагноза в 54,5% случаях на БАР (15,1%) и РДР (39,3%). С учетом этого перераспределения варианты ответа на терапию агомелатином существенно не изменились и не достигали статистической значимости
(рис. 8). Количество лиц, достигших ремиссии в группе с БАР, увеличилось (29,4% против 21,4% у пациентов с РДР). По количеству респондеров существенных изменений не произошло, их процент остался выше в группе с БАР (52,9%), чем с РДР (42,9%). Другая картина наблюдалась при сравнении количества парциальных респондеров и больных, не ответивших на терапию. Так, процент пациентов, частично отреагировавших на лечение, стал больше в группе с РДР (21,4%) по сравнению с группой БАР (11,8%). Увеличилось число нонреспондеров в группе с РДР (14,3%), а в группе с БАР, напротив, уменьшилось (5,9%).
 Таким образом, агомелатин показал высокую эффективность как у пациентов с АД (88,3%), так и МД (83,3%). Скорость наступления первичного респонса уже в первые 2 нед терапии достигала 69,8% при АД и 64% – при МД, отражая быстроту формирования респонса/ремиссии (3– 5 нед терапии). Несмотря на противоположную направленность характерных для АД и МД симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), агомелатин проявлял мультимодальное действие, достигая эффективности в обоих случаях, что, возможно, объясняется механизмом действия препарата, связанного с его способностью к ресинхронизации нарушенной ритмики у больных с депрессиями.
Таким образом, агомелатин показал высокую эффективность как у пациентов с АД (88,3%), так и МД (83,3%). Скорость наступления первичного респонса уже в первые 2 нед терапии достигала 69,8% при АД и 64% – при МД, отражая быстроту формирования респонса/ремиссии (3– 5 нед терапии). Несмотря на противоположную направленность характерных для АД и МД симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), агомелатин проявлял мультимодальное действие, достигая эффективности в обоих случаях, что, возможно, объясняется механизмом действия препарата, связанного с его способностью к ресинхронизации нарушенной ритмики у больных с депрессиями.
Эффективность агомелатина при АД достигалась за счет гармоничной обратной динамики всех характерных для этого состояния симптомов. Статистическая достоверность наблюдалась только при оценке результативности терапии различных клинических вариантов АД в ряду (по убыванию): ИВС (гиперсомния/гипофагия), ЧН, тогда как в отношении РН можно было говорить лишь о тенденции.
Терапевтическая эффективность агомелатина у пациентов с АД в структуре различного стереотипа течения аффективного расстройства (как с учетом катамнеза, так и без) не выявила статистически значимых различий, что свидетельствует о возможности использования агомелатина как при лечении униполярной, так и биполярной депрессии.
Сведения об авторе
Марачев Максим Павлович – мл. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава РФ. E-mail: marachevm@gmail.com
Материалы и методы: изучено 60 больных с атипичной депрессией и 60 пациентов с меланхолической депрессией при помощи клинической оценки, шкал ADDS, BDI, HDRS-17, LSEQ, GAF.
Результаты: агомелатин показал высокую эффективность при атипичной (88,3%) и меланхолической депрессии (83,3%). Скорость наступления первичного респонса (редукция баллов HDRS-17 на 25%) отражала быстроту формирования респонса/ремиссии. Препарат проявлял мультимодальное действие, достигая эффективности при атипичной депрессии и меланхолической депрессии, характеризующихся противоположной направленностью вегетативных симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), что, возможно, объясняется ресинхронизирующим механизмом действия препарата. Агомелатин показал высокую эффективность при атипичной депрессии в структуре различного стереотипа течения аффективного расстройства, что свидетельствует о возможности его использования как при лечении униполярной, так и биполярной депрессии.
Ключевые слова: атипичная депрессия, первичный респонс, циркадианный ритм, мелатонин, агомелатин.
Efficacy of agomelatine in the treatment of atypical depression
M.P.Marachev
The Serbsky National Research Centre for Social & Forensic Psychiatry
Summary. The aim of this article was to determine agomelatine efficacy in the treatment of atypical depression (AD), depending on its clinical typology and types of the course of affective disorders (bipolar, unipolar). Material and methods: studied 60 patients with AD and 30 patients with melancholic depression (MD) with clinical assessment scales ADDS, BDI, HDRS-17, LSEQ, GAF. Results: agomelatine showed high efficacyin the atypical (88,3%) and MD (83,3%). Speed of onset of primary response (reduction of HDRS-17 score of 25%) reflects the rapidity of the formation of response/remission. The drug showed a multimodal action, achieving efficacyin the AD and MD, characterized by the opposite orientation of vegetative symptoms (hypersomnia/insomnia, hyperphagia/gipofagiya), which may be due to resynchronization mechanism of drug action. Agomelatine showed high efficacy in atypical depression in the structure of both unipolar and bipolar affective disorder, so agomelatine can be used in the treatment of both unipolar and bipolar depression.
Key words: atypical depression, primary response, circadian rhythm, melatonin, agomelatine.
Появление и последующее развитие концепции атипичной депрессии (АД) тесно связано с антидепрессантами из группы ингибиторов моноаминоксидазы (ИМАО). В 1959 г. при поиске новых терапевтических мишеней для ИМАО E.West и P.Dally была выделена группа пациентов с отличными от классической депрессии симптомами, при лечении которых эффективность фенелзина превосходила трициклический антидепрессант – имипрамин [37]. С этого времени ИМАО стали рассматриваться как эталонные препараты для лечения АД, что было подтверждено большим количеством исследований, в том числе плацебо-контролируемых [16, 25, 26, 32]. Появление новых групп антидепрессантов (СИОЗС, СИОЗСН и др.) стимулировало проведение ряда исследований, направленных на изучение их эффективности при АД, которые несколько «пошатнули» первоначальные стандарты терапии. Первым препаратом из группы СИОЗС, который превысил плацебо по степени редукции атипичной симптоматики, был флуоксетин [23]. В другом сравнительном исследовании флуоксетина и фенелзина была выявлена сопоставимая динамика обратного развития симптомов АД при превосходстве флуоксетина по показателям переносимости терапии [22]. Обратимый ИМАО – моклобемид показал большую эффективность по сравнению с флуоксетином (67 и 55% респондеров соответственно) при терапии АД, но уступал при оценке результативности лечения сертралину [17, 30].

Единичные исследования проводились в отношении других групп антидепрессантов. Так, положительно зарекомендовал себя венлафаксин у лиц с АД в позднем возрасте – 73% респондеров [28] и гепирон (аналог буспирона) – 62% респондеров [18]. Другие антидепрессанты, такие как миртазапин, миансерин, эсциталопрам, дулоксетин и циталопрам, обнаружили хорошую эффективность в отношении депрессии с атипичными особенностями [14, 19, 21, 33, 34], но результаты этих исследований не могут рассматриваться как валидные, во-первых, из-за малых выборок и, во-вторых, из-за отсутствия сравнения с плацебо.
Современная психофармакотерапия АД во многом обусловлена имеющимися в настоящее время концептуальными представлениями об этом расстройстве.
В соответствии с одной точкой зрения АД представляет собой самостоятельную нозологическую категорию, характеризующуюся такими специфическими симптомами, как реактивность настроения (РН), гиперсомния, гиперфагия, свинцовый паралич, чувствительность к неприя-тию – ЧН [27]. По мнению других исследователей, симптомы АД в большей степени отражают реакцию гистрионных личностей в условиях стресса – истероидная дисфория [24, 36]. Третья, наиболее распространенная точка зрения, отводит АД прочное место в структуре биполярного спектра расстройств как промежуточного состояния между рекуррентным депрессивным расстройством (РДР) и биполярным аффективным расстройством (БАР) типа II [12]. Согласно представлениям F.Benazzi [13] АД является одним из ключевых предикторов БАР II, а инверсированные вегетативные симптомы – ИВС (гиперфагия, гиперсомния), по его мнению, относятся к специфическим диагностическим характеристикам данного расстройства.
Наличие симптомов, характерных для АД, в структуре аффективных расстройств с циклическим течением, таких как БАР, РДР [3], позволяет предположить связь патогенеза АД с дезинтеграцией биологических ритмов, в первую очередь циркадианных, что дает возможность рассматривать АД как модель для изучения нарушений, связанных с десинхронизацией ритмологических процессов [2], а поиск терапевтических стратегий осуществлять в соответствии с этой гипотезой.
Роль мелатонина в регуляции циркадианных ритмов, а следовательно, и патогенезе аффективных расстройств, установлена в результате многочисленных исследований [4, 8, 15]. По мнению некоторых авторов, экзацербация депрессивных нарушений сопровождается фазовым сдвигом пиковых концентраций мелатонина либо в сторону более раннего периода (характерно для БАР) [31], либо, напротив, более позднего (характерно для РДР) [10, 29]. Другие исследователи [35, 38, 39] считают, что патогенетическая основа развития депрессии связана с изменением амплитуды секреции гормона сна.
С учетом ключевой роли мелатонина в поддержании нормального функционирования циркадианных ритмов антидепрессант агомелатин (Вальдоксан), действующий как на серотонинергическую (антагонист НТ2С-рецепторов), так и на мелатонинергическую (агонист МТ1-, МТ2-рецепторов) системы и приводящий к ресинхронизации циркадианных процессов, можно рассматривать в качестве препарата первого выбора при терапии как типичной, так и АД.
Сегодня накоплен большой клинический опыт применения агомелатина при лечении депрессивных расстройств разной степени тяжести. Его клиническая эффективность была подтверждена в масштабных международных исследованиях и в российских наблюдательных программах при лечении больных, как с большим депрессивным расстройством, так и с БАР типа II, в том числе при тяжелой депрессии [5, 7, 9, 20].
 Имеются единичные работы, посвященные применению агомелатина для купирования симптомов АД. Так, в одном исследовании при сравнительном анализе трех классов антидепрессантов (СИОЗС, СИОЗСН, агомелатин) была установлена большая эффективность агомелатина в отношении атипичной симптоматики при сопоставимых показателях редукции суммарного балла по шкале HDRS-21 [11].
Имеются единичные работы, посвященные применению агомелатина для купирования симптомов АД. Так, в одном исследовании при сравнительном анализе трех классов антидепрессантов (СИОЗС, СИОЗСН, агомелатин) была установлена большая эффективность агомелатина в отношении атипичной симптоматики при сопоставимых показателях редукции суммарного балла по шкале HDRS-21 [11].
В другом исследовании агомелатин использовался в качестве монотерапии (n=56) при типичной и АД. Полученные данные показали почти равный процент респондеров к концу 6-й недели терапии (47,6 и 48,6% при АД и типичной депрессии соответственно), однако у пациентов с АД ответ на терапию наступал быстрее и уже на 2-й неделе лечения наблюдался в 42,9% случаях. Сходная ситуация отмечалась и с достижением ремиссии (редукция баллов по шкале HAMD-17≤7), которая наступала раньше при АД и на 2-й неделе терапии составила 38,1% в отличие от типичной депрессии (14,3%). Такая тенденция сохранялась вплоть до завершения терапии, постепенно нивелируясь, но сохраняя статистическую значимость: АД (47,6%), ТД (42,9%) [9].
Косвенным свидетельством успешного применения агомелатина для лечения АД может служить исследование ученых из Сибири, показавших, что наличие нетипичного для меланхолической депрессии (МД) суточного ритма является клиническим предиктором наиболее полного ответа на терапию [5]. Таким образом, агомелатин с его ресинхронизирующим «классическим» действием является перспективным антидепрессантом для лечения АД.
Цель работы – определение эффективности агомелатина при терапии АД (DSM-IV) в зависимости от ее клинической типологии и варианта течения аффективного расстройства (биполярного, униполярного).
Материалы и методы
Исследование было выполнено в отделении новых средств и методов терапии отдела пограничной психиатрии ГНЦССП им. В.П.Сербского на базе Московской городской клинической психиатрической больницы №12. В исследование включались больные, находящиеся на амбулаторном и стационарном лечении, в возрасте от 18 до 65 лет, с диагнозом «депрессивный эпизод» – ДЭ (диагнозы по Международной классификации болезней 10-го пересмотра: F31.3, F32, F32.1, F33.0, F33.1), в структуре которого выявлялись симптомы АД.
Критерии исключения: лица с психотическим уровнем нарушений, шизофренией, шизотипическими и бредовыми расстройствами, пациенты с тяжелыми соматическими заболеваниями в стадии обострения, злоупотребляющие психоактивными веществами, и беременные женщины.
Изученную выборку составили 60 больных с симптомами АД (основная группа) и 30 пациентов с МД (контрольная группа). Для 2 групп было отмечено превалирование лиц женского пола (АД – 86,6%, МД – 83,3%), однако пациенты с АД были моложе (38,3±13,2 против 44,3±7,3 в контрольной группе). Фоновые показатели уровня социального функционирования, оцениваемые по шкале общего функционирования (GAF), не различались между группами (59,2±7,3 при АД и 61,5±7,1 при МД).
Нозологическая принадлежность пациентов сравниваемых групп характеризовалась преобладанием в основной группе лиц с диагнозами: БАР – 20% и ДЭ – 55% (13,3 и 36,6% при МД соответственно), в то время как в контрольной группе депрессивное расстройство у половины пациентов формировалось в рамках РДР (по сравнению с 25% при АД).
Особенности клинической картины, динамика состояния больных оценивались с помощью клинико-психопатологического и психометрического методов с использованием следующих шкал: оценки АД (ADDS), шкалы депрессии Гамильтона (HDRS-17), самооценки депрессии Бека, самоопросника нарушений сна (LSEQ), шкал общего функционирования (GAF).
 Включенным в исследование пациентам проводилась монотерапия агомелатином в дозировке 25 мг/сут в течение 6 нед с возможностью (при отсутствии эффективности в течение первых 2 нед лечения) повышения дозы до 50 мг/сут. Статистический анализ осуществлялся лицензионными статистическими пакетами SPSS 20.0. Применялись двусторонние статистические критерии (уровень значимости не менее p≤0,05).
Включенным в исследование пациентам проводилась монотерапия агомелатином в дозировке 25 мг/сут в течение 6 нед с возможностью (при отсутствии эффективности в течение первых 2 нед лечения) повышения дозы до 50 мг/сут. Статистический анализ осуществлялся лицензионными статистическими пакетами SPSS 20.0. Применялись двусторонние статистические критерии (уровень значимости не менее p≤0,05).
Средний суммарный балл по шкале HDRS-17 был сопоставим в 2 группах и равнялся 22,4±4,0 балла при АД, 22,6±2,7 балла при МД. Аналогичная ситуация наблюдалась и в отношении среднего балла по шкале Бека (37,8±7,7 и 38,2±7,8 соответственно), что позволяло проводить сравнительную оценку психофармакотерапии в изученных группах.
Результаты и обсуждение
Эффективность проведенной терапии оценивалась по количеству пациентов, находящихся в ремиссии (балл по HDRS-17≤7), достигших респонса (редукция по шкале HDRS-17 от 7 баллов и до 50%), частичного респонса (редукция балла по HDRS-17≥25%, но менее 50%) и не ответивших на терапию нонреспондеров (редукция балла по HDRS-17≤25%). Процент больных, достигших ремиссии и респонса, не различался в сравниваемых группах, в то время как доля парциальных респондеров была несколько выше у пациентов с АД (26,6% против 20% в группе МД), а процент нонреспондеров, напротив, был выше в группе с МД (16,6% против 11,6% в группе АД). Полученные результаты не имели статистической значимости (рис. 1). Динамика обратного развития симптомов депрессии по шкале HDRS-17 также не выявила достоверных различий между сравниваемыми группами (p>0,05) на протяжении всего периода лечения. При этом уже на 1-й неделе терапии редукция среднего балла по шкале HDRS-17 была статистически значимой по сравнению с фоновыми показателями как при АД, так и при МД (p<0,001) (рис. 2).
Первичный респонс, являющийся одним из ключевых предикторов эффективности фармакотерапии [1] и оцениваемый как снижение баллов по шкале HDRS-17 на 25%, у 94,3% пациентов основной группы и у 84% – контрольной группы формировался уже в первые 3 нед лечения (рис. 3), свидетельствуя о раннем появлении терапевтического ответа, особенно у больных с АД.
По результатам предыдущих исследований [1, 40] было показано, что от скорости наступления первичного респонса прямо пропорционально зависят скорость формирования ответа на лечение и ремиссия. В нашем исследовании эта связь также была подтверждена. Так, при формировании первичного респонса на 1-й неделе лечения ответ на терапию развивался уже ко 2-й неделе в 2 группах (5,4% при АД, 5,3% при МД), достигая своего максимума к 3 и 4-й неделе (13,5% при АД, 10,5 и 5,3% при МД соответственно). Наличие первичного ответа на терапию на 2-й неделе сдвигало сроки достижения ремиссии и респонса к 3-й неделе лечения в 2 группах. При этом в основной группе процент пациентов, ответивших на терапию, был почти в 4 (18,9%) раза выше, чем в группе сравнения (5,3%). В целом в основной группе по сравнению с контрольной отмечалось более быстрое формирование полного ответа на терапию (см. таблицу).
Диссомнические нарушения (шкала LSEQ) редуцировались уже на 1-й неделе терапии в 2 группах. При этом у пациентов с АД более быстрые темпы обратного развития были характерны для таких показателей, как засыпание и качество сна, в то время как для лиц с МД – состояние после сна (p≤0,05). При оценке расстройств сна по шкале HDRS-17 (динамика инсомнии) статистически значимая редукция по сравнению с фоном наступала уже на 1-й неделе терапии (p≤0,001), в то время как по шкале ADDS (динамика гиперсомнии) достоверные различия выявлялись лишь на 2-й неделе лечения (p≤0,05).
 Таким образом, несмотря на противоположную направленность регистрируемых симптомов в фоновом обследовании (инсомния – в основной группе, гиперсомния – в контрольной), агомелатин проявлял мультимодальное действие, достигая эффективности и в том и другом случае. Аналогичная ситуация наблюдалась и при оценке расстройств приема пищи, при которой нормализация в процессе терапии агомелатином наблюдалась как в случае снижения аппетита при МД (HDRS-17), так и в случае его усиления при АД (ADDS) (рис. 4). Эта особенность действия препарата позволяет рассматривать его эффект как модулирующий, связанный с регуляцией вегетативных процессов в соответствии с требованиями ритма «сон–бодрствование» и обусловливающий адекватный выбор поведения с учетом актуализированной потребности.
Таким образом, несмотря на противоположную направленность регистрируемых симптомов в фоновом обследовании (инсомния – в основной группе, гиперсомния – в контрольной), агомелатин проявлял мультимодальное действие, достигая эффективности и в том и другом случае. Аналогичная ситуация наблюдалась и при оценке расстройств приема пищи, при которой нормализация в процессе терапии агомелатином наблюдалась как в случае снижения аппетита при МД (HDRS-17), так и в случае его усиления при АД (ADDS) (рис. 4). Эта особенность действия препарата позволяет рассматривать его эффект как модулирующий, связанный с регуляцией вегетативных процессов в соответствии с требованиями ритма «сон–бодрствование» и обусловливающий адекватный выбор поведения с учетом актуализированной потребности.
Представление о клинической гетерогенности АД позволило разработать ее клиническую типологию с выделением в зависимости от психопатологической дифференциации доминирующих в клинической картине расстройств трех вариантов: 1) с преобладанием РН (26,6%); 2) с преобладанием ИВС (41,6%); 3) с преобладанием ЧН (31,6%) [3].
В соответствии с выделенными вариантами АД были сформированы 3 терапевтические группы пациентов. Количество женщин преобладало во всех 3 сравниваемых выборках, в то время как возраст у пациентов с преобладанием ИВС был несколько ниже (33,5±11,7), чем в остальных группах (42,1±12,8 в группе РН, 41,2±13,6 – ЧН). Фоновые показатели уровня социального функционирования (GAF) не различались между группами (61±7,6 при РН, 59,7±6,6 при ИВС, 57,2±7,6 при ЧН), однако на уровне обозначения тенденции можно было отметить наихудшие показатели социально-трудовой адаптации у лиц с ЧН, промежуточное положение занимали пациенты с преобладанием ИВС, и наиболее социально адаптированными были больные с преобладанием РН.
Эффективность терапии агомелатином наблюдалась уже на 3-й неделе терапии (р≤0,01) у пациентов всех 3 терапевтических групп, что подтверждалось статистически значимой по сравнению с фоновыми показателями редукцией общего балла по ADDS. При этом более быстрая динамика атипичных симптомов на всем протяжении лечения наблюдалась в группе с ИВС, статистическая достоверность (р<0,05) достигалась и в группе с ЧН, тогда как у пациентов с РН наблюдалась только тенденция (рис. 5).
Анализ динамики симптоматологического спектра АД, обусловливающего эффективность агомелатина, показал неравномерность обратного развития «ключевых» феноменов (ADDS). Так, на всем протяжении исследования лучше всего редуцировались гиперфагия (52,2%) и гиперсомния (53,8%), несколько хуже РН (59,2%) и свинцовый паралич (61,9%), а наиболее медленная положительная динамика отмечалась у показателя, отражающего ЧН (74%) (рис. 6).
Разработанная типология АД отражала различный стереотип развития аффективного расстройства с высоким уровнем биполярности при депрессии с преобладанием ИВС (36%) и с высоким уровнем монополярности для 2 и 3-го вариантов (43,7 и 31,5%). Это стало основанием для определения чувствительности к психофармакологическому воздействию агомелатином пациентов разных диагностических групп: ДЭ (55%), РДР (25%) и БАР (20%).
Анализ эффективности агомелатина в зависимости от нозологической принадлежности АД выявил только один статистически достоверный показатель (р<0,05) – частота формирования респонса (58,3%) в структуре БАР преобладала над таковым при ДЭ. Остальные данные не имели статистической достоверности и отражали только тенденцию в преобладании ремиссий у больных с диагнозом ДЭ (33,3%) по сравнению с РДР и БАР (13,3 и 8,3% соответственно), парциального респонса, формирующегося в структуре ДЭ (30,3%) и РДР (26,6%), по сравнению с БАР (16,6%), нонреспондеров среди больных с БАР (16,6%) и РДР (13,3%) по сравнению с ДЭ (9%) (рис. 7).

 Результаты 2-летнего катамнестического наблюдения лиц с ДЭ с атипичными чертами привели к изменению первоначального диагноза в 54,5% случаях на БАР (15,1%) и РДР (39,3%). С учетом этого перераспределения варианты ответа на терапию агомелатином существенно не изменились и не достигали статистической значимости
Результаты 2-летнего катамнестического наблюдения лиц с ДЭ с атипичными чертами привели к изменению первоначального диагноза в 54,5% случаях на БАР (15,1%) и РДР (39,3%). С учетом этого перераспределения варианты ответа на терапию агомелатином существенно не изменились и не достигали статистической значимости
(рис. 8). Количество лиц, достигших ремиссии в группе с БАР, увеличилось (29,4% против 21,4% у пациентов с РДР). По количеству респондеров существенных изменений не произошло, их процент остался выше в группе с БАР (52,9%), чем с РДР (42,9%). Другая картина наблюдалась при сравнении количества парциальных респондеров и больных, не ответивших на терапию. Так, процент пациентов, частично отреагировавших на лечение, стал больше в группе с РДР (21,4%) по сравнению с группой БАР (11,8%). Увеличилось число нонреспондеров в группе с РДР (14,3%), а в группе с БАР, напротив, уменьшилось (5,9%).
 Таким образом, агомелатин показал высокую эффективность как у пациентов с АД (88,3%), так и МД (83,3%). Скорость наступления первичного респонса уже в первые 2 нед терапии достигала 69,8% при АД и 64% – при МД, отражая быстроту формирования респонса/ремиссии (3– 5 нед терапии). Несмотря на противоположную направленность характерных для АД и МД симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), агомелатин проявлял мультимодальное действие, достигая эффективности в обоих случаях, что, возможно, объясняется механизмом действия препарата, связанного с его способностью к ресинхронизации нарушенной ритмики у больных с депрессиями.
Таким образом, агомелатин показал высокую эффективность как у пациентов с АД (88,3%), так и МД (83,3%). Скорость наступления первичного респонса уже в первые 2 нед терапии достигала 69,8% при АД и 64% – при МД, отражая быстроту формирования респонса/ремиссии (3– 5 нед терапии). Несмотря на противоположную направленность характерных для АД и МД симптомов (гиперсомния/инсомния, гиперфагия/гипофагия), агомелатин проявлял мультимодальное действие, достигая эффективности в обоих случаях, что, возможно, объясняется механизмом действия препарата, связанного с его способностью к ресинхронизации нарушенной ритмики у больных с депрессиями.
Эффективность агомелатина при АД достигалась за счет гармоничной обратной динамики всех характерных для этого состояния симптомов. Статистическая достоверность наблюдалась только при оценке результативности терапии различных клинических вариантов АД в ряду (по убыванию): ИВС (гиперсомния/гипофагия), ЧН, тогда как в отношении РН можно было говорить лишь о тенденции.
Терапевтическая эффективность агомелатина у пациентов с АД в структуре различного стереотипа течения аффективного расстройства (как с учетом катамнеза, так и без) не выявила статистически значимых различий, что свидетельствует о возможности использования агомелатина как при лечении униполярной, так и биполярной депрессии.
Сведения об авторе
Марачев Максим Павлович – мл. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава РФ. E-mail: marachevm@gmail.com
Список исп. литературыСкрыть список1. Аведисова А.С. Новая стратегия повышения эффективности терапии депрессивных расстройств, определяемая первичным ответом. Психиатр. и психофармакотер. 2011; 11.
2. Аведисова А.С. Атипичная депрессия как модель для изучения ритмологических процессов. Журн. неврол. и психиатр. им. С.С.Корсакова. 2009; 12: 93–9.
3. Аведисова А.С., Марачев М.П. Клиническая типология атипичной депрессии при биполярном и монополярном аффективном расстройстве. Журн. неврол. и психиатр. им. С.С.Корсакова. 2012; 3: 18–24.
4. Амон М., Буае П.А., Моке Е. Перспективы в изучении патогенеза и терапии аффективных расстройств: роль мелатонина и серотонина. Журн. неврол. и психиатр. им. С.С.Корсакова. 2007; 11: 77–83.
5. Боборов А.С., Петрунько О.В., Хамарханова А.А., Швецова А.В. Клинические предикторы реакции на терапию Вальдоксаном при умеренной и тяжелой депрессии. Журн. неврол. и психиатр. им. С.С.Корсакова. 2010; 110 (9): 14.
6. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренных и тяжелых депрессий непсихотического уровня в амбулаторной и госпитальной практике. Результаты российского многоцентрового исследования ХРОНОС. Психиатр. и психофармакотер. 2009; 6.
7. Иванов С.В. Вальдоксан в терапии биполярной депрессии: результаты российского многоцентрового натуралистического исследования ХРОНОС. Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2011; 2.
8. Кочетков Я.А. Мелатонин и депрессия. Журн. неврол. и психиатр. им. С.С.Корсакова. 2007; 6: 79–83.
9. Мосолов С.Н. Эффективность и переносимость агомелатина при депрессивных состояниях в рамках рекуррентной депрессии и биполярного расстройства (доклад). 2-я Франко-Российская встреча. Париж, 2011; 9 (7–8).
10. Семак И.В., Кульчицкий В.А. Физиологические и биохимические механизмы регуляции циркадианных ритмов. БГУ, 2007; 2 (1): 17–37.
11. Шепенев А.М. Клинико-динамические, хронобиологические и терапевтические особенности атипичной депрессии. Автореф. дис. … канд. мед. наук. Томск, 2010.
12. Akiskal HS, Benazzi F. Atypical depression: a variant of bipolar II or a bridge between unipolar and bipolar II? J Affect Disord 2005; 84 (2–3): 209–17.
13. Benazzi F. Can only reversed vegetative symptoms define atypical depression? Eur Arch Psychiat Clin Neurosci 2002; 252 (6): 288–93.
14. Falkai P. Mirtazapine: other indications. J Clin Psychiat 1999; 60 (Suppl. 17): 36–40. Dis. 46–8.
15. Gorwood Р. Депрессия и нарушения циркадианных ритмов (расширенный реферат). Обозрение психиатрии и мед. психологии. 2007; 29: 22–7.
16. Liebowitz MR, Quitkin FM, Stewart JW. Antidepressant specificity in atypical depression. Arch Gen Psychiat 1988; 45 (2): 129–37.
17. Lonnqvist J, Sihvo S, Syvälahti E, Kiviruusu O. Moclobemide and fluoxetine in atypical depression: a double-blind trial. J Affect Disord 1994; 32 (3): 169–77.
18. McGrath PJ, Stewart JW, Qiutkin FM. Gepirone treatment of atypical depression: preliminaty evidence of serotonergic involvement. J Clin Psychopharmacol 1994; 14: 347–52.
19. McGrath PJ, Robinson D, Stewart JW. Atypical panic attacks in major depression. Am J Psychiat 1985; 142 (10): 1224.
20. Montgomery SA, Kasper S. Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine. Int Clin Psychopharmacol 2007; 22 (5): 283–29.
21. Pae CU, Masand PS, Peindl K. An open-label, rater-blinded, flexible-dose, 8-week trial of escitalopram in patients with major depressive disorder with atypical features. Prim Care Companion J Clin Psychiat 2008; 10 (3): 205–10.
22. Pande AC, Birkett M, Fechner-Bates S. Fluoxetine versus phenelzine in atypical depression. Biol Psychiat 1996; 40 (10): 1017–20.
23. Pande AC, Haskett RF, Greden JF. Double-blind comparison of fluoxetine and phenelzine in atypical depression. Biol Psychiat 1991; 29: 117A.
24. Parker GB, Thase ME. Atypical depression: a valid subtype? J Clin Psychiat 2007; 68 (3): e08.
25. Quitkin FM, Harrison W, Stewart JW. Response to phenelzine and imipramine in placebo nonresponders with atypical depression. A new application of the crossover design. Arch Gen Psychiat 1991; 48 (4): 319–23.
26. Quitkin FM, Stewart JW, McGrath PJ et al. Atypical depression, panic attacks, and response to imipramine and phenelzine. Arch Gen Psychiat 1990; 47 (10): 935–41.
27. Rabkin JG, Stewart JW, Quitkin FM et al. Should atypical depression be included in DSM-IV? DSM-IV. Source Book, 2. Ed.: T.Widiger, A.Frances, H.Pincus et al. American Psychiatric Association 1994; p. 239–60.
28. Roose SP, Devanand D, Seidman S. An open trial of venlafaxine for the treatment of late-life atypical depression. Int J Geriat Psychiat 2004; 19 (10): 989–94.
29. Rubin RT, Heist EK, McGeoy SS. Neuroendocrine aspects of primary endogenous depression. XI. Serum melatonin measures in patients and matched control subjects. Arch Gen Psychiat 1992; 49: 558–69.
30. Søgaard J, Lane R, Latimer P et al. A 12-week study comparing moclobemide and sertraline in the treatment of outpatients with atypical depression. J Psychopharmacol 1999; 13 (4): 406–14.
31. Srinivasan V, Smits M, Spence W et al. Melatonin in mood disorders. World J Biol Psychiat 2006; 7 (3): 138–52.
32. Stewart JW, McGrath PJ, Nunes EV. A double-blind crossover trial of imipramine and phenelzine for outpatients with treatment-refractory depression. Am J Psychiat 1993; 150: 118–23.
33. Stewart JW, Deliyannides DA, McGrath PJ. Is duloxetine effective treatment for depression with atypical features? Int Clin Psychopharmacol 2008; 23 (6): 333–6.
34. Stewart JW, McGrath PJ. Do atypical features affect outcome in depressed outpatients treated with citalopram? 2010; 13 (1): 15–30. Epub 2009.
35. Szymanska A, Rabe-Jablonska J, Karasek M. Diurnal profile of melatonin concentrations in patients with major depression: relation-ship to the clinical manifestation and antidepressant treatment. Neuroendocrinol Lett 2001; 22: 192–8.
36. Thase ME. New directions in the treatment of atypical depression. J Clin Psychiat 2006; 67 (12): e18.
37. West ED, Dally PJ. Effects of iproniazid in depressive syndromes. Br Med J 1959; 1: 1491–4.
38. Wetterberg L. Clinical importance of melatonin. Prog Brain Res 1979; 52: 539–47.
39. Wirz-Justice A, Graw P, Krauchi K. Morning or night-time melatonin is ineffective in seasonal affective disorder. J Psychiat Res 1990; 24: 129–37.
40. Вазагаева Т.И. Качество и стойкость ремиссии при применении антидепрессантов и трансперсональной психотерапии у больных с депрессивными расстройствами. Рос. психиатр. журн. 2009; с. 658–65.

