Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2012
Адъювантное применение пароксетина у пациентов с обострением параноидной шизофрении, получающих галоперидол №04 2012
Номера страниц в выпуске:52-60
Исследовалась эффективность и безопасность адъювантного применения пароксетина на фоне терапии галоперидолом у пациентов с обострением параноидной шизофрении. Пациенты получали галоперидол в комбинации с пароксетином (25 пациентов), галоперидол в виде монотерапии (26 пациентов) либо арипипразол (26 пациентов) в течение 6 нед. Было показано, что пароксетин снижает антипсихотическую эффективность галоперидола, не приводит к значимому расширению терапевтического потенциала базовой терапии в направлении негативных и аффективных симптомов и оказывает неблагоприятное влияние на безопасность лечения. Полученные данные свидетельствуют, что адъювантное применение пароксетина не может рассматриваться в качестве стратегии оптимизации терапии обострения параноидной шизофрении галоперидолом.
Резюме. Исследовалась эффективность и безопасность адъювантного применения пароксетина на фоне терапии галоперидолом у пациентов с обострением параноидной шизофрении. Пациенты получали галоперидол в комбинации с пароксетином (25 пациентов), галоперидол в виде монотерапии (26 пациентов) либо арипипразол (26 пациентов) в течение 6 нед. Было показано, что пароксетин снижает антипсихотическую эффективность галоперидола, не приводит к значимому расширению терапевтического потенциала базовой терапии в направлении негативных и аффективных симптомов и оказывает неблагоприятное влияние на безопасность лечения. Полученные данные свидетельствуют, что адъювантное применение пароксетина не может рассматриваться в качестве стратегии оптимизации терапии обострения параноидной шизофрении галоперидолом.
Ключевые слова: шизофрения, эффективность, безопасность, пароксетин, галоперидол, арипипразол.
Adjunctive use of paroxetine in patients with acute episode of paranoid schizophrenia treated with haloperidol
M.Y.Popov
St.-Petersburg V.M.Bekhterev Psychoneurological Research Institute
Summary. Efficacy and safety of adjunctive use of paroxetine was studied in patients with acute episode of paranoid schizophrenia treated with haloperidol. Patients received either combination of haloperidol with paroxetine (25 subjects), or haloperidol as monotherapy (26 subjects), or aripiprazole (26 subjects) during 6 weeks. It was demonstrated that paroxetine reduced antipsychotic efficacy of haloperidol, did not increase its efficacy on negative and affective symptoms and deteriorated safety of treatment. Results of the study suggest that adjunctive use of paroxetine cannot be viewed as the strategy of treatment optimization in patients with exacerbation of paranoid schizophrenia who receive haloperidol.
Key words: schizophrenia, efficacy, safety, paroxetine, haloperidol, aripiprazole.
Введение
Характер различий между антипсихотическими препаратами типичного и атипичного ряда определяет неодинаковое терапевтическое значение этих соединений на разных этапах лечения шизофрении. Основные преимущества атипичных средств (более высокая эффективность в отношении негативных и депрессивных симптомов, благоприятное влияние на когнитивное функционирование, а также лучшая переносимость и, следовательно, более высокий уровень комплаенса) очевидным образом в наибольшей степени проявляются при проведении длительной поддерживающей терапии в фазе ремиссии.
В то же время при лечении острой фазы психоза эти препараты все же уступают типичным нейролептикам. Во многом это связано с выраженностью гипноседативного действия последних и их способностью оказывать подавляющее влияние на эмоциональное реагирование. Если при проведении терапии в состоянии ремиссии эти эффекты, проявляясь усугублением негативных и когнитивных нарушений, являются нежелательными и расцениваются в качестве побочных, то при назначении нейролептиков в фазе обострения эти же эффекты приобретают характер желательных.
По нашему глубокому убеждению, адекватный выбор адъювантных препаратов должен определяться направленностью их нейрохимических эффектов в сторону определенных патогенетических механизмов, лежащих в основе развития шизофрении. В соответствии с современными представлениями к наиболее изученным и доказанным нейрохимическим звеньям патогенеза заболевания наряду с изменением функциональной активности дофаминергической передачи и слабостью аминокислотергических систем относится и дисрегуляция серотоно-дофаминовых внутрицентральных взаимодействий [2].
Последний патогенетический механизм может рассматриваться в качестве теоретического обоснования чрезвычайно широко распространенной терапевтической тактики, а именно комбинированного применения антипсихотического и антидепрессивного препаратов при лечении шизофрении. Наиболее часто подобную комбинацию применяют при лечении хронической шизофрении в стадии ремиссии [3]. Вместе с тем, поскольку основной «терапевтической нишей» для типичных нейролептиков является острая психотическая симптоматика, особый интерес вызывает оценка эффективности их комбинированного применения с антидепрессантами именно при обострении психоза.
Существенным «сдерживающим» фактором здесь, на первый взгляд, представляется потенциальное повышение риска экзацербации симптоматики под влиянием антидепрессивной терапии. Однако, во-первых, подобные представления сложились по большей части на основании эффектов «классических» антидепрессантов (ингибиторов моноаминоксидазы и трициклических соединений) [4], в то время как данные о действии препаратов, обладающих избирательной нейрохимической активностью, практически отсутствуют.
Во-вторых, далеко не однозначный характер носит и направленность нейрохимических эффектов нейролептиков и антидепрессантов. С одной стороны, основным нейрохимическим эффектом антидепрессивных средств является моноаминопозитивное действие, а нейролептиков – моноаминонегативное, что определяет вероятность развития антагонистических взаимоотношений между препаратами и может, действительно, вносить свой вклад в повышение риска экзацербации психоза.
С другой стороны, современные представления о действии антидепрессантов позволяют рассматривать их с позиций непрямых антагонистов дофаминергической передачи, поскольку увеличение концентрации серотонина в синаптических образованиях мозга вторично вызывает снижение высвобождения дофамина. С этой точки зрения можно говорить о потенцирующем действии антидепрессантов на нейрохимическую активность нейролептиков. Кстати, подтверждением этому является и хорошо известная способность ряда антидепрессантов вызывать, подобно антипсихотическим средствам, экстрапирамидные побочные эффекты [5].
С указанных позиций наиболее оправданной представляется комбинация антидепрессантов из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) с теми представителями типичных нейролептиков, у которых способность блокировать серотониновые рецепторы отсутствует полностью либо выражена минимально. К подобным соединениям относятся бутирофеноны (галоперидол), пиперазиновые производные фенотиазина (трифлуоперазин), бензамиды (сульпирид, тиапридал). При проведении базовой терапии указанными препаратами серотонинергические структуры мозга, нейрохимические изменения в которых обеспечивают терапевтическое действие СИОЗС, могут оставаться относительно интактными [1]. Поэтому при адъювантном назначении СИОЗС именно на фоне приема перечисленных нейролептиков можно ожидать наиболее адекватного развития желательных клинических эффектов антидепрессантов.
Исходя из изложенного была сформулирована цель исследования: изучить эффективность и безопасность лечения пациентов с обострением параноидной шизофрении при применении комбинации галоперидола и пароксетина по сравнению с монотерапией галоперидолом и арипипразолом.
Выбор галоперидола в качестве препарата базовой терапии был обусловлен не только высокой антипсихотической эффективностью, но и выраженностью характерных для нейролептиков первой генерации побочных эффектов (иначе не было бы «предмета» для оптимизации). Пароксетин был выбран с учетом характера неспецифических эффектов СИОЗС (соотношения стимулирующего и седативного действия). С этой точки зрения при лечении пациентов с обострением шизофрении предпочтительнее выглядят те препараты, которые обладают седативными свойствами, такие как пароксетин [6, 7].
Очевидно, что оценку влияния исследуемого терапевтического вмешательства желательно проводить с учетом эффективности существующих эталонных средств. Если в качестве «золотого стандарта» в отношении антипсихотической эффективности может рассматриваться галоперидол, то с точки зрения «широты» терапевтического действия (в том числе в направлении негативных и аффективных симптомов) подобными эталонными средствами на сегодняшний день являются антипсихотические препараты атипичного ряда. Выбор из их числа именно арипипразола был обусловлен прежде всего минимальной выраженностью у него экстрапирамидных побочных эффектов [8].
Материалы и методы
В исследование включались пациенты с диагнозом «параноидная форма шизофрении» (в соответствии с критериями диагностической рубрики F20.0 по Международной классификации болезней 10-го пересмотра). Основным критерием включения являлось наличие обострения психоза с оценкой не менее 70 баллов по шкале PANSS [9] до начала терапии. Не включались пациенты с первым эпизодом шизофрении. Кроме того, критериями исключения являлись указания на наличие декомпенсированных сопутствующих соматических заболеваний, клинически значимой артериальной гипотензии, тяжелых лекарственных аллергических реакций, зависимости от алкоголя или психоактивных веществ, высокий риск суицидального или агрессивного поведения, период беременности или лактации.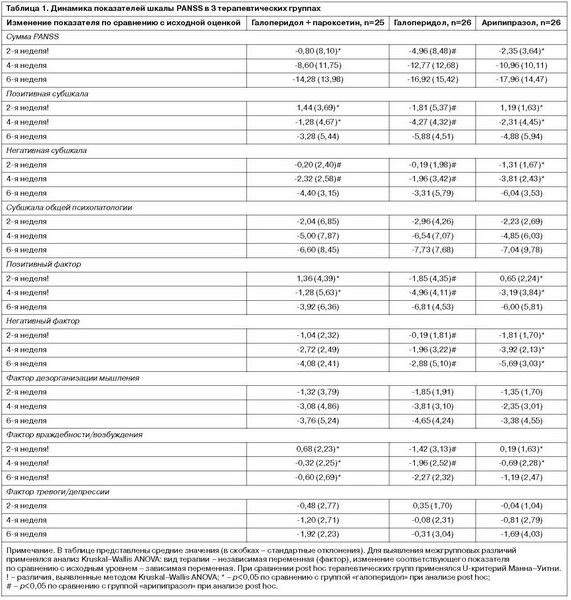
Эффективность терапии оценивалась по шкале PANSS. Оценка проводилась до начала лечения и по завершении 2, 4 и 6-й недели терапии. В качестве параметров эффективности рассматривалась динамика суммарной оценки шкалы PANSS, а также трех ее субшкал (позитивной, негативной и общей психопатологии) и пяти факторов (позитивный, негативный, дезорганизация мышления, враждебность/возбуждение и тревога/депрессия) [10] по сравнению с исходным уровнем.
Безопасность лечения оценивалась при помощи шкал BARS [11], SARS [12] и AIMS [13], а также посредством регистрации всех нежелательных явлений.
При обработке данных применялись непараметрические статистические методы. Межгрупповые сравнения шкальных оценок проводились посредством дисперсионного анализа (Kruskal–Wallis ANOVA) с сравнениями post hoc по критерию Манна–Уитни. Кроме того, применялся критерий c2. Для всех тестов был установлен порог статистической значимости p<0,05.
Результаты
Всего в исследование было включено 77 пациентов. Комбинацию галоперидола с пароксетином получали 25 пациентов, монотерапию галоперидолом и арипипразолом – по 26 пациентов. Терапевтические группы не различались по основным клинико-демографическим показателям, а также по выраженности психопатологической симптоматики (исходным оценкам шкалы PANSS).
Полностью 6 нед терапии завершили 62 (80,5%) пациента. Преждевременно выбыли из исследования 6 (24,0%) пациентов, принимавших комбинацию галоперидола и пароксетина, 4 (15,4%) пациента, получавших галоперидол в виде монотерапии, и 5 (19,2%) пациентов, лечившихся арипипразолом. По количеству преждевременно завершивших участие в исследовании пациентов значимых различий между группами не было. Всем преждевременно выбывшим пациентам проводилась заключительная оценка. Таким образом, данные всех пациентов, принимавших участие в исследовании, были включены в статистический анализ (n=77).
Вместе с тем в группе пациентов, получавших галоперидол с пароксетином, 4 пациента были исключены из исследования до завершения 2-й недели терапии в связи с недостаточной эффективностью, в то время как в других группах выбывших из исследования на раннем этапе по этой причине не было. При этом отличия комбинированной терапии от монотерапии галоперидолом и арипипразолом по частоте раннего выбывания в связи с неэффективностью были статистически значимыми (в обоих случаях c2 равен 3,87; p=0,049).
В табл. 1 представлена динамика суммарного балла шкалы PANSS, трех ее субшкал и пяти факторов в 3 терапевтических группах. По данным анализа Kruskal–Wallis ANOVA, были отмечены статистически значимые межгрупповые различия по динамике суммарной оценки PANSS на 2-й неделе [H(2, n=77)=9,550; p=0,008], позитивной субшкалы на 2-й [H(2, n=77)=12,169; p=0,002] и на 4-й неделе [H(2, n=77)=7,875; p=0,020], позитивного фактора на 2-й [H(2, n=77)=11,117; p=0,004] и на 4-й неделе [H(2, n=77)=10,672; p=0,005], негативного фактора на 2-й неделе [H(2, n=77)=8,870; p=0,012] и фактора враждебности/возбуждения на 2-й неделе [H(2, n=77)=12,905; p=0,002], 4-й неделе [H(2, n=77)=8,286; p=0,016] и 6-й неделе [H(2, n=77)=6,144; p=0,046]. Кроме того, следующие различия достигали уровня тенденции к статистической значимости: по суммарному баллу PANSS на 4-й неделе [H(2, n=77)=4,890; p=0,087], по негативной субшкале на 2-й [H(2, n=77)=5,878; p=0,053] и на 4-й неделе [H(2, n=77)=5,771; p=0,056] и по негативному фактору на 4-й [H(2, n=77)=4,974; p=0,083] и на 6-й неделе [H(2, n=77)=5,039; p=0,081].
Галоперидол на 6-й неделе по влиянию на фактор враждебности/возбуждения значимо превосходил комбинацию галоперидола с пароксетином (Z=-2,346; p=0,019) и на уровне тенденции – арипипразол (Z=-1,711; p=0,087). На 4-й неделе галоперидол на уровне тенденции к статистической значимости превосходил комбинацию галоперидола с пароксетином (Z=-1,950; p=0,051) и арипипразол (Z=-1,684; p=0,092) по динамике суммарной оценки шкалы PANSS.
Кроме того, по влиянию на негативную субшкалу арипипразол значимо превосходил монотерапию галоперидолом и его комбинацию с пароксетином на 2-й неделе (Z=-2,068; p=0,039 и Z=-2,054; p=0,040 соответственно) и на 4-й неделе лечения (Z=-2,031; p=0,042 и Z=-2,044; p=0,041). По влиянию на негативный фактор арипипразол значимо превосходил галоперидол на 2-й неделе (Z=-2,937; p=0,003), 4-й неделе (Z=-1,967; p=0,049) и 6-й неделе (Z=-2,022; p=0,043) и на уровне тенденции – комбинацию галоперидола с пароксетином на 4-й неделе (Z=-1,771; p=0,077) и на 6-й неделе (Z=-1,686; p=0,092).
В табл. 2 представлены результаты сравнения исследуемых вариантов терапии по влиянию на показатели шкал BARS, SARS и AIMS. По данным дисперсионного анализа, значимые межгрупповые различия отмечались по показателям шкалы SARS на 2-й неделе [H(2, n=77)=7,056; p=0,029], 4-й неделе [H(2, n=77)=13,946; p=0,001] и 6-й неделе [H(2, n=77)=20,436; p<0,001], а также по оценкам шкалы AIMS на 4-й неделе [H(2, n=77)=10,004; p=0,007] и 6-й неделе исследования [H(2, n=77)=10,923; p=0,004]. Кроме того, были выявлены межгрупповые различия на уровне тенденции к статистической значимости по показателям шкалы BARS на 4-й неделе [H(2, n=77)=5,122; p=0,077] и 6-й неделе [H(2, n=77)=4,876; p=0,087].
При сравнениях post hoc было выявлено статистически значимое превосходство арипипразола над двумя терапевтическими группами, включавшими галоперидол. Арипипразол приводил к менее выраженному нарастанию оценок по всем экстрапирамидным шкалам на всем протяжении лечения. При этом по сравнению с комбинацией галоперидола и пароксетина статистически значимыми были различия по шкале BARS на 4-й (Z=-2,176; p=0,030) и на 6-й неделе (Z=-2,063; p=0,039), по шкале SARS на 2-й (Z=-2,120; p=0,034), на 4-й (Z=-3,552; p<0,001) и на 6-й неделе (Z=-4,362; p<0,001), и по шкале AIMS на 4-й (Z=-2,280; p=0,023) и на 6-й неделе (Z=-2,544; p=0,011).
При сравнении арипипразола с монотерапией галоперидолом отмечались значимые различия по шкале SARS на 4-й (Z=-2,004; p=0,045) и на 6-й неделе (Z=-2,736; p=0,006) и по шкале AIMS на 4-й (Z=-2,516; p=0,012) и на 6-й неделе (Z=-2,654; p=0,008). Кроме того, по показателю шкалы SARS на 2-й неделе различия между двумя вариантами терапии достигали уровня тенденции к статистической значимости (Z=-1,693; p=0,090).
Сравнение комбинации галоперидола и пароксетина с монотерапией галоперидолом не выявило статистически значимых различий. Вместе с тем комбинированная терапия вызывала более выраженное увеличение показателей всех экстрапирамидных шкал на всем протяжении исследования, за исключением изменений оценок BARS и AIMS ко 2-й неделе лечения. При этом по показателям шкалы SARS на 2 и 4-й неделе различия достигали уровня тенденции к статистической значимости (Z=-1,790; p=0,073 и Z=-1,818; p=0,069 соответственно).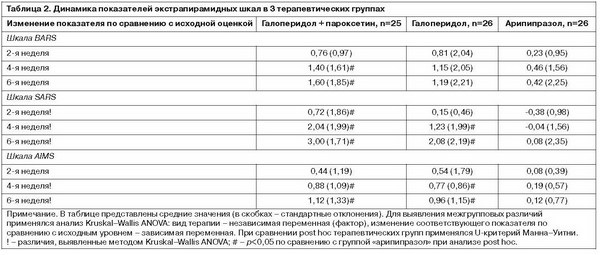
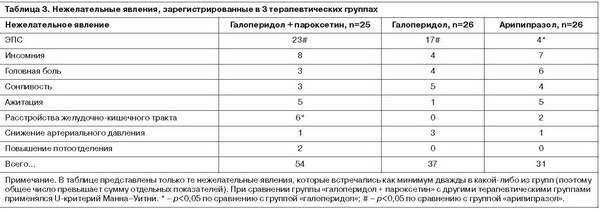
Помимо значимых различий в частоте экстрапирамидных синдромов (ЭПС), обращает на себя внимание, что два побочных эффекта (гастроинтестинальные расстройства и повышенное потоотделение) встречались почти исключительно у пациентов, получавших адъювантно пароксетин. При этом у пациентов, принимавших комбинацию галоперидола и пароксетина, частота гастроинтестинальных расстройств значимо отличалась от частоты этих нарушений у пациентов, получавших монотерапию галоперидолом (c2=5,62; p=0,018). Среди прочих побочных эффектов обращает на себя внимание несколько более высокая частота нежелательных явлений, отражающих стимулирующий эффект (бессонница, ажитация) у пациентов, получавших комбинацию галоперидола с пароксетином и арипипразол, по сравнению с группами пациентов, лечившихся галоперидолом в виде монотерапии.
Все зарегистрированные нежелательные явления были легкой или умеренной степени тяжести и не приводили к преждевременному прекращению приема терапии, за исключением 1 пациента, получавшего монотерапию галоперидолом и исключенного из исследования в связи с развитием выраженных ЭПС.
Обсуждение
Оценка адъювантной терапии должна производиться с учетом ее действия в направлении потенциальной реализации основных стратегических задач. Одной из них является стремление повысить общий терапевтический потенциал базового препарата. Другая задача может состоять в расширении спектра психотропной активности базовой терапии в отношении определенных клинических мишеней. Наконец, еще одна задача отражает стремление повысить безопасность лечения и улучшить его переносимость. В соответствии с перечисленными стратегическими направлениями и будет проанализировано адъювантное действие пароксетина на фоне базовой терапии галоперидолом.
Хотя по итогам 6-недельного лечения комбинация галоперидола с пароксетином уступает остальным вариантам терапии по влиянию на суммарную оценку шкалы PANSS, значимые отличия указанной комбинации от других терапевтических схем отсутствуют. Эти данные, казалось бы, позволяют сделать вывод, что адъювантное применение пароксетина, если и не повышает терапевтическую эффективность галоперидола, то по крайней мере значимо не снижает ее. Однако сравнительный анализ динамики суммарного балла PANSS при меньшей продолжительности терапии свидетельствует о превосходстве монотерапии галоперидолом над комбинацией галоперидола с пароксетином (на 2-й неделе – значимом, на 4-й – на уровне тенденции к статистической значимости).
Принципиально важным является вопрос: что именно обусловливает указанные различия? Иными словами, динамика каких симптомов (кластеров симптомов) играет определяющую роль в изменении общей терапевтической эффективности? Очевидно, что на разных стадиях шизофрении (обострение, ремиссия) отдельные психопатологические расстройства обладают неодинаковым клиническим значением. С точки зрения лечения острых эпизодов шизофрении наибольшую важность имеют позитивные симптомы, а также проявления психомоторного возбуждения, агрессии, враждебности, импульсивности, как правило, и являющиеся основными терапевтическими мишенями. В этой связи особую важность приобретает сравнение действия исследуемых терапевтических схем на те показатели шкалы PANSS, которые отражают указанные клинические проявления. К подобным показателям относятся позитивная субшкала, позитивный фактор и фактор враждебности/возбуждения.
Как следует из полученных данных, наибольшее число межгрупповых различий наблюдается на 2-й неделе терапии, когда к тому же отмечается и их максимальная статистическая значимость (т.е. наименьшая вероятность нулевой гипотезы); к окончанию же исследования различия становятся менее значимыми. Более того, только на 2-й неделе исследования отмечается разнонаправленная динамика рассматриваемых симптомокомплексов в зависимости от терапии: при комбинированном применении галоперидола и пароксетина их показатели увеличиваются, а при монотерапии галоперидолом снижаются. Все это говорит о том, что негативное влияние пароксетина на эффективность галоперидола в отношении позитивных симптомов и враждебности/возбуждения в наибольшей степени выражено в первые недели лечения, а по мере его продолжения постепенно уменьшается. На это же указывают и более высокие показатели выбывания из исследования на ранних этапах в связи с недостаточной эффективностью (экзацербацией психотической симптоматики) при адъювантном применении пароксетина.
При сравнении динамики суммарной оценки шкалы PANSS, позитивной субшкалы, позитивного фактора и фактора враждебности/возбуждения под влиянием комбинации галоперидола с пароксетином и арипипразола на всем протяжении лечения наблюдается отсутствие статистически значимых различий. При этом полностью совпадает и направленность динамики этих показателей, в том числе увеличение большинства из них на 2-й неделе, с последующей редукцией.
Вместе с тем на 2 и 4-й неделе исследования арипипразол (как и комбинация галоперидола с пароксетином) по воздействию на перечисленные показатели значимо уступает монотерапии галоперидолом.
Полученные данные указывают на то, что, во-первых, галоперидол превосходит арипипразол по скорости реализации основного терапевтического эффекта, и, во-вторых, что адъювантное применение пароксетина существенно снижает антипсихотический потенциал галоперидола (по крайней мере в течение первых недель терапевтического вмешательства). При этом клиническая эффективность комбинированной терапии галоперидолом и пароксетином на ранних этапах лечения становится сопоставимой с действием арипипразола.
В контексте известных преимуществ типичных нейролептиков над препаратами атипичного ряда при проведении купирующей терапии снижение антипсихотической эффективности в начале лечения представляется крайне нежелательным. Тем самым можно утверждать, что адъювантное применение пароксетина лишает галоперидол его основного преимущества как средства быстрого и мощного терапевтического воздействия при лечении обострений шизофрении, что в особенности может касаться терапии пациентов с наиболее острой психотической симптоматикой.
Одной из возможных мишеней является негативный симптомокомплекс. Действительно, комбинация галоперидола и пароксетина оказывает более выраженное редуцирующее влияние на показатели как негативной субшкалы, так и негативного фактора PANSS по сравнению с монотерапией галоперидолом на всем протяжении 6-недельного исследования, однако эти различия не являются статистически значимыми.
С другой стороны, сравнение комбинации галоперидола и пароксетина с арипипразолом оказывается не в пользу комбинированной терапевтической схемы. Арипипразол вызывает более выраженную редукцию показателей негативной субшкалы (на 2 и 4-й неделе статистически значимо, на 6-й – на уровне тенденции к значимости) и негативного фактора (на 4 и 6-й неделе – на уровне тенденции к статистической значимости).
Арипипразол, в свою очередь, значимо превосходит и монотерапию галоперидолом по влиянию на негативную субшкалу на 2 и 4-й неделе лечения, а на негативный фактор – на всем протяжении исследования. Важность этого вполне ожидаемого результата состоит не столько в том, что он иллюстрирует известное превосходство препаратов атипичного ряда над типичными нейролептиками по воздействию на негативные симптомы шизофрении [14, 15], сколько в том, что он может рассматриваться в качестве «индикатора» достаточной чувствительности проведенного исследования.
В целом полученные нами данные не дают оснований говорить о благоприятном влиянии пароксетина на выраженность негативных симптомов в ходе базовой терапии галоперидолом. С другой стороны, эти данные и не опровергают существующие представления о возможности коррекции негативных расстройств при адъювантном применении антидепрессантов [16, 17], поскольку настоящее исследование проводилось у пациентов с обострением шизофрении, тогда как более адекватной является оценка «антинегативного» действия в стадии ремиссии. В любом случае, в острой фазе терапии шизофрении применение пароксетина в качестве «корректора» негативных симптомов на фоне лечения галоперидолом вряд ли может считаться обоснованным. К тому же, по воздействию на негативные расстройства подобная комбинированная схема уступает антипсихотическим средствам атипичного ряда (арипипразолу).
В качестве еще одной возможной мишени для адъювантной антидепрессивной терапии может рассматриваться аффективная симптоматика. Отражением соответствующих клинических проявлений в шкале PANSS является фактор тревоги/депрессии. На всем протяжении исследования комбинация галоперидола и пароксетина вызывает более выраженное снижение этого показателя (хотя и не на уровне статистической значимости) по сравнению с двумя другими терапевтическими схемами. Более того, на 2-й неделе комбинированной терапии галоперидолом и пароксетином (как и при лечении арипипразолом) наблюдается редукция средней оценки фактора тревоги/депрессии, в то время как на фоне монотерапии галоперидолом – ее повышение.
Полученные данные лишь косвенно свидетельствуют в пользу потенциальной эффективности пароксетина в отношении симптомов депрессии и/или тревоги в ходе лечения галоперидолом. Однако адъювантное применение антидепрессанта снижает антипсихотическую эффективность базового препарата и повышает вероятность экзацербации психоза. Тем самым соотношение риск/польза указывает на необоснованность применения указанной терапевтической схемы для коррекции аффективных симптомов, по крайней мере у пациентов с острыми эпизодами шизофрении.
Наконец, еще одно стратегическое направление оптимизации терапии шизофрении связано со стремлением повысить ее безопасность. Существенных различий по частоте, характеру и тяжести нежелательных явлений между комбинированной терапией галоперидолом и пароксетином и другими вариантами лечения не отмечается. Исключение составляют гастроинтестинальные расстройства и повышенное потоотделение, зарегистрированные почти исключительно при назначении пароксетина. Кроме того, при адъювантном применении антидепрессанта выше (хотя и незначимо) частота нежелательных явлений, отражающих стимулирующий эффект (бессонница, возбуждение), по сравнению с монотерапией галоперидолом. Перечисленные нежелательные явления соответствуют хорошо известным побочным эффектам антидепрессантов из группы СИОЗС и отражают повышение нейромедиаторной активности на уровне различных серотонинергических проекций.
Сопоставление оценок экстрапирамидных шкал, во-первых, подтверждает ожидаемое значимое превосходство арипипразола над терапевтическими схемами, включающими галоперидол, а во-вторых, указывает на более выраженное увеличение показателей при адъювантном применении пароксетина, чем при других вариантах терапии. При этом различия между комбинацией галоперидола с пароксетином и монотерапией галоперидолом не являются статистически значимыми, достигая уровня тенденции лишь по динамике шкалы SARS к 2 и 4-й неделе. Тем не менее наличие однонаправленных различий позволяет утверждать негативное влияние пароксетина на «неврологическую безопасность» галоперидола. Подобный эффект легко объясним с позиций нейрохимического механизма действия СИОЗС. В результате стимуляции этими препаратами 5-HT2A-рецепторов в базальных ганглиях происходит ингибирование дофаминергической нейротрансмиссии, что, как известно, и является основной причиной развития ЭПС, связанных с применением антипсихотических средств [18].
Итак, результаты проведенного 6-недельного исследования не дают оснований утверждать, что адъювантное применение пароксетина оказывает оптимизирующее действие на качество терапевтического процесса. Скорее, напротив, следует говорить о негативном влиянии пароксетина как на эффективность, так и на безопасность базовой терапии галоперидолом (по крайней мере у пациентов с обострением психоза). Возможный потенцирующий эффект пароксетина на эффективность терапии в отношении определенных клинических мишеней (негативных и аффективных симптомов) явно «перевешивается» его недостатками, в первую очередь повышением риска экзацербации психоза.
1. Пароксетин снижает антипсихотический потенциал галоперидола при терапии пациентов с обострением параноидной шизофрении.
2. Негативный эффект пароксетина в наибольшей степени выражен на 2-й неделе терапии, а по мере ее продолжения постепенно редуцируется.
3. Адъювантное действие пароксетина не приводит к статистически значимому повышению эффективности базовой терапии в отношении негативных и аффективных симптомов.
4. Адъювантное применение пароксетина ухудшает переносимость лечения при использовании галоперидола в качестве средства базовой терапии параноидной шизофрении.
Сведения об авторе
Попов Михаил Юрьевич – канд. мед. наук, вед. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств СПб НИПНИ им. В.М.Бехтерева. E-mail: popovmikhail@mail.ru

Ключевые слова: шизофрения, эффективность, безопасность, пароксетин, галоперидол, арипипразол.
Adjunctive use of paroxetine in patients with acute episode of paranoid schizophrenia treated with haloperidol
M.Y.Popov
St.-Petersburg V.M.Bekhterev Psychoneurological Research Institute
Summary. Efficacy and safety of adjunctive use of paroxetine was studied in patients with acute episode of paranoid schizophrenia treated with haloperidol. Patients received either combination of haloperidol with paroxetine (25 subjects), or haloperidol as monotherapy (26 subjects), or aripiprazole (26 subjects) during 6 weeks. It was demonstrated that paroxetine reduced antipsychotic efficacy of haloperidol, did not increase its efficacy on negative and affective symptoms and deteriorated safety of treatment. Results of the study suggest that adjunctive use of paroxetine cannot be viewed as the strategy of treatment optimization in patients with exacerbation of paranoid schizophrenia who receive haloperidol.
Key words: schizophrenia, efficacy, safety, paroxetine, haloperidol, aripiprazole.
Введение
Характер различий между антипсихотическими препаратами типичного и атипичного ряда определяет неодинаковое терапевтическое значение этих соединений на разных этапах лечения шизофрении. Основные преимущества атипичных средств (более высокая эффективность в отношении негативных и депрессивных симптомов, благоприятное влияние на когнитивное функционирование, а также лучшая переносимость и, следовательно, более высокий уровень комплаенса) очевидным образом в наибольшей степени проявляются при проведении длительной поддерживающей терапии в фазе ремиссии.
В то же время при лечении острой фазы психоза эти препараты все же уступают типичным нейролептикам. Во многом это связано с выраженностью гипноседативного действия последних и их способностью оказывать подавляющее влияние на эмоциональное реагирование. Если при проведении терапии в состоянии ремиссии эти эффекты, проявляясь усугублением негативных и когнитивных нарушений, являются нежелательными и расцениваются в качестве побочных, то при назначении нейролептиков в фазе обострения эти же эффекты приобретают характер желательных.
По нашему глубокому убеждению, адекватный выбор адъювантных препаратов должен определяться направленностью их нейрохимических эффектов в сторону определенных патогенетических механизмов, лежащих в основе развития шизофрении. В соответствии с современными представлениями к наиболее изученным и доказанным нейрохимическим звеньям патогенеза заболевания наряду с изменением функциональной активности дофаминергической передачи и слабостью аминокислотергических систем относится и дисрегуляция серотоно-дофаминовых внутрицентральных взаимодействий [2].
Последний патогенетический механизм может рассматриваться в качестве теоретического обоснования чрезвычайно широко распространенной терапевтической тактики, а именно комбинированного применения антипсихотического и антидепрессивного препаратов при лечении шизофрении. Наиболее часто подобную комбинацию применяют при лечении хронической шизофрении в стадии ремиссии [3]. Вместе с тем, поскольку основной «терапевтической нишей» для типичных нейролептиков является острая психотическая симптоматика, особый интерес вызывает оценка эффективности их комбинированного применения с антидепрессантами именно при обострении психоза.
Существенным «сдерживающим» фактором здесь, на первый взгляд, представляется потенциальное повышение риска экзацербации симптоматики под влиянием антидепрессивной терапии. Однако, во-первых, подобные представления сложились по большей части на основании эффектов «классических» антидепрессантов (ингибиторов моноаминоксидазы и трициклических соединений) [4], в то время как данные о действии препаратов, обладающих избирательной нейрохимической активностью, практически отсутствуют.
Во-вторых, далеко не однозначный характер носит и направленность нейрохимических эффектов нейролептиков и антидепрессантов. С одной стороны, основным нейрохимическим эффектом антидепрессивных средств является моноаминопозитивное действие, а нейролептиков – моноаминонегативное, что определяет вероятность развития антагонистических взаимоотношений между препаратами и может, действительно, вносить свой вклад в повышение риска экзацербации психоза.
С другой стороны, современные представления о действии антидепрессантов позволяют рассматривать их с позиций непрямых антагонистов дофаминергической передачи, поскольку увеличение концентрации серотонина в синаптических образованиях мозга вторично вызывает снижение высвобождения дофамина. С этой точки зрения можно говорить о потенцирующем действии антидепрессантов на нейрохимическую активность нейролептиков. Кстати, подтверждением этому является и хорошо известная способность ряда антидепрессантов вызывать, подобно антипсихотическим средствам, экстрапирамидные побочные эффекты [5].
С указанных позиций наиболее оправданной представляется комбинация антидепрессантов из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) с теми представителями типичных нейролептиков, у которых способность блокировать серотониновые рецепторы отсутствует полностью либо выражена минимально. К подобным соединениям относятся бутирофеноны (галоперидол), пиперазиновые производные фенотиазина (трифлуоперазин), бензамиды (сульпирид, тиапридал). При проведении базовой терапии указанными препаратами серотонинергические структуры мозга, нейрохимические изменения в которых обеспечивают терапевтическое действие СИОЗС, могут оставаться относительно интактными [1]. Поэтому при адъювантном назначении СИОЗС именно на фоне приема перечисленных нейролептиков можно ожидать наиболее адекватного развития желательных клинических эффектов антидепрессантов.
Исходя из изложенного была сформулирована цель исследования: изучить эффективность и безопасность лечения пациентов с обострением параноидной шизофрении при применении комбинации галоперидола и пароксетина по сравнению с монотерапией галоперидолом и арипипразолом.
Выбор галоперидола в качестве препарата базовой терапии был обусловлен не только высокой антипсихотической эффективностью, но и выраженностью характерных для нейролептиков первой генерации побочных эффектов (иначе не было бы «предмета» для оптимизации). Пароксетин был выбран с учетом характера неспецифических эффектов СИОЗС (соотношения стимулирующего и седативного действия). С этой точки зрения при лечении пациентов с обострением шизофрении предпочтительнее выглядят те препараты, которые обладают седативными свойствами, такие как пароксетин [6, 7].
Очевидно, что оценку влияния исследуемого терапевтического вмешательства желательно проводить с учетом эффективности существующих эталонных средств. Если в качестве «золотого стандарта» в отношении антипсихотической эффективности может рассматриваться галоперидол, то с точки зрения «широты» терапевтического действия (в том числе в направлении негативных и аффективных симптомов) подобными эталонными средствами на сегодняшний день являются антипсихотические препараты атипичного ряда. Выбор из их числа именно арипипразола был обусловлен прежде всего минимальной выраженностью у него экстрапирамидных побочных эффектов [8].
Материалы и методы
В исследование включались пациенты с диагнозом «параноидная форма шизофрении» (в соответствии с критериями диагностической рубрики F20.0 по Международной классификации болезней 10-го пересмотра). Основным критерием включения являлось наличие обострения психоза с оценкой не менее 70 баллов по шкале PANSS [9] до начала терапии. Не включались пациенты с первым эпизодом шизофрении. Кроме того, критериями исключения являлись указания на наличие декомпенсированных сопутствующих соматических заболеваний, клинически значимой артериальной гипотензии, тяжелых лекарственных аллергических реакций, зависимости от алкоголя или психоактивных веществ, высокий риск суицидального или агрессивного поведения, период беременности или лактации.

Эффективность терапии оценивалась по шкале PANSS. Оценка проводилась до начала лечения и по завершении 2, 4 и 6-й недели терапии. В качестве параметров эффективности рассматривалась динамика суммарной оценки шкалы PANSS, а также трех ее субшкал (позитивной, негативной и общей психопатологии) и пяти факторов (позитивный, негативный, дезорганизация мышления, враждебность/возбуждение и тревога/депрессия) [10] по сравнению с исходным уровнем.
Безопасность лечения оценивалась при помощи шкал BARS [11], SARS [12] и AIMS [13], а также посредством регистрации всех нежелательных явлений.
При обработке данных применялись непараметрические статистические методы. Межгрупповые сравнения шкальных оценок проводились посредством дисперсионного анализа (Kruskal–Wallis ANOVA) с сравнениями post hoc по критерию Манна–Уитни. Кроме того, применялся критерий c2. Для всех тестов был установлен порог статистической значимости p<0,05.
Результаты
Всего в исследование было включено 77 пациентов. Комбинацию галоперидола с пароксетином получали 25 пациентов, монотерапию галоперидолом и арипипразолом – по 26 пациентов. Терапевтические группы не различались по основным клинико-демографическим показателям, а также по выраженности психопатологической симптоматики (исходным оценкам шкалы PANSS).
Полностью 6 нед терапии завершили 62 (80,5%) пациента. Преждевременно выбыли из исследования 6 (24,0%) пациентов, принимавших комбинацию галоперидола и пароксетина, 4 (15,4%) пациента, получавших галоперидол в виде монотерапии, и 5 (19,2%) пациентов, лечившихся арипипразолом. По количеству преждевременно завершивших участие в исследовании пациентов значимых различий между группами не было. Всем преждевременно выбывшим пациентам проводилась заключительная оценка. Таким образом, данные всех пациентов, принимавших участие в исследовании, были включены в статистический анализ (n=77).
Вместе с тем в группе пациентов, получавших галоперидол с пароксетином, 4 пациента были исключены из исследования до завершения 2-й недели терапии в связи с недостаточной эффективностью, в то время как в других группах выбывших из исследования на раннем этапе по этой причине не было. При этом отличия комбинированной терапии от монотерапии галоперидолом и арипипразолом по частоте раннего выбывания в связи с неэффективностью были статистически значимыми (в обоих случаях c2 равен 3,87; p=0,049).
В табл. 1 представлена динамика суммарного балла шкалы PANSS, трех ее субшкал и пяти факторов в 3 терапевтических группах. По данным анализа Kruskal–Wallis ANOVA, были отмечены статистически значимые межгрупповые различия по динамике суммарной оценки PANSS на 2-й неделе [H(2, n=77)=9,550; p=0,008], позитивной субшкалы на 2-й [H(2, n=77)=12,169; p=0,002] и на 4-й неделе [H(2, n=77)=7,875; p=0,020], позитивного фактора на 2-й [H(2, n=77)=11,117; p=0,004] и на 4-й неделе [H(2, n=77)=10,672; p=0,005], негативного фактора на 2-й неделе [H(2, n=77)=8,870; p=0,012] и фактора враждебности/возбуждения на 2-й неделе [H(2, n=77)=12,905; p=0,002], 4-й неделе [H(2, n=77)=8,286; p=0,016] и 6-й неделе [H(2, n=77)=6,144; p=0,046]. Кроме того, следующие различия достигали уровня тенденции к статистической значимости: по суммарному баллу PANSS на 4-й неделе [H(2, n=77)=4,890; p=0,087], по негативной субшкале на 2-й [H(2, n=77)=5,878; p=0,053] и на 4-й неделе [H(2, n=77)=5,771; p=0,056] и по негативному фактору на 4-й [H(2, n=77)=4,974; p=0,083] и на 6-й неделе [H(2, n=77)=5,039; p=0,081].
Галоперидол на 6-й неделе по влиянию на фактор враждебности/возбуждения значимо превосходил комбинацию галоперидола с пароксетином (Z=-2,346; p=0,019) и на уровне тенденции – арипипразол (Z=-1,711; p=0,087). На 4-й неделе галоперидол на уровне тенденции к статистической значимости превосходил комбинацию галоперидола с пароксетином (Z=-1,950; p=0,051) и арипипразол (Z=-1,684; p=0,092) по динамике суммарной оценки шкалы PANSS.
Кроме того, по влиянию на негативную субшкалу арипипразол значимо превосходил монотерапию галоперидолом и его комбинацию с пароксетином на 2-й неделе (Z=-2,068; p=0,039 и Z=-2,054; p=0,040 соответственно) и на 4-й неделе лечения (Z=-2,031; p=0,042 и Z=-2,044; p=0,041). По влиянию на негативный фактор арипипразол значимо превосходил галоперидол на 2-й неделе (Z=-2,937; p=0,003), 4-й неделе (Z=-1,967; p=0,049) и 6-й неделе (Z=-2,022; p=0,043) и на уровне тенденции – комбинацию галоперидола с пароксетином на 4-й неделе (Z=-1,771; p=0,077) и на 6-й неделе (Z=-1,686; p=0,092).
В табл. 2 представлены результаты сравнения исследуемых вариантов терапии по влиянию на показатели шкал BARS, SARS и AIMS. По данным дисперсионного анализа, значимые межгрупповые различия отмечались по показателям шкалы SARS на 2-й неделе [H(2, n=77)=7,056; p=0,029], 4-й неделе [H(2, n=77)=13,946; p=0,001] и 6-й неделе [H(2, n=77)=20,436; p<0,001], а также по оценкам шкалы AIMS на 4-й неделе [H(2, n=77)=10,004; p=0,007] и 6-й неделе исследования [H(2, n=77)=10,923; p=0,004]. Кроме того, были выявлены межгрупповые различия на уровне тенденции к статистической значимости по показателям шкалы BARS на 4-й неделе [H(2, n=77)=5,122; p=0,077] и 6-й неделе [H(2, n=77)=4,876; p=0,087].
При сравнениях post hoc было выявлено статистически значимое превосходство арипипразола над двумя терапевтическими группами, включавшими галоперидол. Арипипразол приводил к менее выраженному нарастанию оценок по всем экстрапирамидным шкалам на всем протяжении лечения. При этом по сравнению с комбинацией галоперидола и пароксетина статистически значимыми были различия по шкале BARS на 4-й (Z=-2,176; p=0,030) и на 6-й неделе (Z=-2,063; p=0,039), по шкале SARS на 2-й (Z=-2,120; p=0,034), на 4-й (Z=-3,552; p<0,001) и на 6-й неделе (Z=-4,362; p<0,001), и по шкале AIMS на 4-й (Z=-2,280; p=0,023) и на 6-й неделе (Z=-2,544; p=0,011).
При сравнении арипипразола с монотерапией галоперидолом отмечались значимые различия по шкале SARS на 4-й (Z=-2,004; p=0,045) и на 6-й неделе (Z=-2,736; p=0,006) и по шкале AIMS на 4-й (Z=-2,516; p=0,012) и на 6-й неделе (Z=-2,654; p=0,008). Кроме того, по показателю шкалы SARS на 2-й неделе различия между двумя вариантами терапии достигали уровня тенденции к статистической значимости (Z=-1,693; p=0,090).
Сравнение комбинации галоперидола и пароксетина с монотерапией галоперидолом не выявило статистически значимых различий. Вместе с тем комбинированная терапия вызывала более выраженное увеличение показателей всех экстрапирамидных шкал на всем протяжении исследования, за исключением изменений оценок BARS и AIMS ко 2-й неделе лечения. При этом по показателям шкалы SARS на 2 и 4-й неделе различия достигали уровня тенденции к статистической значимости (Z=-1,790; p=0,073 и Z=-1,818; p=0,069 соответственно).


Помимо значимых различий в частоте экстрапирамидных синдромов (ЭПС), обращает на себя внимание, что два побочных эффекта (гастроинтестинальные расстройства и повышенное потоотделение) встречались почти исключительно у пациентов, получавших адъювантно пароксетин. При этом у пациентов, принимавших комбинацию галоперидола и пароксетина, частота гастроинтестинальных расстройств значимо отличалась от частоты этих нарушений у пациентов, получавших монотерапию галоперидолом (c2=5,62; p=0,018). Среди прочих побочных эффектов обращает на себя внимание несколько более высокая частота нежелательных явлений, отражающих стимулирующий эффект (бессонница, ажитация) у пациентов, получавших комбинацию галоперидола с пароксетином и арипипразол, по сравнению с группами пациентов, лечившихся галоперидолом в виде монотерапии.
Все зарегистрированные нежелательные явления были легкой или умеренной степени тяжести и не приводили к преждевременному прекращению приема терапии, за исключением 1 пациента, получавшего монотерапию галоперидолом и исключенного из исследования в связи с развитием выраженных ЭПС.
Обсуждение
Оценка адъювантной терапии должна производиться с учетом ее действия в направлении потенциальной реализации основных стратегических задач. Одной из них является стремление повысить общий терапевтический потенциал базового препарата. Другая задача может состоять в расширении спектра психотропной активности базовой терапии в отношении определенных клинических мишеней. Наконец, еще одна задача отражает стремление повысить безопасность лечения и улучшить его переносимость. В соответствии с перечисленными стратегическими направлениями и будет проанализировано адъювантное действие пароксетина на фоне базовой терапии галоперидолом.
Хотя по итогам 6-недельного лечения комбинация галоперидола с пароксетином уступает остальным вариантам терапии по влиянию на суммарную оценку шкалы PANSS, значимые отличия указанной комбинации от других терапевтических схем отсутствуют. Эти данные, казалось бы, позволяют сделать вывод, что адъювантное применение пароксетина, если и не повышает терапевтическую эффективность галоперидола, то по крайней мере значимо не снижает ее. Однако сравнительный анализ динамики суммарного балла PANSS при меньшей продолжительности терапии свидетельствует о превосходстве монотерапии галоперидолом над комбинацией галоперидола с пароксетином (на 2-й неделе – значимом, на 4-й – на уровне тенденции к статистической значимости).
Принципиально важным является вопрос: что именно обусловливает указанные различия? Иными словами, динамика каких симптомов (кластеров симптомов) играет определяющую роль в изменении общей терапевтической эффективности? Очевидно, что на разных стадиях шизофрении (обострение, ремиссия) отдельные психопатологические расстройства обладают неодинаковым клиническим значением. С точки зрения лечения острых эпизодов шизофрении наибольшую важность имеют позитивные симптомы, а также проявления психомоторного возбуждения, агрессии, враждебности, импульсивности, как правило, и являющиеся основными терапевтическими мишенями. В этой связи особую важность приобретает сравнение действия исследуемых терапевтических схем на те показатели шкалы PANSS, которые отражают указанные клинические проявления. К подобным показателям относятся позитивная субшкала, позитивный фактор и фактор враждебности/возбуждения.
Как следует из полученных данных, наибольшее число межгрупповых различий наблюдается на 2-й неделе терапии, когда к тому же отмечается и их максимальная статистическая значимость (т.е. наименьшая вероятность нулевой гипотезы); к окончанию же исследования различия становятся менее значимыми. Более того, только на 2-й неделе исследования отмечается разнонаправленная динамика рассматриваемых симптомокомплексов в зависимости от терапии: при комбинированном применении галоперидола и пароксетина их показатели увеличиваются, а при монотерапии галоперидолом снижаются. Все это говорит о том, что негативное влияние пароксетина на эффективность галоперидола в отношении позитивных симптомов и враждебности/возбуждения в наибольшей степени выражено в первые недели лечения, а по мере его продолжения постепенно уменьшается. На это же указывают и более высокие показатели выбывания из исследования на ранних этапах в связи с недостаточной эффективностью (экзацербацией психотической симптоматики) при адъювантном применении пароксетина.
При сравнении динамики суммарной оценки шкалы PANSS, позитивной субшкалы, позитивного фактора и фактора враждебности/возбуждения под влиянием комбинации галоперидола с пароксетином и арипипразола на всем протяжении лечения наблюдается отсутствие статистически значимых различий. При этом полностью совпадает и направленность динамики этих показателей, в том числе увеличение большинства из них на 2-й неделе, с последующей редукцией.
Вместе с тем на 2 и 4-й неделе исследования арипипразол (как и комбинация галоперидола с пароксетином) по воздействию на перечисленные показатели значимо уступает монотерапии галоперидолом.
Полученные данные указывают на то, что, во-первых, галоперидол превосходит арипипразол по скорости реализации основного терапевтического эффекта, и, во-вторых, что адъювантное применение пароксетина существенно снижает антипсихотический потенциал галоперидола (по крайней мере в течение первых недель терапевтического вмешательства). При этом клиническая эффективность комбинированной терапии галоперидолом и пароксетином на ранних этапах лечения становится сопоставимой с действием арипипразола.
В контексте известных преимуществ типичных нейролептиков над препаратами атипичного ряда при проведении купирующей терапии снижение антипсихотической эффективности в начале лечения представляется крайне нежелательным. Тем самым можно утверждать, что адъювантное применение пароксетина лишает галоперидол его основного преимущества как средства быстрого и мощного терапевтического воздействия при лечении обострений шизофрении, что в особенности может касаться терапии пациентов с наиболее острой психотической симптоматикой.
Одной из возможных мишеней является негативный симптомокомплекс. Действительно, комбинация галоперидола и пароксетина оказывает более выраженное редуцирующее влияние на показатели как негативной субшкалы, так и негативного фактора PANSS по сравнению с монотерапией галоперидолом на всем протяжении 6-недельного исследования, однако эти различия не являются статистически значимыми.
С другой стороны, сравнение комбинации галоперидола и пароксетина с арипипразолом оказывается не в пользу комбинированной терапевтической схемы. Арипипразол вызывает более выраженную редукцию показателей негативной субшкалы (на 2 и 4-й неделе статистически значимо, на 6-й – на уровне тенденции к значимости) и негативного фактора (на 4 и 6-й неделе – на уровне тенденции к статистической значимости).
Арипипразол, в свою очередь, значимо превосходит и монотерапию галоперидолом по влиянию на негативную субшкалу на 2 и 4-й неделе лечения, а на негативный фактор – на всем протяжении исследования. Важность этого вполне ожидаемого результата состоит не столько в том, что он иллюстрирует известное превосходство препаратов атипичного ряда над типичными нейролептиками по воздействию на негативные симптомы шизофрении [14, 15], сколько в том, что он может рассматриваться в качестве «индикатора» достаточной чувствительности проведенного исследования.
В целом полученные нами данные не дают оснований говорить о благоприятном влиянии пароксетина на выраженность негативных симптомов в ходе базовой терапии галоперидолом. С другой стороны, эти данные и не опровергают существующие представления о возможности коррекции негативных расстройств при адъювантном применении антидепрессантов [16, 17], поскольку настоящее исследование проводилось у пациентов с обострением шизофрении, тогда как более адекватной является оценка «антинегативного» действия в стадии ремиссии. В любом случае, в острой фазе терапии шизофрении применение пароксетина в качестве «корректора» негативных симптомов на фоне лечения галоперидолом вряд ли может считаться обоснованным. К тому же, по воздействию на негативные расстройства подобная комбинированная схема уступает антипсихотическим средствам атипичного ряда (арипипразолу).
В качестве еще одной возможной мишени для адъювантной антидепрессивной терапии может рассматриваться аффективная симптоматика. Отражением соответствующих клинических проявлений в шкале PANSS является фактор тревоги/депрессии. На всем протяжении исследования комбинация галоперидола и пароксетина вызывает более выраженное снижение этого показателя (хотя и не на уровне статистической значимости) по сравнению с двумя другими терапевтическими схемами. Более того, на 2-й неделе комбинированной терапии галоперидолом и пароксетином (как и при лечении арипипразолом) наблюдается редукция средней оценки фактора тревоги/депрессии, в то время как на фоне монотерапии галоперидолом – ее повышение.
Полученные данные лишь косвенно свидетельствуют в пользу потенциальной эффективности пароксетина в отношении симптомов депрессии и/или тревоги в ходе лечения галоперидолом. Однако адъювантное применение антидепрессанта снижает антипсихотическую эффективность базового препарата и повышает вероятность экзацербации психоза. Тем самым соотношение риск/польза указывает на необоснованность применения указанной терапевтической схемы для коррекции аффективных симптомов, по крайней мере у пациентов с острыми эпизодами шизофрении.
Наконец, еще одно стратегическое направление оптимизации терапии шизофрении связано со стремлением повысить ее безопасность. Существенных различий по частоте, характеру и тяжести нежелательных явлений между комбинированной терапией галоперидолом и пароксетином и другими вариантами лечения не отмечается. Исключение составляют гастроинтестинальные расстройства и повышенное потоотделение, зарегистрированные почти исключительно при назначении пароксетина. Кроме того, при адъювантном применении антидепрессанта выше (хотя и незначимо) частота нежелательных явлений, отражающих стимулирующий эффект (бессонница, возбуждение), по сравнению с монотерапией галоперидолом. Перечисленные нежелательные явления соответствуют хорошо известным побочным эффектам антидепрессантов из группы СИОЗС и отражают повышение нейромедиаторной активности на уровне различных серотонинергических проекций.
Сопоставление оценок экстрапирамидных шкал, во-первых, подтверждает ожидаемое значимое превосходство арипипразола над терапевтическими схемами, включающими галоперидол, а во-вторых, указывает на более выраженное увеличение показателей при адъювантном применении пароксетина, чем при других вариантах терапии. При этом различия между комбинацией галоперидола с пароксетином и монотерапией галоперидолом не являются статистически значимыми, достигая уровня тенденции лишь по динамике шкалы SARS к 2 и 4-й неделе. Тем не менее наличие однонаправленных различий позволяет утверждать негативное влияние пароксетина на «неврологическую безопасность» галоперидола. Подобный эффект легко объясним с позиций нейрохимического механизма действия СИОЗС. В результате стимуляции этими препаратами 5-HT2A-рецепторов в базальных ганглиях происходит ингибирование дофаминергической нейротрансмиссии, что, как известно, и является основной причиной развития ЭПС, связанных с применением антипсихотических средств [18].
Итак, результаты проведенного 6-недельного исследования не дают оснований утверждать, что адъювантное применение пароксетина оказывает оптимизирующее действие на качество терапевтического процесса. Скорее, напротив, следует говорить о негативном влиянии пароксетина как на эффективность, так и на безопасность базовой терапии галоперидолом (по крайней мере у пациентов с обострением психоза). Возможный потенцирующий эффект пароксетина на эффективность терапии в отношении определенных клинических мишеней (негативных и аффективных симптомов) явно «перевешивается» его недостатками, в первую очередь повышением риска экзацербации психоза.
1. Пароксетин снижает антипсихотический потенциал галоперидола при терапии пациентов с обострением параноидной шизофрении.
2. Негативный эффект пароксетина в наибольшей степени выражен на 2-й неделе терапии, а по мере ее продолжения постепенно редуцируется.
3. Адъювантное действие пароксетина не приводит к статистически значимому повышению эффективности базовой терапии в отношении негативных и аффективных симптомов.
4. Адъювантное применение пароксетина ухудшает переносимость лечения при использовании галоперидола в качестве средства базовой терапии параноидной шизофрении.
Сведения об авторе
Попов Михаил Юрьевич – канд. мед. наук, вед. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств СПб НИПНИ им. В.М.Бехтерева. E-mail: popovmikhail@mail.ru


Список исп. литературыСкрыть список1. Козловский В.Л., Незнанов Н.Г. Комбинированная терапия антипсихотиками и антидепрессантами: рациональность, стратегия, тактика (сообщение 2). Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2008; 4: 4–7.
2. Richtand M, Welge A, Logue D et al. Dopamine and serotonin receptor binding and antipsychotic efficacy. Neuropsychopharmacol 2007; 32 (8): 1715–26.
3. Андрусенко М.П., Морозова М.А. Комбинированное использование антидепрессантов и нейролептиков при аффективных расстройствах и шизофрении: показания к назначению, побочные эффекты и осложнения. Психиатр. и психофармакотер. 2001; 3 (1): 4–8.
4. Falkai P, Wobrock T, Lieberman J et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of schizophrenia, part 1: acute treatment of schizophrenia. World J Biol Psychiat 2005; 6: 132–91.
5. Lane RM. SSRI-induced extrapyramidal side-effects and akathisia: implications for treatment. Psychopharmacol 1998; 12 (2): 192–214.
6. Максимов В.И. Пароксетин и его место среди препаратов для лечения депрессий и других состояний. Современная терапия психических расстройств. 2008; 2: 36–9.
7. Мосолов С.Н. Клиническое применение современных антидепрессантов. Мед. информ. агентство. СПб., 1995.
8. Swainston HT, Perry CM. Aripiprazole: a review of its use in schizophrenia and schizoaffective disorder. Drugs 2004; 64 (15): 1715–36.
9. Kay SR, Opler LA, Fiszbein A. Positive and Negative Syndrome Scale (PANSS). Rating manual. NY, 1986.
10. Marder SR, Davis JM, Chouinard G. The effects of risperidone on the five dimensions of schizophrenia derived by factor analysis: combined results of the North American trials. J Clin Psychiat 1997; 58: 538–46.
11. Barnes TR. A rating scale for drug-induced akathisia. Br J Psychiat 1989; 154: 672–5.
12. Simpson GM, Angus JW. Drug-induced extrapyramidal disorders. Acta Psychiat Scand 1970; 212: 11–9.
13. Guy W. Abnormal Involuntary Movement Scale (AIMS). Assessment manual for psychopharmacol revised 1976; 534–7.
14. Falkai P, Wobrock T, Lieberman J et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of schizophrenia, part 2: long-tern treatment of schizophrenia. World J Biol Psychiat 2006; 7: 5–40.
15. Möller HJ. Definition, psychopharmacological basis and clinical evaluation of novel/atypical neuroleptics: methodological issues and clinical consequences. World J Biol Psychiat 2000; 1: 75–91.
16. Rummel C, Kissling W, Leucht S. Antidepressants as add-on treatment to antipsychotics for people with schizophrenia and pronounced negative symptoms: a systematic review of randomized trials. Schizophr Res 2005; 80 (1): 85–97.
17. Singh SP, Singh V, Kar N, Chan K. Efficacy of antidepressants in treating the negative symptoms of chronic schizophrenia: meta-analysis. Br J Psychiat 2010; 197 (3): 174–9.
18. De Greef R, Maloney A, Olsson-Gisleskog P et al. Dopamine D2-occupancy as a biomarker for antipsychotics: quantifying the relationship with efficacy and extrapyramidal symptoms. AAPS J 2011; 13 (1): 121–30.
1 апреля 2012
Количество просмотров: 2390

