Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
FGBNU "Research Institute of Pharmacology named after V.V. Zakusov", Laboratory of Pharmacogenetics, Moscow, Russia
Summary
The results of randomized open-label 28-day study of the therapeutic equivalence of extended (30 mg per tablet, 1 tablet per day) and immediate release forms of fabomotizole (10 mg per tablet, 3 tablets per day) in patients diagnosed with generalized anxiety disorder are presented. Methods: Hamilton Anxiety Rating Scale (HARS) with 14 items total score difference of changes from baseline was a primary endpoint. Study's secondary endpoints were difference of changes from baseline of HARS individual items score, proportion of patients with different severity of the disease according to the General Clinical Impression "Severity of the Disease" scale (CGI-S) and difference of changes from baseline of Psychopathology Symptoms Assessment Scale (PSAS) symptom domains score that reflect expected clinical and pharmacological effects of anxiolytics.
Results: The analysis included 58 and 53 patients in the sustained-release and immediate-release fabomotizole group who completed the study without severe protocol violations, respectively. There were no differences in either changes of HARS scale total score or changes in the proportion of patients with different severity of the disease and changes in symptom domains of PSAS scores (all p>0.05). By the day 7 "Intellectual Disorders" HARS item scores decreased statistically significantly faster in the immediate release group (difference of changes: 0.200 [0.024; 0.376], t=2.258, p=0.026), while "Cardiovascular symptoms" item scores decreased statistically significantly faster by day 7 in the sustained-release dosage form group (difference of changes: -0.180 [-0.354; -0.006], t = -2.046, p = 0.043). Conclusions: fabomotizole in sustained release form demonstrated a therapeutic equivalence to the immediate release form.
Keywords: fabomotizole, afobazole, generalized anxiety disorder, sustained release, therapeutic equivalence.
For citation: T.S. Syunyakov, O. A. Dorofeeva, S.B. Seredenin. Comparative study results therapeutic equivalence fabomotizole in dosage form
with immediate and delayed release. Psychiatry and psychopharmacotherapy. 2021; 1: 4–10.
Фабомотизол является эффективным атипичным анксиолитиком [2]. Относительно короткий период полувыведения фабомотизола ассоциируется с необходимостью его 3-разового приема. Для решения проблемы необходимости многократного приема препарата для поддержания его терапевтической концентрации была разработана пролонгированная лекарственная форма фабомотизола в таблетках с дозировкой 30 мг для однократного приема в течение дня.
Такая дозировка позволяет поддерживать терапевтические уровни циркулирующего препарата, а площадь под кривой концентрации (AUClast) после приема фабомотизола в лекарственной форме с замедленным высвобождением (1 таблетка 30 мг) и фабомотизола в лекарственной форме с немедленным высвобождением после установления равновесной концентрации оказалась сопоставимой и составила 107,66 и 106,13 нг/мл (средние геометрические) соответственно (неопубликованные результаты исследования РКИ №459 (19.08.2019), http://grls.rosminzdrav.ru/ CIPermissionMini.aspx?CIStatementGUID=0026a815-ad22-49cb-9b94-e1260dcbeba6&CIPermGUID=9D2F625C-9E09-46C1-A023-B45B021B5477). Эти результаты указывают на биоэквивалентность обеих лекарственных форм.
Вместе с тем модификация фармакокинетических параметров путем изменения лекарственной формы может потенциально сказаться на наборе выявляемых в клинических условиях эффектов, включая терапевтические и побочные, а также временные рамки их возникновения. К примеру, изменение кратности приема некоторых антидепрессантов ассоциировалось с улучшением адгерентности и результативности терапии [1]. Более того, в исследованиях орально дезинтегрируемых лекарственных форм различных препаратов в сравнении с их обычными пероральными аналогами также отмечалось видоизменение доминирующих клинико-фармакологических эффектов либо ускорение скорости их реализации [3, 4], а у трех лекарственных форм феназепама (пероральная, внутримышечная и перкутанная) был выявлен разный набор клинико-фармакологических свойств при введении сопоставимых дозировок [5].
Эти данные обусловили изучение не только биоэквивалентности, но и терапевтической эквивалентности фабомотизола с немедленным и замедленным высвобождением в рамках исследования по протоколу № ОТС-FBR-0118/2В («Проспективное многоцентровое рандомизированное открытое сравнительное клиническое исследование эффективности и безопасности препарата ОТС-FBR-0118, торговое наименование – Афобазол РЕТАРД, таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 30 мг (АО «Отисифарм», производитель ОАО «Фармстандарт-Лексредства», Россия) и препарата Афобазол®, таблетки, 10 мг (АО «Отисифарм», производитель ОАО «Фармстандарт-Лексредства», Россия) у пациентов с генерализованным тревожным расстройством») [РКИ №329 (24.06.2019), http://grls.rosminzdrav.ru/ CIPermissionMini.aspx?CIStatementGUID=622b67cf-0874-4483-839c-c95403d64971&CIPermGUID=577EE941-2EBB-4A9B-A460-AA3FBFD7D674].
Задачами исследования являлись:
1. Провести сравнительную оценку эффективности курсового применения фабомотизола в лекарственных формах с немедленным и замедленным высвобождением у пациентов с генерализованным тревожным расстройством.
2. Провести сравнительный анализ спектральных характеристик клинико-фармакологических эффектов фабомотизола в разных лекарственных формах.
Данное исследование III фазы имело проспективный многоцентровый (7 центров исследования1) открытый рандомизированный сравнительный в параллельных группах дизайн. Длительность приема препаратов исследования составила 28 дней. Исследование проводилось за 6 визитов: Визит 1 (визит скринингового обследования), Визит 2 (день 1; рандомизация, назначение исследуемой терапии), Визит 3 (день 7), Визит 4 (день 14), Визит 5 (день 21), Визит 6 (день 28). Пациенты были рандомизированы согласно сгенерированным по блокам рандомизационным кодам на прием фабомотизола в лекарственной форме с замедленным и немедленным высвобождением в соотношении 1:1. Пациенты 1 группы получали фабомотизол в лекарственной форме с замедленным высвобождением (1 таб. – 30 мг) 1 таблетку утром, а пациенты 2 группы – фабомотизол в лекарственной форме с немедленным высвобождением (1 таб. – 10 мг) по 1 таблетке 3 раза в день.
Для оценки динамики выраженности тревоги использовалась Шкала оценки тревоги Гамильтона (HARS) с 14 пунктами [6], назначаемая клиницистом методика, позволяющая провести количественную оценку степени выраженности тревоги. Оценка производится по пунктам: «Тревожное настроение», «Напряжение», «Страхи», «Инсомния», «Интеллектуальные нарушения», «Депрессивное настроение», «Соматические симптомы (мышечные)», «Соматические симптомы (сенсорные)», «Сердечно-сосудистые симптомы», «Респираторные симптомы», «Гастроинтестинальные симптомы», «Мочеполовые симптомы», «Вегетативные симптомы», «Поведение при осмотре».
Шкала общего клинического впечатления (подшкала «Тяжесть заболевания») использовалась для оценки долей больных, соответствующих разным степеням тяжести состояния.
Для сравнения особенностей реализации клинико-фармакологических эффектов фабомотизола, в соответствии с ранее разработанными подходами [7], использовалась Шкала оценки выраженности симптоматики, составленная на основе “Унифицированной системы оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами”, позволяющая получить объективные количественные данные о терапевтической динамике психопатологической симптоматики [8]. Эквивалентность особенностей действия обеих лекарственных форм фабомотизола проводилась по рассчитанным показателям анксиолитического, антигипотимического, антиастенического, гипнотического, психостимулирующего, антиневротического, вегетостабилизирующего, миорелаксантного и холинолитического эффектов.
1Исследование проведено в 7 клинических центрах:
1. Государственное бюджетное учреждение здравоохранения «Ленинградский областной наркологический диспансер нм. А.Я. Гриненко», 188661. Ленинградская область. Всеволожский район, дер. Новое Девяткино, ул. Славы, д. 6. Главный исследователь: Крупицкий Евгений Михайлович, д.м.н., профессор, врач-психиатр, нарколог.
2. Государственное учреждение здравоохранения «Энгельсская психиатрическая больница» министерства здравоохранения Саратовской области. 413124. Саратовская обл., г. Энгельс, ул. Пристанская, д. 166. Главный исследователь: Ивлиев Дмитрий Давидович, врач-психиатр.
3. Государственное учреждение здравоохранения «Областная клиническая психиатрическая больница Святой Софии», 410060, г. Саратов, ул. им. Штейнберга С.И., д. 50. Главный исследователь: Ивлиева Ирина Анатольевна, врач-психиатр, заместитель главного врача по лечебной работе.
4. Государственное учреждение здравоохранения «Саратовский городской психоневрологический диспансер», 410038, г. Саратов, ул. Загорная. д. 3. Главный исследователь: Кокошников Алексей Вячеславович, врач-психиатр.
5. Общество с ограниченной ответственностью «Научно-исследовательский центр «Эко-Безопасность», 196143, г. Санкт-Петербург, пр. Юрия Гагарина, д. 65. Главный исследователь: Гылыпкылова Кристина Константиновна, врач-психиатр-нарколог.
6. Общество с ограниченной ответственностью «Балтийская Медицина», 194356, г. Санкт-Петербург. Выборгское шоссе, д. 40. лит. А. Главный исследователь: Гончаров Олег Валерьевич, к.м.н., психиатр-нарколог.
7. Общество с ограниченной ответственностью «Астарта». 199226, г. Санкт-Петербург, ул. Нахимова, д. 11, пом. 49Н, часть пом. 38-Н. Главный исследователь: Янушко Мария Григорьевна, к.м.н., врач-психиатр.
Клинико-демографическая характеристика представлена методами описательной статистики с указанием частотных характеристик, средних значений, стандартных отклонений и границ 95% доверительного интервала (ДИ 95%).
Статистический анализ оцениваемых параметров проводился для каждого показателя методом дисперсионного анализа для повторных измерений (RM-ANOVA) с апостериорным вычислением различий между лекарственными формами по изменению фоновых баллов на каждом визите исследования. По результатам анализа оценивалась статистическая значимость взаимодействия фактора визита исследования и терапевтической группы. Различия между терапевтическими группами средних изменений фоновых показателей с указанием границ ДИ 95% приведены на графиках Forest plot. Статистический анализ выполнен с использованием статистического пакета Statistica (TIBCO Software Inc. (2017), Statistica (программный продукт для анализа данных), версия 13. http://statistica.io).
В исследование не включались пациенты, которые соответствовали следующим критериям: 1) Прием лекарственных средств, обладающих психотропной активностью, на протяжении недели до назначения препаратов исследования; 2) Наличие психических расстройств, соответствующих диагностическим критериям шизофрении (F20.0-F20.4 по МКБ-10); 3) Непсихотические (неврозоподобные) расстройства при органических заболеваниях головного мозга, развившихся в связи с травмой, сосудистым заболеванием, новообразованием головного мозга, нейроинфекцией, ВИЧ-инфекцией, нейросифилисом, эпилепсией; 4) Наличие депрессивного состояния с суммарной оценкой выраженности депрессивных расстройств по «общему депрессивном фактору» (пункты 1-3 и 6-8) шкалы оценки депрессии Гамильтона более 7 баллов; 5) Состояния психомоторного возбуждения, делириозных нарушений, проявлений спутанности; 6) Состояния, угрожающие жизни пациента (кома, острый период инфаркта миокарда, нарушения мозгового кровообращения); 7) Злоупотребление или зависимость от психоактивных веществ (за исключением кофеиновой или никотиновой зависимости); наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости; 8) Наличие стойкой хронической инсомнии; 9) Тяжелые заболевания печени, почек с явлениями функциональной недостаточности; 10) Наличие недееспособности в порядке, установленном законодательством Российской Федерации; 11) Беременность или период грудного вскармливания; 12) Непереносимость галактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции; 13) Гиперчувствительность и/или непереносимость любого компонента исследуемого препарата и препарата сравнения; 14) Участие в другом клиническом исследовании в настоящее время или в предыдущие 30 дней до скрининга.
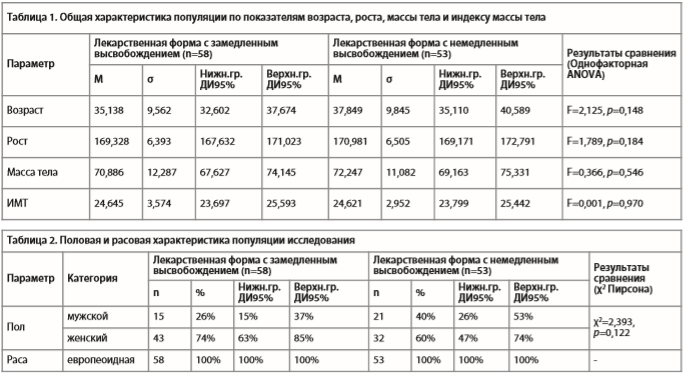
 В табл. 1 и 2 приведена общая характеристика популяции исследования, вошедшей в данный анализ. Пациенты, получавшие фабомотизол с немедленным и с замедленным высвобождением, не отличались по оцененным параметрам (все р>0,05), что указывает на сопоставимость изученных групп по общим характеристикам.
В табл. 1 и 2 приведена общая характеристика популяции исследования, вошедшей в данный анализ. Пациенты, получавшие фабомотизол с немедленным и с замедленным высвобождением, не отличались по оцененным параметрам (все р>0,05), что указывает на сопоставимость изученных групп по общим характеристикам.
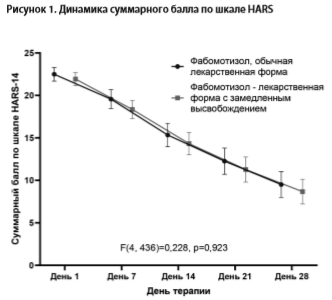
Динамика суммарного балла по шкале HARS приведена на рис. 1. В обеих терапевтических группах отмечалась статистически значимая (p<0,001) редукция этого показателя, начиная с 7 дня. При статистическом анализе результатов исследования были получены следующие данные: в группе терапии фабомотизолом с замедленным высвобождением суммарный балл снизился с 22.491 до 9.509 (на 12.981 (ДИ 95%: [-14.401. -11.561]), p<0,001, редукция 58%), в группе препарата с немедленным высвобождением – с 21.931 до 8.672 (на 13.259 [-14.518, -12.000], р<0,001, редукция 60%). Уменьшение суммарного балла в группах терапии не различалось между группами (F(4, 436)=0,228, p= 0,923). Сравнение изменений суммарного балла по шкале HARS на каждом из визитов исследования не выявило различий между терапевтическими группами (все p>0,2).
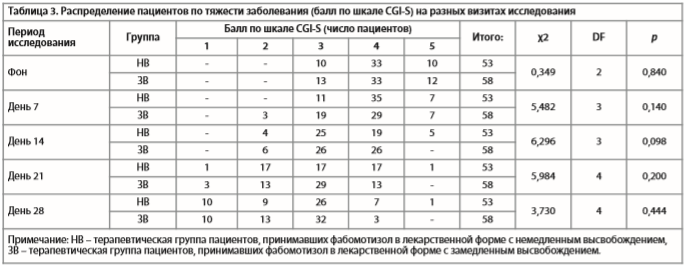
Анализ распределения больных с различными степенями тяжести заболевания по шкале CGI-S (табл. 3) не выявил различий между терапевтическими группами ни на одном из визитов исследования (все p>0,05).
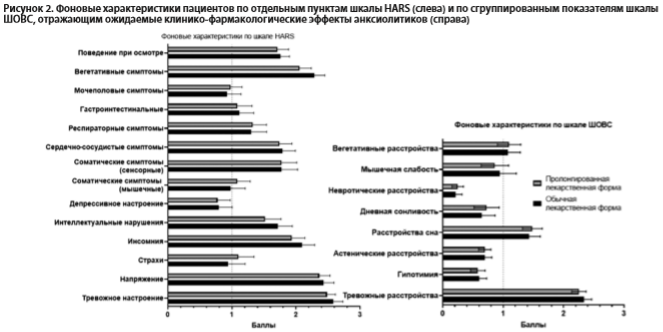
На рис. 2. представлены фоновые средние значения и границы ДИ95% по отдельным пунктам шкалы HARS и по сгруппированным для оценки ожидаемых клинико-фармакологических эффектов анксиолитиков показателям шкалы ШОВС. Обе терапевтические группы не различались по показателям этих шкал на базовом визите, что свидетельствует о клинической однородности включенных в анализ пациентов с диагнозом ГТР (все р>0,05, ANOVA). При этом клинически очерченной выраженности (не менее 1 балла), свидетельствующей о наличии в структуре состояния больных соответствующей клинической мишени для действия анксиолитика, достигали 3 группы симптомов, оцениваемых с помощью шкалы ШОВС (тревожные расстройства, расстройства сна и вегетативные расстройства) и 10 пунктов шкалы HARS (тревожное настроение, напряжение, инсомния, интеллектуальные нарушения, мышечные и сенсорные соматические, сердечно-сосудистые, респираторные, гастроинтестинальные и вегетативные симптомы, а также поведение при осмотре).
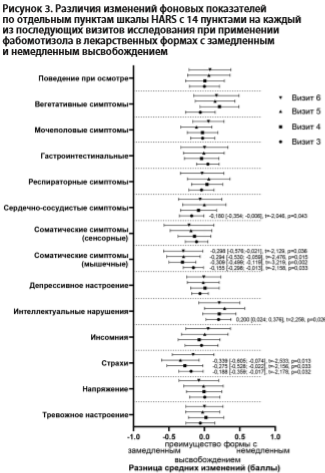 По шкале HARS у пациентов, принимающих фабомотизол в пролонгированной лекарственной форме, статистически значимые изменения по пунктам «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» регистрировались, начиная с 7 дня, а по пунктам «Страхи», «Инсомния», «Соматические сенсорные симптомы», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки). Аналогичный анализ в группе с немедленным высвобождением показал статистически значимую редукцию показателей «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» с 7 дня и показателей «Инсомния», «Интеллектуальные нарушения», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
По шкале HARS у пациентов, принимающих фабомотизол в пролонгированной лекарственной форме, статистически значимые изменения по пунктам «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» регистрировались, начиная с 7 дня, а по пунктам «Страхи», «Инсомния», «Соматические сенсорные симптомы», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки). Аналогичный анализ в группе с немедленным высвобождением показал статистически значимую редукцию показателей «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» с 7 дня и показателей «Инсомния», «Интеллектуальные нарушения», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
При сравнении динамики отдельных пунктов шкалы HARS между терапевтическими группами по результатам анализа RM-ANOVA статистически значимый эффект взаимодействия между динамикой показателей и фактором визита выявлен для пунктов «Страхи» и «Соматические симптомы (мышечные)» (RM-ANOVA: F(4, 436)=2,902, p=0,022 и F(4, 436)=3,434, p=0,009 соответственно). Различия между терапевтическими группами по динамике баллов по отдельным пунктам шкалы HARS приведены на рис. 3. Выявлены статистически значимые различия динамики по пунктам «Страхи» на 7, 14 и 21 дни, «Интеллектуальные нарушения» на 7 день, «Соматические симптомы (мышечные)» на 7, 14, 21 и 28 дни и «Сердечно-сосудистые симптомы» на 7 день. При этом «Страхи» и «Соматические симптомы (мышечные)» имели фоновые значения по крайней мере в одной из терапевтических групп меньше 1, что затрудняет оценку выявленных различий изменений, в качестве имеющих клиническое значение.
Поправка анализа на фоновые значения продемонстрировала, что «Интеллектуальные нарушения» на 7 день быстрее отвечали на применение лекарственной формы с немедленным высвобождением (R=0,232, SS=23,478, df=109, F=6,186, p=0,014), а «Сердечно-сосудистые симптомы» на 7 день быстрее отвечали на применение лекарственной формы с замедленным высвобождением (R=0,25, SS=22,716, df=109, F=7,285, p=0,008).
При анализе отдельных показателей по шкале ШОВС в группе лекарственной формы с немедленным высвобождением, начиная с 7 дня претерпели статистически значимую редукцию показатели «Тревога», «Повышенная раздражительность», а в группе с замедленным высвобождением – «Тревога», «Повышенная раздражительность», «Апатичность, безразличие», «Расстройства засыпания» и «Нарушения глубины и длительности ночного сна». Начиная с 14 дня статистически значимая динамика охватила также показатели «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Апатичность, безразличие», «Расстройства засыпания»,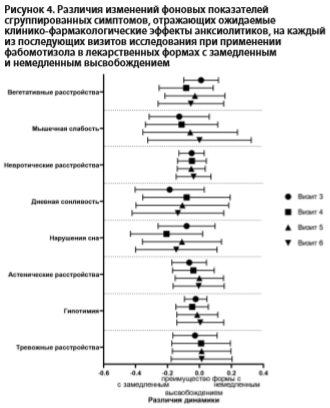 «Нарушения глубины и длительности ночного сна», «Сонливость», «Повышенная отвлекаемость», «Гиперестезия», «Потливость», «Сухость во рту», «Головные боли», «Тошнота», «Тахикардия» и «Вегетативные расстройства пароксизмального характера» в группе с немедленным высвобождением и «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Сонливость», «Потливость», «Лабильность вазомоторов», «Головные боли», «Боли в различных местах тела», «Ортостатические нарушения (головокружения, обмороки)», «Тошнота», «Гипертензия» и «Вегетативные расстройства пароксизмального характера» в группе с замедленным высвобождением (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
«Нарушения глубины и длительности ночного сна», «Сонливость», «Повышенная отвлекаемость», «Гиперестезия», «Потливость», «Сухость во рту», «Головные боли», «Тошнота», «Тахикардия» и «Вегетативные расстройства пароксизмального характера» в группе с немедленным высвобождением и «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Сонливость», «Потливость», «Лабильность вазомоторов», «Головные боли», «Боли в различных местах тела», «Ортостатические нарушения (головокружения, обмороки)», «Тошнота», «Гипертензия» и «Вегетативные расстройства пароксизмального характера» в группе с замедленным высвобождением (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
Различия динамики между терапевтическими группами сгруппированных показателей шкалы ШОВС, отражающих ожидаемые клинико-фармакологические эффекты анксиолитиков, представлены на рис. 4. По результатам попарного сравнения динамики этих показателей не выявлено статистически значимых различий (все p>0,05).
Анализ данных показал, что обе терапевтические группы не различались по динамике основного оцениваемого параметра (суммарного балла по шкале HARS) и по распределению пациентов с разной степенью тяжести, оцениваемой по шкале CGI-S. Это свидетельствует о сопоставимой эффективности и терапевтической эквивалентности обеих лекарственных форм фабомотизола.
Оценка особенностей реализации действия фабомотизола в лекарственных формах с немедленным и замедленным высвобождением продемонстрировала отсутствие статистически значимых различий по динамике сгруппированных показателей шкалы ШОВС, отражающих ожидаемые клинико-фармакологические эффекты препаратов с анксиолитическими свойствами.
При оценке различий влияния обеих лекарственных форм фабомотизола на отдельные пункты шкалы HARS с 14 пунктами, которые на момент фонового обследования имели клинически значимую выраженность, также не выявлено значимых различий между влиянием разных лекарственных форм фабомотизола на баллы отдельных пунктов шкалы, за исключением изменений пунктов «Интеллектуальные нарушения» и «Сердечно-сосудистые симптомы» на 7 день исследования. Отсутствие статистически значимых различий динамики этих показателей на более поздних визитах может свидетельствовать не о различиях в спектральных характеристиках клинико-фармакологического действия, а об отличиях в скорости наступления этих терапевтических изменений. «Интеллектуальные нарушения» несколько быстрее редуцировались у пациентов, принимавших фабомотизол в лекарственной форме с немедленным высвобождением, а «Сердечно-сосудистые симптомы» — несколько быстрее редуцировались при применении препарата в лекарственной форме с замедленным высвобождением.
Выявлены различия в темпах реализации действия двух лекарственных форм фабомотизола к 7 дню терапии в отношении показателей шкалы HARS «Интеллектуальные симптомы», которые статистически значимо больше снижались при применении лекарственной формы с немедленным высвобождением, и «Сердечно-сосудистые симптомы», которые статистически значимо больше снижались при применении лекарственной формы с замедленным высвобождением.
Ограничения исследования
Данное исследование имело открытый дизайн, что потенциально могло сместить результаты исследования в пользу одной из лекарственных форм препарата фабомотизол. Наличие строгих критериев отбора затрудняет интерпретацию результатов исследования применительно ко всей популяции пациентов с диагнозом ГТР.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Сюняков Т.С. — https://orcid.org/0000-0002-4334-1601
Дорофеева О.А. — https://orcid.org/0000-0001-5205-9547
Середенин С.Б. — https://orcid.org/0000-0003-4482-9331
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2021
Результаты сравнительного исследования терапевтической эквивалентности фабомотизола в лекарственной форме с немедленным и замедленным высвобождением №01 2021
Номера страниц в выпуске:4-10
Резюме
Введение: Проведено 28-дневное открытое рандомизированное исследование терапевтической эквивалентности фабомотизола в лекарственной форме с замедленным (30 мг в таблетке, 1 таблетка в день Афобазол РЕТАРД) и немедленным высвобождением (10 мг в таблетке, 3 таблетки в день Афобазол) у пациентов с диагнозом «генерализованное тревожное расстройство» при 28-дневном курсовом применении. Методы: Оценивалась динамика суммарного балла и баллов по отдельным пунктам шкалы тревоги Гамильтона (HARS), доля больных с разной тяжестью заболевания по шкале Общего клинического впечатления «Тяжесть заболевания» (CGI-S) и изменения суммарных показателей шкалы Оценки выраженности симптоматики (ШОВС), отражающих ожидаемые клинико-фармакологические эффекты анксиолитиков.
Результаты: В анализ вошли 58 пациентов в группе фабомотизола с замедленным высвобождением и 53 пациента в группе с немедленным высвобождением. Не выявлено различий по динамике суммарного балла по шкале HARS, изменении долей больных с разной тяжестью заболевания и по динамике показателей шкалы ШОВС (все p>0,05). Выявлены различия в скорости реализации действия фабомотизола в разных лекарственных формах на баллы по пунктам шкалы HARS «Интеллектуальные расстройства» (0,200 [0,024; 0,376], t=2,258, p=0,026), которые к 7 дню статистически значимо быстрее снижались при применении лекарственной формы с немедленным высвобождением, и «Сердечно-сосудистые симптомы»
(-0,180 [-0,354; -0,006], t=-2,046, p=0,043), которые к 7 дню статистически значимо быстрее снижались при применении лекарственной формы с замедленным высвобождением.
Выводы: Фабомотизол в разных лекарственных формах продемонстрировал терапевтическую эквивалентность.
Ключевые слова: фабомотизол, афобазол, генерализованное тревожное расстройство, замедленное высвобождение, терапевтическая эквивалентность
Для цитирования: Т.С. Сюняков, О.А. Дорофеева, С.Б. Середенин. Результаты сравнительного исследования терапевтической эквивалентности фабомотизола в лекарственной форме с немедленным и замедленным высвобождением. Психиатрия и психофармакотерапия. 2021; 1: 4–10.
Введение: Проведено 28-дневное открытое рандомизированное исследование терапевтической эквивалентности фабомотизола в лекарственной форме с замедленным (30 мг в таблетке, 1 таблетка в день Афобазол РЕТАРД) и немедленным высвобождением (10 мг в таблетке, 3 таблетки в день Афобазол) у пациентов с диагнозом «генерализованное тревожное расстройство» при 28-дневном курсовом применении. Методы: Оценивалась динамика суммарного балла и баллов по отдельным пунктам шкалы тревоги Гамильтона (HARS), доля больных с разной тяжестью заболевания по шкале Общего клинического впечатления «Тяжесть заболевания» (CGI-S) и изменения суммарных показателей шкалы Оценки выраженности симптоматики (ШОВС), отражающих ожидаемые клинико-фармакологические эффекты анксиолитиков.
Результаты: В анализ вошли 58 пациентов в группе фабомотизола с замедленным высвобождением и 53 пациента в группе с немедленным высвобождением. Не выявлено различий по динамике суммарного балла по шкале HARS, изменении долей больных с разной тяжестью заболевания и по динамике показателей шкалы ШОВС (все p>0,05). Выявлены различия в скорости реализации действия фабомотизола в разных лекарственных формах на баллы по пунктам шкалы HARS «Интеллектуальные расстройства» (0,200 [0,024; 0,376], t=2,258, p=0,026), которые к 7 дню статистически значимо быстрее снижались при применении лекарственной формы с немедленным высвобождением, и «Сердечно-сосудистые симптомы»
(-0,180 [-0,354; -0,006], t=-2,046, p=0,043), которые к 7 дню статистически значимо быстрее снижались при применении лекарственной формы с замедленным высвобождением.
Выводы: Фабомотизол в разных лекарственных формах продемонстрировал терапевтическую эквивалентность.
Ключевые слова: фабомотизол, афобазол, генерализованное тревожное расстройство, замедленное высвобождение, терапевтическая эквивалентность
Для цитирования: Т.С. Сюняков, О.А. Дорофеева, С.Б. Середенин. Результаты сравнительного исследования терапевтической эквивалентности фабомотизола в лекарственной форме с немедленным и замедленным высвобождением. Психиатрия и психофармакотерапия. 2021; 1: 4–10.
Comparative study results therapeutic equivalence fabomotizole in dosage form with immediate and delayed release
T.S. Syunyakov, O. A. Dorofeeva, S.B. SeredeninFGBNU "Research Institute of Pharmacology named after V.V. Zakusov", Laboratory of Pharmacogenetics, Moscow, Russia
Summary
The results of randomized open-label 28-day study of the therapeutic equivalence of extended (30 mg per tablet, 1 tablet per day) and immediate release forms of fabomotizole (10 mg per tablet, 3 tablets per day) in patients diagnosed with generalized anxiety disorder are presented. Methods: Hamilton Anxiety Rating Scale (HARS) with 14 items total score difference of changes from baseline was a primary endpoint. Study's secondary endpoints were difference of changes from baseline of HARS individual items score, proportion of patients with different severity of the disease according to the General Clinical Impression "Severity of the Disease" scale (CGI-S) and difference of changes from baseline of Psychopathology Symptoms Assessment Scale (PSAS) symptom domains score that reflect expected clinical and pharmacological effects of anxiolytics.
Results: The analysis included 58 and 53 patients in the sustained-release and immediate-release fabomotizole group who completed the study without severe protocol violations, respectively. There were no differences in either changes of HARS scale total score or changes in the proportion of patients with different severity of the disease and changes in symptom domains of PSAS scores (all p>0.05). By the day 7 "Intellectual Disorders" HARS item scores decreased statistically significantly faster in the immediate release group (difference of changes: 0.200 [0.024; 0.376], t=2.258, p=0.026), while "Cardiovascular symptoms" item scores decreased statistically significantly faster by day 7 in the sustained-release dosage form group (difference of changes: -0.180 [-0.354; -0.006], t = -2.046, p = 0.043). Conclusions: fabomotizole in sustained release form demonstrated a therapeutic equivalence to the immediate release form.
Keywords: fabomotizole, afobazole, generalized anxiety disorder, sustained release, therapeutic equivalence.
For citation: T.S. Syunyakov, O. A. Dorofeeva, S.B. Seredenin. Comparative study results therapeutic equivalence fabomotizole in dosage form
with immediate and delayed release. Psychiatry and psychopharmacotherapy. 2021; 1: 4–10.
Введение
Одной из важнейших составляющих результативной терапии является готовность пациента придерживаться режима приема лекарственного средства. Существенный вклад в адгерентность привносит удобство применения препарата и кратность суточного приема. В специально посвященном этому вопросу исследовании было проведено сравнение режимов приема с 1, 2 или 3 приемами дозировок в день [1]. Было продемонстрировано существенное снижение адгерентности с каждым дополнительным суточным приемом лекарственного препарата.Фабомотизол является эффективным атипичным анксиолитиком [2]. Относительно короткий период полувыведения фабомотизола ассоциируется с необходимостью его 3-разового приема. Для решения проблемы необходимости многократного приема препарата для поддержания его терапевтической концентрации была разработана пролонгированная лекарственная форма фабомотизола в таблетках с дозировкой 30 мг для однократного приема в течение дня.
Такая дозировка позволяет поддерживать терапевтические уровни циркулирующего препарата, а площадь под кривой концентрации (AUClast) после приема фабомотизола в лекарственной форме с замедленным высвобождением (1 таблетка 30 мг) и фабомотизола в лекарственной форме с немедленным высвобождением после установления равновесной концентрации оказалась сопоставимой и составила 107,66 и 106,13 нг/мл (средние геометрические) соответственно (неопубликованные результаты исследования РКИ №459 (19.08.2019), http://grls.rosminzdrav.ru/ CIPermissionMini.aspx?CIStatementGUID=0026a815-ad22-49cb-9b94-e1260dcbeba6&CIPermGUID=9D2F625C-9E09-46C1-A023-B45B021B5477). Эти результаты указывают на биоэквивалентность обеих лекарственных форм.
Вместе с тем модификация фармакокинетических параметров путем изменения лекарственной формы может потенциально сказаться на наборе выявляемых в клинических условиях эффектов, включая терапевтические и побочные, а также временные рамки их возникновения. К примеру, изменение кратности приема некоторых антидепрессантов ассоциировалось с улучшением адгерентности и результативности терапии [1]. Более того, в исследованиях орально дезинтегрируемых лекарственных форм различных препаратов в сравнении с их обычными пероральными аналогами также отмечалось видоизменение доминирующих клинико-фармакологических эффектов либо ускорение скорости их реализации [3, 4], а у трех лекарственных форм феназепама (пероральная, внутримышечная и перкутанная) был выявлен разный набор клинико-фармакологических свойств при введении сопоставимых дозировок [5].
Эти данные обусловили изучение не только биоэквивалентности, но и терапевтической эквивалентности фабомотизола с немедленным и замедленным высвобождением в рамках исследования по протоколу № ОТС-FBR-0118/2В («Проспективное многоцентровое рандомизированное открытое сравнительное клиническое исследование эффективности и безопасности препарата ОТС-FBR-0118, торговое наименование – Афобазол РЕТАРД, таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 30 мг (АО «Отисифарм», производитель ОАО «Фармстандарт-Лексредства», Россия) и препарата Афобазол®, таблетки, 10 мг (АО «Отисифарм», производитель ОАО «Фармстандарт-Лексредства», Россия) у пациентов с генерализованным тревожным расстройством») [РКИ №329 (24.06.2019), http://grls.rosminzdrav.ru/ CIPermissionMini.aspx?CIStatementGUID=622b67cf-0874-4483-839c-c95403d64971&CIPermGUID=577EE941-2EBB-4A9B-A460-AA3FBFD7D674].
Цели и задачи
Целью исследования было: сравнительное изучение эффективности фабомотизола в суточной дозе 30 мг в лекарственной форме с пролонгированным и немедленным высвобождением у пациентов с генерализованным тревожным расстройством и апостериорный сравнительный клинико-фармакологический анализ особенностей действия препарата в двух лекарственных формах у пациентов с генерализованным тревожным расстройством.Задачами исследования являлись:
1. Провести сравнительную оценку эффективности курсового применения фабомотизола в лекарственных формах с немедленным и замедленным высвобождением у пациентов с генерализованным тревожным расстройством.
2. Провести сравнительный анализ спектральных характеристик клинико-фармакологических эффектов фабомотизола в разных лекарственных формах.
Материалы и методы
Дизайн исследованияДанное исследование III фазы имело проспективный многоцентровый (7 центров исследования1) открытый рандомизированный сравнительный в параллельных группах дизайн. Длительность приема препаратов исследования составила 28 дней. Исследование проводилось за 6 визитов: Визит 1 (визит скринингового обследования), Визит 2 (день 1; рандомизация, назначение исследуемой терапии), Визит 3 (день 7), Визит 4 (день 14), Визит 5 (день 21), Визит 6 (день 28). Пациенты были рандомизированы согласно сгенерированным по блокам рандомизационным кодам на прием фабомотизола в лекарственной форме с замедленным и немедленным высвобождением в соотношении 1:1. Пациенты 1 группы получали фабомотизол в лекарственной форме с замедленным высвобождением (1 таб. – 30 мг) 1 таблетку утром, а пациенты 2 группы – фабомотизол в лекарственной форме с немедленным высвобождением (1 таб. – 10 мг) по 1 таблетке 3 раза в день.
Для оценки динамики выраженности тревоги использовалась Шкала оценки тревоги Гамильтона (HARS) с 14 пунктами [6], назначаемая клиницистом методика, позволяющая провести количественную оценку степени выраженности тревоги. Оценка производится по пунктам: «Тревожное настроение», «Напряжение», «Страхи», «Инсомния», «Интеллектуальные нарушения», «Депрессивное настроение», «Соматические симптомы (мышечные)», «Соматические симптомы (сенсорные)», «Сердечно-сосудистые симптомы», «Респираторные симптомы», «Гастроинтестинальные симптомы», «Мочеполовые симптомы», «Вегетативные симптомы», «Поведение при осмотре».
Шкала общего клинического впечатления (подшкала «Тяжесть заболевания») использовалась для оценки долей больных, соответствующих разным степеням тяжести состояния.
Для сравнения особенностей реализации клинико-фармакологических эффектов фабомотизола, в соответствии с ранее разработанными подходами [7], использовалась Шкала оценки выраженности симптоматики, составленная на основе “Унифицированной системы оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами”, позволяющая получить объективные количественные данные о терапевтической динамике психопатологической симптоматики [8]. Эквивалентность особенностей действия обеих лекарственных форм фабомотизола проводилась по рассчитанным показателям анксиолитического, антигипотимического, антиастенического, гипнотического, психостимулирующего, антиневротического, вегетостабилизирующего, миорелаксантного и холинолитического эффектов.
1Исследование проведено в 7 клинических центрах:
1. Государственное бюджетное учреждение здравоохранения «Ленинградский областной наркологический диспансер нм. А.Я. Гриненко», 188661. Ленинградская область. Всеволожский район, дер. Новое Девяткино, ул. Славы, д. 6. Главный исследователь: Крупицкий Евгений Михайлович, д.м.н., профессор, врач-психиатр, нарколог.
2. Государственное учреждение здравоохранения «Энгельсская психиатрическая больница» министерства здравоохранения Саратовской области. 413124. Саратовская обл., г. Энгельс, ул. Пристанская, д. 166. Главный исследователь: Ивлиев Дмитрий Давидович, врач-психиатр.
3. Государственное учреждение здравоохранения «Областная клиническая психиатрическая больница Святой Софии», 410060, г. Саратов, ул. им. Штейнберга С.И., д. 50. Главный исследователь: Ивлиева Ирина Анатольевна, врач-психиатр, заместитель главного врача по лечебной работе.
4. Государственное учреждение здравоохранения «Саратовский городской психоневрологический диспансер», 410038, г. Саратов, ул. Загорная. д. 3. Главный исследователь: Кокошников Алексей Вячеславович, врач-психиатр.
5. Общество с ограниченной ответственностью «Научно-исследовательский центр «Эко-Безопасность», 196143, г. Санкт-Петербург, пр. Юрия Гагарина, д. 65. Главный исследователь: Гылыпкылова Кристина Константиновна, врач-психиатр-нарколог.
6. Общество с ограниченной ответственностью «Балтийская Медицина», 194356, г. Санкт-Петербург. Выборгское шоссе, д. 40. лит. А. Главный исследователь: Гончаров Олег Валерьевич, к.м.н., психиатр-нарколог.
7. Общество с ограниченной ответственностью «Астарта». 199226, г. Санкт-Петербург, ул. Нахимова, д. 11, пом. 49Н, часть пом. 38-Н. Главный исследователь: Янушко Мария Григорьевна, к.м.н., врач-психиатр.
Статистический анализ
В качестве основного оцениваемого параметра было принято изменение на 28 день исходного уровня суммарного балла шкалы HARS. В качестве дополнительных оцениваемых параметров выступали: 1) Различие между терапевтическими группами изменения на 7, 14, 21 и 28 дни исследования фонового значения суммарного балла шкалы HARS; 2) Доля пациентов с разными степенями тяжести заболевания по шкале общего клинического впечатления «Тяжесть заболевания» (CGI-S) на каждый из визитов исследования; 3) Различие между терапевтическими группами изменений фоновых баллов по отдельным пунктам и суммарного балла шкалы оценки тревоги Гамильтона (HARS) нa каждом из контрольных визитов; 4) Различие между терапевтическими группами изменений фоновых баллов сгруппированных в кластеры показателей Шкалы оценки выраженности симптоматики нa каждом из контрольных визитов.Клинико-демографическая характеристика представлена методами описательной статистики с указанием частотных характеристик, средних значений, стандартных отклонений и границ 95% доверительного интервала (ДИ 95%).
Статистический анализ оцениваемых параметров проводился для каждого показателя методом дисперсионного анализа для повторных измерений (RM-ANOVA) с апостериорным вычислением различий между лекарственными формами по изменению фоновых баллов на каждом визите исследования. По результатам анализа оценивалась статистическая значимость взаимодействия фактора визита исследования и терапевтической группы. Различия между терапевтическими группами средних изменений фоновых показателей с указанием границ ДИ 95% приведены на графиках Forest plot. Статистический анализ выполнен с использованием статистического пакета Statistica (TIBCO Software Inc. (2017), Statistica (программный продукт для анализа данных), версия 13. http://statistica.io).
Популяция исследования
В исследование включались пациенты, подписавшие информированное согласие на участие в исследовании, мужчины и женщины в возрасте от 18 до 55 лет включительно с диагностированным в соответствии с критериями МКБ-10 «Генерализованным тревожным расстройством» (код F41.1 по МКБ-10), состояние которых соответствовало не менее 18 баллам при тестировании по шкале тревоги Гамильтона, и которые были способны к адекватному сотрудничеству, определяемому как способность понять предоставленную информацию о клиническом исследовании. выразить свое полностью осознанное (то есть правильно оценить содержание и риски) и добровольное согласие на участие в исследовании, готовность к соблюдению требований протокола исследования. В период исследования больные должны были согласиться на использование адекватных методов контрацепции пациентами и их партнерами в период исследования и в течение месяца после его завершения (методы контрацепции с надежностью более 90%: шеечные колпачки со спермицидом, диафрагмы со спермицидом, презервативы с интравагинальным спермицидом, негормональные внутриматочные спирали, полное воздержание от половой жизни на период проведения исследования).В исследование не включались пациенты, которые соответствовали следующим критериям: 1) Прием лекарственных средств, обладающих психотропной активностью, на протяжении недели до назначения препаратов исследования; 2) Наличие психических расстройств, соответствующих диагностическим критериям шизофрении (F20.0-F20.4 по МКБ-10); 3) Непсихотические (неврозоподобные) расстройства при органических заболеваниях головного мозга, развившихся в связи с травмой, сосудистым заболеванием, новообразованием головного мозга, нейроинфекцией, ВИЧ-инфекцией, нейросифилисом, эпилепсией; 4) Наличие депрессивного состояния с суммарной оценкой выраженности депрессивных расстройств по «общему депрессивном фактору» (пункты 1-3 и 6-8) шкалы оценки депрессии Гамильтона более 7 баллов; 5) Состояния психомоторного возбуждения, делириозных нарушений, проявлений спутанности; 6) Состояния, угрожающие жизни пациента (кома, острый период инфаркта миокарда, нарушения мозгового кровообращения); 7) Злоупотребление или зависимость от психоактивных веществ (за исключением кофеиновой или никотиновой зависимости); наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости; 8) Наличие стойкой хронической инсомнии; 9) Тяжелые заболевания печени, почек с явлениями функциональной недостаточности; 10) Наличие недееспособности в порядке, установленном законодательством Российской Федерации; 11) Беременность или период грудного вскармливания; 12) Непереносимость галактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции; 13) Гиперчувствительность и/или непереносимость любого компонента исследуемого препарата и препарата сравнения; 14) Участие в другом клиническом исследовании в настоящее время или в предыдущие 30 дней до скрининга.
Результаты
В исследование было включено 120 пациентов. Исследование без нарушений его протокола завершили 58 пациентов в группе фабомотизола с замедленным высво- бождением (Афобазол РЕТАРД) и 53 пациента в группе фабомотизола с немедленным высвобождением (Афобазол). Таким образом, в анализ включены данные 111 пациентов.
 В табл. 1 и 2 приведена общая характеристика популяции исследования, вошедшей в данный анализ. Пациенты, получавшие фабомотизол с немедленным и с замедленным высвобождением, не отличались по оцененным параметрам (все р>0,05), что указывает на сопоставимость изученных групп по общим характеристикам.
В табл. 1 и 2 приведена общая характеристика популяции исследования, вошедшей в данный анализ. Пациенты, получавшие фабомотизол с немедленным и с замедленным высвобождением, не отличались по оцененным параметрам (все р>0,05), что указывает на сопоставимость изученных групп по общим характеристикам. Динамика суммарного балла по шкале HARS приведена на рис. 1. В обеих терапевтических группах отмечалась статистически значимая (p<0,001) редукция этого показателя, начиная с 7 дня. При статистическом анализе результатов исследования были получены следующие данные: в группе терапии фабомотизолом с замедленным высвобождением суммарный балл снизился с 22.491 до 9.509 (на 12.981 (ДИ 95%: [-14.401. -11.561]), p<0,001, редукция 58%), в группе препарата с немедленным высвобождением – с 21.931 до 8.672 (на 13.259 [-14.518, -12.000], р<0,001, редукция 60%). Уменьшение суммарного балла в группах терапии не различалось между группами (F(4, 436)=0,228, p= 0,923). Сравнение изменений суммарного балла по шкале HARS на каждом из визитов исследования не выявило различий между терапевтическими группами (все p>0,2).
Анализ распределения больных с различными степенями тяжести заболевания по шкале CGI-S (табл. 3) не выявил различий между терапевтическими группами ни на одном из визитов исследования (все p>0,05).
На рис. 2. представлены фоновые средние значения и границы ДИ95% по отдельным пунктам шкалы HARS и по сгруппированным для оценки ожидаемых клинико-фармакологических эффектов анксиолитиков показателям шкалы ШОВС. Обе терапевтические группы не различались по показателям этих шкал на базовом визите, что свидетельствует о клинической однородности включенных в анализ пациентов с диагнозом ГТР (все р>0,05, ANOVA). При этом клинически очерченной выраженности (не менее 1 балла), свидетельствующей о наличии в структуре состояния больных соответствующей клинической мишени для действия анксиолитика, достигали 3 группы симптомов, оцениваемых с помощью шкалы ШОВС (тревожные расстройства, расстройства сна и вегетативные расстройства) и 10 пунктов шкалы HARS (тревожное настроение, напряжение, инсомния, интеллектуальные нарушения, мышечные и сенсорные соматические, сердечно-сосудистые, респираторные, гастроинтестинальные и вегетативные симптомы, а также поведение при осмотре).


 По шкале HARS у пациентов, принимающих фабомотизол в пролонгированной лекарственной форме, статистически значимые изменения по пунктам «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» регистрировались, начиная с 7 дня, а по пунктам «Страхи», «Инсомния», «Соматические сенсорные симптомы», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки). Аналогичный анализ в группе с немедленным высвобождением показал статистически значимую редукцию показателей «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» с 7 дня и показателей «Инсомния», «Интеллектуальные нарушения», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
По шкале HARS у пациентов, принимающих фабомотизол в пролонгированной лекарственной форме, статистически значимые изменения по пунктам «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» регистрировались, начиная с 7 дня, а по пунктам «Страхи», «Инсомния», «Соматические сенсорные симптомы», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки). Аналогичный анализ в группе с немедленным высвобождением показал статистически значимую редукцию показателей «Тревожное настроение», «Напряжение», «Вегетативные симптомы», «Поведение при осмотре» с 7 дня и показателей «Инсомния», «Интеллектуальные нарушения», «Сердечно-сосудистые симптомы», «Респираторные симптомы» – с 14 дня (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).При сравнении динамики отдельных пунктов шкалы HARS между терапевтическими группами по результатам анализа RM-ANOVA статистически значимый эффект взаимодействия между динамикой показателей и фактором визита выявлен для пунктов «Страхи» и «Соматические симптомы (мышечные)» (RM-ANOVA: F(4, 436)=2,902, p=0,022 и F(4, 436)=3,434, p=0,009 соответственно). Различия между терапевтическими группами по динамике баллов по отдельным пунктам шкалы HARS приведены на рис. 3. Выявлены статистически значимые различия динамики по пунктам «Страхи» на 7, 14 и 21 дни, «Интеллектуальные нарушения» на 7 день, «Соматические симптомы (мышечные)» на 7, 14, 21 и 28 дни и «Сердечно-сосудистые симптомы» на 7 день. При этом «Страхи» и «Соматические симптомы (мышечные)» имели фоновые значения по крайней мере в одной из терапевтических групп меньше 1, что затрудняет оценку выявленных различий изменений, в качестве имеющих клиническое значение.
Поправка анализа на фоновые значения продемонстрировала, что «Интеллектуальные нарушения» на 7 день быстрее отвечали на применение лекарственной формы с немедленным высвобождением (R=0,232, SS=23,478, df=109, F=6,186, p=0,014), а «Сердечно-сосудистые симптомы» на 7 день быстрее отвечали на применение лекарственной формы с замедленным высвобождением (R=0,25, SS=22,716, df=109, F=7,285, p=0,008).
При анализе отдельных показателей по шкале ШОВС в группе лекарственной формы с немедленным высвобождением, начиная с 7 дня претерпели статистически значимую редукцию показатели «Тревога», «Повышенная раздражительность», а в группе с замедленным высвобождением – «Тревога», «Повышенная раздражительность», «Апатичность, безразличие», «Расстройства засыпания» и «Нарушения глубины и длительности ночного сна». Начиная с 14 дня статистически значимая динамика охватила также показатели «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Апатичность, безразличие», «Расстройства засыпания»,
 «Нарушения глубины и длительности ночного сна», «Сонливость», «Повышенная отвлекаемость», «Гиперестезия», «Потливость», «Сухость во рту», «Головные боли», «Тошнота», «Тахикардия» и «Вегетативные расстройства пароксизмального характера» в группе с немедленным высвобождением и «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Сонливость», «Потливость», «Лабильность вазомоторов», «Головные боли», «Боли в различных местах тела», «Ортостатические нарушения (головокружения, обмороки)», «Тошнота», «Гипертензия» и «Вегетативные расстройства пароксизмального характера» в группе с замедленным высвобождением (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).
«Нарушения глубины и длительности ночного сна», «Сонливость», «Повышенная отвлекаемость», «Гиперестезия», «Потливость», «Сухость во рту», «Головные боли», «Тошнота», «Тахикардия» и «Вегетативные расстройства пароксизмального характера» в группе с немедленным высвобождением и «Аффективная лабильность», «Пониженное настроение», «Повышенная истощаемость (чувство слабости)», «Снижение интересов», «Сонливость», «Потливость», «Лабильность вазомоторов», «Головные боли», «Боли в различных местах тела», «Ортостатические нарушения (головокружения, обмороки)», «Тошнота», «Гипертензия» и «Вегетативные расстройства пароксизмального характера» в группе с замедленным высвобождением (все p<0,05, One-way RM-ANOVA с коррекцией по Тьюки).Различия динамики между терапевтическими группами сгруппированных показателей шкалы ШОВС, отражающих ожидаемые клинико-фармакологические эффекты анксиолитиков, представлены на рис. 4. По результатам попарного сравнения динамики этих показателей не выявлено статистически значимых различий (все p>0,05).
Обсуждение
В проведенном исследовании решались задачи оценки терапевтической эквивалентности и сравнения терапевтического действия фабомотизола в суточной дозе 30 мг в лекарственных формах с немедленным и замедленным высвобождением у пациентов с диагнозом ГТР на протяжении 28-дневного курса терапии.Анализ данных показал, что обе терапевтические группы не различались по динамике основного оцениваемого параметра (суммарного балла по шкале HARS) и по распределению пациентов с разной степенью тяжести, оцениваемой по шкале CGI-S. Это свидетельствует о сопоставимой эффективности и терапевтической эквивалентности обеих лекарственных форм фабомотизола.
Оценка особенностей реализации действия фабомотизола в лекарственных формах с немедленным и замедленным высвобождением продемонстрировала отсутствие статистически значимых различий по динамике сгруппированных показателей шкалы ШОВС, отражающих ожидаемые клинико-фармакологические эффекты препаратов с анксиолитическими свойствами.
При оценке различий влияния обеих лекарственных форм фабомотизола на отдельные пункты шкалы HARS с 14 пунктами, которые на момент фонового обследования имели клинически значимую выраженность, также не выявлено значимых различий между влиянием разных лекарственных форм фабомотизола на баллы отдельных пунктов шкалы, за исключением изменений пунктов «Интеллектуальные нарушения» и «Сердечно-сосудистые симптомы» на 7 день исследования. Отсутствие статистически значимых различий динамики этих показателей на более поздних визитах может свидетельствовать не о различиях в спектральных характеристиках клинико-фармакологического действия, а об отличиях в скорости наступления этих терапевтических изменений. «Интеллектуальные нарушения» несколько быстрее редуцировались у пациентов, принимавших фабомотизол в лекарственной форме с немедленным высвобождением, а «Сердечно-сосудистые симптомы» — несколько быстрее редуцировались при применении препарата в лекарственной форме с замедленным высвобождением.
Выводы
Применение фабомотизола в лекарственных формах с немедленным и замедленным высвобождением (Афобазол и Афобазол РЕТАРД), в одинаковой суточной дозе 30 мг, продемонстрировало терапевтическую эквивалентность и отсутствие различий в реализации клинико-фармакологических эффектов у больных ГТР.Выявлены различия в темпах реализации действия двух лекарственных форм фабомотизола к 7 дню терапии в отношении показателей шкалы HARS «Интеллектуальные симптомы», которые статистически значимо больше снижались при применении лекарственной формы с немедленным высвобождением, и «Сердечно-сосудистые симптомы», которые статистически значимо больше снижались при применении лекарственной формы с замедленным высвобождением.
Ограничения исследования
Данное исследование имело открытый дизайн, что потенциально могло сместить результаты исследования в пользу одной из лекарственных форм препарата фабомотизол. Наличие строгих критериев отбора затрудняет интерпретацию результатов исследования применительно ко всей популяции пациентов с диагнозом ГТР.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Сюняков Т.С. — https://orcid.org/0000-0002-4334-1601
Дорофеева О.А. — https://orcid.org/0000-0001-5205-9547
Середенин С.Б. — https://orcid.org/0000-0003-4482-9331
Список исп. литературыСкрыть список1. Pullar T., Birtwell A., Wiles P., Hay A., Feely M. Use of a pharmacologic indicator to compare compliance with tablets prescribed to be taken once, twice, or three times daily // Clinical Pharmacology & Therapeutics. ‒ 1988. ‒ Vol. 44, № 5. ‒ p. 540-545.
2. Сюняков Т.С., Незнамов Г.Г. Оценка терапевтической эффективности и безопасности селективного анксиолитика афобазола при генерализованном тревожном расстройстве и расстройствах адаптации: результаты многоцентрового рандомизированного сравнительного с диазепамом исследования // Терапевтический архив. – 2016. – Т. 88. – №8. – C. 73-86. doi: 10.17116/terarkh201688873-86.
3. de Haan L., van Amelsvoort T., Rosien K., Linszen D. Weight loss after switching from conventional olanzapine tablets to orally disintegrating olanzapine tablets // Psychopharmacology. ‒ 2004. ‒ Vol. 175, № 3. ‒ p. 389-390.
4. Montgomery W., Treuer T., Karagianis J., Ascher-Svanum H., Harrison G. Orally disintegrating olanzapine review: effectiveness, patient preference, adherence, and other properties // Patient preference and adherence. ‒ 2012. ‒ Vol. 6. ‒ p. 109.
5. Дорофеева О., Сюняков С., Жердев В., Колыванов Г., Литвин А., Незнамов Г. Г. Особенности терапевтического действия и фармакокинетики феназепама в трансдермальной лекарственной форме у больных с тревожными расстройствами // Экспериментальная и клиническая фармакология. ‒ 2009. ‒ T. 72, № 2. ‒ C. 6-10.
6. Hamilton M. Hamilton Anxiety Rating Scale (HAM-A) // Journal of Medicine (Cincinnati). ‒ 1959. ‒ Vol. 61, № 4. ‒ p. 81-82.
7. Незнамов Г. Г., Сюняков С. А., Бочкарев В. К., Телешова Е. С. Клинические данные о терапевтическом действии и эффективности феназепама // Феназепам. 25 лет в медицинской практике / Середенин С. и др. ‒ М.: Наука, 2007. ‒ C. 203-277.
8. «Унифицированная система оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами. Методические рекомендации. / Александровский Ю. А., Руденко Г. М., Незнамов Г. Г. и др. ‒ М.: Министерство здравохранения СССР, 1984. ‒ 69-69 с.
29 марта 2021
Количество просмотров: 2020


